-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Využití tkání získaných pomocí bioinženýrských metod při rekonstrukci urogenitálního systému
BIOENGINEERED TISSUES FOR UROGENITAL REPAIR IN CHILDREN
The most common congenital abnormalities involve the genitourinary system. These include hypospadias, in which the urethral opening develops in an improper position, and bladder exstrophy, in which the bladder develops on the outer surface of the abdomen. Children with these conditions will require immediate and multiple reconstructive surgeries. Currently, reconstruction may be performed with native nonurologic tissues (skin, gastrointestinal segments, or mucosa), homologous tissues from a donor (cadaver or living donor kidney), heterologous tissues or substances (bovine collagen), or artificial materials (silicone, polyurethane, teflon). However, these materials often lead to complications after reconstruction, either because the implanted tissue is rejected, or because inherently different functional parameters cause a mismatch in the system. For example, replacement of bladder tissue with gastrointestinal segments can be problematic due to the opposite ways in which these two tissues handle solutes – urologic tissue normally excretes material, and gastrointestinal tissue generally absorbs the same materials. This mismatched state can lead to metabolic complications as well as infection and other issues. The replacement of lost or deficient urologic tissues with functionally equivalent ones would improve the outcome of reconstructive surgery in the genitourinary system. This goal may soon be attainable with the use of tissue engineering techniques.
KEY WORDS:
tissue engineering, urogenital repair, scaffolds, cell-seeded-matrices, tissue implants
Autoři: A. Atala
Působiště autorů: Wake Forest University School of Medicine Medical Center Blvd, Winston Salem NC 21157
Vyšlo v časopise: Urol List 2009; 7(2): 42-49
Souhrn
Vrozené abnormality nejčastěji postihují močopohlavní ústrojí. Mezi tyto anomálie patří hypospadie, kdy je ústí močové trubice lokalizováno na nesprávném místě, a extrofie močového měchýře, kdy je močový měchýř lokalizován na vnější straně břišní stěny. Děti postižené těmito anomáliemi vyžadují okamžité provedení vícečetných rekonstrukčních operací. V současné době se při rekonstrukci užívá vlastní tkáň pacienta z jiného nežli uropoetického systému (kůže, segmenty gastrointestálních orgánů nebo sliznice), homologní tkáň dárce (ledvina z kadaverózního či žijícího dárce), heterologní tkáň nebo substance (bovinní kolagen) nebo umělé materiály (silikon, polyuretan, teflon). Implantace těchto materiálů je však často spojena se vznikem komplikací v podobě odmítnutí implantovaného graftu příjemcem nebo neshody systému vyvolané odlišnými funkčními parametry. Kupříkladu nahrazení tkáně močového měchýře gastrointestinálním segmentem může být problematické, vzhledem k tomu, že tyto dva typy tkáně nakládají s rozpustnými látkami opačným způsobem – materiál, který je urologickou tkání vylučován, gastrointestinální tkáň obvykle vstřebává. Tato neshoda může vést ke vzniku metabolických komplikací, infekce a dalších problémů. Možnost nahradit poškozenou nebo defektní urologickou tkáň funkčně ekvivalentním materiálem by umožnila zdokonalení výsledků rekonstrukčních zákroků v močopohlavním ústrojí. Pomocí technik tkáňového inženýrství bude možné tohoto cíle brzy dosáhnout.
KLÍČOVÁ SLOVA:
techniky tkáňového inženýrství, rekonstrukční operace urogenitálního systému, nosné konstrukce, matrix osázená buňkami, tkáňové implantátyTECHNIKY TKÁŇOVÉHO INŽENÝRSTVÍ PROREKONSTRUKČNÍ OPERACE UROGENITÁLNÍHO SYSTÉMU
Tkáňové inženýrství využívá principů buněčné transplantace, nauky o materiálech a bioinženýrství k vývoji biologických náhrad, které umožňují obnovu a zachování normální funkce poškozené tkáně a orgánů. Metody tkáňového inženýrství spočívají ve stimulaci regenerace prostřednictvím injekční aplikace funkčních buněk do nefunkční oblasti nebo v aplikaci přírodních či syntetických matrix (běžně nazývané scaffoldy – nosné konstrukce). Tyto techniky podporují přirozenou schopnost organizmu regenerovat se a napomáhají při růstu nové tkáně. Tkáňové inženýrství často využívá kombinace obou metod. Implantace pojiva osázeného buňkami podporuje růst či regeneraci funkční tkáně.
Využití buněk v rámci tkáňového inženýrství
V případě, že při bioinženýrských technikách (TE) užíváme buňky, odebereme dárcovskou tkáň a rozdělíme ji na jednotlivé buňky, které jsou následně implantovány do těla příjemce, případně jsou před implantací kultivovány a připojeny k podpůrné matrix. Implantovaná tkáň může být heterologní, alogenní nebo autologní. V ideálním případě tento přístup umožňuje obnovu tkáňové funkce nebo její nahrazení in toto s pouze minimálním výskytem komplikací [1-6].
Ideálním materiálem pro implantát jsou autologní buňky dárce. Při užití autologních buněk můžeme obejít komplikace (zánět, rejekce) spojené s implantací od cizího dárce. Hlavní obava spočívá v tom, že při kultivaci buněk z určitého orgánu nemusí být v postiženém orgánu dostatek normálních buněk pro zahájení procesu. Výsledky nejnovějších studií však nasvědčují tomu, že tato obava je lichá. Jedna studie kupříkladu prokázala, že vykultivované buňky hladké svaloviny neuropatického močového měchýře vykazují odlišnou charakteristiku než normální buňky hladké svaloviny in vitro (stanoveno na základě růstové analýzy, testu kontraktility a testů adherence in vitro) [7]. Navzdory těmto rozdílům však bylo prokázáno, že po kultivaci buněk neuropatické hladké svaloviny in vitro, jejich vysazení na matrix a implantaci in vivo vykazoval tento graft stejné vlastnosti jako graft vytvořený z normálních buněk [8]. Bylo prokázáno, že z genetického hlediska jsou normální progenitory (které představují zásobník pro tvorbu nových buněk) přítomny i v narušené tkáni. Tyto normální progenitory jsou nastaveny tak, aby vytvářely novou tkáň, bez ohledu na to, zda se nacházejí v normální, nebo narušené tkáni. Role kmenových buněk při regeneraci normální tkáně stále představuje předmět řady probíhajících výzkumů.
Kmenové buňky
Většina strategií užívaných v současnosti při tkáňovém inženýrství závisí na získání vzorku autologních buněk z poškozeného orgánu příjemce. V některých případech nelze primární autologní buňky z daného orgánu (např. slinivky) kultivovat. V této situaci se jako nejvhodnější zdroj buněk jeví pluripotentní lidské kmenové buňky, které se mohou přeměnit na téměř jakýkoliv typ buněk a nahradit tak prakticky jakoukoliv tkáň v organizmu.
Embryonální kmenové buňky vykazují dvě pozoruhodné vlastnosti: schopnost proliferace v nediferenciovaném, ale přesto pluripotentním (samoobnovovacím) stavu a schopnost přeměny na celou řadu specializovaných buněčných typů [9]. Tyto buňky lze izolovat z vnitřního buněčného materiálu embrya během stadia blastocysty, které začíná pět dní po fertilizaci. Bylo prokázáno, že při užití současných publikovaných protokolů vydrží buňky v nediferenciovaném stavu během minimálně 80 pasáží [10]. Doposud byla publikována řada protokolů pro diferenciaci buněk na různé specifické typy. Řada z těchto metod však není v současné době ve Spojených státech povolena vzhledem k etickému dilematu, kterým je manipulace s embryi při kultivaci.
Při užívání dospělých kmenových buněk se vyhneme etickým otázkám spojeným s užíváním embryonálních buněk. Na rozdíl od embryonálních buněk se dospělé kmenové buňky nediferencují do maligního fenotypu – implantace buněk in vivo je tedy spojena s nižším rizikem vzniku teratomu. Užívání dospělých kmenových buněk pro klinické účely je limitováno, protože vytvoření velkého množství buněk (které je nezbytné pro techniky tkáňového inženýrství) je v tomto případě obtížné.
Nejnovější zdroj kmenových buněk představují fetální kmenové buňky [11,12]. V těchto buňkách dochází k expresi markerů, které odpovídají lidským embryonálním kmenovým buňkám (jako jsou octamer-4 a embryonický antigen-4), ale nevytvářejí teratomy. Tento typ buněk je multipotentní a je schopen se diferencovat na buňky všech tří zárodečných vrstev. Fetální kmenové buňky mají navíc obrovský replikační potenciál a je možné je skladovat pro budoucí užití, a to bez rizika rejekce a bez etických zábran.
Pomocí terapeutického klonování je možné vytvořit linie kmenových buněk. Při tomto procesu vznikají embrya následujícím způsobem: Jaderný materiál dárcovské somatické buňky je vložen do enukleovaného oocytu a výsledná blastocysta je kultivována. Vnitřní buněčný materiál těchto embryí obsahuje embryonální kmenové buňky, které jsou z genetického hlediska identické se zdrojovým materiálem. Tyto kmenové buňky jsou autologní dárci a mohou se přeměnit na téměř jakýkoliv typ buňky v dospělém organizmu. Kmenové buňky získané při terapeutickém klonování by bylo možné využít při nahrazování tkání a orgánů [13]. Aplikace těchto buněk by byla užitečná zejména při léčbě terminálního stadia onemocnění ledvin, vzhledem k tomu, že při léčbě těchto onemocnění máme obvykle k dispozici omezené množství vhodných imunokompatibilních transplantátů.
Biomateriál vhodný pro rekonstrukci tkáně orgánů močopohlavního systému
Biomateriály užívané při genitourinárním tkáňovém inženýrství fungují jako umělá extracelulární matrix (ECM) a slouží k nahrazení biologických a mechanických funkcí přirozené ECM, která se nachází v různých tkáních. Užívání biomateriálů usnadňuje lokalizaci a transport buněk nebo bioaktivních faktorů (např. peptidů buněčné adhezivity, růstových faktorů) do požadovaných míst v těle a umožňuje definovat 3D prostor pro tvorbu nových tkání s příslušnou strukturou. Představují také jakéhosi „průvodce“ pro vznik nových tkání s odpovídající funkcí [14,15]. V některých případech byla testována přímá injekční aplikace buněčné suspenze bez ECM – bez této podpůrné funkce je však obtížné kontrolovat lokalizaci transplantovaných buněk [16,17].
Ideální biomateriál by měl být biokompatibilní, měl by podporovat buněčnou interakci a obnovu tkáně. Dále by měl vykazovat mechanické a fyzikální vlastnosti budoucí tkáně. Biomateriál užívaný v rámci TE urogenitálních tkání lze obecně rozdělit do tří skupin: Materiály získané přirozeným způsobem, jako jsou například kolagen a alginát, acelulární tkáňové matrix, jako jsou například submukóza močového měchýře a submukóza tenkého střeva (SIS), a syntetické polymery, jako je například kyselina polyglykolová (PGA), kyselina polymléčná a kyselina polymléčná-ko-glykolová. Ačkoliv syntetické polymery lze vytvářet ve velkém měřítku a přitom ovlivnit jejich vlastnosti (sílu, rychlost rozpadu, mikrostrukturu), materiály získané přirozeným způsobem mají potenciální výhodu biologického rozpoznání, což může zmírnit reakci příjemce na implantaci graftu.
VÝZNAM TKÁŇOVÉHO INŽENÝRSTVÍ PŘI VZNIKU SPECIFICKÝCH UROLOGICKÝCH A GENITÁLNÍCH STRUKTUR
Močová trubice
Doposud byla navržena celá řada různých strategií pro regeneraci tkáně močové trubice. Na modelu psa byla testována rekonstrukce močové trubice pomocí tkané síťky z PGA (Dexon) [18]. Tento materiál byl užit také jako prostředek pro buněčnou transplantaci při rekonstrukci tubulárního urotelu in vivo [1]. Na králičím modelu bylo testováno provedení uretroplastiky pomocí graftu v podobě onlay záplaty ze SIS bez buněk [19]. Na modelu králíka byla vyzkoušena také implantace homologního graftu z acelulární uretrální matrix [20].
Na králičím modelu bylo prokázáno, že acelulární kolagenová matrix z močového měchýře představuje vhodný materiál pro rekonstrukci defektů močové trubice. Neouretra vytvořená pomocí této matrix vykazovala krátce po rekonstrukci normální uroteliální výstelku a uspořádání svalových vláken [19,20]. Tyto výsledky byly potvrzeny v klinické studii zahrnující pacienty s anamnézou selhání rekonstrukční operace hypospadie. Ke korekci defektů močové trubice byla užita acelulární kolagenová matrix z lidského močového měchýře (obr. 1) [21,22]. Jednou z výhod tohoto materiálu oproti graftům z non-genitální tkáně, které se v současné době užívají při uretroplastice (např. bukální sliznice), je jejich snadná dostupnost. Díky tomu odpadá nutnost provádět další operační zákrok a snižuje se tak celková délka výkonu a potenciální morbidita spojená s odběrem tkáně.
Obr. 1. TE techniky při rekonstrukci močové trubice s užitím kolagenové matrix. A. Ukázkový příklad striktury bulbární uretry. B. Rekonstrukce močové trubice. Tkáň striktury je odstraněna, uretrální ploténka ponechána (levý snímek), matrix je pomocí anastomózy fixována k uretrální ploténce onlay způsobem (pravý snímek). C. Uretrogram 6 měsíců po rekonstrukci. D. Cystoskopické zobrazení močové trubice před zákrokem (vlevo) a 4 měsíce po rekonstrukci (vpravo). 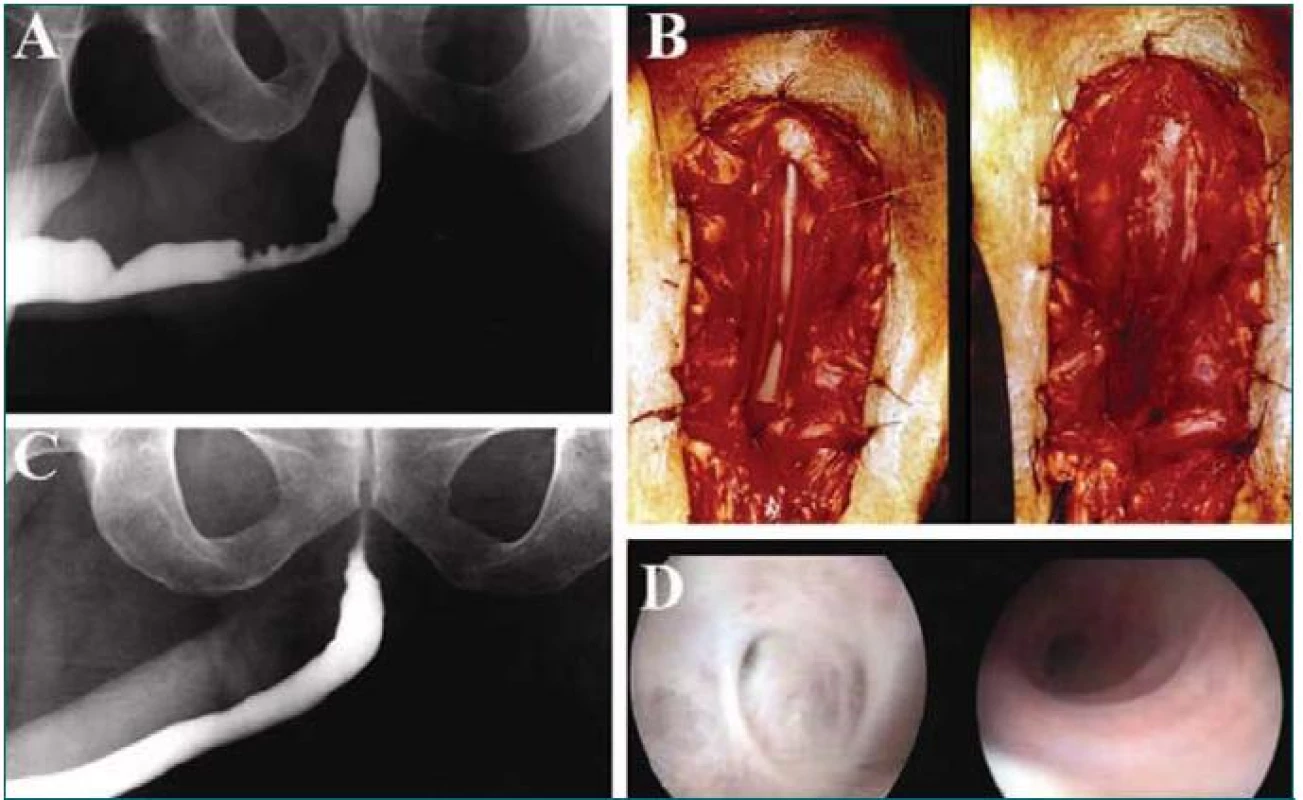
Výše uvedené techniky s užitím neosázené acelulární matrix byly úspěšně experimentálně i klinicky aplikovány při onlay rekonstrukci močové trubice. Při provádění tubulizované rekonstrukce uretry v experimentálních podmínkách se adekvátní regenerace tkáně močové trubice nezdařila, což mělo za následek vznik komplikací (kontraktura graftu a vznik striktury) [23]. Ve studiích na zvířecích modelech bylo při užití tubulizované kolagenové matrix osázené buňkami dosaženo lepších výsledků. Na králičím modelu byla provedena resekce celé části močové trubice a pomocí tubulizované kolagenové matrix byla provedena uretroplastika (matrix osázená autologními buňkami nebo acelulární matrix). S pomocí kolagenové matrix osázené autologními buňkami došlo k vytvoření nové tkáně, která byla z histologického hlediska podobná vlastní tkáni močové trubice [24]. Užití acelulární tubulizované kolagenové matrix je spojeno s narušeným vývojem tkáně, vznikem fibrózy a striktury.
Močový měchýř
Při rekonstrukci nebo nahrazování močového měchýře se v současné době užívají nejčastěji gastrointestinální segmenty. Tkáně v gastrointestinálním systému však absorbují látky, které tkáně močového systému vylučují, a tato odlišná funkce obou tkání může vést ke vzniku četných komplikací, jako jsou například infekce, metabolické poruchy, urolitiáza, perforace, zvýšená tvorba hlenu a maligní onemocnění [25-27]. Z důvodu výskytu výše uvedených komplikací při užívání gastrointestinálních segmentů se řada vědců snažila přijít s alternativními technikami pro náhradu nebo rekonstrukci močového měchýře. Doposud lékaři testovali účinnost tkáňové expanze, implantace seromuskulárních graftů, matrix pro regeneraci tkáně a metody tkáňového inženýrství s transplantací buněk.
Tkáňová expanze při augmentaci močového měchýře
Jako jedna z metod augmentace močového měchýře byl navržen systém progresivní dilatace močovodů a močového měchýře. Tato technika však nebyla doposud testována v klinickém prostředí. Augmentační cystoplastika s užitím dilatovaného segmentu močovodu na zvířecím modelu vedla ke zvýšení kapacity močového měchýře o 190–380 % [28,29]. Na zvířecím modelu byl testován systém progresivní expanze původní tkáně močového měchýře pro augmentaci močového měchýře. V průběhu 30 dní po progresivní dilataci se objem neorezervoáru zvýšil alespoň desetinásobně. Urodynamické vyšetření prokázalo u všech živočichů normální komplianci, mikroskopické vyšetření tkáně rozšířeného neorezervoáru vykazovalo normální histologický výsledek. Řada imunocytochemických vyšetření prokázala, že u dilatované tkáně měchýře zůstaly zachovány normální fenotypové vlastnosti [29].
Implantace seromuskulárních graftů a deepitelizovaných střevních segmentů
Lékaři testovali implantaci seromuskulárního graftu a deepitelizovaného střevního segmentu – samotného nebo přes původní urotel [30-35]. Pokud ponecháme urotel intaktní, předejdeme výskytu komplikací souvisejících s implantací střevního segmentu v rámci močových cest [31,32]. Příkladem této metody je kombinace autoaugmentace a enterocystoplastiky. Po provedení autoaugmentace je divertikl překryt gastrickým nebo intestinálním segmentem zbaveným sliznice.
Matrix pro regeneraci močového měchýře
Neosázená alogenní acelulární matrix slouží jako nosná konstrukce pro zarůstání komponent stěny močového měchýře. Matrix je připravena následujícím způsobem: Všechny buněčné komponenty jsou mechanickým a chemickým způsobem odstraněny z tkáně močového měchýře [36-39]. Matrix slouží jako prostředek pro částečnou regeneraci močového měchýře, relevantní antigenicita nebyla prokázána. Jedním z příkladů je SIS, biodegradabilní, acelulární, xenogenní kolagenová tkáňová matrix. SIS byla poprvé užita na počátku osmdesátých let minulého století jako acelulární matrix při nahrazení tkáně na poli cévním. Bylo prokázáno, že SIS podporuje regeneraci celé řady různých typů hostitelské tkáně, včetně krevních cév a ligament [40]. Studie prováděné na zvířecích modelech prokázaly, že neosázená SIS matrix užitá při augmentaci močového měchýře je schopna regenerace in vivo [41,42].
V řadě studií testujících v rámci cystoplastiky rozdílné materiály při implantaci neosázených graftů byla vrstva urotelu schopna normální regenerace, vrstva svaloviny (ačkoliv byla přítomna) nebyla plně rozvinuta [36-38,42]. V mnoha případech došlo ke kontrakci graftu na 60–70 % jeho původní velikosti s minimálním zvětšením kapacity močového měchýře nebo kompliance [43,44]. V současné době probíhají studie testující acelulární matrix, která může poskytovat prostředí nezbytné pro podporu buněčné migrace, růstu a diferenciace. Bylo prokázáno, že při užití SIS z distální části ilea dosahuje rekonstrukce močového měchýře spolehlivějších výsledků [41]. Pokud bude této problematice věnována pozornost v dalším výzkumu, mohou mít tyto matrix v budoucnosti klinický význam při náhradě močového měchýře.
Nahrazení močového měchýře s užitím technik tkáňového inženýrství
Na psím modelu byla testována augmentace močového měchýře s užitím buňkami osázené alogenní acelulární matrix. Skupina pokusných zvířat podstoupila cystektomii se zachováním trigona, subjekty byly následně randomizovány do tří skupin. Jedna skupina podstoupila uzavření trigona bez pomoci rekonstrukční procedury, další skupina rekonstrukci pomocí biodegradabilních nosných konstrukcí ve tvaru močového měchýře osázených buňkami, poslední skupina podstoupila rekonstrukci pomocí biodegradabilních nosných konstrukcí ve tvaru močového měchýře osázených uroteliálními buňkami a buňkami hladké svaloviny.
U objektů, které podstoupily pouze cystektomii, byla kapacita měchýře 22 % hodnoty naměřené před výkonem, u kontrolních objektů (neosázená matrix) 46 %. U objektů, které podstoupily nahrazení močového měchýře s implantací osázené matrix, činila průměrná kapacita měchýře 95 % původního objemu (obr. 2). U objektů, které podstoupily pouze cystektomii bez rekonstrukce, a objektů, u nichž byly při transplantaci užity pouze polymery, bylo prokázáno významné snížení kompliance močového měchýře (10 % a 42 %). Kompliance u objektů s implantovaným měchýřem (osázená matrix) byla prakticky srovnatelná s předoperačními hodnotami (106 %). Z histologického hlediska vykazovaly neosázené nosné konstrukce močového měchýře normální vrstvu uroteliálních buněk se zesílenou fibrotickou submukózou a slabou vrstvou svalových vláken. U měchýřů vytvořených pomocí TE byla přítomna normální buněčná organizace, sestávající z následujících tří vrstev – urotelu, submukózy a svaloviny [45].
Obr. 2. Makroskopické vzorky a cystogramy 11 měsíců po cystektomii u kontrolních objektů (neosázená matrix) a objektů, které podstoupily nahrazení močového měchýře pomocí tkáně osázené buňkami. Močový měchýř u objektů po cystektomii měl kapacitu 22 % hodnoty naměřené před zákrokem a komplianci 10 % hodnoty naměřené před zákrokem. U kontrolní skupiny (neosázená matrix) bylo zjištěno signifikantní zjizvení, kapacita 46 % hodnoty naměřené před zákrokem a kompliance 42 % hodnoty naměřené před zákrokem. U objektů, které podstoupily nahrazení močového měchýře s užitím tkáně osázené buňkami, byla zjištěna průměrná kapacita 95 % původního objemu (před cystektomií) a kompliance byla téměř srovnatelná s hodnotou naměřenou před zákrokem (s původním močovým měchýřem) – 106 %. 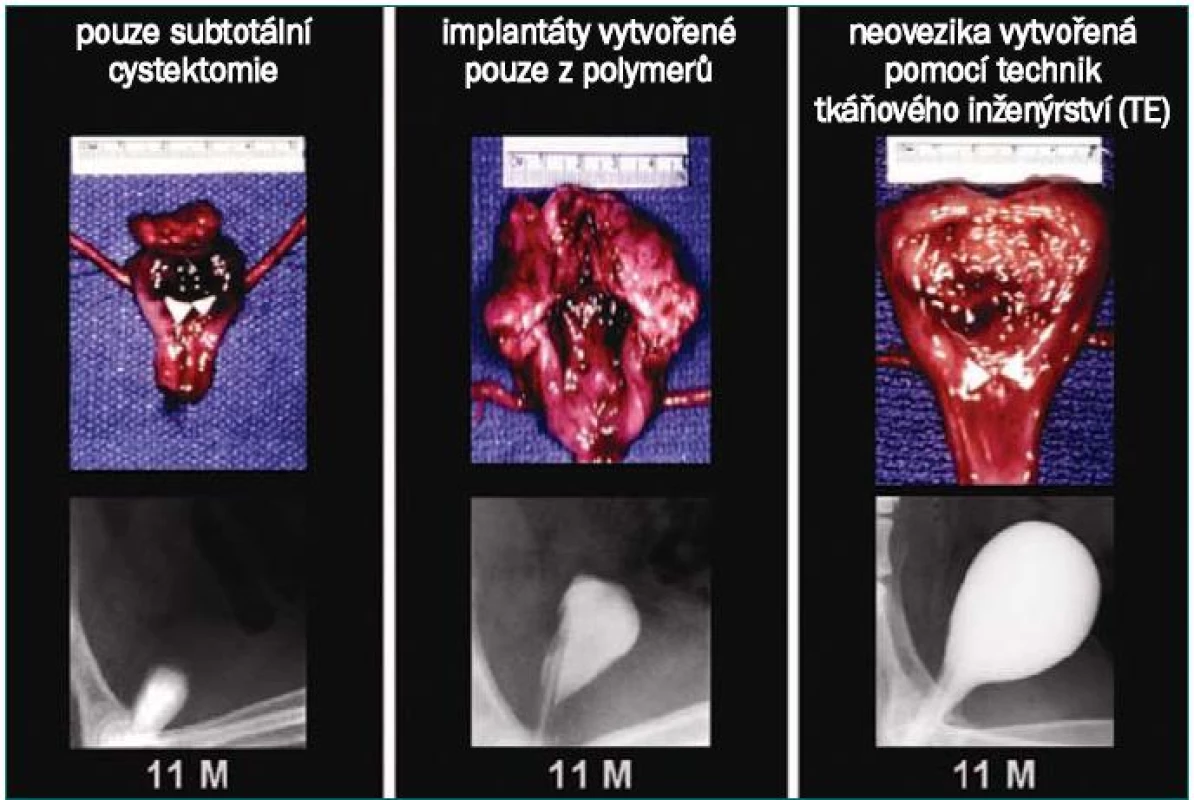
V roce 1999 byly zahájeny první studie testující užití TE tkáně při cystoplastice v klinickém prostředí. Malá pilotní studie zahrnující 7 pacientů hodnotila užití kolagenové nosné konstrukce osázené buňkami (překryté, nebo nepřekryté omentem) nebo kombinované PGA-kolagenové nosné konstrukce osázené buňkami překryté omentem (obr. 3). U pacientů, u nichž byly při rekonstrukci užity PGA-kolagenové nosné konstrukce osázené buňkami, byla pozorována zvýšená kompliance, snížení tlaku na konci plnicí fáze, zvýšení kapacity a delší trvání period kontinence [5]. Ačkoliv jsou tyto výsledky povzbuzující a jasně nasvědčují tomu, že implantaci takto upravené tkáně lze bezpečně provést, je to teprve pouhý začátek cesty, na jejímž konci stojí vytvoření plně funkčního močového měchýře. V současné době probíhají další experimentální i klinické studie.
Obr. 3. Konstrukce lidského močového měchýře pomocí TE. A. Měchýř je pomocí anastomózy fixován ke tkáni původního močového měchýře (pomocí pokračovací 4-0 polyglykolové sutury). B. Implantovaný měchýř je pokryt vrstvou fibrinového lepidla a omenta. 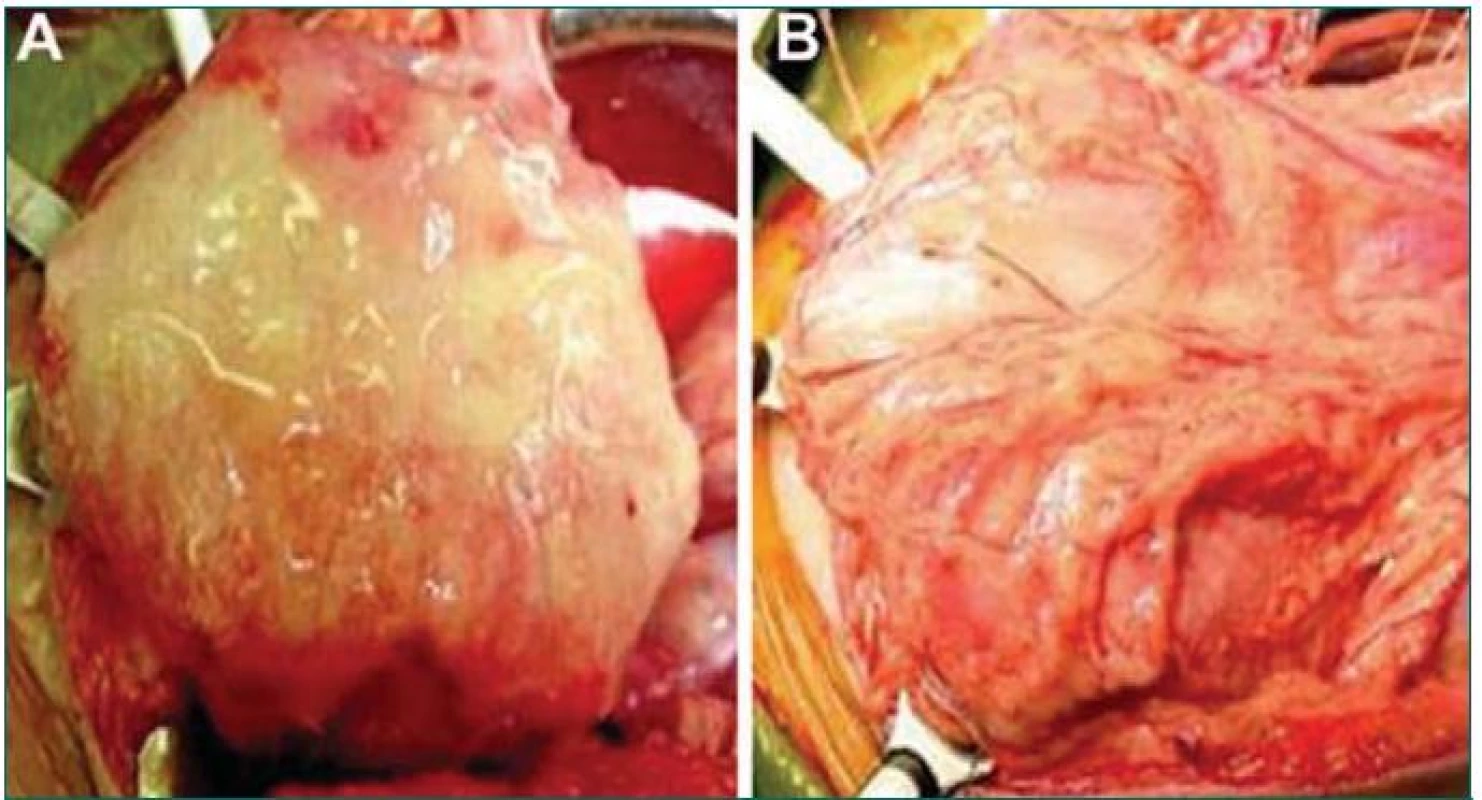
Ledvina
Vzhledem ke své extrémně složité struktuře i funkci představuje ledvina největší oříšek při rekonstrukci orgánů urogenitálního systému. Vědci se v současné době snaží rozpracovat koncept bioarteficiální ledviny. Část výzkumu se zaměřila na nahrazení samostatných funkčních parametrů ledviny pomocí extrakorporální jednotky, jiní se pokouší nahradit celkovou funkci ledviny pomocí implantace bioarteficiální renální struktury.
Ex vivo funkční renální jednotky
Nejčastěji užívanou formu nahrazující funkci ledviny představuje v současné době dialýza. Poměrně vysoká míra morbidity a mortality spojená s touto procedurou přiměla lékaře k hledání alternativních řešení.
Ve snaze hodnotit proveditelnost a fyziologickou funkčnost zařízení osázeného buňkami, které by nahradilo filtrační, transportní, metabolickou a endokrinologickou funkci ledviny, byla do extrakorporálního perfuzního obvodu začleněna syntetická hemofiltrační zařízení a zařízení obsahující TE prasečí renální tubuly. Tento systém byl testován na psím modelu trpícím akutní uremií. Během léčby vědci měřili hladinu draslíku a urey v krvi. Systém umožňoval frakční reabsorpci sodíku a vody. Autoři sledovali aktivní transport draslíku, hydrogenuhličitanu sodného a glukózy a postupnou tendenci k vylučování amoniaku. Tyto výsledky nasvědčují tomu, že začlenění proximálních tubulárních buněk do extrakorporálního zařízení je proveditelné a přináší benefit [46].
U pacientů hospitalizovaných na jednotce intenzivní péče byla testována úspěšnost bioarteficiální ledviny využívající výše uvedené principy. Bioarteficiální ledvina byla vytvořena z běžného hemofiltračního zásobníku a zařízení obsahujícího lidské renální proximální tubuly. Předběžné klinické údaje nasvědčují tomu (na základě měření akutních a biochemických indexů), že terapie s užitím renálních tubulů může představovat dynamický a individuální léčebný program [47].
Funkční renální struktury in vivo
Další přístup zacílený na zlepšení renální funkce spočívá v augmentaci renální tkáně pomocí ledvinných buněk kultivovaných in vitro, které jsou následně užity při autologní transplantaci. Nejnovější studie se zaměřují na rekonstrukci renálního epitelu s cílem vytvořit funkční nefrony. Autoři odebrali ledvinné buňky, které následně kultivovali. Tyto buňky byly vysázeny na tubulární zařízení vytvořené z polykarbonátové membrány a jeden z jeho konců byl připevněn k Silastic katétru, který ústil do rezervoáru. Tento systém byl implantován do myšího modelu bez brzlíku. Histologické vyšetření implantátu prokázalo rozsáhlou vaskularizaci, přítomnost glomerulů s vysoce organizovanými strukturami připomínajícími tubuly. Imunocytochemické vyšetření potvrdilo renální fenotyp. Z vnitřní části implantátu byla odebrána tekutina žluté barvy, jejíž koncentrace kreatininu a kyseliny močové odpovídala složení rozředěné moči. Další studie na bovinním modelu prokázaly, že pomocí nukleární transfer techniky lze dosáhnout vzniku renální struktury (obr. 4) [48]. Rozšíření tohoto systému na větší, trojrozměrné struktury představuje další výzvu v oblasti TE urogenitálního systému.
Obr. 4. Kombinace technik terapeutického klonování a tkáňového inženýrství při vytváření renální tkáně. A. Ilustrace renální jednotky. B. Renální jednotka osázená klonovanými buňkami 3 měsíce po implantaci, vykazuje nahromadění tekutiny podobné moči. C. Byla prokázána zřejmá jednosměrná kontinuita mezi zralými glomeruly, tubuly a polykarbonátovou membránou. D. „Elispot“ analýzy frekvence T-buněk vylučujících IFN gama po primární a sekundární stimulaci pomocí alogenních renálních buněk, klonovaných renálních buněk nebo nukleárních dárcovských fibroblastů. 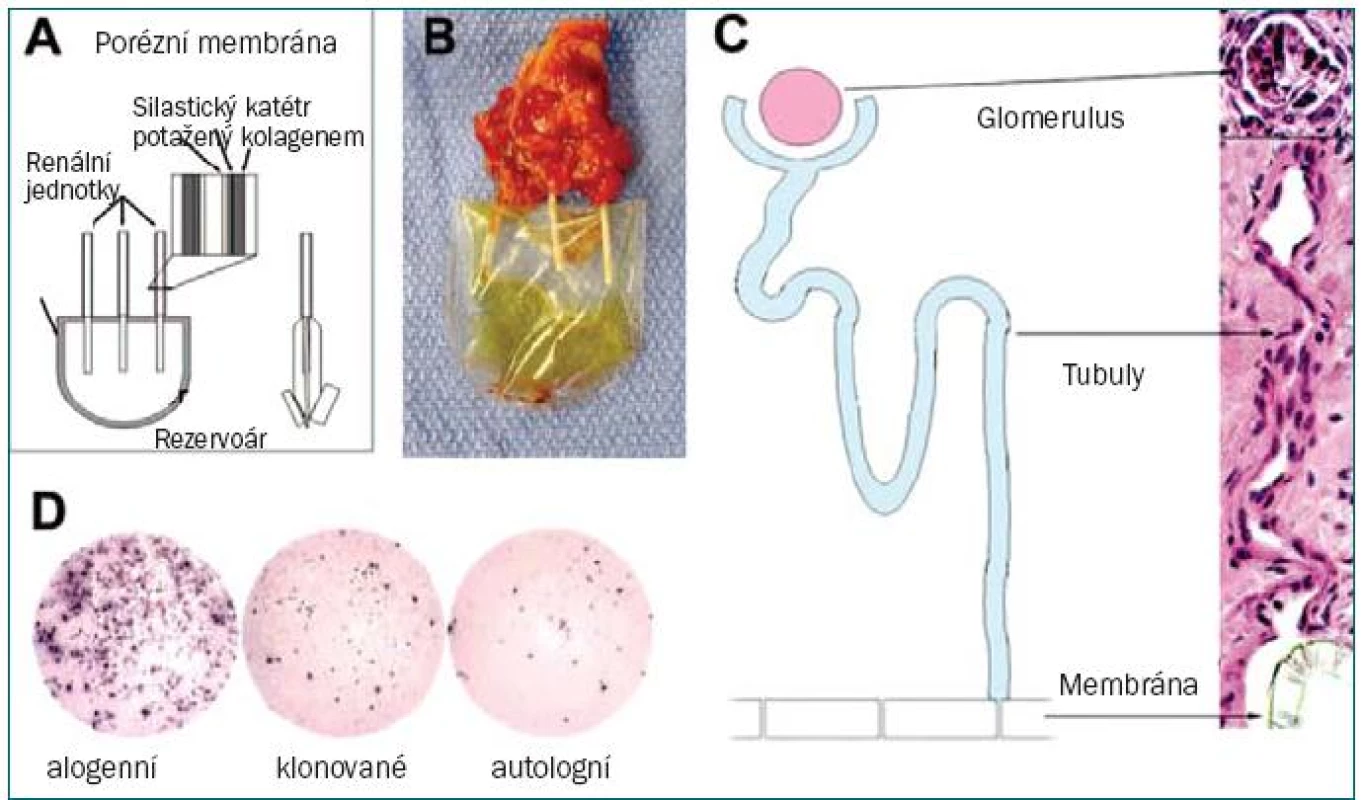
Genitální tkáň
Rekonstrukce hladké svaloviny corpus cavernosum
Jednu z hlavních částí pohlavního údu tvoří hladká svalovina corpus cavernosum. Možnost vytvořit autologní funkční a strukturální tkáň corpus cavernosum de novo by představovala benefit při léčbě vrozených abnormalit genitálu a při léčbě pacientů, u nichž je provedení rekonstrukční operace nezbytné z funkčního i estetického hlediska. Pro účely testování funkčních parametrů corpus cavernosum vytvořených pomocí bioinženýrských technik lékaři odebrali acelulární kolagenní matrix z penilní tkáně králičího modelu. Lékaři odebrali a kultivovali autologní hladkou svalovinu kavernózních těles a endoteliální buňky, které následně vysadili na matrix. Celá králičí kavernózní tělesa byla odstraněna a nahrazena těmito TE strukturami. Vyšetření experimentálních korporálních těles pomocí kavernosografie prokázalo intaktní strukturální integritu, při kavernosometrii byl naměřen intrakorporální tlak odpovídající hodnotám u kontrolní skupiny. Králíci, jimž byly implantovány acelulární nosné konstrukce, nedosáhli v průběhu studie normální erektilní funkce. U objektů, jimž byla implantována corpora osázená buňkami, byla jeden měsíc po výkonu pozorována normální kopulační činnost. U všech králíků s uměle vytvořenými corpora byla prokázána přítomnost spermií. Králičí samice, které se pářily se samci s TE corpora, byly oplodněny a porodily zdravá mláďata. U samců, jimž byla implantována samotná matrix, nebyla zaznamenána normální kopulační činnost ani nedošlo k ejakulaci do vaginy samice [49,50].
TE penilní protéza
Silikon představuje přijatelný biomateriál pro výrobu penilní protézy, obavy však vyvolává biokompatibilita tohoto materiálu [51,52]. Z tohoto důvodu se implantace přirozené protézy vytvořené z autologních buněk jeví jako potenciálně výhodná alternativa. V nedávné době provedená studie hodnotí proveditelnost implantace tyčinek chrupavky in situ [53]. Z králičího ucha byly odebrány autologní chondrocyty, které byly následně kultivovány. Buňky byly vysazeny na polymerové biodegradabilní tyčinky z polyglykolové kyseliny pokryté poly-i-mléčnou kyselinou a následně implantovány do prostorů kavernózních těles na králičím modelu. Vyšetření kavernózních těles provedené po jednom měsíci prokázalo přítomnost dobře zformovaných mléčně bílých chrupavčitých struktur, po dvou měsících došlo k rozložení polymeru. Na žádném z implantovaných míst nebyly zjištěny známky eroze ani infekce. Další studie hodnotily dlouhodobou funkčnost chrupavčitých penilních tyčinek in vivo. Zvířata užitá v této studii jsou v současnosti v dobrém stavu, jsou schopna kopulace a samci jsou bez problémů schopni oplodnit samice.
Genitální tkáň u žen
Vrozené malformace dělohy mohou mít významné klinické následky. U pacientek trpících kloakální extrofií a poruchou sexuální diferenciace nemusí být přítomno dostatečné množství tkáně dělohy, které by umožňovalo budoucí reprodukci. Zabývali jsme se možností vytvoření funkční tkáně dělohy pomocí implantace autologních buněk. Z králičího modelu jsme odebrali autologní hladkou svalovinu a epiteliální buňky dělohy, které jsme následně kultivovali. Tyto buňky byly vysazeny na předem upravené biodegradabilní polymerové nosné konstrukce ve tvaru dělohy a následně užity pro náhradu části děložní tkáně u příslušných samic. Histologické, imunocytochemické vyšetření a vyšetření metodou Western blot potvrdilo přítomnost komponent normální děložní tkáně 6 měsíců po implantaci. Biochemická analýza a orgánové studie prokázaly, že funkční vlastnosti těchto tkání byly srovnatelné s vlastnostmi normální děložní tkáně. V současné době probíhají studie testující implantaci TE dělohy.
Podobně negativní dopad mohou mít na vývoj a anatomii vaginy různá patologická onemocnění, jako jsou například vrozené malformace a malignity. V další studii autoři odebrali epiteliální buňky a buňky hladké svaloviny z králičí vaginy, které byly následně kultivovány s cílem prozkoumat možnost implantace TE vaginální tkáně. Tyto buňky byly vysazeny na polymerové biodegradabilní nosné konstrukce a takto osázené konstrukce byly následně implantovány myším samicím. Histologické, imunocytochemické vyšetření a vyšetření metodou Western blot potvrdilo přítomnost fenotypu vaginální tkáně. Studie testující stimulaci TE konstrukcí pomocí elektrického pole prokázaly, že tkáně vykazují podobné funkční vlastnosti jako normální vaginální tkáň. Při užití těchto konstrukcí při autologním nahrazení vaginy byly ve vzorcích pozorovány průchodné vaginální struktury; ve strukturách, které nebyly osázeny buňkami, byla přítomna stenóza [54].
Injekční terapie
Močová inkontinence a vezikoureterální reflux patří mezi častá onemocnění močopohlavních cest. Jednu z možností léčby představuje v současné době injekční aplikace „bulking agens“, znepokojujícím aspektem této léčby je však biokompatibilita v současné době užívaných syntetických „bulking agens“. Ideální substance vhodná pro endoskopickou léčbu refluxu a inkontinence by měla být aplikována injekčně, neměla by vykazovat antigenní vlastnosti a neměla by migrovat, měla by udržovat stabilní objem a měla by být bezpečná při aplikaci na člověka. Studie na zvířecích modelech prokázaly, že chondrocyty (buňky chrupavky) lze snadno odebrat, zkombinovat s alginátem in vitro a vzniklou suspenzi snadno aplikovat při cystoskopii. Vzhledem k tomu, že aplikace umožňuje korekci vezikoureterálního refluxu bez jakékoliv známky obstrukce, došlo k vytvoření elastické chrupavčité tkáně. Tato technologie byla užita při korekci vezikoureterálního refluxu u dětských pacientů a močové inkontinence u dospělých (obr. 5) [55,56].
Obr. 5. Chondrocyty jsou odebrány a smíchány s alginátem in vitro, suspenze aplikována pomocí cystoskopické injekce při léčbě močové inkontinence. 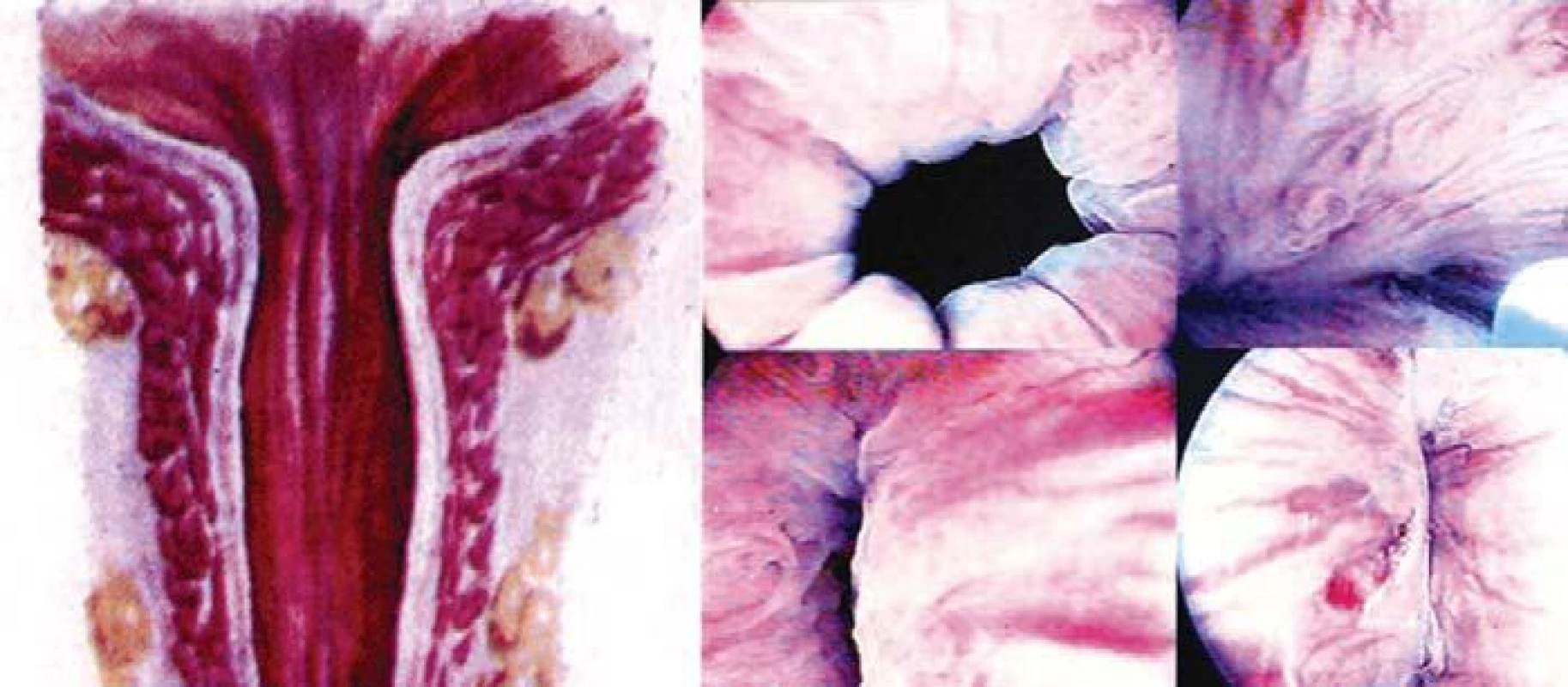
Implantace buněk autologní hladké svalové tkáně s využitím buněčných technik byla testována při léčbě močové inkontinence a vezikoureterálního refluxu. Testováno bylo také potenciální užití kultivovaných myoblastů při léčbě močové inkontinence [57,58]. Aplikace prekurzorů buněk svalové tkáně byla testována při léčbě močové inkontinence vyvolané poraněním uretrálního sfinkteru nebo jeho nedostatečným vývojem [59]. Klinická studie testující implantaci kmenových buněk ze svalové tkáně při léčbě stresové močové inkontinence přinesla příznivé výsledky. Byla provedena biopsie kosterní svaloviny a kultivace autologních myoblastů a fibroblastů. Pod ultrazvukovou kontrolou byly myoblasty injekčně aplikovány do rhabdosfinkteru, fibroblasty spolu s kolagenem byly aplikovány do submukózy. Jeden rok po injekci bylo zjištěno zlepšení tloušťky a funkce rhabdosfinkteru, všichni pacienti byli kontinentní [60]. Jedná se o první ukázky nahrazení svalové tkáně sfinkteru a jeho inervace pomocí aplikace prekurzorů svalových buněk.
Genová terapie založená na injekci svalové tkáně a TE tkáně byla kombinována ve snaze zlepšit funkci detrusoru na modelu poraněného močového měchýře. Tato technika může představovat novou možnost léčby močové inkontinence [61].
Pacienti trpící testikulární dysfunkcí vyžadují androgenní nahrazovací terapii k zabezpečení somatického vývoje. Běžná léčba testikulární dysfunkce spočívá v pravidelné aplikaci intramuskulární injekce chemicky modifikované dávky testosteronu nebo aplikaci transdermální testosteronové náplasti. Dlouhodobá testosteronová terapie v nepulzačním režimu však není vhodná a může vést ke vzniku komplikací, jako jsou například erytropoiéza a změny kostní denzity.
Jednou z možností kontrolované substituční terapie testosteronem je systém umožňující mikroenkapsulaci Leydigových buněk. Leydigovy buňky byly izolovány a enkapsulovány v roztoku alginát-poly-L-lysinu. Takto upravené Leydigovy buňky byly implantovány do vykastrovaných samců. Pravidelné měření testosteronu v séru prokázalo dlouhodobé stabilní zvýšení hladinu testosteronu [62]. Tyto studie nasvědčují tomu, že mikroenkapsulované Leydigovy buňky mohou u pacientů trpících anorchií či testikulárním selháním sloužit jako náhrada testosteronu.
ZÁVĚR
Techniky tkáňového inženýrství jsou v současné době uplatňovány ve všech typech tkání a orgánů močopohlavního systému. K největšímu rozkvětu této oblasti došlo v průběhu uplynulých deseti let. Ačkoliv některé aplikace tkáňového inženýrství jsou postupně začleňovány do klinické praxe, řadu výše popisovaných technik je předtím, než je budeme moci využít při léčbě lidských onemocnění, nutné podrobit dalšímu studiu. Nejnovější pokroky v oblasti tkáňového inženýrství však nasvědčují tomu, že uměle vytvořené urologické tkáně a buněčné terapie bude možné využít v klinické praxi, zejména při rekonstrukčních operacích.
Professor Anthony Atala, M.D.
Wake Forest University School of Medicine Medical Center Blvd, Winston Salem NC 21157
aatala@wfubmc.edu
Zdroje
1. Atala A, Vacanti JP, Peters CA et al. Formation of urothelial structures in vivo from dissociated cells attached to biodegradable polymer scaffolds in vitro. J Urol 1992; 148 : 658–662.
2. Atala A, Cima LG, Kim W et al. Injectable alginate seeded with chondrocytes as a potential treatment for vesicoureteral reflux. J Urol 1993; 150 : 745–747.
3. Atala A, Freeman MR, Vacanti JP et al. Implantation in vivo and retrieval of artificial structures consisting of rabbit and human urothelium and human bladder muscle. J Urol 1993; 150 : 608–612.
4. Atala A, Kim W, Paige KT et al. Endoscopic treatment of vesicoureteral reflux with a chondrocyte-alginate suspension. J Urol 1994; 152 : 641–643; discussion 644.
5. Atala A, Bauer SB, Soker S et al. Tissue-engineered autologous bladders for patients needing cystoplasty. Lancet 2006; 367 : 1241–1246.
6. Atala A. Tissue engineering, stem cells, and cloning for the regeneration of urologic organs. Clin Plast Surg 2003; 30 : 649–667.
7. Lin HK, Cowan R, Moore P et al. Characterization of neuropathic bladder smooth muscle cells in culture. J Urol 2004; 171 : 1348–1352.
8. Lai JY, Yoon CY, Yoo JJ et al. Phenotypic and functional characterization of in vivo tissue engineered smooth muscle from normal and pathological bladders. J Urol 2002; 168 : 1853–1857; discussion 1858.
9. Brivanlou AH, Gage FH, Jaenisch R et al. Stem cells. Setting standards for human embryonic stem cells. Science 2003; 300 : 913–916.
10. Thomson JA, Itskovitz-Eldor J, Shapiro SS et al. Embryonic stem cell lines derived from human blastocysts. Science 1998; 282(5395): 1145–1147. Erratum in Science 1998; 282(5395): 1827.
11. De Coppi P, Bartsch G Jr, Siddiqui MM et al. Isolation of amniotic stem cell lines with potential for therapy. Nat Biotechnol 2007; 25 : 100–106.
12. De Coppi P, Callegari A, Chiavegato A et al. Amniotic fluid and bone marrow derived mesenchymal stem cells can be converted to smooth muscle cells in the cryo-injured rat bladder and prevent compensatory hypertrophy of surviving smooth muscle cells. J Urol 2007; 177 : 369–376.
13. Hochedlinger K, Rideout WM, Kyba M et al. Nuclear transplantation, embryonic stem cells and the potential for cell therapy. Hematol J 2004; 5: S114–S117.
14. Kim BS, Baez CE, Atala A. Biomaterials for tissue engineering. World J Urol 2000; 18 : 2–9.
15. Kim BS, Mooney DJ. Development of biocompatible synthetic extracellular matrices for tissue engineering. Trends Biotechnol 1998; 16 : 224–230.
16. Ponder KP, Gupta S, Leland F et al. Mouse hepatocytes migrate to liver parenchyma and function indefinitely after intrasplenic transplantation. Proc Natl Acad Sci USA 1991; 88 : 1217–1221.
17. Brittberg M, Lindahl A, Nilsson A et al. Treatment of deep cartilage defects in the knee with autologous chondrocyte transplantation. N Engl J Med 1994; 331 : 889–895.
18. Olsen L, Bowald S, Busch C et al. Urethral reconstruction with a new synthetic absorbable device. An experimental study. Scand J Urol Nephrol 1992; 26 : 323–326.
19. Kropp BP, Ludlow JK, Spicer D et al. Rabbit urethral regeneration using small intestinal submucosa onlay grafts. Urology 1998; 52 : 138–142.
20. Sievert KD, Bakircioglu ME, Nunes L et al. Homologous acellular matrix graft for urethral reconstruction in the rabbit: histological and functional evaluation. J Urol 2000; 163 : 1958–1965.
21. Atala A, Guzman L, Retik AB. A novel inert collagen matrix for hypospadias repair. J Urol 1999; 162 : 1148–1151.
22. Chen F, Yoo JJ, Atala A. Acellular collagen matrix as a possible “off the shelf” biomaterial for urethral repair. Urology 1999; 54 : 407–410.
23. Le Roux PJ. Endoscopic urethroplasty with unseeded small intestinal submucosa collagen matrix grafts: a pilot study. J Urol 2005; 173 : 140–143.
24. De Filippo RE, Yoo JJ, Atala A. Urethral replacement using cell seeded tubularized collagen matrices. J Urol 2002; 168 : 1792–1793.
25. McDougal WS. Metabolic complications of urinary intestinal diversion. J Urol 1992; 147 : 1199–1208.
26. Kaefer M, Hendren WH, Bauer SB et al. Reservoir calculi: a comparison of reservoirs constructed from stomach and other enteric segments. J Urol 1998; 160 : 2187–2190.
27. Kaefer M, Tobin MS, Hendren WH et al. Continent urinary diversion: the Children’s Hospital experience. J Urol 1997; 157 : 1394–1399.
28. Lailas NG, Cilento B, Atala A. Progressive ureteral dilation for subsequent ureterocystoplasty. J Urol 1996; 156 : 1151–1153.
29. Satar N, Yoo JJ, Atala A. Progressive dilation for bladder tissue expansion. J Urol 1999; 162 : 829–831.
30. Blandy JP. Ileal pouch with transitional epithelium and anal sphincter as a continent urinary reservoir. J Urol 1961; 86 : 749–767.
31. Blandy JP. The feasibility of preparing an ideal substitute for the urinary bladder. Ann R Coll Surg Engl 1964; 35 : 287–311.
32. Harada N, Yano H, Ohkawa T et al. New surgical treatment of bladder tumours: mucosal denudation of the bladder. Br J Urol 1965; 37 : 545–547.
33. Oesch I. Neourothelium in bladder augmentation. An experimental study in rats. Eur Urol 1988; 14 : 328–329.
34. Salle JL, Fraga JC, Lucib A et al. Seromuscular enterocystoplasty in dogs. J Urol 1990; 144 : 454–456; discussion 460.
35. Cheng E, Rento R, Grayhack JT et al. Reversed seromuscular flaps in the urinary tract in dogs. J Urol 1994; 152 : 2252–2257.
36. Yoo JJ, Meng J, Oberpenning F et al. Bladder augmentation using allogenic bladder submucosa seeded with cells. Urology 1998; 51 : 221–225.
37. Probst M, Dahiya R, Carrier S et al. Reproduction of functional smooth muscle tissue and partial bladder replacement. Br J Urol 1997; 79 : 505–515.
38. Sutherland RS, Baskin LS, Hayward SW et al. Regeneration of bladder urothelium, smooth muscle, blood vessels and nerves into an acellular tissue matrix. J Urol 1996; 156 : 571–577.
39. Piechota HJ, Dahms SE, Nunes LS et al. In vitro functional properties of the rat bladder regenerated by the bladder acellular matrix graft. J Urol 1998; 159 : 1717–1724.
40. Badylak SF, Lantz GC, Coffey A et al. Small intestinal submucosa as a large diameter vascular graft in the dog. J Surg Res 1989; 47 : 74–80.
41. Kropp BP, Cheng EY, Lin HK et al. Reliable and reproducible bladder regeneration using unseeded distal small intestinal submucosa. J Urol 2004; 172 : 1710–1713.
42. Kropp BP, Rippy MK, Badylak SF et al. Regenerative urinary bladder augmentation using small intestinal submucosa: urodynamic and histopathologic assessment in long-term canine bladder augmentations. J Urol 1996; 155 : 2098 – 2104.
43. Portis AJ, Elbahnasy AM, Shalhav AL et al. Laparoscopic augmentation cystoplasty with different biodegradable grafts in an animal model. J Urol 2000; 164 : 1405–1411.
44. Landman J, Olweny E, Sundaram CP et al. Laparoscopic mid sagittal hemicystectomy and bladder reconstruction with small intestinal submucosa and reimplantation of ureter into small intestinal submucosa: 1-year follow up. J Urol 2004; 171 : 2450–2455.
45. Oberpenning F, Meng J, Yoo JJ et al. De novo reconstitution of a functional mammalian urinary bladder by tissue engineering. Nat Biotechnol 1999; 17 : 149–155.
46. Humes HD, Buffington DA, MacKay SM et al. Replacement of renal function in uremic animals with a tissue-engineered kidney. Nat Biotechnol 1999; 17 : 451–455.
47. Humes HD, Weitzel WF, Bartlett RH et al. Renal cell therapy is associated with dynamic and individualized responses in patients with acute renal failure. Blood Purif 2003; 21 : 64–71.
48. Lanza RP, Chung HY, Yoo JJ et al. Generation of histocompatible tissues using nuclear transplantation. Nat Biotechnol 2002; 20 : 689–696.
49. Yoo JJ, Park HJ, Atala A. Tissue-engineering applications for phallic reconstruction. World J Urol 2000; 18 : 62–66.
50. Yoo JJ, Atala A. Tissue engineering of genitourinary organs. Ernst Schering Res Found Workshop 2002; 35 : 105–127.
51. Nukui F, Okamoto S, Nagata M et al. Complications and reimplantation of penile implants. Int J Urol 1997; 4 : 52–54.
52. Thomalla JV, Thompson ST, Rowland RG et al. Infectious complications of penile prosthetic implants. J Urol 1987; 138 : 65–67.
53. Yoo JJ, Park HJ, Lee I et al. Autologous engineered cartilage rods for penile reconstruction. J Urol 1999; 162 : 1119–1121.
54. De Filippo RE, Yoo JJ, Atala A. Engineering of vaginal tissue in vivo. Tissue Eng 2003; 9 : 301–306.
55. Diamond DA, Caldamone AA. Endoscopic correction of vesicoureteral reflux in children using autologous chondrocytes: preliminary results. J Urol 1999; 162 : 1185–1188.
56. Bent AE, Tutrone RT, McLennan MT et al. Treatment of intrinsic sphincter deficiency using autologous ear chondrocytes as a bulking agent. Neurourol Urodyn 2001; 20 : 157–165.
57. Yokoyama T, Huard J, Chancellor MB. Myoblast therapy for stress urinary incontinence and bladder dysfunction. World J Urol 2000; 18 : 56–61.
58. Chancellor MB, Yokoyama T, Tirney S et al. Preliminary results of myoblast injection into the urethra and bladder wall: a possible method for the treatment of stress urinary incontinence and impaired detrusor contractility. Neurourol Urodyn 2000; 19 : 279–287.
59. Yiou R, Yoo JJ, Atala A. Restoration of functional motor units in a rat model of sphincter injury by muscle precursor cell autografts. Transplantation 2003; 76 : 1053–1060.
60. Strasser H, Berjukow S, Marksteiner R et al. Stem cell therapy for urinary stress incontinence. Exp Gerontol 2004; 39 : 1259–1265.
61. Huard J, Yokoyama T, Pruchnic R et al. Muscle-derived cell-mediated ex vivo gene therapy for urological dysfunction. Gene Ther 2002; 9 : 1617–1626.
62. Machluf M, Orsola A, Boorjian S et al. Microencapsulation of Leydig cells: a system for testosterone supplementation. Endocrinology 2003; 144 : 4975–4979.
Štítky
Detská urológia Urológia
Článek Úvodní slovoČlánek Ze zahraničních periodik
Článok vyšiel v časopiseUrologické listy
Najčítanejšie tento týždeň
2009 Číslo 2- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Symptomy dolních cest močových u dětí: současné hodnocení a léčba
- Léčba hyperaktivity močového měchýře (OAB) u mužů
- Inkontinence u pacientů po prostatektomii: patofyziologie a léčba
- TOT – nový „zlatý standard“ v řešení ženské stresové inkontinence?
- Úvodní slovo
- Využití tkání získaných pomocí bioinženýrských metod při rekonstrukci urogenitálního systému
- Botulinum toxin: Jaký je jeho význam při léčbě dolních cest močových?
- Právní úprava vazektomie z antikoncepčních důvodů v České republice
- Ze zahraničních periodik
- GUIDELINES EAU PRO TRANSPLANTACI LEDVINY (část 2)
- Urologické listy
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- TOT – nový „zlatý standard“ v řešení ženské stresové inkontinence?
- Symptomy dolních cest močových u dětí: současné hodnocení a léčba
- Léčba hyperaktivity močového měchýře (OAB) u mužů
- Inkontinence u pacientů po prostatektomii: patofyziologie a léčba
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



