-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Kryochirurgická operace lokalizovaného karcinomu prostaty v počátečním stadiu: přechod od léčby celé prostatické žlázy k fokální kryoablaci
TRANSITION OF WHOLE GLAND CRYOSURGERY TO FOCAL CRYOABLATION FOR THE TREATMENT OF EARLY STAGE LOCALIZED PROSTATE CANCER
Modern cryoablation of the prostate is a constantly developing technique for the definitive treatment of localized prostate cancer that has evolved over three main generations into a safer and more successful therapy nowadays. Technical improvements have occurred secondary to advancements in engineering, procedural refinement, temperature monitoring, and a better understanding of cryobiology at the molecular level. Cryotherapy for prostate cancer has become a feasible option proposed as a viable alternative to traditional radical surgery and radiation therapy.
Key words:
prostate cancer, review, cryoablation, focal therapy
Autoři: V. Mouraviev; M. Tsivian; T. J. Polascik
Působiště autorů: Associate Professor of Urology, Duke University Medical Center
Vyšlo v časopise: Urol List 2009; 7(4): 20-26
Souhrn
Moderní kryoablace prostaty je neustále se vyvíjející technika pro definitivní léčbu lokalizovaného karcinomu prostaty. Po třech generacích vývoje se tato terapie vyvinula do bezpečnější a účinnější podoby, což bylo podmíněno rozvojem technologie, zdokonalením techniky, monitorováním teploty a lepším porozuměním kryobiologii na molekulární úrovni. Léčba karcinomu prostaty pomocí kryoterapie se tak stala schůdnou alternativou k běžné radikální operaci a radioterapii.
Klíčová slova:
karcinom prostaty, přehled, kryoablace, fokální terapieÚVOD
Kryochirurgická terapie třetí generace dosahuje v rámci primární léčby lokalizovaného karcinomu prostaty převratných výsledků, a to díky technickým inovacím, jako je užívání plynových sond (cirkulace argonu-helia) na bázi Joule-Thompsonova principu nebo ultratenkých 17G jehel (1,5 mm) s ostrým hrotem [1–2]. Kryoablace se stala skutečně minimálně invazivní technikou – s přímou transperineální penetrací a precizním zavedením kryosond do prostaty skrze mřížku šablony užívané při brachyterapii [3]. Tyto inovace umožnily vedle zmrazení celé prostatické žlázy rovněž lepší zacílení kryoablačního procesu do oblasti tumoru. Kryochirurgická technika třetí generace byla zavedena do klinické praxe v roce 2000 [3–5].
Oficiální statistiky AUA (Americká urologická společnost) uvádějí, že navzdory konstantnímu podílu urologů provádějících kryochirurgickou operaci v letech 1997–2001 (2 %) se průměrný počet výkonů prováděných jedním urologem zvýšil ze 4 na 24 [6]. Probíhající technické inovace a nejnovější kryotechnologie třetí generace užívané v akademických centrech vedly k dramatickému zlepšení klinických výsledků. V reakci na tyto výsledky AUA akceptovala kryoablaci jako bezpečnou alternativní modalitu pro léčbu klinicky lokalizovaného karcinomu prostaty [7]. Dále lze předpokládat, že tato modalita bude v blízké budoucnosti hrát v rámci lokální léčby karcinomu prostaty daleko významnější roli.
NEJNOVĚJŠÍ VÝVOJ V KRYOBIOLOGII
Destrukční účinek kryoterapie (na tumor) probíhá několika předpokládanými drahami. Předchozí výzkum pomohl odhalit dva hlavní patofyziologické mechanizmy [8–9]. První mechanizmus spočívá v přímém poškození buňky, kdy samotný led dezintegruje a poškozuje buněčnou membránu a další důležité organely. Druhým mechanizmem je cévní poranění s následnou koagulační nekrózou. Z molekulárního hlediska představuje nejnovější a nejdůležitější objev související s kryochirurgií zjištění, že třetím mechanizmem zodpovědným za buněčnou smrt po poranění chladem je apoptóza. Hollister et al [10] v roce 1998 zjistili, že buněčná DNA karcinomu prostaty vykazuje po zmrazení na teplotu -5 a -15 °C nenahodilý degradační vzorec obvykle související s pozdním stadiem apoptózy. Následně i další studie potvrdily, že po aplikaci mrazicího cyklu dochází k aktivaci apoptózy. Apoptické buňky byly po zmrazení přítomny zejména v periferní zóně kryogenní léze, kde teplota nebyla natolik nízká, aby způsobila buněčnou smrt všech buněk. V periferní oblasti mohou některé buňky přežít, zatímco jiné nikoli. V nedávné době provedené studii Baust et al [11] prokázali, že kombinace subletální koncentrace chemoterapeutika před zahájením mrazení (-15 °C) u buněčné linie PC3-karcinomu prostaty podporuje buněčnou smrt v periferní zóně zmrazené oblasti. Forest et al [12–13] zjistili, že kombinace kryoterapie a chemoterapie (navelbin) in vivo na lidském modelu karcinomu plic vyvolá silnější apoptózu než samotná chemoterapie. Výsledky těchto studií potvrzují rozdílný efekt kryoablace a chemoterapie in vivo, což nasvědčuje tomu, že kombinovaná aplikace obou terapií bude mít různý mechanizmus účinku a různý potenciální benefit.
Dalším mechanizmem vyvolaným hypotermií je imunologické poškození stimulované mrazením [14–15]. Tato hypotéza předpokládá, že imunitní systém pacienta je senzitizován k tkáni poškozené při kryoablaci. Jinými slovy, imunitní systém může během procesu obnovy zničit jakoukoli tkáň, která zůstala nepoškozena nebo utrpěla pouze subletální poškození. Doposud bylo publikováno několik studií (na zvířatech i v klinické praxi), které popisují vznik imunologické reakce na tkáň tumoru po kryoablaci [16–17]. Případ sporadické remise metastazující léze po sekvenční kryoablaci prostaty (jako monoterapie) ve starších studiích svědčí o atraktivitě této léčebné modality, zejména u pacientů s onemocněním v pokročilém stadiu [16,18–19]. Jiné studie však neuvádějí (po kryoablaci) žádnou nebo pouze minimální změnu imunitní reakce [20–21]. Některé studie dokonce popisují, že kryochirurgická operace naopak podporuje růst tumoru a metastáz [22–23]. Doposud tedy nebylo prokázáno, že by mechanizmus imunitní reakce po kryoblaci dosahoval konzistentního efektu. Tato problematika tedy vyžaduje další výzkum [24].
Z biologického úhlu pohledu nebyla doposud vyřešena otázka, zda je při destrukci buněk tumoru a vzniku specifické imunity účinnější nekróza nebo apoptóza. Chao et al [25] prokázali, že nekróza prostatické tkáně vyvolaná kryoablací je schopna, v kombinaci s aplikací imunomodulátorů v podobě cytosinů (např. THFα), stimulovat imunitu proti tkáni tumoru. Den Brok et al [26] v nedávné době prokázali, že in situ kryoablace způsobuje vznik potenciálního zdroje nádorového antigenu pro dendritické buňky (DCs) v oblasti nekrózy in vivo. Protinádorová imunitní reakce však byla po samotné ablaci pouze slabá. Autoři proto zkombinovali kryoablaci s aplikací imunoadjuvantních agens TLR9 (toll-proteiny náležící do třídy MHC I) via CpG-oligodeoxynukleotidy ke stimulaci nezralých DCs k jejich signifikantnějšímu vyzrávání pro exogenní antigeny třídy MHC I. Jinými slovy, aplikace těchto agens může účinkovat jako imunitní, tumor-specifická „in situ vakcína“. Výsledky tohoto kombinovaného kryoimunoterapeutického přístupu prokazují synergistický protinádorový účinek na lokální i systémové úrovni umožňující přímou vazbu s antigeny a zrání DCs in vivo bez aplikace definovaných tumor antigenů.
Rozmanitost potenciálních mechanizmů destrukce (vyvolané hypotermickým poškozením) nasvědčuje tomu, že reakce na poranění chladem je proces, na němž se podílí celá řada faktorů. Baust a Gage [27] v nedávné době popsali trend posunu nahlížení na kryobiologii z čistě termofyzikální úrovně k složitější molekulární a genetické úrovni.
PRIMÁRNÍ KRYOABLACE KARCINOMU PROSTATY
Tab. 1 uvádí souhrn výsledků nejnovějších studií zabývajících se léčbou karcinomu prostaty pomocí primární kryoablace, které byly publikovány po zavedení kryotechnologií třetí generace. Vyšší morbiditu v prvních studiích, využívajících k mrazení tekutý dusík, lze mimo jiné přičítat užívání systémů první a druhé generace, starších ultrazvukových technik a nařízení FDA zakazující užívat vybavení k ohřevu močové trubice [4,7].
Tab. 1. Kontrola karcinomu po primární kryoterapii s užitím technologie třetí generace. 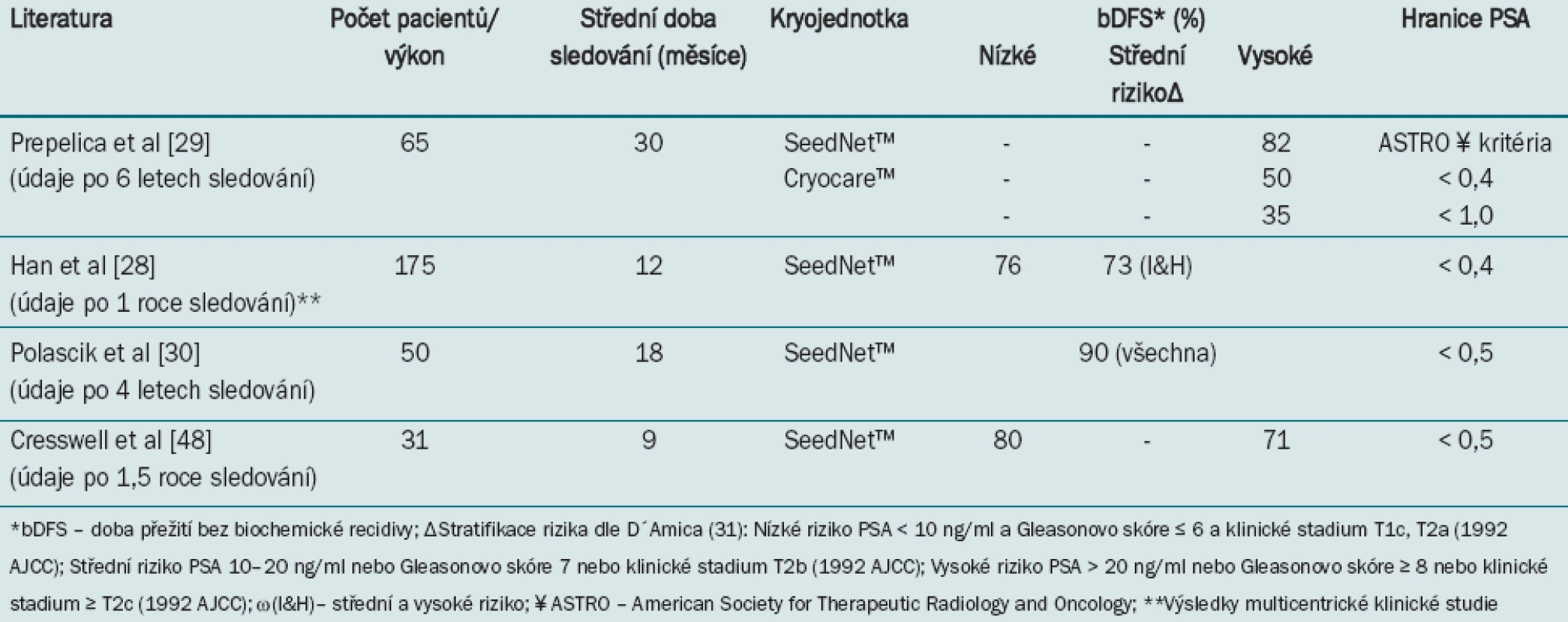
Han et al [28] nashromáždili údaje 175 pacientů, kteří v několika amerických centrech podstoupili kryoablaci využívající kryojehly třetí generace. Celkem 110 pacientů podstoupilo po 12 měsících kontrolní měření hladiny PSA s následujícími výsledky: 80 (73 %) mělo PSA < 0,4 ng/ml, u 42 z 65 (76 %) pacientů s nízkým rizikem nedošlo po roce k recidivě PSA.
Prepelica et al [29] publikovali výsledky 65 pacientů, kteří podstoupili primární kryoablaci pro léčbu karcinomu prostaty T1–T3 s vysoce rizikovými parametry (PSA ≥ 10 ng/ml, Gleasonovo skóre ≥ 8, nebo obojí). Střední hodnota věku pacientů byla 72 let. Pro hodnocení výsledků léčby autoři užili ASTRO (American Society for Therapeutic Radiology and Oncology) kritéria biochemické recidivy (tři po sobě se vyskytující zvýšení hladiny PSA). Po střední době sledování 35 měsíců bylo trvalé doby přežití bez biochemické recidivy dosaženo u 83,3 % pacientů. Šestiletá Kaplan-Meierova analýza prokázala 81,7% pravděpodobnost doby přežití podle ASTRO kritérií. Pouze v jediném případě z celkem osmi (12,5 %) podezření na lokální recidivu byla biopsie pozitivní. Na konci studie nebyla u žádného z pacientů prokázána progrese onemocnění a celková míra přežití dosáhla 100 %. Morbidita byla pouze minimální, jen dva pacienti uvedli přítomnost inkontinence a bolest v oblasti rekta, která následně samovolně vymizela. 1,5 % pacientů zaznamenalo mikční komplikace, u žádného se však nevyskytla hematurie ani píštěl.
Polascik et al [30] publikovali výsledky 50 pacientů s klinicky lokalizovaným karcinomem prostaty, kteří podstoupili primární kryoablaci využívající technologii třetí generace se 17G kryojehlami. Střední hodnota věku pacientů byla 68 let (rozmezí 50–83) a střední doba sledování 18 měsíců (rozmezí 3–43 měsíců). Na základě D´Amicovy stratifikace onemocnění podle rizika [31] mělo 36 (72 %) pacientů karcinom prostaty s nízkým rizikem, 9 (18 %) pacientů karcinom se středním rizikem a 5 (10 %) karcinom s vysokým rizikem. Hladina PSA při posledním měření byla následující: < 0,5 ng/ml u 45 (90 %) pacientů a ≥ 0,5 ng/ml u 5 (10 %) pacientů. U dvou pacientů prokázala biopsie přetrvávající přítomnost karcinomu vyžadující provedení záchranné kryoterapie nebo ozařování zevním paprskem. Celková míra přežití byla 100 %.
Tab. 2 uvádí míru výskytu komplikací u pacientů podstupujících primární kryoterapii pro léčbu karcinomu prostaty. Nejnovější technologie umožňují dosáhnout minimálního výskytu vedlejších komplikací. Jedinou výjimku představuje výskyt impotence, stále významný a obtížný problém postihující až 80–90 % pacientů. Míra výskytu impotence zůstává i nadále vysoká vzhledem k tomu, že současná technika spočívá ve zmrazení celé prostatické žlázy (a tedy i neurovaskulárních svazků), což způsobí destrukci veškeré tkáně na periferii prostatické žlázy. V současné době jsou stále častěji indikovány protokoly se zachováním nervových svazků umožňující zachovat erektilní funkci. Robinson et al [32] zaznamenali plnou obnovu sexuální funkce u 5 (13 %) pacientů, dalších 13(34 %) pacientů bylo tři roky po kryoablaci schopno uskutečnit pohlavní styk.
Tab. 2. Míra výskytu komplikací (%) po primární kryoablaci prostaty s užitím systému třetí generace. 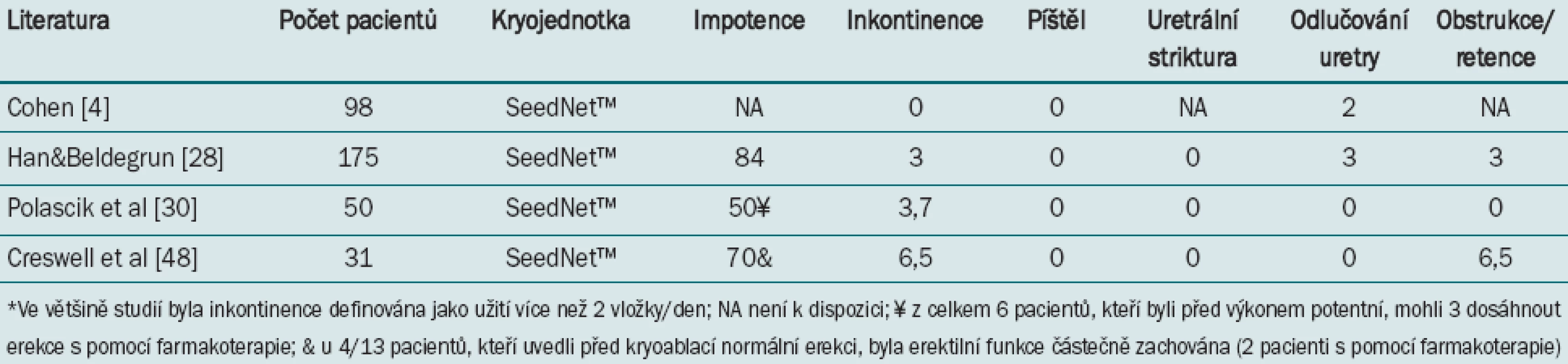
Tyto předběžné výsledky je nutné potvrdit údaji dlouhodobějšího sledování. Přesto však jasně prokazují, že léčba lokalizovaného karcinomu prostaty pomocí kryotechnologie třetí generace je bezpečnou terapeutickou modalitou. Vysokou morbiditu spojenou s kryoterapií, kterou uvádějí starší studie publikované v uplynulých dvaceti letech, lze přičítat řadě faktorů – užívání systémů první generace na bázi tekutého dusíku, méně dokonalých ultrazvukových technik, absenci monitorování teploty a nařízení FDA zakazující zavádění katétru k zahřátí močové trubice.
EKONOMICKÉ HLEDISKO A KVALITA ŽIVOTA PACIENTA PO KRYOCHIRURGICKÉ OPERACI
Lze předpokládat, že řada technologických zlepšení a klinických algoritmů povede k dalšímu zlepšení výsledků kryochirurgické operace, a to v oblastech účinnosti léčby, ceny a kvality života pacienta (QoL). Mouraviev et al [33] uskutečnili finanční analýzu přímých a nepřímých nákladů u 462 pacientů, kteří podstoupili čtyři různé terapie. Navzdory relativně vyšším operačním nákladům na kryoablaci (ve srovnání s běžnou otevřenou radikální prostatektomií – retropubickou nebo perineální – a roboticky asistovanou laparoskopickou prostatektomií) je celková cena výkonu vykompenzována signifikantně nižšími náklady v dalších oblastech. Tato cenová výhoda spočívá v kratší době hospitalizace (54/57 výkonů bylo provedeno ambulantně) a absenci nákladů spojených s patologickým vyšetřením a transfuzí krve.
Robinson et al [32] hodnotili během tříletého sledování QoL mužů, kteří byli původně zařazeni do klinické studie II. fáze zabývající se léčbou lokalizovaného karcinomu prostaty. K hodnocení byly užity instrumenty EORTC QLQ-C30 a Prostate Cancer Index. Pacienti léčení pomocí kryoablace uváděli srovnatelnou QoL jako pacienti, kteří podstoupili běžnou léčbu (radikální prostatektomii a radioterapii). Jedinou výjimku představovalo zhoršení sexuální funkce u pacientů po kryoablaci.
Anastasiadis et al [34] rovněž pomocí instrumentu EORTC QLQ-C30 a doplňkového modulu (specifického pro karcinom prostaty) hodnotili QoL u 131 po sobě jdoucích pacientů, kteří podstoupili primární a záchrannou kryoablaci. Ačkoliv celkové skóre QoL a funkční skóre u pacientů po kryoablaci bylo srovnatelné s výsledky u pacientů podstupujících otevřenou prostatektomii a radioterapii, sexuální dysfunkce představuje v této populaci pacientů stále závažnou komplikaci. 86 % pacientů po primární kryoterapii uvedlo neschopnost navodit nebo udržet erekci. Míra inkontinence je u těchto pacientů 5,9 %. Pacienti po primární kryoterapii uvádějí (ve srovnání s pacienty podstupujícími záchrannou kryoterapii) signifikantně vyšší skóre v doméně fyzikální a sociální funkce.
Ball et al [35] publikovali výsledky prospektivní longitudinální studie z jediné instituce srovnávající výsledky týkající se QoL související se zdravotním stavem u pacientů (n = 719) podstupujících pět různých terapeutických přístupů včetně minimálně invazivních výkonů. K hodnocení užili autoři Prostate Cancer Index a AUA Symptom Index 1, 3, 6, 9, 12, 24 a 36 měsíců po výkonu. Hodnocení po třech měsících prokázalo, že kryoablace měla významně horší dopad na sexuální funkci než brachyterapie, ačkoliv zde byl zaznamenán signifikantní rozdíl v počáteční sexuální funkci. Mikční funkce jeden měsíc po výkonu byla lepší po brachyterapii než po kryoablaci, tento rozdíl se však po šesti měsících ztrácí. Iritační a obstrukční symptomy byly tři měsíce po výkonu signifikantně méně závažné u pacientů po kryoablaci než po brachyterapii.
Modifikace intenzity a rozsahu kryoablace (např. zmrazení celé žlázy vs fokální terapie) by měla umožňovat vytvořit rovnovážný stav mezi kvalitou života pacienta a kontrolou karcinomu.
SOUČASNÝ A BUDOUCÍ VÝVOJ KRYOABLAČNÍ LÉČBY PROSTATY
Limitace zjištěné při analyzování údajů ve studiích zabývajících se kryoablační terapií zahrnují užívání rozdílných definic klinického rizika, biochemické recidivy, kontinence i potence. Všechny výše uvedené definice je nutné standardizovat pro potřeby kryoablační terapie, což v důsledku umožní lepší kvalitu designu multicentrických studií. Výsledky kryoablace využívající technologií třetí generace je třeba srovnávat s výsledky jiných zavedených terapeutických modalit v prospektivních randomizovaných studiích na základě konzistentních definic a klinických rizikových parametrů.
Kryoablace celé prostatické žlázy
Jedním z nedostatků vytýkaných kryoterapii je možnost přežití buněk karcinomu po výkonu v periuretrální oblasti, kde katétr ohřívající močovou trubici chrání její stěnu před nadměrným zmrazením, a minimalizuje tedy riziko následného odlučování močové trubice. Huang et al [36] zjistili přítomnost karcinomu lokalizovaného 5 mm od močové trubice u 31 (67 %) vzorků a karcinom přímo zasahující močovou trubici u 3 (7 %) vzorků (z celkem 47 po sobě jdoucích vzorků odebraných při záchranné radikální prostatektomii). Dospěli k závěru, že významný podíl karcinomů u pacientů, u nichž selhala radioterapie, je v patologicky pokročilém stadiu a léčba pomocí ablativních technik, jako jsou kryoterapie nebo brachyterapie, může být vzhledem k jejich lokalizaci v této oblasti prostatické žlázy technicky velmi náročná. Limitace této studie však zahrnují malou velikost odebraného vzorku a skutečnost, že nálezy u pacientů po selhání radioterapie budou pravděpodobně velmi odlišné od nálezů pacientů podstupujících výkon v rámci primární terapie.
V reakci na tuto obavu popsal Gould [37] techniku úplné kryoablace, při níž se neužívá katétr ohřívající močovou trubici a záměrně dochází k ablaci uretry spolu s celou prostatickou žlázou. Po šesti měsících dosáhl u 96 % pacientů PSA nadir < 0,2 ng/ml ve srovnání s 49 % pacientů, kteří podstoupili standardní kryoterapii a 73 % pacientů po radikální perineální prostatektomii. Tohoto stupně biochemické kontroly však bylo dosaženo za cenu vzniku obstrukce vyžadující transuretrální resekci u většiny pacientů a vzniku inkontinence u 18,5 % pacientů.
Kryoterapie se zachováním nervů
Techniku umožňující zachování nervů poprvé popsali Onik et al [38] v pilotní studii zahrnující devět pacientů. Technika spočívala v provedení unilaterální ablace laloku, kde biopsie prokázala pozitivní nález a vynechání kontralaterálního laloku a neurovaskulárního svazku. Po průměrné době sledování tři roky bylo celkem sedm pacientů potentních. Všichni pacienti měli stabilní hladinu PSA a negativní výsledek biopsie. Jansen et al [39] testovali na psím modelu proveditelnost kryoablace se zachováním nervů prostřednictvím aktivního zahřívání neurovaskulárního svazku. Autoři zjistili, že tato technika může umožnit zachování neurovaskulárního svazku, nebyla však konzistentně reprodukovatelná. V některých případech vede dokonce k neúplné ablaci periferní prostatické tkáně. Techniku se zachováním nervů je v tomto stadiu vhodné považovat za experimentální do doby, než další studie prokážou přijatelnou kontrolu karcinomu a adekvátní funkční výsledky.
Fokálně zaměřený přístup
Díky rozšíření screeningových programů a detekci karcinomu prostaty již v časném stadiu může fokální terapie zaplnit chybějící místo mezi dvěma extrémy – otevřenou prostatektomií s odstraněním orgánu a nečinností („pozorným vyčkáváním“). Tento přístup může být prospěšný zejména pro mladší populaci pacientů (tj. v pátéma šestém decenniu), kteří jsou doposud potentní a přejí si po výkonu zachovat potenci i další funkce (kontinenci, normální střevní aktivitu atd.). V uplynulých deseti letech byla provedena řada patologických a klinických studií s cílem lépe porozumět roli a významu ablačních technologií umožňujících zachování orgánu s přihlédnutím k tomu, že u dobře zvolené populace pacientů může fokusovaná kryoablace sloužit jako „mužská verze“ lumpektomie.
Odstranění karcinomu v jeho počátečním stadiu představuje nejlepší možnost pro minimalizaci morbidity i mortality. Mouraviev et al analyzovali 1 186 vzorků (uložených v parafínu) odebraných při radikální prostatektomii od pacientů s klinicky lokalizovaným karcinomem prostaty [40]. Při patologickém vyšetření se zaměřili zejména na lateralitu a procentuální zasažení prostaty tumorem (PTI) a patologické Gleasonovo skóre. Pouze unilaterální karcinom byl detekován u 227 pacientů (19,2 %). Většina unilaterálních tumorů (72 %) měla nízký objem s PTI ≤ 5 %. Výsledky prokázaly vyšší míru incidence (39,4 %) klinicky signifikantních tumorů (Gleasonovo skóre ≥ 7) mezi malými (≤ 5 % PTI) unilaterálními ložisky tumoru než v předchozích studiích [41]. Výsledky této studie nasvědčují tomu, že až u 20 % mužů, u nichž byl diagnostikován karcinom prostaty, bude přítomen čistě unilaterální tumor vhodný pro fokální ablaci jednoho laloku.
Multidisciplinární studie ze dvou institucí z nedávné doby analyzuje 1 000 vzorků získaných při radikální prostatektomii od pacientů s karcinomem prostaty v počátečním stadiu [42]. Pouze 18 % karcinomů bylo unilaterálních, což je v souladu s výsledky Mouravieva et al [40]. Průměrné PTI u největšího ložiska bylo 80 % u všech intraprostatických tumorů zasahujících mimo kapsulu prostaty (ECE) (ve více než 90 % lézí). Klinický význam těchto údajů je nesmírný, např. účinná ablace léze může vést k téměř úplné destrukci masy nádoru a ECE. Potenciální výhoda kryoablace spočívá ve skutečnosti, že operatér může na straně s unilaterálním karcinomem navigovat ice-ball až za prostatickou kapsulu. Další fokální terapeutické techniky, jako například HIFU (fokusovaný ultrazvuk o vysoké intenzitě) a vaskulární fokusovaná fotodynamická terapie, jsou schopny naopak lézi zničit uvnitř prostaty, tzn. pod kapsulou.
Cheng et al [41] prokázali významnou roli této techniky pro další rozvoj strategií prevence a detekce onemocnění. Autoři zjistili, že většina karcinomů o malém objemu je multifokální a zasahuje obě strany prostatické žlázy. Tumory jsou lokalizovány především v periferní zóně (79 %) a v posteriorním aspektu prostaty (84 %). Tyto údaje nasvědčují tomu, že karcinogenezi lze připisovat „field efektu“, což potvrzují i nejnovější molekulární studie prokazující, že mnohačetné karcinomy v prostatě vznikají nezávisle na sobě. Nález často se vyskytující multifokality a bilaterality u karcinomu prostaty o malém objemu je pro fokální ablativní techniky velmi důležitý. Skutečnost, že u těchto pacientů došlo ke vzniku multifokálních tumorů i při velmi nízkém celkovém objemu tumoru, svědčí o existujícím efektu karcinogeneze a pokud tyto tumory zůstanou neléčeny, mohou vést ke vzniku dalších tumorů. Autoři dospěli k závěru, že karcinom prostaty o malém objemu je často multifokální a bilaterální s tendencí vyskytovat se v periferní zóně prostaty. U 16 % karcinomů o malém objemu bylo prokázáno vysoké Gleasonovo skóre, které lze považovat za klinicky signifikantní a bez terapie poměrně agresivní.
Moderní zobrazovací vyšetření o vysokém rozlišení spolu s inovacemi softwaru pro počítačovou modelaci mohou v budoucnu poskytnout adekvátní zobrazení nezbytné pro alternativní terapeutické modality pro léčbu lokalizovaného karcinomu v počátečním stadiu. Tento přístup představuje významný krok v procesu hledání lepších způsobů léčby onemocnění při současném zachování kvality života pacientů. Barzel et al [43] kupří-kladu před volbou vhodné terapie užili transperineální 3D patologické mapování k identifikaci klinicky signifikantních karcinomů. Díky tomu autoři pečlivě vybrali osm vhodných kandidátů pro konformní kryoablaci.
Rukstalis et al [44] konstatují, že kryoablace se zachováním parenchymu může zlepšit míru kontinence i potence. Navzdory multifokální povaze karcinomu prostaty autoři předpokládali (při analýze 112 vzorků získaných při radikální prostatektomii), že pokud by byl největší tumor detekován při biopsii, bylo by možné omezením léčby na 9/12 zón prostaty (a tedy zachováním kontralaterálního neurovaskulárního svazku) dosáhnout kontroly karcinomu s 21% rizikem přítomnosti signifikantního (tj. > 0,5 ml) reziduálního onemocnění.
Tab. 3 uvádí přehled prvních klinických studií zaměřujících se na fokální kryoablaci prostaty. Lambert et al [45] publikovali údaje 25 pacientů, kteří podstoupili unilaterální kryoablaci indikovanou na základě minimální biopsie dvanácti vzorků prokazující přítomnost karcinomu prostaty v jednom laloku. Za kritérium pro podezření na přítomnost biochemické recidivy bylo stanoveno PSA nadir < 50 %. Z celkem 25 pacientů mělo 21 (84 %) míru přežití bez biochemické recidivy. Sedm pacientů podstoupilo opakovanou biopsii prostaty, která odhalila přítomnost karcinomu v kontralaterálním laloku u dvou pacientů a přítomnost karcinomu v léčeném laloku u jednoho pacienta. Z celkem 24 pacientů, kteří byli před operací potentní, zůstala potence zachována u 17 (71 %) z nich. Mikční funkce a úplná kontinence zůstaly zachovány u všech pacientů.
Tab. 3. Kontrola karcinomu a míra výskytu komplikací po fokání unilaterální kryoablaci. 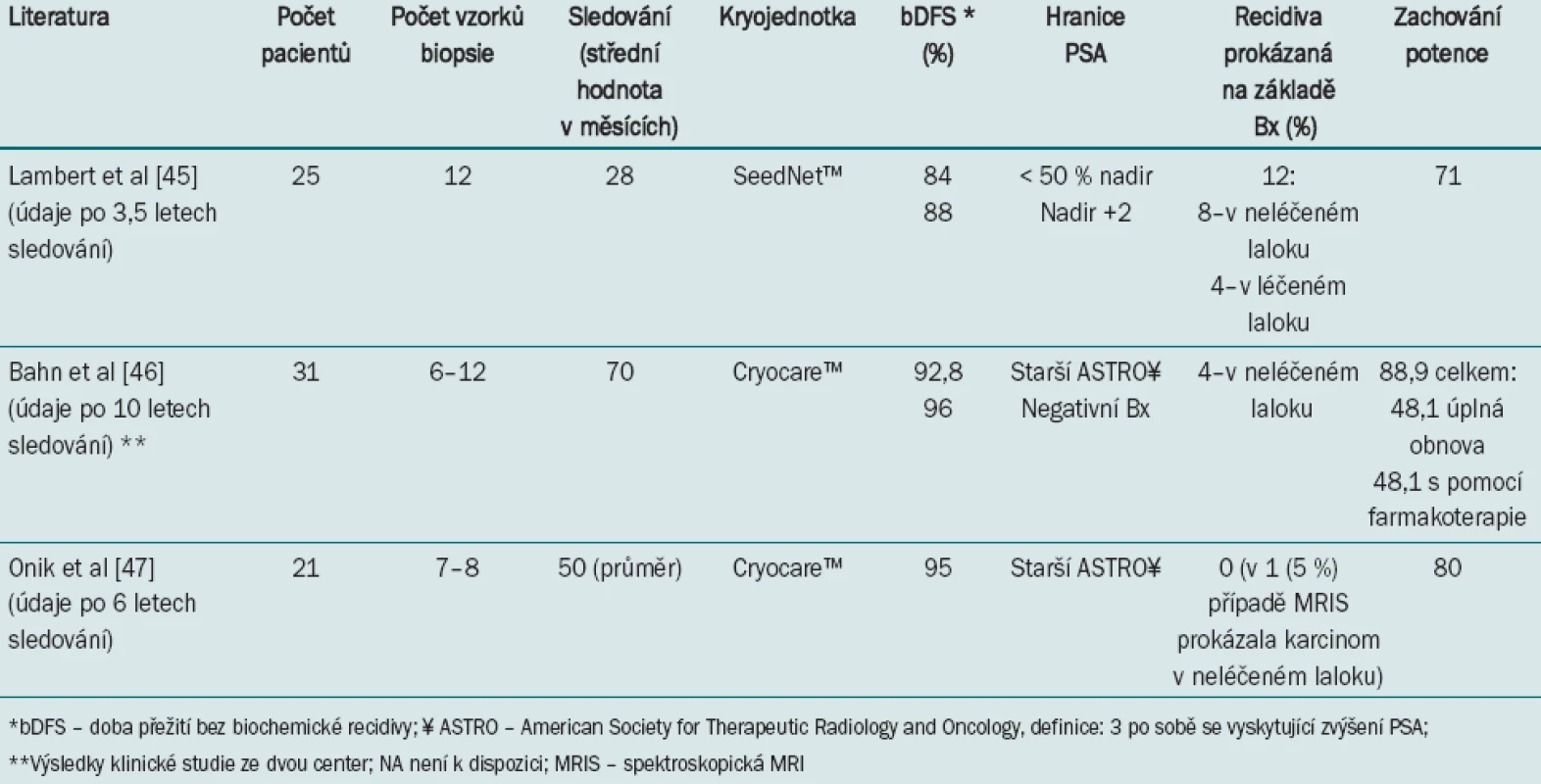
Bahn et al [46] v nedávné době publikovali výsledky studie probíhající ve dvou institucích, do níž bylo zařazeno celkem 31 pacientů s klinickým, na orgán ohraničeným unilaterálním karcinomem, který byl identifikován na základě barevné Dopplerovy ultrasonografie a prokázán pomocí fokusované a systematické biopsie. Průměrný věk mužů byl 63 let. Všichni pacienti podstoupili unilaterální kryoablaci s přáním zachování sexuální funkce i kontinence. Údaje týkající se kontroly karcinomu při sledování po průměrné době 70 měsíců byly velmi slibné – např. doby přežití bez biochemické recidivy na základě starší ASTRO definice (tři po sobě se vyskytující zvýšení hladiny PSA) bylo dosaženo u 92,8 % pacientů s 96% mírou negativní biopsie. Jediný pacient, u něhož biopsie vzorku odebraného z apexu v kontralaterálním neléčeném laloku prokázala pozitivní výsledek, podstoupil další výkon s odstraněním celé žlázy a zůstává nadále bez recidivy. U 13 z 31 pacientů (41,8 %) došlo k plné obnově potence na úroveň před výkonem. Dalších 40,7 % pacientů bylo potentních díky orální farmakoterapii a schopno dosáhnout erekce dostatečné pro úplný pohlavní styk. Potence tedy byla zachována u 88,9 % pacientů. U žádného z pacientů nebyl zaznamenán výskyt inkontinence ani jiných komplikací.
Onik [47] aktualizoval svou studii 21 pacientů údaji delší doby sledování. Na základě starší ASTRO definice bylo u 20/21 pacientů zaznamenáno přežití bez biochemické recidivy, ačkoli u deseti mužů bylo klasifikováno střední nebo vysoké riziko. Navzdory negativnímu výsledku biopsie odhalilo spektroskopické MRI přítomnost karcinomatózní léze na neléčené straně prostaty. U 17/21 pacientů byla potence zachována (80 %) bez výskytu dalších komplikací jako např. inkontinence nebo rektální píštěl.
Před zařazením těchto modalit mezi standardní léčebné postupy je nutné posoudit jejich dlouhodobou onkologickou účinnost. Klíčovým úkolem tohoto výzkumu je identifikace a vývoj prognostických indikátorů (na základě bioptického vyšetření tkáně, séra a/nebo močových markerů), které umožní predikovat pravděpodobný vývoj tumoru s větší přesností. Pacienti s nízkým rizikem progrese onemocnění by byli vhodnými kandidáty pro aktivní sledování nebo fokální terapii, zatímco pacientům s parametry nasvědčujícími přítomnosti agresivnějšího tumoru by byla poskytnuta časná multimodální terapie. Pokud přihlédneme k vývoji, k němuž došlo v uplynulých deseti letech, lze očekávat, že kryoterapie bude jistě v budoucnosti hrát v rámci léčby karcinomu prostaty významnější roli.
ZÁVĚR
Lze očekávat, že další pokroky v oblasti kryobiologie, kryotechnologie a klinických algoritmů povedou k dalšímu zlepšení výsledků kryoterapie jak s ohledem na kontrolu karcinomu, tak kvalitu života. Spolu se zavedením transrektální ultrazvukové kontroly, katétrů k ohřívání močové trubice a menších kryojehel klesla morbidita spojená s kryoablací na úroveň srovnatelnou s ostatními dostupnými možnostmi léčby. Kryoterapie je navíc spojena s několika potenciálními benefity, které činí tuto modalitu lákavou jak pro operatéry, tak pro jejich pacienty (např. ambulantní a minimálně invazivní povaha výkonu, přijatelná cena nemocničních nákladů, poměrně přijatelná doba rekonvalescence a zachování kvality života související se zdravotním stavem). Před vyvozením jakýchkoli závěrů týkajících se dlouhodobého přetrvávajícího efektu tohoto minimálně invazivního přístupu je nutné nashromáždit potřebné údaje dlouhodobého sledování (PSA a doba přežití). V současné době je možné kryoterapii s užitím systému třetí generace považovat za léčbu první volby pro starší pacienty nebo pacienty s vyšším rizikem, kteří nejsou vhodnými kandidáty pro radikální prostatektomii, a rovněž pro pacienty, u nichž došlo k selhání radioterapie.
Nejnovější molekulární výzkumy prokázaly, že apoptóza funguje jako mechanizmus zodpovědný za buněčnou smrt v periferii kryogenních lézí, což podporuje teorii, že kombinace kryoterapie s další léčbou (tj. chemoterapií nebo radioterapií) může posílit účinnost kryoablace. V dalších studiích je třeba prozkoumat správné načasování a aplikaci cytotoxických preparátů, radioterapie a dalších agens (agens posilujících imunologickou reakci a apoptózu), které lze kombinovat s lokálním destrukčním účinkem kryoablace. V dalším vývoji je třeba se soustředit na snížení výskytu vedlejších komplikací, například minimalizaci kryopoškození neurovaskulárního svazku (procedura se zachováním nervového svazku), a rovněž na techniky fokální ablace při léčbě unifokálních a unilaterálních tumorů potvrzených na základě mnohočetné nebo saturační biopsie.
Thomas J. Polascik, M.D.
Associate Professor of Urology
Duke University Medical Center
Box 2804 Yellow Zone
Durham, NC 27710
polas001@mc.duke.edu
Zdroje
1. Fahmy WE, Bissada NK. Cryosurgery for prostate cancer. Arch Androl 2003; 49(5): 397–407.
2. Zisman A, Leibovici D, Siegel YI et al. Prostate cryoablation without an insertion kit using direct transperineal placement of ultrathin freezing probes. Tech Urol 2000; 6(1): 34–36.
3. Zisman A, Pantuck AJ, Cohen JK et al. Prostate cryoablation using direct transperineal placement of ultrathin probes through a 17-gauge brachytherapy template-technique and preliminary results. Urology 2001; 58(6): 988–993.
4. Cohen J. Cryosurgery of the prostate: techniques and indications. Rev Urol 2004; 6 (Suppl 4): 21–26.
5. Han KR, Cohen JK, Miller RJ et al. Treatment of organ confined prostate cancer with third generation cryosurgery: preliminary multicenter experience. J Urol 2003; 170 : 1126–1130.
6. Cooperberg MR, Shinohara K. Prostate cancer: Cryotherapy. 2005. http://www.emedicine.com/med/topic3539.htm.
7. Mouraviev V, Polascik TJ. Update on cryotherapy for prostate cancer in 2006. Curr Opin Urol 2006; 16(3): 152–156.
8. Hoffmann NE, Bischof JC. The cryobiology of cryosurgical injury. Urology 2002; 60 (2 Suppl 1): 40–49.
9. Bischof JC, Smith D, Pazhayannur PV et al. Cryosurgery of dunning AT-1 rat prostate tumor: thermal, biophysical, and viability response at the cellular and tissue level. Cryobiology 1997; 34(1): 42–69.
10. Hollister WR MA, Baust JG et al. The effects of freezing on cell viability and mechanisms of cell death in an vitro human prostate cancer cell line. Mol Urol 1998; 2 : 13-19.
11. Baust JG, Gage AA, Clarke D et al. Cryosurgery--a putative approach to molecular-based optimization. Cryobiology 2004; 48(2): 190–204.
12. Forest V, Peoc'h M, Ardiet C et al. In vivo cryochemotherapy of a human lung cancer model. Cryobiology 2005; 51(1): 92–101.
13. Forest V, Peoc'h M, Campos L et al. Effects of cryotherapy or chemotherapy on apoptosis in a non-small-cell lung cancer xenografted into SCID mice. Cryobiology 2005; 50(1): 29–37.
14. Ablin RJ, Soanes WA, Gonder MJ. Immuno-cryourogenital treatment of benign and malignant diseases of the prostate. Gerontol Clin (Basel) 1970; 12(5): 302–313.
15. Alblin RJ, Soanes WA, Gonder MJ. Prospects for cryo-immunotherapy in cases of metastasizing carcinoma of the prostate. Cryobiology 1971; 8(3): 271–279.
16. Soanes WA, Ablin RJ, Gonder MJ. Remission of metastatic lesions following cryosurgery in prostatic cancer: immunologic considerations. J Urol 1970; 104(1): 154–159.
17. Mouraviev V, Prochorov G, Ablin R. The combined cytoreductive cryoablation and immunochemotherapy for advanced prostate cancer. Abstracts of 5th World Congress on Advances in Oncology, Rhodes,Greece (October 15-18) (#116). Int.J.Mol.Med 2000; 6, (Suppl.1): 202.
18. Gursel E, Roberts M, Veenema RJ. Regression of prostatic cancer following sequential cryotherapy to the prostate. J Urol 1972; 108(6): 928–932.
19. Drylie DM, Hahn GS. Stimulation of prostatic antibodies by cryosurgery. J Urol 1973; 110(3): 324–325.
20. Hoffmann NE, Coad JE, Huot CS et al. Investigation of the mechanism and the effect of cryoimmunology in the Copenhagen rat. Cryobiology 2001; 42(1): 59–68.
21. Milleman LA, Weissman WD, Culp DA. Serum protein, enzyme and immunoglobulin responses following perineal cryosurgery for carcinoma of the prostate. J Urol 1980; 123(5): 710–711.
22. Hayakawa K, Yamashita T, Suzuki K et al. Comparative immunological studies in rats following cryosurgery and surgical excision of 3-methylcholanthrene-induced primary autochthonous tumors. Gann 1982; 73(3): 462–469.
23. Yamashita T, Hayakawa K, Hosokawa M et al. Enhanced tumor metastases in rats following cryosurgery of primary tumor. Gann 1982; 73(2): 222–228.
24. Ablin R. An appreciation and realization of the concept of cryoimmunology. In Onik G, Rubinsky B, Watson G et al (Eds), Percutaneous Prostate Cryoablation. St.Louis, Quality Medical Publishing, Inc 1995 : 136–154.
25. Chao BH, He X, Bischof JC. Pre-treatment inflammation induced by TNF-alpha augments cryosurgical injury on human prostate cancer. Cryobiology 2004; 49(1): 10–27.
26. den Brok MH, Sutmuller RP, Nierkens S et al. Synergy between in situ cryoablation and TLR stimulation results in a highly effective in vivo dendritic cell vaccine. Cancer Res 2006; 66(14): 7285–7292.
27. Baust JG, Gage AA. The molecular basis of cryosurgery. BJU Int 2005; 95(9): 1187–1191.
28. Shen D, Zeng J, Zhang W et al. Optimized prostate biopsy via a statistical atlas of cancer spatial distribution. Med Image Anal 2004. 8(2): 139–150.
29. Prepelica KL, Okeke Z, Murphy A et al. Cryosurgical ablation of the prostate: high risk patient outcomes. Cancer 2005; 103(8): 1625–1630.
30. Polascik TJ, Nosnik I, Mayes JM et al. Short-term cancer control after primary cryosurgical ablation for clinically localized prostate cancer using third-generation cryotechnology. Urology 2007; 70(1): 117–121.
31. D'Amico AV. Combined-modality staging for localized adenocarcinoma of the prostate. Oncology (Williston Park) 2001; 15 : 1049–1059; discussion 1060–1042, 1064–1045, 1069–1070,1073–1045.
32. Robinson JW, Donnelly BJ, Saliken JC et al. Quality of life and sexuality of men with prostate cancer 3 years after cryosurgery. Urology 2002; 60 (2 Suppl 1): 12–18.
33. Mouraviev V, Nosnik I, Sun L et al. Financial comparative analysis of minimally invasive surgery to open surgery for localized prostate cancer: a single-institution experience. Urology 2007; 69(2): 311–314.
34. Anastasiadis AG, Sachdev R, Salomon L et al. Comparison of health-related quality of life and prostate-associated symptoms after primary and salvage cryotherapy for prostate cancer. J Cancer Res Clin Oncol 2003; 129(12): 676–682.
35. Ball AJ, Gambill B, Fabrizio MD et al. Prospective longitudinal comparative study of early health-related quality-of-life outcomes in patients undergoing surgical treatment for localized prostate cancer: a short-term evaluation of five approaches from a single institution. J Endourol 2006; 20(10): 723–731.
36. Huang WC, Kuroiwa K et al. The anatomical and pathological characteristics of irradiated prostate cancers may influence the oncologic efficacy of salvage therapies. J Urol. 2006; 175 (Suppl): 312.
37. Gould RS. Total cryosurgery of the prostate versus standard cryosurgery versus radical prostatectomy: comparison of early results and the role of transurethral resection in cryosurgery. J Urol 1999; 162(5): 1653–1657.
38. Onik G, Narayan P, Vaughan D et al. Focal "nerve-sparing" cryosurgery for treatment of primary prostate cancer: a new approach to preserving potency. Urology 2002; 60(1): 109–114.
39. Janzen NK, Han KR, Perry KT et al. Feasibility of nerve-sparing prostate cryosurgery: applications and limitations in a canine model. J Endourol 2005; 19(4): 520–525.
40. Mouraviev V, Mayes JM, Sun L et al. Prostate cancer laterality as a rationale of focal ablative therapy for the treatment of clinically localized prostate cancer. Cancer 2007; 110(4): 906–910.
41. Cheng L, Jones TD, Pan CX et al. Anatomic distribution and pathologic characterization of small-volume prostate cancer (<0.5 ml) in whole-mount prostatectomy specimens. Mod Pathol 2005; 18(8): 1022–1026.
42. Ohon M EJ, Koh H,Kuroiwa K,Slawin K,Wheeler TM, Scardino PT. Is focal therapy reasonable in patients with early stage prostate cancer (CAP) - an amalysis of radical prostatectomy (RP) specimens. J Urol 2006;175 (Suppl) 507 (Abstract#1574).
43. Barzell WE CR, Melamed MR. The utility of transperineal 3-Dimensional pathological mapping in counseling patients seeking expectant management for low volume prostate cancer. Seventh Annual SUO meeting to discuss current tipiocs and strategies in urologc oncology. Extraodinary opportunities for discovery.Abstract book 2006 : 91.
44. Rukstalis DB, Goldknopf JL, Crowley EM et al. Prostate cryoablation: a scientific rationale for future modifications. Urology 2002; 60 (2 Suppl 1): 19–25.
45. Lambert EH, Bolte K, Masson P et al. Focal cryosurgery: encouraging health outcomes for unifocal prostate cancer. Urology 2007; 69(6): 1117–1120.
46. Bahn DK, Silverman P, Lee F Sr et al. Focal prostate cryoablation: initial results show cancer control and potency preservation. J Endourol 2006; 20(9): 688–692.
47. Onik G. Rationale for a "Male Lumpectomy," a Prostate Cancer Targeted Approach Using Cryoablation: Results in 21 Patients with at Least 2 Years of Follow-Up. Cardiovasc Intervent Radiol 2007; 31(1): 98–106.
48. Cresswell J, Asterling S, Chaudhary M et al. Third-generation cryotherapy for prostate cancer in the UK: a prospective study of the early outcomes in primary and recurrent disease. BJU Int 2006; 97 : 969–974.
Štítky
Detská urológia Urológia
Článek Úvodní slovo
Článok vyšiel v časopiseUrologické listy
Najčítanejšie tento týždeň
2009 Číslo 4- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Srovnání peroperačního průběhu, časných komplikací a funkčních výsledků robotické a otevřené radikální prostatektomie
- Operační anatomie prostaty a pánevního dna pro účely provádění radikální prostatektomie a radikální cystektomie: nejdůležitější body pro dosažení onkologické bezpečnosti, kontroly močové kontinence a erektilní funkce
- Kryochirurgická operace lokalizovaného karcinomu prostaty v počátečním stadiu: přechod od léčby celé prostatické žlázy k fokální kryoablaci
- Možnosti léčby kostního postižení u karcinomu prostaty
- Nové horizonty v léčbě kostního postižení souvisejícího s androgenní deprivací při léčbě karcinomu prostaty
- Roboticky asistované a laparoskopické urologické operační výkony ve Spojených Státech: současný stav
- Vývoj a implementace laparoskopické simulace na zvířecím modelu v rámci urologických tréninkových programů
- Úvodní slovo
- Jak lépe pracovat s odbornou literaturou
- Roboticky asistovaná laparoskopická prostatektomie: kritické hodnocení výsledků
- Technika se zachováním cév při operaci striktury v proximální anteriorní části močové trubice: primární anastomóza a augmentovaná anastomóza
- Léčba hyperaktivního měchýře u žen
- GUIDELINES EAU PRO BENIGNÍ HYPERPLAZII PROSTATY (2. část)
- Urologické listy
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Srovnání peroperačního průběhu, časných komplikací a funkčních výsledků robotické a otevřené radikální prostatektomie
- Operační anatomie prostaty a pánevního dna pro účely provádění radikální prostatektomie a radikální cystektomie: nejdůležitější body pro dosažení onkologické bezpečnosti, kontroly močové kontinence a erektilní funkce
- Roboticky asistovaná laparoskopická prostatektomie: kritické hodnocení výsledků
- Kryochirurgická operace lokalizovaného karcinomu prostaty v počátečním stadiu: přechod od léčby celé prostatické žlázy k fokální kryoablaci
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



