-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Léčba nádorů, které neprorůstají do svaloviny: transuretrální resekce, nové postupy
Treatment of muscle non-invasive tumours: transurethral resection, novel approaches
Approximately 75–85% of bladder cancer patients present with disease confined to mucosa, which is also labeled as a non-invasive or superficial cancer, more precisely as muscle non-invasive cancer. The curve indicating mortality on bladder cancer in Czech Republic has been increasing pretty slowly during the last two decades, which indicates improvement of diagnostic procedures and detection of the cancer in its early stage. Transurethral resection of bladder cancer (TURB) plays a key role in the management of patients suffering from muscle non-invasive bladder cancer. This method also influences the further development. Use of modern technologies enabling better visualization of occult tumor changes during cystoscopy and TURB is the path to follow to further improve oncologic results and prognosis [1,2].
Key words:
superficial urothelial bladder cancer, transurethral tumor resection, optical coherence tomography, narrow-band imaging, fluorescence cystoscopy, Raman spectroscopy
Autoři: G. Varga
Působiště autorů: Urologická klinika FN Brno LF MU Brno
Vyšlo v časopise: Urol List 2012; 10(2): 46-49
Souhrn
Přibližně 75–85 % pacientů s karcinomem měchýře má onemocnění ohraničené na mukózu, kdy hovoříme o neinvazivním neboli superficiálním karcinomu, přesněji však o karcinomu neinfiltrujícím svalovinu. Křivka mortality karcinomu měchýře v ČR ve srovnání se vzestupem křivky incidence za posledních 20 let roste poměrně pomalu, což naznačuje zlepšení diagnostických postupů se záchytem onemocnění v jeho časné fázi. Transuretrální resekce nádoru močového měchýře (TURB) je metodou, která sehrává zásadní roli v péči o pacienty s karcinomem neinfiltrujícím svalovinu močového měchýře. Rozhoduje o jejich dalším osudu. Aplikace nových technologií s cílem zlepšit vizualizací i okultních nádorových změn v průběhu cystoskopie a TURB je právě cestou, jak dále zlepšovat onkologické výsledky a prognózu pacienta [1,2].
Klíčová slova:
superficiální uroteliální karcinom močového měchýře, transureterální resekce nádoru, optická koherentní tomografie, narrow-band imaging, fluorescenční cystoskopie, Ramanová spektroskopieTRANSURETRÁLNÍ RESEKCE NÁDORŮ MOČOVÉHO MĚCHÝŘE
Iniciálním krokem, který rozhoduje o dalším osudu pacienta s TCC močového měchýře, je transuretrální resekce nádoru močového měchýře (TURB). TURB má v procesu diagnostiky a léčby zásadní roli. EAU Guidelines doporučují TURB jako zlatý standard pro stanovení iniciální diagnózy a pro léčbu karcinomu močového měchýře neinfiltrujícího svalovinu (NMIBC) [3,4]. I přesto, že TURB je často prováděným výkonem, nejedná se o lehkou operaci. Cílem procedury je potvrdit histologickou diagnózu, určit staging a grading onemocnění a dosáhnout kompletní odstranění exofytického tumoru. I přesto, že desetileté specifické prožívaní po TURB pro karcinom Ta je 85 % a pro stadium T1 se udává 70 % [5], jsou výsledky TURB limitovány vysokým procentem recidivy a rizikem podhodnocení nádorového stagingu [2]. Úspěch léčby závisí nejen na biologické povaze nádoru, terapeutické strategii a včasnosti zahájení léčby, ale také na kvalitě provedené TURB.
O technických aspektech tohoto frekventně prováděného výkonu referoval Babjuk v suplementech Evropské urologie a referovali jsme o něm i v Urologických listech [2,6]. V dalších odstavcích se proto budeme věnovat metodám, kterými lze zlepšit výsledky TURB.
MOŽNOSTI ZLEPŠENÍ VÝSLEDKŮ TURB
Obecně lze říci, že nejlepších výsledků lze dosáhnout, pokud výkon provádí zkušený urolog, což potvrdily i výsledky studie EORTC, která konstatovala, že za kvalitu a výsledek TURB nejvíce zodpovídá operatér [7]. Je také důležité používat při výkonu moderní zařízení zahrnující i uzavřený televizní řetězec, který jednak výkon usnadňuje a hlavně poskytuje možnost pro výuku rezidentů v oboru urologie. Během výkonu, který provádí rezident, je samozřejmostí přítomnost zkušeného urologa. Z hlediska erudice jsou důležité pravidelné výukové semináře. Bylo prokázáno, že cíleným výukovým programem lékařů v atestační přípravě lze dosáhnout redukce výskytu recidivy v tříměsíčním intervalu u pacientů operovaných rezidentem z 28 na 16 % a lze zvýšit i přítomnost svaloviny detruzoru v resekátu z 50 na 88 % [8]. Výsledky TURB dále evidentně zlepšuje pooperační instilace chemoterapeutika (single-shot) a reTURB podle indikačních kritérií uvedených v doporučeních EAU [3].
APLIKACE NOVÝCH TECHNOLOGIÍ DO DIAGNOSTIKY A LÉČBY KARCINOMU MOČOVÉHO MĚCHÝŘE
I přesto, že některé z faktorů, jako je velikost nádoru, počet, genetická charakteristika nádoru, které ovlivňují riziko recidivy, jsou neměnné, existuje jeden faktor, který může významně redukovat nádorovou rekurenci – kompletní resekce původní léze/í. To, co se na první pohled jeví jako nádorová recidiva, může být ve finále reziduální nádor, který byl přehlédnut během resekce [7]. Cystoskopie (CSK) zůstává i nadále zlatým standardem pro stanovení primární diagnózy karcinomu močového měchýře, a proto i vývoj nových technologií se ubírá cestou zlepšení vizualizace kavity měchýře pomocí CSK, která může odhalit okultní změny sliznice, a zlepšit tak i finální výsledek resekce. I přes dosažené pokroky má však CSK s tzv. bílým světelným zdrojem své limitace. Ploché léze, jako je CIS, mohou být sotva patrné, a tím pádem mohou být přehlédnuty až v 50 % [9]. Přehléd-nutí těchto lézí může zásadním způso-bem negativně zasáhnout do prognózy onemocnění.
Další limitaci použití konvenční CSK lze vysledovat v průběhu samotné resekce, kdy se pozoruje ponechání reziduálního tumoru a podhodnocení nádorového stagingu v případě T1 GIII tumorů. Několik studií zkoumalo výsledky časné reTURB krátce po iniciální diagnóze nádorů T1 a demonstrovalo 43–62% přítomnost reziduálního nádoru [10,11]. Byl vysloven předpoklad, že signifikantní riziko recidivy je spojeno právě s ponecháním málo viditelných reziduálních nádorů přehlédnutých v průběhu TURB [7]. Mezi metody, které zlepšují nebo mohou zlepšit vizualizaci těchto okultních změn v průběhu konvenční CSK, patří:
- fluorescenční cystoskopie
- optická koherentní tomografie
- narrow-band imaging
- Ramanová spektroskopie
FLUORESCENČNÍ CYSTOSKOPIE (FCSK)
Fotodynamická diagnostika (PDD) umožňuje zvýšit detekci maligní tkáně pomocí fluorescence. Tato technologie může vést k detekci uroteliálních lézí, jako jsou CIS a malé papilární karcinomy, které nejsou normálně zřetelné v konvenčním CSK obrazu. Včasná detekce a léčba těchto lézí může snížit riziko recidivy a zlepšit onkologický výsledek. Princip fluorescence vyžaduje přítomnost fotosenzitivní substance nebo fluoroforu a vhodné elektromagnetické stimulace. Fluorofor je molekula, která absorbuje fotony určité vlnové délky a následně emituje fotony s nižší energií a delší vlnovou délkou [12].
Kyselina 5-ALA (aminolevulová) je derivátem porfyrinu, která je nejvíce prostudovanou a využívanou substancí pro PDD. Exogenním přísunem ALA se indukuje akumulace protoporfyrinu IX v rychle se dělících buňkách, jako jsou nádorové buňky. Následná expozice těchto buněk modrým světlem (380–480 nm) vede k identifikaci karcinomových a prekancerogenních lézí [13]. HAL (hexylester aminolevulové kyseliny) je esterový derivát ALA s vyšší lipofilní vlastností a vyšší tkáňovou solubilitou.
Hungerhuber et al s využitím PDD zjistili v souboru 875 pacientů až 23,7 % pozitivních biopsií u pacientů, kteří měli negativní nález v průběhu konvenční CSK. Dále zjistili 92% senzitivitu pro fluorescenční CSK a 76% pro konvenční CSK [14]. I přesto má fluorescenční CSK své slabiny. Jak ALA, tak HAL mají limitovanou tkáňovou penetraci, což omezuje hodnocení více invazivních lézí. Dalším limitujícím faktorem je doba trvání fluorescence (tzv. photobleaching), která je přibližně 30 min, a tedy koresponduje i s dobou vyšetřování nebo intervence [15]. Další slabinou je i falešná pozitivita, která je ve srovnání s konvenční CSK mírně vyšší (39 % s HAL vs 31 % s CSK) [16]. Zánět, intravezikální terapie a hyperplazie se ukázaly jako nejčastější příčina falešné pozitivity PDD [17].
Ve snaze zlepšit fluorescenční CSK se objevila i snaha prozkoumat intravezikální použití dalšího fluoroforu – hypericinu. Jedná se o rostlinný produkt z třezalky tečkované s nízkou náchylností k photobleaching nebo odbarvení lézí a lepší specificitou. Instrumentárium se neliší od fCSK. Byla prezentována 94% senzitivita pro detekci CIS a 95% specificita, která byla vyšší než u ALA a HAL. Jako excelentní vlastnost hypericinu se ukázala také dobrá tolerabilita a fluorescence trvající až 16 hod [18].
OPTICKÁ KOHERENTNÍ TOMOGRAFIE (OKT)
OKT je nová technologie, která poskytuje průřezové zobrazení biologické tkáně v reálném čase a ve vysokém rozlišení. Na rozdíl od ostatních optických metod používá OKT infračervené záření, které je schopno pronikat výrazně hlouběji (1–3 mm) a které má vyšší rozlišovací schopnost. Na jeho základě může počítač rekonstruovat mikroarchitekturu tkáně ve dvou nebo třech rozměrech v rozlišení 10–20 um, a to vše díky reflexi infračerveného záření [19]. Fyzikální princip OKT je analogický s ultrazvukem s tím rozdílem, že OKT nepoužívá pro snímání biologických tkání akustické vlny, ale záření blízké infračervenému spektru (~ 1 mikron). Ve srovnání s vysokofrekvenčním ultrazvukem dokáže OKT rozlišit struktury 10–25× menší [20]. OKT byla vyvinuta pro využití v diagnostice retinálních nádorů, gastrointestinální patologie, cervikální dysplazie a kožních nemocí [21]. Její využití v detekci patologie močového měchýře a v podmínkách in vivo prezentoval Zagyanova. Metoda OKT umožňuje vyšetřování v reálném čase s využitím standardního CSK instrumentária. Je schopná poskytnout unikátní informace o mikrostruktuře tkáně do hloubky 1–3 mm, rozlišit mezi maligní a benigní tkání, což může zlepšit staging TCC [21].
Manyak prezentoval 100% senzitivitu a 89% specificitu pro klasifikaci lézí jako benigní a maligní u 24 pacientů [22]. V souboru 32 pacientů Goh dosáhl 100% senzitivitu, 90% specificitu se 100% negativní prediktivní hodnotou pro detekci nádorové invaze do svaloviny [23].
NARROW-BAND IMAGING (NBI)
Metoda, která by se dala do češtiny volně přeložit jako úzkospektrální analýza, se pomocí cystoskopie pokouší zlepšit kontrast mezi abnormální (patologickou) a normální sliznicí měchýře pomocí restrikce světelného optického spektra použitého v průběhu CSK. Zúžení světelného spektra se dosahuje filtry, které povolují transmisi světla s vlnovou délkou 415–540 nm [24]. Hemoglobin preferenčně absorbuje tuto vlnovou délku, a zvyšuje se tak viditelnost kapilár a submukózních krevních cév. Modré světelné spektrum zvyšuje viditelnost povrchové kapilární sítě, zatímco zelené spektrum viditelnost hlouběji uložených kapilár (obr. 1,2). NBI se osvědčila při identifikaci metaplastických lézí a prekanceróz žaludku a jícnu, jakož i při zvýšení detekce maligních nádorů v průběhu kolonoskopie [25]. Výhodou této metody je to, že není potřeba další fotosenzitizující substance. Protože hypervaskularita je nespecifickým nálezem, budou potřebné multicentrické kontrolované studie k potvrzení role NBI v diagnostice prekanceróz a maligních lézí měchýře [12].
Obr. 1. Obraz tumoru v konvenčním CSK obrazu vlevo a v NBI obrazu vpravo. 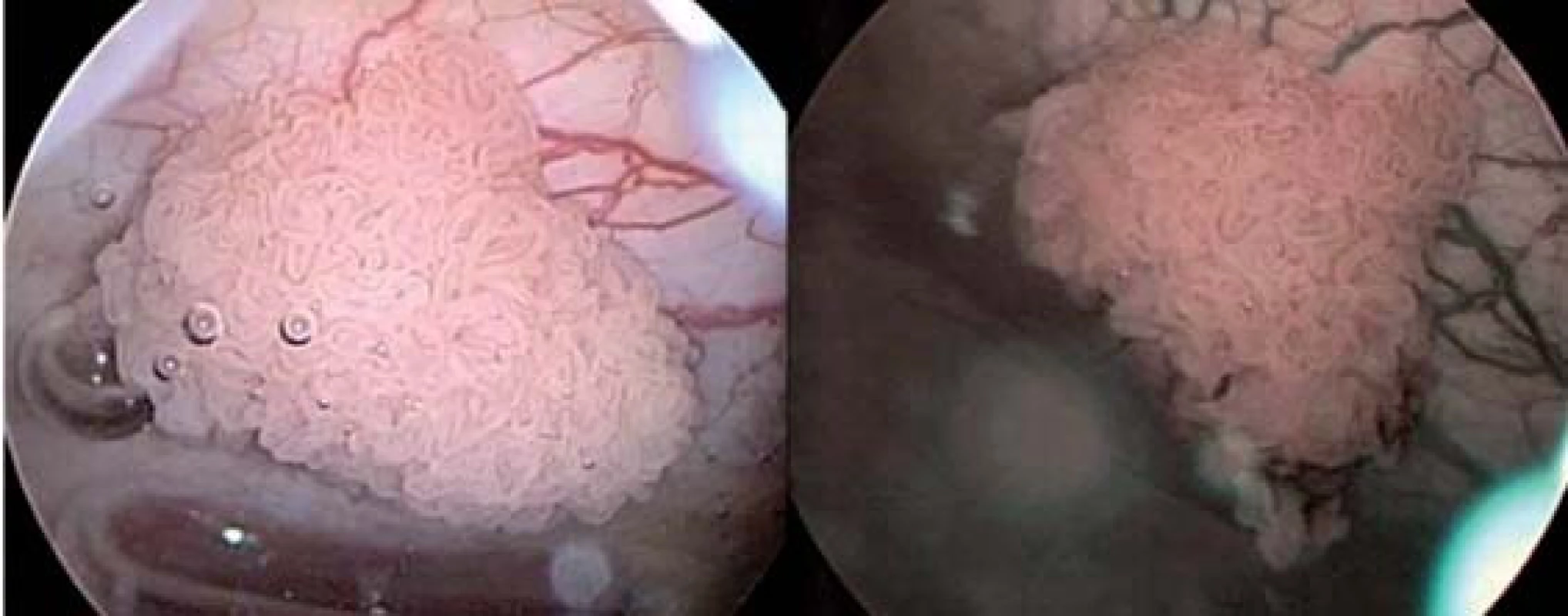
Zdroj: http://www.europeanurology.com/uploads/eur_articles/S0302-2838(09)00222-X/assets/gr8.jpg. Obr. 2. Povrchové kapiláry se v NBI obraze znázorňují hnědě zatímco podslizniční vény cyanoticky. 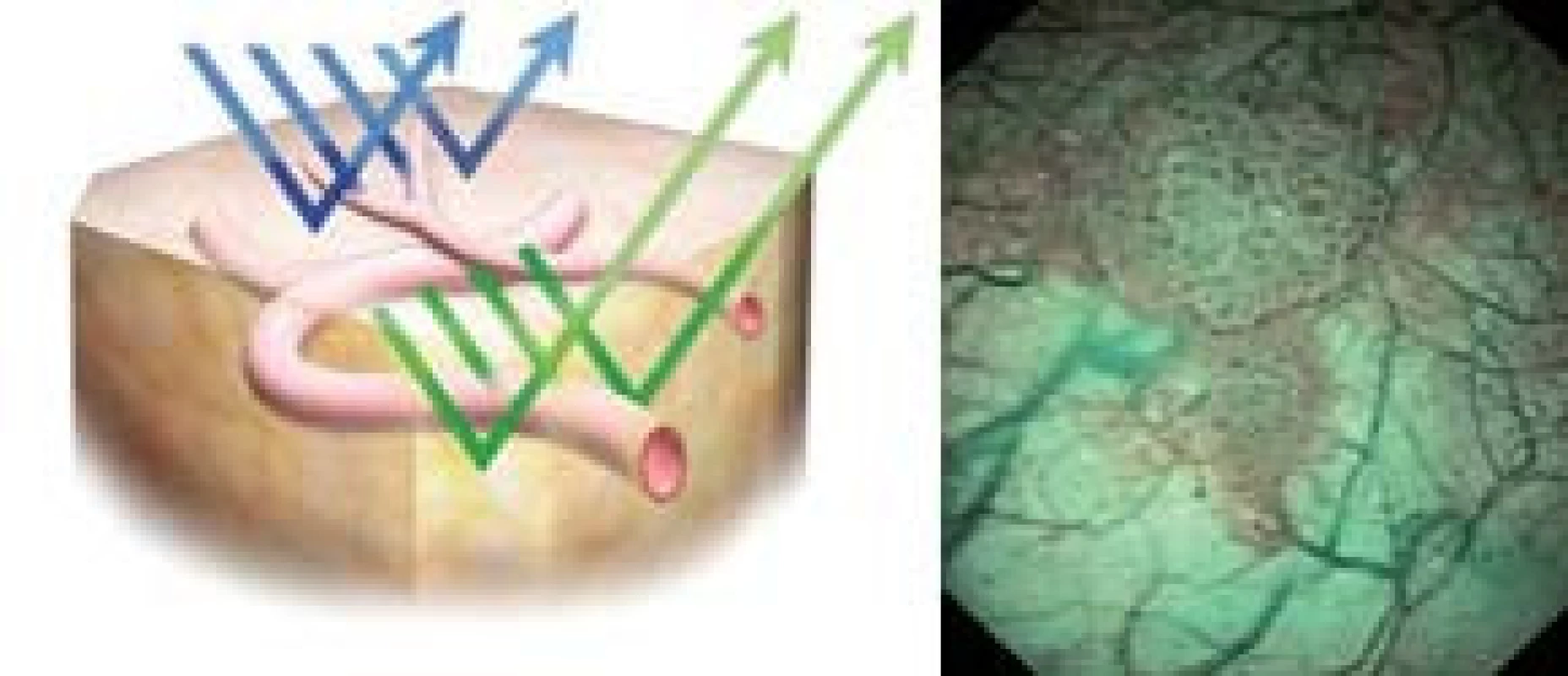
VIRTUÁLNÍ CYSTOSKOPIE (VCSK)
Metoda vznikla s cílem detekce patologie močového měchýře méně invazivním způsobem. Využívá 3D rekonstrukci kavity měchýře pomocí CT a vzduchového kontrastu. I přes pokroky v multiplanární rekonstrukci má tato metoda své nedostatky. Nedokáže detekovat ploché léze, které nezpůsobují ztluštění stěny měchýře, speciálně detekce CIS představuje nadále výzvu pro tuto metodu. Abnormality detekované touto metodou jsou pouze morfologické a poskytují minimální informace o jejich biologické povaze. Další nevýhodou je nemožnost provedení současné biopsie nebo resekce, které při konvenční CSK nejsou problémem. A konečně také expozice radiací je dalším nemalým problémem [12,26]. Lze tedy rekapitulovat, že v případě podezření na maligní onemocnění měchýře je prozatím využití v CSK minimální a nenahrazuje konveční CSK.
RAMANOVÁ SPEKTROSKOPIE (RS)
RS umožňuje měření tkáňových molekulárních komponentů jak kvalitativně, tak kvantitativně. Princip této optické techniky je založený na Ramanovém efektu neelastického rozptylu. Světelný paprsek (foton) ovlivňuje molekuly tkáně, čímž je uvádí do stavu s vyšší energetickou hladinou. Po návratu excitovaných molekul do základního stavu dochází k emisi fotonů s odlišnou vlnovou délkou než původní elektromagnetické záření. Každá molekula má přitom jedinečnou oscilační energetickou hladinu, které odpovídá i korespondující vlnová délka emitujícího záření (světla). Všechny změněné vlnové délky z různých molekul vyšetřované tkáně se pomocí speciálního detektoru slučují do formy tzv. Ramanového spektra, které je funkcí molekulární kompozice vyšetřované tkáně. Spektrum se mění v případě patologické změny tkáně, a tím RS poskytuje objektivní predikci patologické diagnózy [27].
ZÁVĚR
Integrace těchto doplňkových metod vyžaduje další výzkum, aby na základě důkazů byl dosažen jejich maximální klinický benefit pro využití v klinické praxi.
MUDr. Gabriel Varga, FEBU
Urologická klinika FN Brno LF MU Brno
Jihlavská 20, 625 00 Brno
gabrielvarga@hotmail.com
Zdroje
1. http://www.svod.cz/analysez
2. Babjuk M. Transurethral Resection of Non–muscle-invasive Bladder Cancer. Eur Urol Suppl 2009; 8 : 542–548.
3. Babjuk M, Oosterlinck W, Sylvester R et al. EAU guidelines on non-muscle-invasive urothelial carcinoma of the bladder. Eur Urol 2008; 54(2): 303–314.
4. Nieder AM, Brausi M, Lamm D et al. Management of stage T1 tumours of the bladder: international consensus panel. Urology 2005; 66 (Suppl 1): 108–125.
5. Herr HW. High-risk superficial bladder cancer: transurethral resection alone in selected patients with T1 tumour. Semin Urol Oncol 1997; 15(3):142–146.
6. Varga G. Možnosti a místo chirurgické léčby superficiálního karcinomu močového měchýře. Urol List 2011; 9(3): 16–21.
7. Brausi M, Collette L, Kurth K et al. EORTC Genito-Urinary Tract Cancer Collaborative Group. Variability in the recurrence rate at first follow-up cystoscopy after TUR in stage Ta T1 transitional cell carcinoma of the bladder: a combined analysis of seven EORTC studies. Eur Urol 2002; 41(5): 523–531.
8. Brausi MA, Gavioli M, Peracchia G et al. Dedicated teaching programs can improve the quality of TUR of non-muscle-invasive bladder tumors (NMIBT): experience of a single institution. Eur Urol Suppl 2008; 7 : 180.
9. Soloway MS, Murphy W, Rao MK et al. Serial multiplesite biopsies in patients with bladder cancer. J Urol 1978; 120(1): 57–65.
10. Schwaibold HE, Sivalingam S, May F et al. The value of a second transurethral resection for T1 bladder cancer. BJU Int 2006; 97(6): 1199–1201.
11. Brauers A, Buettner R, Jakse G. Second resection and prognosis of primary high risk superficial bladder cancer: is cystectomy often too early? J Urol 2001; 165(3): 808–810.
12. Goh AC, Lerner SP. Application of new technology in bladder cancer diagnosis and treatment. World J Urol 2009; 27(3): 301–307.
13. Batlle AM. Porphyrins, porphyrias, cancer and photodynamic therapy – a model for carcinogenesis. J Photochem Photobiol B 1993; 20(1): 5–22.
14. Hungerhuber E, Stepp H, Kriegmair M et al. Seven years’ experience with 5-aminolevulinic acid in detection of transitional cell carcinoma of the bladder. Urology 2007; 69(2): 260–264.
15. Steinbach P, Weingandt H, Baumgartner R et al. Cellular Xuorescence of the endogenous photosensitizer protoporphyrin IX following exposure to 5-aminolevulinic acid. Photochem Photobiol 1995; 62(5): 887–895.
16. Grossman HB, Gomella L, Fradet Y et al. A phase III, multicenter comparison of hexaminolevulinate fluorescence cystoscopy and white light cystoscopy for the detection of superficial papillary lesions in patients with bladder cancer. J Urol 2007; 178(1): 62–67.
17. Zaak D, Karl A, Knuchel R et al. Diagnosis of urothelial carcinoma of the bladder using fluorescence endoscopy. BJU Int 2005; 96(2): 217–222.
18. D’Hallewin MA, Kamuhabwa AR, Roskams T et al. Hypericin-based fluorescence diagnosis of bladder carcinoma. BJU Int 2002; 89(7): 760–763.
19. Pan Y, Xie H, Fedder GK. Endoscopic optical coherence tomography based on a microelectromechanical mirror. Opt Lett 2001; 26(24): 1966–1968.
20. Fujimoto JG, Pitris C, Boppart SA et al. Optical coherence tomography: an emerging technology for biomedical imaging and optical biopsy. Neoplasia 2000; 2(1–2): 9–25.
21. Zagaynova EV, Shirmanova MV, Kirillin MY et al. Contrasting properties of gold nanoparticles for optical coherence tomography: phantom, in vivo studies and Monte Carlo simulation. Phys Med Biol 2008; 53(18): 4995–5009.
22. Manyak MJ, Gladkova ND, Makari JH et al. Evaluation of superficial bladder transitional-cell carcinoma by optical coherence tomography. J Endourol 2005; 19(5): 570–574.
23. Goh AC, Tresser NJ, Shen SS et al. Optical koherence tomography as an adjunct to white light cystoscopy for intravesical real-time imaging and staging of bladder cancer. Urology 2008; 72(1): 133–137.
24. Gono K, Obi T, Yamaguchi M et al. Appearance of enhanced tissue features in narrow-band endoscopic imaging. J Biomed Opt 2004; 9(3): 568–577.
25. Machida H, Sano Y, Hamamoto Y et al. Narrow-band imaging in the diagnosis of colorectal mucosal lesions: a pilot study. Endoscopy 2004; 36(12): 1094–1098.
26. Tsili A, Tsampoulas C, Chatziparaskevas N et al. Computed tomographic virtual cystoscopy for the detection of urinary bladder neoplasms. Eur Urol 2004; 46(5): 579–585.
27. De Jong BW, Bakker Schut TC, Wolffenbuttel KP et al. Identification of bladder wall layers by Raman spectroscopy. J Urol 2002; 168 (4 Pt 2): 1771–1778.
Štítky
Detská urológia Urológia
Článek Denosumab rozšiřuje možnosti farmakoterapie kostního postižení pacientů s karcinomem prostatyČlánek Technické triky a tipy pro retroperitoneální laparoendoskopickou nefrektomii jedním portem (LESS)Článek Zobrazovací metody, jejich přínos pro zjištění rozsahu onemocnění karcinomem močového měchýřeČlánek Kongres Americké urologické asociace z trochu jiného pohledu aneb jak chutná vlastní medicínaČlánek Karcinom ledvinyČlánek Karcinom močového měchýře
Článok vyšiel v časopiseUrologické listy
Najčítanejšie tento týždeň
2012 Číslo 2- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Denosumab rozšiřuje možnosti farmakoterapie kostního postižení pacientů s karcinomem prostaty
- Nejnovější informace v oblasti terapeutických cílů a preparátů pro léčbu karcinomu prostaty rezistentního na kastrační léčbu
- Etiologie a diagnostika nádorů horních močových cest
- Ureteroskopická biopsie tumorů horních cest močových: endoskopické a cytologické techniky
- Technické triky a tipy pro retroperitoneální laparoendoskopickou nefrektomii jedním portem (LESS)
- Chemoterapie karcinomů horních cest močových
- Léčba generalizovaných nádorů ledvin: systémová imunoterapie, paliativní léčba
- Zobrazovací metody, jejich přínos pro zjištění rozsahu onemocnění karcinomem močového měchýře
- Léčba nádorů, které neprorůstají do svaloviny: transuretrální resekce, nové postupy
- Chemoterapie a radioterapie u nádorů močového měchýře
- Léčba metastatických nádorů močového měchýře, systémová chemoterapie, symptomatická léčba
- Antimuskarinika a lékové interakce
- Kongres Americké urologické asociace z trochu jiného pohledu aneb jak chutná vlastní medicína
- Extrakt ze Serenoa repens při léčbě benigní hyperplazie prostaty
- Karcinom ledviny
- Karcinom močového měchýře
- EAU Guidelines pro vazektomii
- Urologické listy
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Antimuskarinika a lékové interakce
- Zobrazovací metody, jejich přínos pro zjištění rozsahu onemocnění karcinomem močového měchýře
- Chemoterapie a radioterapie u nádorů močového měchýře
- Karcinom močového měchýře
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



