-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Guidelines EAU pro léčbu mužské infertility
7. Hypogonadizmus
Autori: A. Jungwirth; T. Diemer; G. R. Dohle; A. Giwercman; Z. Kopa; C. Krausz; H. Tournaye
Vyšlo v časopise: Urol List 2012; 10(4): 65-67
Kategória: Guidelines
© European Association of Urology 2012
6. Varikokéla
7. Hypogonadizmus
7.1 Úvod
Pro hypogonadizmus je charakteristická porucha testikulární funkce, jež může mít vliv na spermatogenezi a/nebo syntézu testosteronu. Symptomy hypogonadizmu závisejí na stupni androgenní nedostatečnosti a na tom, zda onemocnění vzniklo před rozvinutím sekundárních pohlavních znaků v pubertě, nebo po něm. Symptomy a známky hypogonadizmu projevující se před završením puberty a po něm jsou uvedeny v tab. 10.
Tab. 1. Symptomy a znaky hypogonadizmu projevující se před završením puberty a po něm.* 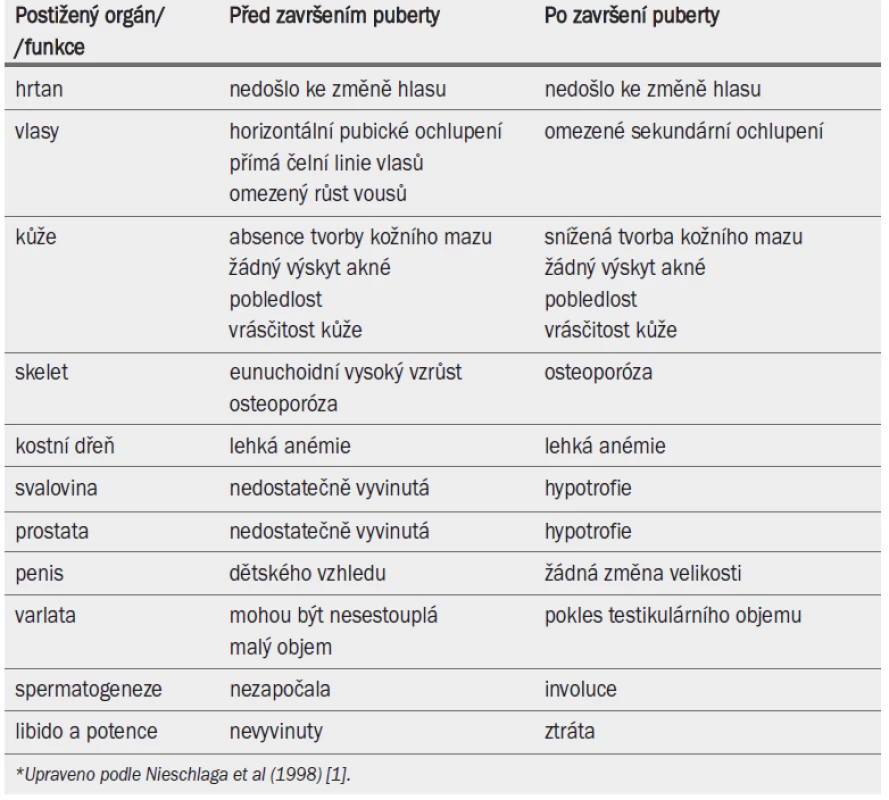
Etiologické a patogenní mechanizmy mužského hypogonadizmu lze rozdělit do tří hlavních kategorií:
- primární (hypergonadotropní) hypogonadizmus způsobený testikulárním selháním
- sekundární (hypogonadotropní) hypogonadizmus způsobený nedostačeným uvolňováním hormonu uvolňujícího gonadotropin (GnRH) a/nebo nedostatečná sekrece gonadotropních hormonů (FSH, LH)
- androgenní insenzitivita (rezistence v cílovém orgánu)
Nejčastější onemocnění spadající do těchto tří kategorií jsou uvedena v tab. 11 (viz rovněž kap. 4 Genetické poruchy u infertilních mužů).
Tab. 2. Poruchy související s mužským hypogonadizmem. 
7.2 Hypogonadotropní hypogonadizmus: příčina, diagnostika a terapie
Idiopatický hypogonadotropní hypogonadizmus (IHH) je definován nízkou hladinou gonadotropinů a pohlavních steroidů při současné absenci funkčních abnormalit hypotalamo-hypofyzárně-gonadální osy [2]. Idiopatický HH se může vyskytovat jako samostatné onemocnění nebo v kombinaci s anosmií/hyposmií (Kallmannův syndrom). Genetické faktory, které mají na svědomí deficit gonadotropinů, mohou působit na úrovni hypotalamu nebo hypofýzy.
Mutace kandidátních genů (vázané na chromozom X nebo autozomální) jsou přítomny přibližně ve 30 % případů vrozeného HH [2] a před tím, než přistoupíme k asistované reprodukci, se doporučuje provést jejich screening [3].
Příčinou získané formy hypogonadotropního hypogonadizmu může být užívání některých farmak, hormonů a anabolických steroidů a rovněž tumory. V případě podezření na přítomnost tumoru je nutné provést zobrazovací vyšetření (CT nebo MR) v okolí tureckého sedla a kompletní endokrinologické vyšetření.
Poruchu hormonální regulace lze snadno odhalit [4]. Porucha endokrinní funkce vede v důsledku poklesu sekrece FSH a LH k nedostatečné spermatogenezi a sekreci testosteronu. Po vyloučení sekundárních forem onemocnění (způsobených léky, hormony a tumory) závisí volba léčby na skutečnosti, zda je cílem terapie dosáhnout normální hladiny androgenů nebo fertilita.
Normální hladiny androgenů a následného vývoje sekundárních pohlavních znaků (v případě manifestace hypogonadizmu před pubertou) a eugonadálního stavu lze dosáhnout jen pomocí substituce androgenů. Ke stimulaci tvorby spermií je však nutná léčba lidským choriovým gonadotropinem (hCG) v kombinaci s rekombinantním FSH nebo močovým FSH nebo lidskými menopauzálními gonadotropiny (HMG). Ve vzácných případech „fertilních eunuchů“ s dostatečnou produkcí FSH, ale nedostatkem LH, může samotná léčba pomocí hCG umožnit dostatečnou stimulaci tvorby spermií a dosažení normální hladiny testosteronu [5]. Pokud má hypogonadotropní hypogonadizmus původ v hypotalamu, je alternativou k léčbě pomocí hCG pulzní aplikace gonadotropin uvolňujícího hormonu (GnRH) [6]. U pacientů, u nichž se hypogonadizmus projevil před pubertou a nebyl léčen gonadotropiny ani GnRH, může být pro dosažení tvorby spermií nezbytná 1–2 roky trvající terapie. Jakmile partnerka otěhotní, pacienti se mohou vrátit k substituci testosteronem.
7.3 Hypergonadotropní hypogonadizmus: příčina, diagnostika a terapie
Řada onemocnění souvisí s hypogonadotropním hypogonadizmem (tab. 11, viz také kap. 4 Genetické poruchy u infertilních mužů). Většina onemocnění uvedených v tab. 11 ovlivňuje reprodukční funkci varlete, takže dochází pouze ke zvýšení hladiny FSH. Bylo však prokázáno, že infertilní muži mají vyšší riziko poruchy funkce Leydigových buněk [7] a muži s Klinefelterovým syndromem mají často vysoké hodnoty LH a v průběhu stárnutí se u nich vyvine hypoandrogenizmus [8]. Dále byl zaznamenán pokles koncentrace testosteronu v krvi po rozsáhlé testikulární biopsii prováděné z důvodu TESE/ICSI, což vyvolává otázku o nutnosti dlouhodobého endokrinního sledování u těchto pacientů [9].
Po léčbě GnRH analogy nebo po chirurgické kastraci u pacientů s karcinomem prostaty dochází ke vzniku hypogonadizmu, který má dopad na reprodukční i endokrinní funkci varlete [10].
Při laboratorním vyšetření je hypergonadotropní hypogonadizmus diagnostikován na základě vyšší hladiny FSH, nižší hladiny testosteronu v séru a vyšší hladiny LH [3]. Hladinu testosteronu je třeba hodnotit v kontextu koncentrace pohlavního hormonu vážícího globulin (SHBG) v séru. Na základě hladin celkového testosteronu a SHBG lze spočítat hodnoty volného a biologicky dostupného testosteronu (http://www.issam.ch/freetesto.htm).
Vzhledem ke kolísání hodnot během dne se doporučuje odběr krve pro hodnocení hladiny testosteronu provádět před desátou hodinou dopolední. Současná guidelines pro substituční terapii androgenem jsou založena zejména na hladině celkového testosteronu. Existuje obecný konsenzus, že muži s celkovou hladinou testosteronu > 12 nmol/l (350 ng/dl) nevyžadují substituční terapii. A podobně na základě údajů mladších mužů bylo stanoveno, že pacienti s celkovou hladinou testosteronu v séru < 8 nmol/l (230 ng/dl) budou mít obvykle benefit ze substituce testosteronu. V případě, že se hladina celkového testosteronu pohybuje v rozmezí 8–12 nmol/l, je o suplementaci testosteronem rozhodnuto na základě přítomnosti symptomů.
U obézních mužů může být užitečné měření hladiny celkového testosteronu a SHBG pro kalkulaci volného testosteronu nebo měření volného testosteronu pomocí ekvilibrační dialýzy [11]. Pro klinické užití je k dispozici testosteron ve formě pro injekční, perorální i transdermální aplikaci [3]. Nejvhodnější je taková forma, jež udrží hladinu testosteronu v séru co nejblíže fyziologické koncentraci [11–13].
7.4 Závěry a doporučení pro muže s hypogonadizmem
Obecně lze říci, že pacienti s primárním nebo sekundárním hypogonadizmem v kombinaci s hypoandrogenizmem by měli podstoupit substituční terapii testosteronem.
V současné době máme k dispozici efektivní medikamentózní terapii umožňující mužům s hypogonadotropickým hypogonadizmem dosáhnout fertility [4] (stupeň doporučení: A).
8. Kryptorchizmus
Zdroje
1. Andrology. In: Nieschlag E, Behre HM (eds). Male Reproductive Health and Dysfunction. Berlin: Springer Verlag 1997 : 83–87.
2. Bianco SD, Kaiser UB. The genetic and molecular basis of idiopathic hypogonadotropi hypogonadism. Nat Rev Endocrinol 2009; 5(10): 569–576. http://www.ncbi.nlm.nih.gov/pubmed/19707180.
3. Krausz C. Genetic aspects of male infertility. European Urological Review 2009; 3(2): 93–96.
4. World Health Organization. WHO manual for the Standardized Investigation, Diagnosis and Management of the Infertile Male. Cambridge: Cambridge University Press, 2000.
5. Burris AS, Rodbard HW, Winters SJ et al. Gonadotropin therapy in men with isolated hypogonadotropic hypogonadism: the response to human chorionic gonadotropin is predicted by initial testicular size. J Clin Endocrinol Metab 1988; 66(6): 1144–1151. http://www.ncbi.nlm.nih.gov/pubmed/3372679.
6. Schopohl J, Mehltretter G, von Zumbusch R et al. Comparison of gonadotropin-releasing hormone and gonadotropin therapy in male patients with idiopathic hypothalamic hypogonadism. Fertil Steril 1991; 56(6): 1143–1150. http://www.ncbi.nlm.nih.gov/pubmed/1743335.
7. Andersson AM, Jorgensen N, Frydelund-Larsen L et al. Impaired Leydig cell function in infertile men: a study of 357 idiopathic infertile men and 318 proven fertile controls. J Clin Endocrinol Metab 2004; 89(7): 3161–3167. http://www.ncbi.nlm.nih.gov/pubmed/15240588.
8. Lanfranco F, Kamischke A, Zitzmann M et al. Klinefelter’s syndrome. Lancet 2004; 364(9430): 273–283. http://www.ncbi.nlm.nih.gov/pubmed/15262106.
9. Manning M, Junemann KP, Alken P. Decrease in testosterone blood concentrations after testicular sperm extraction for intracytoplasmic sperm injection in azoospermic men. Lancet 1998; 352(9121): 37. http://www.ncbi.nlm.nih.gov/pubmed/9800753
10. Daniell HW. Osteoporosis after orchiectomy for prostate cancer. J Urol 1997; 157(2): 439–444. http://www.ncbi.nlm.nih.gov/pubmed/8996327.
11. Finkelstein JS. Androgens and bone metabolism. In: Nieschlag E, Behre HM (eds). Testosterone: Action, Deficiency, Substitution. 2nd ed. Berlin: Springer-Verlag 1998 : 187–207.
12. Nieschlag E, Swerdloff R, Behre HM et al. Investigation, treatment and monitoring of late-onset hypogonadism in males: ISA, ISSAM, and EAU recommendations. Int J Androl 2005; 28(3): 125–127. http://www.ncbi.nlm.nih.gov/pubmed/15910536.
13. Nieschlag E, Wang C, Handelsman DJ et al. Guidelines for the Use of Androgens in Men. Geneva: WHO 1992.
Štítky
Detská urológia Urológia
Článok vyšiel v časopiseUrologické listy
Najčítanejšie tento týždeň
2012 Číslo 4- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Vedlejší účinky hormonální substituční léčby testosteronem
- Vývoj chirurgického odběru spermií u mužů s azoospermií
- Adenomatoidní tumor varlete – diagnostika a doporučené operační postupy
- Vaporizace prostaty pomocí zeleného laseru (GreenLight laser) – zkušenost z jednoho centra po provedení více než 1 000 výkonů
- Syntetický miduretrální sling při léčbě močové inkontinence u žen: analýza 1 000 případů z jednoho centra
- Slovo úvodem
- Virulentný profil a rezistencia Escherichia coli izolovaných od imunokompromitovaných pacientov pri urosepse
- Sekvence léčby a sledování pacienta s metastatickým kastračně rezistentním karcinomem prostaty
-
Guidelines EAU pro léčbu mužské infertility
1. Metodologie -
Guidelines EAU pro léčbu mužské infertility
2. Vyšetření -
Guidelines EAU pro léčbu mužské infertility
3. Testikulární nedostatečnost (selhání spermatogeneze) -
Guidelines EAU pro léčbu mužské infertility
4. Genetické poruchy u infertilních mužů -
Guidelines EAU pro léčbu mužské infertility
5. Obstrukční azoospermie - Nádory penisu spojené s výskytem dalších novotvarů
-
Guidelines EAU pro léčbu mužské infertility
6. Varikokéla -
Guidelines EAU pro léčbu mužské infertility
7. Hypogonadizmus -
Guidelines EAU pro léčbu mužské infertility
8. Kryptorchizmus -
Guidelines EAU pro léčbu mužské infertility
9. Idiopatická mužská infertilita -
Guidelines EAU pro léčbu mužské infertility
10. Mužská antikoncepce -
Guidelines EAU pro léčbu mužské infertility
11. Infekce mužských přídatných žláz -
Guidelines EAU pro léčbu mužské infertility
12. Maligní onemocnění ze zárodečných buněk a testikulární mikrokalcifikace -
Guidelines EAU pro léčbu mužské infertility
13. Poruchy ejakulace -
Guidelines EAU pro léčbu mužské infertility
14. Kryoprezervace ejakulátu -
Guidelines EAU pro léčbu mužské infertility
15. Zkratky užité v textu
- Urologické listy
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Vedlejší účinky hormonální substituční léčby testosteronem
- Adenomatoidní tumor varlete – diagnostika a doporučené operační postupy
-
Guidelines EAU pro léčbu mužské infertility
13. Poruchy ejakulace -
Guidelines EAU pro léčbu mužské infertility
5. Obstrukční azoospermie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



