-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Jaterní postižení při deficitu alfa−1−antitrypsinu
Liver disease at alpha-1-antitrypsin deficiency
Alpha-1-antitrypsin deficiency is a hereditary disease. Most often it affects lungs and liver. It can manifest itself as cholestasis in the newborn period or later as chronic hepatitis, liver cirrhosis, and also pulmonary emphysema. In this article a case report of a 21-year-old woman with alpha-1-antitrypsin deficiency determined by liver tests during a viral disease with high fevers treated by antibiotics and paracetamol has been described. Histology proved no changes in liver except PAS positive granules in hepatocytes. Examinations proved alpha-1-antitrypsin deficiency and PiZZ phenotype in the patient. Her medical history revealed asthma bronchiale present since her child’s age. Following examination of her family’s medical history revealed alpha-1-antitrypsin deficiency in her mother and her sister, PiMZ phenotype. However, neither one of them suffered from liver or pulmonary disease.
Key words:
alpha-1-antitrypsin deficiency – chronic hepatitis – liver cirrhosis – pulmonary emphysema
Autoři: L. Husová 1; M. Dastych jr. 1; E. Kunertová 2; P. Husa 3; K. Dvořák 4; M. Votava 4
Působiště autorů: Interní gastroenterologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Petr Dítě, DrSc. 1; Interní oddělení nemocnice Břeclav, přednosta prim. MUDr. Jitka Siegelová 2; Klinika infekčních chorob Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta doc. MUDr. Petr Husa, CSc. 3; Patologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jirka Mačák, CSc. 4
Vyšlo v časopise: Vnitř Lék 2005; 51(1): 101-105
Kategorie: Kazuistiky
Souhrn
Vrozený deficit alfa-1-antitrypsinu je geneticky podmíněná choroba. Nejvíce postihuje plíce a játra. Může se manifestovat jako novorozenecká cholestáza nebo později jako chronická hepatitida, jaterní cirhóza a také jako plicní emfyzém. V publikaci je popisován případ 21leté ženy, u které byla diagnostika deficitu alfa-1-antitrypsinu stanovena na základě vzestupu jaterních testů při virovém onemocnění s vysokými febriliemi a při podání antibiotik a paracetamolu. Histologicky byla játra bez přestavby, ale s uloženými PAS pozitivními granuly v hepatocytech. Provedená vyšetření prokázala u pacientky deficit alfa-1-antitrypsinu, fenotyp PiZZ. Anamnesticky bylo zjištěno asthma bronchiale od dětského věku. Došetřením rodiny byl identifikován deficit alfa-1-antitrypsinu u matky a sestry, fenotypu PiMZ. Ani u jedné z příbuzných nebylo zjištěno postižení jater ani plic.
Klíčová slova:
deficit alfa-1-antitrypsinu – chronická hepatitida – jaterní cirhóza – plicní emfyzémÚvod
Deficit alfa-1-antitrypsinu je dědičné onemocnění zakotvené v dlouhém raménku 14. chromozomu, četnost výskytu deficitu alfa-1-antitrypsinu (AATD) v populaci je pod 0,2 % [2,6, 14,18]. Onemocnění řadíme k metabolickým chorobám, má autozomálně recesivní dědičnost s kodominantní expresí. Incidence AATD je přibližně 1 : 2000–4000 [5,9,18]. Alfa-1-antitrypsin (AAT) je protein ze skupiny alfa-1-globulinů. Jeho přirozenou funkcí je antiproteázová aktivita. V krvi inhibuje trypsin, chymotrypsin, renin, kalikrein, urokinázu, plazmin, trombin a další proteázy. Klinicky nejvýznamnější je však inhibice leukocytové elastázy (PMN-elastázy) a kolagenózy. AAT je pozitivním reaktantem akutní zánětlivé fáze, skládá se z jednoduchého polypeptidového řetězce s 394 aminokyselinami o molekulární váze 52 kDa. Snížené hodnoty se nalézají u chorob se ztrátami proteinů, u novorozeneckého „respiratory distress“ syndromu a při vrozeném AATD [1,13,15]. AAT je kódován v lokusu proteázového inhibitoru (Pi-lokus), který má dosti značnou variabilitu. Nejčastější je fenotyp PiMM, který je přítomen u 95 % populace s normální hladinou AAT v séru. Existuje více než 75 rozdílných genetických variant, z nichž nejzávažnější jsou fenotypy PiZZ, a PiZ0 [4,6,12,13, 15]. Pro homozygotní formu PiZZ je charakteristická normální sekrece AAT, ale pouze 15 % je vylučováno do plazmy, zbývajících 85 % je blokováno v hepatocytu. Hladina AAT v plazmě je 15–20 % normy pro homozygoty PiZZ a 50–60 % pro heterozygoty PiMZ [3,15,17]. Hlavní komplikací přítomnosti alely PiZ jsou obstrukční choroba plicní a jaterní onemocnění [12]. Ale i heterozygoti (PiMZ, PiSZ) mají středně sníženou hladinu AAT a mohou mít jaterní onemocnění [5]. Mutace Z vede ke vzniku AAT, kde v řetězci aminokyselin je záměna lyzinu za glutamin (Glu342 Lys). PiZZ fenotyp (v menší míře i některé další) bývá v prvních týdnech života spojen s novorozeneckou hepatitidou a rozvojem juvenilní cirhózy [1,13,15,17,18]. Převážná část AAT je syntetizována v endoplazmatickém retikulu jaterních buněk. Existují však místa mimojaterní syntézy AAT, jako například v monocytech, bronchoalveolárních makrofágách a epiteliálních buňkách [2,15]. Nízká plazmatická koncentrace AAT není důsledkem nedostatečné syntézy, ale blokádou jeho sekrece z endoplazmatického retikula. Jaterní poškození vzniká v důsledku hromadění abnormálního AAT a jeho patologickou polymerací. Čím je větší množství uloženého abnormálního AAT, tím větší je poškození jater. Toto onemocnění lze zařadit mezi lyzozomální střádací choroby [15]. Epizody zánětu vedou ke zvýšené syntéze AAT, ten se zvýšeně ukládá u AATD v játrech a vede k jejich poškození. Je jasné, že AAT, který vzniká u AATD, musí být z endoplazsmatického retikula vylučován, protože jinak by postižení orgánů bylo mnohem častější a v nižším věku. Situaci jaterního postižení jistě zhoršují i jiné faktory, jako užívání hepatotoxických léků, pravidelný příjem alkoholu, virová onemocnění [13,15]. Jako u mnohých dědičných chorob je klinická exprese AATD vysoce variabilní [15]. Onemocnění probíhá pod obrazem těžkého emfyzému nebo pod obrazem poškození jater, u některých nemocných může dojít jak k postižení plic, tak jater. V prvním roce života dochází ke zvýšení aminotransferáz a cholestatické žloutence. Později se pomalu vyvíjí jaterní cirhóza [2,5,7, 14,16]. U homozygotního stavu v lokusu PiZZ 15–30 % dětí prodělá neonatální cholestatický ikterus, jen u části se vyvine cirhóza a jaterní selhání. Heterozygotní stav v lokusu PiZ0 má nejasný klinický význam [4,5]. Přítomnost jaterní cirhózy u AATD je nízká, přibližně 2,2/100 000 pro PiZZ homozygoty [11]. Incidence jaterního postižení narůstá s věkem (2 % ve věku 20–40 let, 5 % ve věku 40–50 let a 15 % ve věku od 50 let a více) [5,11]. Diagnostika se opírá o zjištění poklesu alfa-1-globulinové frakce v séru pod 2 % nebo přímým průkazem nízké koncentrace AAT. Kvantitativní stanovení AAT v séru je prvním krokem v diagnostice AATD, ale má vysokou variabilitu, a tak pouze stanovení fenotypu dává kompletní diagnózu [15]. Histologicky lze v jaterním punktátu prokázat PAS-pozitivní inkluze obsahující AAT. Agregáty uloženého AAT v endoplazmatickém retikulu hepatocytů ve formě inkluzí jsou rozpoznatelné barvením dle Schiffa [2,5,18]. Diagnózu potvrdí molekulární vyšetření Pi lokusu [4]. Je vhodné pravidelné sledování transamináz, USG-vyšetření je indikováno pravidelně u jaterní cirhózy a jejích komplikací pro včasnou diagnostiku maligního zvratu [15]. Léčba substituční není indikována u jaterního onemocnění v důsledku AATD, transplantace přichází v úvahu při progredující jaterní insuficienci [4,15]. Není známa genová terapie [15,18]. Důležitý je zákaz kouření jako prevence rozvoje emfyzému a prodloužení přežití u AATD [15].
Popis případu
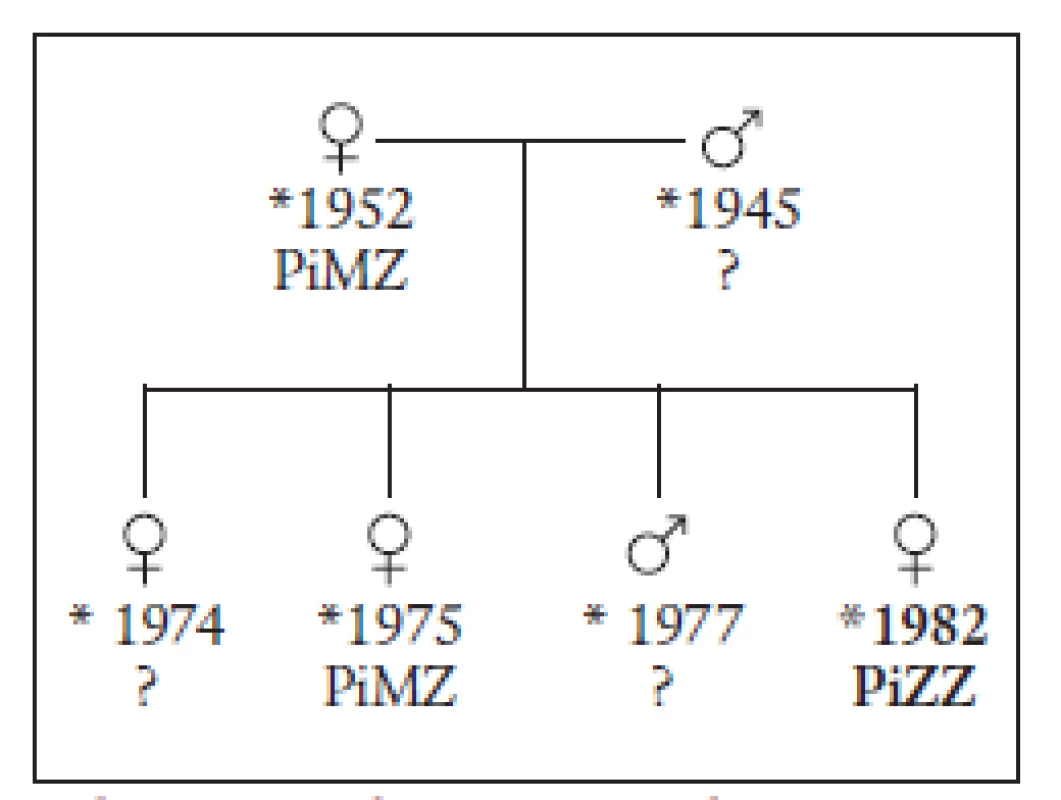
21letá pacientka se od dětství léčila pro asthma bronchiale, jinak nemocná nebyla. Pravidelně užívala hormonální antikoncepci od roku 2002. Od 18 let pravidelně kouřila 10 cigaret denně. Nemocná byla v dubnu 2003 přijata pro elevaci alaninaminotransferázy (ALT) 5,0 μkat/l, aspartátaminotransferázy (AST) 2,5 μkat/l na infekční oddělení, kde byla za hospitalizace vyloučena infekční etiologie jaterního postižení. Pacientka odmítla další vyšetření a hospitalizaci, a proto byla na vlastní žádost propuštěna. Za měsíc se dostavila k ambulantní kontrole na spádové gastroenterologii. Pro vzestup jaterních testů (ALT 8,42 μkat/l, AST 5,25 μkat/l) byla v měsíci květnu přijata na interní oddělení spádové nemocnice. Hospitalizace na interním oddělení trvala dva dny a potvrdila vzestup jaterních enzymů, byla vyloučena obstrukční příčina jaterního postižení (negativní ultrazvukové vyšetření žlučníku a žlučových cest). K došetření příčiny vzestupu jaterních enzymů a léčbě byla pacientka přeložena na naše pracoviště. Po celou dobu sledování neměla nemocná subjektivní potíže. Před přijetím na infekční oddělení však pacientka prodělala virózu s postižením horních cest dýchacích a s vysokými febriliemi. Z tohoto důvodu užívala paracetamol 1500 mg/den, amoxicilin klavulát 1,125 g/den. Vyšetření jaterních testů měla provedeno před zavedením hormonální antikoncepce (v roce 2002), jejich hodnoty byly v normě. Objektivně byla pacientka obézní 152 cm výška, 83 kg váha, BMI = 37, kardiopulmonálně kompenzována, břicho bylo klidné, játra zvětšená o 2 cm v medioklavikulární čáře. Provedená laboratorní vyšetření potvrdila elevaci jaterních enzymů (ALT 8,82 μkat/l, AST 2,62 μkat/l, gamaglutamyltransferáza – GMT 1,07 μkat/l). Bilirubin, alkalická fosfatáza, koagulace, krevní obraz, sérová bílkovina i albumin byly opakovaně v mezích normy. Sonografický obraz prokázal lehce zvětšená játra hladkého povrchu, bez ložiskového procesu jaterního parenchymu, s nerozšířenými intra - i extrahepatálními žlučovody. Odebraný sérový AAT potvrdil nízkou hladinu 0,28 g/l (norma 0,9–2,0 g/l). Histologický obraz z jaterní biopsie prokázal pravidelnou stavbu lobulů, portobiliární prostory lehce rozšířené, s poněkud hojnějším lymfocytárním infiltrátem a zmnoženými fibroblasty. V některých byla mírně neostrá hranice k hraniční ploténce. Hepatocyty měly světlejší cytoplazmu s hojným glykogenem, při natrávení glykogen zmizel a v některých skupinách hepatocytů perzistovala různě objemná PAS pozitivní granula. Tyto buňky byly rozloženy v nepravidelných skupinách a více periportálně, fokálně byly skupiny histiocytů s fagocytovaným PAS pozitivním materiálem. Reakce na AAT byla difuzně pozitivní a v granulovaných buňkách výrazná. Jaterní biopsie tedy prokázala hepatopatii při AATD. Projevy ve skupinách buněk, v současném stadiu játra bez přestavby (obr. 1 a 2). Prostý snímek srdce a plic neprokázal patologii na vyšetřených orgánech. Byla provedena DNA analýza mutací v genu pro AAT, která prokázala fenotyp PiZZ, homozygotní formu AATD. Po zavedené parenterální výživě, klidovém režimu a polyvitaminózní terapii došlo k poklesu aminotransferáz (ALT 2,93 μkat/l, AST 1,03 μkat/l, GMT 1,94 μkat/l). Pacientka byla propuštěna do domácího ošetření. Nemocné bylo doporučeno nekouřit a byla upozorněna na nutnost pravidelného sledování. Při kontrolním vyšetření za 4 měsíce byly jaterní testy zcela v mezích normy. Pacientka je dále dispenzarizována. Pokrevní příbuzní byli vyzváni k vyšetření. Dostavila se však jen matka a starší sestra. U obou byla prokázána mutace PiMZ, hraniční hladina alfa-1-antitrypsinu a jaterní enzymy v mezích normy. U bratra dle údajů matky byl po narození protrahovaný ikterus, ostatní děti byly bez ikteru. Vzhledem k omezené spolupráci nebylo možné vyšetřit všechny rodinné příslušníky. U žádného z nich nebylo anamnesticky (od vyšetřených příbuzných) zjištěno jaterní onemocnění. Charakteristika rodiny je znázorněna na obr. 3.
Obr. 1. PAS pozitivní globule abnormálního alfa-1-antitrypsinu v cytoplazmě hepatocytů. 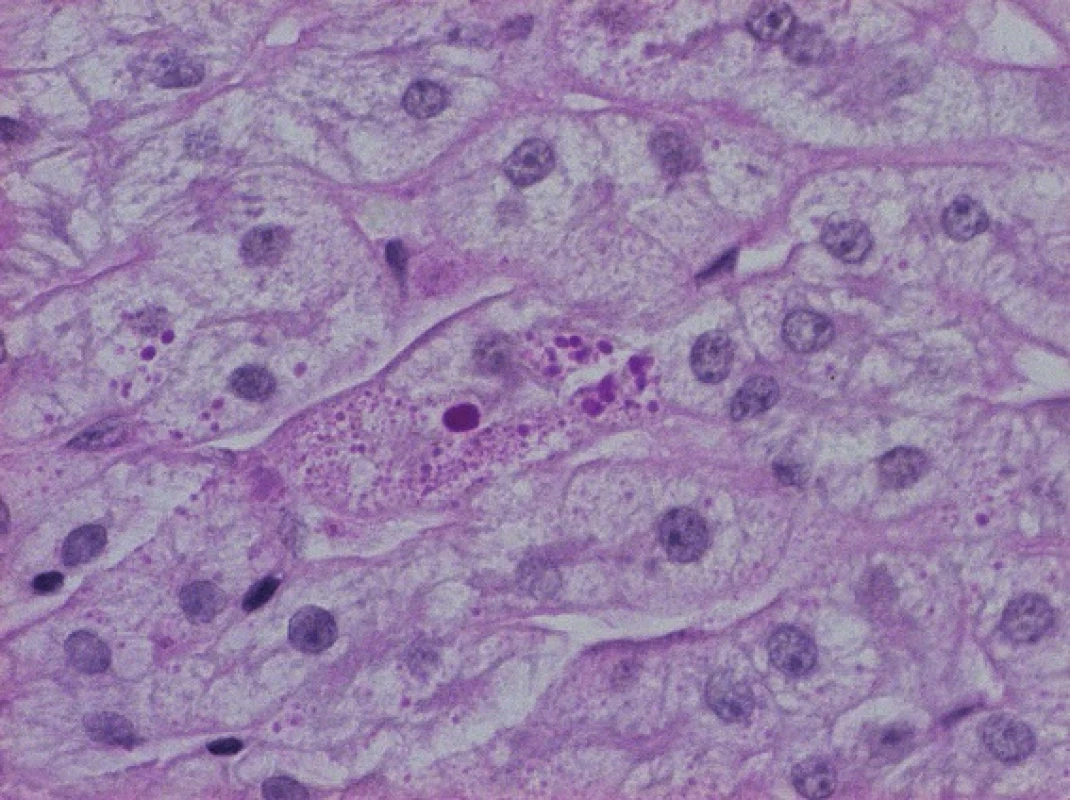
Zvětšeno 400×. Obr. 2. Imunochemická reakce na přítomnost alfa-1-antitrypsinu v cytoplazmě hepatocytů – pozitivní hnědé zbarvení. 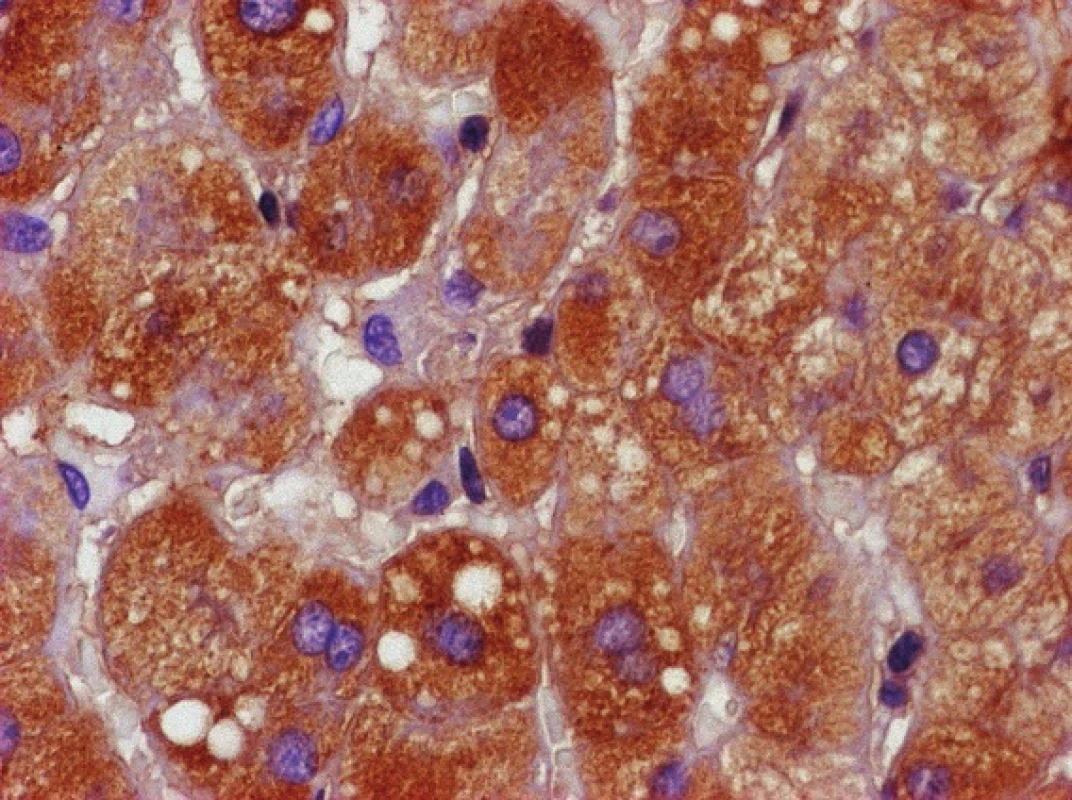
Zvětšeno 400×. Diskuse
AATD je geneticky podmíněné onemocnění. Klinicky se projevuje postižením jater a plic.
Klinicky vyjádřená jaterní choroba se vyskytuje asi u 10 až 20 % všech novorozenců s homozygotním PiZZ AATD, ale většina (70 %) má abnormální jaterní testy. Nejvíce se vyskytujícím postižením spojeným s AATD je syndrom novorozenecké hepatitidy, charakterizovaný pruritem, konjugovanou hyperbilirubinemií, zvýšením sérových aminotransferáz, hepatomegalií. Známky cholestázy se objevují mezi 4. dnem a 2. měsícem života a mohou přetrvávat po několik týdnů až do 8. měsíce. Cholestáza může být příčinou acholické stolice a může být v začátcích zaměněna za biliární atrezii. Postupně dochází k regresi, v menšině k progresi do cirhózy a jaterního selhání, a pokud není léčeno transplantací, často končí smrtí. Před 20. rokem věku se jaterní cirhóza vyskytuje u 3 % nemocných s AATD, respektive u 30 % novorozenců, u kterých se rozvinula novorozenecká cholestáza [15].
Brazilští autoři De Tommaso et al uvádějí vyšetření fenotypu u 12 dětí, z nichž 7 mělo chronické onemocnění jater neznámé etiologie a 5 pacientů mělo nízkou hladinu AAT spojenou s diagnózou novorozenecké cholestázy a/nebo chronickým jaterním onemocněním. 5 ze 12 dětí (3 měsíce – 19 let) byly homozygoti Z alely (PiZZ) a dvě měly S alelu (PiS0). Tyto výsledky ukazují, že AATD je relativně časté v dětském věku u chronického onemocnění jater neznámé etiologie a/nebo s nízkým AAT (41,6 %) [7].
Seger et al sledovali švédské děti (narozené od roku 1972 do roku 1974). Ze souboru 200 000 dětí bylo diagnostikováno a dále sledováno 184 dětí s AATD (127 PiZZ, 2 PiZ0, 54 PiSZ, 1 PiS0). Šest dětí zemřelo v dětství (1 PiSZ a 5 PiZZ). Vývoj jaterního onemocnění byl sledován ve věku 16 a 18 let. Žádné z dětí nemělo ve věku 16 nebo 18 let s fenotypem PiZZ a PiSZ klinické známky jaterního onemocnění. Vyšší ALT nebo GMT mělo 17 % PiZZ a 8 % PiSZ v 16 letech a 12 % PiZZ a 15 % PiSZ v 18 letech. Ze 127 dětí PiZZ mělo 22 klinické známky jaterního postižení v dětství. Z těchto 22 zemřely 2 děti v dětství na jaterní cirhózu. Další 2 děti zemřely z jiných příčin (nehoda, aplastická anémie), biopsie prokázala u těchto dětí cirhózu a v druhém případě fibrózu jater. Všech 18 dětí, které se z této skupiny dožily kontroly v 16 a 18 letech, bylo v době kontroly bez klinických příznaků onemocnění jater a jen u dvou z nich byly patologické ALT a GMT. Prognóza deficitu AAT je dle těchto autorů do 18 let dobrá, neboť těmito autory nebyly zjištěny klinické známky jaterního onemocnění v uvedeném věku, ale v 10–15 % patologické jaterní testy (ALT, GMT) [5].
Hlavním úkolem klinické péče o pacienty s AATD je určit čas transplantace jater. Ten je dán progredující jaterní dysfunkcí. Čas transplantace závisí nejen na přítomnosti jaterní cirhózy, portální hypertenze nebo jaterní dysfunkci, ale je dán spoluprací mezi hepatologem, pacientem a rodinou [8].
Podle Evropského registru transplantací tvoří 5 % všech transplantací jater metabolické poruchy. Pratschke et al sledovali příčinu ortotopických transplantací jater (OLTX) v důsledku metabolických onemocnění. Sledovali transplantace jater a kombinované transplantace jater a ledvin v letech 1988 až 1997. Bylo provedeno 837 transplantací jater, z toho 39 ortotopických transplantací jater u 38 pacientů (15 žen, 23 mužů, 4–60 let věku), pro metabolické poruchy 4,7 %. Nejčastější indikací byla Wilsonova choroba (14 pacientů), AATD (7 pacientů), hemochromatóza (4 pacienti), erytropoetická porfýrie (4 pacienti), cystická fibróza (2 pacienti), Criglerův-Najjarův syndrom (1 pacient), glykogenóza I. typu (1 pacient), deficit ornithin-transcarbomylázy (1 pacient), primární hyperoxalurie (4 pacienti). 7 pacientů s AATD bylo věkového rozmezí 4–54 let, jeden z nich zemřel 5 měsíců po OLTx na maligní lymfom. Zbývajících 6 pacientů přežilo první rok po transplantaci, udávaná doba přežití je 13–72 měsíců. Jeden pacient byl opětovně transplantován 2 měsíce po OLTx pro trombózu jaterní tepny. Pacienti transplantovaní pro AATD byli fenotypu PiZZ, u jednoho pacienta byla prokázána plicní fibróza s plicní insuficiencí, u 6 byla histologicky prokázána cirhóza jater. Bezpečnost a účinnost OLTX u AATD je velmi dobrá. Čas transplantace je velmi rozdílný a je dán jak pokročilostí jaterního, tak plicního postižení [9].
Práce De Serrese poukazuje, že AATD je geneticky podmíněné onemocnění postihující nejen bělochy v Evropě, ale vyskytuje se na celém světě u různých ras. Jde o jednu z mnoha chorob společných pro celý svět [10]. Nejvyšší prevalence tohoto onemocnění je ve východní Evropě u bělošské populace, kde je incidence homozygotní mutace 1 : 500, v USA u bělochů je incidence AATD 1 : 1800–2000 živě narozených [18]. Incidence v moravské populaci AATD je 1 : 1855 [19].
Cosme et al prokázali, že věk, kdy je diagnostikována cirhóza nebo fibróza jater, je u diagnózy AAT obvykle vyšší než 50 let, poměr mužů k ženám je 2 : 1. U pacientů s jaterní cirhózou neprokázali rozdíl mezi zastoupením homozygotů PiZZ a heterozygotů PiMZ a PiSZ. Vyšetřili 50 pacientů s jaterním onemocněním a AATD (16 žen, 34 mužů, věk 18–77 let), z nichž 29 (58 %) mělo jaterní cirhózu. Cirhóza byla dekompenzována u 48 % pacientů. U uvedených pacientů byl prokázán fenotyp homozygotní PiZZ u 12 nemocných a u 12 heterozygotní nejčastěji fenotyp PiMZ a PiSZ [11].
Lok et al popsali zajímavý případ 22leté ženy s koincidencí autoimunní hepatitidy a AATD. Nejprve byla diagnostikována autoimunní hepatitida a později i AATD. Upozornili na společný výskyt AATD s jinými jaterními onemocněními [16]. Lima et al vyšetřili 29 pacientů s kryptogenní cirhózou (věk od 1 měsíce do 18 let). 5 z 29 pacientů se podrobilo jaterní transplantaci. 3 pacienti byli heterozygoti pro PiZ alelu (12,07 %) a 2 homozygoti PiZZ. Ze skupiny 100 kontrolních pacientů byl pouze 1 heterozygot pro alelu PiZ (0,5 %) [12].
Genetický deficit AAT je spojován s emfyzémem plic, ale také s asthma bronchiale, bronchiektaziemi a vaskulitidou. Velmi důležitým faktorem v rozvoji plicního emfyzému je kouření postiženého pacienta [13]. U dospělých s AATD jsou 2krát častěji postiženi muži než ženy. Recentní studie prokázaly vysoké riziko cirhózy (40 %) i hepatocelulárního karcinomu (15 %) u nemocných s AATD [15].
Závěr
AATD je metabolické geneticky podmíněné onemocnění, které může vést k závažnému postižení jater a/nebo plic. Choroba se může manifestovat chronickou hepatitidou či cirhózou jater v různém věku. Proto je třeba na tuto chorobu myslet i v dospělosti. Etiologie jaterní cirhózy u dospělých s AATD je málo diagnostikována. Terapeuticky připadá v úvahu jaterní transplantace. Studie se substitucí AAT na hodnoty normy nebyly u postižení jater úspěšné. Alternativní se jistě jeví genová terapie, která však není zatím dostupná. AATD vede k plicnímu postižení, je známo, že kuřáctví toto postižení zhoršuje, proto je vhodné na tuto skutečnost pacienta upozornit. AATD může být závažným onemocněním v diferenciální diagnostice u dospělých nemocných s přítomností chronické hepatitidy, jaterní cirhózy či portální hypertenze nejasné etiologie.
MUDr. Libuše Husová
www.fnbrno.cz
e-mail: lhusova@fnbrno.cz
Doručeno do redakce: 15. 1. 2004
Přijato po recenzi: 23. 3. 2004
Zdroje
1. Schneiderka P. Biochemické vyšetření. In: Ehrmann J et al. Icterus – diferenciální diagnostika. Praha: Grada Publishing 2003 : 45–64.
2. Hauftová D, Ehrmann J. Metabolická jaterní onemocnění. In: Ehrmann J et al. Icterus – diferenciální diagnostika. Praha: Grada Publishing 2003 : 179–189.
3. Eriksson, S. Alpha-1-antitrypsin deficiency. J Hepatol 1999; 30 (S1): 34–39.
4. Trunečka P. Kongenitální fibróza jater a vzácné metabolické choroby. In: Postgraduální kurs subkatedry gastroenterologie IPVZ. Sborník přednášek. Praha: Institut postgraduálního vzdělávání ve zdravotnictví 2000 : 157–161.
5. Sveger T, Eriksson S. The liver in adolescents with alpha-1-antitrypsin deficiency. Hepatology 1995; 2(22): 514–517.
6. Rosen HR. Alpha-1-antitrypsin deficiency and other metabolic liver diseases. In: Friedman, LS, Keeffe EB. Handbook of liver disease. London: Churchil Livingstone 1998 : 255–265.
7. De Tommaso AM, Rossi CL, Escanhoela CA et al. Diagnosis of alpha-1-antitrypsin deficiency by DNA analysis of children with liver disease. Arquivos de gastroenterologia 2001; 1(38): 63–68.
8. Perthutter DH. Alpha-1-antitrypsin deficiency. Current Treatment Options in gastroenterology 2000; 3(6): 451–456.
9. Pratschke J, Steinmüller T, Bechstein WO et al. Orthotopic liver transplantation for hepatic associated metabolic disorders. Clin Transplantation 1998; 12 : 228–232.
10. De Serres FJ. Worldwide racial and ethnic distribution of alpha-1-antitrypsin deficiency: Summary of and analysis of published genetic epidemiologic surveys. Chest 2002; 5(122): 1818–1829.
11. Cosme A, Ojeda E, Torrado J et al. Liver alterations due to alpha-1-antitrypsin deficiency in adults. Study of 5 patients and analysis of the cases reported in the Spanish literature. Gastroenterologia y hepatologia 2003; 4(26): 251–256.
12. Lima LC, Matte U, Leistner S et al. Molecular analysis of the Pi*Z allele in patients with liver disease. American Journal of Medical Genetics 2001; 4(104): 287–290.
13. Carrell RW, Lomas DA. Alpha-1-antitrypsin deficiency – a model for conformational diseases. N Engl J Med 2002; 1(346): 45–53.
14. Vogel W, Braunsteiner T, Dietze O et al. Pathogenesis of liver disease alpha-1-antitrypsin deficiency. Scandinavian J Gastroeterol 1990; 5(17): 100–103.
15. Eriksson S. Alpha-1-antitrypsin deficiency. J Hepatol 1999; 30 : 34–39.
16. Lok ASF, Ghany MG, Gerber MA. A young woman with cirrhosis. Autoimmune hepatitis vs. alpha-1-antitrypsin deficiency. Hepatology 1994; 5(19): 1302–1306.
17. Sharp HL. Wherefore are thou liver disease associated with alpha-1-antitrypsin deficiency? Editorial. Hepatology 1995; 2(22): 666–667.
18. Leonis MA, Balisteri WF. Inherited metabolic disorders of the liver. In: Feldman M, Friedman LS, Sleisenger MH et al. Fordtran’s Gastrointestinal and liver disease: pathophysiology, diagnosis, management. II. 7th ed. Philadelphia: Saunders 2002 : 1240–1277.
19. Mrskoš A, Kozák L, Pospíšilová J et al. Alpha-1-antitrypsin deficiency: Simple, inexpensive newborn mass screening method. Klin Biochem Metab 2002; 4(10): 191–194.
Štítky
Diabetológia Endokrinológia Interné lekárstvo Pneumológia a ftizeológia Praktické lekárstvo pre dospelých
Článek Slovo nakladateleČlánek Odkaz sira Williama OsleraČlánek Jan Lebl, Štěpánka Průhová et al. Abeceda diabetu. Příručka pro děti, mladé dospělé a jejich rodičeČlánek MyokarditidyČlánek Metabolický syndrom a sympatický nervový systém: je obstrukční spánková apnoe klíčem k pochopení?Článek ÚvodníkČlánek Hypertenze a hyperurikemie
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2005 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
-
Všetky články tohto čísla
- Slovo nakladatele
- Jaterní postižení při deficitu alfa−1−antitrypsinu
- Akutní myokarditida manifestující se obrazem transmurálního infarktu myokardu provázená akutním renálním selháním
- Význam centralizace péče o nemocné s akutním krvácením do horní části trávicího traktu
- Za profesorem MUDr. Stanislavem Havelkou
- Otevřený dopis Jiřímu Vorlíčkovi
- Bioekvivalenční studie s novými antihypertenzivy
- Komentář k Doporučení American Heart Association/American College of Cardiology Foundation pro léčbu warfarinem
- Odkaz sira Williama Oslera
- Jan Lebl, Štěpánka Průhová et al. Abeceda diabetu. Příručka pro děti, mladé dospělé a jejich rodiče
- Jiří Vítovec, Jindřich Špinar et al. Farmakoterapie kardiovaskulárních onemocnění
- Petr Cetkovský et al. Intenzivní péče v hematologii
- Individuální výběr nemocných pro silový trénink po akutním infarktu myokardu se sníženou ejekční frakcí levé komory
- Viktor Chrobok, Jaromír Astl, Pavel Komínek et al. Tracheostomie a koniotomie, techniky, komplikace a ošetřovatelská péče
- Anna Jedličková. Antimikrobiální terapie v každodenní praxi
- David Cibula, Luboslav Stárka, Jana Vrbíková et al. Syndrom polycystických ovarií
- Tomáš Skalický, Vladislav Třeška, Jiří Šanjdauf et al. Chirurgie jater
- Zpráva o kurzu Hot topics in internal medicine, Alicante, Španělsko, 16.–22. 10. 2004
- Myokarditidy
- Myelodysplastický syndrom v novém tisíciletí. Jak klasifikovat a jak léčit nemocné?
- Efekt a tolerancia kombinovanej liečby fludarabinom s cyklofosfamidom u chorých s chronickou lymfocytovou leukémiou
- Naše zkušenosti s novou organizací péče o nemocné s akutním krvácením do horní části trávicího traktu
- Silový trénink u nemocných po akutním infarktu myokardu se sníženou ejekční frakcí levé komory srdeční
- Úvod do problematiky metabolického syndromu
- Metabolický syndrom a sympatický nervový systém: je obstrukční spánková apnoe klíčem k pochopení?
- Diabetes mellitus a metabolický syndrom
- Hypertenze jako součást metabolického syndromu
- Úvodník
- Obezita a metabolický syndrom
- Dyslipidemie u metabolického syndromu
- Hypertenze a hyperurikemie
- Role pohybové léčby a tělesné zdatnosti v prevenci a léčbě metabolického syndromu
- Akutní infarkt myokardu u pacienta s anamnézou infekční endokarditidy
- Extramedulární plazmocytom štítné žlázy - vzácná příčina solitární uzlové strumy s hypertyreózou
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Jaterní postižení při deficitu alfa−1−antitrypsinu
- Myelodysplastický syndrom v novém tisíciletí. Jak klasifikovat a jak léčit nemocné?
- Hypertenze a hyperurikemie
- Myokarditidy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy