-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Metabolický syndrom a sympatický nervový systém: je obstrukční spánková apnoe klíčem k pochopení?
Metabolic syndrome and sympathetic nervous system: is obstructive sleep apnea a key to understanding?
Chronically increased sympathetic nervous system activity may contribute to the onset and progression of the metabolic syndrome. However, the primary cause of increased sympathetic activity in patients with this syndrome remains unclear. Obstructive sleep apnea has a high incidence in the general population and may be a significant independent risk factor for some cardiovascular diseases. Despite these considerations, obstructive sleep apnea remains generally underestimated phenomenon in both clinical practice as well as research. Data from clinical and basic research suggest that obstructive sleep apnea is associated with, and may contribute to, a significant increase in sympathetic activity, body weight and body fat, and systemic blood pressure. Obstructive sleep apnea is also associated with insulin and leptin resistance. Moreover, obstructive sleep apnea is linked with systemic inflammation, endothelial dysfunction, oxidative stress and a protrombotic state. Similarities in regulatory and metabolic abnormalities in obstructive sleep apnea and the metabolic syndrome, as well as the high prevalence of both metabolic syndrome and obstructive sleep apnea in the general population, suggest that obstructive sleep apnea may contribute to the pathophysiology and progression of the metabolic syndrome.
Key words:
metabolic syndrome – nervous system sympathetic – sleep apnea obstructive – sleep – syndrome X
Autoři: T. Kára 1; M. Souček 3; Š. Kárová 1; J. Vítovec 2; V. K. Somers 1
Působiště autorů: Division of Cardiovascular Diseases and Hypertension, Mayo Clinic, Rochester, MN, USA, přednosta prof. David L. Hayes, M. D. 1; I. interní kardio-angiologická klinika Lékařské fakulty MU a FN u sv. Anny, Brno, přednosta prof. MUDr. Jiří Vítovec, CSc., FESC 2; II. interní klinika Lékařské fakulty MU a FN u sv. Anny, Brno, přednosta doc. MUDr. Miroslav Souček, CSc. 3
Vyšlo v časopise: Vnitř Lék 2005; 51(1): 53-61
Kategorie: Přehledné referáty
Souhrn
Chronicky zvýšená aktivita sympatického nervového systému pravděpodobně přispívá ke vzniku a rozvoji metabolického syndromu. Příčina zvýšené aktivity sympatiku u tohoto syndromu však zůstává neznámá. Obstrukční spánková apnoe vykazuje vysoký výskyt v běžné populaci a může být významným nezávislým rizikovým faktorem některých kardiovaskulárních onemocnění. I přes všechny tyto skutečnosti je význam obstrukční spánkové apnoe všeobecně podceňován, a to jak v klinické praxi, tak i ve výzkumu. Data z klinického i základního výzkumu však ukazují, že obstrukční spánková apnoe je spojena a pravděpodobně přispívá k signifikantnímu zvýšení sympatické aktivity, tělesné hmotnosti, tělesného tuku a systémového krevního tlaku. Obstrukční spánková apnoe je rovněž spojena s inzulinovou a leptinovou rezistencí. Obstrukční spánková apnoe je navíc spojena se vzestupem zánětlivé a koagulační aktivity organizmu a dále s endoteliální dysfunkcí a oxidativním stresem. Podobnosti v regulačních a metabolických odchylkách stejně jako vysoký výskyt obou nozologických jednotek v populaci dovolují předpokládat, že se obstrukční spánková apnoe může podílet na patofyziologii metabolického syndromu a přispívá k jeho progresi.
Klíčová slova:
metabolický syndrom – sympatický nervový systém – obstrukční spánková apnoe – spánek – syndrom XÚvod
Metabolický syndrom (MS) je v plně rozvinuté formě charakterizován hypertenzí, obezitou, aterogenní dyslipidemií, inzulinovou a leptinovou rezistencí, protrombotickým a prozánětlivým stavem. Teorie zvýšené aktivity sympatického nervového systému si v patofyziologii MS získala poměrně značnou oblibu a byla o ní publikována řada prací také v české odborné literatuře [11,14,32, 38]. Tento model obezity spojené s hypertenzí, u kterého vede zvýšený sympatický tonus ke zvýšení srdeční frekvence, srdečního výdeje, periferní vaskulární rezistence, zvýšené tubulární reabsorpci sodíku v ledvinách a následnému zvýšení systémového krevního tlaku a rovněž metabolickým poruchám, je jistě velmi atraktivní.
I když řada studií zjistila u pacientů s obezitou a/nebo MS zvýšenou aktivitu sympatiku [8,35], existuje nemálo důkazů z lidských i zvířecích experimentů, které prokazují, že obezita může být spojena s normální nebo dokonce sníženou aktivitou sympatiku [1,33,39]. Z pohledu patofyziologie MS tak precizní analýza těchto výsledků dovoluje předpokládat dva základní modely obezity: s normální a zvýšenou aktivitou sympatiku.
Existuje významný ukazatel, který je spojen s aktivací sympatiku jako málokterý jiný – byl však doposud ve studiích týkajících se patofyziologie a léčby obezity a MS téměř zcela ignorován: obstrukční spánková apnoe (OSA). Tento článek se pokusí shrnout nejnovější poznatky, které ukazují, že pochopení patofyziologie OSA a změn, které v organizmu vyvolává, může přinést klíčové informace k vyřešení sporů, týkajících se významu aktivace sympatického nervového systému v patofyziologii obezity a MS.
Definice pojmu „sympatikus“
Autonomní nervový systém se dělí na sympatický nervový systém, parasympatický nervový systém a tzv. nonadrenergní noncholinergní autonomní nervový systém. Obecně je potom tendence hovořit o sympatiku jako celku. Tento přístup není správný, protože dnes již víme o existenci minimálně 4 podsystémů sympatického nervového systému (sympatický adrenergní nervový systém, sympatický cholinergní nervový systém, cirkulující katecholaminy a sympatický nonadrenergní noncholinergní nervový systém). I když spolu všechny podsystémy úzce spolupracují, každý zprostředkovává jiný typ regulace [13]. V našem článku se zabýváme pouze vztahem OSA k aktivitě sympatického adrenergního nervového systému (SANS) a cirkulujících katecholaminů (specifikace v tab. 2). Pro zjednodušení není diskutován vliv OSA na parasympatický nervový systém a tkáňové katecholaminy.
Tab. 1. Abecední přehled zkratek použitých v textu. 
Tab. 2. Definice jednotlivých termínů užívaných ve vztahu k sympatickému nervovému systému v tomto článku. 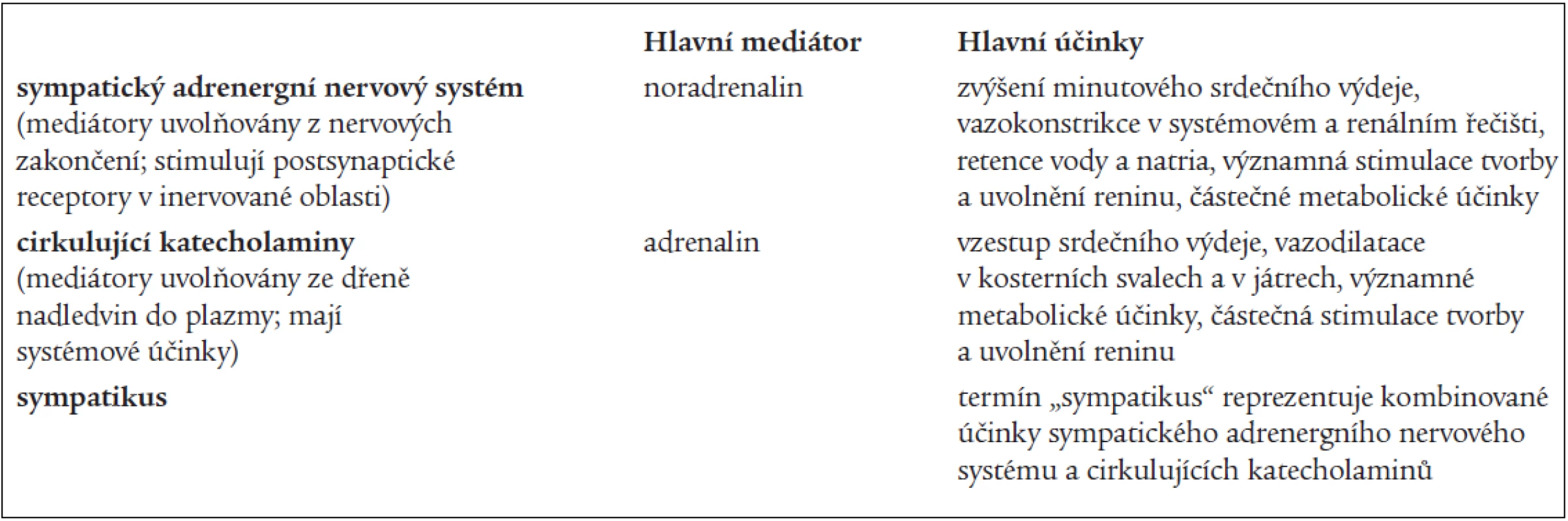
Výskyt obezity a OSA v populaci
Je obecně známo, že prevalence obezity v populaci je značná. Například v USA má nadváhu více než 60 % mužské a 50 % ženské populace, což představuje více než 97 milionů dospělých; stejně alarmující je zjištění, že výskyt obezity vykazuje setrvale vzestupný trend [17]. Podstatně méně je však znám fakt, že vysokou prevalenci má i obstrukční spánková apnoe – populační studie zjistily výskyt OSA u 24 % mužů a 9 % žen středního věku [47]. Podobně jako u obezity, také výskyt OSA v populaci narůstá – nejnovější studie publikovaná v časopise JAMA hlásí 5letou incidenci těžkých forem 7,5 % a lehkých až středně těžkých forem OSA dokonce 16 % [41]. Pokud vezmeme v úvahu vysokou prevalenci i incidenci hypertenze a metabolických poruch u obézní populace, již tato prostá fakta naznačují potencionální souvislost mezi poruchami dýchání ve spánku a MS. V následující části probíráme možné patofyziologické mechanizmy spojující OSA s jednotlivými prvky metabolického syndromu.
Definice OSA
Obstrukční spánková apnoe je stav, který je charakterizován opakovanými epizodami zástav proudění vzduchu ve spánku, způsobenými kolapsem horních dýchacích cest během nádechu. Apnoické pauzy mají většinou délku trvání 10–30 sekund (někdy však i více než 1 minutu) a jsou provázeny významným poklesem saturace kyslíku v arteriální krvi. Typicky bývá OSA nejfrekventovanější a nejtěžší v REM-spánku, během nějž dochází k přirozenému celkovému poklesu svalového tonu. Podrobnosti o patofyziologii a diagnostice OSA jsme publikovali dříve [13]. Závažnější formy obstrukční spánkové apnoe se léčí pomocí tzv. CPAP [(nasal) Continuous Positive Airway Pressure], což je kontinuální aplikace nosního přetlaku. Tato terapie zabraňuje kolapsu dýchacích cest ve spánku, a tím vzniku apnoe. Pro úplnost uvádíme, že OSA se zcela zásadně liší od centrální spánkové apnoe [13].
Mechanizmy aktivace sympatického nervového systému při OSA
Řízení krevního oběhu se významně liší během tzv. nonREM - a REM-fází spánku. Během prohlubujících se stadií nonREM-spánku dochází k celkovému postupnému poklesu aktivity SANS, jejímž výsledkem je snížení srdeční frekvence, srdečního výdeje, cévní rezistence a systémového krevního tlaku. Naproti tomu nástup REM-spánku je charakteristický náhlým vzestupem aktivity SANS, jejíž hodnoty, stejně jako hodnoty krevního tlaku a srdeční frekvence, dosahují parametrů typických pro denní klidové záznamy.
OSA těžce narušuje řízení krevního oběhu během spánku, neboť opakovaně způsobuje extrémní vzestup aktivity sympatiku (tj. SANS a cirkulujících katecholaminů) během nonREM - i REM-spánku. Patofyziologie aktivace sympatiku během OSA je velmi složitá a její popis přesahuje možnosti této publikace [13]. Řečeno stručně – na vzestupu aktivity sympatiku se podílejí 3 hlavní mechanizmy: a) hypoxie a hyperkapnie; b) negativní nitrohrudní tlak, tzv. Müllerův manévr; c) mikroprobuzení.
Hypoxie aktivací periferních a hyperkapnie aktivací centrálních chemoreceptorů silně zvyšují nejen aktivitu SANS, ale i cirkulujících katecholaminů. Výsledkem je těžká vazokonstrikce v systémové a renální cirkulaci. Těžká hypoxemie může působit i vazokonstrikci v plicním řečišti. Na tomto místě bychom chtěli zdůraznit, že hypoxie kombinovaná s hyperkapnií (tzv. hypoxická hyperkapnie) je vůbec nejsilnějším známým stimulem pro aktivaci SANS a cirkulujících katecholaminů. Mozek zpracovává hypoxickou hyperkapnii jako těžké ohrožení existence organizmu, a proto aktivuje sympatikus jako svůj hlavní záchranný systém, jenž stimuluje dýchání a krevní oběh. Předpokládaným výsledkem aktivace je obnovení vnitřního prostředí. Porovnání odpovědi SANS na jednotlivé typy stimulace znázorňuje obr.
Obr. Záznam aktivity sympatických nervů inervujících cévy kosterního svalstva v klidu, při izometrické zátěži (handgrip), mentálním stresu, testu „diving reflex“ a během apnoické pauzy. Všechny zátěžové záznamy znázorňují posledních 40 s před vrcholem (ukončením) testu. Každý „burst“ reprezentuje signál k vazokonstrikci. Z obrázku je zřejmé, že nejsilnějším stimulem pro vzestup aktivity SANS je aktivace chemoreflexu během apnoe. Další podrobnosti viz text. 
Všechny záznamy pocházejí od stejné osoby (shodou okolností jednoho z autorů tohoto článku – T.K.). Vyšetření bylo provedeno v Cardiovascular Physiology Laboratory, General Clinical Research Center, Mayo Clinic, Rochester, USA. Převzato z publikace Souček et al [15]; © 2002, Grada Publishing. OSA je způsobena kolapsem horních dýchacích cest během inspiria. Organizmus se však reflexně snaží prolomit odpor dýchacích cest vystupňovaným inspiračním úsilím. Generovaný negativní nitrohrudní tlak může během OSA dosahovat hodnot až –80 cm H2O. Nepřekvapí proto, že během OSA dochází k těžké změně konfigurace nitrohrudních struktur. To vede mj. ke změně plnících tlaků, levokomorového transmurálního tlaku a tlaku v aortě. Společným výsledkem je pokles srdečního výdeje, který dále prohlubuje hypoxii a hyperkapnii.
OSA ukončuje mikroprobuzení (arousal), které aktivací kortikálních a subkortikálních struktur obnovuje svalový tonus a restituuje normální dýchání. Aktivace korových i podkorových center dále umocňuje nárůst sympatické aktivity. Ještě důležitějším efektem opakovaných mikroprobuzení je však těžké narušení architektury spánku, které vede k chronické spánkové deprivaci (její účinky jsou probírány dále).
Hypoxie s hyperkapnií, negativní nitrohrudní tlak a mikroprobuzení kombinovaným účinkem zvyšují během spánku aktivitu sympatiku k extrémním hodnotám, čímž se zcela narušuje proces řízení krevního oběhu i homeostázy organizmu. Účinky dlouhodobé stimulace sympatiku lze rozdělit na kardiovaskulární a metabolické.
Kardiovaskulární účinky
Spánek hraje klíčovou roli v řízení diurnálních rytmů. OSA zcela mění regulaci krevního oběhu během spánku, což se mimo jiné manifestuje vzestupem krevního tlaku během noci [20,37]. Pacienti s OSA jsou typickými nondippery, tedy jedinci, u kterých v nočních hodinách nedochází k poklesu krevního tlaku. Řada z nich má dokonce reverzní průběh křivky při ambulantním monitorování TK s nejvyššími hodnotami tlaku během noci, které někdy mohou dosahovat až hranice 240/140 mm Hg. Data z některých studií ukazují, že až 90 % nondipperů mohou tvořit pacienti s OSA.
Spánek hraje důležitou roli také v kalibraci systémů, které se podílejí na řízení krevního tlaku. To je jedním z důvodů, proč pacienti s OSA mají silně zvýšenou aktivitu SANS a hladiny cirkulujících katecholaminů i během dne v porovnání s jedinci stejného stáří, pohlaví a indexu tělesné hmotnosti. Pionýrské výzkumy v této oblasti provedli zejména Somers a Narkiewitz [23,37]. Bylo prokázáno, že pacienti s OSA mají zvýšenou klidovou srdeční frekvenci a krevní tlak, sníženou variabilitu srdeční frekvence, baroreflexní senzitivitu srdeční frekvence a zvýšenou variabilitu krevního tlaku, což vytváří silnou predispozici pro vznik a rozvoj kardiovaskulárních onemocnění [22,45]. Aktivace SANS vyvolává vazokonstrikci i v renálním řečišti, čímž dochází i k narušení renálních regulačních mechanizmů. Léčba OSA pomocí CPAP vede k výraznému snížení, či úplné normalizaci aktivity SANS [21] a hladin cirkulujících katecholaminů s následným zlepšením výše diskutovaných parametrů.
OSA prostřednictvím vzestupu sympatické aktivity narušuje krátko-, středně - i dlouhodobé regulační mechanizmy krevního tlaku. Nepřekvapí proto, že pacienti s OSA mají vysoké riziko vzniku arteriální hypertenze a její rychlé progrese do chronického srdečního selhání. Pokud hypertenze vznikne, bývá v mnoha případech rezistentní ke standardní terapii. Důležitost OSA v patofyziologii arteriální hypertenze podtrhuje i 7. zpráva Joint National Committee on Prevention, Detection, Evaluation and Treatment of High Blood Pressure [3].
OSA může hrát důležitou, často však opomíjenou roli i v patofyziologii některých forem plicní hypertenze. Opakovaná hypoxie přímo indukuje vazokonstrikci plicního řečiště s následným chronickým vzestupem plicní vaskulární rezistence.
Metabolické účinky
Zvýšení tonu sympatiku způsobené OSA vede rovněž k aktivaci hypotalamo - hypofyzární osy s následným vzestupem plazmatických hladin kortizolu. Kortizol společně s cirkulujícími katecholaminy výrazně přispívá ke vzniku a rozvoji inzulinové a leptinové rezistence, protrombotického stavu a endoteliální dysfunkce (viz dále). Kardiovaskulární a metabolické důsledky OSA značně zvyšují riziko vzniku a progrese kardiovaskulárních i metabolických onemocnění u těchto pacientů.
Leptinová rezistence a OSA
Leptin je proteinový hormon, který je v organizmu tvořen zejména adipocyty. Tvorba leptinu je výsledkem exprese ob-genu. Syntéza leptinových receptorů je řízena prostřednictvím db-genu. Receptory leptinu se vyskytují jednak v mozku, zejména v oblasti hypotalamu, jednak v periferních tkáních, zvláště pak v adipocytech a buňkách kosterních svalů. Leptin hraje významnou roli v udržování energetické rovnováhy organizmu, přičemž se liší jeho účinky v periferních tkáních a v centrálním nervovém systému (CNS).
Příjem potravy vede k syntéze a následnému uvolnění leptinu z adipocytů. Alimentární zvýšení plazmatických hladin leptinu je pravděpodobně stimulováno inzulinem. Plazmatický leptin aktivuje receptory v periferních tkáních a proniká i do CNS. Centrální účinky leptinu: stimulace leptinových receptorů v mozku, zejména v hypotalamu, vede ke poklesu apetitu (vyvolává např. emoční pocit příjemného nasycení), a tím ke snížení příjmu potravy. K hypotalamickým účinkům leptinu patří i stimulace termogeneze, která zvyšuje energetický obrat organizmu. V adipocytech vyvolává leptin lipolýzu. Leptin (spolu s dalšími adipokiny) se rovněž uplatňuje v regulaci intracelulárního metabolizmu lipidů i ve tkáních, které nejsou určeny jako zásobárny tuku („non-adipose tissues“), v nichž zvyšuje oxidaci mastných kyselin a tlumí lipogenezi, tudíž brání hromadění ektopického tuku. Mezi tyto tkáně patří například kosterní sval, myokard, játra a buňky Langerhansových ostrůvků, v nichž je „lipotoxicita“ zodpovědná za poruchu funkce těchto tkání.
Souhrnně řečeno, leptin snižuje příjem potravy, zvyšuje energetický výdej, zvyšuje lipolýzu v tukové tkáni a stimuluje metabolizmus lipidů v tzv. „non-adipose tissues“. Úbytek hmotnosti po centrálním i periferním podání leptinu je omezen pouze na tukovou tkáň, přičemž nedochází k úbytku ostatních tkání. Podrobnosti o patofyziologii leptinu shrnuje např. uvedená citace [16].
Všechny tyto poznatky vedly k závěru, že leptin je pravděpodobně antiobezitním hormonem, což zcela logicky vyvolalo obrovský zájem o studium této molekuly a jejích účinků. Překvapením však bylo zjištění, že část obézních pacientů má hodnoty leptinu zvýšeny [4]. Tyto výsledky stejně jako studie na geneticky modifikovaných zvířatech vedly k formulování teorie leptinové rezistence, která je v podstatě analogií teorie inzulinové rezistence. Zjednodušeně lze říci, že podle této (zatím jednoznačně neprokázané) teorie vede trvalý nadměrný přísun potravy k chronickému zvýšení hladin leptinu, na což reaguje organizmus poklesem receptorů a/nebo snížením jejich citlivosti. Konečným důsledkem je snížení odpovědi organizmu na metabolické účinky leptinu. Při vzniku rezistence je k dosažení pocitu nasycení potřeba zvýšit příjem potravy a v metabolizmu převládá tvorba (ukládání) tuku nad jeho odbouráváním. Nadměrný přísun kalorií společně s liponeogezí vede ke vzniku tzv. centrální obezity.
Leptin je však také důležitým kardiovaskulárním hormonem. Svým účinkem na centra autonomního nervového systému v hypotalamu, a velmi pravděpodobně také v mozkovém kmeni, vede k signifikantnímu zvýšení aktivity SANS, provázené vzestupem srdeční frekvence a krevního tlaku. Nárůst hladiny leptinu je spojen také se zvýšenou agregabilitou krevních destiček. Nepřekvapí proto, že zvýšená hladina leptinu byla prokázána jako nezávislý rizikový faktor vzniku kardiovaskulárních onemocnění.
Není jistě bez zajímavosti, že vysoká hladina leptinu byla zjištěna také u pacientů s OSA. Pionýrský výzkum provedl Phillips se spolupracovníky, kteří porovnali hladiny leptinu, aktivity SANS a ročního přírůstku váhy u precizně vybraných dvou skupin jinak zdravých obézních mužů. Obě skupiny se lišily pouze přítomností OSA. Výsledky ukázaly, že skupina obézních s OSA měla výrazně vyšší (přibližně o 50 %) hodnoty leptinu a sympatické aktivity; ještě vyšší byl relativní roční přírůstek váhy ve srovnání s kontrolní skupinou obézních bez spánkové apnoe [25,26]. Následné studie prokázaly, že léčba obstrukční spánkové apnoe pomocí CPAP vede k signifikantnímu snížení hladin leptinu, sympatické aktivity i tělesného (viscerálního) tuku.
Je pravděpodobné, že pro chronické zvýšení hladin leptinu a následný vznik leptinové rezistence je důležitá chronicky zvýšená aktivita sympatického nervového systému, zejména jeho center v hypotalamu. Ta vede k aktivaci hypotalamo-hypofyzární osy, jejímž výsledkem je mj. vzestup hladin kortizolu a následně inzulinu (vztah inzulinu a cirkulujících katecholaminů je diskutován dále).
Bylo prokázáno, že zvýšené hladiny kortizolu i inzulinu vedou k významnému nárůstu syntézy leptinu v adipocytech. Pacienti s obstrukční spánkovou apnoe mají výrazně zvýšené klidové hladiny aktivity SANS i cirkulujících katecholaminů. Nejnovější data ze základního i klinického významu naznačují, že obstrukční spánková apnoe by mohla být velmi důležitou příčinou vzniku leptinové i inzulinové rezistence.
Inzulinová rezistence a OSA
Vzhledem k tomu, že patofyziologie inzulinové rezistence je podrobně diskutována v následujících článcích, zaměříme se pouze na vztah inzulinové rezistence k OSA. Obstrukční spánková apnoe může přispívat ke vzniku inzulinové rezistence 3 faktory: a) zvýšenou produkcí inzulinu; b) snížením počtu inzulinových receptorů; c) snížením citlivosti inzulinových receptorů/postreceptorových mechanizmů v periferních tkáních k metabolickým účinkům inzulinu (zejména v kosterních svalech). Podrobnosti diskutuje oddíl „OSA – obezita – OSA nebo obezita – OSA – obezita?“.
Inzulinová rezistence má nejen závažné metabolické důsledky, jako je hyperglykemie a nadměrný přírůstek váhy (inzulin tlumí lipomobilizaci a odbourávání tuků na volné mastné kyseliny), ale má také řadu negativních kardiovaskulárních účinků. Vysoká hladina inzulinu pravděpodobně přes centrální nervový systém zvyšuje aktivitu SANS s následným zvýšením srdeční frekvence a systémového krevního tlaku (fyziologický význam: urychlení přepravy glukózy do cílových orgánů). Stimulace endoteliálních buněk v systémovém řečišti inzulinem způsobuje za normálních okolností vazodilataci (prostřednictvím uvolnění oxidu dusnatého). Tento regulační ochranný mechanizmus snižuje vazokonstrikci, kterou inzulin navozuje stimulací SANS. V podmínkách inzulinové rezistence však výrazně klesá citlivost endoteliálních buněk vůči inzulinu; snížená produkce oxidu dusnatého endoteliem pak umožní uplatnění SANS navozené vazokonstrikce, čímž vzrůstá systémová vaskulární rezistence.
V současné době již máme dostatek důkazů o tom, že OSA je schopna působit závažné metabolické změny, a to i nezávisle na obezitě. Pacienti s poruchami dýchání během spánku mají signifikantně vyšší hodnoty glukózy, inzulinu a glykozilovaného hemoglobinu, a to nezávisle na tělesné hmotnosti [7,42]. Zásadní studii v tomto směru provedl Punjabi et al z John Hopkins University, kteří sledovali vztah mezi OSA a inzulinovou rezistencí na souboru 150 jinak zdravých mužů s nadváhou nebo lehkou obezitou (průměrný index tělesné hmotnosti 30,5) [27]. Výskyt OSA v této populaci byl 62 % s průměrným apnea/hypopnea indexem 17,4. Mnohočetná regresivní analýza prokázala, že již velmi mírná OSA (apnea/hypopnea index ≥ 5) byla v této populaci spojena jak s významnou poruchou glukózové tolerance, tak i signifikantní inzulinovou rezistencí, a to nezávisle na stupni obezity (indexu tělesné hmotnosti a procentu tělesného tuku). Neméně důležitým zjištěním této studie je poznatek, že závažnost poruchy glukózové tolerance i inzulinové senzitivity významně souvisí s poklesem saturace kyslíkem během apnoických pauz. Byla tak vůbec poprvé prokázána jasná závislost dávky a účinku mezi stupněm poruchy dýchání ve spánku a závažností inzulinové rezistence. Další studie dospěly k podobným výsledkům [10]. Prokázaly navíc, že OSA způsobuje inzulinovou rezistenci i nezávisle na typu obezity (waist/hip ratio). Těsný vztah mezi OSA a inzulinovou rezistencí byl prokázán i u jedinců s normálními hodnotami BMI [40]. Je pravděpodobné, že u afroamerického etnika může OSA způsobovat ještě výraznější změny v glukózové toleranci a inzulinové senzitivitě než u bělochů. Léčba OSA pomocí CPAP vede k velmi rychlému signifikantnímu zlepšení inzulinové rezistence [8a].
OSA – obezita – OSA nebo obezita – OSA – obezita?
Je obtížné určit, zda-li je spánková apnoe příčinou či důsledkem obezity. Obě vazby jsou možné, přičemž vztah příčiny a důsledku je zřejmě individuální a pravděpodobně souvisí jak s genetickou výbavou jedince, tak i s jeho životním stylem.
OSA má v běžné populaci vysokou prevalenci a vyskytuje se u obézních i u jedinců s normálním indexem tělesné hmotnosti. Pokud není úspěšně léčena, vede u obou skupin k výraznému váhovému přírůstku.
Obezita je považována za hlavní rizikový faktor pro vznik OSA. Těsné vztahy mezi OSA a obezitou potvrzují i data z populačních studií, které ukazují, že přibližně 40 % obézních pacientů má OSA [43] a asi 70 % pacientů s OSA je obézních [46]. Navíc nárůst hmotnosti o 10 % zvyšuje 6násobně riziko vzniku OSA v budoucnu [24]. Platí i obrácená závislost – snížení hmotnosti je spojeno se snížením výskytu OSA [24]. Navíc účinná léčba OSA pomocí CPAP je spojena se signifikantním poklesem celkového i viscerálního tuku [2].
OSA – obezita – OSA
Mechanizmus, kterým může OSA vyvolat vznik a progresi obezity, nebyl zatím zcela objasněn. Předpokládáme následující model: vysoká aktivita SANS, která je typická pro OSA, vede ke stimulaci hypotalamo-hypofyzární osy. Bylo prokázáno, že u pacientů s OSA produkuje přední lalok hypofýzy po stimulaci kortikotropinem signifikantně vyšší množství ACTH než u kontrol [18]. Následně uvolněný kortizol může stimulovat tvorbu inzulinu (a také cirkulujících katecholaminů). Kortizol také významně snižuje počet periferních receptorů pro inzulin a pravděpodobně i jejich citlivost. V zájmu objektivnosti je však nutno podotknout, že stanovení hladin kortizolu u pacientů s OSA zatím neposkytuje jednoznačné výsledky. Některé studie prokázaly signifikantně vyšší hladiny, jiné dokumentují normální hodnoty. V této oblasti je nutné provést další výzkum, včetně stanovení 24hodinového profilu.
Pacienti s OSA mají rovněž signifikantně zvýšené hladiny cirkulujících katecholaminů [5,19]. Plazmatický adrenalin indukuje uvolnění inzulinu z pankreatu stimulací beta2-adrenergních receptorů. V rozvoji inzulinové rezistence bývá často podceňován účinek cirkulujících katecholaminů na játra, kde stimulují jednak glykogenolýzu, a současně indukují glukoneogenezi (zejména z laktátu a aminokyselin). Oba mechanizmy signifikantně zvyšují plazmatické hladiny glukózy, jenž obratem stimuluje uvolnění inzulinu (viz dále).
Obstrukční spánková apnoe vede také k výraznému narušení architektury spánku (opakovaná mikroprobuzení), což způsobuje chronickou spánkovou deprivaci. Ta vede k indukci typického agresivního sacharidového (karbohydrátového) hladu (který zná dobře i většina lékařů po těžkých nočních službách), čímž se bludný kruh uzavírá. Indukce sacharidového hladu (excesivní hyperfagie s touhou po jídle s vysokým obsahem cukrů jako rychlém zdroji energie) je pravděpodobně dána zvýšenou hladinou cirkulujících katecholaminů. Spánková deprivace způsobená OSA vede k vyššímu uvolnění cirkulujících katecholaminů než deprivace způsobená jinými mechanizmy. Sacharidový hlad zvyšuje absolutní i relativní přísun cukrů do organizmu. Zvýšení hladiny plazmatické glukózy je hlavním a nejsilnějším stimulem pro sekreci inzulinu. To je další mechanizmus, kterým OSA přispívá ke vzniku inzulinové rezistence.
Chronická spánková deprivace je rovněž spojena se změnou životního stylu, charakterizovaného denní somnolencí, únavou a poklesem fyzické aktivity. Zvýšený přísun kalorií společně s pohybovou inaktivitou dále prohlubují neurohumorální, metabolickou a energetickou rozkladu organizmu.
Chronicky zvýšené hladiny inzulinu společně s odchylkami jeho receptorů způsobují vznik inzulinové rezistence. Inzulin společně s kortizolem podporují syntézu a uvolnění leptinu. Dlouhodobě zvýšené hladiny leptinu způsobují leptinovou rezistenci: ta způsobuje další progresi změn vyvolaných inzulinovou rezistencí. Leptinová rezistence typicky vede k poruše regulace příjmu potravy (zvýšený kalorický přísun) a k liponeogenezi zejména ve viscerální oblasti, což může vést ke vzniku a rozvoji centrální obezity. Inzulin i leptin zvyšují aktivitu sympatiku, čímž dochází ke vzniku pozitivní zpětné vazby a vzniku bludného kruhu.
Nárůst tělesné hmotnosti způsobuje progresi OSA, čímž vzniká pozitivní zpětná vazba vyššího řádu.
Obezita – OSA – obezita
Mechanizmy, kterými obezita přispívá ke vzniku/progresi spánkové apnoe, nejsou rovněž zcela známé. Mohou být spojeny s účinkem tvorby tuku na anatomii dýchacích cest. Bylo prokázáno, že snížení tělesné hmotnosti je u pacientů s OSA spojeno se vzestupem odolnosti horních dýchacích cest vůči kolapsu (zúžení až uzávěru). Pokud je obezita provázena zvýšenými hladinami leptinu, může se uplatnit jeho efekt na činnost chemoreflexu, a tím řízení dýchání. Protože vysoké hladiny leptinu jsou spojeny s autonomní dysbalancí, může svoji roli hrát i porucha autonomní regulace tonu svalstva horních cest dýchacích během spánku.
Souhrnně lze říci, že OSA se může výrazně podílet jak na vzniku, tak i na rozvoji centrální obezity. Zvýšení hladin všech 3 hormonů, které hrají klíčovou roli v udržování energetické rovnováhy organizmu (inzulin, leptin a adrenalin) spojené s těžkou dysfunkcí jejich receptorů, může vést až ke vzniku tzv. rezistentní obezity. Jak již bylo diskutováno, účinná léčba OSA pomocí CPAP vede k signifikantnímu snížení hladin cirkulujících katecholaminů, leptinu, hmotnosti i množství viscerálního tuku.
Zánětlivá reakce organizmu a OSA
Zánětlivá reakce organizmu hraje pravděpodobně důležitou roli v patofyziologii kardiovaskulárních onemocnění, zejména ischemické choroby srdeční a chronického srdečního selhání. Alarmující řadou narůstají důkazy o tom, že zánětlivý marker C-reaktivní protein (CRP) je důležitým ukazatelem kardiovaskulárního rizika a je prognostickým faktorem výskytu komplikací u pacientů s metabolickým syndromem, akutní ischemickou chorobou srdeční, stabilní anginou pectoris a anamnézou infarktu myokardu [12,28,29,30,31]. Zvýšená hodnota CRP je také silným prediktorem rizika kardiovaskulárních onemocnění u jinak zdravých osob [28]. CRP hraje důležitou roli v patofyziologii aterosklerózy, a to zejména pomocí těchto mechanizmů: inhibice syntézy oxidu dusnatého, zvýšená produkce adhezivních molekul, zvýšení hladin PAI-1 (plasminogen activator inhibitor-1), aktivací proliferace cévních hladkých svalových buněk a přímým prozánětlivým působením na endoteliální buňky. Naše skupina prokázala, že pacienti s OSA bez dalších známých onemocnění mají signifikantně zvýšené hladiny CRP ve srovnání se souborem kontrol stejného věku, pohlaví a indexu tělesné hmotnosti [36]. Přímý proinflamační účinek OSA je důležitým momentem, který umožňuje mj. vysvětlit prokázanou souvislost mezi OSA a zvýšeným rizikem vzniku a progrese akutních i chronických forem ischemické choroby srdeční. Zjistili jsme také, že existuje nezávislá asociace mezi hladinami CRP a leptinu, což naznačuje další možný vztah mezi zánětlivými a metabolickými mechanizmy kardiovaskulárních onemocnění [36a].
Další náš výzkum ukázal, že pacienti s OSA mají signifikantně zvýšené hodnoty i dalšího zánětlivého markeru organizmu, kterým je sérový amyloid A [39a]. Sérový amyloid A je u člověka jedním z nejdůležitějších proteinů akutní fáze zánětlivé reakce organizmu. Je tvořen predominantně v játrech a secernován jako hlavní součást apolipoproteinového spektra HDL-částic. Syntéza amyloidu A je stimulována zánětlivými cytokiny, včetně interleukinu 1 a 6. Zvýšení hladiny sérového amyloidu A bylo prokázáno jako rizikový marker ischemické choroby srdeční.
Koagulace
Předpokládá se, že alespoň část pacientů MS má zvýšené parametry krevní koagulace, což je spojeno se zvýšeným rizikem aterosklerózy a trombotických příhod.
Významné odchylky koagulace byly prokázány i u pacientů s obstrukční spánkovou apnoe. OSA vede ke zvýšené agregabilitě krevních destiček [34]. Pravděpodobnou hlavní příčinou je zvýšená hladina cirkulujících katecholaminů jako důsledek noční hypoxie [6]. Uplatnit se však může i vliv kortizolu a leptinu. U pacientů s OSA byly rovněž prokázány zvýšené hodnoty hematokritu, krevní viskozity, fibrinogenu a aktivity faktoru VII, jenž dále prohlubují riziko vzniku aterosklerózy a trombotických komplikací. Přinejmenším část těchto odchylek může být normalizována pomocí léčby CPAP, což naznačuje, že OSA je přímo spojena se zvýšenou srážlivostí krve.
Další účinky obstrukční spánkové apnoe
Minimálně část pacientů s metabolickým syndromem trpí poruchami potence. V současné době již existují důkazy o tom, že obstrukční spánková apnoe může hrát významnou roli v patofyziologii erektilní dysfunkce, a to zejména díky silnému negativnímu vlivu OSA na proces syntézy a uvolňování pohlavních hormonů a autonomní řízení krevního oběhu. O této problematice jsou již dostupné informace i v českém písemnictví [26a, 26b].
Souhrn
Prevalence OSA je v běžné populaci velmi vysoká; jen v USA se vyskytuje asi u 15 milionů Američanů [9]. Naprostá většina OSA není diagnostikována [47]. Obstrukční spánková apnoe vede k výraznému chronickému vzestupu aktivity sympatiku, jenž následně narušuje krátko–, středně - i dlouhodobé regulační mechanizmy krevního tlaku. Výsledkem je hypertenze (denní i noční), zvýšená srdeční frekvence, snížená variabilita srdeční frekvence a baroreflexní senzitivita srdeční frekvence, zvýšená variabilita krevního tlaku a narušení renálních regulačních mechanizmů TK. Sympatikem indukovaná aktivace hypotalamo–hypofyzární osy společně se zvýšenou hladinou cirkulujících katecholaminů vyvolává vznik leptinové a inzulinové rezistence s následným rozvojem obezity a poruchou metabolizmu lipidů. OSA má také důležité proinflamační a protrombotické účinky. OSA tak indukuje stav identický s obrazem rozvinutého metabolického syndromu se všemi negativními důsledky pro organizmus. Kombinace obstrukční spánkové apnoe se znaky typickými pro MS je proto některými autory označována jako syndrom Z [44]. Těsnou souvislost mezi OSA a metabolickým kardiovaskulárním syndromem znázorňuje schéma.
Schéma. Obstrukční spánková apnoe (OSA) a metabolický syndrom (MS) sdílejí řadu regulačních a metabolických abnormalit. Tato podobnost, společně s vysokým výskytem obou nozologických jednotek v populaci, dovoluje předpokládat důležitou roli OSA v patofyziologii metabolického syndromu. 
Je možné, že pouze obezita, která vzniká na podkladě OSA, anebo obezita, která vede ke vzniku OSA, je spojena s vysokou aktivitou sympatiku. Pokud není OSA přítomna, může být aktivita sympatiku normální, nebo dokonce snížená. OSA tak pravděpodobně představuje klíčovou spojnici mezi zvýšenou aktivitou sympatiku a MS.
Nové výzkumy také ukazují, že OSA může hrát důležitou roli i v patofyziologii dalších nozologických jednotek, které jsou blízké MS, jako je například deprese nebo erektilní dysfunkce.
Závěr
OSA může pravděpodobně být důležitou příčinou metabolického syndromu. Klíčovým mechanizmem rozvoje MS u pacientů s obstrukční spánkovou apnoe je zřejmě chronicky zvýšená aktivita SANS a cirkulujících katecholaminů. OSA i přes svoji vysokou prevalenci tvoří zcela podhodnocený fenomén ve výzkumu, diagnostice a léčbě kardiovaskulárních i metabolických onemocnění, a to i přes to, že pacienti s OSA tvoří skupinu s vysokým rizikem vzniku a progrese těchto onemocnění. Z logických důvodů se proto v USA spánkové laboratoře začínají stávat nedílnou součástí moderních kardiologických pracovišť. Tento trend jistě brzy ovlivní i koncepci evropských kardiologických klinik a pracovišť zabývajících se výzkumem, diagnostikou a léčbou metabolického syndromu.
MUDr. Tomáš Kára, Ph.D.
www.mayoclinic.org/rochester
e-mail: kara.tomas@mayo.edn
Doručeno do redakce: 3. 1. 2004
Přijato po recenzi: 15. 7. 2004
Zdroje
1. Bray GA, York DA, Fisler JS. Experimental obesity: a homeostatic failure due to defective nutrient stimulation of the sympathetic nervous system. Vitam Horm 1989; 45 : 1–125.
2. Chin K, Shimizu K, Nakamura T et al. Changes in intra-abdominal visceral fat and serum leptin levels in patients with obstructive sleep apnea syndrome following nasal continuous positive airway pressure therapy. Circulation 1999; 100(7): 706–712.
3. Chobanian AV, Bakris GL, Black HR et al. The Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure: the JNC 7 report. JAMA 2003; 289 (19): 2560–2572.
4. Considine RV, Sinha MK, Heiman ML et al. Serum immunoreactive-leptin concentrations in normal-weight and obese humans. N Engl J Med 1996; 334(5): 292–295.
5. Dimsdale JE, Coy T, Ziegler MG et al. The effect of sleep apnea on plasma and urinary catecholamines. Sleep 1995; 18(5): 377–381.
6. Eisensehr I, Ehrenberg BL, Noachtar S et al. Platelet activation, epinephrine, and blood pressure in obstructive sleep apnea syndrome. Neurology 1998; 51(1): 188–195.
7. Elmasry A, Lindberg E, Berne C et al. Sleep-disordered breathing and glucose metabolism in hypertensive men: a population – based study. J Intern Med 2001; 249(2): 153–161.
8. Grassi G, Seravalle G, Cattaneo BM et al. Sympathetic activation in obese normotensive subjects. Hypertension 1995; 25(4 Pt 1): 560–563.
8a. Harsch IA, Schahin, SP, Radespiel - Troger M et al. Continuous positive airway pressure treatment rapidly improves insulin sensitivity in patient with obstructive sleep aponea syndrome. Am J Respir Crit Care Med 2004; 169(2): 156–162.
9. Holden C. Wake–up call for sleep research. Science 1993; 259(5093): 305.
10. Ip MS, Lam B, Ng MM et al. Obstructive sleep apnea is independently associated with insulin resistance. Am J Respir Crit Care Med 2002; 165(5): 670–676.
11. Jenšovský J. Kardiovaskulární důsledky neurohumorální odpovědi na stres. Kardiol Rev 1999; 2 : 63–66.
12. Jialal I, Devaraj S. Role of C–reactive protein in the assessment of cardiovascular risk. Am J Cardiol 2003; 91(2): 200–202.
13. Kára T, Souček M. Autonomní nervový systém. In: Souček M, Kára T. Klinická patofyziologie hypertenze. Praha: Grada 2002 : 37–99.
14. Kára, T, Souček M. Společné působení patofyziologických faktorů při vzniku esenciální arteriální hypertenze. In: Souček, M, Kára T. Klinická patofyziologie hypertenze. Praha: Grada Publishing 2002 : 290–309.
15. Kára T, Souček M, Jurák P et al. Regulační mechanizmy krevního tlaku. In: Souček M, Kára T. Klinická patofyziologie hypertenze. Praha: Grada 2002 : 235–289.
16. Kára T, Souček M, Orban M. Ostatní humorální regulační faktory. In: Souček M, Kára T. Klinická patofyziologie hypertenze. Praha: Grada , 2002, 154–189
17. Kuczmarski RJ, Flegal KM. Criteria for definition of overweight in transition: background and recommendations for the United States. Am J Clin Nutr 2000; 72(5): 1074–1081.
18. Lanfranco F, Gianotti L, Pivetti S et al. Obese patients with obstructive sleep apnoea syndrome show a peculiar alteration of the corticotroph but not of the thyrotroph and lactotroph function. Clin Endocrinol (Oxf) 2004; 60(1): 41–48.
19. Marrone O, Riccobono L, Salvaggio A et al. Catecholamines and blood pressure in obstructive sleep apnea syndrome. Chest 1993; 103(3): 722–727.
20. Moráň M, Siegelová J, Kadaňka Z. Circadian variability of blood pressure and heart rate in patients with sleep apnoea syndrome. Česk Slov Neurol 2000; 63 : 147–151.
21. Narkiewicz K, Kato M, Phillips BG et al. Nocturnal continuous positive airway pressure decreases daytime sympathetic traffic in obstructive sleep apnea. Circulation 1999; 100(23): 2332–2335.
22. Narkiewicz K, Montano N, Cogliati C et al. Altered cardiovascular variability in obstructive sleep apnea. Circulation 1998; 98(11): 1071–1077.
23. Narkiewicz K, van de Borne PJ, Cooley RL et al. Sympathetic activity in obese subjects with and without obstructive sleep apnea. Circulation 1998; 98(8): 772–776.
24. Peppard PE, Young T, Palta M et al. Longitudinal study of moderate weight change and sleep-disordered breathing. JAMA 2000; 284(23): 3015–3021.
25. Phillips BG, Hisel TM, Kato M et al. Recent weight gain in patients with newly diagnosed obstructive sleep apnea. J Hypertens 1999; 17(9): 1297–1300.
26. Phillips BG, Kato M, Narkiewicz K et al. Increases in leptin levels, sympathetic drive, and weight gain in obstructive sleep apnea. Am J Physiol Heart Circ Physiol 2000; 279(1): H234–H237.
26a. Pohanka M, Kaňovský P. Nové pohledy na patofyziologii erektilní dysfunkce. Vnitř. Lék., v tisku.
26b. Pohanka M, Kaňovský P. Erectile Dysfunction and Obstructive Sleep Apnea. Scripta Medica, v tisku.
27. Punjabi NM, Sorkin JD, Katzel LI et al. Sleep-disordered breathing and insulin resistance in middle–aged and overweight men. Am J Respir Crit Care Med 2002; 165(5): 677–682.
28. Ridker PM. High-sensitivity C-reactive protein: potential adjunct for global risk assessment in the primary prevention of cardiovascular disease. Circulation 2001; 103(13): 1813–1818.
29. Ridker PM. Clinical application of C-reactive protein for cardiovascular disease detection and prevention. Circulation 2003; 107(3): 363–369.
30. Ridker PM, Buring JE, Cook NR et al. C-reactive protein, the metabolic syndrome, and risk of incident cardiovascular events: an 8-year follow-up of 14 719 initially healthy American women. Circulation
2003; 107(3): 391–397.
31. Ridker PM, Rifai N, Pfeffer MA et al. Long-term effects of pravastatin on plasma concentration of C-reactive protein. The Cholesterol and Recurrent Events (CARE) Investigators. Circulation 1999; 100(3): 230–235.
32. Rosolová H. Sympatický nervový systém a kardiovaskulární riziko. Praha: Maxdorf Jesenius 2000.
33. Rumantir MS, Vaz M, Jennings GL et al. Neural mechanisms in human obesity–related hypertension. J Hypertens 1999; 17(8): 1125–1133.
34. Sanner BM, Konermann M, Tepel Met al. Platelet function in patients with obstructive sleep apnoea syndrome. Eur Respir J 2000; 16(4): 648–652.
35. Scherrer U, Randin D, Tappy L et al. Body fat and sympathetic nerve activity in healthy subjects. Circulation 1994; 89(6): 2634–2640.
36. Shamsuzzaman AS, Winnicki M, Lanfranchi P et al. Elevated C–reactive protein in patients with obstructive sleep apnea. Circulation 2002; 105(21): 2462–2464.
36a. Shamsuzzaman AS, Winnicki M, Wolk R et al. Independent association between plasma leptin and C–reactive protein in healthy humans. Circulation 2004; 109(18): 2181–2185.
37. Somers VK, Dyken ME, Clary MP et al. Sympathetic neural mechanisms in obstructive sleep apnea. J Clin Invest 1995; 96(4): 1897–1904.
38. Souček M, Kára T. Stresem indukovaná hypertenze a diabetes mellitus. Vnitř Lék 2001; 47(5): 315–319.
39. Spraul M, Ravussin E, Fontvieille AM et al. Reduced sympathetic nervous activity. A potential mechanism predisposing to body weight gain. J Clin Invest 1993; 92(4): 1730–1735.
39a. Svatikova A, Wolk R, Shamsuzzaman AS et al. Serum amyloid a in obstructive sleep apnea. Circulation 2003; 108(12): 1451–1454.
40. Tassone F, Lanfranco F, Gianotti L et al. Obstructive sleep apnoea syndrome impairs insulin sensitivity independently of anthropometric variables. Clin Endocrinol (Oxf) 2003; 59(3): 374–379.
41. Tishler PV, Larkin EK, Schluchter MD et al. Incidence of sleep–disordered breathing in an urban adult population: the relative importance of risk factors in the development of sleep-disordered breathing. JAMA 2003; 289(17): 2230–2237.
42. Vgontzas AN, Papanicolaou DA, Bixler EO et al. Sleep apnea and daytime sleepiness and fatigue: relation to visceral obesity, insulin resistance, and hypercytokinemia. J Clin Endocrinol Metab
2000; 85(3): 1151–1158.
43. Vgontzas AN, Tan TL, Bixler EO et al. Sleep apnea and sleep disruption in obese patients. Arch Intern Med 1994; 154(15): 1705–1711.
44. Wilcox I, McNamara SG, Collins FL et al. „Syndrome Z“: the interaction of sleep apnoea, vascular risk factors and heart disease. Thorax 1998; 53 (Suppl 3): S25–S28.
45. Wolk R, Kara T, Somers VK. Sleep-disordered breathing and cardiovascular disease. Circulation 2003; 108(1): 9–12.
46. Wolk R, Shamsuzzaman AS, Somers VK. Obesity, sleep apnea, and hypertension. Hypertension 2003; 42(6): 1067–1074.
47. Young T, Palta M, Dempsey J et al. The occurrence of sleep-disordered breathing among middle-aged adults. N Engl J Med 1993; 328(17): 1230–1235.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Slovo nakladateleČlánek Odkaz sira Williama OsleraČlánek Jan Lebl, Štěpánka Průhová et al. Abeceda diabetu. Příručka pro děti, mladé dospělé a jejich rodičeČlánek MyokarditidyČlánek ÚvodníkČlánek Hypertenze a hyperurikemie
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2005 Číslo 1- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Slovo nakladatele
- Jaterní postižení při deficitu alfa−1−antitrypsinu
- Akutní myokarditida manifestující se obrazem transmurálního infarktu myokardu provázená akutním renálním selháním
- Význam centralizace péče o nemocné s akutním krvácením do horní části trávicího traktu
- Za profesorem MUDr. Stanislavem Havelkou
- Otevřený dopis Jiřímu Vorlíčkovi
- Bioekvivalenční studie s novými antihypertenzivy
- Komentář k Doporučení American Heart Association/American College of Cardiology Foundation pro léčbu warfarinem
- Odkaz sira Williama Oslera
- Jan Lebl, Štěpánka Průhová et al. Abeceda diabetu. Příručka pro děti, mladé dospělé a jejich rodiče
- Jiří Vítovec, Jindřich Špinar et al. Farmakoterapie kardiovaskulárních onemocnění
- Petr Cetkovský et al. Intenzivní péče v hematologii
- Individuální výběr nemocných pro silový trénink po akutním infarktu myokardu se sníženou ejekční frakcí levé komory
- Viktor Chrobok, Jaromír Astl, Pavel Komínek et al. Tracheostomie a koniotomie, techniky, komplikace a ošetřovatelská péče
- Anna Jedličková. Antimikrobiální terapie v každodenní praxi
- David Cibula, Luboslav Stárka, Jana Vrbíková et al. Syndrom polycystických ovarií
- Tomáš Skalický, Vladislav Třeška, Jiří Šanjdauf et al. Chirurgie jater
- Zpráva o kurzu Hot topics in internal medicine, Alicante, Španělsko, 16.–22. 10. 2004
- Myokarditidy
- Myelodysplastický syndrom v novém tisíciletí. Jak klasifikovat a jak léčit nemocné?
- Efekt a tolerancia kombinovanej liečby fludarabinom s cyklofosfamidom u chorých s chronickou lymfocytovou leukémiou
- Naše zkušenosti s novou organizací péče o nemocné s akutním krvácením do horní části trávicího traktu
- Silový trénink u nemocných po akutním infarktu myokardu se sníženou ejekční frakcí levé komory srdeční
- Úvod do problematiky metabolického syndromu
- Metabolický syndrom a sympatický nervový systém: je obstrukční spánková apnoe klíčem k pochopení?
- Diabetes mellitus a metabolický syndrom
- Hypertenze jako součást metabolického syndromu
- Úvodník
- Obezita a metabolický syndrom
- Dyslipidemie u metabolického syndromu
- Hypertenze a hyperurikemie
- Role pohybové léčby a tělesné zdatnosti v prevenci a léčbě metabolického syndromu
- Akutní infarkt myokardu u pacienta s anamnézou infekční endokarditidy
- Extramedulární plazmocytom štítné žlázy - vzácná příčina solitární uzlové strumy s hypertyreózou
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Jaterní postižení při deficitu alfa−1−antitrypsinu
- Myelodysplastický syndrom v novém tisíciletí. Jak klasifikovat a jak léčit nemocné?
- Hypertenze a hyperurikemie
- Myokarditidy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



