-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Léčba symptomatické intermitentní fibrilace síní katetrovou ablací v levé srdeční síni. Bezprostřední a dlouhodobé výsledky u 150 pacientů
Treatment of symptomatic intermitent atrial fibrillation with catheter ablation in the left atrium: Immediate and long-term results in 150 patients
Catheter ablation has been establishing as a routine curative method of atrial fibrillation. Immediate and long-term results of catheter ablation employing method of pulmonary vein isolation using conventional or electroanatomic mapping in patients with intermitent atrial firillation are presented. Patients and methods: Ablation was performed in 150 patients (26 females), aged 52.4 plusmin 10.7 years, in 173 procedures. Results: During the initial ablation procedure in the first 110 patients, full pulmonary vein isolation was achieved in 358 (96%) of 372 target pulmonary veins. In 286 (77%) out of these 372 pulmonary veins, investigated angiografically before and after the isolation, mean narrowing from 12.6 plusmin 2.7 to 12.1 plusmin 2.8 mm was measured. Asymptomatic ostial narrowing, ranging between 25 až 50%, occurred in 16 (5.6%) of pulmonary veins. In the subsequent 40 patients, full isolation was achieved in all 160 pulmonary veins, and in none of them ostial stenosis and turbulent flow were found one month after the ablation during transesophageal echocardiographic examination. Twenty-two patients (15%) underwent a second and one patient a third ablation.Complication (embolic stroke resulting in hemianopsia) occurred in one (0.06%) out of 173 procedures. The mean follow-up period was 15.9 plusmin 10.3 months. First 110 patients had the folow-up period of 9-40 months and the following 40 patients had follow-up period of 1-6 month after ablation. Among the first 110 patients, 77%, 82%, 83%, 83%, 86%, resp. 89% patients were free of atrial fibrillation at 3rd, 6th, 9th, 12th and 18th month after ablation and the clinical benefit, ie. elimination of clinically significant atrial fibrillation was achieved in 85%, 89%, 91%, 93%, 92%, resp. 89% of the patients. In the last 40 patients, elimination of atrial fibrillation and clinical benefit at months 3 and 6 were achieved in 91% resp. 100% patients. Ablation was associated with a significant reduction of antiarhythmic and anticoagulation medication. Conclusion: Catheter ablation of intermitent atrial fibrillation in patients without major structural heart disease, based on full isolation of all pulmonary veins, is highly effective and relatively safe. Although technology and ablation strategies continuously evolve, ablation of atrial fibrillation can be currently considered a routine curative method.
Key words:
intermitent atrial fibrillation - catheter ablation - pulmonary vein isolation
Autoři: M. Fiala 1,2; J. Chovančík 1; P. Heinc 2; R. Neuwirth 1; I. Nykl 1; R. Nevřalová 1; M. Branny 1
Působiště autorů: Kardiocentrum Nemocnice Podlesí, Třinec, přednosta prim MUDr. Marian Branny 1; I. interní klinika Lékařské fakulty UP a FN, Olomouc, přednosta prof. MUDr. Jan Lukl, CSc. 2
Vyšlo v časopise: Vnitř Lék 2005; 51(9): 971-983
Kategorie: Původní práce
Souhrn
Katetrová ablace se stává rutinní léčbou fibrilace síní. Jsou prezentovány bezprostřední a dlouhodobé výsledky ablace metodou izolace plicních žil konvečně nebo pomocí elektroanatomického mapování u nemocných s intermitentní fibrilací síní.
Soubor nemocných a metodika:
Ablace byla provedena ve 173 výkonech u 150 pacientů (26 žen) průměrného věku 52,4 plusmin 10,7 let.Výsledky:
Při prvním výkonu bylo u prvních 110 pacientů docíleno úplné izolace u 358 (96 %) ze 372 cílených plicních žil. U 286 (77 %) z těchto 372 plicních žil, které byly vyšetřeny angiograficky před a po izolaci, došlo k zúžení jejich ústí ze 12,6 plusmin 2,7 na 12,1 plusmin 2,8 mm. Asymptomatické zúžení ústí v rozmezí 25 až 50 % se vyskytlo u 16 (5,6 %) plicních žil. U následujících 40 pacientů bylo dosaženo úplné izolace u všech 160 plicních žil a u žádné z nich nebyl zjištěn vznik stenózy ústí a turbulentního proudění při transezofageální echokardiografii 1 měsíc po ablaci. 22 pacientů (15 %) podstoupilo 2. a 1 pacient 3. ablaci. Komplikace (embolická příhoda do CNS s hemianopsií) se vyskytla při jednom (0,06 %) ze 173 výkonů. Pacienti jsou sledováni po dobu 15,9 plusmin 10,3 měsíců. Prvních 110 pacientů je sledováno 9 až 40 měsíců a následujících 40 pacientů je sledováno 1-6 měsíců po ablaci. U prvních 110 pacientů se ve 3., 6., 9. 12. a 18. měsíci sledování neobjevila recidiva fibrilace síní u 77 %, 82 %, 83 %, 83 %, 86 %, resp. 89 % pacientů a klinického benefitu, tj. odstranění klinicky významné fibrilace síní, bylo dosaženo u 85 %, 89 %, 91 %, 93 %, 92 %, resp. 89 % pacientů. U následujících 40 pacientů se klinický benefit bez recidivy fibrilace síní dostavil ve 3. a 6. měsíci sledování u 91 % resp. 100 % nemocných. Ablace byla spojena s významnou redukcí antiarytmické a antikoagulační léčby.Závěr:
Katetrová ablace intermitentní fibrilace síní u pacientů bez významného strukturálního postižení srdce, jejímž základem je úplná izolace plicních žil, je vysoce účinná a relativně bezpečná. Přestože se technologie i ablační strategie stále vyvíjejí, lze ablaci pro fibrilaci síní již v současné době zařadit mezi rutinní léčebné metody.Klíčová slova:
intermitentní fibrilace síní - katetrová ablace - izolace plicních žilÚvod
Katetrová ablace v levé srdeční síni se v současnosti stává rutinní metodou léčby intermitentní i permanentní fibrilace síní. Ablační strategie se postupně rozvíjela od modifikace arytmogenního substrátu pomocí lineárních lézí [3,9,13] přes prostou izolaci plicních žil s eliminací spouštěcí ektopické aktivity [5] až po kombinaci obou postupů pomocí obkružujících lézí kolem plicních žil a lineárních lézí v levé srdeční síni [16]. Katetrová ablace se pro fibrilaci síní jeví jako metoda, která ve srovnání s medikamentózní léčbou zaměřenou na udržení sinusového rytmu přináší významné snížení morbidity a mortality a zlepšení kvality života [15].
V uvedeném souboru pacientů byla použita ablační strategie, jejímž základem byla ve všech případech izolace plicních žil, hodnocená konvečně přímým mapováním elektrické aktivity uvnitř plicní žíly. Samotná katetrová ablace byla provedena buď konvečně, tj. pouze podle snímaných elektrických signálů pod skiaskopickou kontrolou, nebo za pomocí elektroanatomické navigace. Srovnání obou metod není předmětem tohoto sdělení.
Cílem sdělení je prezentace souhrnné bezprostřední účinnosti a bezpečnosti metody, jejímž společným základním cílovým momentem byla jednotně hodnocená izolace plicních žil. Jsou také prezentovány výsledky dlouhodobého klinického sledování při použití této metody u pacientů s intermitentní fibrilací síní, kteří neměli výraznější strukturální postižení srdce.
Soubor nemocných a metodika
Soubor nemocných
Katetrovou ablaci s izolací plicních žil pro intermitentní fibrilaci síní podstoupilo celkem 150 pacientů (26 žen) průměrného věku 52,4 plusmin 10,7 (21-74) let. Pacienti měli záchvat symptomatické fibrilace síní nejméně 1krát měsíčně, ale většinou několikrát týdně až denně. Arytmie se ve většině případů vyskytovala dlouhodobě a byla rezistentní na nejméně 2 antiarytmika I. a III. třídy. Amiodaron před ablací užívalo 88 (59 %) pacientů, ale u mnoha z nich byl tento lék již dříve pro neúčinnost nebo závažné vedlejší účinky vysazen, takže bezprostředně před ablací jej užívalo 47 (31 %) pacientů. V souboru nebyli zařazeni pacienti s výraznějším strukturálním postižením srdce (podrobnosti jsou uvedeny v tab. 1) a také pacienti, u nichž byla katetrová ablace provedena pro permanentí (chronickou) fibrilaci síní. Indikace ke katetrové ablaci dále zohledňovala nevýhody trvalé antikoagulační léčby a přítomnost jiných zdravotních stavů, zaměstnání nebo např. sportovních aktivit, při nichž antikoagulační léčba nebyla vhodná. 30 pacientů podstoupilo v minulosti katerovou ablaci pro flutter síní I. typu a u 8 pacientů byla dříve provedena katetrová ablace pro fibrilaci síní metodou lineárních lézí v pravé srdeční síni.
Tab. 1. Základní klinické údaje o nemocných. 
Prvních 110 pacientů podstoupilo katetrovou ablaci konvenčním způsobem nebo pomocí elektroanatomického mapování a navigace. V tomto období byly získány vlastní zkušenosti, na jejichž základě byly vytvořeny jednotné pracovní postupy a ablační strategie, které byly použity u dalších 40 pacientů a budou používány a rozvíjeny i nadále. Od roku 2001 do roku 2003 byly výkony prováděny na I. interní klinice LF UP a FN Olomouc, od roku 2003 současně a od roku 2004 výlučně v Kardiocentru Nemocnice Podlesí, Třinec.
Elektrofyziologické vyšetření a katetrová ablace
K elektrofyziologickému vyšetření byly žilními vstupy zavedeny 3 katétry. Pokud měl pacient sinusový rytmus, bylo v úvodu provedeno standardní elektrofyziologické vyšetření. Jestliže měl pacient v úvodu vyšetření fibrilaci síní, do září roku 2002 se prováděla elektrická kardioverze fibrilace síní na sinusový rytmus, zatímco po tomto datu byl výkon započat přímo ablací v levé srdeční síni a elektrofyziologické vyšetření se provedlo po znovunastolení sinusového rytmu až na konci vyšetření. Ablace reentry okruhu pro flutter síní I. typu se zpočátku prováděla tehdy, jestliže byl flutter síní dokumentován nebo vyvolán při elektrofyziologickém vyšetření. Později se stala rutinní součástí vyšetření.
Do poloviny roku 2003 se standardně prováděla angiografie pravé a levé větve plicní arterie a v žilní fázi byly zobrazeny plicní žíly, levá síň, levá komora a aorta, později byla tato část výkonu vypuštěna. Dalším krokem výkonu byla výměna 2 krátkých zaváděcích pouzder za dlouhá transseptální pouzdra, která byla společně s katétry zavedena po dvojité transseptální punkci do levé srdeční síně.
Následovalo provedení přímé angiografie všech dostupných plicních žil (obr. 1A), a kdykoli to bylo technicky a s ohledem na skiaskopický čas a délku výkonu možné, po dokončení izolace se provedla kontrolní angiografie cílených žil. Od března roku 2004 se kontrolní přímá angiografie neprováděla vzhledem k výlučnému používání elektroanatomicky navigované ablace a na základě zkušenosti, že riziko vzniku stenózy plicní žíly při tomto přístupu je minimální.
Obr. 1. Angiografie plicní žíly a zavedení cirkulárního katétru do plicní žíly. Na části A je zobrazena levá horní plicní žíla a její ústí do levé síně nástřikem kontrastní látky. Angiografické zobrazení plicní žíly zmrazené na 2. obrazovce skiaskopického přístroje umožňuje přímé hodnocení polohy cirkulárního katétru uvnitř žíly (šipka) (B) a místa aplikací radiofrekvenční energie ablačním katétrem v průběhu výkonu. Angiografické zobrazení plicní žíly poskytuje v průběhu samotného vyšetření neocenitelnou přímou korekci anatomických vztahů plicních žil a levé síně i při použití elektroanatomického mapování. 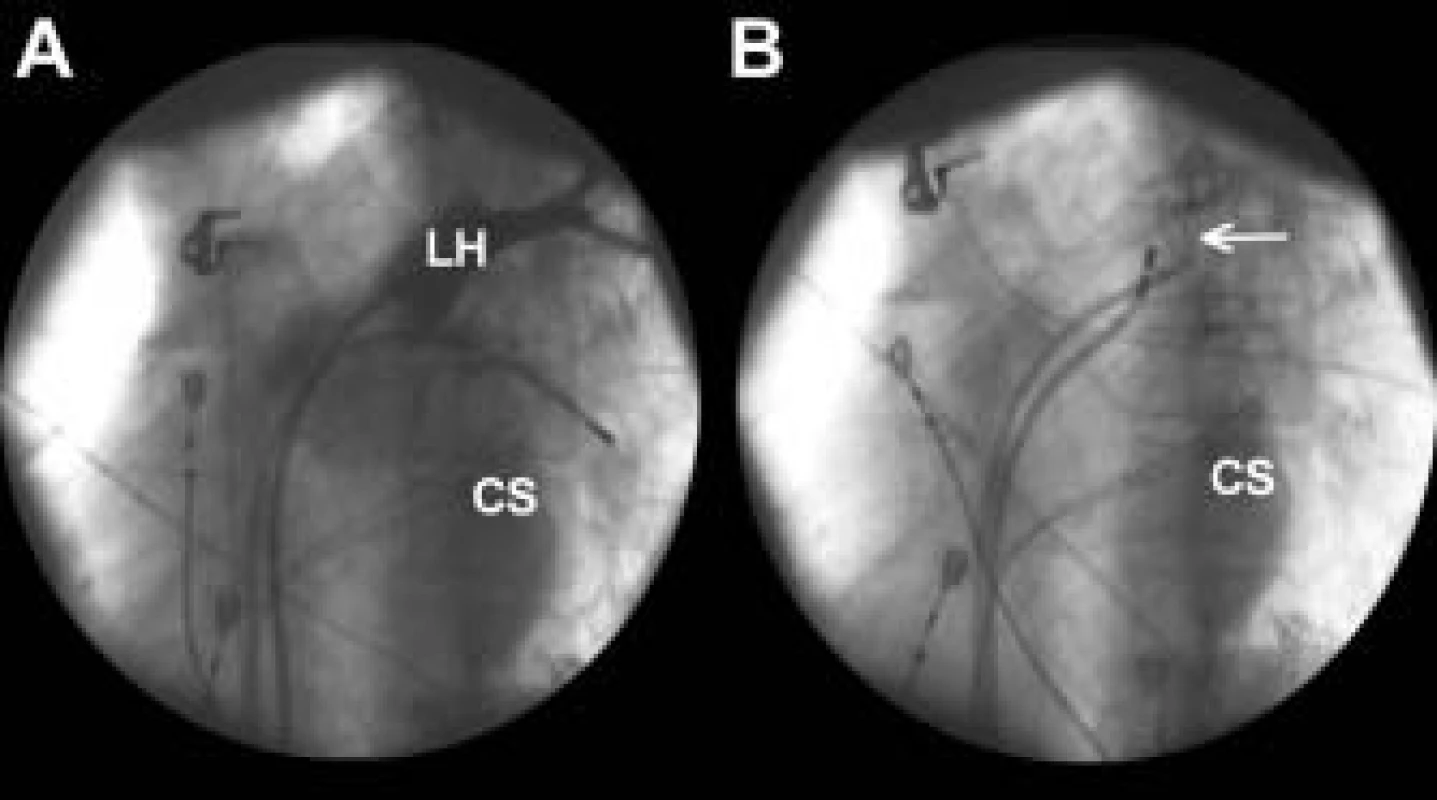
K hodnocení kvality izolace se do každé plicní žíly postupně zavedl cirkulárně tvarovaný katétr (Lasso, Biosense Webster nebo Spiral, Daig) (obr. 1B). Radiofrekvenční energie se postupně aplikovala kolem ústí plicní žíly až do dosažení úplné izolace plicní žíly. Pokud pacient neměl fibrilaci síní, prováděla se izolace levostranných plicních žil při stimulaci v koronárním sinu, izolace pravostranných plicních žil při sinusovém rytmu. Výše uvedené kroky byly provedeny u všech nemocných bez rozdílu použité mapovací a ablační metody.
Při konveční metodě se radiofrekvenční energie podávala prostřednictvím standardního 7F katétru se 4mm koncovou elektrodou pod skiaskopickou kontrolou. Radiofrekvenční energie se aplikovala do oblasti spojení myokardu síní s myokardiálními snopci v plicních žilách co nejproximálněji v ústí žíly. Ačkoli vždy byla snaha podat radiofrekvenční energii kolem celého obvodu ústí, úplná izolace žíly nevyžadovala ve všech případech pokrytí celého obvodu žíly aplikacemi radiofrekvenční energie.
U pacientů, u nichž bylo použito elektroanatomické mapování (CARTO, Biosense Webster), byla v průběhu výkonu nejprve provedena 3rozměrná elektroanatomická rekonstrukce levé síně a plicních žil. Poté se využila 3rozměrná navigace 7F katétru se 4mm koncovou elektrodou, respektive u posledních 40 pacientů katétru s chlazenou 3,5mm koncovou elektrodou (Navi-Star, Biosense Webster) k vytvoření souvislé obkružující léze lokalizované ve srovnání s konvenční ablací více na síňové straně žilního ústí. Na rozdíl od konvenčního přístupu byla obkružující léze vždy dokončena, i když bylo úplné izolace dosaženo již předchozími aplikacemi radiofrekvenční energie. Jednotlivé obkružující léze byly vytvářeny samostatně kolem jednotlivých plicních žil nebo společně kolem dvojice ipsilaterálních plicních žil v závislosti na individuálních anatomických poměrech. Nicméně ve výsledku se léze prakticky vždy buď dotýkaly, nebo splývaly ve společnou levou a pravou obkružující lézi (obr. 2A,B). U některých pacientů byla ablační strategie rozšířena o jednodušší či složitější lineární léze (obr. 2C-F). Jejich lokalizace a rozsah se lišily, základem ale byla 1 nebo 2 lineární léze: první spojující ústí levé dolní plicní žíly s mitrálním prstencem a druhá spojující levou a pravou obkružující lézi ve stropě levé síně.
Obr. 2. Elektroanatomické mapování a obkružující a lineární léze v levé srdeční síni. Na obr. 2 jsou příklady elektroanatomického mapování (voltážové mapy) a různých ablačních strategií u 3 pacientů. Na částech A a B jsou pohledy na zadní stěnu resp. a přední stěnu levé srdeční síně a na plicní žíly. Na voltážové mapě levé síně, v níž je amplituda EKG signálů v jednotlivých místech vyobrazena v barevném spektru (viz barevná škála na sloupci vpravo), jsou odděleny hodnoty větší a menší než 1 mV. Hnědé body znázorňují jednotlivá místa aplikací radiofrekvenční energie ve formě jednoduchých obkružujících lézí kolem levých a pravých plicních žil. Tato strategie je dostačující u pacientů s incesantními fibrilacemi síní kratšího trvání, u nichž je zjevnou příčnou fibrilace síní 1 nebo více jasně arytmogenních plicních žil. Na obr. 2C a 2D jsou pohledy na zadní stěnu levé síně a plicních žil u jiného pacienta, u nějž jsou obkružující léze kombinovány se 3 lineárními lézemi v levé srdeční síni. Na obrázku 2C je vidět lineární lézi spojující levou obkružující lézi od levé dolní plicní žíly k posterolaterálnímu aspektu mitrálního prstence, jejímž smyslem je preventivní eliminace reentry okruhu kolem mitrálního prstence. Obě obkružující léze jsou dále spojeny 2 lineárními lézemi nahoře ve stropě levé síně a dole mezi dolními plicními žilami. Jejich smyslem je eliminace potenciálních ektopických ložisek lokalizovaných mimo vlastní plicní žíly a „mateřských“ reentry okruhů na zadní stěně levé síně a také preventivní přerušení potenciálních reentry okruhů kolem obkružujících lézí. Tuto strategii využíváme u pacientů s intermitentní fibrilací síní, kdy jednotlivé epizody trvají hodiny až několik dní, a u nichž je tedy spoluúčast síňového myokardu v mechanizmu fibrilace síní suspektní. Na obr. 2E a 2F jsou pohledy na levou síň a plicní žíly u jiného pacienta zezadu (2E) a zepředu (2F). Kromě obkružujících lézí jsou zde přítomny komplexní lineární léze. Ty navíc oproti obrázku 2D a 2C spojují oblast pravé dolní plicní žíly s posteriorním aspektem mitrálního prstence, dále horní lineární lézi s anteriorním aspektem mitrálního prstence kolem ouška levé síně vpředu a konečně spojují napříč přepážkou pravou horní plicní žílu s foramen ovale. Tato strategie je používána jednak u pacientů s chronickou fibrilací síní, a také u pacientů s intermitentní fibrilací síní, u nichž se v mechanizmu fibrilace síní uplatňuje arytmogenní substrát pramenící z vlastní síně a spočívající v disperzní vazivové přeměně levé srdeční síně (což se odráží v nízkých amplitudách EKG signálu ve voltážové mapě). 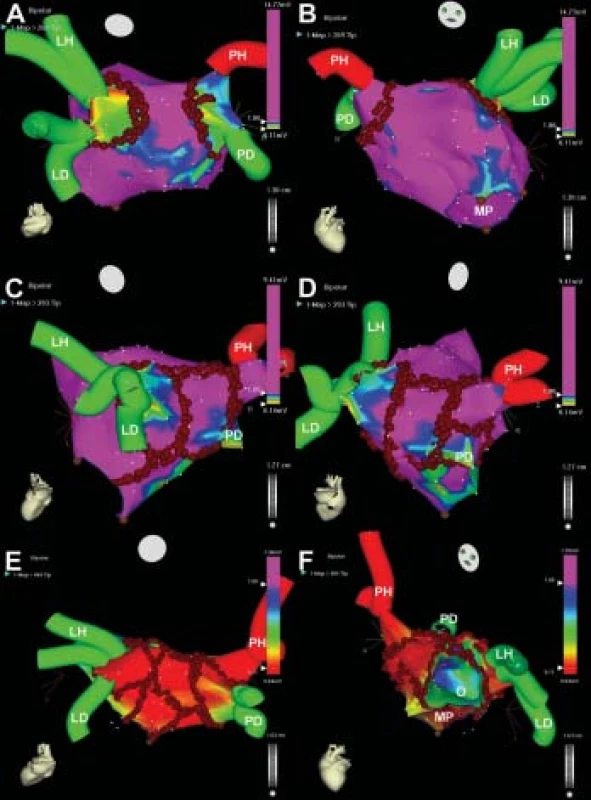
Vysvětlivky: LH, LD, PH, PD – levá horní, levá dolní, pravá horní a pravá dolní plicní žíla, MP – mitrální prstenec Cílovým momentem izolace jednotlivé plicní žíly byla úplná eliminace veškeré elektrické aktivity v plicní žíle. Izolace plicní žíly mohla být hodnocena i při běžící fibrilaci (obr. 3A-D), ale vždy na konci vyšetření při sinusovém rytmu (pravostranné plicní žíly) (obr. 4) nebo při stimulaci v koronárním sinu (levostranné plicní žíly). Při procesu izolace byl cirkulární katétr uložen ve stabilní pozici v houbce asi 1 cm a po dosažení izolace byl postupně stahován až do samotného ústí, a tak byla kvalita izolace kontrolována na různých úrovních plicní žíly. Pokud byly nalezeny potenciály v proximálnějších segmentech ústí žíly, byly odstraněny také. Po izolaci jednotlivé plicní žíly se vždy vyčkávalo nejméně 5 minut a kontrolní mapování všech plicních žil cirkulárním katétrem se provedlo ještě jednou na konci výkonu.
Obr. 3. Izolace plicních žil v průběhu běžící fibrilace síní. Na obr. 3A je EKG záznam z plicní žíly před izolací plicní žíly. V plicní žíle jsou vidět ostré vysokofrekvenční potenciály o rychlé frekvenci, které reprezentují rychlou elektrickou aktivitu vycházející ze svaloviny plicních žil. Na obrázku 3B je stav po izolaci dotyčné plicní žíly, projevující se eliminací vysokofrekvenčních potenciálů a do záznamu se promítají pouze tupé („far field“) signály z levé srdeční síně. Skutečnost, že po izolaci plicní žíly fibrilace síní přetrvává, může znamenat, že uvedená plicní žíla neurčuje běh fibrilace síní, resp. není jedinou plicní žilou, která fibrilaci síní řídí. Na obr. 3C je záznam ukončení paroxyzmu fibrilace síní (trvajícího několik hodin) v průběhu izolace plicních žil. Těsně před ukončením běžící fibrilace je zjevné zpomalování elektrické aktivace jak v plicní žíle, tak i v levé síni a také relativní zpožďování aktivace v levé síni oproti aktivaci v plicní žíle. Z prvního sinusového stahu je zjevné, že izolace plicní žíly v okamžiku ukončení fibrilace síní není úplná, při sinusovém stahu šipky ukazují na pasivní elektrickou aktivaci myokardu plicní žíly (vysvětlení viz obr. 4). Ukončení fibrilace síní při izolaci plicní žíly znamená, že se jedná o jedinou arytmogenní plicní žílu nebo jednu z více aktuálně arytmogenních plicních žil, která byla postupně izolována jako poslední v pořadí. 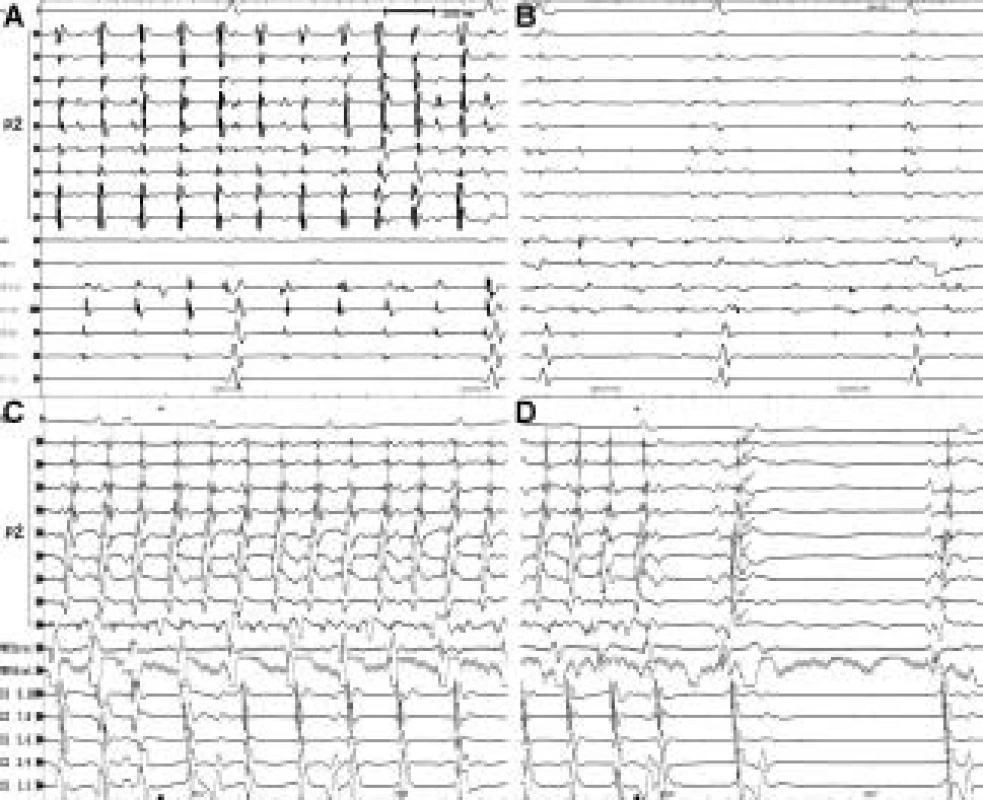
Vysvětlivky: PŽ – záznamy z cirkulárního katétru v plicní žíle, CS – záznamy z katétru v koronárním sinu, reprezentující aktivaci levé síně kolem mitrálního prstence, Abl nebo MAP – záznamy z ablačního katétru. Rychlost posunu EKG záznamu je 200 mm/s. Obr. 4. Izolace plicní žíly při sinusovém rytmu. Na obrázku je záznam z plicní žíly snímaný cirkulárním katétrem při sinusovém rytmu. Aktivita snímaná cirkulárním katétrem je tvořena prvním tupým („far field“) potenciálem ze svaloviny srdeční síně a 2. potenciálem reprezentujícím aktivaci svaloviny ve stěně plicní žíly. Jejich pořadí odráží pasivní průnik sinusové elektrické aktivace ze síně do nitra plicní žíly. V okamžiku úplné izolace plicní žíly dochází k úplnému přerušení vedení mezi levou síní a plicní žilou, což se projeví vymizením potenciálu z plicní žíly (A). Následně spontánní ektopická aktivace v plicní žíle neuchvacuje levou síň (a nemůže spouštět, resp. rychlá aktivita ve formě pravidelné či nepravidelné tachykardie nemůže řídit fibrilaci síní) (B). 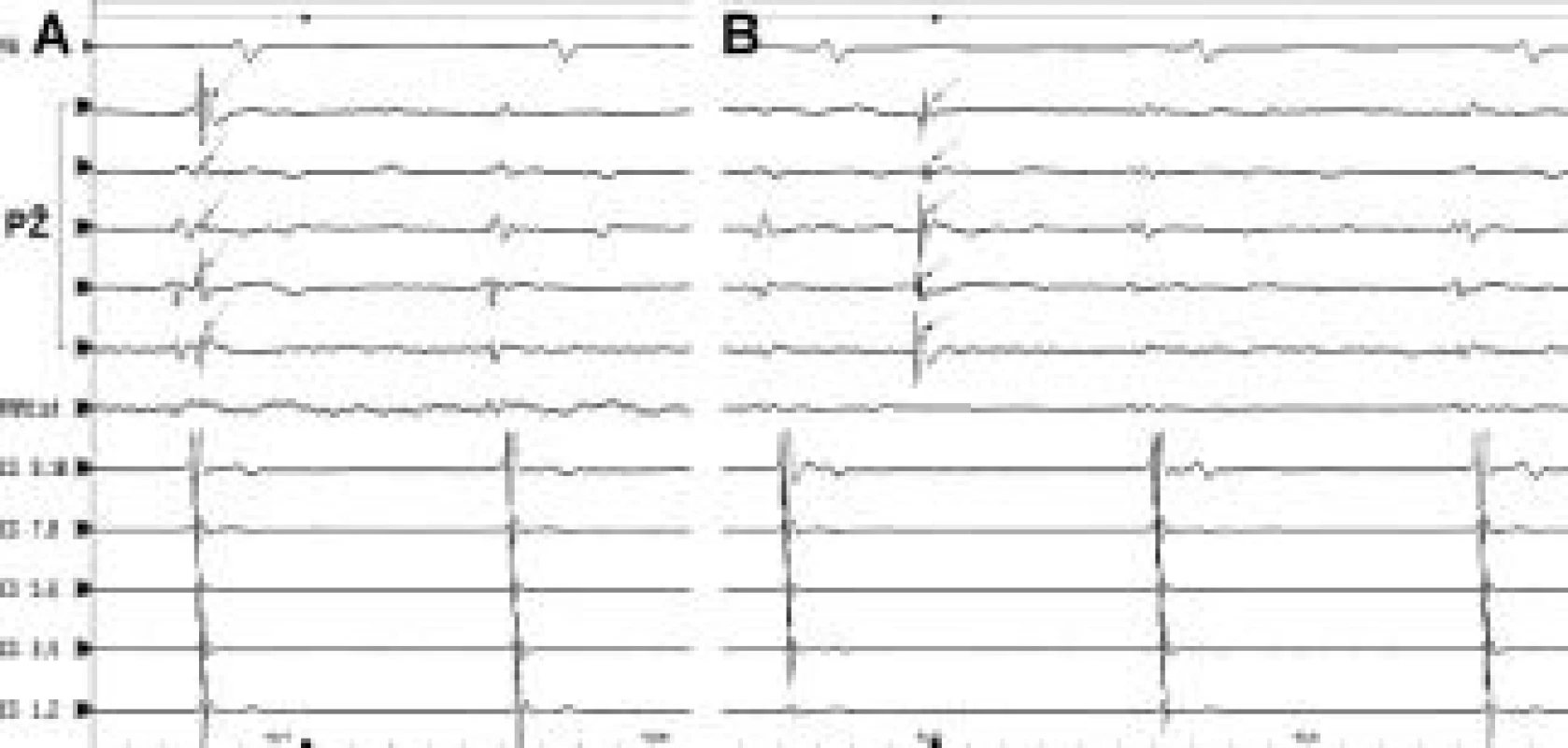
Vysvětlivky jako na obr. 3. Rychlost posunu EKG záznamu je 200 mm/s Úplná izolace plicní žíly byla definována jako úplná eliminace elektrických potenciálů generovaných svalovinou plicní žíly.
Částečná izolace plicní žíly byla definována jako stav, kdy po izolaci byly v plicní žíle detekovány reziduální potenciály, obvykle u samotného ústí žíly. Částečná izolace byla obvykle ponechána záměrně, pokud bylo zjevné, že arytmogenní byla jiná žíla, že ektopická aktivita se v dotyčné plicní žíle neprojevovala, že nejvýraznější potenciály v plicní žíle byly eliminovány a že další aplikace radiofrekvenční energie by mohly pacienta zbytečně ohrozit vznikem stenózy plicní žíly za cenu sporného přínosu.
Cílovým momentem výkonu byla izolace elektrické aktivity ve všech plicních žilách, v nichž byla přítomna. Izolace jen vybraných arytmogenních plicních žil byla provedena jen u několika pacientů, většinou v počátečních obdobích. U většiny nemocných byla provedena izolace všech plicních žil. Od března roku 2004 je izolace všech plicních žil cílovým momentem výkonu bez výjimky.
Stenóza plicní žíly, která byla arbitrárně zaznamenávána jako potenciálně závažná, byla definována jako zúžení původního průměru ústí žíly o 3 mm a/nebo zúžení původního průměru o 25 %. Od března roku 2004 se neprovádí kontrolní vyšetření a standardně se hodnotí průměr žilních ústí a rychlost s kvalitou toku v plicních žilách (laminární nebo turbulentní proudění) při transezofageální echokardiografii 1 měsíc po ablaci.
Reablace byla provedena nejdříve s odstupem nejméně 3 měsíců a vždy pomocí elektroanatomického mapování. Ve všech případech byla při opakovaném výkonu vytvořena širší souvislá elektroanatomicky navigovaná obkružující léze kolem všech plicních žil bez ohledu na to, zda v nich došlo k recidivě vedení nebo ne. Cílem těchto obkružujících lézí byla izolace potenciálních ektopických fokusů, lokalizovaných proximálněji na okrajích ústí plicních žil a případná modifikace arytmogenního substrátu pro udržování fibrilace síní. V případě recidivy vedení, nebo pokud nebyla plicní žíla při prvním výkonu cílena, byla cílovým momentem této obkružující léze plná izolace plicní žíly. Při reablaci byly většinou obkružující léze doplněny o lineární léze v jednodušší nebo složitější podobě.
Při konvečním mapování byly intrakardiální bipolární elektrokardiogramy filtrované v pásmu 30-400 Hz zaznamenávány v digitální formě na mnohakanálovém registračním zařízení (Cardiolab System - Prucka Engineering).
Při elektroanatomickém mapování byly bipolární elektrokardiogramy filtrované v pásmu 10-400 Hz zaznamenány na systému CARTO (Biosense Webster) a současně na konvečním registračním systému. Při elektroanatomické rekonstrukci byly v počáteční době vytvářeny aktivační mapy při sinusovém rytmu, později byla využívána čistě anatomická mapa nezávislá na přítomném rytmu. Při vytváření aktivační mapy u pacientů se sinusovým rytmem byl jako časový referenční bod využit bipolární signál z katétru umístěného v koronárním sinu. Jako zdroj radiofrekvenční energie byl použit generátor Stockert (Biosense Webster). Katetrová ablace byla teplotně řízena s nastavením maximálních hodnot do 55 °C a 25 W při konvenční metodě a 60 °C a 35 W při elektroanatomické metodě. Při použití katétru s chlazenou koncovou elektrodou byl zvolen nízký průtok 2 ml/min a teplotně řízená ablace s maximálním teplotním limitem 56 °C a limitem výkonu 30 W.
Hodnocení klinického výsledku
Pacienti byli po ablaci vyšetřeni v ambulanci za 1, 3, 6, 9 a 12 měsíců a následně každých 6 měsíců. Kromě toho byli pravidelně sledováni svými kardiology a internisty. Při kontrolách byli pacienti vyšetřeni anamnesticky se zaměřením na příznaky arytmie. Dále se hodnotily všechny pravidelně získávané standardní a Holterovy EKG-záznamy. Někteří pacienti s následnými symptomy byli vybaveni kartou pro transtelefonní přenos EKG.
Recidiva fibrilace byla buď dokumentovaná na EKG-záznamu, nebo se za recidivu považovala také palpitace suspektní z fibrilace síní. Jako recidiva fibrilace síní byla v Holterově EKG-záznamu zaznamenána arytmie, jejíž trvání přesáhlo 30 sekund.
Kromě recidivy fibrilace síní se hodnotil klinický benefit, který vyjadřoval subjektivní porovnání výskytu arytmií před ablací a po ablaci. Hodnocení klinického benefitu je založeno zvláště na tom, že naprostá většina pacientů měla před ablací výrazné subjektivní potíže vyskytující se několikrát týdně. Benefit I znamenal úplné odstranění příznaků. Benefit II zahrnoval mírné reziduální příznaky většinou v důsledku vnímané extrasystolie. V některých případech byli do této skupiny zařazeni pacienti, u kterých došlo s odstupem měsíců i k setrvalé symptomatické recidivě fibrilace síní, jejíž ojedinělý výskyt nebyl v žádném případě indikací k nasazení antikoagulační léčby. Ve srovnání s četnými paroxyzmy fibrilace před ablací se jednalo o náhodný jev, přičemž tito pacienti vnímali zásadní rozdíl v klinickém stavu před ablací a po ablaci. Benefit III byl definován jako mírné zlepšení v četnosti výskytu a trvání fibrilace síní a benefit IV znamenal, že nedošlo k žádnému zlepšení v klinickém stavu. Souhrnem nebyl ablační výkon považován za klinický přínos u pacientů zařazených do skupiny III a IV.
Antiarytmická léčba
Antiarytmická léčba, kterou pacienti užívali v době indikace výkonu, byla nadále ponechávána i v době výkonu, a pak nejméně 1 až 3 měsíce po výkonu. Dávka antiarytmik se postupně snižovala a vysazovala podle klinického stavu. Pokud se po snížení nebo vysazení antiarytmika začaly opět objevovat klinicky významné paroxyzmy fibrilace síní, byla do léčby vrácena nejmenší nutná dávka antiarytmika, která arytmie potlačila. Klinický efekt pak byl součtem vlivu výkonu a před ablací neúčinného antiarytmika. U pacientů, kteří před ablací užívali amiodaron, se po jeho vysazení v případě opětovné potřeby antiarytmické léčby obvykle nejprve zkoušela jiná antiarytmika I. nebo III. třídy.
Antikoagulační léčba
Většina pacientů užívala před ablací dlouhodobě antikoagulační léčbu. Antikoagulační léčba se nasazovala na dobu nejméně 4-6 týdnů před výkonem i u pacientů, kteří ji trvale neměli. Až na výjimky tak měli všichni pacienti 4 až 6 týdnů před výkonem antikoagulační léčbu v účinné hladině INR (2-3). Perorální antikoagulační léčba se vysazovala 5 dní před výkonem a až do výkonu se podával nízkomolekulární heparin. Přítomnost sraženiny v srdečních síních se vylučovala u všech pacientů transezofageálním vyšetřením bezprostředně před výkonem. V případě, že byl v srdečních síních přítomen trombus, výkon se odložil o několik týdnů až měsíců, pokračovalo se v intenzivní antikoagulační léčbě a ablace se provedla v okamžiku vymizení krevní sraženiny. Pacienti také podstoupili transezofageální echokardiografii v 1. období za 1-2 dny po výkonu a podle potřeby opakovaně později. Později se za 1 až 2 dny po výkonu prováděla pouze transtorakální echokardiografie a transezofageální echokardiografie se provedla až za 1 měsíc po ablaci.
Po provedení dvojité transseptální punkce byla zavedena plná heparinizace (bolus a následně kontinuální infúze) s udržováním aPTT okolo 100 až 200 s, resp. ACT 250 až 350 s. Infuze heparinu byla přerušena na konci výkonu. Po návratu na lůžko se pokračovalo v léčbě nízkomolekulárním heparinem až do dosažení účinné hladiny perorální antikoagulace, která byla obvykle nasazena zpět 2. den po výkonu. Antikoagulační léčba se nadále udržovala nejméně 1 až 3 měsíce po výkonu a byla v principu vysazena v okamžiku, kdy bylo možné předpokládat zhojení radiofrekvenčních lézí, ústup procesu omráčení síní a kdy bylo z klinického obrazu a EKG-záznamů zjevné, že klinicky významné fibrilace síní byly odstraněny.
Hodnocení dat
Číselné hodnoty byly vyjádřeny jako průměr - směrodatná odchylka.
Výsledky
Výsledky jsou prezentovány odděleně u prvních 110 pacientů, tedy za období získávání zkušeností, a u následujících 40 pacientů, tedy za období, kdy se ablace již prováděla jednotnou metodou, ale po níž jsou pacienti sledováni jen krátkodobě.
Bezprostřední výsledky
První výkon
U 150 nemocných bylo provedeno celkem 173 výkonů. 22 pacientů podstoupilo druhou katetrovou ablaci pro recidivy fibrilace síní a 1 pacient třetí ablaci pro reziduální levosíňový flutter.
U prvních 110 pacientů byla při 1. výkonu v rámci srovnávací studie provedena izolace 372 plicních žil, což bylo 92 % ze 404 plicních žil identifikovaných přímou angiografií, nepřímou angiografií a elektroanatomickým mapováním. 358 (96 %) cílených plicních žil bylo izolováno plně, tj. veškerá elektrická aktivita v těchto plicních žilách byla zcela odstraněna. Nebyl žádný rozdíl v účinnosti obou metod, konvenční metodou bylo plně izolováno 176 (96 %) ze 184 žil a elektroanatomickou metodou 182 (97 %) ze 188 plicních žil. U ostatních 14 (4 %) plicních žil bylo dosaženo pouze částečné izolace (definice viz výše). Z 372 cílených plicních žil bylo 286 (77 %) vyšetřeno přímou angiografií před izolací a bezprostředně po ní. Podrobnosti uvádí tab. 2.
Tab. 2. Údaje o nalezených a izolovaných plicních žilách při prvním výkonu. 
U 286 angiograficky vyšetřených plicních žil se bezprostředně po izolaci zúžil průměr jejich ústí ze 12,6 plusmin 2,7 (5-27) mm na 12,1 plusmin 2,8 (4-27) mm. Průměrně se ústí plicních žil zúžilo o 0,47 plusmin 0,92 (0-5) mm. Zúžení plicní žíly přesahující 3 mm nebo 25 % původního úsťového průměru se vyskytlo u 16 (5,6 %) plicních žil. Nejvýraznější zúžení dosáhlo u jedné žíly 50 % průměru. Žádné z těchto zúžení se klinicky neprojevilo plicní hypertenzí.
U 20 (18 %) z těchto 110 pacientů byla k izolaci plicních žil navíc provedena 1 nebo více lineárních lézí. U 6 pacientů byla provedena lineární léze spojující ústí levé dolní plicní žíly a laterální aspekt mitrálního prstence, u 4 pacientů byla provedena kombinace první lineární léze a lineární léze spojující levou a pravou obkružující lézi. U 10 pacientů byly vytvořeny komplexnější lineární léze různého rozsahu. U 30 pacientů byla současně v jednom výkonu provedena katetrová ablace reentry okruhu pro flutter síní I. typu.
Skiaskopický čas na celý výkon byl průměrně 46,3 plusmin 14,9 (17-86) min a průměrná doba celého výkonu byla 267,2 plusmin 50 (160-420) min. Na konci výkonu byla pouze v jednom případě nutná elektrická kardioverze pro perzistující fibrilaci síní. První výkon proběhl u všech pacientů bez závažnější komplikace spojené s provedením výkonu, pouze u 2 pacientů byl při transezofageální echokardiografii zjištěn po ablaci trombus v oušku levé síně, který byl přítomen dočasně a nebyl příčinou embolické komplikace. Jeden pacient se dostavil několik dní po propuštění z hospitalizace s femorálním pseudoaneuryzmatem, které bylo vyřešeno kompresí bez dalších následků.
U následujících 40 pacientů bylo při prvním výkonu identifikováno a plně izolováno všech 160 plicních žil [4 plusmin 0,4 (3-5)/pacienta]. U 31 pacientů byly obkružující léze kombinovány s jednoduchými či složitějšími lineárními lézemi. Průměrný skiaskopický čas na výkon byl 36,7 plusmin 10,1 (17-53) a průměrná doba celého výkonu byla 248,8 plusmin 37,2 (160-330) min. Na konci výkonu měli všichni pacienti sinusový rytmus bez nutnosti elektrické kardioverze. Při transezofageální echokardiografii 1 měsíc po ablaci nebyla přítomna stenóza plicních žil a na všech plicních žilách bylo detekováno laminární proudění.
Žádný ze 150 pacientů nezemřel, u žádného pacienta nebyl první výkon komplikován srdeční tamponádou, tromboembolickou komplikací, atrioezofageální píštělí ani echokardiograficky významným výpotkem (> 5 mm).
Opakovaný výkon
22 (15 %) pacientů podstoupilo pro recidivu klinicky významné fibrilace síní druhý ablační výkon. Opakovanou ablaci podstoupilo 20 (18 %) z prvních 110 pacientů a 2 (5 %) z následujících 40 pacientů. Opakovaný výkon se standardně prováděl za pomoci elektroanatomického mapování a navigace. U těchto pacientů byla provedena širší elektroanatomicky navigovaná obkružující radiofrekvenční léze kolem všech plicních žil. U 2 pacientů bylo provedeno prosté obkroužení plicních žil s reizolací některé plicní žíly nebo více žil či s novou izolací dříve necílené žíly (žil), u 3 pacientů byla provedena navíc lineární léze spojující ústí dolní duté žíly a laterální segment mitrálního prstence, u 13 pacientů byla vytvořena výše uvedená lineární léze a druhá lineární léze spojující levou a pravou obkružující lézi. Dva pacienti podstoupili výkon s obkružujícími a komplexními lineárními lézemi.
U 12 pacientů byla nalezena recidiva vedení mezi 1 nebo více plicními žilami a levou síní s výraznou ektopickou aktivitou v plicní žíle uchvacující levou síň. U dalších 3 pacientů byla nalezena ektopická aktivita v plicní žíle, která nebyla při 1. výkonu cílena katetrovou ablací. Ve všech 3 případech se jednalo o pravou dolní plicní žílu, která v době výkonu svou ektopickou aktivitou řídila běžící fibrilaci síní, přičemž tato fibrilace síní byla s izolací žíly ukončena. U dalších 3 pacientů byla při druhé ablaci zjištěna ektopická aktivita jak v důsledku recidivy vedení, tak i v důsledku neprovedení ablace v některé z plicních žil. Recidiva ektopické aktivity v dříve cílené plicní žíle uchvacující levou síň tak byla při druhém výkonu nalezena u 15 (75 %) pacientů a přítomnost ektopické aktivity v plicní žíle vůbec u 18 (90 %) pacientů. U 2 pacientů byla při 2. výkonu nalezena plná izolace všech 4 plicních žil a ablace byla zaměřena na modifikaci arytmogenního substrátu pomocí obkružujících a mnohočetných lineárních lézí.
Průměrný skiaskopický čas na opakovaný výkon byl 38,7 plusmin 10,8 (21-60) min. U 1 pacienta, u nějž byly vytvořeny komplexní lineární léze, došlo za 10 hodin po výkonu k embolizaci do CNS z trombu v oblasti ústí plicní žíly se vznikem parciální hemianopsie, která zcela neregredovala ani za dobu 18 měsíců sledování. U ostatních pacientů proběhly opakované výkony bez komplikací.
Dlouhodobé výsledky
Průměrná doba sledování je 15,9 plusmin 10,3 (1-40) měsíců. Prvních 110 pacientů je sledováno nejméně 9 měsíců po ablaci. Z nich 96 je sledováno 12 měsíců, 65 pacientů je sledováno18 měsíců a 37 pacientů je sledováno po dobu 24 měsíců. Dalších 40 pacientů je sledováno po dobu 1 až 6 měsíců. Nikdo z pacientů neprodělal v období sledování tromboembolickou příhodu. Výsledky sledovaných parametrů jsou uvedeny v jednotlivých etapách sledování.
Recidiva fibrilace síní po katetrové ablaci
Recidiva fibrilace síní byla hodnocena od okamžiku propuštění z hospitalizace, tedy asi od 5. dne po výkonu. U prvních 110 pacientů byla fibrilace síní podle definice dokumentována poměrně častěji v 1. měsíci sledování (u 40 % pacientů), a pak se její výskyt ustálil kolem 20 % a mezi 3. a 12. měsícem se výrazněji neměnil. Ve 3., 6., 9. a 12. měsíci bylo bez fibrilace síní 85 (77 %), 90 (82 %), 91 (83 %), resp. 80 (83 %) pacientů. Později pak došlo k dalšímu poklesu recidiv fibrilace síní patrně v důsledku provedených úspěšných reablací a vyladění antiarytmické léčby. V 18. a 24. měsíci bylo bez fibrilace síní 56 (86 %), resp. 33 (89 %) pacientů. Poměr pacientů bez recidivy fibrilace síní u prvních 110 pacientů je zobrazen graficky (obr. 5).
Graf 1. Vývoj bez recidiv fibrilace síní a klinický benefit po ablaci. 
Z posledních 40 pacientů bylo po 3 měsících vyšetřeno 23 pacientů a po 6 měsících 6 pacientů, z nichž 21 (91 %) resp. 6 (100 %) bylo bez fibrilace síní.
Klinický benefit po katetrové ablaci
Klinický benefit v zásadě kopíroval absenci recidiv fibrilace síní, nicméně byl ve všech etapách sledování asi o 10 % vyšší. Rozdíl spočíval v občasném výskytu arytmie u některých pacientů, nicméně se nejednalo o klinicky významné epizody fibrilace síní (viz výše). Tito pacienti hodnotili klinické zlepšení jako významné. Vnímali zlepšení svého zdravotního stavu jako výrazné ve srovnání s mnohahodinovými či mnohadenními epizodami fibrilace síní vyskytujícími se před ablací několikrát týdně. Zásadní klinické zlepšení, tedy součet benefitu I a II, tak bylo dosaženo ve 3., 6., 9., 12., 18. a 24. měsíci u 94 (85 %), 98 (89 %), 100 (91 %), 89 (93 %), 60 (92 %), resp. 33 (89 %) pacientů. Klinický benefit u prvních 110 pacientů je znázorněn graficky (obr. 5).
U posledních 40 pacientů zaznamenalo po 3 měsících klinický benefit 21 (91 %) ze 23 pacientů a po 6 měsících 6 ze 6 pacientů.
Antikoagulační léčba po katetrové ablaci
Antikoagulační léčba byla postupně podle výše uvedených zásad vysazována, a tak kopírovala klinický benefit víceméně až od 9. měsíce sledování, odkdy byla potřebná u 11 až 14 % pacientů. Dva pacienti přitom užívali warfarin dále i přes odstranění fibrilace síní z jiné indikace. U jiných nemocných po prodělané tromboembolické příhodě před ablací se empiricky vyčkávalo s vysazením antikoagulační léčby déle než 6 měsíců. Ve 3., 6., 9., 12., 18. a 24. měsíci užívalo warfarin 52 (47 %), 23 (21 %), 15 (14 %), 12 (11 %), 7 (11 %), resp. 5 (14 %) pacientů. Vývoj antikoagulační léčby u prvních 110 nemocných je znázorněn graficky (obr. 6).
Graf 2. Vývoj užívání antiarytmik I. a III. třídy a amiodaronu po ablaci. 
Léčba antiarytmiky I. a III. třídy po ablaci
Antiarytmická léčba byla také postupně vysazována podle výše uvedených zásad. Od 9. měsíce byla antiarytmická léčba potřebná u méně než 30 % pacientů. Antiarytmika I. a III. třídy užívalo ve 3., 6., 9., 12., 18. a 24. měsíci 69 (63 %), 48 (44 %), 28 (25 %) 22 (23 %), 18 (28 %), resp. 11 (30 %) pacientů. Léčba antiarytmiky I.a III. třídy po ablaci u prvních 110 pacientů je znázorněna graficky (obr. 7).
Graf 3. Vývoj užívání antikoagulační léčby po ablaci. 
Léčba amiodaronem byla také redukována a od 6. měsíce byla nutná u méně než 10 % pacientů. Amiodaron užívalo ve 3., 6., 9., 12., 18. a 24. měsíci 28 (25 %), 15 (14 %), 9 (8 %), 7 (7 %), 5 (8 %), resp. 2 (5 %) pacientů. Léčba amiodaronem je u prvních 110 pacientů znázorněna graficky (obr. 7).
Diskuse
V uvedeném souboru je prezentována metoda katetrové ablace v levé srdeční síni pro intermitentní fibrilaci síní u pacientů bez významného strukturálního postižení srdce. Princip metody je založen na převratném nálezu z posledních let, že fibrilace síní je spouštěna i udržována ektopickou aktivitou vycházející z myokardiálních snopců ve stěně plicních žil [4]. Použití širších elektroanatomicky navigovaných obkružujících lézí ev. kombinovaných s lineárními lézemi rozšiřuje strategii izolace spouštěcích faktorů o odstranění tzv. mateřských reentry okruhů neboli tzv. rotorů [7,10], eliminaci dalších potenciálních spouštěcích ložisek na zadní stěně mezi plicními žilami, resp. vycházejících z Marshallova ligamenta [6]. Dalším efektem širších obkružujících lézí může být vagová denervace [17] a ablace septálních myokardiálních spojení mezi pravou a levou síní [18]. Konečně po zhojení širších obkružujících a lineárních lézí vazivovou jizvou dochází k významné redukci levosíňové svalové hmoty nutné k udržení fibrilačních reentry okruhů [14]. Na většině pracovišť se však nepoužívala kombinace elektroanatomického mapování a současného kontinuálního snímání elektrické aktivity v plicních žilách cirkulárním katétrem. Spíše jsme byli svědky diskusí, který z přístupů je lepší.
Od roku 2001 do roku 2004 prošla námi prezentovaná metoda vývojem, který vyústil do současné techniky, založené na vytvoření elektroanatomicky navigovaných obkružujících lézí kolem plicních žil kombinovaných podle potřeby s jednoduchými či komplexními lineárními lézemi. Použití katétru s chlazenou koncovou elektrodou dále zvyšuje účinnost a rychlost při vytváření ablační léze. Nicméně v každé době a u všech pacientů byla základem použité strategie izolace plicních žil hodnocená kontinuálním snímáním elektrické aktivity cirkulárními katétry uvnitř plicních žil. Prezentovaná strategie tak standardně kombinovala výhody obou přístupů.
Úspěšnost izolace plicních žil
V uvedeném souboru pacientů byla u prvních 110 pacientů konvenční metodou nebo kombinovanou metodou s elektroanatomickou navigací dosažena úplná izolace u 358 (96 %) ze 372 cílených plicních žil. U dalších 40 pacientů bylo při použití katétru s chlazenou koncovou elektrodou dosaženo úplné izolace všech 160 přítomných plicních žil. Ponechání částečné izolace plicní žíly, tzn. reziduálních elektrických potenciálů z okrajů ústí plicních žil, bylo zvoleno v případě, pokud z povahy nálezu vyplývalo, že uvedená plicní žíla s velkou pravděpodobností není rozhodující v arytmogenezi a že by další aplikace radiofrekvenční energie mohly vést ke zbytečnému zvýšení rizika vzniku stenózy plicní žíly. Otázkou zůstává, zda výše uvedená definice částečné izolace plicních žil (podle níž bylo dosaženo eliminace nejvýznamnějších potenciálů generovaných v plicních žilách) neznamená v pojetí jiných pracovišť úplnou izolaci.
Bez ohledu na to, úspěšnost se při dosažení plné izolace plicních žil neliší od zkušeností z předních pracovišť, podle nichž je izolace plicních žil dosahována v rozmezí 95 až 100 % [1,2,8,11,12,14].
Zúžení plicních žil a další komplikace
K zúžení plicních žil u prvních 110 pacientů, které bylo definováno jako zúžení původního průměru plicní žíly nejméně o 3 mm a/nebo o 25 %, došlo u 16 (5,6 %) plicních žil. Zúžení bylo hodnoceno porovnáním přímé angiografie v jedné rovině před izolací a po izolaci u 286 (77 %) ze 372 cílených plicních žil. K uvedenému zúžení došlo pouze v 1 ze 16 případů při použití elektroanatomické metody. Jen v 1 případě vznikla stenóza plicní žíly dosahující 50 % původního průměru ústí žíly. U žádného z pacientů nedošlo v době sledování k rozvoji plicní hypertenze. U posledních 40 pacientů byly plicní žíly standardně hodnoceny 1 měsíc po ablaci pomocí transezofageální echokardiofrafie. Přitom se vedle anatomie ústí plicních žil posuzoval případný vznik stenózy i funkčně podle kvality proudění krve plicní žilou a nebyla zaznamenána změna z laminárního na turbulentní proudění ani u jediné žíly.
Akutní zúžení ústí žíly je pravděpodobně důsledkem otoku tkáně v místě aplikací radiofrekvenční energie. Přestože jsou popsány progrese zúžení plicní žíly v čase, ve většině případů se zúžení dále výrazněji neprohlubuje, jak vyplývá z pravidelných vyšetření transezofageální echokardiografií s odstupem týdnů až měsíců. Nicméně v experimentu u psů byl popsán patofyziologický mechanizmus rozvoje stenózy plicních žil po podání radiofrekvenční energie, který zahrnuje fibrocelulární intimální proliferaci, tvorbu trombu uvnitř žíly, kontrakci endokardu a proliferaci laminy elastiky [20].
V literatuře se za významnou stenózu plicní žíly považuje podle anatomické definice zúžení dosahující nejméně 50 % původního průměru žíly. Vznik významné stenózy plicní žíly nad 50 resp. 70 % hodnocený angiograficky nebo pomocí CT nebo MR se vyskytl v rozmezí 0,5 % až 2 % a vznik stenózy v rozsahu 20 až 50 % dosáhl až 10 % [8,11,19].
Použití elektroanatomického mapování v naší sestavě nemocných potvrzuje výsledky Papponeho et al a jiných autorů, že použití elektroanatomické navigace k vytvoření izolace na síňové straně žilního ústí je spojená prakticky s nulovým rizikem významné žilní stenózy [12,14].
Recidiva fibrilace síní po katetrové ablaci
Recidiva fibrilace síní byla definována jako fibrilace síní objektivně dokumentovaná na standardním nebo Holterově EKG-záznamu respektive jako subjektivní pocit palpitací suspektní z fibrilace síní. Recidiva fibrilace síní byla pochopitelně definována s vědomím, že pacienti mohli mít asymptomatické epizody arytmie, které nebyly dokumentovány. Na druhé straně mohly být palpitace považované za fibrilaci síní ve skutečnosti často jen důsledkem nakupené reziduální síňové extrasystolie. To se později prokázalo u některých pacientů z korelace potíží a dlouhodobého EKG-monitorování. Nicméně, nejdůležitější pro hodnocení recidivy a také pro následné hodnocení klinického zlepšení byla skutečnost, že většina pacientů měla před ablací výrazné potíže, že svou poruchu rytmu dobře rozpoznávali a že jednotlivé paroxyzmy arytmie se u většiny z nich dostavovaly několikrát týdně. Kromě toho, všichni pacienti měli z předablačního období objektivně bohatou EKG-dokumentaci recidiv fibrilace síní.
Recidiva fibrilace síní byla hodnocena v pravidelných etapách období sledování. V různých obdobích sledování se mohl klinický vývoj u jednotlivých pacientů lišit. U mnoha pacientů v prvních týdnech sledování docházelo k opakovaným recidivám fibrilace síní, které později vymizely. Vysvětlení recidiv fibrilace síní v časném období po je pravděpodobně komplexní. Po ablaci přetrvávají funkční změny síňového myokardu (elektrická remodelace), podílející se na substrátu pro udržování fibrilace síní. V prvních týdnech může z poměrně rozsáhlých hojících se radiofrekvenčních lézí vznikat arteficiální ektopická aktivita, sice odlišná od izolované ektopické aktivity v plicních žilách a ve své podstatě dočasná, ale uchvacující myokard síní je dlouhodobě zvyklý udržovat fibrilaci síní. Teprve s hojením obkružujících a případně lineárních lézí tato arteficiální ektopická aktivita mizí a s redukcí výskytu fibrilace síní postupně dochází k reverzní elektrické remodelaci síňového myokardu a dalšímu omezení arytmogenního potenciálu. Kromě toho dochází s hojením širších elektroanatomicky navigovaných obkružujících radiofrekvenčních lézí k modifikaci arytmogenního substrátu pro udržování fibrilace síní v levé srdeční síni.
V delším časovém úseku docházelo u některých pacientů k recidivám fibrilace síní po bezpříznakovém období, obvykle po úplném vysazení antiarytmické léčby mezi 6. a 12. měsícem sledování. Po navrácení nejmenší nutné dávky antiarytmika arytmie u mnoha pacientů ustoupily, a pozitivní klinický průběh pak byl výsledkem kombinace efektu výkonu a pokračující, dříve neúčinné, antiarytmické léčby.
Pro nepříznivý klinický vývoj po první ablaci podstoupilo 22 pacientů druhý ablační výkon, který ve většině případů vedl k trvalému odstranění fibrilace síní. Při opakované ablaci byla kromě 2 pacientů u všech ostatních zjištěna v některé z plicních žil významná ektopická aktivita uchvacující myokard síní, ať už v důsledku recidivy vedení přes původní radiofrekvenční lézi, nebo proto, že arytmogenní plicní žíla nebyla při prvním výkonu izolována. Před provedením reablace se sledoval klinický vývoj nejméně 3 měsíce, ale obvykle se reablace prováděla až s odstupem mnoha měsíců. Až na výjimky byl klinický vývoj u pacientů podstupujících reablaci trvale nepříznivý už od provedení prvního výkonu bez zásadního zlepšení stavu v některé etapě sledování.
Výskyt recidiv fibrilace síní se po ablaci neliší od výsledků na jiných pracovištích. Při použití konvenční segmentální izolace plicních žil je přes 80 % pacientů bez fibrilace síní včetně nejméně 60 % pacientů, kteří po ablaci nemusí užívat žádné antiarytmické léky [1,5,8,11,12]. Po použití elektroanatomicky navigovaných obkružujících lézí byly publikovány výsledky, podle nichž až 90 % pacientů zůstává bez recidiv fibrilace síní a bez antiarytmik [12,14].
Klinické zlepšení po katetrové ablaci
Dlouhodobé klinické zlepšení po ablaci bylo hodnoceno podobně jako recidiva fibrilace síní v jednotlivých etapách sledování. Klinický benefit sledoval vývoj recidiv fibrilace síní, nicméně oba ukazatele sledování nejsou zcela totožné. Někteří pacienti měli zaznamenánu fibrilaci síní, přesto pro ně jejich zdravotní stav po ablaci znamenal významné zlepšení ve srovnání s mnoha symptomatickými paroxyzmy fibrilace síní, objevujícími se před ablací několikrát týdně a v trvání několika hodin až dní. Asi 10% rozdíl mezi zastoupením pacientů bez recidiv arytmie a pacientů s klinickým benefitem I a II vyjadřuje právě skutečnost, že u některých pacientů byla na EKG-Holteru zaznamenána krátká fibrilace síní trvající několik desítek sekund nebo že někteří pacienti měli i několikahodinovou recidivu fibrilace síní, nicméně jednou za několik měsíců např. pooperačním období nebo jiné zátěžové situaci.
Fibrilace síní je svým mechanizmem složitá arytmie a její etiologie je natolik multifaktoriální, že po ablaci nelze očekávat, že by v průběhu měsíců či let nemohlo za určitých okolností dojít k její recidivě. Klinický benefit nelze hodnotit tím, zda vůbec k nějaké recidivě fibrilace síní došlo či ne. Klinický benefit může u těchto pacientů vzejít jedině ze srovnání klinického stavu a nutné medikamentózní léčby před ablací a po ablaci.Výkon podstupují pacienti výrazně symptomatičtí. Navíc je u nich výskyt fibrilace síní tak častý a jednotlivé paroxyzmy natolik dlouhé, že jsou většinou indikací k nasazení trvalé antikoagulační léčby. Klinický benefit je ukazatel, který především vyjadřuje, zda byl pacient zbaven svých subjektivních potíží, kterými před ablací dlouhodobě trpěl a které dobře rozpoznal. Kromě toho je podle pravidelného hodnocení standardních a Holterových EKG-záznamů součástí klinického benefitu dosažení rozumné pravděpodobnosti, že pacient byl dostatečně zbaven klinicky závažných paroxyzmů fibrilace síní, že není nutné pokračovat v pravidelné antikoagulační léčbě. Pacienti ze souboru měli před ablací bez rozdílu dokumentovánu řadu EKG-záznamů s fibrilací síní. Absenci symptomů a fibrilace síní na četných EKG záznamech lze u těchto pacientů při současných klinických možnostech depistáže fibrilace síní považovat za dostatečnou informaci k tomu, aby se mohlo posoudit, zda bylo uvedeného klinického efektu dosaženo.
Srozumitelněji lze říci, že chceme-li hodnotit riziko asymptomatické fibrilace síní, jsou na tom pacienti, kteří po ablaci fibrilace síní dlouhodobě nemají původní symptomy a nemají dokumentovánu fibrilaci síní na EKG stejně nebo spíše lépe než jejich vrstevníci bez významnějšího strukturálního postižení srdce a s dalšími srovnatelnými klinickými znaky (jako je např. arteriální hypertenze), u nichž nebyla fibrilace síní zjištěna, a kteří proto také nejsou léčeni ani antiarytmiky, ani antikoagulací. Na rozdíl od nich však mají pacienti po úspěšné ablaci pro fibrilaci síní výhodu v tom, že by uměli případné recidivy arytmie na základě dřívějších zkušeností lépe rozpoznat a že podstupují pravidelná EKG-vyšetření.
Antikoagulační léčba po ablaci
Vývoj antikoagulační léčby koreloval po postupném vysazení od 9. měsíce s klinickým benefitem, její potřeba se pohybovala kolem 11 až 14 %. Vývoj antikoagulační léčby zahrnuje i skutečnost, že u některých pacientů byla tato léčba ponechána déle vzhledem k anamnéze systémové tromboembolické komplikace a že 2 pacienti měli antikoagulaci ponechánu trvale z jiné příčiny, ačkoli u obou byla fibrilace síní úspěšně odstraněna. Nikdo z pacientů neměl při této antikoagulační strategii od propuštění z hospitalizace za celou dobu sledování žádnou tromboembolickou komplikaci.
U 3 pacientů byl bezprostředně po ablaci prokázán trombus v levé srdeční síni, který byl u 2 pacientů asymptomatický, lokalizovaný v oušku levé síně. U 1 pacienta došlo po několika hodinách k výše zmíněné embolické komplikaci a při transezofageální echokardografii byl zjištěn trombus v ústí jedné z plicních žil. Tyto stavy ovšem souvisely se samotným výkonem a především s vytvořením rozsáhlejších lineárních lézí v levé síni, nikoli s dlouhodobou strategií léčby warfarinem.
Antiarytmická léčba po ablaci
Antiarytmická léčba má u pacientů s fibrilací síní jiné postavení, než je tomu obvykle u běžných supraventrikulárních tachyarytmií. Na rozdíl od nich se u pacientů s fibrilací síní před ablací ponechávala bez vysazení poslední antiarytmická léčba a ta se následně udržovala nejméně 1 až 3 měsíce po ablaci a podle potřeby i déle. Smyslem tohoto přístupu bylo co nejvíce po ablaci omezit výskyt fibrilace síní a napomoci reverzní elektrické remodelaci síní. Léčba pak byla postupně redukována a po nabytí jistoty, že v delším časovém úseku nedochází k recidivě arytmie, byla antiarytmika vysazena zcela. Pokud došlo po redukci antiarytmik, resp. po jejich vysazení k novým recidivám fibrilace síní, byla vrácena antiarytmická léčba v nejmenší nutné dávce, dostačující k potlačení arytmie. Teprve pacienti, jejichž stav nebyl uspokojivý ani s antiarytmickou léčbou, byli indikováni ke druhému ablačnímu výkonu.
Z vývoje antiarytmické léčby preparáty I. a III. třídy je zjevné, že se její potřeba po ablaci výrazně redukovala a že od 9. do 24. měsíce sledování byla potřebná u méně než 30 % pacientů. Jsou to údaje srovnatelné se zkušenostmi z jiných pracovišť [1,8].
Spotřeba amiodaronu se také výrazně snížila. Od 9. měsíce sledování užívalo amiodaron méně než 10 % pacientů.
Závěr
Katetrová ablace pro intermitentní fibrilaci síní, jejímž základem je kontinuálně měřená izolace plicních žil, je metoda technicky spolehlivě proveditelná. U prezentovaného souboru pacientů bylo katétrem se standardní 4mm koncovou elektrodou dosaženo úplné izolace u 96 % a s použitím katétru s chlazenou koncovou elektrodou prakticky u 100 % cílených plicních žil. Současně se tato metoda u uvedeného souboru ukázala jako poměrně bezpečná s méně než 1% výskytem závažných komplikací. Riziko vzniku klinicky závažné stenózy plicní žíly je při zvolené metodě minimální.
Dlouhodobě zůstává po ustálení stavu v prvních 3 měsících po ablaci a po provedení opakované ablace (u 15 % pacientů) asi 80 až 85 % pacientů bez dokumentované či klinicky suspektní recidivy fibrilace síní a významný klinický užitek vycházející z porovnání klinického stavu před ablací a po ablaci byl dosažen u 90 až 95 % pacientů. S klinickým užitkem, čili eliminací klinicky významných fibrilací síní, koreluje i potřeba antikoagulační léčby. Absence tromboembolických komplikací v době sledování podporuje oprávněnost použité antikoagulační strategie.
Léčba antiarytmiky I. a III. třídy stejně jako léčba amiodaronem byla po úspěšné ablaci zcela vysazena u většiny pacientů. Nicméně u jedné čtvrtiny až třetiny nemocných byla v jednotlivých obdobích kombinace efektu výkonu a antiarytmické léčby nezbytná k dosažení zásadního klinického zlepšení. Nelze však přehlédnout, že v mnoha případech stačila menší dávka dříve neúčinného antiarytmika a že u mnoha pacientů mohl být vysazen amiodaron a nahrazen antiarytmikem s výrazně menšími nežádoucími účinky.
Práce je podpořena grantem IGA MZ NA7217-3/2002.
MUDr. Martin Fiala, Ph.D.
www.nempodlesi.cz
e-mail: martin.fiala@nempodlesi.cz
Doručeno do redakce: 21. 10. 2004
Přijato po recenzi: 3. 2. 2005
Zdroje
1. Arentz T, von Rosenthal J, Blum T et al. Feasibility and safety of pulmonary vein isolation using a new mapping and navigation system in patients with refractory atrial fibrillation. Circulation 2003; 108 : 2484-2490.
2. Cappato R, Negroni S, Pecora D et al. Prospective assessment of late conduction recurrence across radiofrequency lesions producing electrical disconnection at the pulmonary vein ostium in patients with atrial fibrillation. Circulation 2003; 108 : 1599-1604.
3. Haïssaguerre M, Jais P, Shah DC et al. Right and left atrial radiofrequency catheter therapy of paroxysmal atrial fibrillation. J Cardiovasc Electrophysiol 1996; 7 : 1132-1144.
4. Haïssaguerre M, Jais P, Shah DC et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med 1998; 339 : 659-666.
5. Haïssaguerre M, Shah DC, Jais P et al. Electrophysiological breakthroughs from the left atrium to the pulmonary veins. Circulation 2000; 101 : 1409-1417.
6. Hwang C, Karagueuzian HS, Chen PS. Idiopathic paroxysmal atrial fibrillation induced by focal discharge mechanism in the left superior pulmonary vein: Possible roles of the ligament of Mashall. J Cardiovasc Electrophysiol 1999; 10 : 636-648.
7. Jalife J, Berenfeld O, Mansour M. Mother rotors and fibrillatory conduction: A mechanism of atrial fibrillation. Cardiovasc Res 2002; 54 : 204-216.
8. Macle L, Jaïs P, Weerasooriya R et al. Irrigated-tip catheter ablation of pulmonary veins for treatment of atrial fibrillation. J Cardiovasc Electrophysiol 2002; 13 : 1067-1073.
9. Maloney JD, Milner L, Barold S et al. Two-staged biatrial linear and focal ablation to restore sinus rhythm in patients with refractory chronic atrial fibrillation. Pacing Clin Electrophysiol 1998; 21 : 2527-2532.
10. Mandapati R, Skanes A, Chen J et al. Stable microreentrant sources as a mechanism of atrial fibrillation in the isolated sheep heart. Circulation 2000; 1 : 194-199.
11. Marrouche NF, Dresing T, Cole C et al. Circular mapping and ablation of the pulmonary vein for treatment of atrial fibrillation. J Am Coll Cardiol 2002; 40 : 464-474.
12. Oral H, Scharf C, Chugh A et al. Catheter ablation for paroxysmal atrial fibrillation: segmental pulmonary vein ostial ablation versus left atrial ablation. Circulation 2003; 108 : 2355-2360.
13. Pappone C, Oreto G, Lamberti F, et al. Catheter ablation of paroxysmal atrial fibrillation using 3D mapping system. Circulation 1999; 100 : 1203-1208.
14. Pappone C, Oreto G, Rosanio S et al. Atrial electroanatomic remodelling after circumferential radiofrequency pulmonary vein ablation. Efficacy of an anatomic approach in a large cohort of patients with atrial fibrillation. Circulation 2001; 104 : 2539-2544.
15. Pappone C, Rosanio S, Augello G et al. Mortality, morbidity, and quality of life after circumferential pulmonary vein ablation for atrial fibrillation. J Am Coll Cardiol 2003; 42 : 185-197.
16. Pappone C, Rosanio S, Oreto G et al. Circumferential radiofrequency ablation of pulmonary vein ostia. A new anatomic approach for curing atrial fibrillation. Circulation 2000; 102 : 2619-2628.
17. Pappone C, Santinelli V, Manguso F et al. Pulmonary vein denervation enhances long-term benefit after circumferential ablation for paroxysmal atrial fibrillation. Circulation 2004; 109 : 327-334.
18. Platonov PG, Mitrofanova LB, Chireikin LV et al. Morphology of interatrial conduction routes in patients with atrial fibrillation. Europace 2002; 4 : 183-192.
19. Pürerfellner H, Cihal R, Aichinger J et al. Pulmonary vein stenosis by ostial irrigated-tip ablation: Incidence, time course, and prediction. J Cardiovasc Electrophysiol 2003; 14 : 158-164.
20. Taylor GW, Neal GK, Zheng X et al. Pathological effects of extensive radiofrequency applications in the pulmonary veins in dogs. Circulation 2000; 101 : 1736-1742.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Význam kombinovaného rehabilitačního programu u nemocných s chronickou ischemickou chorobou srdečníČlánek Nekomplikovaný priebeh“ hypertenzie, paroxyzmálnej atriálnej fibrilácie a esenciálnej trombocytémieČlánek KarcinoidČlánek Stoleté výročíČlánek Dopis redakciČlánek „Editorialmánie“Článek Z odborné literaturyČlánek Karcinoid – editorial
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2005 Číslo 9- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Nekomplikovaný priebeh“ hypertenzie, paroxyzmálnej atriálnej fibrilácie a esenciálnej trombocytémie
- Karcinoid
-
Prevence kardiovaskulárních onemocnění v dospělém věku
Společné doporučení českých odborných společností -
Diskusní příspěvek k článku: Pospíšilová Y, Adam Z, Vorlíček J.
Postavení výuky interní propedeutiky (a oboru vnitřního lékařství obecně) v době stále pokračující specializace v oblasti interní medicíny.
Vnitř Lék 2005; 51: 479-481. - Stoleté výročí
- Dopis redakci
- „Editorialmánie“
- Z odborné literatury
- Je tělesný trénink nezbytnou součástí léčby chronické ICHS i v 21. století? – editorial
- Radiofrekvenční ablace v terapii arytmií – editorial
- Migraeflux v akutní léčbě migrény – editorial
- Karcinoid – editorial
- Lack of Efficacy of Ticlopidine Pre-Treatment in the Reduction of Troponin I Release Following Percutaneous Intervention in Stable Angina Patients
- Esenciální hypertenze a Arg16Gly polymorfizmus genu pro β2-adrenergní receptor
- Význam vyšetření kontraktilní rezervy levé komory dobutaminovou echokardiografií u nemocných s pokročilým chronickým srdečním selháním
- Význam kombinovaného rehabilitačního programu u nemocných s chronickou ischemickou chorobou srdeční
- Big endotelin, interleukin 6 a funkce pravé komory
- Léčba symptomatické intermitentní fibrilace síní katetrovou ablací v levé srdeční síni. Bezprostřední a dlouhodobé výsledky u 150 pacientů
- Migraeflux v akutní léčbě migrény
- Účinnost a komplikace léčby snímatelnými kontaktními fixacemi u pacientů s neuropatickými ulceracemi, akutní Charcotovou osteoartropatií a neuropatickými frakturami
- Poruchy metabolizmu železa II.
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Karcinoid
- Poruchy metabolizmu železa II.
- Migraeflux v akutní léčbě migrény
- Význam vyšetření kontraktilní rezervy levé komory dobutaminovou echokardiografií u nemocných s pokročilým chronickým srdečním selháním
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



