-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Zobrazovací metody v diagnostice viability myokardu.
Část 1. Interpretace nálezů při zobrazování viability myokardu pomocí SPECT a PET
Myocardial viability findings interpretation using SPECT and PET imaging
Myocardial perfusion and function imaging using single photon emission computed tomography (SPECT) plays the important role in coronary artery disease diagnostics and risk stratification, however, there is nowadays growing significance of the myocardial viability detection. A glucose metabolism assessment using positron emission tomography (PET) becomes accessible also. A brief review is given about the interpretation principle in the viable myocardium diagnosis and current progress in perfusion and metabolism defect severity quantification in patients with the left ventricular dysfunction.
Key words:
myocardial viability – SPECT – PET
Autori: M. Kamínek 1; M. Hutyra 2
Pôsobisko autorov: Klinika nukleární medicíny Lékařské fakulty UP a FN Olomouc, přednosta doc. MUDr. Miroslav Mysliveček, Ph. D. 1; I. interní klinika Lékařské fakulty UP a FN Olomouc, přednosta prof. MUDr. Jan Lukl, CSc. 2
Vyšlo v časopise: Vnitř Lék 2008; 54(10): 971-978
Kategória: Přehledné referáty
Súhrn
Zobrazování myokardiální perfuze a funkce jednofotonovou emisní tomografií (SPECT) dnes hraje důležitou roli nejen v diagnostice ischemické choroby srdeční a při posuzování její prognózy, ale stále více nabývá na významu také při detekci viabilního myokardu. Dostupnějším se stává i vyšetřování metabolizmu glukózy pomocí pozitronové emisní tomografie (PET). Je podán stručný přehled o zásadách interpretace těchto vyšetření v diagnostice viabilního myokardu a o současném pokroku při kvantifikaci významnosti perfuzních a metabolických defektů u pacientů s dysfunkcí levé komory srdeční.
Klíčová slova:
viabilita myokardu – SPECT – PETÚvod
Zobrazování myokardiální perfuze pomocí jednofotonové emisní tomografie (SPECT) hraje důležitou roli při neinvazivní diagnostice ischemické choroby srdeční (ICHS), při posuzování její prognózy, při detekci ischemie u pacientů po koronární revaskularizaci a stále více i při zjišťování viability myokardu. Zjištění viability myokardu má klinický význam u pacientů s dysfunkcí levé komory a nízkou ejekční frakcí (EF) levé komory. Signifikantně horší prognózu mají nemocní s dysfunkčním viabilním myokardem, nejsou‑li revaskularizováni, než ti, kteří se podrobili revaskularizaci, nebo než nemocní s dysfunkčním neviabilním myokardem. Zpravidla zajímá intervenční kardiology nejen viabilita, ale také rozsah a závažnost ischemie v jednotlivých koronárních povodích. Proto se při zobrazování viability jeví nejcennějším testem zátěžové SPECT vyšetření, které poskytne odpověď na oba dotazy. Avšak ne u všech pacientů s dysfunkcí levé komory je možné zátěž bezpečně provést. Pokud tedy klinický dotaz směřuje především na viabilitu, provádíme u vysoce rizikových pacientů pouze klidová SPECT vyšetření. V ně-kte-rých případech pak lze kombinovat perfuzní SPECT se zobrazením metabolizmu glukózy pozitronovou emisní tomografií (PET).
Počítačové zpracování dat a jejich automatické kvantitativní hodnocení doznalo v poslední době obrovského rozvoje. Standardem pro SPECT zobrazování je v současnosti EKG synchronizované nahrávání dat (gated SPECT), které umožňuje po aplikaci perfuzního radiofarmaka posoudit nejen perfuzi, ale i funkci levé komory [1–14].
Hodnocení zátěžových gated SPECT vyšetření
Vizuálně hodnotíme lokalizaci a charakter perfuzního defektu, který by měl být patrný v několika po sobě jdoucích řezech, a to alespoň ve dvou na sebe kolmých rovinách. Standardní orientace pro SPECT zobrazování myokardu je uvedena na obr. 1.
Obr. 1. Standardní orientace pro SPECT zobrazení myokardu. 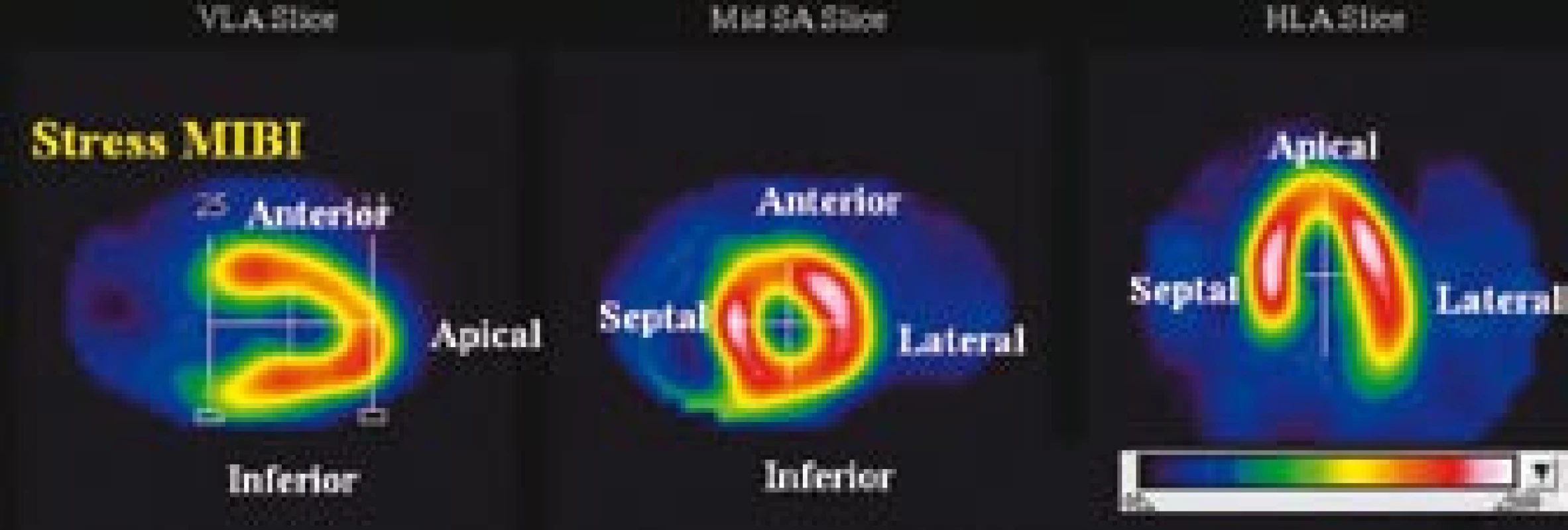
Nálezy zátěžové scintigrafie myokardu jsou v zásadě tříděny na:
- normální perfuzi
- reverzibilní defekt (ischemii) (obr. 2)
- fixní defekt perfuze (obr. 3)
Obr. 2. Zátěží navozený reverzibilní defekt perfuze svědčící pro ischemii apikálně a inferoseptálně. Pro ischemii dále svědčí zvýšený poměr tranzientní ischemické dilatace (TID = 1,26). 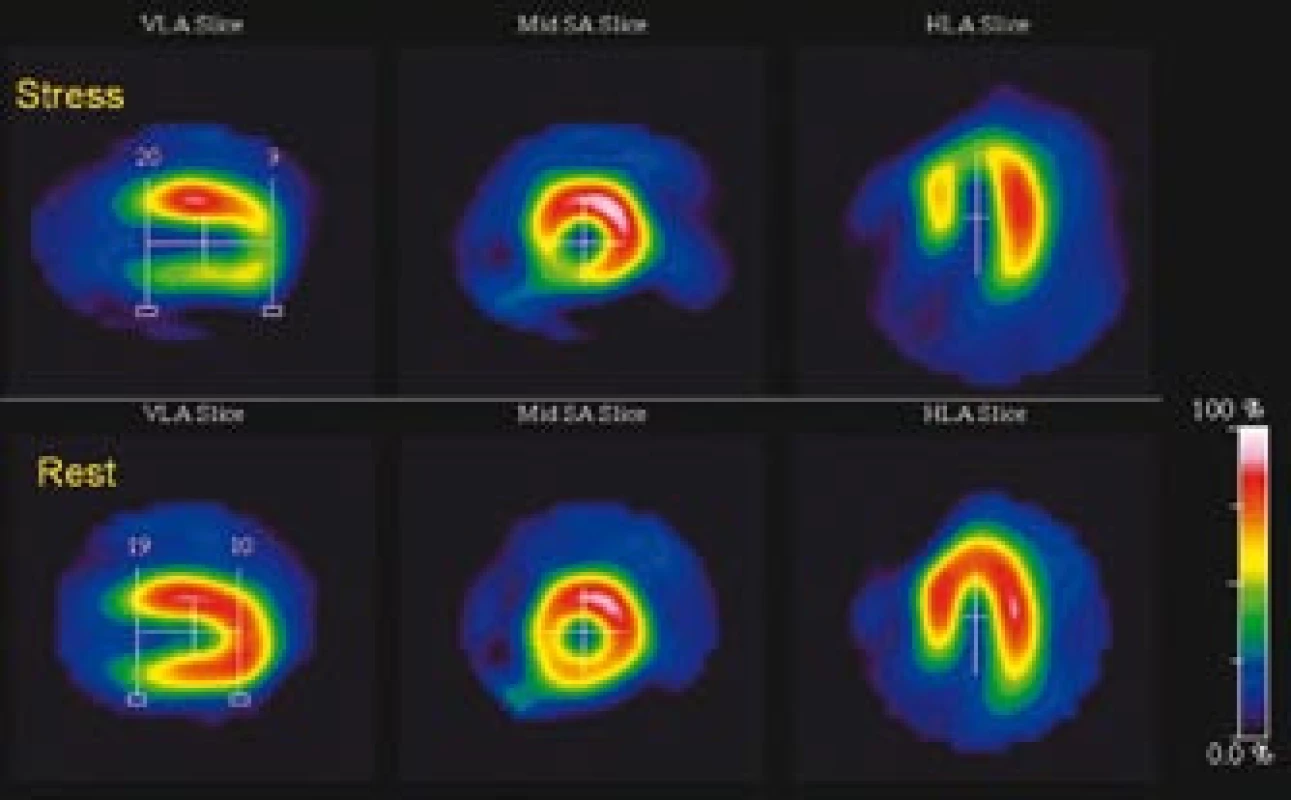
Obr. 3. Fixní defekt perfuze laterálně a inferolaterálně s nízkým uptakem radiofarmaka (< 50 % maxima) odpovídající jizvě po infarktu myokardu. 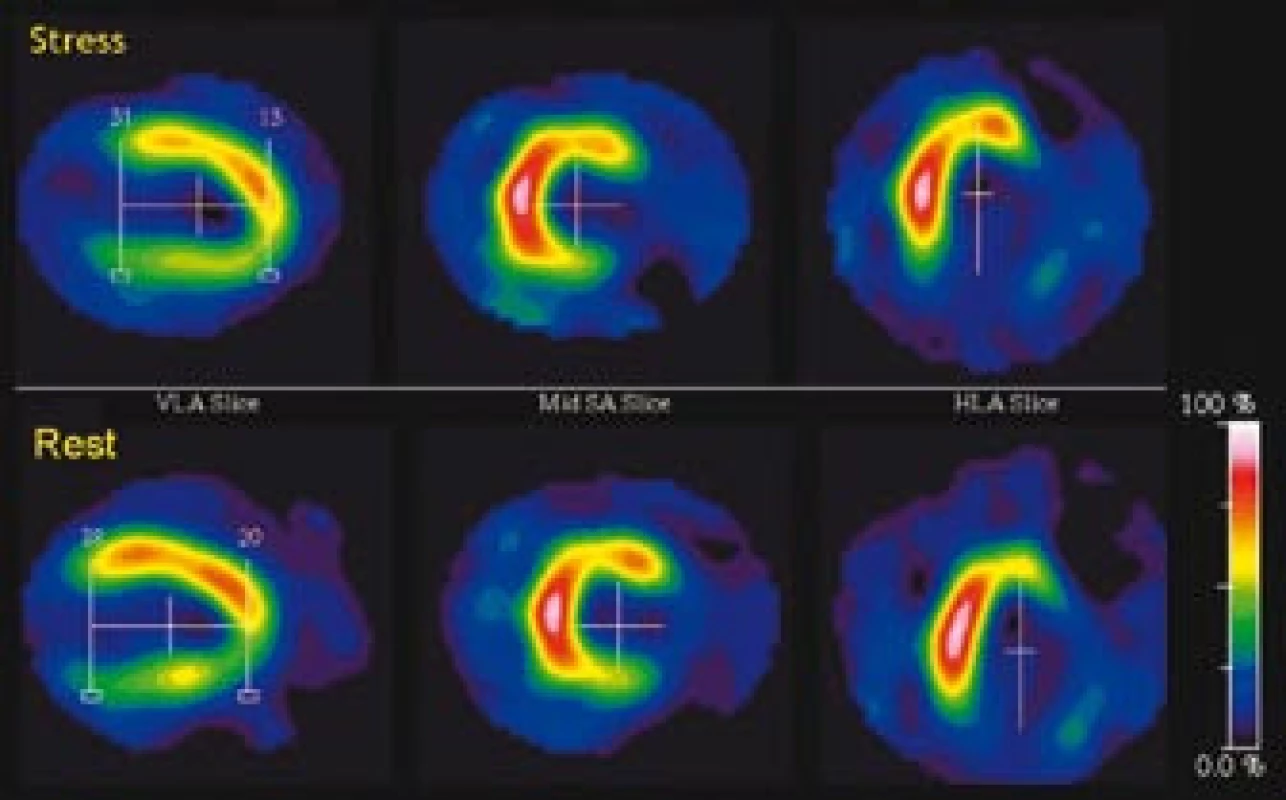
Z rozdílné velikosti kavity levé komory po zátěži a v klidu můžeme často již pouhým okem rozpoznat její tranzientní ischemickou dilataci (TID), při počítačovém hodnocení je pak kvantitativně stanoven TID poměr (obr. 2 a 7A) [8]. Nález reverzibilního perfuzního defektu v dysfunkčním myokardu můžeme hodnotit jako ischemický, ale viabilní myokard. V těchto segmentech pak dochází po revaskularizaci k úpravě funkce [15–17]. Nález fixního defektu často odpovídá neviabilnímu myokardu, avšak nemusí tomu tak být ve všech případech (je nezbytné posoudit kvantitativně úroveň vychytávání radiofarmaka v dysfunkčním myokardu).
Pro kvantitativní hodnocení významnosti perfuzních defektů se používají softwarově generované polární mapy (schéma jejich konstrukce je na obr. 4), je potřeba mít k dispozici ně-kte-rý z komerčně dostupných kardiologických programů vybavených normálovou databází vytvořenou ze souboru zdravých dobrovolníků (zvlášť pro muže, pro ženy a pro jednotlivá radiofarmaka). Nejrozšířenějšími takovými programy jsou Cedar Sinai QPS/QGS, Emory Cardiac Toolbox a 4D-MSPECT [5–7,10]. Tyto softwary nám umožňují kvantifikovat hned několik klinicky důležitých parametrů.
Obr. 4. Schéma konstrukce polárních map [36]. ![Schéma konstrukce polárních map [36].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/8b917891fa8e50845ff99641df994cbd.jpg)
Rozsah a závažnost perfuzní abnormality
Existuje několik možností, jak prezentovat rozsah a závažnost perfuzní abnormality. Při porovnání dat pacienta s normálovou databází můžeme kvantifikovat rozsah defektu pomocí tzv. „defect blackout map“, kdy perfuzní defekt je definován jako zhoršení perfuze o více než 2,5 standardních odchylek (SD) ve srovnání s databází. Obrazové body s touto vlastností jsou graficky vyjádřeny černě, rozsah defektu se udává v procentech z levé komory a z jednotlivých koronárních povodí (obr. 5). Pokud chceme kvantifikovat současně rozsah i závažnost defektu (tj. jeho hloubku), použijeme segmentální skórink systém [10–12]. Perfuze v jednotlivých 17 segmentech levé komory je opět porovnávána s normálovou databází a podle SD je charakterizována 5stupňovou škálou, kdy 0 = normální perfuze a 4 = absence vychytávání radiofarmaka (obr. 5). Každý ze segmentů levé komory je tedy takto ohodnocen, body se sčítají a stanovuje se tzv. sumační zátěžové skóre (summed stress score – SSS) a sumační rozdílové skóre (summed difference score – SDS), které mají prognostický význam (tab. 1) [3,10,12].
Tab. 1. Frekvence náhlé srdeční smrti a nefatálního infarktu myokardu (% za rok) u 5 183 pacientů vyšetřených pomocí zátěžového SPECT zobrazení myokardiální perfuze. 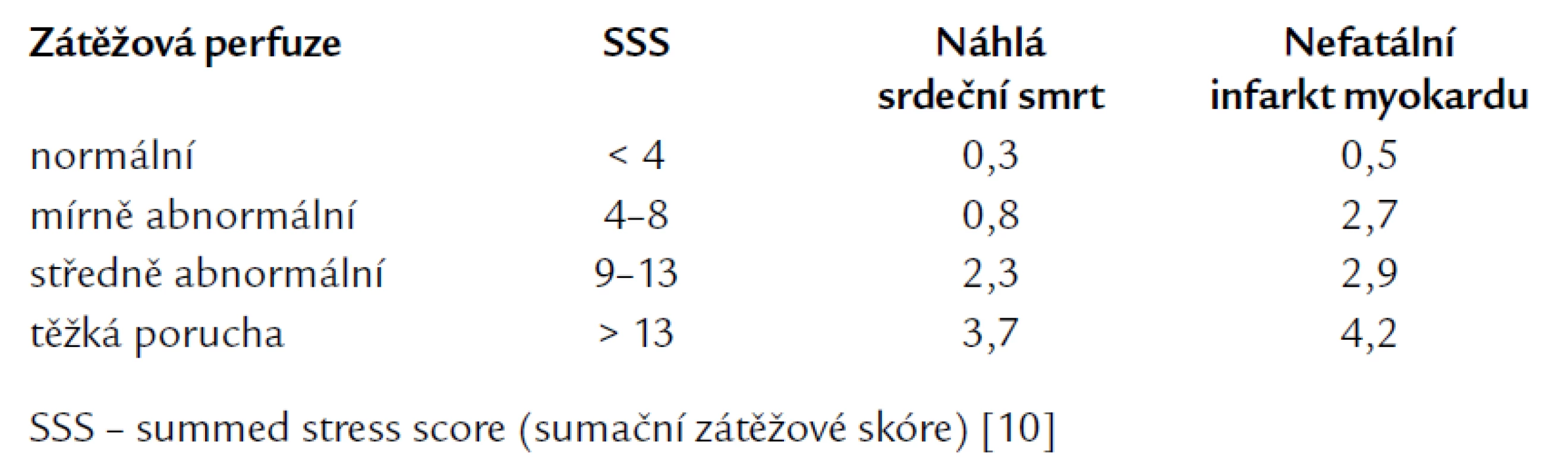
Obr. 5. Ukázka možností kvantifikace perfuzní abnormality u 73letého muže. Pomocí tzv. „defect blackout map“ je znázorněn rozsah defektu (74 % z levé komory), který zasahuje do všech povodí všech 3 koronárních tepen [36]. ![Ukázka možností kvantifikace perfuzní abnormality u 73letého muže. Pomocí tzv. „defect blackout map“ je znázorněn rozsah defektu (74 % z levé komory), který zasahuje do všech povodí všech 3 koronárních tepen [36].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/b579454b612a59d7d9d3b6ffab2e3d87.jpg)
LAD – left anterior descending artery, LCX – left circumflex artery, RCA – right coronary artery. Pomocí sumačního zátěžového skóre (SSS) je vyjádřena současně i závažnost perfuzní abnormality v jednotlivých segmentech (SSS 42 svědčí pro těžkou poruchu perfuze po zátěži) U pacientů s dysfunkcí levé komory je důležité kvantitativní stanovení rozsahu viabilního a neviabilního myokardu. Reverzibilní defekt (při počítačovém zpracování s více než 10% klidovou úpravou perfuze) považujeme za ischemický, ale viabilní myokard (obr. 6, 7). Při nálezu fixního defektu perfuze záleží na úrovni vychytávání radiofarmaka – za neviabilní jsou považovány dysfunkční segmenty s vychytáváním < 50 % maximální aktivity v daném tomografickém řezu (tato koncentrace odpovídá méně než 50 % myocytů se zachovanou integritou buněčné membrány, obr. 3). Pokud zobrazíme v dysfunkčním segmentu zhoršenou perfuzi, ale vychytávání radiofarmaka je ještě nad hranicí 50 % maxima, svědčí tento nález pro hibernující myokard. Nález normální perfuze v dysfunkčním segmentu pak odpovídá omráčenému myokardu.
Funkce levé komory
Pomocí gated SPECT získáme informace o pozátěžové a klidové EF levé komory, objemech levé komory v end‑diastole (ED) a end‑systole (ES) a o její regionální kinetice. Tyto informace jsou důležité jak při posuzování prognózy, kdy se zjištěná pozátěžová dysfunkce levé komory pojí s vysokým rizikem kardiální příhody [1,2,8,13,14], tak i při detekci viability (obr. 7). Při interpretaci scintigrafického nálezu je vždy nezbytné vědět, které segmenty levé komory jsou dysfunkční, a také je nutné znát aktuální funkci levé komory. Např. bezprostředně po akutní koronární příhodě může mít pacient omráčení myokardu (stunning) a v době provedení našeho vyšetření pak již může být kinetika stěn upravena. U jiného pacienta naopak může docházet vlivem repetitivního stunningu k postupnému zhoršování funkce. Pro hodnocení regionální kinetiky pomocí gated SPECT používáme dva pojmy: systolické ztlušťování a hybnost stěny (wall thickening a wall motion) [1,9]. Zatímco hodnocení wall thickening (WT) je založeno na systolickém nárůstu hustoty impulzů vlivem tzv. efektu částečného objemu, wall motion (WM) software hodnotí jako pohyb endokardiální kontury vyjádřený v mm (obr. 6, 7, 9). Obvykle jsou WT i WM shodně normální či abnormální, v ně-kte-rých případech však dochází k jejich diskrepanci (např. po CABG, u pacientů s kompletním blokem levého Tatarova raménka, u malých jizev apod.) [4].
Obr. 6. (a) Zátěž <sup>99m</sup>Tc- MIBI/ klid <sup>201</sup>Tl SPECT zobrazuje rozsáhlo u ischemii u 75leté pacientky. Závažný parciálně reverzibilní defekt je patrný v oblasti hrotu, septa, přední a spodní stěny. (b) Kvantitativně se jedná o perfuzní defekt v rozsahu 73 % z levé komory, sumační zátěžové skóre (SSS) je 34, sumační klidové skóre (SRS) je 11. (c) Gated SPECT 3D zobrazení endokardiálního povrchu v end‑diastole (ED) a end‑systole (ES) svědčí pro výraznou dilataci levé komory, těžkou difuzní hypokinézu, pozátěžová i klidová EF = 21 %. Koronarografie prokázala závažné stenózy všech 3 koronárních tepen a následně byla provedena chirurgická revaskularizace myokardu. 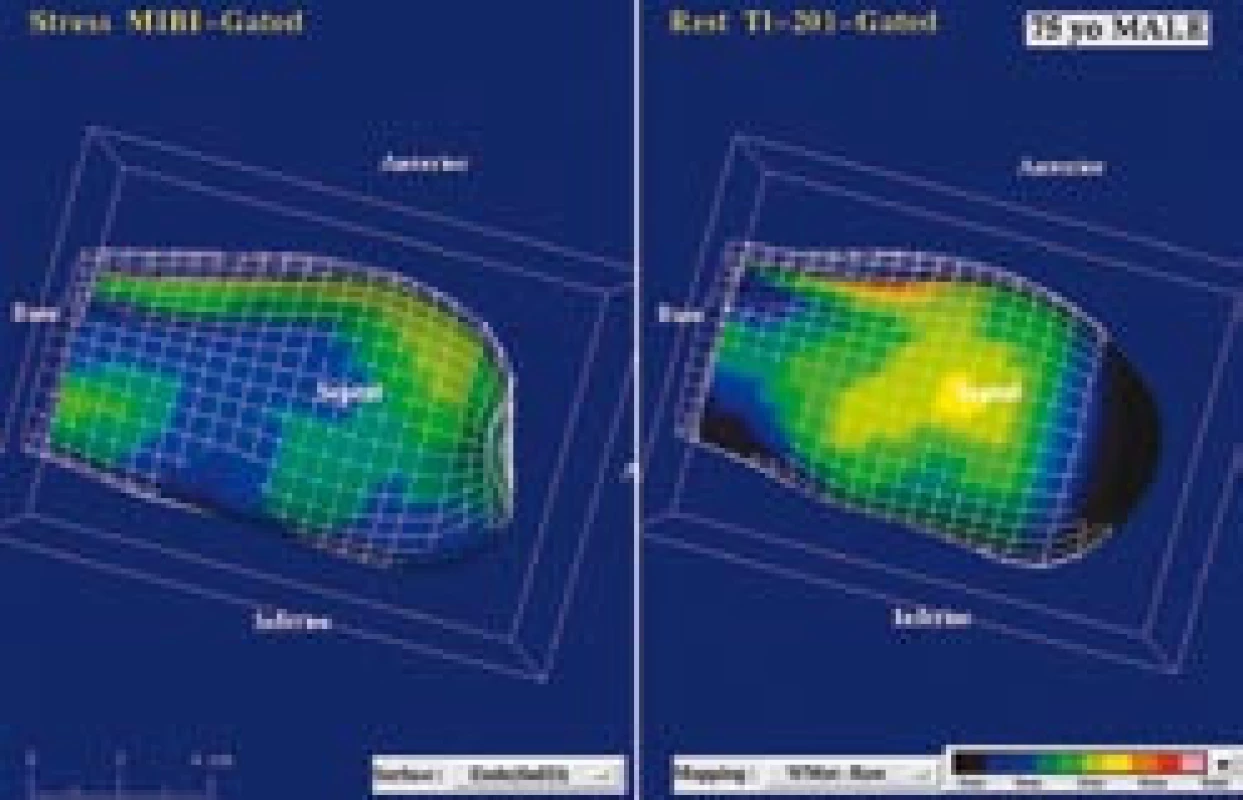
Obr. 7. Na zátěžové <sup>201</sup>Tl SPECT vyšetření byl odeslán 77letý pacient s echokardiografickým nálezem difuzní hypokinézy levé komory s apikální akinézou, EF 25 %. Na tomografických řezech (a) i polárních mapách (b) je zobrazen ischemický, ale viabilní myokard apikálně, anteriorně a laterálně. Kvantitativně je sumační zátěžové skóre (SSS) zvýšeno na 20, zatímco sumační klidové skóre (SRS) je 11. Levá komora je po zátěži extrémně dilatována s částečnou úpravou v klidu (TID poměr = 1,22). (c) Gated SPECT 3D zobrazení endokardiálního povrchu v end‑diastole (ED) a end‑systole (ES). Již v klidu jsou výrazně zvýšené objemy v ED a ES (263 ml, resp. 183 ml), je zobrazena difuzní hypokinéza, klidová EF je 31 %. Po zátěži dochází k dalšímu zhoršení kinetiky anterolaterálně a apikálně, objemy v ED a ES narůstají (295 ml, resp. 232 ml), pozátěžová EF je snížena na 21 %. Následně provedená koronarografie prokázala nemoc tří tepen. Tento nález byl vzhledem k difuznímu charakteru postižení obtížně řešitelný revaskularizací. Za 3 měsíce po vyšetření pacient zemřel na akutní infarkt myokardu. 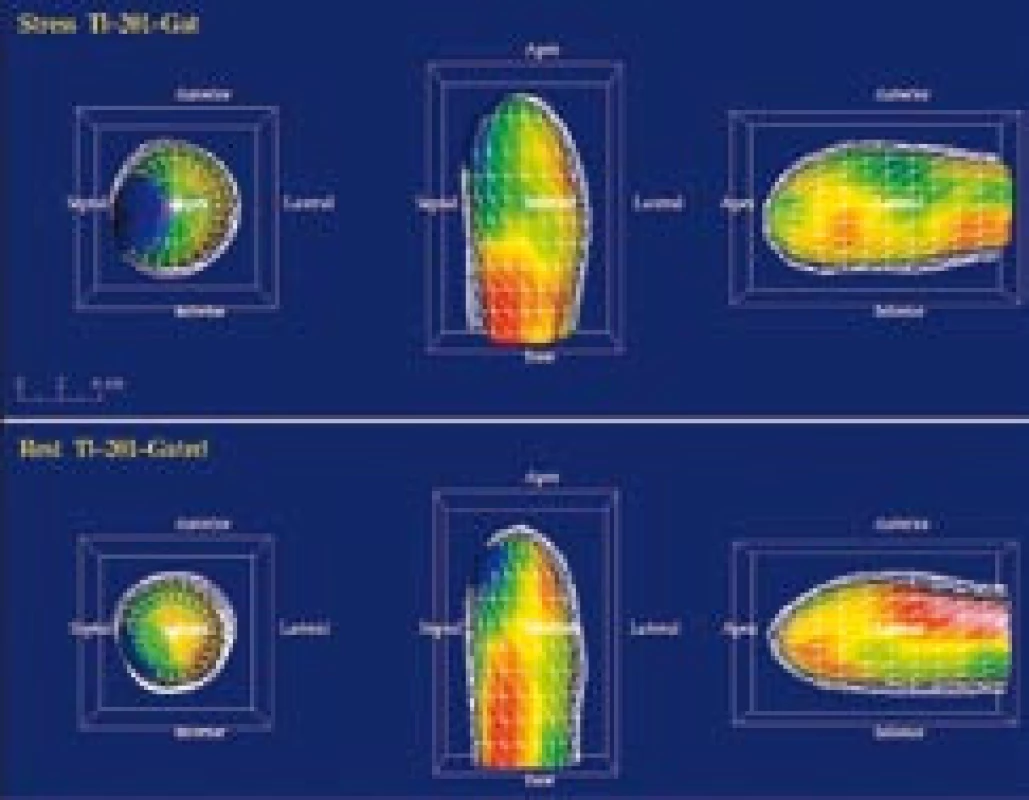
Obr. 8. Různé typy klidových protokolů pro vyšetření viability myokardu [36]. ![Různé typy klidových protokolů pro vyšetření viability myokardu [36].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/68301ca3b52449ca4034d7e86236f666.png)
Samostatná klidová gated SPECT vyšetření
Klidové studie se uplatňují u vysoce rizikových pacientů, zejména s velmi nízkou EF levé komory, levostrannou srdeční insuficiencí, klidovou symptomatologií apod. Rovněž zde je důležitá kvantifikace rozsahu a závažnost perfuzní abnormality [15–23]. Po aplikaci perfuzních radiofarmak v klidu se zkoumá integrita buněčné membrány, o čemž nás informuje stupeň vychytávání radionuklidu v dysfunkčních segmentech. Za hranici pro průkaz viabilního myokardu je obvykle považována 50% a vyšší kumulace radiofarmaka v porovnání s maximální koncentrací v daných tomografických řezech. Tato hranice byla stanovena nejprve empiricky – v segmentech s uptakem radiofarmaka > 50 % maxima dochází po koronární revaskularizaci k úpravě funkce. Později bylo zjištěno, že tato úroveň vychytávání radiofarmaka odpovídá 50 % myocytů se zachovanou integritou buněčné membrány [15,16,19]. Prognostický význam má kvantitativní stanovení rozsahu jizvy (mortalita se zvyšuje s její velikostí), tak i rozsahu hibernujícího myokardu (vysoká mortalita při konzervativním řešení) [15,19].
Existuje několik protokolů pro klidovou studii viability (obr. 8). Při použití 201thallia (201Tl) se provádí klidová studie jako tzv. rest-redistribuční protokol (klidové zobrazení časně po aplikaci 201Tl a následně pak za 3–4 hod). Redistribuční defekt perfuze pak umožňuje rozpoznat hibernující myokard jako oblast s relativně sníženou perfuzí na časných obrazech, ale se zachovanou schopností dostatečné kumulace radiofarmaka na pozdním zobrazení za 4 hod [15–17] . Při použití 99mtechneciem (99mTc) značených radiofarmak (MIBI, resp. Tetrofosmin) lze v některých případech porovnat perfuzi za bazálních podmínek a po podání nitrátů [2,17,20–23].
Zjišťování metabolizmu glukózy pomocí PET
Význam zobrazení glukózového metabolizmu po aplikaci 18F-fluorodeoxyglukózy (FDG) pro průkaz viability myokardu byl prokázán řadou studií [18,24–30]. FDG PET navazuje buď na zátěžový test, nebo častěji na klidové zobrazení perfuze (obr. 8, 9). Existuje více variant zobrazení perfuze v rámci těchto studií (např. pomocí SPECT po aplikaci 201Tl nebo 99mTc radiofarmak nebo pomocí PET po aplikaci 82Rb, 13N značeného čpavku, 15O značené vody). V dysfunkčních segmentech pak rozeznáváme 4 základní typy nálezů (tab. 2). Vedle všeobecně známých kategorií omráčení (normální perfuze a metabolizmus), hibernace (perfuzně‑metabolický mismatch) a jizvy (perfuzně‑metabolický match) je nově popisován tzv. reverzní mismatch (tj. normální nebo jen lehká snížená perfuze a významná alterace metabolizmu), který je považován za známku omráčení myokardu, a lze tedy očekávat úpravu funkce po revaskularizaci [24]. V žádném případě tedy nelze hodnotit FDG PET samostatně bez znalosti perfuze a funkce levé komory.
Tab. 2. Hodnocení perfuze a metabolizmu glukózy v dysfunkčních segmentech levé komory [24]. ![Hodnocení perfuze a metabolizmu glukózy v dysfunkčních segmentech levé komory [24].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/1b86d415b0c7e7afe2df1652ee746b43.png)
Obr. 9. 55letý muž s akutním anteroextenzivním infarktem myokardu léčeným direktní perkutánní koronární intervencí (PCI) na ramus interventricularis anterior. Po průkazu neviabilního myokardu (dobutaminovo u echokardiografií, SPECT a PET) byl pacient randomizovaně zařazen do kontrolního souboru v projektu zkoumajícím efekt buněk kostní dřeně na reparaci infarktového ložiska. (a) Na tomografických řezech po aplikaci <sup>99m</sup>Tc- MIBI SPECT a <sup>18</sup>F- FDG levé komory v horizontální dlouhé ose je zobrazen „perfuzně‑metabolický match“ (jizva) anteriorně, anteroseptálně a apikálně. (b) Kvantifikace na polárních mapách u téhož pacienta svědčí pro rozsáhlý neviabilní myokard tvořící 56 % z levé komory a 90 % z povodí ramus interventricularis anterior (LAD). (c) Gated SPECT 3D zobrazení endokardiálního povrchu v end‑di astole (ED) a end‑systole (ES). Při vstupním vyšetření (horní řádek) je patrná hypokinéza přední stěny, septa a hrotu. Objemy v ED a ES byly výrazně zvýšené (239 ml, resp. 151 ml) a EF snížena na 37 %. Při kontrole za 3 měsíce po PCI (dolní řádek) je patrné, že regionální kinetika se nezlepšuje, naopak dochází k poinfarktové remodelaci s nárůstem objemů v ED a ES (299 ml, resp. ESV 205 ml) a dalšímu snížení EF na EF 31 %. 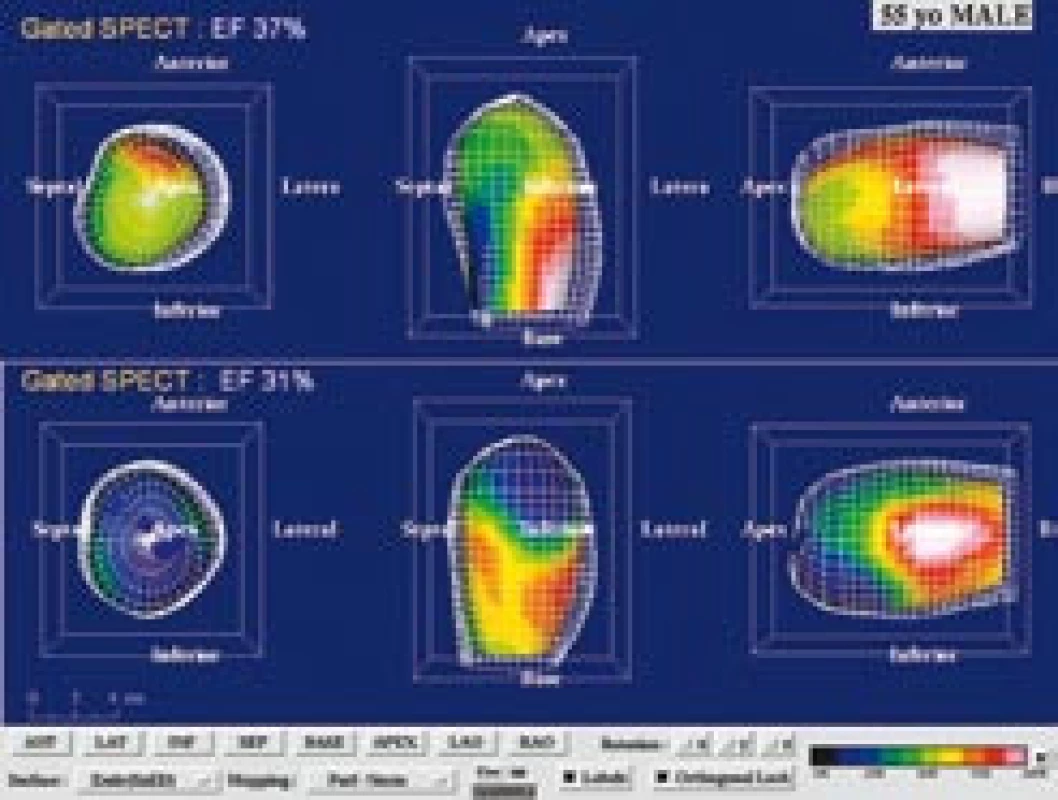
Cena FDG PET je sice významně vyšší než u ostatních radionuklidových metod nebo u dobutaminové echokardiografie, jedná se však o test s nejvyšší senzitivitou pro detekci viabilního myokardu. Senzitivita FDG PET dosahuje až 93 %, zatímco u ostatních konvenčních testů se pohybuje kolem 80–85 %, a může tak docházet k jejímu určitému podhodnocení (a to zejména u nejzávažnějších pacientů s velmi nízkou EF) [18]. Důležitost FDG PET pak podporuje pozorovaná vysoká mortalita, která se pojí s konzervativní léčbou u pacientů s dysfunkčním viabilním myokardem [18,24,27,30]. V neposlední řadě je také třeba zmínit důležitost přesného zkoumání viability při klinickém výzkumu. V projektu zkoumajícím vliv intrakoronární transplantace mononukleárních buněk kostní dřeně na reparaci infarktového ložiska jsme využili vedle dobutaminové echokardiografie všech tč. dostupných možností, které poskytuje současná klinická nukleární kardiologie [31–33].
Závěr
Při radionuklidovém zjišťování viability myokardu využíváme celé škály metod od zátěžových testů přes samostatné klidové perfuzní SPECT studie až po zjišťování metabolizmu glukózy pomocí PET. Díky rychlému rozvoji počítačových technologií bylo dosaženo velkého pokroku při kvantitativním určování rozsahu viabilního a neviabilního myokardu i při monitorování porevaskularizačního vývoje funkčních parametrů levé komory pomocí gated SPECT (regionální kinetika, end‑diastolické a end‑systolické objemy, EF). Radionuklidové metody tak v rutinním provozu přispívají k výběru správné léčebné strategie, ve výzkumných projektech také k lepšímu pochopení efektu nových terapeutických možností. Pro správné posouzení viability myokardu lze s výhodou kombinovat radionuklidové metody s dalšími zobrazovacími modalitami [15,31–35].
doc. MUDr. Milan Kamínek, Ph.D.
www.fnol.cz
e‑mail: milankaminek@seznam.cz
Doručeno do redakce: 5. 5. 2008
Přijato po recenzi: 4. 6. 2008
Zdroje
1. Germano G, Berman DS. Regional and Global Ventricular Function and Volumes from Single‑Photon Emission Computed Tomography Perfusion Imaging. In: Zaret BL, Beller GA. Clinical Nuclear Cardiology. 3rd ed. Philadelphia: Elsevier Mosby 2005 : 189–212.
2. Hesse B, Tägil K, Cuocolo A et al. EANM/ESC procedural guidelines for myocardial perfusion imaging in nuclear cardiology. Eur J Nucl Med Mol Imaging 2005; 32 : 855–897.
3. Hachamovitch R. Clinical value of combined perfusion and function imaging in the diagnosis, prognosis, and management of patients with suspected or known coronary artery disease. In: Germano G, Berman DS. Clinical gated cardiac SPECT. Armonk, New York: Futura Publishing Company, Inc., 1999 : 239–258.
4. Hesse B, Lindhardt TB, Acampa W et al. EANM/ESC guidelines for radionuclide imaging of cardiac function. Eur J Nucl Med Mol Imaging 2008; 35 : 851–885.
5. Nakajima K, Higuchi T, Taki J et al. Accuracy of ventricular volume and ejection fraction measured by gated myocardial SPECT: comparison of 4 software programs. J Nucl Med 2001; 42 : 1571–1578.
6. Lum DP, Coel MN. Comparison of automatic quantification software for the measurement of ventricular volume and ejection fraction in gated myocardial perfusion SPECT. Nucl Med Commun 2003; 24 : 259–266.
7. Kondo CH, Fukushima K, Kusakabe K. Measurement of left ventricular volumes and ejection fraction by quantitative gated SPET, contrast ventriculography and magnetic resonance imaging: a meta‑analysis. Eur J Nucl Med 2003; 30 : 851–858.
8. Heiba SI, Santiago J, Mirzaitehrane M et al. Transient postischemic stunning evaluation by stress gated Tl-201 SPECT myocardial imaging: effect on systolic left ventricular function. J Nucl Cardiol 2002; 9 : 482–490.
9. Abidov A, Bax JJ, Hayes SW et al. Transient ischemic dilation ratio of the left ventricle is a significant predictor of future cardiac events in patients with otherwise normal myocardial perfusion SPECT. JACC 2003; 42 : 1818–1825.
10. Hachamovitch R, Berman DS, Shaw LJ et al. Incremental prognostic value of myocardial perfusion single photon emission computed tomography for the prediction of cardiac death: differential stratification for risk of cardiac death and myocardial infarction. Circulation 1998; 97 : 535–543.
11. Cerqueira MD, Weissman NJ, Dilsizian V et al. Standardized myocardial segmentation and nomenclature for tomographic imaging of the heart: A statement for health-care professionals from the Cardiac Imaging Committee of the Council on Clinical Cardiology of the American Heart Association. J Nucl Cardiol 2002; 9 : 240–245.
12. Berman DS. Prognostic validation of a 17-segment score derived from a 20-segment score. J Nucl Cardiol 2004; 11 : 414–423.
13. Hachamovitch R, Berman DS, Lewin H et al. Incremental prognostic value of gated SPECT ejection fraction in patients undergoing dual isotope exercise or adenosine stress SPECT. J Nucl Med 1998; 39 : 101P.
14. Sharir T, Bacher-Stier C, Dhar S et al. Identification of severe and extensive coronary artery disease by postexercise regional wall motion abnormalities in Tc-99m sestamibi gated single‑photon emission computed tomography. Am J Cardiol 2000; 86 : 1171–1175.
15. Dilsizian V. Myocardial Viability: A Clinical and Scientific Treatise. Armonk, New York: Futura Publishing Company, Inc., 2000.
16. Dilsizian V, Arrighi JA. Myocardial Viability in Chronic Coronary Artury Disease: Perfusion, Metabolism, and Contractile Reserve. In: Gerson MC. Cardiac Nuclear Medicine. 3rd ed. New York: McGraw-Hill 1997.
17. Cuocolo A. Controversies – against: FDG imaging should be considered the preferred technique for accurate assessment of myocardial viability. Eur J Nucl Med 2005; 32 : 832–835.
18. Bax JJ. Controversies – for: FDG imaging should be considered the preferred technique for accurate assessment of myocardial viability. Eur J Nucl Med 2005; 32 : 829–931.
19. Dakik HA, Howell JF, Lawrie GM et al. Assessment of myocardial viability with 99mTc-sestamibi tomography before coronary bypass graft surgery. Circulation 1997; 96 : 2892–2898.
20. Maurea S, Cuocolo A, Soricelli A et al. Enhanced detection of viable myocardium by technetium-99m-MIBI imaging after nitrate administration in chronic coronary artery disease. J Nucl Med 1995; 36 : 1945–1952.
21. Li ST, Liu XJ, Lu ZL et al. Quantitative analysis of technetium 99m 2-methoxyisobutyl isonitrile single‑photon emission computed tomography and iso-sorbide dinitrate infusion in assessment of myocardial viability before and after revascularization. J Nucl Cardiol 1996; 3 : 457–463.
22. Sciagra R, Bisi G, Santoro GM et al. Comparison of baseline-nitrate tech-netium-99m sestamibi with rest-redistribution thallium-201 tomography in de-tecting viable hibernating myocardium and predicting postrevascularization recovery. J Am Coll Cardiol 1997; 30 : 384–391.
23. He W, Acampa W, Mainolfi C et al. Tc-99m tetrofosmin tomography after nitrate administration in patients with ischemic left ventricular dysfunction: relation to metabolic imaging by PET. J Nucl Cardiol 2003; 10 : 599–606.
24. Di Carli M. Assessment of myocardial viability with positron emission tomography. In: Zaret BL, Beller GA. Clinical Nuclear Cardiology. 3rd ed. Philadelphia: Elsevier Mosby 2005 : 519–534.
25. Baer FM, Voth E, Schneider ChA et al. Comparison of low‑dose dobutamine-gradient-echo magnetic resonance imaging and positron emission tomography with 18F flourodeoxyglukose in patients with chronic coronary artery disease. Circulation 1995; 91 : 1006–1015.
26. Beanlands RSB, DeKemp R, Smith S et al. F-18-fluorodeoxyglucose PET imaging alters clinical decision making in patients with impaired ventricular function. Am J Cardiol 1997; 79 : 1092–1095.
27. Bax JJ, Poldermans D, Elhendy A et al. Sensitivity, specificity, and predictive accuracies of various noninvasive techniques for detecting hibernating myocardium. Curr Probl Cardiol 2001; 26 : 142–186.
28. Pagano D, Townend JN, Parums DV et al. Hibernating myocardium: morphological correlates of inotropic stimulation and glucose uptake. Heart 2000; 83 : 456–461.
29. Matsunari I, Boning G, Ziegler SI et al. Attenuation-corrected 99mTc-tetrofosmin single‑photon emission computed tomography in the detection of viable myocardium: comparison with positron emission tomography using 18F-fluorodeoxyglucose. J Am Coll Cardiol 1998; 32 : 927–935.
30. Bax JJ, Wijns W. Fluorodeoxyglucose imaging to assess myocardial viability: PET, SPECT or gamma camera coincidence imaging? J Nucl Med 1999; 40 : 1893–1895.
31. Meluzín J, Mayer J, Groch L et al. Autologous transplantation of mononuclear bone marrow cells in patients with acute myocardial infarction: The effect of the dose of transplantanted cells on myocardial function. Am Heart J 2006; 152 : 975.e9–975.e15.
32. Kamínek M, Meluzín J, Janoušek S et al. The role of quantitative Tc-99m-MIBI gated SPECT/F-18-FDG PET imaging in the monitoring of intracoronary bone marrow cell transplantation. Nucl Med Review 2006; 9 : 60–64.
33. Kamínek M, Meluzín J, Janoušek S et al. Individual differences in the effectiveness of intracoronary bone marrow cell transplantation assessed by sestamibi SPECT/FDG PET imaging. J Nucl Cardiol, v tisku.
34. Hutyra M, Skála T, Kamínek M et al. Zobrazení transmurální jizvy u pacienta s ischemickou kardiomyopatií po infarktu myokardu spodní stěny. Cor Vasa 2006; 48 : 303.
35. Hutyra M, Skála T, Kamínek M et al. Rozsáhlé posterolaterálně lokalizované aneuryzma levé komory srdeční s nástěnným trombem. Cor Vasa 2008; 50 : 148.
36. Lang O, Kamínek M, Trojanová H. Nu-kleární kardiologie. Praha: Galén 2008.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2008 Číslo 10- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Hemoeliminační metody v léčbě sepse: současný stav
- Srdeční arytmie při obstruktivní spánkové apnoe
- Izolovaná forma srdeční amyloidózy v podobě počínající infiltrativní kardiomyopatie bez restriktivní fyziologie
- Myopatie a smíšená hyperlipoproteinemie jako první projev systémové AL‑amyloidózy
- XIV. medzinárodný kongres pre výživu a metabolizmus pri chorobách obličiek, 11.–15. júna 2008, Marseille (Francúzsko)
- Z odborné literatury
- Zahajovací zdravice XV. kongresu České internistické společnosti České lékařské společnosti J. E. Purkyně, Brno, 24. 9. 2008
- Internistická moudrost – matka celé klinické medicíny. Metamorfózy internistova myšlení a praktického konání
- Komentář k novým Doporučením o diagnostice a léčbě plicní embolie Evropské kardiologické společnosti (EKS)(Torbicki et al 2008) ve světle Doporučení diagnostiky,léčby a prevence plicní embolie České kardiologické společnosti – verze 2007
- Stanovení LDL‑cholesterolu – stále nevyřešený problém: vypočíst, nebo změřit? – editorial
- Nukleární kardiologie: postradatelná, či nepostradatelná? – editorial
- Srdeční amyloidóza – editorial
- Srdeční amyloidóza – podceňovaná hrozba? – editorial
- Radiofrekvenční katetrová ablace paroxyzmální fibrilace síní konvenční metodou, bezprostřední a dlouhodobé výsledky
- Zhodnotenie alternatívnych metód pre výpočet LDL cholesterolu
- Biomarkery ischemie a nekrózy myokardu v roce 2008
-
Zobrazovací metody v diagnostice viability myokardu.
Část 1. Interpretace nálezů při zobrazování viability myokardu pomocí SPECT a PET - Kolorektální karcinom a diabetes mellitus
- Duální protidestičková léčba
- Hemofilie
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Duální protidestičková léčba
- Srdeční arytmie při obstruktivní spánkové apnoe
- Stanovení LDL‑cholesterolu – stále nevyřešený problém: vypočíst, nebo změřit? – editorial
- Hemoeliminační metody v léčbě sepse: současný stav
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy









