-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Léčba diabetu při metabolickém syndromu
Treatment of diabetes in metabolic syndrome
Hyperglycaemia is a typical feature of metabolic syndrome (MeTS) and one of its independent diagnostic criteria. The term includes impaired glucose homeostasis (impaired fasting glucose and impaired glucose tolerance) and type 2 diabetes mellitus. Although glycaemic control has been shown to lower the risk of microvascular events, the effect of intensive glycaemic control on macrovascular outcomes is less clear. Epidemiological studies show hyperglycaemia, particularly the postprandial one, to be a clear risk factor for cardiovascular (CV) mortality and morbidity. However, the intervention studies are less conclusive. The large interventional studies published in 2008 and 2009 (UKPDS, VADT, ACCORD, ADVANCE, RECORD) advocate the controlling of nonglycemic risk factors (through blood pressure control, lipid lowering with statin therapy, aspirin therapy, and lifestyle modifications) as the primary strategies for reducing the burden of CV disease in people with diabetes, and demonstrated the need for individualized approach to the patients’ care in terms of blood glucose control. The patients with shorter duration of type 2 diabetes and without established atherosclerosis might reap CV benefit from intensive glycemic control. Conversely, it is possible that potential risks of intensive glycaemic control (hypoglycaemia) may outweigh its benefits in other patients, such as those with a very long duration of diabetes, known history of severe hypoglycemia, advanced atherosclerosis, and advanced age/frailty. According to the latest recommendations of the Czech Diabetes Society that are in line with the European and US standards the best way to protect type 2 diabetic patients against coronary and cerebrovascular disease is to target all cardiovascular risk factors (blood pressure treatment, including lipid-lowering with statins, aspirin prophylaxis, smoking cessation, and healthy lifestyle behaviors hypertension, dyslipidemia, obesity and other symptoms of metabolic syndrome. The target HbA1c levels in patients with the low CV risk shoul be below 4.5%. Less strict goals (HbA1c below 6%) may be appropriate for patients with a history of severe hypoglycemia, limited life expectancy, advanced microvascular or macrovascular complications, or extensive comorbid conditions or those with long‑standing diabetes. The individual targets should be achieved safely (without hypoglycaemias). Slow advancing in diabetes compensation is preferred. Lifestyle changes are the cornerstone of therapy. Metformin is the drug of choice; its administration, together with lifestyle changes, should be initiated immediately after the diagnoses of diabetes. If monotherapy does not provide satisfactory glucose control, other oral antidiabetic agents or insulin are added to the combination. Since it is not known which hypoglycaemic agents are beneficial from the perspective of long‑term patient prognosis, the selection is liberal. Contraindication of the various farmaceuticals must be respected. It is possible to use a range of different combinations, metformin is administered with a glitazone (zero risk of hypoglycaemias is the advantage) with sulphonylurea derivatives (low price is the advantage) with glinides, with incretins, acarbose, antiobesity agents or insulin. The next step is a triple combination of hypoglycaemic agents with different mechanisms of action. Therapy also includes education focusing on changes to dietary and lifestyle habits, including smoking cessation, and education related to the prevention of complications, with particular regard to prevention of diabetic foot and atherosclerosis.
Key words:
metabolic syndrome – hyperglycaemia – oral antidiabetic agents – insulin – therapy
Autori: T. Pelikánová 1,2
Pôsobisko autorov: Centrum diabetologie IKEM Praha, přednostka prof. MUDr. Terezie Pelikánová, DrSc. 1; Subkatedra diabetologie IPVZ Praha, vedoucí prof. MUDr. Terezie Pelikánová, DrSc. 2
Vyšlo v časopise: Vnitř Lék 2009; 55(7-8): 637-645
Kategória: 134. internistický den – XXIII. Vanýskův den, Brno 2009 – Vanýskova přednáška
Súhrn
Hyperglykemie je typickou součástí metabolického syndromu (MeTS). V patogenezi hyperglykemie hraje nepochybnou roli inzulinová rezistence (IR), která se velmi pravděpodobně uplatňuje při progresivním selhávání B buněk. Hyperglykemie je jedním z nezávislých diagnostických kritérií MeTs. Zahrnuje kategorie poruch glukózové homeostázy (hraniční glykemie nalačno a porucha tolerance glukózy) a diabetes mellitus. Léčba hyperglykemie významně redukuje riziko rozvoje a progrese mikrovaskulárních komplikací diabetu, a to v kterémkoli stadiu choroby a nezávisle na volbě léčebného prostředku. Význam léčby hyperglykemie z hlediska redukce kardiovaskulárního (KV) rizika je stále předmětem diskuzí. V epidemiologických hodnoceních je hyperglykemie, a to zejména postprandiální, jasným nezávislým rizikovým faktorem KV mortality a morbidity. Intervenční studie zveřejněné v roce 2008 a 2009 (UKPDS, VADT, ACCORD, ADVANCE, RECORD) ukazují na nutnost diferencovaného přístupu k nemocným. Významně příznivý efekt na redukci KV rizika má těsná kompenzace diabetu zejména u osob časně po záchytu cukrovky v primární KV prevenci. Uplatňuje se tzv. „metabolická paměť“. Naopak příliš agresivní léčba hyperglykemie u diabetiků s pokročilými komplikacemi a již manifestním KV onemocněním riziko KV úmrtí zvyšuje, pravděpodobně v souvislosti s výskytem hypoglykemií. Podle posledních doporučení České diabetologické společnosti, která jsou v souladu s evropskými a americkými standardy, zůstává léčba hyperglykemie u nemocného s diabetem 2. typu součástí komplexních opatření, která zahrnují léčbu hypertenze, dyslipidemie, obezity a dalších projevů metabolického syndromu. Cílové hodnoty HbA1c u osob s nízkým KV rizikem jsou pod 4,5 %. U nemocných v sekundární prevenci jsme méně přísní (HbA1c pod 6 %) a zásadním požadavkem je bezpečnost léčby (nepřítomnost hypoglykemií). Přednost dáváme pozvolnému zlepšování kompenzace. Základním kamenem léčby jsou režimová opatření. Lékem první volby je metformin, jehož podávání zahajujeme ihned po záchytu diabetu spolu s režimovými opatřeními. Pokud monoterapie nezajistí uspokojivou kompenzaci, přidáváme do kombinace další perorální antidiabetika nebo inzulin. Protože není jasné, které hypoglykemizující prostředky jsou výhodné z hlediska dlouhodobé prognózy nemocného, je postup liberální. Respektujeme kontraindikace jednotlivých farmak. Použít můžeme řadu různých kombinací, metformin podáváme s glitazonem (výhodou je nulové riziko hypoglykemií), s deriváty sulfonylurey (výhodou je nízká cena), s glinidy, s inkretiny, akarbózou, antiobezitiky nebo inzulinem. Dalším krokem je trojkombinace hypoglykemizujících farmak s různým mechanizmem účinku. Součástí léčby je edukace zaměřená zejména na změnu stravovacích zvyklostí a životního stylu, včetně zákazu kouření, a edukace týkající se prevence komplikací se zvláštním zřetelem na diabetickou nohu a prevenci aterosklerózy.
Klíčová slova:
metabolický syndrom – hyperglykemie – p.o. antidiabetika – inzulin – léčbaÚvod
Metabolický syndrom (MeTS) je souborem klinických, biochemických a humorálních odchylek, které zvyšují riziko rozvoje aterosklerózy. Přestože definice, diagnostická kritéria, etiologie a postavení MeTS jako samostatné klinické jednotky jsou stále předmětem diskuzí, zůstávají inzulinová rezistence (IR), hyperinzulinemie a hyperglykemie jeho nepochybnými projevy [1].
IR je řadou autorů stále chápána jako základní metabolická odchylka, která stojí v pozadí všech dalších projevů MeTS, ačkoli v posledních letech se obdobným způsobem dostává do popředí tuková tkáň a poruchy v její metabolické a endokrinní aktivitě. V klinické praxi není třeba míru IR kvantifikovat. Podle doporučení ADA/NHLBI [2] a IDF [3] nepatří k základním diagnostickým kritériím MeTS. Přítomnost IR předpokládáme, pokud nemocný splňuje ostatní diagnostická kritéria syndromu. Stejně tak není třeba rutinně vyšetřovat inzulinemii.
Hyperglykemie je typickou součástí MeTS a je také jedním z nezávislýchdiagnostických kritérií MeTS. Zahrnujekategorie poruch glukózové homeo-stázy (hraniční glykemie nalačno a porucha tolerance glukózy) a diabetes mellitus [4–6]. Hyperglykemii diagnostikujeme na základě opakovaného stanovení glykemie ve venózní plazmě s použitím standardních laboratorních metod.
Diagnózu diabetu nelze stanovit na základě glykosurie či glykemie naměřené pomocí glukometru. Pro screeningové účely je měření glykemie v kapilární krvi glukometrem naopak možné a výhodné.
Glykovaný hemoglobin (HbA1c) sedosud užíval pouze k hodnocení míry kompenzace cukrovky a kvality léčby. V poslední době se však diskutuje vhodnost jeho užití také pro screeningové a diagnostické účely. Hodnota HbA1c nad 4,5 % by mohl být dalším nezávislým kritériem pro diagnózu diabetu srovnatelným s glykemií nalačno, náhodnou glykemií a glykemií ve 120. minutě orálního glukózového tolerančního testu (oGTT). Naopak hodnota pod 4,0 % by mohla být hodnocena jako negativní screeningové vyšetření. U osob s vysokým rizikem diabetu, mezi něž patří nemocní s kardiovaskulárním (KV) onemocněním či gestačním diabetem v anamnéze či metabolickým syndromem, by mohlo vyšetření HbA1c významně omezit potřebu oGTT. oGTT je totiž v současné době standardně doporučován u všech výše uvedených nemocných, kteří nedosahují hodnot glykemií splňujících podmínky diabetu.
Stejně tak by mohlo vyšetření HbA1c omezit indikace oGTT u těhotných žen. oGTT se v podle současných doporučení provádí plošně u všech ve 24. týdnu těhotenství.
Kategorie hyperglykemie
- porucha glukózové homeostázy (PGH)
- hraniční glykemie nalačno – glykemie nalačno ≥ 5,6 mmol/l a ≤ 6,9 mmol/l
- porucha tolerance glukózy – glykemie ve 120. minutě oGTT ≥ 7,8 mmol/l a ≤ 11,0 mmol/l
- kombinovaná PGH
Diagnostická kritéria diabetu uvádí tab. 1.
Patofyziologické poznámky
Glukoregulační porucha při metabolickém syndromu má charakter diabetu 2. typu. V patogenezi hyperglykemie hraje nepochybnou roli inzulinová rezistence (IR), která zodpovídá za snížené vychytávání glukózy v kosterním svalu a neschopnost inzulinu potlačit produkci glukózy v játrech. Sama IR však nestačí ke klinické manifestaci diabetu, protože porucha je zpočátku vyrovnávána zvýšenou sekrecí inzulinu a hyperinzulinemií, která je výrazem snahy překonat IR. Porucha glukózové homeostázy či diabetes mellitus 2. typu (DM2T) se projeví pouze při neschopnosti B buněk přiměřeně zvýšit sekreci inzulinu (obr. 1). U nemocných s diabetem 2. typu je dokumentována řada funkčních odchylek v sekreci inzulinu, např. zhoršení konverze proinzulinu na inzulin, a tudíž vyšší podíl proinzulinu v plazmě či ztráta pulsatilní sekrece inzulinu. Zásadní význam má však pokles sekreční odpovědi B buněk na stimulaci glukózou [7]. Postupující selhání B buněk je rozhodujícím faktorem, který podmiňuje progresi glukózové intolerance od normálních hodnot přes poruchu glukoregulace až k manifestaci diabetu a stojí v pozadí typického „zhoršování“ klinického obrazu diabetu 2. typu [8,9]. Řada klinických studií doložila, že právě progresivně se zhoršující sekreční defekt odpovídá za postupné prohlubování glukoregulační poruchy v průběhu diabetu 2. typu, který zpočátku reaguje na léčbu dietou, potom přidáváme antidiabetika a nakonec nemocné převádíme na léčbu inzulinem. Morfologickým podkladem úbytku sekrece inzulinu v průběhu onemocnění je apoptóza, které vede ke snížení masy B buněk [10]. Progresivní úbytek B buněk nejsme v současné době schopni ovlivnit žádným léčebným prostředkem. V průběhu let sekrece inzulinu klesá nezávisle na použitém léčebném prostředku, a to při léčbě deriváty sulfonylurey, metforminem i inzulinem [11] (obr. 2). Relativně pomalejší pokles, řádově jde však o rozdíly v měsících, byl doložen pro léčbu rosiglitazonem ve studii Diabetes Outcome Progression Trial (ADOPT) [12]. V poslední době byly do klinické praxe zavedeny nové léky na bázi inkretinů, u nichž existují in vitro důkazy pro jejich příznivé účinky na B buňky. Klinické potvrzení ochrany B buněk v dlouhodobé léčbě diabetu 2. typu však chybí.
Obr. 1. Sekrece inzulinu a inzulinová rezistence v průběhu zhoršování glukoregulační poruchy. Inzulinová rezistence – měřena pomocí spotřeby glukózy během hyperinzulinového euglykemického clampu; sekrece inzulinu – měřena pomocí hladin imunoreaktivního inzulinu (IRI); IFG – impaired fasting glucose (hraniční glykemie nalačno). 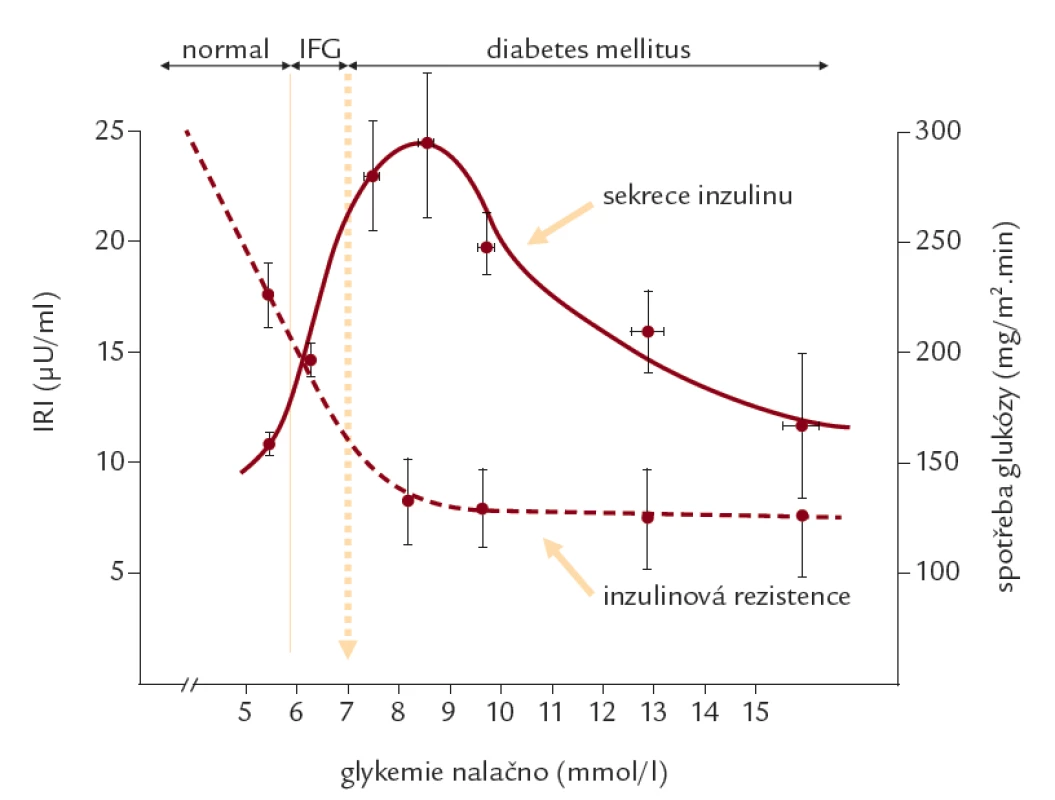
Obr. 2. Progresivní pokles funkce B buněk nezávislý na způsobu léčby diabetu. Pokles funkce B buněk hodnocený pomocí HOMA indexu pro sekreci inzulinu je patrný ve skupině léčené sulfonylureou, metforminem i dietou (upraveno podle [11]). ![Progresivní pokles funkce B buněk nezávislý na způsobu léčby diabetu. Pokles funkce B buněk hodnocený pomocí HOMA indexu pro sekreci inzulinu je patrný ve skupině léčené sulfonylureou, metforminem i dietou (upraveno podle [11]).](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/2e03954eb087c5f9a663483d4466d42a.jpeg)
Příčin apoptózy a funkčního poškození B buněk může být mnoho (tab. 2).
Předpokládá se účast faktorů genetických a sekundárních, z nichž nepochybný je vliv chronické hyperglykemie (glukotoxicita), chronického zvýšení koncentrací volných mastných kyselin (lipotoxicita) a oxidačního stresu. Diskutuje se vliv ukládání amylinu či vlivy lokálních regulačních peptidů (např. galanin). Velmi atraktivní hypotézou, která elegantně propojuje zatím odděleně diskutované patogenetické odchylky při diabetu 2. typu (defekt v sekreci inzulinu a IR), je přímé poškození sekrece inzulinu navozené IR B buněk. Uvedenou hypotézu podporuje řada experimentálních i klinických pozorování.
Přestože transport glukózy do B buněk není závislý na inzulinu (v B buňkách nejsou glukózové transportéry 4), B buňky obsahují všechny komponenty inzulinové signalizační kaskády, které jsou navíc přítomné i v membránách sekrečních granulí inzulinu [13]. Na geneticky modifikovaných experimentálních zvířatech bylo doloženo, že jejich exprese přímo ovlivňuje sekreci inzulinu. Hypotézu, že IR přímo v B buňce může být pravou příčinou sekreční poruchy u nemocných s diabetem, podporují i intervenční studie, které dokládají, že podávání thiazolidindionů (TZD), což jsou farmaka, která snižují IR, vede ke zlepšení sekrece inzulinu v experimentu i u člověka [14]. V rozvoji IR v B buňce hrají roli stejné faktory jako v jiných cílových tkáních inzulinu. Jde opět o faktory genetické či sekundární, které se uplatňují mechanizmy, jež zasahují cestou vegetativního nervstva, humorální cestou či změnami metabolického charakteru (tab. 2). Stejně jako při rozvoji IR v kosterním svalu, játrech či myokardu se také v souvislosti se sekrecí inzulinu věnuje v posledních letech značná pozornost roli lipidů a ektopické akumulaci tuku. Zvýšený obsah triglyceridů svázaný s poruchou sekrece inzulinu byl nalezen také v Langerhansových ostrůvcích (LO) u obézních diabetických zvířat i neobézních modelů inzulinové rezistence [15]. Mechanizmus, kterým akumulace lipidů v B buňce indukuje rozvoj IR, poruchu sekrece inzulinu a apoptózu B buněk, označujeme jako lipotoxicitu. Uplatňuje se při ní zvýšená tvorba ceramidů a kysličníku dusnatého, přímá interakce s nukleárními receptory a exprese genů a konečně zvýšená lipoperoxidace a oxidační stres. Kromě zvýšené hladiny volných mastných kyselin, která je pro stavy s IR typická, se na ektopické akumulaci tuku v LO může podílet i porucha humorální regulace intracelulární homeostázy lipidů. Fyziologicky je v buňkách velmi pečlivě udržována rovnováha mezi oxidací tuků na jedné straně a ukládáním tuků na straně druhé. Na této regulaci se významně podílejí působky produkované tukovou tkání (adipokiny), z nichž některé jsou asociované s rozvojem inzulinorezistence a jiné mají účinky opačné. Bylo prokázáno, že příjem potravy zvyšuje v adipocytech tvorbu leptinu a adiponektinu. Ty pak cestou aktivace AMP-aktivované proteinkinázy zvyšují oxidaci mastných kyselin, a naopak snižují aktivitu lipogenních enzymů. Deficience leptinu či leptinová rezistence vede stejně jako deficience adiponektinu naopak k ektopickému hromadění tuku. Tato regulace vedoucí k IR se uplatňuje nejen v kosterním svalu či játrech, ale byla doložena i v B buňkách Langerhansových ostrůvků [15–17]. Adiponektin a leptin navíc chrání B buňky před cytokiny a mastnými kyselinami indukovanou apoptózou [17].
Mezi další mechanizmy, které se mohou uplatňovat při poškození B buněk, patří oxidační stres, dysfunkce mitochondrií a stres endoplazmatického retikula (ER).
Mitochondrie jsou buněčnými organelami, v nichž probíhá oxidace lipidů a cukrů v Krebsově cyklu a tvorba ATP. Jejich dysfunkce je asociována s IR a poruchou funkce B buněk. Navíc je mitochondrilní dysfunkce a porucha energetického metabolizmu spojena se zvýšenou tvorbou redukovaného NADPH, a tudíž se zvýšeným oxidačním stresem, který indukuje apoptózu B buněk [18].
ER je místem, kde probíhají změny konformace molekul inzulinu a dochází k jejich definitivní úpravě před případným použitím a sekrecí. Trvale zvýšené nároky na syntézu inzulinu, např. při IR nebo při stimulaci deriváty sulfonylurey, vedou k přetížení ER (stres ER) a poruše jeho funkce. Výsledkem je zvýšená apoptóza B buněk [19].
Hyperglykemie a riziko cévních komplikací
Léčba hyperglykemie významně redukuje riziko rozvoje a progrese mikrovaskulárních komplikací diabetu 2. typu, a to v kterémkoli stadiu choroby a nezávisle na volbě léčebného prostředku (UKPDS [20], ADVANCE [21]). Význam léčby hyperglykemie z hlediska redukce kardiovaskulárního (KV) rizika je stále předmětem diskuzí. V epidemiologických hodnoceních je hyperglykemie, a to zejména postprandiální, jasným nezávislým rizikovým faktorem KV mortality a morbidity [5,22]. KV riziko se extrémně zvyšuje, pokud jsou splněna kritéria diabetu, který s sebou navíc přináší rizika mikrovaskulárních komplikací (diabetická nefropatie, retinopatie a neuropatie). Pro glykemii nebyla v epidemiologických studiích nalezena prahová hodnota, každé snížení glykemie a HbA1c je provázeno další redukcí KV rizika, nezávisle na použitém léčebném prostředku a nezávisle na pokročilosti komplikace. Intervenční studie u diabetiků však nevyznívají zcela jednoznačně; efekt léčby na redukci KV mortality není významný nebo se pohybuje na hranici významnosti (UKPDS [20], PROACTIVE [23], DIGAMI 2 [24]). Důležité je, že pouze 10–40 % nemocných ve studiích publikovaných v minulých letech dosahovalo cílových hodnot HbA1c.
V roce 2008 a 2009 byly zveřejněny výsledky velkých randomizovaných, multicentrických intervenčních studií (UKPDS [25], VADT [26], ACCORD [27], ADVANCE [21], RECORD [32]). Přestože neprokazují v celých souborech významný pozitivní vliv intenzivní léčby hyperglykemie na KV mortalitu, přinesly významné poznatky s konkrétními dopady na léčbu diabetiků. Ukazují, že agresivními způsoby léčby je možné dosáhnout cílových hodnot glykemie HbA1c pod 7 % DCCT (odpovídá 5,3 % IFCC používaných u nás) u 70–80 % nemocných, ale zároveň dokládají, že zlepšení kompenzace je provázeno zvýšenou frekvencí hypoglykemických příhod [21,25–27]. Hypoglykemie jsou nepochybným rizikovým faktorem KV příhod, a mohou tak smazat případné pozitivní vlivy těsné kompenzace. Uvedené studie také upozorňují na poměrně dlouhou dobu latence, po které se může příznivý efekt normoglykemie projevit, a na nutnost diferencovaného přístupu k nemocným.
Významně příznivý efekt na redukci KV rizika má těsná kompenzace diabetu zejména u osob časně po záchytu cukrovky v primární KV prevenci. Uplatňuje se tzv. „metabolická paměť“ [25,28]. Naopak příliš agresivní léčba hyperglykemie u diabetiků s pokročilými komplikacemi a již manifestním KV onemocněním může KV riziko úmrtí dokonce zvýšit [27], pravděpodobně v souvislosti s výskytem hypoglykemií.
United Kingdom Prospective Diabetes Study (UKPDS 80) [25]. V prodloužené studii UKPDS, jejíž intervenční perioda byla ukončena v roce 1997 a nemocní byli sledováni dalších 10 let, se ukázalo, že ačkoli obě skupiny měly na konci studie v roce 2007 stejnou hodnotu HbA1c, významně se lišily v riziku nejen mikrovaskulárních komplikací, ale i riziku infarktu myokardu a celkové mortality (tab. 3) [25].
Epidemiology of Diabetes Interventions and Complications Study (EDIC/DCCT) [29]. Obdobné výsledky přineslo i prodloužení studie DCCT u diabetiků 1. typu, kdy stejným způsobem byly dále sledováni nemocní, kteří ukončili intervenční část studie. Nemocní, kteří byli původně léčeni intenzivně, měli po 10 letech sledování, kdy již byly srovnatelné hladiny HbA1c, nižší riziko mikrovaskulárních komplikací, o 42 % nižší riziko KV úmrtí a o 57 % nižší riziko KV příhod (infarkt myokardu, centrální příhoda mozková, revaskularizační výkon) [29].
Veterans Affair Diabetes Trial (VADT)[26]. Význam časné léčby hyperglykemie podpořila i subanalýza studie VADT. Do celé studie bylo zařazeno 1791 US veteránů se špatně kontrolovaným diabetem, kteří byli 5–7 let léčeni inzulinem nebo PAD konvenčním nebo intenzivním způsobem. Průměrný věk byl 60 let, trvání diabetu 11,5 roku, 40 % osob již mělo KV onemocnění v anamnéze, 80 % mělo hypertenzi, 50 % dyslipidemii, průměrné BMI bylo 31, vstupní HbA1c byl 9,5 % DCCT (= 8 % IFCC). Po více než 6 letech sledování nebyl prokázán v celé skupině významný příznivý vliv intenzivní kontroly glykemie na KV příhody (úmrtí, infarkt myokardu, CMP, revaskularizace, srdeční selhání), při velmi nízké mortalitě. V intenzivní větvi bylo 2krát více hypoglykemií, přičemž těžká hypoglykemie byla silným prediktorem KV příhody v následujících 3 měsících (HR 2,062; 95% CI 1,132–3,756, p = 0,018). Část nemocných měla vyšetřeno kalciové skóre (prediktor ICHS). Zajímavé je, že z intenzivní léčby hyperglykemie významně profitovali nemocní s kalciovým skóre pod 100, kteří měli významně nižší KV mortalitu, na rozdíl od pacientů s kalciovým skóre nad 100. Výsledky znovu dokládají oprávněnost časné intervence hyperglykemie.
Action to Control CardiovascularRisk in Diabetes (ACCORD) [27]. Studie prokázala signifikantně vyšší KV mortalitu a rizikovost intenzivní léčby hyperglykemie u osob s vysokým KV rizikem, pokud je vedena velmi agresivně k nízkým cílovým hodnotám HbA1c v krátkém časovém horizontu. Do studie bylo zařazeno 10 251 vysoce rizikových nemocných s diabetem 2. typu s průměrnou dobou trvání cukrovky 10 let, s neuspokojivou kompenzací (průměrné vstupní hodnoty HbA1c byly 8 %), kteří byli po KV příhodě v anamnéze nebo měli kromě cukrovky minimálně 2 další rizikové faktory (hypertenze, dyslipidemie, obezita, kouření). Cílové hodnoty HbA1c byly v intenzivně léčené skupině v pásmu normy – pod 6,0 % (odpovídá hodnotám pod 4,5 % IFCC) a v konvenčně léčené skupině pod 7,5 % (pod 5,5 % IFCC). V intenzivně léčené skupině dosáhlo HbA1c pod 6,5 % přes 50 % osob, a to velmi rychle, prakticky do 2–3 měsíců od začátku intervence! Během průměrně 4letého sledování v intenzivně léčené skupině zemřelo 257 osob, zatímco v konvenčně léčené skupině 203 osob. Rozdíl 54 osob mezi skupinami představuje v průměru 3 úmrtí na 1 000 osob za 1 rok. Jinak vyjádřeno, intenzivně léčená skupina měla o 20 % vyšší riziko úmrtí. Analýzy neprokázaly vztah úmrtí k frekvenci hypoglykemií ani ke způsobu farmakoterapie, která byla ve studii použita.
Rosiglitazone Evaluated for Cardiac Outcomes and Regulation of Glycaemia in Diabetes (RECORD) [32]. KV mortalita a celková mortalita nebyla významně ovlivněna intenzivní kontrolou krevního cukru rosiglitazonem. Na druhou stranu studie doložila u více než 4 000 zařazených nemocných KV bezpečnost rosiglitazonu, který byl pro KV mortalitu + stroke + IM hraničně nevýznamně lepší než léčba metforminem a sulfonylureou (HR 0,93). Léčba rosiglitazonem byla provázena dvojnásobným zvýšením výskytu kardiálních selhání a vyšším rizikem fraktur dlouhých kostí u žen.
Volba hypoglykemizujících prostředků ve vztahu k cévnímu riziku
V léčbě hyperglykemie byly a jsou tradičně využívány deriváty sulfonylurey (SU), metformin, akarbóza a inzulin, a v poslední době se paleta léčebných prostředků rozšířila o další látky s hypoglykemizujícím účinkem. Kromě výše uvedených pronikly do širší klinické praxe glitazony (thiazolidindiony), glinidy a léky na bázi inkretinů (inkretinová kinetika = analoga GLP‑1 či blokátory DPP4 = gliptiny).
Rozdělení hypoglykemizujících prostředků, jejich výhody a nevýhody shrnuje tab. 4.
Metformin, akarbóza a gliptiny jsoufarmaka, která vedou ve srovnání s in-zulinem, deriváty SU či glitazony k menším hmotnostním přírůstkům. Hmotnostní úbytek provází podávání inkretinových mimetik. Zároveň tato farmaka nezvyšují riziko hypoglykemie. Výhodou glitazonů by mohlo být přímé ovlivnění inzulinové rezistence, ale také ochrana B buněk [30]. Potenciálně příznivý efekt na B buňky se také skloňuje ve vztahu k nově zaváděným lékům na bázi inkretinů, v dlouhodobých klinických studiích však není doložen.
V současné době nemáme jasné doklady pro rozdíly mezi používanými hypoglykemizujícími prostředky (perorální antidiabetika, inzulin) z hlediska prevence mikrovaskulárních komplikací, KV komplikací či zabránění selhání B buněk, které by odůvodnily jejich přednostní užití.
Určité výhody z hlediska redukce rizika KV komplikací, které však jsou poloviční, než je efekt statinů či blokátorů RAS, má podávání metforminu u obézních diabetiků 2. typu [25] (tab. 4), akarbózy u osob s poruchou glukózové tolerance [31] a pioglitazonu u diabetiků s vysokým KV rizikem [23].
Důležité je, že v současné době také nejsou jasné doklady pro to, že by některý léčebný prostředek ve srovnání s jiným jasně KV mortalitu diabetiků zvyšoval. Jako relativně velmi bezpečné vycházejí také deriváty SU [20,21] nebo inzulin [20,24] a rosiglitazon [32]. Doklady pro KV bezpečnost zatím logicky chybí u novějších látek s inkretinovým účinkem.
Protože zatím nebyly doloženy žádné výhody inzulinu proti perorálním antidiabetikům, je inzulin u nemocného s diabetem 2. typu využíván jako hypoglykemický prostředek druhé volby v období po selhání perorálních antidiabetik. V současné době probíhající studie ORIGIN, která testuje vliv časného podání glarginu u osob s poruchou glukózové homeostázy či nově zjištěným diabetem 2. typu na KV mortalitu, možná přinese změny v zavedené strategii.
Stejně tak neexistují studie, které by prokázaly, že kombinovaná léčba inzulinem a PAD má proti monoterapii inzulinem jasné výhody z hlediska mortality a morbidity diabetiků či z hlediska přirozeného průběhu choroby. Přestov posledních letech přibývá údajů, které racionálnost kombinační léčby podporují. Ve srovnání s monoterapií inzulinem jsou výhody kombinované léčby následující:
- a) synergické působení farmak a zvýšená šance dosáhnout lepší kompenzace
- b) nižší celková dávka exogenního inzulinu (asi o 30 %), nutná k dosažení srovnatelné kompenzace
- c) menší riziko přibírání na váze u obézních nemocných při použití metforminu či inkretinů
Výhodou související s kvalitou života může být i šance dosáhnout požadované kompenzace menším počtem dávek inzulinu za den [33].
Otázkou také je, jaký inzulinový režim je u nemocných s diabetem 2. typu výhodnější z hlediska KV mortality, dlouhodobé prognózy a z hlediska ovlivnění přirozeného průběhu choroby. HEART2 byla první randomizovanou intervenční studií, která tuto problematiku řešila. Ukázala, že po 5 letech léčby není rozdíl v KV mortalitě u skupiny léčené jednou dávkou bazálního inzulinu či 3 dávkami prandiálního inzulinu [34].
Léčba nemocných s diabetem 2. typu v klinické praxi
Podle posledních doporučení České diabetologické společnosti [6], která jsou v souladu s evropskými a americkými standardy [35–37], zůstává léčba hyperglykemie u nemocného s diabetem 2. typu součástí komplexních opatření, která zahrnují léčbu hypertenze, dyslipidemie, obezity a dalších projevů metabolického syndromu (STENO) [38].
V praxi volíme komplexní přístupy, kterými dosáhneme přiměřených hodnot krevního tlaku, sérových lipidů a žádoucí metabolické kompenzace při co nejmenším hyperinzulinizmu. Léčba by měla vést k dosažení přiměřené hmotnosti v ideálním případě, hmotnostní redukci, či alespoň bránit dalším váhovým přírůstkům. Mezi režimová opatření patří i zákaz kouření.
Cílové hodnoty uvádí tab. 5. Cíle léčby by měly být vždy stanoveny individuálně.
Cílové hodnoty HbA1c u osob s nízkým KV rizikem jsou pod 4,5 %. Jde o nemocné s krátce trvajícím diabetem, bez cévních změn a s hodnotami HbA1c do asi 7,0 %. U nemocných v sekundární prevenci jsme méně přísní, cílové hodnoty HbA1c jsou pod 6 %.
Zásadním požadavkem však je bezpečnost léčby, to znamená dosažení těchto hodnot bez přítomnosti hypoglykemií a bez hmotnostních přírůstků (případně s hmotnostním úbytkem). Přednost dáváme pozvolnému zlepšování kompenzace.
Léčba by měla být dostatečně agresivní, s kontrolou HbA1ckaždé 3 měsíce, a opakovanou revizí režimových opatření, dokud není dosaženo cílové hodnoty HbA1c. Po dosažení cílových hodnot HbA1c je minimální frekvence kontrol 1krát za 6 měsíců.
Základním kamenem léčby jsou režimová opatření.
Lékem první volby je metformin, jehož podávání zahajujeme ihned po záchytu diabetu spolu s režimovými opatřeními. Při kontraindikaci metforminu či ve vybraných případech je možné použít i další PAD: glitazony při vyjádřených známkách inzulinorezistence; akarbózu při významných postpradniálních vzestupech glykemie, antiobezitika při BMI nad 35 (obecně jsou indikována při BMI nad 27) či deriváty sulfonylurey. Gliptiny a inkretinová mimetika zatím nejsou pro monoterapii schválena, nicméně jejich použití s cílem ovlivnit postprandiální hyperglykemii je velmi nadějné.
Pokud monoterapie nezajistí uspokojivou kompenzaci, přidáváme do kombinace další PAD nebo inzulin. Protože není jasné, které hypoglykemizující prostředky jsou výhodné z hlediska dlouhodobé prognózy nemocného, je postup liberální. Respektujeme kontraindikace jednotlivých farmak. Použít můžeme řadu různých kombinací, metformin podáváme s glitazonem (výhodou je nulové riziko hypoglykemií), s deriváty sulfonylurey (výhodou je nízká cena), s glinidy, s inkretiny, akarbózou, antiobezitiky nebo inzulinem. Bylo prokázáno, že přidávání dalších farmak do kombinace je z hlediska zlepšení kompenzace přínosné.
Na rozdíl od evropských a amerických doporučení [36] je postup liberálnější a ponechává lékaři možnost libovolného výběru farmak podle mechanizmu účinku.
K inzulinu saháme obvykle až tehdy, pokud neuspějeme s PAD. Inzulin můžeme přidat k monoterapii či ke kombinaci PAD. Důvodem převodu na inzulinoterapii je obvykle selhání léčby PAD, alergie na PAD, diabetes v graviditě, těžší nedostatečnost ledvin a jater a stavy spojené s přechodnou dekompenzací cukrovky. Přítomnost dlouhodobých cévních komplikací cukrovky není sama o sobě indikací k převodu na inzulin, pokud jsou nemocní těsně kompenzováni dietou či PAD. Tolerovanou hodnotou u nemocných s diabetem je HbA1c do 5,3 %. Je logické, že této kompenzace naprostá většina nemocných s chronickými komplikacemi nedosahuje, a v klinické praxi by prakticky všichni nemocní např. se syndromem diabetické nohy či s diabetickou neuropatií měli být léčeni inzulinem.
Pokud nejsou přítomny kontraindikace, vždy kombinujeme inzulin s metforminem.
Volíme některý z konvenčních nebo intenzifikovaných režimů včetně inzulinové pumpy. Při volbě léčebné strategie vycházíme z klinického obrazu choroby. Pro klinický odhad potřeby substituce bazální a prandiální sekrece inzulinu postačuje výše glykemie nalačno a postprandiálně. Protože není potvrzeno, jaký inzulinový režim je nejvýhodnější z hlediska KV mortality a dlouhodobé prognózy nemocných s diabetem 2. typu ani z hlediska ovlivnění přirozeného průběhu choroby, začínáme jednoduššími inzulinovými schématy, obvykle jednou dávkou středně dlouho působícího inzulinu nebo dlouhého inzulinového analoga na noc v kombinaci s metforminem a deriváty SU. Perspektivní, byť zatím standardně neschválená, je kombinace s inkretiny. Pokud není kompenzace uspokojivá, intenzifikujeme inzulinový režim. K intenzifikovanému inzulinovému režimu a k substituci prandiální potřeby inzulinu můžeme přistoupit ihned. V tomto případě ponecháváme v kombinaci metformin a vysazujeme deriváty SU. Tento způsob má blíže k patofyziologii onemocnění a ovlivňuje postpostprandiální hyperglykemie, jež je prvním projevem glukoregulační poruchy.
Algoritmus léčby znázorňuje obr. 3.
Obr. 3. Algoritmus léčby hyperglykemi e u nemocných s di abetem 2. typu. Léčbu revidujeme a intenzifi kujeme obvykle při HbA<sub>1c</sub> ≥ 5,3 %. 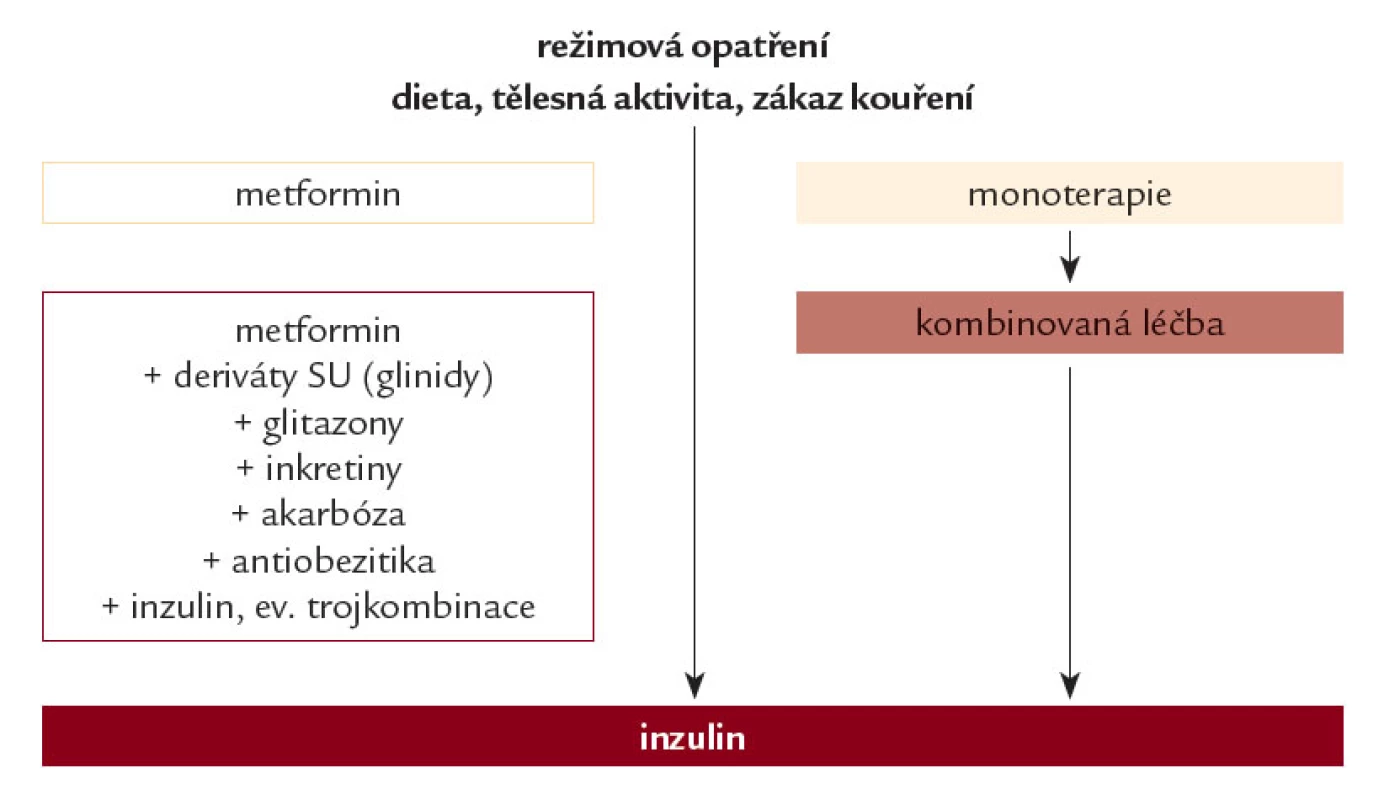
Součástí léčby je edukace zaměřená zejména na změnu stravovacích zvyklostí a životního stylu, včetně zákazu kouření, a edukace týkající se prevence komplikací, se zvláštním zřetelem na diabetickou nohu a prevenci aterosklerózy. Pokud je nemocný léčen PAD, pak musí být seznámen s jejich riziky. Při léčbě inzulinem, zvláště intenzifikovaným způsobem, je nutnou podmínkou selfmonitoring glykemií a samostatné úpravy dávek inzulinu.
Nezbytnou součástí péče o nemocného s DM 2. typu je screening a léčba mikro - a makroangiopatických komplikací.
Chyby v léčbě diabetu 2. typu:
- podávání inzulinu a PAD bez průběžné snahy o redukci hmotnosti – značné procento diabetiků léčených vysokými dávkami inzulinu lze po úspěšné redukční terapii uspokojivě kompenzovat pouze dietou
- zvyšování celkové dávky inzulinu nad 340 IU/den v jedné nebo dvou injekcích denně a váhání s převodem na intenzifikovaný inzulinový režim
- zbytečné prodlužování léčby PAD a váhání s nasazením inzulinu, zejména u neobézních nemocných
Poděkování
Práce byla podpořena grantem IGA MZ ČR č. NR9359-3/2007.
Doručeno do redakce: 29. 5. 2009
prof. MUDr. Terezie Pelikánová, DrSc.
www.ikem.cz
e‑mail: tepe@medicon.cz
Zdroje
1. Kahn R, Buse J, Ferrannini E et al. The metabolic syndrome: time for a critical appraisal. Joint statement from the American Diabetes Association and the European Association for the Study of Diabetes. Diabetologia 2005; 48 : 1684–1699.
2. Grundy SM, Cleeman JI, Daniels SR et al. Diagnosis and management of the metabolic syndrome: an American Heart Association/National Heart, Lung, and Blood Institute Scientific Statement. Circulation 2005; 112 : 2735–2752.
3. The IDF Consensus Worldwide Definition of the Metabolic Syndrome 2005. Available from: http://www.idf.org/webdata/docs/Metabolic_syndrome_definition.pdf.
4. Association AD. Standards of medical care in diabetes – 2009. Diabetes Care 2006; 29 (Suppl 1): S4–S42.
5. Rydén L, Standl E, Bartnik M et al. Guidelines on diabetes, pre‑diabetes, and cardiovascular diseases: executive summary. The Task Force on Diabetes and Cardiovascular Diseases of the European Society of Cardiology (ESC) and of the European Association for the Study of Diabetes (EASD). Eur Heart J 2007; 28 : 88–136.
6. Standardy péče o diabetes mellitus 2. typu. Standardy České diabetologické společnosti. 2009 (www.diab.cz). Diabetologie, metabolismus, endokrinologie, výživa 2009; v tisku.
7. Defronzo RA. Banting Lecture. From the triumvirate to the ominous octet: a new paradigm for the treatment of type 2 diabetes mellitus. Diabetes 2009; 58 : 773–795.
8. Gastaldelli A, Ferrannini E, Miyazaki Y et al. Beta‑cell dysfunction and glucose intolerance: results from the San Antonio metabolism (SAM) study. Diabetologia 2004; 47 : 31–39.
9. Festa A, Williams K, D’Agostino R jr et al. The natural course of beta‑cell function in nondiabetic and diabetic individuals: the Insulin Resistance Atherosclerosis Study. Diabetes 2006; 55 : 1114–1120.
10. Deng S, Vatamaniuk M, Huang X et al. Structural and functional abnormalities in the islets isolated from type 2 diabetic subjects. Diabetes 2004; 53 : 624–632.
11. U.K. prospective diabetes study 16. Overview of 6 years’ therapy of type II diabetes: a progressive disease. U.K. Prospective Diabetes Study Group. Diabetes 1995; 44 : 1249–1258.
12. Kahn SE, Haffner SM, Heise MA et al. Glycemic durability of rosiglitazone, metformin, or glyburide monotherapy. N Engl J Med 2006; 355 : 2427–2443.
13. Kulkarni RN. The islet beta‑cell. Int J Biochem Cell Biol 2004; 36 : 365–371.
14. Buchanan TA, Xiang AH, Peters RK et al. Preservation of pancreatic beta‑cell function and prevention of type 2 diabetes by pharmacological treatment of insulin resistance in high‑risk hispanic women. Diabetes 2002; 51 : 2796–2803.
15. Unger RH. Minireview: weapons of lean body mass destruction: the role of ectopic lipids in the metabolic syndrome. Endocrinology 2003; 144 : 5159–5165.
16. Shimabukuro M, Zhou YT, Levi M et al. Fatty acid‑induced beta cell apoptosis: a link between obesity and diabetes. Proc Natl Acad Sci USA 1998; 95 : 2498–2502.
17. Rakatzi I, Mueller H, Ritzeler O et al. Adiponectin counteracts cytokine and fatty acid‑induced apoptosis in the pancreatic beta‑cell line INS-1. Diabetologia 2004; 47 : 249–258.
18. Newsholme P, Haber EP, Hirabara SM et al. Diabetes associated cell stress and dysfunction: role of mitochondrial and non‑mitochondrial ROS production and activity. J Physiol 2007; 583 : 9–24.
19. Scheuner D, Kaufman RJ. The unfolded protein response: a pathway that links insulin demand with beta‑cell failure and diabetes. Endocr Rev 2008; 29 : 317–333.
20. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). UK Prospective Diabetes Study (UKPDS) Group. Lancet 1998; 352 : 837–853.
21. Patel A, MacMahon S, Chalmers J et al. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. N Engl J Med 2008; 358 : 2560–2572.
22. Nesto RW. Correlation between cardiovascular disease and diabetes mellitus: current concepts. Am J Med 2004; 116 (Suppl 5A): 11S–22S.
23. Dormandy JA, Charbonnel B, Eckland DJ et al. Secondary prevention of macrovascular events in patients with type 2 diabetes in the PROactive Study (PROspective pioglitAzone Clinical Trial In macroVascular Events): a randomised controlled trial. Lancet 2005; 366 : 1279–1289.
24. Malmberg K, Ryden L, Wedel H et al. Intense metabolic control by means of insulin in patients with diabetes mellitus and acute myocardial infarction (DIGAMI 2): effects on mortality and morbidity. Eur Heart J 2005; 26 : 650–661.
25. Holman RR, Paul SK, Bethel MA et al. 10-year follow‑up of intensive glucose control in type 2 diabetes. N Engl J Med 2008; 359 : 1577–1589.
26. Duckworth W, Abraira C, Moritz T et al. Glucose control and vascular complications in veterans with type 2 diabetes. N Engl J Med 2009; 360 : 129–139.
27. Gerstein HC, Miller ME, Byington RP et al. Effects of intensive glucose lowering in type 2 diabetes. N Engl J Med 2008; 358 : 2545–2559.
28. Team for the Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications Research Group. Effect of intensive therapy on the microvascular complications of type 1 diabetes mellitus. JAMA 2002; 287 : 2563–2569.
29. Nathan DM, Cleary PA, Backlund JY et al. Intensive diabetes treatment and cardiovascular disease in patients with type 1 diabetes. N Engl J Med 2005; 353 : 2643–2653.
30. Gerstein HC, Yusuf S, Bosch J et al. Effect of rosiglitazone on the frequency of diabetes in patients with impaired glucose tolerance or impaired fasting glucose: a randomised controlled trial. Lancet 2006; 368 : 1096–1105.
31. Chiasson JL, Josse RG, Gomis R et al. Acarbose treatment and the risk of cardiovascular disease and hypertension in patients with impaired glucose tolerance: the STOP-NIDDM trial. JAMA 2003; 290 : 486–494.
32. Home PD, Pocock SJ, Beck-Nielsen H et al. Rosiglitazone evaluated for cardiovascular outcomes in oral agent combination therapy for type 2 diabetes (RECORD): a multicentre, randomised, open-label trial. Lancet 2009; 373 : 2125-2135.
33. Pelikánová T. Léčba inzulinem v éře inzulinových analog. In: Pelikánová T (ed.) Trendy soudobé diabetologie XI. Praha: Galén 2007 : 181–245.
34. Raz I, Wilson PW, Strojek K et al. Effects of prandial versus fasting glycemia on cardiovascular outcomes in type 2 diabetes: the HEART2D trial. Diabetes Care 2009; 32 : 381–386.
35. Association AD. Standards of medical care in diabetes – 2009. Diabetes Care 2009; 32 (Suppl 1): S13–S61.
36. Nathan DM, Buse JB, Davidson MB et al. Medical management of hyperglycemia in type 2 diabetes: a consensus algorithm for the initiation and adjustment of therapy: a consensus statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care 2009; 32 : 193–203.
37. Skyler JS, Bergenstal R, Bonow RO et al. Intensive glycemic control and the prevention of cardiovascular events: implications of the ACCORD, ADVANCE, and VA diabetes trials: a position statement of the American Diabetes Association and a scientific statement of the American College of Cardiology Foundation and the American Heart Association. Diabetes Care 2009; 32 : 187–192.
38. Gaede P, Lund-Andersen H, Parving HH et al. Effect of a multifactorial intervention on mortality in type 2 diabetes. N Engl J Med 2008; 358 : 580–591.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek PozvánkaČlánek Metabolický syndrom
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2009 Číslo 7-8- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Pozvánka
- Metabolický syndrom
- Léčba obezity u metabolického syndromu
- Léčba dyslipidemie u metabolického syndromu
- Léčba hypertenze u metabolického syndromu
- Léčba diabetu při metabolickém syndromu
- Metabolický syndrom a játra (NAFLD/NASH)
- Anxiózně depresivní poruchy a metabolický syndrom
- Metabolický syndrom a kardiovaskulární onemocnění
- Chronický mírný zánět spojuje obezitu, metabolický syndrom, aterosklerózu a diabetes
- Laboratorní markery metabolického syndromu v praxi
- Léčba dyslipidemie u pacientů s metabolickým syndromem a chronickým onemocněním ledvin
- XXVIII. dny mladých internistů České republiky a Slovenska v Olomouci
- Prof. MUDr. Jan Petrášek, DrSc. – 80 let
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Metabolický syndrom a játra (NAFLD/NASH)
- Anxiózně depresivní poruchy a metabolický syndrom
- Chronický mírný zánět spojuje obezitu, metabolický syndrom, aterosklerózu a diabetes
- Laboratorní markery metabolického syndromu v praxi
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy








