-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Hereditární angioedém – opomíjená diagnóza
Hereditary angioedema – neglected diagnosis
Hereditary angioedema caused by C1 esterase inhibitor deficiency is a rare autosomal dominant inherited disorder. It is characterized by reccurent episodes of potentially life ‑ threatening swellings without itching localized in the dermis and submucosa. We report a case of 41 years old woman with hereditary angioedema manifested as episodes of localized skin swellings and painful gastrointestinal colics. This report underlines the fact that hereditary angioedema is underdiagnosed in differential diagnoses. If hereditary angioedema is correctly diagnosed, effective treatment highly improving patients’ quality of life is available.
Key words:
angioedema – C1 inhibitor – danazol
Autori: P. Králíčková 1; E. Burešová 1; T. Freiberger 2; I. Tachecí 3
Pôsobisko autorov: Ústav klinické imunologie a alergologie Lékařské fakulty UK a FN Hradec Králové, přednosta prof. RNDr. Jan Krejsek, CSc. 1; Genetická laboratoř Centra kardiovaskulární a transplantační chirurgie Brno, ředitel doc. MU Dr. Petr Němec, CSc., FETCS 2; Oddělení gastroenterologie a hepatologie, vedoucí prof. MU Dr. Jan Bureš, CSc., II. interní kliniky Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MU Dr. Jaroslav Malý, CSc. 3
Vyšlo v časopise: Vnitř Lék 2010; 56(9): 927-931
Kategória: Kazuistiky
Súhrn
Hereditární angioedém je autozomálně dominantně dědičné onemocnění, které je zapříčiněno deficiencí inhibitoru C1 esterázy. Je charakterizován opakujícími se atakami potenciálně život ohrožujících nesvědivých otoků v dermis či submukóze. Popsaný případ 41leté ženy s hereditárním angioedémem, který se manifestoval epizodami lokalizovaných otoků končetin a křečovitými atakami v oblasti gastrointestinálního traktu, dokazuje, že toto onemocnění bývá často v diferenciálně diagnostické rozvaze opomíjeno. Jeho diagnostika je přitom klíčová pro účinný terapeutický zásah, který zásadně zvyšuje kvalitu života nemocných.
Klíčová slova:
angioedém – C1 inhibitor – danazolÚvod
Hereditární angioedém je autozomální dominantně dědičné onemocnění, pro které je charakteristická tvorba nebolestivých, nesvědivých otoků podkoží a sliznic. Příčinou je genová mutace, která způsobuje absolutní či relativní nedostatek (tvorba afunkčního proteinu) C1 inhibitoru. V populaci se vyskytuje s frekvencí 1 : 50 000 až 1 : 150 000 bez závislosti na rase či pohlaví [1,2].
C1 inhibitor je multifunkční inhibitor serinových proteáz, které se vyskytují v plazmě. Je tvořen hepatocyty, aktivovanými makrofágy a dalšími buňkami. Je jediným známým inhibitorem aktivovaných proteáz C1r, C1s a lektinu manózu vázajícího asociovaného se serinovou proteázou (MASP 1 a 2). Dále významně inhibuje aktivovaný faktor XI, XII, kalikrein a trombin v koagulačním systému a tkáňový aktivátor plazminogenu (tPA) a plazmin ve fibrinolytickém systému [3]. Inhibicí přeměny prekalikreinu na kalikrein reguluje tvorbu bradykininu, který je zásadní při vzniku klinických příznaků u pacientů s hereditárním angioedémem. Deficit C1 inhibitoru vede k spontánní aktivaci C1 složky komplementu za současného spotřebovávání C2 a C4 složek komplementu. Výsledkem je produkce anafylaktických, chemotaktických a vazoaktivních mediátorů. Dochází ke zvýšení permeability cév a tvorbě otoků [1,2,4]. Klinicky se projevuje snížení jeho aktivity o více než 50% [3].
Popis případu
Na naše pracoviště byla doporučena k vyšetření 41letá žena pro tvorbu otoků nejasného původu. Nikdo v rodině (rodiče, sourozenci či syn) obdobnými obtížemi netrpěl. Žena nikdy vážněji nestonala až na četnější výskyt angín. V anamnéze nic nesvědčilo pro přítomnost alergické rinokonjunktivitidy či astma bronchiale. Asi od 30 let se u ní začaly objevovat otoky v oblasti rukou a nohou, a to v souvislosti s mechanickým podrážděním (mačkání rybízové šťávy) nebo bez zjistitelné příčiny. Otoky nikdy nesvědily a nebyly doprovázeny změnami barvy kůže. Byly poměrně značných rozměrů (nebylo možné např. nosit obuv či rukavice). Přetrvávaly v průměru 3 dny. Podávaná antihistaminika byla zcela bez efektu. Otoky se nikdy nevyskytly v oblasti hlavy a krku. Jejich frekvence v době našeho prvního vyšetření byla asi 4krát měsíčně.
Dále pacientka udala, že je vyšetřována na gastroenterologii pro opakující se záchvaty kolikovitých bolestí břicha spojených se zvracením a průjmy, které také přetrvávají asi 3 dny. Mají vždy afebrilní průběh a nezdařilo se vypátrat vyvolávající příčinu. Křečovité stavy zažívacího traktu se u ní začaly objevovat od 15. roku věku. Nejprve velmi zřídka, a proto jim nebyla věnována pozornost (uzavíráno jako gastroenteritidy), ale po porodu syna došlo ke zvýšení frekvence výskytu až na 1krát měsíčně. Z těchto důvodů byla žena opakovaně endoskopována, bylo provedeno CT břicha, vše s negativním nálezem. Jedenkráte byl v průběhu záchvatu ultrazvukem zachycen otok stěny jejuna (obr. 1). Žena nebyla nikdy operována a stomatologické výkony vždy proběhly bez komplikací (včetně 2 nekomplikovaných extrakcí).
Obr. 1. UZ obraz edému stěny jejuna při atace hereditárního angioedému. 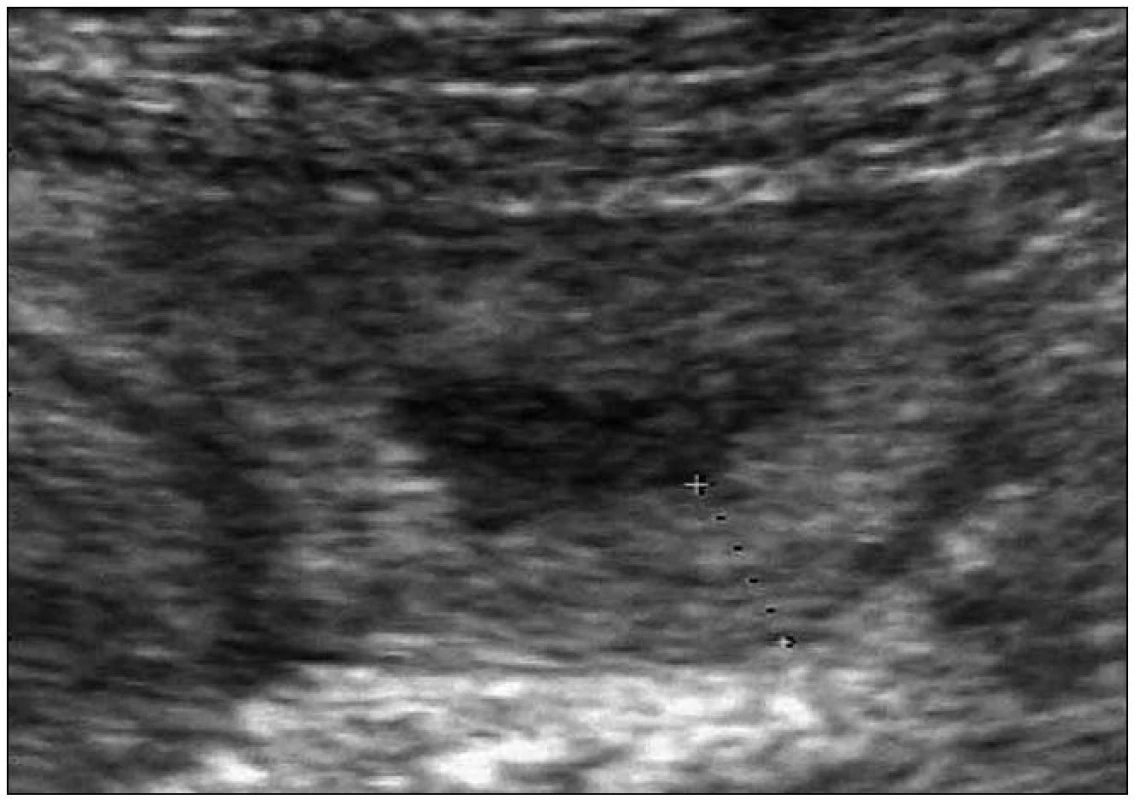
Při objektivním vyšetření byl zjištěn fyziologický nález. Na základě anamnézy bylo v rámci diferenciální diagnostiky uvažováno na prvním místě o přítomnosti hereditárního angioedému, což i následně provedená vyšetření jednoznačně potvrdila. Alergologické vyšetření bylo zcela v normě. Nebyla zachycena autoimunitní reaktivita – antinukleární protilátky (ANA), autoprotilátky proti extrahovatelným nukleárním antigenům (ENA), autoprotilátky proti antigenům cytoplazmatických granulí neutrofilních granulocytů (ANCA), protilátky proti Saccharomyces cerevisiae (ASCA), protilátky proti tkáňové transglutamináze, tyreoblobulinu či tyreoperoxidáze. Při vyšetření komplementového systému byla zjištěna snížená aktivace klasické cesty při zcela normální aktivitě cesty alternativní a lektinové a dále pak významně snížená hodnota C4 složky komplementu, následně pak i velmi nízká hladina C1 inhibitoru (0,038g/l), s normální hladinou C1q složky komplementu. K definitivnímu potvrzení diagnózy bylo provedeno genetické vyšetření, které prokázalo velkou deleci exonu 7 v genu pro C1 inhibitor (SERPING1) (obr. 2). S ohledem na to, že rodiče i sourozenci jsou klinicky zdrávi (genetické vyšetření odmítli), jedná se pravděpodobně o mutaci vzniklou de novo. Genetickému vyšetření se následně podrobil 6letý syn pacientky, u kterého byla identifikována tatáž mutace. Chlapec je zatím klinicky zcela bez obtíží, ale laboratorně je u něho hladina C1 inhibitoru významně snížená.
Obr. 2. Výsledek molekulárně genetického vyšetření – detekce velké delece v genu pro C1 inhibitor (SERPING1). 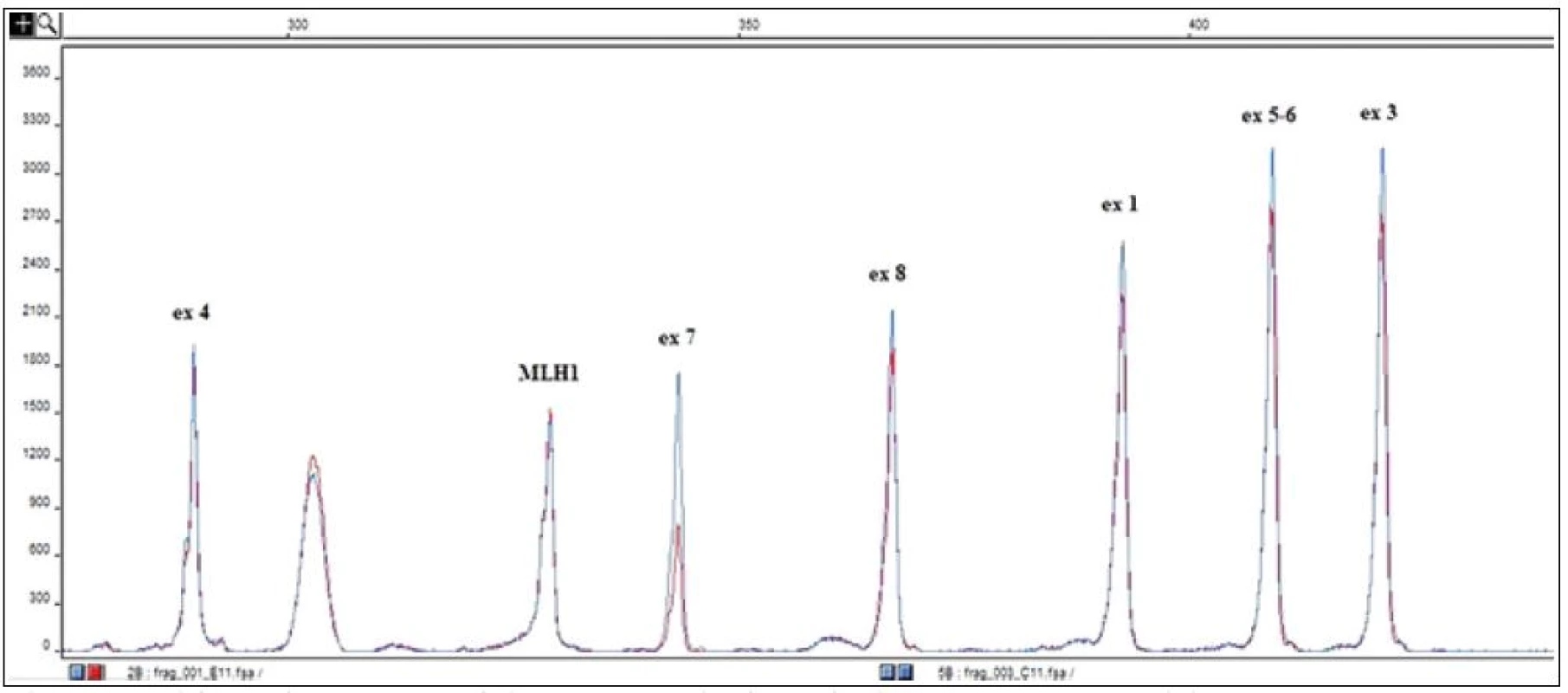
Porovnání elektroferogramu pacienta (zobrazeno červeně) s elektroferogramem kontroly (zobrazeno modře) po amplifikaci kódujících oblastí genu pro SERPING1 pomocí fluorescenčně značených primerů [16]. Snížení píku reprezentujícího fragment exonu 7 ve fluorescenčním profilu pacienta na polovinu výšky kontrolního píku detekuje deleci tohoto exonu na jedné z alel. Výšky píků jsou normalizovány podle amplifikačního fragmentu referenčního genu MLH1. S ohledem na četnost a závažnost atak a současně s přihlédnutím k přání pacientky, která se výrazně obávala dalších záchvatů, bylo přistoupeno k zahájení dlouhodobé profylaktické léčby. Protože se jednalo o ženu ve fertilním věku, lékem první volby byla kyselina tranexamová. Tu však pacientka špatně tolerovala pro významné stavy nevolnosti. Jako lék druhé volby byl tedy zvolen danazol. Pro obavy pacientky z nežádoucích účinků bylo započato s dávkou atypicky nízkou (200 mg/den). Asi za měsíc od zahájení léčby se vyskytla 1krát lehká ataka zažívacích obtíží, které byly symptomaticky lehce zvládnuty. Pacientka se cítila celkově dobře, pouze pozorovala lehký váhový přírůstek a došlo k amenorhee. Celkem po 6 měsících byla dávka snížena na 100 mg denně a za další 4 měsíce pak na 100 mg obden. V průběhu nižšího dávkování se opět obnovil menstruační cyklus a pouze 2krát došlo k lehkému otoku ruky (po lámání špejlí a drobném úrazu). Plánovaně byla v tomto období provedena extrakce zubů a odstranění několika pigmentových névů s nárazovým zvýšením dávky danazolu na dávku 400 mg ode dne –7 do dne +3 s následným postupným snížením k udržovací dávce. Výkony proběhly zcela bez komplikací. Na dny těchto zákroků byla připravena na spádové transfuzní stanici čerstvě zmražená plazma v množství 20ml/kg pro případ vzniku akutního otoku v oblasti laryngu. Nelze opomenout poučení o nevhodnosti podávání estrogenní hormonální antikoncepce a kontraindikaci podávání lékové skupiny inhibitorů angiotenzin konvertujícího enzymu (ACE I) (pokud by byly v budoucnosti zvažovány). V letošním roce pak byla vybavena koncentrátem C1 inhibitoru, který bude event. využit v případě akutní ataky s břišní symptomatologií, která by imitovala náhlou příhodu břišní, či při vzniku otoku v oblasti laryngu. Další využití pak bude preventivní, pokud by byl plánován z nějakého důvodu operační či rozsáhlejší stomatologický zákrok.
Diskuze
Diferenciální diagnóza
Angioedém je definován jako limitovaný, lokalizovaný otok. Lze ho nalézt až u 15% obecné populace, častěji u žen než u mužů. Až v polovině případů je provázen urtikarií. V 38% uzavíráme diagnózu jako idiopatický angioedém (tedy bez znalosti primární příčiny). Četně pak nacházíme alergický (IgE mediovaný angioedém), dále pak angioedém asociovaný s léky (kyselina acetylsalicylová, nesteroidní antirevmatika, antihypertenziva – ACE inhibitory, narkotika, hormonální antikoncepce), indukovaný fyzikálními podněty (např. chlad, teplo, vibrace), četně se vyskytující u autoimunitních tyreopatií či velmi vzácně jako angioedém asociovaný s cytokiny (Gleichův syndrom – horečka, eozinofilie, 10–20% úbytek hmotnosti, elevace IgM, zvýšení hladin IL 3, IL 5 a IL 6).
Dále v diferenciální diagnostice musíme vždy myslet kromě hereditárního angioedému i na získaný angioedém typ 1 asociovaný s lymfoproliferativními onemocněními (na základě konzumpce C1 inhibitoru malignímu buňkami) či typ 2 asociovaný s autoprotilátkami proti C1 inhibitoru (např. při systémovém lupus erythematodes) [1,5].
Laboratorní diagnostika je uvedena v tab. 1.
Tab. 1. Laboratorní nálezy v diferenciální diagnostice [5]. ![Laboratorní nálezy v diferenciální diagnostice [5].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/53918872df0192943f6827b81cd23a9d.jpeg)
HAE – hereditární angioedém, AAE – získaný angioedém, AE – angioedém, N – normální Klinická klasifikace hereditárního angioedému
I. typ (85% případů) nacházíme sníženou koncentraci C1 inhibitoru za současného snížení C4 složky komplementu.
II. typ (15% případů) normální či zvýšené hladiny C1 inhibitoru, který je dysfunkční.
III. typ (velmi vzácně) – estrogen dependentní, s normálními hladinami C1 inhibitoru i C4 složky komplementu, kdy je na genetickém podkladě patologicky snížená aktivita koagulačního faktoru XII [6].
Klinický obraz
Ke klinické manifestaci dochází obvykle v druhé dekádě života. Spouštěcími mechanizmy pro vznik otoků bývá lokální fyzikální působení (v praxi nejčetněji stomatologický výkon, endoskopické vyšetření, intubace, trauma), infekce, nelze pominout ani psychické vlivy (stres). Z farmak to pak bývá nasazení hormonální antikoncepce obsahující estrogeny či léčba ACE inhibitory. Otoky trvají obvykle déle než 12 hod, často 2–3 dny a poté spontánně vymizí. Nejčastěji postihují podkoží v oblasti obličeje, končetin a genitálu. V oblasti gastrointestinálního traktu vedou k vyčerpávajícím, krutým, křečovitým bolestem, které bývají provázeny zvracením a vodnatými průjmy, vedoucím k významné hemokoncentraci. Pacienti s takovými projevy jsou četně vyšetřováni a operováni s podezřením na náhlou příhodu břišní. Z klinických zkušeností vyplývá, že pacienti jsou sice prvních 72–96 hod po atace refrakterní k dalšímu vzniku otoku, ale s větším odstupem jsou v důsledku invazivních vyšetřovacích metod vystavováni významnému riziku vyvolání dalšího záchvatu [7]. Nejvíce rizikový je vznik otoku v oblasti laryngu, uvuly, měkkého patra či jazyka, které mohou končit bez adekvátní pomoci úmrtím. Klinicky však může docházet k manifestaci v řadě dalších orgánů (CNS – s projevy bolestí hlavy a barvitými neurologickými nálezy, dále pak urogenitálního traktu, svalů, kloubů apod.). V průměru je zaznamenáván těžší průběh u žen a u pacientů s časnou manifestací [1,8].
Léčba
Léčbu je třeba členit na léčbu preventivní a léčbu akutní ataky. Svá specifika má léčba angioedému v dětství a v průběhu gravidity, porodu či kojení.
Dlouhodobá profylaxe je indikována u klinicky závažných případů. Vždy je třeba zohlednit četnost a závažnost atak, postižený orgán, ale i přání pacienta ve smyslu jeho vnímání snížení kvality života, dnů pracovní neschopnosti či strachu ze závažných atak [9]. Nezbytné je vyvinout maximální snahu o redukci spouštěčů atak (léčba infekčních fokusů, eradikace Helicobacter pylori, kontraindikace podání ACE inhibitorů a estrogenní hormonální léčby). V profylaxi je lékem první linie kyselina tranexamová. Inhibuje aktivaci plazminogenu, a tím snižuje počet a sílu atak. Její efektivnost je však poměrně nízká. Před dlouhodobým podáváním je vždy vhodné vyloučení trombofilních stavů. Jako nežádoucí účinek může působit nauzeu, závratě, průjem a stavy vyčerpání. Profylaktické dávkování dospělých činí 1g 3krát denně [1,10,11].
Další lékovou skupinou používanou v dlouhodobé profylaxi jsou atenuované deriváty androgenů, v našich podmínkách pak (v rámci zvláštního léčebného programu) danazol, který zvyšuje syntézu C1 inhibitoru v játrech. Úvodní podávaná dávka je 400–600 mg/den, kterou se snažíme postupně snižovat na nejnižší účinnou dávku (např. 100 mg 3krát týdně). Tato léková skupina však není vhodná pro děti, ženy ve fertilním věku či v průběhu těhotenství. Provází ji četné nežádoucí účinky (přírůstek hmotnosti, akné, hirzutizmus, poruchy menstruačního cyklu, hypertenze, hepatopatie ve formě peliózy či adenomů, poruchy metabolizmu lipidů s akcentací aterosklerózy a nelze opominout ani zvýšení rizika tromboembolizmu či intrakraniální hypertenze apod.). Při používání obou skupin léků pravidelně kontrolujeme jaterní testy, lipidy a provádíme UZ jater. Kromě dlouhodobé profylaxe lze zvolit profylaxi nárazově před plánovaným rizikovým výkonem (stomatologické ošetření, endoskopické vyšetření, operace, porod), a to tranexamovou kyselinou v dávce 4g/den u dospělého podanou ode dne –2 do dne +2, či častěji danazol 600 mg ode dne –5 do dne +3 po výkonu. Další možností je použití koncentrátu C1 inhibitoru 500–1 000 j i.v., či při jeho nedostupnosti podání čerstvé zmražené plazmy [1,10,11].
V léčbě akutních atak je nutné si na prvním místě uvědomit, že antihistaminika i kortikoidy jsou zcela neúčinné! Lékem volby je pak koncentrát C1 inhibitoru, u mírné ataky je postačující dávka 7,5 j/kg (obvykle odpovídá 500 j) a u závažné ataky pak 14 j/kg. Dávku dle efektu pak opakujeme (obvykle přehodnocujeme po 2 hod po podání). Ke zlepšení příznaků dochází do 30–60 min, příznaky zcela mizí do 24 hod [12–14]. V případě podezření na náhlou příhodu břišní u pacienta s prokázanou diagnózou hereditárního angioedému je doporučováno v první řadě podání koncentrátu C1 inhibitoru, a teprve pokud nedojde ke zmírnění příznaků, chirurgické řešení.
Do klinické praxe se v České republice nově dostává icatibant. Icatibant je selektivní kompetitivní antagonista bradykininových receptorů typu 2(B2). Je to syntetický dekapeptid, strukturálně velmi podobný bradykininu, který je určen k léčbě akutních atak. Aplikuje se podkožně do oblasti břicha, přičemž jednotlivá dávka činí 30 mg účinné látky a počet podání je závislý na klinickém obrazu. Nežádoucí reakce se vyskytují nečetně a převážně se jedná o lokální reakce v místě aplikace [13,15].
V rámci klinických studií je připravován inhibitor plazmatického kalikreinu Dx 88. Zdá se, že mimo jiné bude jeho uplatnění v případě získaného angio-edému s přítomnými autoprotilátkami [3].
Závěr
Hereditární angioedém je dědičné, potenciálně život ohrožující onemocnění, které svými důsledky zasahuje do řady medicínských oborů. Kauzální léčba sice neexistuje, avšak je nezbytná včasná diagnostika, aby pacienti nebyli vystavováni nadměrnému riziku vyplývajícího nejen z povahy vlastního onemocnění, avšak i z řady prováděných vyšetřovacích a léčebných postupů. K dispozici jsou preparáty, které významně zlepší kvalitu života pacientů s hereditárním angioedémem.
MU Dr. Pavlína Králíčková
www.fnhk.cz
e-mail: kralickova.pavlina@fnhk.cz
Zdroje
1. Gompels MM, Lock RJ, Abinum M et al. C1 inhibitor deficiency: consensus document. Clin Exp Immunol 2005; 139 : 379 – 394.
2. Kuklínek P. Hereditární a získaný angioedém (deficit C1 – INH). In: Špičák V, Panzner P (eds). Alergologie. Praha: Galén 2004 : 257 – 262.
3. Cugno M, Zanichelli A, Foieni F et al. C1‑inhibitor deficiency and angioedema: molecular mechanisms and clinical progress. Trends Mol Med 2009; 15 : 69 – 78.
4. Krejsek J, Kopecký O. Klinická imunologie. Hradec Králové: Nucleus 2004 : 81 – 196.
5. Temiňo VM, Peebles RS Jr. The spectrum and treatment of angioedema. Am J Med 2008; 121 : 282 – 286.
6. Cichon S, Martin L, Hennies HC et al. Increased activity of coagulation factor XII (Hageman factor) cause hereditary angio-edema type III. Am J Hum Genet 2006; 79 : 1098 – 1104.
7. Rosen FS, Davis AE 3rd. Deficiencies of C1 inhibitor. Best Pract Res Clin Gastroenterol 2005; 19 : 251 – 261.
8. Bork K, Meng G, Staubach P et al. Hereditary angioedema: New findings concerning symptoms, affected organs, and course. Am J Med 2006; 119 : 267 – 274.
9. Craig T, Riedl M, Dykewicz MS et al. When is prophylaxis for hereditary angio-edema necessary? Ann Allergy Asthma Immunol 2009; 102 : 366 – 72.
10. Cicardi M, Zingale L. How do we treat patients with hereditary angioedema. Transfus Apher Sci 2003; 29 : 221 – 227.
11. Bowen T, Herbert J, Ritchie B et al. Management of hereditary angioedema: a Canadian approach. Transfus Apher Sci 2003; 29 : 205 – 214.
12. Craig TJ, Levy RJ, Wasserman RL et al. Efficacy of human C1 esterase inhibitor concentrate compared with placebo in acute hereditary angioedema attacks. J Allergy Clin Immunol 2009; 124 : 801 – 808.
13. Christiansen SC, Zuraw BL. Update on therapeutic developments for hereditary angioedema. Allergy Asthma Proc 2009; 30 : 500 – 505.
14. De Serres J, Gröner A, Lindner J. Safety and efficacy of pasteurized C1 inhibitor concentrate (Berinet P) in hereditary angioedema: a review. Transfus Apher Sci 2003; 29 : 247 – 254.
15. Fincham CI, Bressan A, Paris M et al. Bradykinin receptor antagonista – a review of the patent literature 2005 – 2008. Expert Opin Ther Pat 2009; 19 : 919 – 941.
16. Roche O, Blanch A, Duponchel C et al. Hereditary angioedema: The mutation spectrum of SERPING1/ C1NH in a large Spanish cohort. Hum Mutat 2005; 26 : 135 – 144.
Štítky
Alergológia a imunológia Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2010 Číslo 9- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficitmi v reálnej praxi
- Intermitentní hladovění v prevenci a léčbě chorob
-
Všetky články tohto čísla
- Metabolický syndróm a tuhosť aorty
- Liečime správne pacientov s claudicatio intermittens?
- Normalizovaný smoothness index a parametrický populační RDH index losartanu u pacientů s čerstvě zjištěnou hypertenzí a metabolickým syndromem
- Naše zkušenosti s endoskopickou drenážní léčbou pankreatických pseudocyst
- Kardiovaskulárna morbidita u pacientov po liečbe nádorov testis
- Rivaroxaban a inhibitory faktoru Xa v klinické praxi
- Hereditární angioedém – opomíjená diagnóza
- XV. medzinárodný kongres pre výživu a metabolizmus pri chorobách obličiek, 25.– 28. mája 2010, Lausanne (Švajčiarsko)
- Dopis adresovaný prof. MU Dr. Zdeňku Adamovi, CSc.
- Dopis adresovaný prof. MU Dr. Zdeňku Adamovi, CSc.
-
Zemřel doc. MU Dr. Dušan Mrkos, CSc.,
editor emeritus časopisu Vnitřní lékařství - Profesor Jiří Ehrmann jubilantem
-
Cikánková V, Forejtová Š, Ištvánková E et al. Rehabilitace po revmatochirurgických výkonech.
Praha: Maxdorf Jessenius 2010. Počet stran 223. ISBN 978- 80-7345- 206- 3. - Prof. MU Dr. Andrej Dukát, CSc., FESC – šesťdesiatročný
- Multidisciplinárny prístup k liečbe gastroenteropankreatických neuroendokrinných tumorov
- Artériová hypertenzia spojená s ortostatickou hypotenziou
- Imunoterapia a dlhodobá chemoprofylaxia v prevencii recidivujúcich uroinfekcií u žien
- Adrenálne incidentalómy – je súčasný manažment racionálny?
- Lipoproteínový profil séra pri novozistenej artériovej hypertenzii. Úloha aterogénnych lipoproteínov v patogenéze ochorenia
- Statínová myopatia – rarita, alebo realita?
- Kontrola glykemie u kriticky nemocných je oprávněná a účinná
- Srdce a obličky – osudový vzťah
- Hypertenze u pacienta s diabetes mellitus
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Srdce a obličky – osudový vzťah
- Naše zkušenosti s endoskopickou drenážní léčbou pankreatických pseudocyst
- Statínová myopatia – rarita, alebo realita?
- Adrenálne incidentalómy – je súčasný manažment racionálny?
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



