-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Terapie stabilní chronické obstrukční plicní nemoci (CHOPN) a její případná kardiovaskulární rizika (základní přehled)
Treating stable chronic obstructive pulmonary disease (COPD) and its potential cardiovascular risks (a basic overview)
Chronic obstructive pulmonary disease (COPD) is a highly prevalent clinical syndrome. It affects a significant proportion of world population, including non-smokers. The number of COPD patients continues to grow. For many reasons, COPD is often associated with a heart disease. In some patients, a heart disease is the primary pathology, in others COPD develops first, while sometimes heart and pulmonary involvement occur more or less simultaneously. As yet we are unable to repair damaged pulmonary parenchyma or to restore capillary destruction occurring around pulmonary alveoli. Furthermore, the disease development cannot be completely suppressed. However, outpatients may be offered a range of treatment interventions leading to slower COPD progression, improvement in quality of life and longevity, and symptom and acute exacerbation risk reduction. The main aim of the paper is to present current perceptions of COPD and to discuss potential cardiovascular risks of the treatments used.
Key words:
COPD – therapy – cardiovascular risks
Autoři: V. Koblížek
Působiště autorů: Plicní klinika Lékařské fakulty UK a FN Hradec Králové, přednosta doc. MUDr. František Salajka, CSc.
Vyšlo v časopise: Vnitř Lék 2011; 57(9): 709-720
Kategorie: 65. narozeniny MUDr. Jany Lacinové a 60. narozeniny prim. MUDr. Milana Tržila
Souhrn
Chronická obstrukční plicní nemoc je frekventovaným klinickým syndromem. Postihuje značnou část světové populace včetně nekuřáků. Počet nemocných stále roste. Z mnoha důvodů bývá plicní komponenta chronické obstrukční plicní nemoci často asociována s kardiálním postižením. V některých případech je primární kardiální postižení, jindy nejprve vzniká chronická obstrukční plicní nemoc, případně dochází k téměř simultánnímu vzniku kardiální a pulmonální patologie. Zatím neumíme reparovat již zničené části plicního parenchymu ani napravit kapilární destrukci vznikající v oblasti plicních sklípků. Vývoj onemocnění nelze ani zcela zastavit. Našim pacientům však můžeme nabídnout mnoho léčebných intervencí vedoucích ke zpomalení rozvoje chronické obstrukční plicní nemoci, zlepšení kvality a délky života, omezení symptomů a snížení rizika akutních exacerbací. Hlavním cílem našeho sdělení je prezentovat moderní pohled na chronickou obstrukční plicní nemoc a poté diskutovat potenciální kardiovaskulární rizika námi využívané léčby.
Klíčová slova:
CHOPN – terapie – kardiovaskulární rizikaÚvod
Každý člověk se něčeho bojí – např. žraloků, po jejichž útocích dle celosvětových odhadů ročně zahyne 5–10 osob [1]. Přibližně stejný počet pacientů měsíc co měsíc umírá na chronickou obstrukční plicní nemoc (CHOPN) „pouze“ v naší univerzitní nemocnici. Každoročně v důsledku CHOPN končí život 2 000 obyvatel naší země [2]. A přitom se této choroby téměř nikdo neobává. Mortalitní data evropských i českých statistik mezitím vytrvale rostou. Rovněž stoupá počet těch, které choroba dostala do invalidního důchodu, či těch, kterým vzala práci a výrazně zhoršila jejich životní perspektivu.
Popis onemocnění a jeho epidemiologický význam
CHOPN je v současnosti považována za heterogenní syndrom s dominujícími pulmonálními projevy a s různě vyjádřeným mimoplicním postižením [3,4]. Pulmonální postižení je spojeno s obligátní přítomností ne zcela reverzibilní bronchiální obstrukce vznikající postupně v důsledku dlouhodobého primárně neinfekčního zánětu. Jedná se o patologickou (vystupňovanou a prolongovanou) reakci vnímavého organizmu na chronickou inhalační expozici škodlivým částicím a plynům [5]. Mimoplicní postižení se týká zejména kardiovaskulárního a muskulo-skeletálního traktu (schéma 1). CHOPN představuje poměrně frekventovanou příčinu mortality, morbidity a snížené kvality života [6]. Globální incidence a prevalence v posledních několika desetiletích neustále stoupá [7]. V Evropské unii trpí tímto syndromem minimálně 4–6 % neselektované populace. Celosvětově bývá přítomnost tohoto postižení popisována u 10 % osob starších 40 let [2,8,9]. Nejvýraznější incidence je u seniorů: CHOPN nacházíme minimálně u 1/3 populace starší 70 let [8]. Existují reálné předpoklady pro to, aby se CHOPN v horizontu několika let (2020) dostala na 3. místo celosvětového mortalitního žebříčku [3,10,11].
Schéma 1. Přehled rozvoje systémových konsekvencí CHOPN (volně vytvořené dle [109]. ![Schéma 1. Přehled rozvoje systémových konsekvencí CHOPN (volně vytvořené dle [109].](https://pl-master.mdcdn.cz/media/image/80b3679e1f5275c08fa28f92ef31c13c.jpg?version=1537794893)
Příčiny
Dominující příčinou vzniku CHOPN v ČR i v EU zůstává kouření cigaret vedoucí k rychlejšímu stárnutí plic. Plíce jedinců postižených CHOPN stárnou o 10–20 let rychleji. Nejvýraznější riziko představuje kouření cigaret zahájené před 18. rokem věku [12–14]. V rozvojových i rozvinutých zemích se však CHOPN nevyhýbá ani celoživotním nekuřákům. Sofistikované odhady popisují u 15–20 % osob postižených CHOPN celoživotní absenci nikotinizmu [15,16]. Mezi prokázaná rizika patří inhalace tabákového kouře z okolí, profesní inhalační expozice a jakékoli vdechování drobných (2,5–5 μm) částic z dopravy a z průmyslových exhalací, inhalace obdobných škodlivin během práce v zemědělství či při domácím spalování fosilních paliv a dřeva [17,18]. Většina „necigaretových“ rizik se více uplatňuje ve vyšším věku, a to zejména u žen s nižší úrovní vzdělání [18].
Patofyziologie
V poslední dekádě se na poli CHOPN dostáváme na celulární a molekulární úroveň [5,19,20]. Pulmonální komponenta CHOPN má několik vzájemně se překrývajících forem a může být spojena s různě vyjádřenými systémovými projevy onemocnění. Tyto systémové projevy jsou pravděpodobně nezávislé na stadiu choroby hodnoceném dle stupně bronchiální obstrukce – tj. dle míry redukce FEV1 [19,21,22]. Zcela individuální kombinace plicního emfyzému, chronické bronchitidy, chronické bronchiolitidy, intrapulmonální cévní patologie a postižení skeletu, svalů a tukové tkáně je zčásti determinována geneticky, zčásti určována pohlavím, typem rizikové inhalace, stavem výživy, anamnézou předchozích respiračních infekcí, porodní váhou a dalšími vlivy [23]. Např. výrazné snížení netukové tělesné hmoty bylo pozorováno asi u 25 % osob s CHOPN a bylo zjištěno, že přítomnost kachexie má přímý vliv na pravděpodobnost úmrtí (obr. 1) [21,24]. Do patofyziologie CHOPN se také promítají velmi četné kardiovaskulární, metabolické a další převážně interní komorbidity: kardiální nedostatečnost, ischemická choroba srdeční, některé nádory, diabetes mellitus či vředová choroba gastroduodena [25–28]. Perzistence chronického pulmonálního zánětu, příčiny abnormální aktivity vlastního imunitního systému, potenciální autoimunitní rysy a systémová extenze, původně na plíce limitovaného zánětu pro nás stále zůstává zahalena mnoha nejasnostmi [29,30]. Navíc přítomnost systémového postižení (např. slabost příčně pruhované svaloviny) není patrná pouze u subjektů s těžkým stupněm plicního postižení, ale i u osob s mírnou obstrukcí a minimální namáhavou dušností [31]. Na druhé straně někteří výrazně dušní nemocní mají těžkou poruchu difuze (neboli transfer faktoru) při pouze lehkém stupni bronchiální obstrukce.
Obr. 1. Kachexie provází zejména pokročilá stadia CHOPN, je spojena s vyšším rizikem úmrtí (na obrázku 65letý muž se soudkovitým hrudníkem při výrazné hyperinflaci plic, na horních končetinách je patrná atrofie svalů a na pokožce krvácení při dlouhodobé léčbě systémovými glukokortisteroidy) (foto autor). 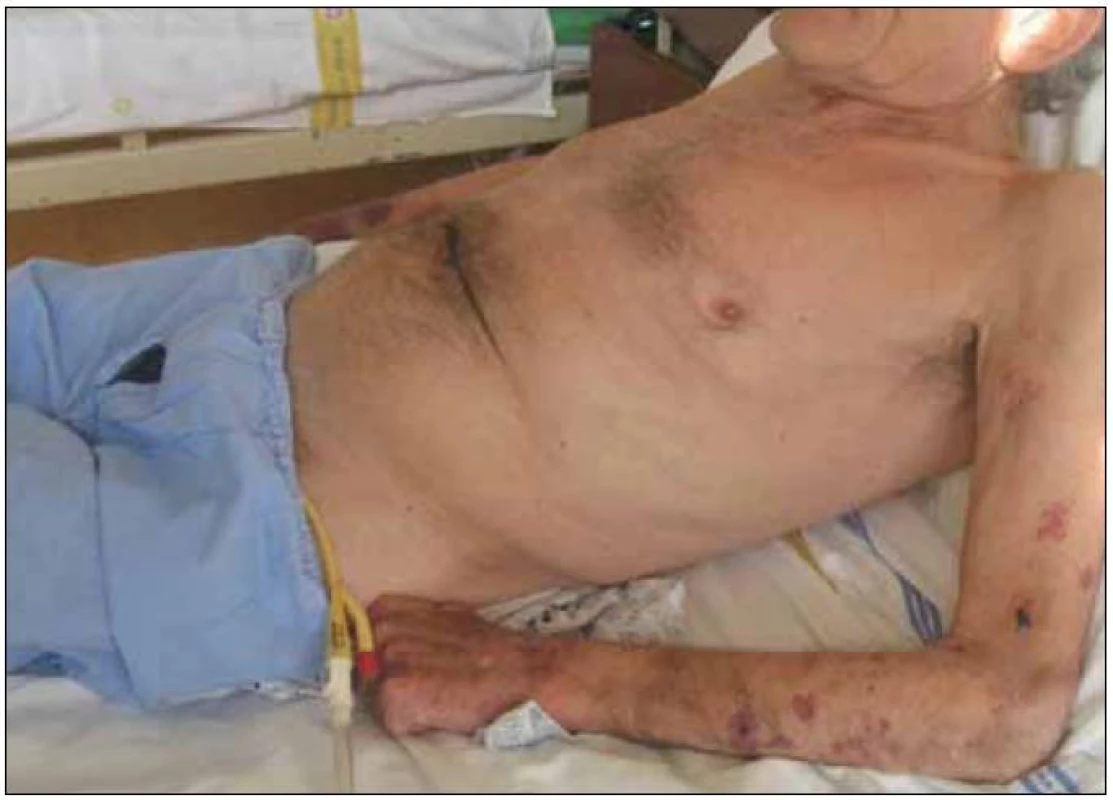
Patologie
Patologickou podstatou CHOPN je chronický, perzistující, primárně neinfekční zánět v oblasti plicního parenchymu, velkých bronchů, bronchiolů a plicních cév vyvolaný abnormální reakcí plicní tkáně na chronickou inhalační expozici plynným či pevným škodlivinám (pevné částice, plyny, páry). Tento trvale progredující zánět má některé autoagresivní rysy (zaměřené např. proti intrapulmonálnímu elastinu) a multiorgánový charakter [3]. Na patologii choroby se různou měrou podílí: plicní emfyzém s ireverzibilní destrukcí stěny alveolů, duktulů a sakulů, chronická bronchiolitida s chronickou exsudací ve sliznici asociovanou s celulární infiltrací progredující až do tvorby lymfocytových agregátů a s peribronchiolární fibrotizací spolu s přítomností předčasného kolapsu bronchiolů během expiria a chronická tracheobronchitida s hypersekrecí hlenu, hyperplazií pohárkových buněk, hypertrofií a metaplazií podslizničních žlázek, dlaždicobuněčnou metaplazií a povšechnou poruchou mukociliární clearance [32,33]. Každý nemocný má zcela individuální poměr mezi emfyzémovým postižením a progresivní bronchiolitidou, případně bronchitidou. Navíc CHOPN postihuje i horní dýchací cesty [33–36]. Systémové dopady CHOPN jsou zřetelné zejména v příčně pruhované svalovině (progresivní atrofie příčně pruhovaného svalstva končetin a trupu), případně ve skeletu (akcelerovaná osteoporóza). Současně dochází ze zvýšení rizika vzniku aterosklerózy a cévních trombóz. K tomu dochází působením mnoha nepříznivých faktorů, zahrnujících kromě vlivu hypoxemie také škodlivé působení drobných inhalovaných částic (procházejících do kapilární krve přímou difuzí v alveolech, případně přes CNS, kam se dostávají perineuronální cestou) na arteriální endotel. CHOPN je navíc jednoznačně spojena s hyperkoagulací a také se zvýšením rizika vzniku malignit [4,37].
Klinické projevy
Hlavní klinickým projevem CHOPN je nepochybně dušnost. Nejprve bývá vyvolána relativně velkou námahou (chůzí do schodů či do kopce, dobíháním na autobus), později vzniká i při méně výrazné zátěži (chůzi po rovině se zátěží, domácím úklidu nebo práci na zahradě). Nakonec je postižený člověk dušný v průběhu zcela nepatrné fyzické aktivity (ranní hygiena, oblékání a svlékání). Úroveň vnímané dušnosti je individuální, zjevně výraznější u žen [38]. Ke zhodnocení stupně dušnosti se ve světě mezi pneumology využívá zejména MRC dotazník (tab. 1) [3,38–41].
Tab. 1. Modifikované MRC (Medical Research Council) skóre dušnosti (volně dle Fletchera 1952 a Celliho 2008). 
Většina osob s CHOPN také kašle. Kašel obvykle bývá (přibližně u 2/3 postižených osob) produktivní s maximem expektorace během rána a dopoledne. Někteří nemocní však kašlou zcela bez expektorace sputa (asi 20–30 % pacientů s CHOPN) [42].
Dalším projevem CHOPN bývá nespecifický pocit změny tvaru hrudníku spojený s vnímáním jeho zvětšení a roztažení a případně i s pocity tlaku či sevření v oblasti hrudi. V období akutního zhoršení (exacerbace) pak naši pacienti popisují symptomy prolongovaného a recidivujícího nachlazení, často se opakující během jarních a podzimních měsíců (obr. 2).
Obr. 2a, b. Stabilní průběh CHOPN může být u některých nemocných narušován atakami zhoršení klinického stavu (neboli akutními exacerbacemi). Během terapie exacerbací je často nutná hospitalizace na JIP. Pacient na JIP lůžku plicní kliniky s neinvazivní ventilační podporou (obr. 2A). Nemocná se stejnou základní diagnózou u pulmonální rehabilitace (obr. 2B) (foto autor a MUDr. Antušová). 
Osoby s velmi těžkým a těžkým stupněm onemocnění (dle GOLD klasifikace) trpí hypoxemií s únavou a postupným rozvojem centrální cyanózy, případně s projevy pravostranného kardiálního selhávání [4]. Případná hyperkapnie má za následek poruchu úrovně vědomí, dezorientaci, zmatenost až rozvoj kómatu.
Plicní projevy jsou často spojeny s mimoplicními. Nejčastějšími extrapulmonálními symptomy bývá svalová únava a slabost, deprese, bolesti horní části břicha, nechutenství a redukce váhy, otoky dolních končetin, případně stenokardie a projevy kardiální nedostatečnosti (i levostranné). Symptomy CHOPN se někdy překrývají s některým interními komorbiditami (hlavně s ischemickou chorobou srdeční), a u každého nemocného tak nacházíme zcela individuální obraz tohoto onemocnění [4,43,44].
Diagnostika a sledování plicních funkcí
CHOPN je z hlediska plicních funkcí charakterizována limitací průtoku vydechovaného vzduchu v dolních dýchacích cestách. Tato limitace není (na rozdíl od většiny osob s bronchiálním astmatem) zcela reverzibilní [45]. Bronchiální obstrukce (jak tuto expirační limitaci označujeme) postupně progreduje. Rychlost deklinace plicních funkcí (tj. rychlost progrese bronchiální obstrukce) je však zcela individuální. Základní diagnostickou metodou zůstává spirometrické vyšetření, jež pomocí metody průtok–objem, provedené před podáním a po podání bronchodilatační inhalační léčby (bronchodilatace se provádí nejčastější inhalací salbutamolu), stanoví diagnózu a určí stadium onemocnění (obr. 3, tab. 2) [4,46]. Podrobnější obraz přináší vyšetření transfer faktoru (dříve nazývané vyšetření plicní difuze) a také výsledky celotělové bodypletysmografie. První metoda ukazuje stupeň destrukce plicního parenchymu a také nepřímo posuzuje kardiální funkci včetně poměrně časné detekce přítomnosti plicní hypertenze, druhá stanoví stupeň plicní hyperinflace [47–51].
Obr. 2. Pacientka během spirometrického vyšetření (na stole je inhalátor se salbutamolem nutným k provedení bronchodilatačního testu) (foto autor). 
Tab. 2. Klasifikace CHOPN dle Světové iniciativy o chronické obstrukční plicní nemoci (tzv. GOLD klasifikace). 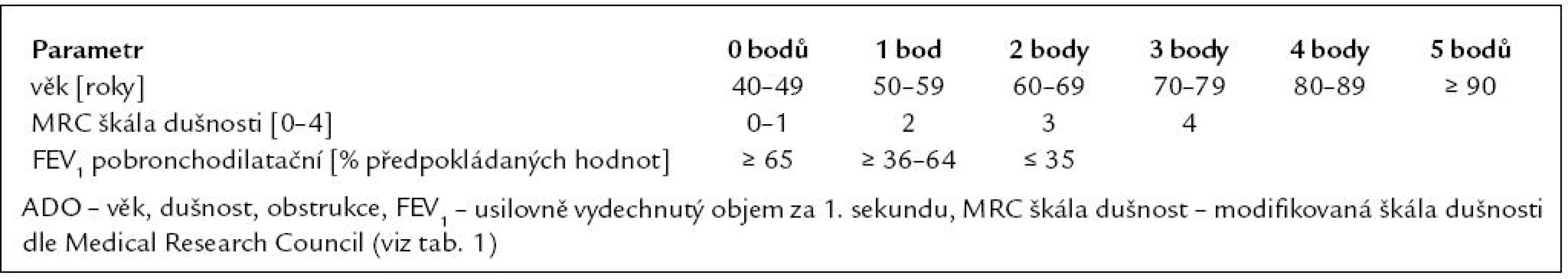
Současné možnosti sledování zahrnují pravidelné provádění BODE a ADO indexů a pátrání po sekundární, s CHOPN asociované depresi pomocí Zungova či Beckova dotazníku, kvantifikující pohled na kvalitu života nemocných se syndromem CHOPN pak přináší CAT skóre a SGRQ (tab. 3 a 4) [3,52–54]. Máme i řadu dalších dotazníkových nástrojů, např. CDLM (Capacity of Daily Living during the Morning questionnaire) a GCSQ (Global Chest Symptoms Questionnaire) [55].
Tab. 3. Modifikovaný BODE index (Puhan 2009 – publikováno bez úprav se svolením autora [52,53]). ![Modifikovaný BODE index (Puhan 2009 – publikováno bez úprav se svolením autora [52,53]).](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/0d1937864bbef5c21a24a9db67832427.jpg)
Tab. 4. ADO index (Puhan 2009 – publikováno bez úprav se svolením autora [53]). ![ADO index (Puhan 2009 – publikováno bez úprav se svolením autora [53]).](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/2db9ade5d87811499a2169954a890c20.jpg)
Terapie
Na rozdíl od bronchiálního astmatu, na poli CHOPN zatím nemáme v rukou žádnou terapeutickou strategii schopnou úplně zastavit progresi choroby, napravit pokles plicních funkcí, či dokonce reparovat dopady systémových změn. Dokážeme však již vývoj CHOPN účinně zpomalit, umíme snížit rizika vyplývající z akutních exacerbací, účinně redukujeme symptomy, zlepšujeme kvalitu a prodlužujeme délku života našich pacientů [56]. Celkový přehled léčby je uveden ve schématu 2.
Schéma 2. Schéma léčby pacientů s CHOPN (volně dle doporučení Světové iniciativy o chronické obstrukční plicní nemoci neboli GOLD). 
Všechny terapeutické možnosti u osob postižených CHOPN jsou nepochybně účinnější v počátečních stadiích onemocnění [57]. Nejefektivnější léčebnou metodu představuje podstatná redukce, či lépe úplné ukončení všech rizikových expozic (nejen aktivního a pasivního nikotinizmu) [4]. Dalším krokem je symptomatická léčba stavů dušnosti zajišťovaná pomocí krátkodobě působících bronchodilatancí aplikovaných (výhradně) inhalační cestou (salmeterol, ipratropium, fenoterol, terbutalin). Základním udržovacím lékem od středně významného stadia choroby (stadium II) je pravidelně inhalačně aplikované tiotropium [3,4,58], případně jeho kombinace s dlouhodobě působícími inhalačními β2-mimetiky (LABA), salmeterolem, případně formoterolem a nyní nově s indakaterolem [3,4,44]. Přínos terapie inhalačními glukokortikosteroidy (IKS), patrný z několika starších observačních studií, nebyl u nemocných s CHOPN dosud prokázán žádnými akceptovatelnými randomizovanými studiemi [59]. U nemocných s CHOPN a se zvýšenou hodnotou bronchiálního NO však byla terapie IKS (např. flutikazonem) spojena se zlepšením symptomů i se zlepšením plicních funkcí (FEV1) [60]. Navíc je efekt kombinované terapie (IKS + LABA) patrný i u osob s klinickým překryvem mezi CHOPN a astmatem či u nemocných s opakovanými exacerbacemi. Relativně prostá otázka poměru přínosů a rizik dlouhodobého používání IKS u CHOPN stále není uspokojivě zodpovězena. Protizánětlivou alternativu inhalačních steroidů představuje zcela nový lék – selektivní inhibitor fostodiesterázy 4 – roflumilast, jenž je prvním lékem na poli CHOPN, jehož preskripce se řídí čistě fenotypicky (je indikován u osob ve III. a IV. klinickém stadiu trpících bronchitickým fenotypem a opakovanými akutními exacerbacemi) [61].
Levným a přitom velmi účinným nefarmakologickým léčebným postupem je komplexní pulmonální rehabilitace. Hlavní součástí rehabilitační péče je pravidelně vykonávaná submaximální aerobní pohybová aktivita. V ČR a EU se nejčastěji jedná o 3krát týdně vykonávanou submaximální zátěž na rotopedu (vždy po dobu 30–45 min). Doporučená doba trvání jednoho cyklu pulmonální rehabilitace by měla dosahovat 8–12 týdnů. Cykly se mohou opakovat (po 6–12 měsících). Pulmonální rehabilitace přináší nemocným ústup symptomů, zlepšení kvality a prodloužení délky života. Navíc je použitelná u všech symptomatických stadií tohoto onemocnění (obr. 2b a 4). Součástí pulmonální rehabilitace je nutriční podpora (změna jídelníčku, sipping či aplikace enterální výživy) – je efektivní zejména u osob s nižším (≤ 21) BMI (obr. 1). V neposlední řadě do spektra pulmonální rehabilitace patří i nácvik inhalačních technik a fyzioterapeutické postupy zlepšující mechaniku dýchání a usnadňující expektoraci vazkého hlenu [62].
Obr. 3. Pulmonální rehabilitace je spojena se submaximální aerobní pohybovou aktivitou, zde zachyceni nemocní s CHOPN či astmatem při pravidelné 45 min trvající zátěži (foto autor). 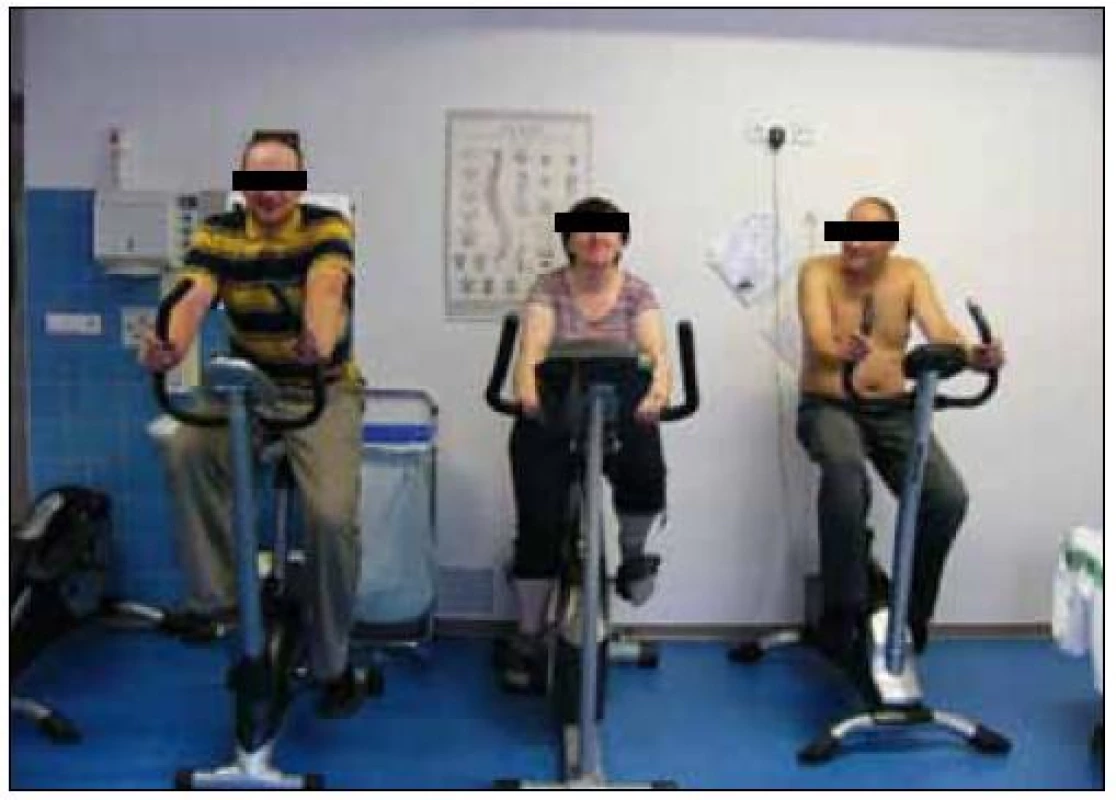
Kvůli frekventovanému výskytu deprese u osob s CHOPN je vhodné využití antidepresivní farmakoterapie. Všechny nemocné s CHOPN bychom měli každý rok (na podzim) vakcinovat proti chřipce a všechny pacienty starší 65 let také proti pneumokokové infekci (v intervalu 5 let) [3,4].
Pro nemocné s nejtěžšími stadii onemocnění máme (i v ČR) možnost indikovat volumredukční operace plic, případně plicní transplantaci [63–65]. U všech osob s výraznější hypoxemií je třeba pečlivě posoudit indikaci dlouhodobé domácí oxygenoterapie (DDOT), pokud pacienti současně trpí hyperkapnií při alveolární hypoventilací, je možné kombinovat DDOT spolu s domácí neinvazivní ventilací [3,4]. Další léčebné přístupy představují bronchoskopické volumredukce – nyní nově prováděné za pomoci speciálních semipermeabilních chlopní, biologických lepidel či horké páry (v ČR je zatím dostupné zavedení chlopní). Po jejich aplikaci do nejvíce postižených lokalit plíce dojde k postupné desuflaci až k úplnému kolapsu plicního parenchymu nejvíce postiženého emfyzémem a současně k reexpanzi relativně zdravější plíce [63–65].
Kardiovaskulární rizika u CHOPN
Předchozí epidemiologické studie prokázaly těsné spojení CHOPN a mnoha kardiovaskulárních onemocnění. Nejčastěji zmiňováno je kardiální selhávání a koronární ateroskleróza [3,4]. Vše aktuálně potvrdila rozsáhlá britská observační studie nacházející vyšší výskyt všech sledovaných kardiovaskulárních chorob u nemocných s CHOPN. Z desetiletého (1995–2005) sledování 35 772 osob s CHOPN (starších 40 let) a stejného počtu subjektů bez CHOPN vyplývá zjištění, že incidence srdečních arytmií, tromboembolické nemoci, srdečního infarktu a iktu je vyšší u osob s CHOPN v porovnání se stejně starými kontrolami (arytmie OR 1,19, 95% CI 0,98–1,43, žilní trombóza OR 1,35, 95% CI 0,97–1,89, plicní embolie OR 2,51, 95% CI 1,62–3,87, srdeční infarkt OR 1,40, 95% CI 1,13–1,73 a iktus OR 1,13, 95% CI 0,92–1,38) [25]. Podobný obrázek nabízí rok stará dánská práce (využívající dat získaných v průběhu Copenhagen City Heart Study) popisující výsledky spirometrie a sonografie srdce u 3 469 osob z běžné dospělé populace. Práce nachází u 5,7 % subjektů CHOPN I, u 9,4 % osob CHOPN II a nakonec u 2,5 % vyšetřených potvrzuje přítomnost CHOPN III či IV (dle GOLD). Osoby s CHOPN byly starší a měly více kardiovaskulárních rizik a také výraznější kardiovaskulární morbiditu. Navíc při současně provedeném sonografickém vyšetření byla u 17,7 % nemocných s CHOPN nalezena hypertrofie levé komory (stejný nález byla patrný jen u 12,1 % osob bez CHOPN) [66]. Dle některých prací zvyšuje přítomnost CHOPN výskyt kardiovaskulární morbidity ještě výraznějším způsobem [67].
Kromě hypoxemie jsou dalšími příčinami zvýšené kardiovaskulární a cerebrovaskulární morbidity systémová extenze zánětu a současně i působení částic poškozujících endotel a způsobujících CHOPN [25,26,44,68–71].
Kardiovaskulární bezpečnost farmakoterapie CHOPN
Základem léčby syndromu CHOPN jsou farmaka, jejichž podávání je dlouhodobé (v podstatě celoživotní). Navíc velké procento nemocných již primárně trpí různými formami aterosklerózy, případně zvýšeným rizikem tromboembolické nemoci [25,26]. Proto je otázka kardio-cerebro-vaskulární bezpečnosti těchto léků zcela zásadní [44].
Bezpečnost bronchodilatancií
Bronchodilatancia jsou stále nezpochybnitelným fundamentem v léčbě CHOPN. Patří k nim krátkodobě působící inhalační bronchodilatancia (ipratropium, fenoterol, salbutamol, terbutalin), dlouhodobě působící inhalační bronchodilatancia (tiotropium, formoterol, salmeterol, indakaterol) a dlouhodobě působící perorálně aplikovaná léčiva s bronchodilatačním účinkem (teofylin). Jiné léky (např. perorálně aplikovaný klenbuterol nebo prokaterol) by se v léčbě CHOPN již neměly objevovat.
Bezpečnost tiotropia
Inhalačně podávané parasympatikolytikum tiotropium (obchodní název Spiriva®) je od roku 2002 celosvětově považováno za základ farmakoterapie CHOPN již od II. klinického stadia (dle GOLD klasifikace). Nejrozsáhlejší bezpečnostní metaanalýzou 30 randomizovaných, dvojitě slepých, paralelních, placebem kontrolovaných studií (zahrnujících 10 846 subjektů léčených tiotropiem a 8 699 osob léčených placebem) nebyla nalezena žádná známka zvýšeného kardiovaskulárního rizika ve skupině s tiotropiem. Naopak byla jasně prokázána protektivní role tiotropia na poli kardiovaskulární a cerebrovaskulární patologie (s poklesem rizika celkového i kardiovaskulárního úmrtí a redukcí kardiální morbidity). Největší benefit byl patrný v poklesu počtu infarktů myokardu a ve snížení rizika závažných arytmií – srdeční zástavy a komorové tachykardie a fibrilace [72]. Výsledky této studie podpořily závěry dalších studií a analýz od Kestena, Tashkina, Gershonové, Leeho, Wortha, Salpetera a Rodriga [44,73–78], a vyvrátily tak nejistotu vycházející z (metodicky ne zcela objektivních) prací Singha a Wedzichové [79,80]. Na rizika náhlých cévních mozkových příhod se dívá práce Grossa et al nenalézající žádné důkazy pro negativní působení tiotropia na výskyt iktu [81]. Současný pohled na kardiovaskulární a cerebrovaskulární bezpečnost shrnuje recentní komentář autorů v NEJMu, kde konstatují, že nejdůležitějším zdrojem pro spolehlivá data byla a je studie UPLIFT. Proto experti FDA došli k závěru, že jim nejsou patrné žádné validní známky svědčící pro kardiovaskulární či cerebrovaskulární škodlivost tiotropia [82].
Bezpečnost indakaterolu
Indakaterol (obchodní název Onbrez®) je nové inhalační ultradlouhodobě (24 hod) působící β2-mimetikum. Od listopadu roku 2009 bylo v EU povolenou používání indakaterolu v dávkách 150 mg a 300 mg jednou denně pro nemocné s CHOPN. V ČR je možné léčit tímto lékem od jara roku 2011. Je určen pro nemocné od II. klinického stadia. Z patofyziologického hlediska je kardiovaskulární a cerebrovaskulární bezpečnost u tohoto léku obzvláště důležitá, neboť stimulací β2 adrenoreceptorů roste tepová frekvence a stoupá riziko srdečních arytmií [83]. Na druhou stranu jakákoli generalizovaná bronchodilatace zlepšuje ventilaci, snižuje hyperinflaci s redukcí air-trappingu a zlepšením funkce všech oddílů srdečních [84]. Vzhledem k malým klinickým zkušenostem zatím existuje výrazně méně bezpečnostních studií týkajících se léčby indakaterolem. Z těch nemnoha zatím nevyplývá žádné kardiovaskulární riziko u zdravých osob ani u nemocných s CHOPN [44,85,86].
Bezpečnost formoterolu a salmeterolu
Formoterol (obchodní názvy Foradil®, Atimos®, Fromano®, Formoterol Easyhaler®, Formoterol Ratiopharm®, Formovent®, Oxis®) představuje rychle a dlouhodobě (12 hod) působící inhalační β2-mimetikum používané v ČR od roku 1998. Formoterol používáme (stejně jako indakaterol) u nemocných od II. klinického stadia CHOPN. Vzhledem k jeho rychlému nástupu se u některých nemocných objevuje sklon k výskytu palpitací a od počátku používání je pečlivě sledován výskyt všech kardiálních problémů [87]. Zatím nebyl negativní vliv na kardiovaskulární morbiditu a mortalitu prokázán žádnou z dostupných prací a lék je u osob s CHOPN obecně považován za bezpečný [44,88,89]. Formoterol je rovněž součástí kombinovaných preparátů s obsahem inhalačního glukokortikosteroidu – budesonidu (obchodní název Symbicort®) nebo beklometazonu (Combair®).
Salmeterol (obchodní název Serevent® či v kombinované formě s inhalačním glukokortikoidem flutikazonem – Seretide®) je také dlouhodobě (12 hod) působící inhalační β2-mimetikum s poněkud pomalejším nástupem účinku (v porovnání s formoterolem). Obecně je salmeterol považován za lék poněkud vhodnější pro kardiaky s arytmiemi (vzhledem k pomalejšímu nástupu účinku je zde menší riziko palpitací). Ani u salmeterolu žádná z bezpečnostních studií neprokázala zjevná kardiovaskulární rizika [44,87,90]. Hlavním důkazem je hlavně velmi rozsáhlá a dlouhodobá (3 roky trvající) studie TORCH s několika léčebnými větvemi. U obou skupina subjektů léčených salmeterolem (samotným či v kombinaci s inhalačním glukokortikosteroidem flutikazonem) byla zaznamenána stejná či lepší kardiovaskulární bezpečnost než u placeba [90]. I přesto, že studie INSPIRE [80] naznačila potenciální bezpečnostní benefit salmeterolu oproti tiotropiu, další práce (metodiky objektivnější a obecně lépe akceptované širokou pneumologickou veřejností) prokázaly naprosto stejnou kardiovaskulární bezpečnost salmeterolu v porovnání s tiotropiem [91,92]. Z dosud nejvíce uznávané studie zkoumající efekt farmak v oblasti CHOPN (UPLIFTU) vyplývají spíše skutečnosti a důkazy pro kardioprotektivní působení tiotropia [43,73].
Bezpečnost krátkodobě působících inhalačních bronchodilatancií
Do této skupiny léků počítáme všechna farmaka podávaná z důvodů akutních obtíží (úlevová medikace). Jejich působení je rychlé (minuty) a krátkodobé (hodiny) a jejich aplikace musí být opakovaná (obvykle ve 4 denních dávkách, či lépe jen při obtížích, denní maximum je 12–16 vdechů). Většina lékových forem využívá bezfreonový MDI inhalační systém, který si pacient inhaluje přímo, nepřímo přes plastikový zásobník neboli spacer (Volumatic® či Aerochamber®), případně pomocí ultrazvukového či kompresorového inhalátoru. V této skupině léků se setkáváme s β2-mimetiky (sambutamol – Ventolin®, Buventol®, Ecosal®, fenoterol – Berotec®, Berodual®, terbutalin – Bricanyl®) a parasympatikolytikem ipratropiem (Atrovent®, Berodual®). Všechny tyto léky jsou podávány mnoho desítek let. Z tohoto důvodu považujeme údaje o jejich (kardiovaskulární i celkové) bezpečnosti za poměrně spolehlivé. Ipratropium bylo však nejprve v závěrech Lung Health Study (LHS) [93], a také v metaanalýze Singha (využívající stejnou skupinu nemocných jako LHS), označeno jako lék s potenciálními kardiovaskulárními riziky [79]. Následné analýzy prokázaly přítomnost skutečně velkého množství potenciálních bias. Jedním z nejvážnějších byla skutečnost, že většina subjektů LHS s výskytem závažných kardiovaskulárních komplikací byla sice zahrnuta ve ipratropiové skupině, avšak ipratropiem nebyla vůbec léčena (v důsledku non--compliance této skupiny nemocných s léčbou) [94]. Také v tomto případě udělala jasno studie UPLIFT prokazující absenci rizik inhalačních parasympatikolytik [57,73].
Bezpečnost teofylinu
Perorálně aplikovaný retardovaný teofylin (Afonilum®, Euphyllin®, Theoplus®) působí bronchodilatačně pomocí neselektivní inhibice fosfodiesterázy. Jedná se o lék s úzkým terapeutickým oknem a rizikem četných farmakologických interakcí, nicméně pokud se používá retardovaná léková forma v náležité dávce a je kontrolována sérová hladina (po 3–4 dnech od nasazení nebo změny dávky), nebyla nalezena klinicky významná kardiální symptomatologie [95,96]. Nutno zdůraznit, že dle aktuálních doporučení je teofylin indikován pouze pro nemocné v těžkém či velmi těžkém stadiu CHOPN, případně je (spolu s úlevovou inhalační medikací) lékem volby pro obyvatele chudých zemí, nebo v reálné praxi naší republiky i lékem indikovaným pro stále aktivní kuřáky s perzistující non-compliance a s absencí finančních zdrojů k úhradě doplatků za nákladné inhalační preparáty (bezdomovci, vězni). Na druhou stranu existují nová data prokazující benefit nízkých dávek systémově podávaného teofylinu u nemocných s CHOPN, pokud jsou současně léčeni inhalačními nebo systémovými glukokortikosteroidy (teofylin zde pomáhá na buněčné úrovni zvyšovat citlivost nukleárních procesů vůči protizánětlivému působení glukokortikosteroidů) [96–98].
Bezpečnost protizánětlivých léků
Bezpečnost inhalačních a systémových glukokortikosteroidů
Inhalační glukokortikosteroidy (IKS) své místo v léčbě CHOPN stále hledají. Zjednodušeně řečeno, jejich hlavní indikací jsou osoby od III. stadia v případě opakovaných akutních exacerbací a také subjekty s klinickým překryvem mezi bronchiálním astmatem a CHOPN. V České republice máme v tuto chvíli několik preparátů obsahujících IKS: beklometazon (Clenil®, Ecobec®, Beclomet®, Combair®), budesonid (Budiair®, Giona®, Miflonid®, Pulmicort®, Symbicort®) a flutikazon (Flixotide®, Seretide®). Metaanalýza 18 randomizovaných studií (téměř 17 000 osob s CHOPN) trvajících nejméně 24 týdnů však prokázala zvýšení rizika pneumonií u osob léčených IKS oproti placebu [99]. Velmi podobné zvýšení rizika pneumonií bylo pozorováno také při porovnávání pacientů s kombinací IKS/LABA v porovnání se subjekty s LABA [100]. Kardiovaskulární morbidita či mortalita však léčbou IKS nebyla nijak ovlivněna [100]. Absenci kardiovaskulárních rizik (při dlouhodobém použití IKS) potvrdily i 3 největší randomizované farmakologické studie provedené během poslední dekády – INSPIRE, TORCH a UPLIFT [73,80,90] a také rozsáhlá jihoamerická metaanalýza [77].
Systémové glukokortikoidy (KS) mají, z pohledu kardiovaskulární bezpečnosti, o poznání horší „životopis“. Je třeba zdůraznit, že jejich využití u stabilní fáze CHOPN je naprosto okrajové – mělo by být vyhrazeno pouze pro některé nemocné ve IV. stupni onemocnění, a to při respektování mnoha kontraindikací a farmakologických interakcí. Nejčastěji používáme prednison (Prednison®) a methylprednisolon (Medrol®). Mezi jejich hlavní nežádoucí účinky KS (kromě postižení žaludeční a duodenální sliznice, postižení skeletu, zhoršení glukózového metabolizmu, zánětů slinivky břišní, psychických a kožních následků) patří i hypokalemie (s potenciálním rizikem poruch srdečního rytmu) a elevace systémového krevního tlaku (s poruchou funkce levé komory či rizikem iktu) [3,4].
Bezpečnost roflumilastu
Roflumilast (Daxas®) je zcela novým (perorálně aplikovaným) lékem ve skupině protizánětlivých farmak používaných u CHOPN. Jeho preskripce v ČR bude pravděpodobně možná již od 2. poloviny roku 2011. Je určen pro nemocné od III. stadia v případě, že jejich CHOPN je asociována s chronickou expektorací sputa (bronchitický fenotyp) a současně s častými akutními exacerbacemi (nejméně 1–2krát ročně). Mechanizmus účinku spočívá v selektivní inhibici fosfodiesterázy 4 a vede k protizánětlivému efektu již při podání μg dávek (nepůsobí primárně bronchodilatačně). Efekt roflumilastu není totožný s působením teofylinů (ty inhibují fosfodiesterázu neselektivně, podávají se v mg dávkách a působí primárně bronchodilatačně). Hlavním nežádoucím účinkem roflumilastu je průjem a mírná redukce tělesné hmotnosti. V souhrnné bezpečnostní analýze všech pacientů z klinických studií však nebylo při porovnávání s placebem zaznamenáno žádné zvýšení kardiovaskulárního (náhlá úmrtí, jiné arytmie, prodloužení QT intervalu, infarkty, kardiální selhávání) ani cerebrovaskulárního (ikty) rizika [100,101]. V červnu roku 2011 vyšla analýza neprokazující žádné negativní kardiální interakce u zdravých osob při současném podávání roflumilastu a formoterolu [102].
Bezpečnost další farmakoterapie
U pacientů s CHOPN jsou indikována rovněž léčiva pomáhající s léčbou nikotinové závislosti: kromě volně prodejných nikotinových náplastí či žvýkaček (s ojedinělým výskytem palpitací, případně nevýrazným vzestupem krevního tlaku) se jedná o antidepresivum bupropion (Zyban®) a parciální agonista nikotinových receptorů vareniclin (Champix®). U prvně jmenovaného léku (bupropionu) byl opakovaně popsán negativní vliv na koronární ischemii a rovněž vzestup systémového krevního tlaku. Z těchto důvodů je třeba u osob s dekompenzovanou či nedostatečně léčenou arteriální hypertenzí monitorovat krevní tlak a u nemocných s jasnými projevy ICHS zvážit jiné metody léčby nikotinové závislosti [103]. Druhý preparát kromě zcela ojedinělých případů palpitací není spojován s žádnými kardiální či vaskulárními problémy [104]. V praxi jsou všechny tři způsoby léčby nikotinové závislosti mnohdy různým způsobem kombinovány. Případné ukončení chronického nikotinizmu se poměrně rychle pozitivně projeví i na kardiálním stavu pacientů.
Dalšími hojně používanými léčivy u nemocných s CHOPN jsou očkovací látky proti chřipce a pneumokoku (Vaxigrip® a Pneumo 23®), u nichž se nesetkáváme s žádnými kardiologickými kontraindikacemi (snad s výjimkou infekční endokarditidy) ani se žádnými negativními dopady na kardiovaskulární systém [3,4].
Bezpečnost nefarmakologické léčby
Nefarmakologická léčba zahrnuje zejména komplexní pulmonální rehabilitaci. Její dopad na kardiovaskulární aparát je velmi pozitivní, zatím nebyl zaznamenán výskyt žádných kardiálních problémů v souvislosti s tímto léčebným postupem [3,4,62]. Stejně benefitní je také dlouhodobá domácí oxygenoterapie a domácí neinvazivní ventilace [3,4,62]. Na hodnocení kardiálních nežádoucích projevů u bronchoskopických volum redukujících zákroků je v ČR i v EU potřeba více zkušeností [63]. Chirurgické metody léčby CHOPN (bulektomie a chirurgická volumredukce) jsou většinou spojeny s výrazným kardiálním benefitem, neboť při redukci plicní hyperinflace dochází k lepšímu plnění srdečních oddílů [65,84]. Otázka kardiálního a kardiovaskulárního efektu plicních transplantací je velmi komplikovaná a jistě by byla zajímavým námětem na samostatný článek [3,4,64].
Závěr
U kardiologických pacientů často nacházíme přítomnost chronické obstrukční plicní nemoci. Z různých zdrojů se dozvídáme, že až 1/3 osob odeslaných k provedení koronarografie, či stejný počet osob s kardiálním selháváním trpí dosud nediagnostikovanou CHOPN [43]. Na druhou stranu u osob postižených CHOPN běžně diagnostikujeme ischemickou chorobu srdeční či kardiální selhávání. Na základně dostupných dat lze konstatovat, že většina farmak, využívaných při léčbě stabilní fáze chronické obstrukční plicní nemoci, je z kardiologického pohledu bezpečná [105]. Tato bezpečnost je samozřejmě podmíněna dodržováním všech léčebných doporučení [3,4], včetně respektování případných lékových interakcí (nutné zejména během terapie teofyliny a systémovými glukokortikosteroidy). Na léčbu CHOPN se však nemusíme dívat pouze prizmatem toho, jak pneumolog pomáhá či škodí srdci. Pokud tuto otázku obrátíme, dostáváme se k jinému pohledu. Může běžná kardiologická léčba pomoci, či spíše škodí nemocným s CHOPN? Odpovědi jsou zajímavé. Různé dietetické intervence zaměřené proti rozvoji aterosklerózy současně vedou k signifikantnímu zlepšení plicních funkcí [106,107]. Například použití beta-blokátorů u osob s CHOPN nejen že neškodí, ale naopak redukuje počet akutních exacerbací a značně prodlužuje život nemocných [108]. Benefit přínašejí také statiny či antiagregační léčba.
Závěrem lze konstatovat: správně indikované léčebné intervence doporučované u osob s CHOPN srdci a cévám rozhodně neškodí a nemusíme se jich proto obávat. Dokazují to stále další a další data.
V článku byly využity části doktorské dizertační práce autora a vznikla za technické podpory výzkumných záměrů: MZ 0 FNHK 2005 a MSM 002 162 0820.
MUDr. Vladimír Koblížek
www.fnhk.cz
e-mail: koblizek@fnhk.czDoručeno do redakce: 6. 6. 2011
Zdroje
1. Bandolier. Risk of death from shark attack. [cit. 2011-04-12]. Dostupné z: http://www.medicine.ox.ac.uk/bandolier/booth/Risk/shark.html.
2. Vondra V. Peče o nemocné s chronickou obstrukční plicní nemocí v České republice. Praha: Jalna 1996 : 160.
3. Celli BR. Update on the management of COPD. Chest 2008; 133 : 1451–1462.
4. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease (Updated 2010). c 2010, last revision 5th of January 2011. [cit. 2011-04-20]. Dostupné z: http://www.goldcopd.com/ Guidelineitem.asp?l1=2&l2=1&intId=989.
5. Barnes PJ. Why more research into molecular and cellular mechanisms of COPD is needed. In Chronic Obstructive Pulmonary Disease – Cellular and Molecular Mechanisms. Boca Raton: Taylor & Francis Group 2005 : 1–16.
6. Pauwels RA, Rabe KF. Burden and clinical features of chronic obstructive pulmonary disease (COPD). Lancet 2004; 364 : 613–620.
7. Caballero A, Torres-Duque CA, Jaramillo C et al. Prevalence of COPD in five Colombian cities situated at low, medium, and high altitude (PREPOCOL study). Chest 2008; 133 : 343–349.
8. Buist AS, Vollmer WM, McBurnie H et al. Worldwide burden of COPD in high - and low - income countries. Part I. The burden of obstructive lung disease (BOLD) initiative. Int J Tuberc Lung Dis 2008; 12 : 703–708.
9. Halbert RJ, Natoli JL, Gano A et al. Global burden of COPD: systematic review and meta-analysis. Eur Respir J 2006; 28 : 523–532.
10. Musil J. Léčba chronické obstrukční plicní nemoci. Praha: Grada 1999.
11. Pauk N. Současné možnosti léčby CHOPN. Studia Pneumologica et Phtiseologica 2008; 68 : 182–190.
12. Hansen JE, Sun XG, Wasserman K. Calculating gambling odds and lung ages for smokers. Eur Respir J 2010; 35 : 776–780.
13. Kostekenvuo K, Broms U, Korhonen T et al. Smoking strongly predicts disability retirement due to COPD: the Finnish Twin Cohort Study. Eur Respir J 2011; 37 : 26–31.
14. Tan WC, Lo C, Jong A et al. Vancouver Burden of Obstructive Lung Disease (BOLD) Research Group. Mariujana and chronic obstructive lung disease: a population – based study. CMAJ 2009; 180 : 814–820.
15. Bridevaux PO, Probst-Hensch NM, Schindler C et al. Prevalence of airflow obstruction in smokers and never-smokers in Switzerland. Eur Respir J 2010; 36 : 1259–1269.
16. Klenha K, Koblizek V, Maly M. How far is it from the first admission for an exacerbation chronic obstructive pulmonary disease to death? Retrospective study from a rural region of the Czech Republic. Chest 2010; 138 : 447A.
17. Etter JF. Short-term change in self-reported COPD symptoms after smoking cessation in an internet sample. Eur Respir J 2010; 35 : 1249–1255.
18. Lamprecht B, McBurnie MA, Vollmer WM et al. BOLD Collaborative Research Group. COPD in never smokers: results from the population-based Burden of Obstructive Lung Disease study. Chest 2011; 139 : 752–763.
19. Agusti A, Sobradillo P, Celli BR. Addressing the complexity of chronic obstructive pulmonary disease: from phenotypes and biomarkers to scale-free networks, systems biology, and P4 medicine. Am J Respir Crit Care Med 2011; 183 : 1129–1137.
20. Barnes PJ, Hansel TT. New treatments for chronic obstructive pulmonary disease: molecular and cellular mechanisms. Eur Respir J 2003; 20 : 672–688.
21. Schols AM, Broekhuizen R, Weling--Scheepers CA et al. Body composition and mortality in chronic obstructive pulmonary disease. Am J Clin Nutr 2005; 82 : 53–59.
22. Schols AM, Slangen J, Volovics L et al. Weight loss is a reversible factor in the prognosis of chronic obstructive pulmonary disease. Am J Respir Crit Care Med 1998; 157 : 1791–1797.
23. Kim WJ, Hoffman E, Reilly J et al. Association of COPD candidate genes with computed tomography emphysema and airway phenotypes in severe COPD. Eur Respir J 2011; 37 : 39–43.
24. Wagner PD. Possible mechanisms underlying the developement of cachexia in COPD. Eur Respir J 2008; 31 : 492–501.
25. Schneider C, Bothner U, Jick SS et al. Chronic obstructive pulmonary disease and the risk of cardiovascular diseases. Eur J Epidemiol 2010; 25 : 253–260.
26. Curkendall SM, DeLuise C, Jones JK et al. Cardiovascular disease in patients with chronic obstructive pulmonary disease, Saskatchewan Canada cardiovascular disease in COPD patients. Ann Epidemiol 2006; 16 : 63–70.
27. Schneider C, Jick SS, Bothner U et al. Reflux disease, gastrointestinal ulcer or weight loss in patients with COPD. COPD 2010; 7 : 172–178.
28. Schneider C, Jick SS, Bothner U et al. COPD and the risk of depression. Chest 2010; 137 : 341–347.
29. Taylor AE, Finney-Hayward TK, Quint JK at el. Defective macrophage phagocytosis of bacteria in COPD. Eur Respir J 2010; 35 : 1039–1047.
30. Wood AM, de Pablo P, Buckley CD et al. Smoke exposure as a determinant of autoantibody titre in α1-antitrypsin deficiency and COPD. Eur Respir J 2011; 37 : 32–38.
31. Seymour JM, Spruit MA, Hopkinson NS et al. The prevalence of quadriceps weakness in COPD and the relationship with disease severity. Eur Respir J 2010; 36 : 81–88.
32. Hogg JC. Small airways disease in COPD. In: Barnes P (ed.). Chronic Obstructive Pulmonary Disease – Cellular and Molecular Mechanisms. Boca Raton: Taylor & Francis Group 2005 : 33–54.
33. Turato G, Baraldo S, Balestro E et al. Inflammation in lung parenchyma. In: Barnes P (ed.). Chronic Obstructive Pulmonary Disease – Cellular and Molecular Mechanisms. Boca Raton: Taylor & Francis Group 2005 : 17–32.
34. Kim JS, Rubin BK. Nasal and sinus inflammation in chronic obstructive pulmonary disease. COPD 2007; 4 : 163–166.
35. Kim J, Rubin B. Nasal and sinus involvement in chronic obstructive pulmonary disease. Curr Opin Pulm Med 2008; 14 : 101–104.
36. Pistolesi M, Camiciottoli G, Paoletti M et al. Identification of a predominant COPD phenotype in clinical practice. Respir Med 2008; 102 : 367–376.
37. Arrequi MA, Ezquerra KL, López FC et al. Hypercoagulability state and endotelial injury in stable chronic obstructive pulmonary disease patients. An Sist Sanit Nevar 2010; 33 : 43–50.
38. Guenette JA, Webb KA, Ofir D et al. Sex differences in exertional dyspnea in patients with mild COPD. Chest 2010; 138 : 692 A.
39. Bestall JC, Paul EA, Garrod R et al. Usefulness of the Medical Research Council (MRC) dyspnoea scale as a measure of disability in patients with chronic obstructive pulmonary disease. Thorax 1999; 54 : 581–586.
40. Fletcher CM. The clinical diagnosis of pulmonary emphysema – an experimental study. Proc R Soc Med 1952; 45 : 577–584.
41. Nishimura K, Izumi T, Tsukino M et al. Dyspnea is a better predictor of 5-year survival than airway obstruction in patients with COPD. Chest 2002; 121 : 1434–1440.
42. Koblizek V, Tomsova M, Cermakova E et al. Impairment of nasal mucociliary clearance in former smokers with stable chronic obstructive pulmonary disease relates to the presence of a chronic bronchitis phenotype. Rhinology 2011 [in press].
43. Hawkins NM, Petrie MC, MacDonald MR et al. Heart failure and chronic obstructive pulmonary disease. The quandary of beta-blockers and beta-agonists. J Am Coll Cardiol 2011; 57 : 2127–2138.
44. Worth H, Chung KF, Felser JM et al. Cardio - and cerebrovascular safety of indacaterol vs formoterol, salmeterol, tiotropium and placebo in COPD. Respir Med 2011; 105 : 571–579.
45. Prentice HA, Mannino DM, Caldwell GG et al. Significant bronchodilator responsiveness and „reversibility“ in a population sample. COPD 2010; 7 : 323–330.
46. Schirnhofer L, Lamprecht B, Firlei N et al. Using targeted spirometry to reduce non-diagnosed chronic obstructive pulmonary disease. Respiration 2010; 81 : 476–482.
47. Chlumský J, Fišerová J, Satinská J et al. Doporučený postup pro interpretaci základních vyšetření plicních funkcí [online]. c2007, poslední revize 9. 12. 2007 [cit. 2011-04-20]. Dostupné z: http://www.pneumologie.cz/odborne/doporucene-postupy.php.
48. Pellegrino RC, Antonelli A, Mondino M. Bronchodilator testing: an endless story. Eur Respir J 2010; 35 : 952–954.
49. Pellegrino RC, Viegi G, Brusasco V et al. Interpretative strategies for lung function tests. Eur Respir J 2005; 26 : 948–968.
50. Han MK, Wise R, Muford J et al. NETT Research Group. Prevalence and clinical correlates of bronchreversibility in severe emphysema. Eur Respir J 2010; 35 : 1048–1056.
51. Vollmer WM, Gâslason T, Burney P et al. Comparison of spirometry criteria for the diagnosis of COPD: results from the BOLD study. Eur Respir J 2009; 34 : 588–597.
52. Celli BR, Cote CG, Marin JM et al. The body-mass index, airflow obstruction, dyspnea and exercise capacity index in chronic obstructive pulmonary disease. N Engl J Med 2004; 350 : 1005–1012.
53. Puhan MA, Garcia-Aymerich J, Frey M et al. Expansion of the prognostic assessment of patients with chronic obstructive pulmonary disease: the updated BODE index and the ADO index. Lancet 2009; 374 : 704–711.
54. Koblížek V, Salajka F, Čermáková E et al. Vztah mezi kvalitou života a BODE indexem u bývalých kuřáků ve stabilní fázi chronické obstrukční plicní nemoci. Vnitř Lék 2009; 55 : 940–947.
55. Partridge MR, Miravitlles M, Ståhl E et al. Development and validation of the Capacity of Daily Living during the Morning questionnaire and the Global Chest Symptoms Questionnaire in COPD. Eur Respir J 2010; 36 : 96–104.
56. Koblížek V, Prachařová Š. Co bychom měli vědět o CHOPN? Stud Pneumol Phthiseol 2011; 71 : 51–53.
57. Decramer M, Celli BR, Kesten S et al. UPLIFT investigators. Effect of tiotropium on outcomes in patients with moderate chronic obstructive pulmonary disease (UPLIFT): a prespecified subgroup analysis of a randomised controlled trial. Lancet 2009; 374 : 1171–1178.
58. Troosters T, Celli BR, Lystiq T et al. Tiotropium as a first maintenance drug in COPD: secondary analysis of the UPLIFT trial. Eur Respir J 2010; 36 : 65–73.
59. Loke YK, Kwok CS, Singh S. Risk of myocardial infarction and cardiovascular death associated with inhaled corticosteroids in COPD. Eur Respir J 2010; 35 : 1003–1021.
60. Lehtimäki L, Kankaanranta H, Saarelainen S et al. Bronchial nitric oxide is related to symptom relief during fluticasone treatment in COPD. Eur Respir J 2010; 35 : 72–78.
61. Rennard SI, Calverley PM, Goehring UM et al. Reduction of exacerbations by the PDE4 inhibitor roflumilast – the importace of defining different subsets of patients with COPD. Respir Res 2011; 27 : 18.
62. Hodgkin JE, Celli BR, Connors GL (eds). Pulmonary rehabilitation – Guidelines to success. 4th ed. St. Louis, Missouri: Mosby Elsevier 2009.
63. Kotecha S, Westall GP, Holsworth L et al. Long-term outcomes from bronchoscopic lung volume reduction using a bronchial prosthesis. Respirology 2011; 16 : 167–173.
64. Lahzami S, Bridevaux PO, Soccal PM et al. Survival impact of lung transplantation for COPD. Eur Respir J 2010; 36 : 74–80.
65. Criner GJ. Alternatives to lung transplantation: lung volume reduction for COPD. Clin Chest Med 2011; 32 : 379–397.
66. Lange P, Mogelvang R, Marott JL et al. Cardiovascular morbidity in COPD: a study of the general population. COPD 2010; 7 : 5–10.
67. Sin DD, Man SF. Why are patients with chronic obstructive pulmonary disease at increased risk of cardiovascular disease? The potential role of systemic inflammation in chronic obstructive pulmonary disease. Circulation 2003; 107 : 1514–1519.
68. Dinh-Xuan AT, Higenbottam TW, Clelland CA et al. Impairment of endothelium dependent pulmonary artery relaxation in chronic obstructive lung disease. N Engl J Med 1991; 324 : 1539–1547.
69. Howes TQ, Deane CR, Levin GE et al. The effects of oxygen and dopamine on renal and aortic blood flow in chronic obstructive pulmonary disease with hypoxemia and hypercapnia. Am J Respir Crit Care 1995; 151 : 378–383.
70. Baudouin SV, Bott J, Ward A et al. Short term effect of oxygen on renal haemodynamics in patients with hypoxaemic chronic obstructive airways disease. Thorax 1992; 47 : 550–554.
71. Bassuk SS, Rifai N, Ridker PM. High-sensitivity C-reactive protein: clinical Importace. Curr Probl Cardiol 2004; 29 : 439–493.
72. Celli BR, Decramer M, Leimer H et al. Cardiovascular safety of tiotropium in patients with COPD. Chest 2010; 137 : 20–30.
73. Tashkin DP, Celli BR, Senn S et al. UPLIFT Study Investigators. A four year trial of tiotropium in patients with chronic obstructive pulmonary disease. N Engl J Med 2008; 359 : 1543–1554.
74. Kesten S, Jara M, Wentworth C et al. Pooled clinical trial analysis of tiotropium safety. Chest 2006; 130 : 1695–1703.
75. Gershon AS, Wang L, To T et al. Survival with tiotropium compared to long-acting beta-2-agonists in chronic obstructive pulmonary disease. COPD 2008; 5 : 229–234.
76. Lee TA, Wilke C, Joo M et al. Outcomes associated with tiotropium use in patients with chronic obstructive pulmonary disease. Arch Intern Med 2009; 169 : 1403–1410.
77. Rodrigo GJ, Castro-Rodriguez JA, Nannini LJ et al. Tiotropium and risk for fatal and nonfatal cardiovascular events in patients with chronic obstructive pulmonary disease: Systematic review with meta-analysis. Respir Med 2009; 103 : 1421–1429.
78. Salpeter SR. Do inhaled anticholinergics increase or decrease the risk of major cardiovascular events? A synthesis of the available evidence. Drugs 2009; 69 : 2025–2033.
79. Singh S, Loke YK, Furberg CD. Inhaled anticholinergics and risk of major adverse cardiovascular events in patients with chronic obstructive pulmonary disease: a systematic review and meta-analysis. JAMA 2008; 300 : 1439–1450.
80. Wedzicha JA, Calverley PM, Seemungal TA et al. INSPIRE Investigators. The prevention of chronic obstructive pulmonary disease exacerbations by salmeterol/fluticasone propionate or tiotropium bromide. Am J Respir Crit Care Med 2008; 177 : 19–26.
81. Grosso A, Douglas I, Hingorani AD et al. Inhaled tiotropium bromide and risk of stroke. Br J Clin Pharmacol 2009; 68 : 731–736.
82. Michele TM, Pinheiro S, Iyasu S. The safety of tiotropium – the FDA’s conclusions. N Engl J Med 2010; 363 : 1097–1099.
83. Insulander P, Juhlin-Dannfelt A, Freyschuss U et al. Electrophysiologic effects of salbutamol, a beta2-selective agonist. J Cardiovasc Electrophysiol 2004; 15 : 316–322.
84. Watz H, Waschki B, Meyer T et al. Decreasing cardiac chamber sizes and associated heart dysfunction in COPD – role of hyperinflation. Chest 2010; 138 : 32–38.
85. Khindri S, Sabo R, Harris S et al. Cardiac safety of indacaterol in healthy subjects: a randomized, multidose, placebo and positive controlled, parallel group thorough QT study. BMC Pulm Med 2011; 11 : 31.
86. Buhl R, Dunn LJ, Disdier C et al. INTENSITY study investigators. Blinded 12 week comparison of once-daily indacaterol and tiotropium in COPD. Eur Respir J 2011 [Epub akad of print].
87. Cazzola M, Matera MG, Donner CF. Inhaled beta2-adrenoreceptor agonists: Cardiovascular safety in patients with obstructive lung disease. Drugs 2005; 65 : 1595–1610.
88. Nelson HS, Gross NJ, Levine B et al. Formoterol Study Group. Cardiac safety profile of nebulized formoterol in adults with COPD: a 12-week, multicenter, randomized, double-blind, double-dummy, placebo - and active-controlled trial. Clin Ther 2007; 29 : 2167–2178.
89. Campbell SC, Criner GJ, Levine B et al. Cardiac safety of formoterol 12 microg twice daily in patients with chronic obstructive pulmonary disease. Pulm Pharmacol Ther 2007; 20 : 571–579.
90. Calverley PM, Anderson JA, Celli BR et al. TORCH Investigators. Cardiovascular events in patients with COPD: Torch study results. Thorax 2010; 65 : 719–725.
91. Jara M, Lanes SF, Wentworth C 3rd et al. Comparative safety of long-acting inhaled bronchodilators: a cohort study using the UK THIN primary care database. Drug Saf 2007; 30 : 1151–1160.
92. Vogelmeier C, Hederer B, Glaab T et al. POET-COPD Investigators. Tiotropium versus salmeterol for the prevention of exacerbation of COPD. N Engl J Med 2011; 364 : 1093–1103.
93. Anthonisen NR, Connett JE, Enright PF et al. Lung Health Study Research Group. Hospitalization and mortality in the Lung Health Study. Am J Respir Crit Care Med 2002; 166 : 333–339.
94. Hilleman DE, Malesker MA, Morrow LE et al. A systematic review of the cardiovascular risk of inhaled anticholinergics in patients with COPD. Int J Chron Obstruct Pulmon Dis 2009; 4 : 253–563.
95. Makino S, Adachi M, Ohta K et al. Safety of Sustained-Release Theophylline and Injectable Methylxanthines Committee; Asthma Prevention and Management Guidelines Committee. A prospective survey on safety of sustained-release theophylline in treatment of asthma and COPD. Allergol Int 2006; 55 : 395–402.
96. Morfin M, Castillo M. Theophylline, a new look to an old drug. Rev Alerg Mex 2010; 57 : 112–122.
97. Barnes PJ. Glucocorticosteroids: current and future directions. Br J Pharmacol 2011; 163 : 29–43.
98. Ford PA, Durham AL, Russell RE et al. Treatment effects of low-dose theophylline combined with an inhaled corticosteroid in COPD. Chest 2010; 137 : 1338–1344.
99. Singh S, Amin AV, Loke YK. Long-term use of inhaled corticosteroids and the risk of pneumonia in chronic obstructive pulmonary disease : a meta-analysis. Arch Intern Med 2009; 169 : 219–229.
100. Rabe KF. Roflumilast for the treatment of chronic obstructive pulmonary disease. Expert Rev Respir Med 2010; 4 : 543–555.
101. Vignola AM. PDE4 inhibition in COPD – a more selective approach to treatment. Respir Med 2004; 98 : 495–503.
102. de Mey C, Nassr N, Lahu G. No relevant cardiac, pharmacokinetic or safety interactions between roflumilast and inhaled formoterol in healthy subjects: an open-label, randomized, actively controlled study. BMC Clin Pharmacol 2011; 11 : 7.
103. Rigotti NA, Thorndike AN, Regan S et al. Bupropion for smokers hospitalized with acute cardiovascular disease. Am J Med 2006; 119 : 1080–1087.
104. Coe JW, Brooks PR, Veteline MG et al. Varenicline: an alpha4beta2 nicotinic receptor partial agonist for smoking cessation. J Med Chem 2005; 48 : 3474–3477.
105. Yohannes AM, Willgoss TG, Vestbo J. Tiotropium for treatment of stable COPD: a meta-analysis of clinically relevant outcomes. Respir Care 2011 [Epub akad of print].
106. Keranis E, Makris D, Rodopoulou P et al. Impact of dietary shift to higher antioxidant fous in COPD: a randomized trial. Eur Respir J 2010; 36 : 774–780.
107. Shaheen SO, Jameson KA, Syddall HE et al. Hertfordshire Cohort Study Group. The relationship of dietary patterns with adult lung function and COPD. Eur Respir J 2010; 36 : 277–284.
108. Rutten EH, Zuithoff NP, Hak E et al. Beta-blockers may reduce mortality and risk of exacerbations in patients with chronic obstructive pulmonary disease. Arch Intern Med 2010; 170 : 880–887.
109. Barnes PJ, Celli BR. Systemic manifestations and comorbidities of COPD. Eur Respir J 2009; 33 : 1165–1185.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek MUDr. Jana Lacinová – 65 letČlánek Dráždivý tračník
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2011 Číslo 9- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- MUDr. Jana Lacinová – 65 let
- Prim. MUDr. Milanu Tržilovi k 60. narozeninám
- Česká angiologie a její proměny
- Dráždivý tračník
- Biologická léčba v dermatologii – psoriáza
- Prokinetika – jejich přínos v klinické praxi gastroenterologické
- Nemoci jater v interní ambulanci
- Arytmologie dnes: rizika antiarytmické terapie v interní ambulanci
- Terapie stabilní chronické obstrukční plicní nemoci (CHOPN) a její případná kardiovaskulární rizika (základní přehled)
- Předoperační vyšetření u nemocných před nekardiálním chirurgickým výkonem
- Současný pohled na léčbu hypertenze v těhotenství
- Nová antitrombotika v prevenci žilní tromboembolie a nové protidestičkové léky
- Cílená biologická léčba solidních nádorů
- Proteinurie v ambulantní praxi
- Význam antihypertenzní léčby u subklinického poškození mozku
- Polypragmazie a lékové interakce
- Existuje vztah mezi léčbou diabetu a vznikem nádorů?
- Kombinovaný trénink u mužů s metabolickým syndromem po akutní koronární příhodě
- Diagnostika sekundární hypertenze v ambulantní praxi
- FARIM – FARmakoterapie po Infarktu Myokardu
- Tyreopatie v ambulantní praxi
- Zemřel prof. MUDr. Vladimír Pacovský, DrSc., emeritní předseda Československé internistické společnosti
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Proteinurie v ambulantní praxi
- Prokinetika – jejich přínos v klinické praxi gastroenterologické
- Polypragmazie a lékové interakce
- Tyreopatie v ambulantní praxi
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



