-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Arytmologie dnes: rizika antiarytmické terapie v interní ambulanci
Arrhythmology today: risks associated with anti-arrhythmic therapy in an internal medicine outpatient clinic
Arhytmology that is focused on diagnostics and therapy of heart rhythm disturbances and their complications has undergone dramatic development in last 2 decades. Widespread use of catheter ablation, introduction of implantable cardioverter-defibrillators for prevention of sudden cardiac death and finally, development of cardiac resynchronization therapy have lead to decreased importance of drug treatment. Antiarhythmic drugs remain therapy of choice in management of atrial fibrillation and in some ventricular arrhythmias, especially in patients with implantable cardioverter-defibrillator backup. Therefore, this review deals predominantly with a strategy of antiarythmic therapy in atrial fibrillation and discusses possible risks.
Key words:
arhythmology – antiarhythmic drugs – atrial fibrillation – long QT syndrome – proarhythmia
Autoři: J. Kautzner
Působiště autorů: Klinika kardiologie IKEM Praha, přednosta prof. MUDr. Josef Kautzner, CSc., FESC
Vyšlo v časopise: Vnitř Lék 2011; 57(9): 702-708
Kategorie: 65. narozeniny MUDr. Jany Lacinové a 60. narozeniny prim. MUDr. Milana Tržila
Souhrn
Arytmologie, která se zabývá diagnostikou a léčbou poruch srdečního rytmu a jejich komplikací, prodělala za posledních 20 let bouřlivý rozvoj. Rozšíření metody katetrizačních ablací, používání implantabilních kardioverterů-defibrilátorů v prevenci náhlé srdeční smrti a nakonec rozmach srdeční resynchronizační léčby vedly k snížení významu léčby medikamentózní. Ta zůstává strategií první volby především u fibrilace síní a u některých komorových arytmií, zejména u pacientů zajištěných implantabilním kardioverterem-defibrilátorem. Tento přehled se proto věnuje převážně strategii antiarytmické léčby u fibrilace síní a zabývá se možnými riziky.
Klíčová slova:
arytmologie – antiarytmika – fibrilace síní – syndrom dlouhého QT – proarytmieÚvod
Arytmologie, kterou lze charakterizovat jako podobor kardiologie zabývající se diagnostikou a léčbou poruch srdečního rytmu a jejich komplikací, prodělala za posledních 20 let bouřlivý rozvoj [1–3]. Ten odrážel především zavedení metody katetrizačních ablací, která dovolila poprvé odstranit řadu srdečních arytmií, a používání implantabilních kardioverterů-defibrilátorů (ICD) k primární i sekundární profylaxi náhlé srdeční smrti. Později se přidala i tzv. srdeční resynchronizační léčba, která se používá k ovlivnění pokročilého srdečního selhání u pacientů s poruchou nitrokomorového vedení vzruchu. Vzhledem k tomu, že jde o intervenční metody, stala se arytmologie převážně intervenčním oborem. K tomu přispěly i výsledky mnoha studií, které prokázaly omezenou účinnost antiarytmik a řadu jejich nežádoucích účinků [4–9].
Díky výše uvedenému vývoji se změnily přístupy k léčbě řady srdečních arytmií. Katetrizační ablace se stala metodou první volby pro léčbu většiny supraventrikulárních tachyarytmií s výjimkou fibrilace síní (FS). To samé platí pro idiopatické komorové arytmie. Ve všech těchto případech lze totiž katetrizační ablací arytmii odstranit a nemocného vyléčit. U nemocných s FS nebo komorovými arytmiemi v přítomnosti strukturního postižení srdce je situace jiná. Ke kontrole rytmu při FS se v prvním kroku až na naprosté výjimky používá některé z antiarytmik a teprve při jeho selhání lze indikovat selektivní katetrizační ablaci [10,11]. U komorových arytmií je situace ještě složitější. Antiarytmika mohou potlačit recidivy komorových tachykardií, nicméně jejich role v prevenci výskytu náhlé arytmické smrti selhala. Řada studií ověřila, že jejich profylaktické podávání nevede k zlepšení prognózy nemocných [4–9]. To platí i pro nejúčinnější antiarytmikum, kterým je amiodaron. Nejnázornějším příkladem je výsledek studie SCD HEFT [9], ve které byli randomizováni pacienti s významnou systolickou dysfunkcí levé komory k podávání placeba, amiodaronu a k primárně profylaktické implantaci ICD. Jedině ICD ovlivnil příznivě prognózu nemocných. Mezi amiodaronem a placebem nebyl žádný rozdíl. Proto je u nemocných s pokročilou dysfunkcí levé komory nebo některými kardiomyopatiemi (např. arytmogenní kardiomyopatie pravé komory nebo hypertrofická kardiomyopatie) na prvním místě v profylaxi náhlé smrti ICD [12]. Podobná je i situace u primárních elektrických poruch, jako je syndrom vrozeného prodloužení intervalu QT s vysokým rizikem nebo primární fibrilace komor. Antiarytmická léčba se poté používá převážně k omezení terapií z ICD. Následující text se proto bude věnovat především strategii antiarytmické léčby u FS a s ní spojeným rizikům.
Strategie antiarytmické léčby u fibrilace síní
FS je nejčastější arytmií u člověka a zároveň arytmií, u které dosud hraje antiarytmická medikace v léčbě hlavní roli [10,11,13]. FS je definována jako ztráta koordinované elektrické aktivace síní, která vede k ztrátě koordinované mechanické funkce síní s řadou důsledků. EKG obraz FS je dobře znám a klíčovým nálezem je absence vln P a jejich nahrazení rychlými oscilujícími vlnkami a nepravidelná, obvykle rychlejší aktivace komor. Jedině při úplné AV blokádě může být i při FS pravidelná komorová aktivita, která odpovídá náhradnímu junkčnímu nebo idioventrikulárnímu rytmu (obvykle o frekvenci 45/min a níže).
Léčba nemocného s FS je primárně zaměřena na zlepšení symptomů a prevenci komplikací této arytmie [10,11,13]. Oba cíle je nutno plnit současně, zejména u nově zachycené arytmie. Otázky stratifikace rizika tromboembolických komplikací a jejich prevence přesahuje rámec tohoto textu. V další části budou proto diskutovány pouze principy kontroly frekvence a rytmu. Akutní léčba pacientů s FS spočívá v prevenci tromboembolismu a v akutním zlepšení funkce srdce. Závažnost příznaků by měla určovat rozhodování o kontrole frekvence nebo o nutnosti kardioverze.
Akutní kontrola frekvence
Akutní kontrola frekvence při FS spočívá ve zpomalení převodu elektrických vzruchů na komory. U hemodynamicky stabilních pacientů lze dosáhnout podáním beta-blokátorů nebo nedihydropyridinových blokátorů kalciových kanálů. U pacientů s výraznějšími příznaky lze použít intravenózní podání těchto léků ke zpomalení komorové odpovědi na frekvenci okolo 80–100/min. U některých nemocných, zejména u pacientů s dysfunkcí levé komory, je indikován amiodaron. Při parenterálním podání je nutné dodržovat způsob podání formou infuze. V případě pomalé odpovědi nebo AV blokády při FS (tehdy pravidelný a pomalý rytmus komor, neboť jde o náhradní rytmus) lze použít v první pomoci intravenózně podaný atropin.
Farmakologická kardioverze
Mnoho epizod FS končí spontánně během několika hodin nebo dní. V případě, kdy je nemocný výrazně hemodynamicky kompromitován, je indikována elektrická kardioverze. Farmakologickou verzi volíme tam, kde jsou příznaky mírnější, ale přesto je nelze kontrolovat zpomalením komorové frekvence. Antiarytmikum lze podat ve formě bolusu. U nás je zatím možné použít ke kardioverzi propafenon, případně amiodaron. V prvním případě lze očekávat přechod do sinusového rytmu během 30 min až 2 hod. Pacient by neměl trpět organickým srdečním onemocněním s významnou dysfunkcí levé komory nebo ischemií myokardu. V případě amiodaronu dochází ke kardioverzi o několik hodin později než po propafenonu. Procento konverze na sinusový rytmus je sice nižší než při použití elektrické kardioverze, ale odpadá nutnost celkové anestezie a rizik s tím spojených. V průběhu podání antiarytmika by mělo být monitorováno EKG alespoň po dobu poloviny eliminačního poločasu daného léku. Lze tak odhalit případné proarytmické účinky nebo manifestaci onemocnění sinusového uzlu nebo AV blokády. U vybraných nemocných lze použít strategii „pilulky v kapse“, kdy si pacient provede kardioverzi sám perorální aplikací antiarytmika jako propafenon nebo flekainid. U sotalolu nebylo prokázáno významnější ovlivnění procenta konverze na sinusový rytmus [14]. Bez prokazatelného účinku na konverzi na sinusový rytmus je i digoxin nebo verapamil.
Dlouhodobá strategie léčby FS: kontrola rytmu nebo frekvence?
Klinické randomizované studie srovnávající kontrolu rytmu a frekvence neprokázaly žádný významný rozdíl v celkové mortalitě a výskytu mozkových příhod [15–18]. Proto rozhodnutí o strategii kontroly rytmu vyžaduje individuální posouzení. Před volbou kontroly frekvence jako dlouhodobé strategie by měl lékař posoudit, jaká je šance na udržení sinusového rytmu a jak ovlivní ponechání permanentní FS osud individuálního pacienta. Symptomy spojené s FS a jejich závažnost jsou určujícím faktorem, který v tomto rozhodování hraje roli. Další faktory jsou takové, které mohou negativně ovlivnit udržení sinusového rytmu, jako jsou například dlouhodobá anamnéza FS, starší věk, závažná přidružená kardiovaskulární onemocnění a výrazné zvětšení levé síně.
Přestože randomizované klinické studie neprokázaly rozdíl v kvalitě života mezi pacienty léčenými strategií k udržení sinusového rytmu a ke kontrole srdeční frekvence, následné analýzy ukázaly, že přítomnost sinusového rytmu zlepšuje kvalitu života. Ačkoli uvedené studie nezjistily rozdíl ve výskytu srdečního selhání a ve funkci levé komory srdeční, některé podstudie (např. studie RACE) dokumentovaly, že pacienti se sinusovým rytmem po katetrizační ablaci měli nižší stupeň zhoršení funkce levé komory srdeční [19]. Podobný trend nebyl shledán ve studii AFFIRM [20]. Nicméně následná analýza studie AFFIRM naznačila, že pozitivní efekt udržení sinusového rytmu (pokles mortality o 53 %) byl znevážen nežádoucími účinky antiarytmické léčby (zvýšení mortality o 49 %) [21]. Výsledek studie ATHENA [22] s podáváním dronedaronu je prvním signálem toho, že antiarytmikum může zabránit hospitalizacím pro srdeční selhání. Podobně se hromadí první údaje o tom, že katetrizační ablace přináší podstatně vyšší účinnost v udržení sinusového rytmu a zřejmě může pozitivně ovlivnit prognózu nemocných s FS.
Kontrola frekvence
Primárním cílem této strategie je zlepšení symptomů a prevence zhoršování srdeční funkce vlivem rychlé a nepravidelné srdeční akce. Kromě toho by měla účinná kontrola frekvence zajistit zlepšenou toleranci zátěže a kvalitu života. Znemožněním rozvoje kardiomyopatie navozené tachyarytmií by měla tato léčba bránit i hospitalizacím pro srdeční selhání. Naposled jmenovaná komplikace FS se vyskytuje především u nemocných s perzistující komorovou frekvencí nad 120/min a je přitom reverzibilní účinnou kontrolou frekvence nebo rytmu.
Podobně jako při akutní kontrole frekvence se používají dlouhodobě především beta-blokátory, nedihydropyridinové blokátory kalciových kanálů a digoxin. Spíše výjimečně je nutné u nemocných se srdečním selháním použít ke kontrole frekvence amiodaron. V takových případech je lepší pomýšlet na nefarmakologickou kontrolu frekvence – katetrizační ablaci AV uzlu a implantaci stimulačního systému umožňujícího resynchronizační léčbu. Studie ERATO ukázala, že dalším lékem, který účinně kontroluje srdeční frekvenci, je dronedaron [23]. Velká multicentrická studie s dronedaronem u perzistující fibrilace síní, která by měla ověřit pozitivní vliv na morbiditu a mortalitu (studie PALLAS), však byla nedávno předčasně zastavena pro vyšší výskyt komplikací.
Důležitou otázkou je, co lze považovat za účinnou kontrolu frekvence při FS. V minulosti byla hranice přiměřené kontroly definována empiricky jako 80 tepů/min v klidu. V současné době máme k dispozici výsledky studie, která randomizovala nemocné k striktní kontrole (80/min v klidu a 110/min během středně těžké zátěže) a méně striktní kontrole frekvence (110/min v klidu) [24]. Mezi oběma strategiemi nebyl prokázán překvapivě žádný rozdíl z hlediska primárního cíle studie (složený cíl kardiovaskulární mortality, hospitalizace pro srdeční selhání, mozkové příhody, systémové embolizace, krvácení a události související s arytmií). Méně striktní kontroly bylo dosaženo snadněji a s menšími dávkami léků. Přesto měla většina pacientů hodnoty v průměru okolo 85/min v klidu, což bylo přibližně o 10/min více než ve skupině s přísnou kontrolou. Proto se většinou doporučuje jako cílová hodnota v klidu 100/min. U pacientů s výraznými symptomy při zátěži je vhodné ověřit hodnoty frekvence komor při zátěžovém testu nebo při holterovské monitoraci.
Kontrola rytmu
Bez podání antiarytmika lze očekávat rekurence FS přibližně v 75 % v průběhu jednoho roku [25–27]. Účinnost antiarytmik v udržení sinusového rytmu lze odhadnout z metaanalýzy 44 randomizovaných studií srovnávajících antiarytmika a placebo nebo žádnou léčbu. Celkově lze očekávat účinnost zhruba dvojnásobnou v porovnání s placebem. To platí pro léky jako disopyramid nebo chinidin, flekainid nebo propafenon, sotalol a amiodaron.
Je potřeba zdůraznit, že podávání antiarytmik s cílem kontroly rytmu vede málokdy k úplnému potlačení FS. Lék by ovšem měl výrazně snížit počet epizod FS a zlepšit kvalitu života. U asymptomatických pacientů je proto podávání antiarytmik s cílem snížení počtu epizod FS diskutabilní. Ideálně by antiarytmika měla snížit i počet hospitalizací a kardiovaskulární mortalitu. V tomto směru bohužel většina léků selhala. Jediný příznivý efekt byl prokázán pro dronedaron [22].
Přehled léků, dávkování a další údaje jsou v tab. 1. Výběr léku a dávkování by měly vycházet z individuálního profilu pacienta a především z údajů o přítomnosti nebo absenci srdečního onemocnění. Amiodaron je považován za nejúčinnější k redukci počtu epizod FS. Je to také jediný lék, který má zanedbatelné riziko proarytmie a je lékem volby u nemocných se symptomatickými rekurencemi FS, které nereagují na ostatní léky. Lze jej podávat i u pacientů se srdečním selháním a strukturním postižením srdce. Přestože riziko vzniku tachykardie typu torsade de pointes je nízké, měl by být na počátku léčby monitorován interval QT (obr. 1). V současnosti je nově k dispozici dronedaron, jehož účinnost je nižší než u amiodaronu, ale má podstatně méně nežádoucích účinků.
Tab. 1. Přehled současně používaných antiarytmik, jejich dávkování a rizik. 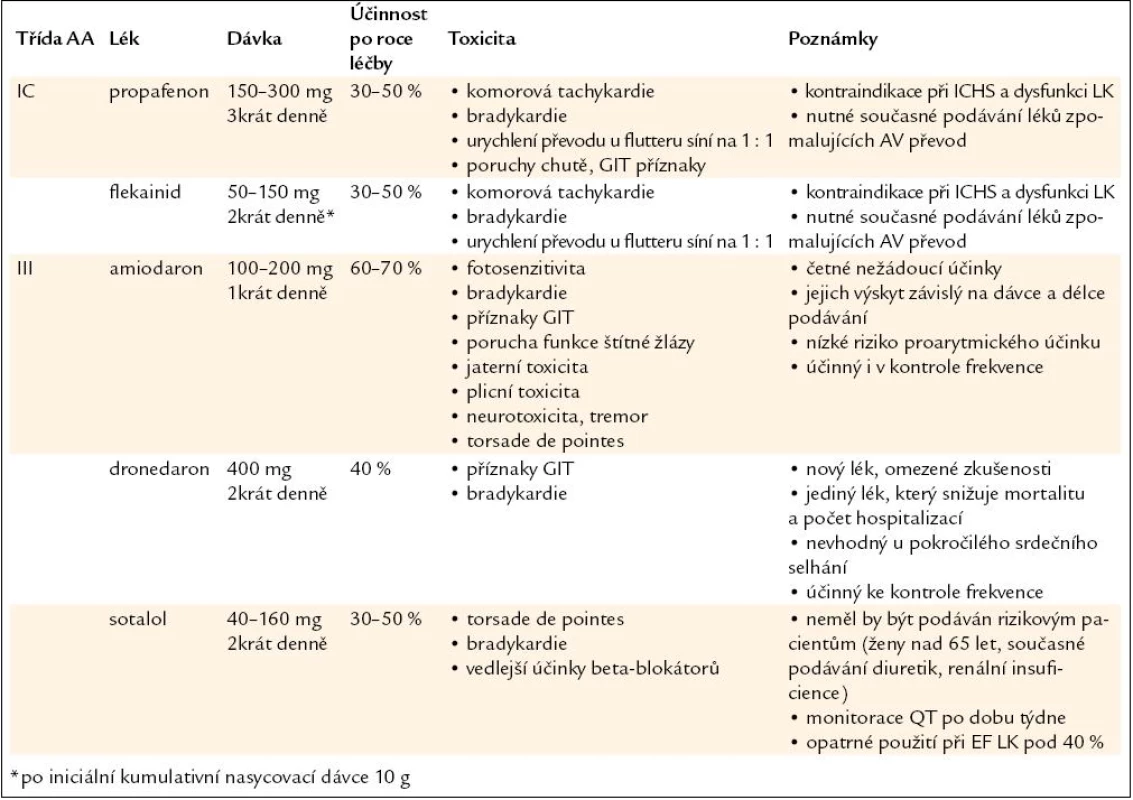
Obr. 1. Ukázka EKG křivky od 63letého pacienta, kterému byl navzdory prodloužení intervalu QT na 530 ms za bazálních podmínek podán amiodaron v infuzích k zvládnutí epizod fibrilace síní. Je patrno extrémní prodloužení intervalu QT s bizarními vlnami T a bigeminicky vázanými komorovými extrasystolami. U tohoto pacienta došlo k rozvoji elektrické bouře na podkladě epizod torsade de pointes a situace byla zvládnuta dočasnou kardiostimulací a vysazením amiodaronu. 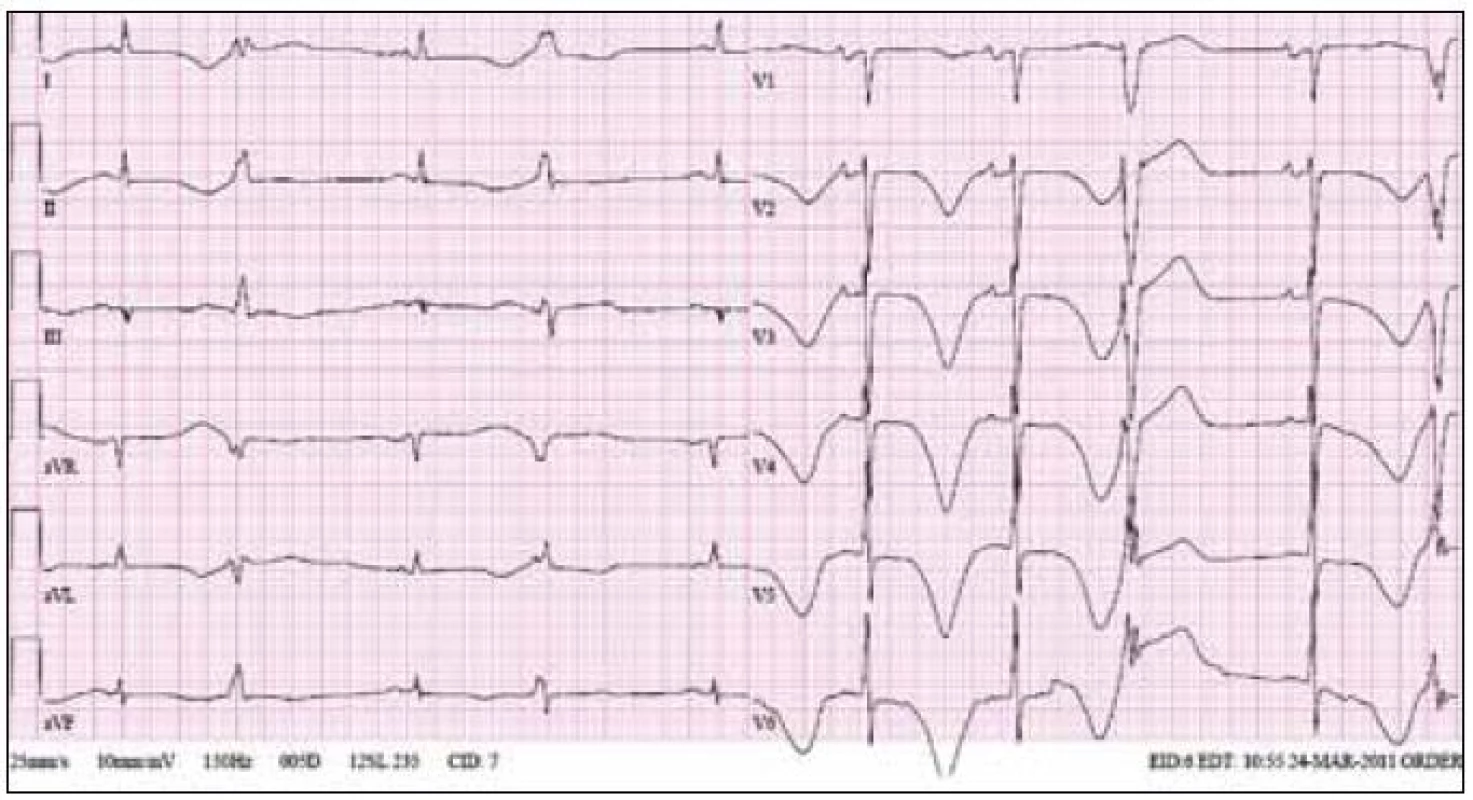
Při zahájení léčby flekainidem se doporučuje monitorace EKG. Prodloužení QRS o 25 % a více svědčí pro riziko proarytmie. Doporučuje se i souběžné podávání beta-blokátoru, neboť existuje riziko konverze FS do flutteru síní s rychlým převodem na komory. Propafenon působí podobně a lze jej bezpečně podávat pacientům bez strukturního postižení srdce. Sotalol brání sice účinně rekurencím FS, ale je méně účinný než amiodaron. Mnohem častěji u něj lze pozorovat proarytmické účinky. Proto je nezbytné pečlivé monitorování intervalu QT a bradykardie. Při dosažení QT okolo 500 ms by měla být snížena dávka nebo podávání zastaveno. Riziko proarytmie je největší u žen, pacientů s výraznou hypertrofií myokardu, výraznou bradykardií, renální insuficiencí, hypokalemií nebo hypomagnezemií.
Problém lékových interakcí při podávání antiarytmik
Zvyšující se počet léků a také narůstající množství firemních produktů s různými názvy výrazně zvyšují riziko případných lékových interakcí. To platí dvojnásobně pro podávání antiarytmik. Proto je nutná snaha tato rizika minimalizovat. Běžná praxe je však zcela rozdílná. Retrospektivní analýza databáze preskripcí z Německa [28] zahrnující 50 praktických lékařů a údaje o více než 4 000 pacientech, kteří měli předepsáno alespoň 10 léků, sledovala potenciální interakce nebo jasné kontraindikace současného podávání léků. Bylo odhaleno 1 295 kombinací s rizikem interakcí a z toho plných 10 % představovaly kontraindikované kombinace. Celkem 6,5 % pacientů mělo předepsáno dokonce 2 a více nežádoucích kombinací. Mezi kontraindikovanými léky byla nejčastější antiarytmika a tricyklická antidepresiva. Zhruba 1/3 pacientů se srdečním selháním neměla léčbu odpovídající současným doporučením.
Data z kanadského registru CARAF (723 pacientů) sloužila k analýze počtů nemocných s FS, kteří mají kontraindikace k použití jednoho z 5 antiarytmik jako chinidin, propafenon, flekainid, sotalol a amiodaron nebo u kterých je zvýšené riziko nežádoucích proarytmických účinků [29]. Kontraindikace nebo potenciální kontraindikace byly zjištěny u 38–57 % pacientů podle konkrétního léku. Při analýze 465 nemocných, kteří brali jeden z těchto léků v průběhu sledování, dosahoval podíl nemocných s kontraindikací nebo potenciální kontraindikací 33 až 83 %. Z velké části to bylo v důsledku přidružených onemocnění.
Některé lékové kombinace jsou potenciálně velmi nebezpečné [30–32]. Typickým příkladem jsou léky ovlivňující srdeční repolarizaci. Mohou vést k prodloužení intervalu QT a náhlému úmrtí. Takové případy přitahují pozornost zejména proto, že získaný syndrom prodloužení intervalu QT je mnohem častější než vrozený. Je způsoben léky, metabolickými abnormalitami a získaným onemocněním srdce. Zdá se, že tito pacienti mají určitou genetickou predispozici [33,34]. Za normálních okolností nemají prodloužený interval QT, ale přesto jsou potenciálně ohroženi náhlou smrtí.
Syndrom získaného prodloužení intervalu QT a torsade de pointes
Syndrom dlouhého QT je důsledkem poruch iontových kanálů, které jsou zodpovědné za repolarizaci myokardu [30–38]. Opožděná repolarizace (která se projeví prodloužením intervalu QT) je buď důsledkem defektů toku draslíkových iontů (pozdě nebo pomalu), nebo toku iontů sodíku (mnoho nebo dlouho). V konečném důsledku dochází k stabilizaci fáze plateau akčního potenciálu o 30 mV výše. To je práh pro pomalé kalciové kanály, závislé na voltáži a čase. Jejich otevření vede k pozdnímu přítoku kalcia do buněk a k vzniku časných následných depolarizací (early afterdepolarizations). Ty mohou spouštět polymorfní komorové arytmie typu torsade de pointes. K jejich manifestaci napomáhá aktivace sympatiku. Rozdíly mezi jednotlivými vrstvami myokardu vedou k disperzi repolarizace, což je predispozice pro arytmie typu reentry.
Mnoho stavů zvyšuje disperzi repolarizace. Zahrnují ischemii, poruchy elektrolytů či podávání léků ovlivňujících iontové kanály. Pokud je pacient exponován těmto stavům, může u něj dojít k prodloužení QT a vzniku torsade de pointes (obr. 2). Každý lékař by měl být obeznámen s rostoucím seznamem počtu léků, které jsou spojovány se vznikem této potenciálně smrtelné arytmie. Jednak ovlivňují funkci draslíkových kanálů a jednak může dojít k toxickému efektu v důsledku farmakokinetických nebo farmakodynamických interakcí. Existuje řada rizikových faktorů, které nebezpečí torsade de pointes zvyšují. Zahrnují ženské pohlaví, bradykardii, hypokalemii a hypomagnezemii, užívání diuretik, srdeční selhání, hypertrofie myokardu nebo ischemie a preexistující prodloužení QT. Varovnými znaky na EKG jsou prodloužení QT, bifazické vlny T nebo měnící se vlny U a dále komorové extrasystoly.
Obr. 2. Epizoda komorové tachykardie torsade de pointes zachycená na monitoru u 83leté pacientky přijaté pro fibrilaci síní s pomalou odpovědí komor při intoxikaci digoxinem a verapamilem, s hypokalemií po diuretické léčbě. Situace byla vyřešena vysazením léku, korekcí hypokalemie a dočasnou kardiostimulací. 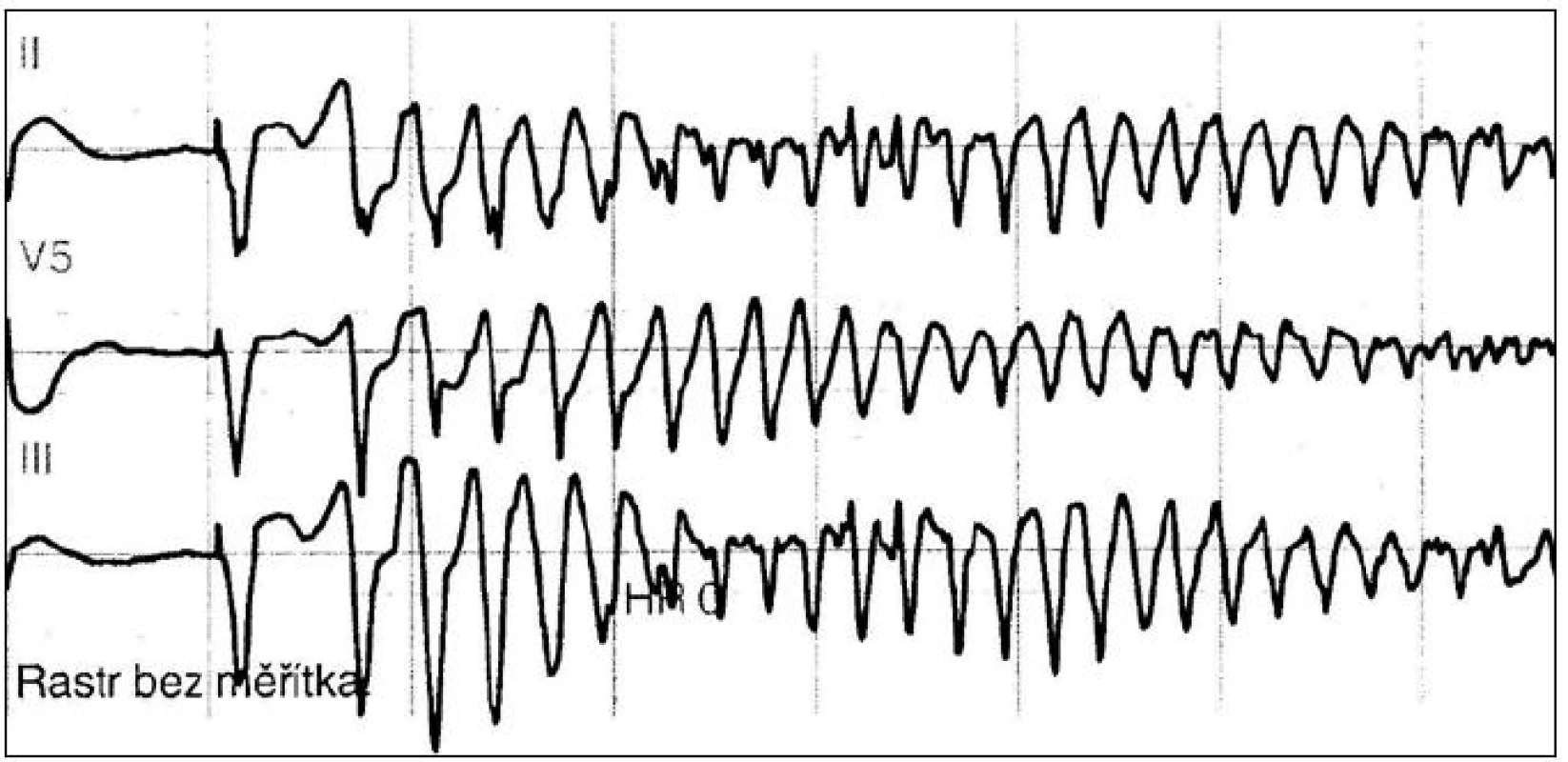
Antiarytmika třídy IA jako chinidin, prokainamid a disopyramid jsou typickými léky s rizikem torsade de pointes. Riziko je zvýšeno především při výrazném prodloužení QT (na hodnoty okolo 0,6 s). Proto se při zahájení léčby doporučovalo 2–3denní monitorování v nemocnici, zejména u žen. Dnes se tyto léky u nás již nepoužívají. Používá se však sotalol, který je spojen s rizikem torsade de pointes zhruba v 1,8–4,8 %. Dávku léku je potřeba redukovat při snížené funkci ledvin. U amiodaronu je situace trochu jiná. Ačkoli lék prodlužuje významně interval QT, arytmie torsade de pointes je poměrně vzácná. Přesto se může vyskytnout a je potřeba na tuto eventualitu pomýšlet.
Interval QT mohou prodlužovat také psychiatrické léky [39–43]. Pacienti s psychiatrickými onemocněními mají současně významně vyšší kardiovaskulární mortalitu. Prodloužení QT se udává až u 8–25 % těchto nemocných a je ještě častější při zvýšené dávce léku. Arytmie torsade de pointes byly popsány po podání fenotiazinů, haloperidolu, pimozidu a sertindolu. Vzácně byly pozorovány i u jiných léků. Účinek tricyklických antidepresiv na interval QT je znám velmi dlouho. Jsou popsány i kazuistické případy torsade de pointes po podání selektivních inhibitorů reuptake serotoninu jako fluoxetin a zimeldin [41,42]. Riziko se zvyšuje při souběžném podávání s lithiem [43]. Rizika vzniku torsade de pointes zvyšují výrazně podání diuretik nebo hypomagnezemie. Zvýšení rizika je nezávislé na koncentracích kalia v séru, zejména při současném podání antiarytmik.
Velkou pozornost zasluhují i antibiotika, antihistaminika a antimykotika [44–48]. Tyto léky bývají předepisovány příležitostně pro nezávažná onemocnění. Erytromycin a další makrolidová antibiotika mohou vést k prodloužení intervalu QT a ke vzniku torsade de pontes. Fluorochinoliny jako sparfloxacin nebo levofloxacin mají podobné účinky. To samé platí pro antimalarika včetně chininu. Imidazolová antimykotika (ketokonazol, fluconazol, itrakonazol) prodlužují interval QT, ale největší nebezpečí představují pro lékové interakce.
U antihistaminik se riziko liší podle jejich generace. V 1. generaci prodlužoval difenhydramin interval QT, ale nevedl k torsade de pointes. Tato arytmie byla popsána opakovaně po podávání terfenadinu a astemizolu. Bezpečnost 3. generace antihistaminik je posuzována.
Kombinace léků
Mnohé z výše vedených léků vedou k vzniku torsade de pointes pouze při dosažení vysokých plazmatických koncentrací, a to buď při předávkování, nebo při změněném metabolizmu. Souběžné podávání léků metabolizovaných cytochromem P450 – CYP3A4 v játrech je zřejmě nejčastější příčinou zvýšení koncentrací rizikového léku. Léky, které sdílejí stejný metabolický systém, jsou imidazolová antimykotika, inhibitory reuptake serotoninu, antidepresiva, inhibitory proteáz, dihydropiridinové blokátory kalciových kanálů a makrolidová antibiotika. Typickým příkladem je cisaprid, který se používal jako eumotilans horní části trávicí soustavy, jehož plazmatická koncentrace se zvýšila při souběžném podávání erytromycinu až 10krát [49,50]. Kromě toho oba léky reagují vzájemně i po stránce farmakodynamické – oba blokují stejný draslíkový kanál. Proto byl cisaprid v mnoha zemích stažen z trhu. Ketoconazol vede sám o sobě k vzniku torsade de pointes zřídka, ale je velmi silným inhibitorem cytochromu P450 a zvyšuje hladiny dalších léků, jako jsou antihistaminika terfenadin a astemizol. Podobný účinek lze pozorovat po grapefruitovém džusu, který inhibuje stejný enzymový systém [51]. Proto bychom se měli vždy vyvarovat kombinovaní uvedených léků a dávat pozor i při narušení jejich metabolizmu nebo vylučování jako při onemocnění jater a ledvin.
Další faktory
Riziko vzniku torsade de pointes se zvyšuje při srdečním selhání nebo hypertrofii myokardu. Fibróza myokardu vedoucí k větší heterogenitě repolarizace myokardu zvyšuje riziko ještě více. Dalším faktorem je bradykardie, která sama o sobě prodlužuje repolarizaci. Riziko se zvyšuje v případě náhlého vzniku bradykardie jako u kompletní AV blokády [52]. Prediktorem vzniku torsade de pointes je za těchto okolností prodloužení QT na 0,7 s. V takovém případě by měl být pacient preventivně stimulován bez ohledu na hemodynamickou toleranci bradykardie. Dalším příkladem náhlého zpomalení rytmu je verze FS na sinusový rytmus. Mezi rizikové faktory torsade de pointes se počítá i mentální anorexie nebo speciální bezproteinové diety, které jsou spojeny s prodloužením intervalu QT [53]. Rizikem je i subarachnoidální krvácení nebo intrakraniální krvácení.
Závěr
Rozvoj současné arytmologie vedl k oslabení úlohy antiarytmik. Ta se převážně používají k farmakologické léčbě FS, případně k potlačení komorových arytmií při akutních stavech nebo u pacientů s implantovaným ICD. Vzhledem k možným proarytmickým účinkům a riziku vzniku syndromu získaného prodloužení QT by měli být všichni lékaři seznámeni s mírou rizika jednotlivých léků a lékových interakcí a znát další rizikové faktory. Podobně by měli být o možných interakcích informováni pacienti.
prof. MUDr. Josef Kautzner, CSc.
www.ikem.cz
e-mail: joka@medicon.czDoručeno do redakce: 11. 5. 2011
Zdroje
1. Kautzner J, Čihák R, Bytešník J. Pokroky v elektrofyziologii: katetrizační ablace srdečních arytmií a implantabilní kardiovertery-defibrilátory. Cor Vasa 2001; 43 : 225–231.
2. Kautzner J. Radiofrekvenční katetrizační ablace: převrat v intervenční kardiologii. Prakt lékař 1999; 79 : 274–282.
3. Kautzner J. Srdeční resynchronizační terapie v léčbě chronického srdečního selhání. Kardiofórum 2004; 1 : 23–27.
4. Echt DS, Liebson PR, Mitchell LB et al. Mortality and morbidity in patients receiving encainide, flecainide, or placebo. The Cardiac Arrhythmia Suppression Trial. N Engl J Med 1991; 324 : 781–718.
5. Pratt CM, Camm AJ, Cooper W et al. Mortality in the Survival With ORal D-sotalol (SWORD) trial: why did patients die? Am J Cardiol 1998; 81 : 869–876.
6. Hallstrom A, Friedman L, Denes P et al. AVID Investigators. Do arrhythmia patients improve survival by participating in randomized clinical trials? Observations from the Cardiac Arrhythmia Suppression Trial (CAST) and the Antiarrhythmics Versus Implantable Defibrillators Trial (AVID). Control Clin Trials 2003; 24 : 341–352.
7. Camm AJ, Pratt CM, Schwartz PJ et al. AzimiLide post Infarct surVival Evaluation (ALIVE) Investigators. Mortality in patients after a recent myocardial infarction: a randomized, placebo-controlled trial of azimilide using heart rate variability for risk stratification. Circulation 2004; 109 : 990–996.
8. Julian DG, Camm AJ, Frangin G et al. Randomised trial of effect of amiodarone on mortality in patients with left-ventricular dysfunction after recent myocardial infarction: EMIAT. European Myocardial Infarct Amiodarone Trial Investigators. Lancet 1997; 349 : 667–674.
9. Bardy GH, Lee KL, Mark DB et al. Amiodarone or an implantable cardioverter--defibrillator for congestive heart failure. N Engl J Med 2005; 352 : 225–237.
10. Čihák R, Heinc P. Doporučení pro léčbu pacientů s fibriací síní. Cor Vasa 2004; 46: K 67–K77.
11. Camm AJ, Kirchhof P, Lip GY et al. European Heart Rhythm Association; European Association for Cardio-Thoracic Surgery. Guidelines for the management of atrial fibrillation: the Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC). Europace 2010; 12 : 1360–1420.
12. Priori SG, Aliot E, Blomstrom-Lundqvist C et al. Task Force on Sudden Cardiac Death of the European Society of Cardiology. Eur Heart J 2001; 22 : 1374–1450.
13. Gillis AM, Verma A, Talajic M et al. CCS Atrial Fibrillation Guidelines Committee. Canadian Cardiovascular Society Atrial Fibrillation Guidelines 2010: Rate and Rhythm Management. Can J Cardiol 2011; 27 : 47–59.
14. Alboni P, Botto GL, Baldi N et al. Outpatient treatment of recent-onset atrial fibrillation with the ‘pill-in-the-pocket’ approach. N Engl J Med 2004; 351 : 2384–2391.
15. Hohnloser SH, Kuck KH. Randomized trial of rhythm or rate control in atrial fibrillation: the Pharmacological Intervention in Atrial Fibrillation Trial (PIAF). Eur Heart J 2001; 22 : 801–802.
16. Wyse DG, Waldo AL, DiMarco JP et al. Atrial Fibrillation Follow-up Investigation of Rhythm Management (AFFIRM) Investigators. A Comparison of Rate Control and Rhythm Control in Patients with Atrial Fibrillation. N Engl J Med 2002; 347 : 1825–1833.
17. Roy D, Talajic M, Dorian P et al. Amiodarone to prevent recurrence of atrial fibrillation. Canadian Trial of Atrial Fibrillation Investigators. N Engl J Med 2000; 342 : 913–920.
18. Van Gelder IC, Hagens VE, Bosker HA et al. Rate Control versus Electrical Cardioversion for Persistent Atrial Fibrillation Study Group. A comparison of rate control and rhythm control in patients with recurrent persistent atrial fibrillation. N Engl J Med 2002; 347 : 1834–1840.
19. Hagens VE, Van Veldhuisen DJ, Kamp O et al. RAte Control versus Electrical Cardioversion for Persistent Atrial Fibrillation Study Group. Effect of rate and rhythm control on left ventricular function and cardiac dimensions in patients with persistent atrial fibrillation: results from the RAte Control versus Electrical Cardioversion for Persistent Atrial Fibrillation (RACE) study. Heart Rhythm 2005; 2 : 19–24.
20. Freudenberger RS, Wilson AC, Kostis JB. AFFIRM Investigators and Committees. Comparison of rate versus rhythm control for atrial fibrillation in patients with left ventricular dysfunction (from the AFFIRM Study). Am J Cardiol 2007; 100 : 247–252.
21. Guglin M, Chen R, Curtis AB. Sinus rhythm is associated with fewer heart failure symptoms: insights from the AFFIRM trial. Heart Rhythm 2010; 7 : 596–601.
22. Hohnloser SH, Crijns HJ, van Eickels M et al. ATHENA Investigators. Effect of dronedarone on cardiovascular events in atrial fibrillation. N Engl J Med 2009; 360 : 668–678.
23. Davy JM, Herold M, Hoglund C et al. Dronedarone for the control of ventricular rate in permanent atrial fibrillation: the Efficacy and safety of dRonedArone for the cOntrol of ventricular rate during atrial fibrillation (ERATO) study. Am Heart J 2008; 156 : 527.e1–527.e9.
24. Van Gelder IC, Groenveld HF, Crijns HJ et al. RACE II Investigators. Lenient vs strict rate control in patients with atrial fibrillation. N Engl J Med 2010; 362 : 1363–1373.
25. Lafuente-Lafuente C, Mouly S, Longas--Tejero MA et al. Antiarrhythmics for maintaining sinus rhythm after cardioversion of atrial fibrillation. Cochrane Database Syst Rev 2007; 4: CD005–CD049.
26. McNamara RL, Bass EB, Miller MR et al. Management of new onset atrial fibrillation. Rockville (MD): Agency for Heathcare Research and Quality 2001.
27. Testa L, Biondi-Zoccai GG, Dello Russo A et al. Rate-control vs rhythm-control in patients with atrial fibrillation: a meta-analysis. Eur Heart J 2005; 26 : 2000–2006.
28. Fux R, Greiner D, Geldmacher M et al. Multiple drug prescribing by general practitioners in a German region: Implications for drug interactions and patient safety. Int J Clin Pharmacol Ther 2006; 44 : 539–547.
29. Humphries KH, Kerr CR, Steinbuch M et al. Canadian Registry of Atrial Fibrillation investigators. Limitations to antiarrhythmic drug use in patients with atrial fibrillation. CMAJ 2004; 171 : 741–745.
30. Schutte D, Obel IWP. Dangerous and life-threatening drugs – practical lessons from the long QT syndrome. Cardiovasc J S Afr 2002; 13 : 54–61.
31. Roden D. Taking the ‘idio’ out of ‘idiosyncratic’: Predicting torsade de pointes. Pacing Clin Electrophysiol 1998; 21 : 1029–1034.
32. Jackman WM, Friday KJ, Anderson JL et al. The long QT syndromes: A critical review, new clinical observations and a unifying hypothesis. Prog Cardiovasc Dis 1988; 31 : 115–172.
33. Vincent GM, Timothy KW, Leppert M et al. The spectrum of symptoms and QT intervals in carriers of the gene for the long QT syndrome. N Engl J Med 1992; 327 : 846–852.
34. Priori SG, Napolitano C, Schwartz PJ et al. Low penetrance in the long-QT syndrome: clinical impact. Circulation 1999; 99 : 529–533.
35. Roden DM, Anderson ME. The pause that refreshes, or does it? Mechanism of torsade de pointes. Heart 2000; 84 : 235–237.
36. Antzelevitch C, Sicouri S. Clinical relevance of cardiac arrhythmias generated by after depolarizations: Role of M cells in the generation of U waves, triggered activity and torsade de pointes. J Am Coll Cardiol 1994; 23 : 259–277.
37. Haverkamp W, Breithardt G, Camm AJ et al. The potential for QT prolongation and proarrhythmia by non-antiarrhythmic drugs: Clinical and regulatory implications. Report on a policy conference of the European Society of Cardiology. Eur Heart J 2000; 21 : 1216–1231.
38. Canadian Adverse Drug Reaction Newsletter. Drugs causing prolongation of QT interval and torsade de pointes. Can Med Assoc J 1998; 158 : 103–104.
39. Reilly JG, Ayis SA, Ferrier IN et al. QT--c-interval abnormalities and psychotropic drug therapy in psychiatric patients. Lancet 2000; 355 : 1048–1052.
40. Rampe D, Murawsky MK, Grau J et al. The antipsychotic agent sertindole is a high affinity antagonist of human cardiac potassium channel HERG. J Pharmacol Exp Ther 1998; 286 : 788–793.
41. Lherm T, Lottin F, Larbi D et al. Torsade de pointes after poisoning with fluoxetine alone. Presse Med 2000; 29 : 306–307.
42. Liljeqvist JA, Edvardsson N. Torsade de pointes tachycardias induced by overdosage of zimeldine. J Cardiovasc Pharmacol 1989; 14 : 666–670.
43. Mitchell JE, Mackenzie TB. Cardiac effects of lithium therapy in man. A review. J Clin Psychiatry 1982; 43 : 47–51.
44. Antzelevitch C, Sun ZQ, Zhang ZQ et al. Cellular and ionic mechanisms underlying erythromycin-induced long QT intervals and torsade de pointes. J Am Coll Cardiol 1996; 28 : 1836–1848.
45. Samaha FF. QTc interval prolongation and polymorphic ventricular tachycardia in association with levofloxacin. Am J Med 1999; 107 : 528–529.
46. Zareba W, Moss AJ, Roscro S et al. Electrocardiographic findings in patients with diphenhydramine overdose. Am J Cardiol 1997; 80 : 1168–1173.
47. Woosley RL, Chen Y, Freiman JP et al. Mechanism of the cardiotoxic actions of terfenadine. JAMA 1993; 269 : 1532–1536.
48. Vorperian VR, Zhou Z, Mohammad S et al. Torsade de pointes with an antihistamine metabolite: potassium channel blockade with desmethylastemizole. J Am Coll Cardiol 1996; 28 : 1556–1561.
49. Wysowski D, Bakanyi J. Cisapride and fatal arrhythmias. N Engl J Med 1996; 59 : 383–388.
50. Hill SL, Evangelista JK, Pizzi AM et al. Proarrhythmia associated with cisapride in children. Pediatrics 1998; 101 : 1053–1056.
51. Benton RE, Honig PK, Zamani K et al. Grapefruit juice alters terfenadine pharmacokinetics resulting in prolongation of repolarization on the electrocardiogram. Clin Pharmacol Ther 1996; 59 : 383–388.
52. Michaëlsson M, Jonzon A, Riesenfeld T. Isolated congenital complete atrioventricular block in adult life: a prospective study. Circulation 1995; 92 : 442–449.
53. Cooke RA, Chambers JB, Singh R et al. QT interval in anorexia nervosa. Br Heart J 1994; 72 : 69–73.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek MUDr. Jana Lacinová – 65 letČlánek Dráždivý tračník
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2011 Číslo 9- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- MUDr. Jana Lacinová – 65 let
- Prim. MUDr. Milanu Tržilovi k 60. narozeninám
- Česká angiologie a její proměny
- Dráždivý tračník
- Biologická léčba v dermatologii – psoriáza
- Prokinetika – jejich přínos v klinické praxi gastroenterologické
- Nemoci jater v interní ambulanci
- Arytmologie dnes: rizika antiarytmické terapie v interní ambulanci
- Terapie stabilní chronické obstrukční plicní nemoci (CHOPN) a její případná kardiovaskulární rizika (základní přehled)
- Předoperační vyšetření u nemocných před nekardiálním chirurgickým výkonem
- Současný pohled na léčbu hypertenze v těhotenství
- Nová antitrombotika v prevenci žilní tromboembolie a nové protidestičkové léky
- Cílená biologická léčba solidních nádorů
- Proteinurie v ambulantní praxi
- Význam antihypertenzní léčby u subklinického poškození mozku
- Polypragmazie a lékové interakce
- Existuje vztah mezi léčbou diabetu a vznikem nádorů?
- Kombinovaný trénink u mužů s metabolickým syndromem po akutní koronární příhodě
- Diagnostika sekundární hypertenze v ambulantní praxi
- FARIM – FARmakoterapie po Infarktu Myokardu
- Tyreopatie v ambulantní praxi
- Zemřel prof. MUDr. Vladimír Pacovský, DrSc., emeritní předseda Československé internistické společnosti
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Proteinurie v ambulantní praxi
- Prokinetika – jejich přínos v klinické praxi gastroenterologické
- Polypragmazie a lékové interakce
- Tyreopatie v ambulantní praxi
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



