-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Je protidoštičková liečba vždy účinná?
Is antiplatelet therapy always effective?
Objective:
Acetylsalicylic acid (ASA) and clopidogrel (KLP) therapy is associated with the high degree of variability in response to the drug and some patients are drug-resistant. The aim of our study was to evaluate the individual response to antiplatelet therapy in patients at high risk of cardiovascular events treated with ASA (n = 131), KLP (n = 51) or ASA + KLP (n = 34).Subjects and methods:
Investigations were performed in them by light transmission aggregometry and in selected patients by VASP fosforylation.Results:
Good response to ASA treatment with arachidonic acid-induced platelet aggregation inhibition < 20% reached 75.0% of patients, partial response with 20–40% inhibition 12.9% of patients and poor response with > 40 % inhibition 12.1 % of patients. Good response to KLP treatment with 20 µmol/l ADP-induced platelet aggregation inhibition < 60% reached 66.1% of patients, partial response with 60–70% inhibition 13.9% of patients and poor response > 70% in 20% of patients. In patients treated by KLP + ADP induced platelet aggregation correlated with VASP fosforylation. We found, that 50% of KLP-treated and 44.4% of ASA-treated patients obtained the adequate response to therapy by compliance improvement. In 80% of patients, which did not respond to KLP therapy in daily dose of 75 mg, the adequate response after the increase to daily dose of 150 mg was observed. The increase of ASA daily dose above 100 mg did not improve in our patients their response to therapy. However, in those patients without a good response to low-dose ASA (< 100 mg daily) the increase to daily dose of 100 mg effectively influenced the aggregatory response.Conclusion:
Laboratory monitoring of individual response allows the optimalization of the antiplatelet therapy. The patients who could profit from other type of antiplatelet therapy, such as prasugrel and ticagrelor, can be selected by this method.Key words:
acetylsalicylic acid – clopidogrel – antiplatelet therapy – light transmission aggregometry (LTA)
Autori: A. Remková 1; A. Janušicová 1; M. Remko 1,2
Pôsobisko autorov: Centrum hemostázy a trombózy, HemoMedika Bratislava, Slovenská republika, vedúca centra prof. MUDr. Anna Remková, DrSc. 1; Farmaceutická fakulta Univerzity Komenského, Bratislava, Slovenská republika, dekan prof. PharmDr. Ján Kyselovič, CSc. 2
Vyšlo v časopise: Vnitř Lék 2012; 58(12): 904-914
Kategória: Původní práce
Súhrn
Cieľ práce:
Liečba kyselinou acetylsalicylovou (ASA) a klopidogrelom (KLP) je spojená s vysokým stupňom variability v liečebnej odpovedi a niektorí pacienti sú na liečbu rezistentní. Cieľom našej štúdie bolo posúdenie individuálnej odpovede na protidoštičkovú liečbu u pacientov s vysokým rizikom kardiovaskulárnych príhod liečených ASA (n = 131), KLP (n = 51) alebo ASA + KLP (n = 34).Materiál a metódy:
Vyšetrenia sa u nich uskutočnili svetelnou transmisnou agregometriou a u vybraných pacientov pri liečbe KLP aj VASP fosforyláciou.Výsledky:
Dobrú odpoveď na liečbu ASA s inhibíciou agregácie krvných doštičiek po indukcii kyselinou arachidonovou < 20 % dosiahlo 75 % pacientov, parciálnu odpoveď s 20–40% inhibíciou 12,9 % pacientov a nedostatočnú odpoveď s > 40% inhibíciou 12,1 % pacientov. Dobrú odpoveď na liečbu KLP s inhibíciou agregácie krvných doštičiek po indukcii 20 μmol/l ADP < 60 % dosiahlo 66,1 % pacientov, parciálnu odpoveď s 60–70% inhibíciou 13,9 % pacientov a nedostatočnú odpoveď > 70 % malo 20 % pacientov. U pacientov liečených KLP + ADP indukovaná agregácia krvných doštičiek korelovala s VASP fosforyláciou. Zistilo sa, že 50 % pacientov pri liečbe KLP a 44,4 % pri liečbe ASA dosiahlo primeranú odpoveď na liečbu až zlepšením kompliancie. U 80 % pacientov, ktorí opakovane neodpovedali na liečbu KLP v dávke 75 mg denne, došlo po zvýšení dávky na 150 mg denne k dosiahnutiu požadovanej odpovede na liečbu. Zvýšenie dávky ASA nad 100 mg denne neviedlo u našich pacientov k zlepšeniu odpovede na liečbu. U tých pacientov, ktorí nevykazovali dostatočnú odpoveď na liečbu nízkou dávkou ASA (< 100 mg denne), však zvýšenie dávky na 100 mg denne viedlo k efektívnemu ovplyvneniu agregačnej odpovede.Záver:
Laboratórne monitorovanie individuálnej odpovede umožňuje optimalizovať protidoštičkovú liečbu. Možno pritom selektovať pacientov, ktorí by mohli profitovať z iného typu protidoštičkovej liečby, akými sú napr. prasugrel a tikagrelor.Kľúčové slová:
kyselina acetylsalicylová – klopidogrel – protidoštičková liečba – svetelná transmisná agregometria (LTA)Úvod
Protidoštičková liečba patrí k osvedčeným postupom v sekundárnej prevencii aterotrombotických ochorení, najmä pri koronárnej chorobe srdca, na prevenciu recidív ischemických mozgových príhod artériového pôvodu, ako aj pri ochoreniach periférnych artérií. Hoci sa v tejto oblasti zaznamenali významné pokroky, kyselina acetylsalicylová (ASA) zostáva dodnes liečbou „zlatého štandardu“ [1]. Riziko zvýšeného krvácania a recidív artériovej/koronárnej trombózy viedol k vývoju novšej generácie inhibítorov krvných doštičiek, ktorých cieľom sú enzýmy (fosfodiesteráza, cyklooxygenáza), receptory (purinergické, prostaglandínové, pre tromboxan) a glykoproteíny (integrín αIIbβ3 čiže GPIIbIIIa, GPVI, vWF, GPIb) [1–3]. Patria k nim predovšetkým tienopyridíny (starší tiklopidín, novší klopidogrel), ktoré inhibujú agregáciu krvných doštičiek indukovanú adenozín-difosfátom (ADP). Inou možnosťou je duálna protidoštičková liečba, napr. kombinácia ASA + klopidogrel, ktorá je v súčasnosti základom liečby a sekundárnej prevencie pri akútnych koronárnych syndrómoch a/alebo perkutánnej koronárnej intervencii (PKI) a následnej implantácii stentu. Nevýhodou doteraz dostupných inhibítorov agregácie krvných doštičiek je ich variabilnosť v odpovedi na liečbu [1,4]. Nedostatočná odpoveď na protidoštičkovú liečbu je významným kardiovaskulárnym (KV) rizikovým faktorom recidív ischemických príhod [4,5].
Individuálnu odpoveď na liečbu ASA pravdepodobne podmieňujú > 3 gény, ktoré zatiaľ nie sú úplne prebádané. Prevalencia rezistencie sa udáva pri liečbe ASA (na základe stanovenia hladiny tromboxanu TXB2 v sére) asi 1–5 %. Vysoká reaktivita krvných doštičiek pri protidoštičkovej liečbe (HPR) sa pri použití ASA vyskytla v jednej zo štúdií po PKI až v 19,2 % [6]. Doteraz nie sú k dispozícii údaje o klinickej účinnosti liečby ASA „šitej na mieru“ podľa výsledkov funkčných testov krvných doštičiek. Výskyt HPR alebo rezistencie na liečbu klopidogrelom je asi u 20–30 % pacientov. Jedinci, ktorí sú nositeľmi variantu alely génu CYP2C19 (približne 26 % belochov) tvoria len málo aktívneho metabolitu, ktorý je zodpovedný za inhibičný účinok klopidogrelu na agregáciu krvných doštičiek [7–9].
Zatiaľ neexistuje konsenzus o optimálnej metóde stanovujúcej reaktivitu krvných doštičiek pri protidoštičkovej liečbe. Za referenčnú metódu sa považuje stále svetelná transmisná agregometria (LTA). Pri liečbe ASA sa používa ako induktor agregácie kyselina arachidonová (ale je citlivosť aj na ADP), pri liečbe tienopyridínmi je induktorom ADP. Pri porovnávaní 4 metód pri liečbe ASA, t.j. LTA s použitím kyseliny arachidonovej ako induktora, VerifyNow® Aspirin Assay, IMPACT-R po stimulácii kyselinou arachidonovou a PFA-100 v plnej krvi pri vysokom šmykovom napätí viedli k najlepšej diskriminácii rizikových pacientov prvé 2 metódy [4]. Žiaľ, chýbajú údaje o TXB2 v sére, považovanom za najšpecifickejšie stanovenie aktivity COX-1 v krvných doštičkách ako odpoveď na ASA. Pri liečbe tienopyridínmi (tiklopidín, klopidogrel, prasugrel) alebo tikagrelorom možno okrem LTA posudzovať HPR aj pomocou tzv. „vasodilator stimulated phosphoprotein“ (VASP) fosforylácie [4]. Ide o metódu prietokovej cytometrie z plnej krvi, ktorá špecificky hodnotí funkciu, resp. stupeň blokády receptora P2Y12 pre ADP. Meria účinok ADP na adenylcyklázu podľa stupňa fosforylácie intracelulárneho proteínu VASP. V závislosti od pomeru fosforylovaný/defosforylovaný VASP sa pacienti klasifikujú ako „dobrí respondenti“ s nízkym rizikom a ako HPR s vysokým rizikom post-PKI recidívy KV trombotických príhod. Ďalšou metódou je analýza v systéme VerifyNow® P2Y12 (Accumetrics Inc., San Diego, CA), trombelastografia, použitie IMPACT analyzátora, stanovenie expresie P-selektínu na povrchu krvných doštičiek pomocou prietokovej cytometrie a iné [4].
Cieľom našej prospektívnej, observačnej štúdie bolo porovnanie agregability krvných doštičiek vyšetrenej pomocou LTA (s použitím 5 induktorov) u pacientov s vysokým rizikom KV príhod liečených ASA, klopidogrelom alebo ASA + klopidogrelom v rámci primárnej alebo sekundárnej prevencie s pacientmi bez protidoštičkovej liečby. Na základe týchto laboratórnych vyšetrení sa posudzovala individuálna odpoveď na protidoštičkovú liečbu. U pacientov liečených klopidogrelom, ktorí nevykázali primeranú inhibíciu agregácie krvných doštičiek, sa HPR stanovovala aj pomocou VASP fosforylácie, s posúdením vzájomnej korelácie oboch vyšetrení. Hlavným cieľom bola optimalizácia protidoštičkovej liečby podľa individuálnej odpovede pacientov vykazovanej v laboratórnych testoch.
Materiál a metódy
Agregáciu krvných doštičiek sme vyšetrili v kontrolnej skupine u 225 jedincov bez symptomatického KV ochorenia a bez protidoštičkovej liečby: 94 jedincov s nižším KV rizikom (< 5 % podľa SCORE, priemer 3 %) vo veku 34 (28–48,5) rokov a 131 jedincov s vyšším KV rizikom (≥ 5 % podľa SCORE, priemer 8 %) vo veku 56,1 ± 14,6 rokov. Ich body mass index (BMI) bol 23 (20,5–25,1) a 28 (25–30) kg/m2, s výskytom fajčenia 0 (0–0), hladina cholesterolu 4,5 ± 0,5 a 4,7 ± 0,5 mmol/l, LDL-cholesterolu 3,4 ± 0,5 a 3,5 ± 0,6 mmol/l, HDL-cholesterolu 1,8 ± 0,3 a 1,7 ± 0,4 mmol/l a hladina triacylglycerolov 1,4 ± 0,4 a 1,6 ± 0,4 mmol/l. Ich ďalšie charakteristiky a liečbu uvádza tab. 1.
Tab. 1. Charakteristika súborov a použitá liečba. 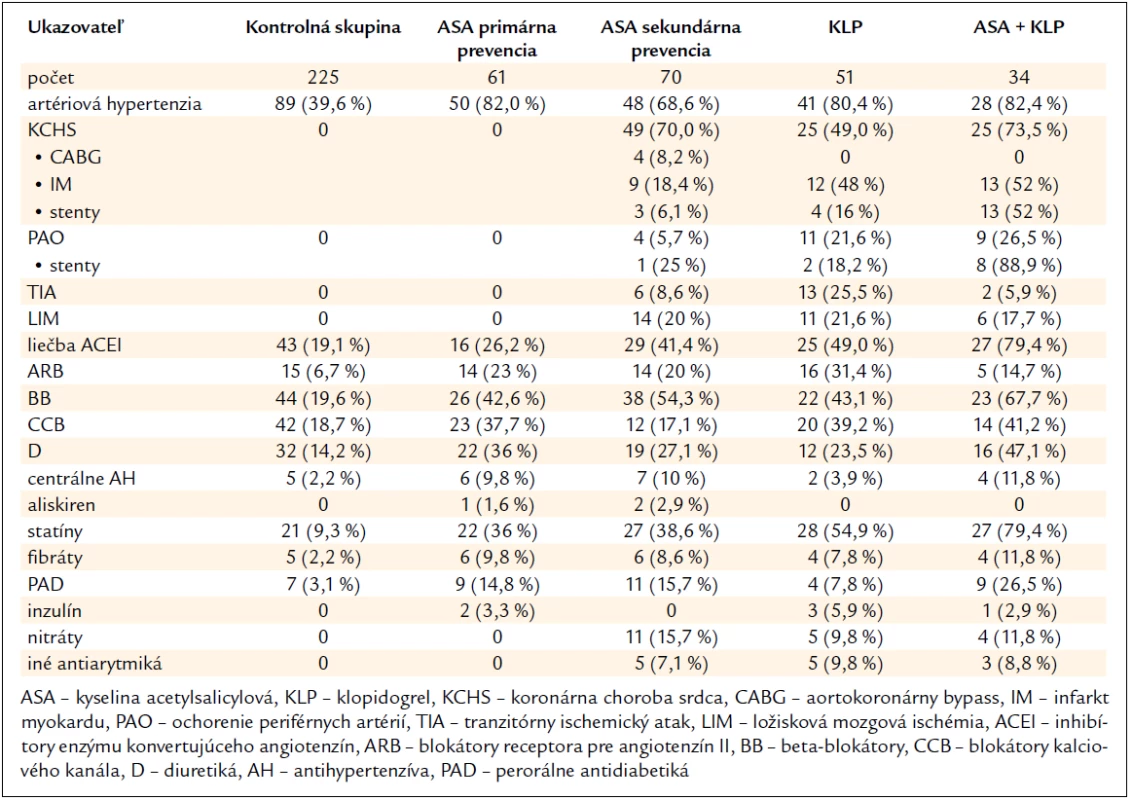
Odpoveď na protidoštičkovú liečbu sme vyšetrili u 216 pacientov s ≥ 10% 10-ročným rizikom fatálnej KV príhody alebo so známym KV ochorením. Odhad rizika sme uskutočnili podľa SCORE [10], t.j. podľa regiónu Európy s vysokým rizikom (Slovensko), pohlavia, veku, systolického tlaku krvi, hladiny cholesterolu a fajčenia. Išlo teda o pacientov s vysokým KV rizikom liečených ASA v rámci primárnej prevencie (61 pacientov) alebo so známym KV ochorením (celkovo 155 pacientov) liečených ASA (70 pacientov), klopidogrelom (51 pacientov) alebo ASA + klopidogrel (34 pa-cientov) v rámci sekundárnej prevencie. Títo pacienti mali hladinu cholesterolu 5,8 ± 1,3 mmol/l, LDL-cholesterolu 4,3 ± 0,6 mmol/l, HDL-cholesterolu 1,6 ± 0,2 mmol/l a triacylglycerolov 1,5 ± 0,4 mmol/l. Pacienti liečení ASA boli vo veku 61,9 ± 12,1 rokov, ich BMI bol 28 (24,5–31,1) kg/m2, s výskytom fajčenia 0 (0–0), liečení klopidogrelom vo veku 65,8 ± 11 rokov, s BMI 26 (24–31) kg/m2 a s výskytom fajčenia 0 (0–0), liečení ASA + klopidogrelom vo veku 61,5 (53–75,5) rokov, s BMI 28,5 ± 4,3 kg/m2, s výskytom fajčenia 0 (0–10). Liečbu ASA (v dávke 30–300 mg denne) malo celkovo 165 pacientov, a to v dennej dávke 100 mg 89,9 %, 150–300 mg 5,9 % a 30–50 mg 4,2 % pacientov. Liečbu klopidogrelom v denne dávke 75 mg užívalo celkove 85 pacientov. Ďalšie charakteristiky pacientov a ich liečbu uvádza tab. 1. Na sledovanie odpovede na protidoštičkovú liečbu sme použili metódu klasickej LTA a vo vybraných prípadoch VASP fosforyláciu. Odbery krvi sa uskutočnili ráno nalačno (8 : 00–9 : 30 hod), po poslednom užití lieku 12–24 hod pred odberom krvi. Krv na vyšetrenie agregácie krvných doštičiek a VASP fosforylácie sme odoberali hladkým vpichom do skúmaviek systému Vacuette® 5 ml 9NC Coagulation sodium citrate 3,2 % a na vyšetrenie počtu krvných doštičiek do skúmaviek Vacuette® 3 ml K3E K3EDTA (Greiner Bio-One, Kremsmünster, Rakúsko) s použitím ihly Vacuette® 21Gx1 1/2“ (Greiner Bio-One, Kremsmünster, Rakúsko). Vzorky boli vyšetrené bezprostredne, t.j. najneskôr do 2 hod po odbere krvi. Skúmavky sa centrifugovali 10 min pri 100 g a vo forme supernatantu sa odpipetovala plazma bohatá na krvné doštičky (PRP). Ďalšou centrifugáciou sedimentu pri 2 500 g počas 10 min sa získala plazma chudobná na doštičky (PPP). Vyšetrenia sa uskutočnili turbidimetrickou metódou na koagulometri BCT (Dade Behring, Nemecko) s kanálom pre agregometriu. PRP sa upravovala pomocou PPP s cieľom dosiahnuť počet krvných doštičiek 200–250 × 109/l. V tejto vzorke sme potom merali maximálnu agregáciu krvných doštičiek (%) oproti plazme chudobnej na doštičky, ktorá slúžila ako „pozadie“. Na stimuláciu agregácie krvných doštičiek sme použili 5 induktorov v týchto koncentráciách: kyselina arachidonová 0,5 mg/ml, adenozín-difosfát (ADP) 20 µmol/l, kolagén 10 μmol/l, adrenalín 300 μmol/l, ristocetín 1,0 μmol/l. Na kontrolu induktorov sme použili zmes plazmy získanej od 6 darcov krvi, spracovanej rovnako ako pri príprave vyšetrovanej vzorky. Za rozlišovacie „cut-off“ hodnoty pre HPR sme považovali pri liečbe ASA > 20% agregáciu krvných doštičiek po indukcii kyselinou arachidonovou 0,5 mg/l [11] a pri liečbe klopidogrelom > 59% agregáciu krvných doštičiek po indukcii 20 μmol/l ADP [12]. Komplianciu k liečbe sme posudzovali cielenou anamnézou pri kontrolnom vyšetrení. U pacientov, ktorí pri liečbe klopidogrelom vykazovali hodnoty poukazujúce na HPR, sme po dôraznom poučení o potrebe pravidelnosti liečby (v snahe minimalizovať non-komplianciu) vyšetrenie reaktivity krvných doštičiek opakovali a popri LTA sme ju posudzovali aj pomocou VASP fosforylácie (16 pacientov). Výsledky sa hodnotili ako index reaktivity krvných doštičiek (PRI) podľa návodu výrobcu: > 50 % svedčí pre HPR, < 50 % pre pozitívnu účinnosť tienopyridínov typu klopidogrelu. U 45 pacientov liečených ASA, klopidogrelom alebo ASA + klopidogrel, ktorí pri 1. vyšetrení nedostatočne odpovedali na liečbu, sme vyšetrenia agregácie krvných doštičiek opakovali (celkove 102 vyšetrení) a analyzovali sme dosiahnuté výsledky.
Štatistické hodnotenie
Výsledky sú udávané väčšinou ako medián a 25–75% percentily, v prípade súborov s normálnym rozdelením ako priemer ± štandardná odchýlka (SD). Testovanie normality sa uskutočnilo pomocou D’Agostinovho a Pearsonovho testu. Na porovnanie rozdielov hodnôt v jednotlivých súboroch sa použil neparametrický Mann-Whitney U test. Posúdenie korelácie medzi 2 laboratórnymi metódami sa uskutočnilo pomocou lineárnej regresie. Za štatisticky významné sa považovali hodnoty P < 0,05. Všetky analýzy sa uskutočnili pomocou počítačového programu GraphPad Prism 5.04 (San Diego, USA).
Výsledky
V kontrolnej skupine bez protidoštičkovej liečby sa u jedincov s nižším KV rizikom (SCORE < 5 %) v porovnaní s jedincami s vyšším rizikom (SCORE ≥ 5 %) zistil štatisticky významne nižší vek (P < 0,001), nižší BMI (P < 0,001), ale bez významných rozdielov v hladine lipidov, vo výskyte fajčenia, v počte krvných doštičiek a v ich agregácii po použití 5 induktorov.
Oproti kontrolnej skupine sa všetky skupiny pacientov liečených protidoštičkovou liečbou vyznačovali vyšším vekom (P < 0,001), vyššou hladinou cholesterolu (P < 0,05) a LDL-cholesterolu (P < 0,05), pričom so stúpajúcim KV rizikom stúpal aj počet pacientov liečených statínom (tab. 1), a skupina liečených ASA a ASA + klopidogrel aj vyšším BMI (P < 0,001). Nezistili sa rozdiely vo výskyte fajčenia. Ani v jednej zo skupín sa nezistili štatisticky významné rozdiely v počte krvných doštičiek.
Výsledky agregácie krvných doštičiek v kontrolnej skupine (podskupina s nižším a vyšším KV rizikom) sú uvedené v tab. 2. Nezistili sa pritom štatisticky významné rozdiely v agregácii krvných doštičiek po jednotlivých induktoroch medzi oboma podskupinami.
Tab. 2. Výsledky vyšetrení u jedincov bez protidoštičkovej liečby (s 2 stupňami odhadovaného 10-ročného rizika fatálnych kardiovaskulárnych príhod – podľa SCORE [8]). ![Výsledky vyšetrení u jedincov bez protidoštičkovej liečby (s 2 stupňami odhadovaného 10-ročného rizika fatálnych kardiovaskulárnych príhod – podľa SCORE [8]).](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/9ccb720b842ba6e978f27cfe0423f1e1.png)
Výsledky agregácie krvných doštičiek po jednotlivých induktoroch u pacientov s jednotlivými druhmi protidoštičkovej liečby a ich porovnanie s kontrolnou skupinou jedincov bez protidoštičkovej liečby uvádza tab. 3. Oproti kontrolnej skupine (graf 1) viedli všetky druhy protidoštičkovej liečby (ASA – graf 2, klopidogrel – graf 3, ASA + klopidogrel – graf 4) k štatisticky významnému poklesu agregácie krvných doštičiek po všetkých 5 induktoroch (P < 0,001). Porovnanie výsledkov agregácie krvných doštičiek po jednotlivých induktoroch medzi kontrolnou skupinou bez protidoštičkovej liečby a skupinami s protidoštičkovou liečbou ASA, klopidogrelom a ASA + klopidogrel možno vidieť na graf 5–9.
Tab. 3. Výsledky v kontrolnej skupine jedincov bez protidoštičkovej liečby a v súbore pacientov s protidoštičkovou liečbou – kyselinou acetylsalicylovou (ASA), klopidogrelom (KLP) a s kombinovanou liečbou (ASA + KLP). 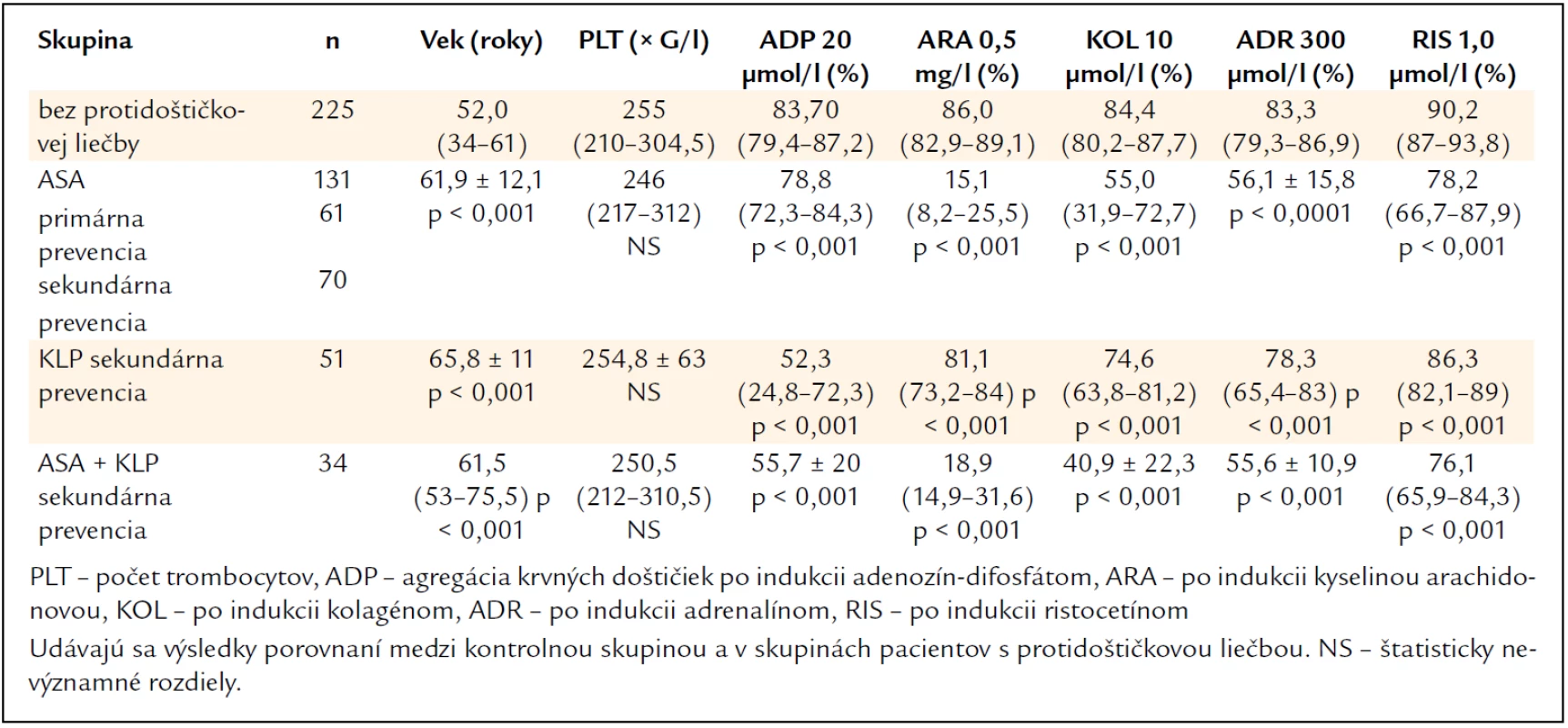
Graf 1. Agregácia krvných doštičiek po rôznych induktoroch v kontrolnej skupine bez protidoštičkovej liečby. 
ADP – adenozín-difosfát, ARA – kyselina arachidonová, COL – kolagén, EPI – adrenalín, RIPA – ristocetín. Uvedené sú mediány, minimálne a maximálne hodnoty. Graf 2. Agregácia krvných doštičiek po rôznych induktoroch u pacientov liečených kyselinou acetylsalicylovou. 
AA – kyselina acetylsalicylová, ADP – adenozín-difosfát, ARA – kyselina arachidonová, COL – kolagén, EPI – adrenalín, RIPA – ristocetín. Uvedené sú mediány, minimálne a maximálne hodnoty. Graf 3. Agregácia krvných doštičiek po rôznych induktoroch u pacientov liečených klopidogrelom. 
KLP – klopidogrel, ADP – adenozín-difosfát, ARA – kyselina arachidonová, COL – kolagén, EPI – adrenalín, RIPA – ristocetín. Uvedené sú mediány, minimálne a maximálne hodnoty. Graf 4. Agregácia krvných doštičiek po rôznych induktoroch u pacientov liečených kyselinou acetylsalicylovou a klopidogrelom. 
AA – kyselina acetylsalicylová, KLP – klopidogrel, ADP – adenozín-difosfát, ARA – kyselina arachidonová, COL – kolagén, EPI – adrenalín, RIPA – ristocetín. Uvedené sú mediány, minimálne a maximálne hodnoty. Graf 5. Vplyv protidoštičkovej liečby na agregáciu krvných doštičiek po indukcii kyselinou arachidonovou. 
K – kontrolná skupina bez liečby, ASA – liečba kyselinou acetylsalicylovou, KLP – liečba klopidogrelom, ASA + KLP – duálna protidoštičková liečba. Graf 6. Vplyv protidoštičkovej liečby na agregáciu krvných doštičiek po indukcii adenozín-difosfátom. 
K – kontrolná skupina bez liečby, ASA – liečba kyselinou acetylsalicylovou, KLP – liečba klopidogrelom, ASA + KLP – duálna protidoštičková liečba. Graf 7. Vplyv protidoštičkovej liečby na agregáciu krvných doštičiek po indukcii kolagénom. 
K – kontrolná skupina bez liečby, ASA – liečba kyselinou acetylsalicylovou, KLP – liečba klopidogrelom, ASA + KLP – duálna protidoštičková liečba. Graf 8. Vplyv protidoštičkovej liečby na agregáciu krvných doštičiek po indukcii adrenalínom. 
K – kontrolná skupina bez liečby, ASA – liečba kyselinou acetylsalicylovou, KLP – liečba klopidogrelom, ASA + KLP – duálna protidoštičková liečba. Graf 9. Vplyv protidoštičkovej liečby na agregáciu krvných doštičiek po indukcii ristocetínom. 
K – kontrolná skupina bez liečby, ASA – liečba kyselinou acetylsalicylovou, KLP – liečba klopidogrelom, ASA + KLP – duálna protidoštičková liečba. Dobrú odpoveď na liečbu ASA s inhibíciou agregácie krvných doštičiek po indukcii kyselinou arachidonovou < 20 % dosiahlo 75,0 % pacientov, parciálnu odpoveď s 20–40% inhibíciou 12,9 % pacientov a nedostatočnú odpoveď s > 40% inhibíciou 12,1 % pacientov (graf 10). Dobrú odpoveď na liečbu klopidogrelom s inhibíciou agregácie krvných doštičiek po indukcii 20 µmol/l ADP < 60 % dosiahlo 66,1 % pacientov, parciálnu odpoveď s 60–70% inhibíciou 13,9 % pacientov a nedostatočnú odpoveď > 70 % malo 20 % pacientov (graf 11). U pacientov liečených klopidogrelom sme zistili štatisticky významnú pozitívnu koreláciu medzi ADP-indukovanou agregáciou krvných doštičiek a VASP fosforyláciou (P < 0,05, graf 12). Analýzou opakovaných vyšetrení u 24 pacientov, ktorí pri 1. vyšetrení nevykazovali pri liečbe klopidogrelom primeranú inhibíciu ADP-indukovanej agregácie krvných doštičiek, sa zistilo, že u 12 z nich (50 %) došlo po zlepšení kompliancie k dosiahnutiu primeranej odpovede na protidoštičkovú liečbu. U 4 z 5 pacientov, ktorí opakovane neodpovedali na liečbu klopidogrelom v dávke 75 mg denne (posudzované vyšetrením ADP-indukovanej agregácie krvných doštičiek aj VASP fosforyláciou), došlo po zvýšení dávky klopidogrelu na 150 mg denne k dosiahnutiu požadovanej odpovede na liečbu. Pri opakovanom vyšetrení agregácie krvných doštičiek po indukcii kyselinou arachidonovou u 18 pacientov, ktorí pri liečbe ASA v dávke 100 mg denne nedosiahli primeranú odpoveď, sa zistilo, že po zlepšení kompliancie sa u 8 z nich (44,4 %) dosiahla primeraná inhibícia agregácie krvných doštičiek. Ďalších 10 z týchto pacientov (55,6 %) nedosiahlo účinnú inhibíciu agregácie krvných doštičiek ani po zvýšení dávky ASA nad 100 mg denne. Naopak, u ďalších 3 pacientov, ktorí pri nízkej dávke ASA (< 100 mg denne) nevykazovali primeranú agregačnú odpoveď, viedlo zvýšenie jej dávky na 100 mg denne k primeranej agregačnej odpovedi na liečbu. Nedostatočnú odpoveď na duálnu protidoštičkovú liečbu (ASA + klopidogrel) mali z celého nášho súboru 2 pacienti.
Graf 10. Odpoveď na protidoštičkovú liečbu kyselinou acetylsalicylovou. 
Graf 11. Odpoveď na protidoštičkovú liečbu klopidogrelom. 
Graf 12. Korelácia medzi agregáciou krvných doštičiek po adenozín-difosfáte a VASP fosforyláciou pri liečbe klopidogrelom. 
VASP – vasodilator-stimulated phosphoprotein. Diskusia
Protidoštičková liečba ASA, ale najmä klopidogrelom môže byť spojená s vysokou interindividuálnou variabilitou v odpovedi na liečbu. V niekoľkých štúdiách sa u pacientov liečených klopidogrelom zistilo, že významná časť (asi 1/3) vykazuje suboptimálnu inhibíciu funkcie krvných doštičiek [4,13]. Na tejto variabilite sa podieľajú genetické a environmentálne faktory, ktoré ovplyvňujú absorpciu a/alebo rozsah metabolizmu klopidogrelu na jeho aktívny metabolit. Hlavné faktory ovplyvňujúce farmakodynamickú odpoveď na klopidogrel sú uvedené v tab. 4 [13]. Protidoštičková liečba preto nemusí byť vždy účinná. Na vyriešenie tohto problému sa navrhla liečba „šitá na mieru“ – podľa výsledkov laboratórnych testov funkcie krvných doštičiek, používaných na monitorovanie individuálnej farmakodynamickej odpovede na liek, čo môže mať významný klinický dopad [13]. Súčasný trend uniformnej protidoštičkovej liečby, ktorá „sedí každému“, vedie čoraz viac k individualizácii liečby, aby sa optimalizoval jej účinok.
Tab. 4. Hlavné faktory ovplyvňujúce farmakodynamickú odpoveď na klopidogrel [11]. ![Hlavné faktory ovplyvňujúce farmakodynamickú odpoveď na klopidogrel [11].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/af5d98a65fd4e4ed1ff51d4d8fe59224.png)
V našej práci v porovnaní s kontrolnou skupinou viedli všetky druhy protidoštičkovej liečby (ASA , klopidogrel, ASA + klopidogrel) k významnému poklesu agregácie krvných doštičiek po všetkých 5 induktoroch. Dobrú odpoveď na liečbu ASA s inhibíciou agregácie krvných doštičiek po indukcii kyselinou arachidonovou < 20 % dosiahlo 75,0 % pacientov a na liečbu klopidogrelom s inhibíciou agregácie krvných doštičiek po indukcii 20 µmol/l ADP < 60 % dosiahlo 66,1 % pacientov. Tieto výsledky sú v súlade s inými údajmi z literatúry. U pacientov liečených klopidogrelom sa zistila významná pozitívna korelácia medzi ADP-indukovanou agregáciou krvných doštičiek a VASP fosforyláciou. Analýzou opakovaných vyšetrení u pacientov s HPR sa zistilo, že 50 % pacientov pri liečbe klopidogrelom a 44,4 % pri liečbe ASA dosiahlo primeranú odpoveď na liečbu zlepšením kompliancie. U 80 % pacientov, ktorí opakovane neodpovedali na liečbu klopidogrelom v dávke 75 mg denne, došlo po zvýšení dávky na 150 mg denne k dosiahnutiu požadovanej odpovede na liečbu. Zvýšenie dávky ASA nad 100 mg denne neviedlo u našich pacientov k zlepšeniu odpovede na liečbu. U tých pacientov, ktorí nevykazovali dostatočnú odpoveď na liečbu nízkou dávkou ASA (< 100 mg denne), však viedlo zvýšenie dávky na 100 mg denne k efektívnemu ovplyvneniu agregačnej odpovede. Laboratórne monitorovanie umožnilo optimalizovať protidoštičkovú liečbu podľa individuálnej odpovede. Možno pritom selektovať pacientov, ktorí by mohli profitovať aj z iného typu liečby.
Optimálnu inhibíciu reaktivity krvných doštičiek možno pri HPR dosiahnuť zvýšením dávky klopidogrelu [4,14]. Alternatívou je prechod na novšiu protidoštičkovú liečbu. Dostupné možnosti protidoštičkovej liečby sú zhrnuté v tab. 5 [1,4,13]. Vyvinula sa „tretia generácia“ tienopyridínových a nontienopyridínových antagonistov receptora P2Y12. Tieto novšie lieky (ako je prasugrel a tikagrelor) účinnejšie a rýchlejšie inhibujú agregáciu krvných doštičiek, nie sú spojené s genetickou interferenciou a odpoveď na ne sa dá lepšie predvídať.
Tab. 5. Súčasnosť a budúcnosť protidoštičkovej liečby [2]. ![Súčasnosť a budúcnosť protidoštičkovej liečby [2].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/51e833bb3dc40850decf8a231c71bc1f.png)
Na posúdenie inhibície funkcie krvných doštičiek pri protidoštičkovej liečbe a v niektorých prípadoch aj na predpovedanie rizika závažných KV príhod sa používajú rôzne in vitro metódy [3,4,13]. V našej štúdii sme na posúdenie odpovede na protidoštičkovú liečbu použili konvenčnú LTA, ktorú sme vo vybraných prípadoch doplnili VASP fosforyláciou. Predtým než by sa malo odporúčať zavedenie liečby individualizovanej podľa laboratórnych testov do klinickej praxe, je potrebné za týmto účelom identifikovať a štandardizovať laboratórny test vhodný na klinické použitie. To znamená:
- identifikáciu najsenzitívnejšieho a najšpecifickejšieho laboratórneho testu na odhalenie tých pacientov, ktorí vykazujú abnormálnu odpoveď na liek;
- identifikáciu tzv. cut-off hodnôt pre riziko trombózy aj riziko krvácania („terapeutické okno“), ktoré by boli univerzálne akceptovateľné všetkými laboratóriami;
- štandardizáciu predanalytických aj analytických podmienok laboratórneho testu;
- identifikáciu účinnej, bezpečnej a ekonomicky výhodnej liečby u pacientov, ktorých hodnoty vybočujú z „terapeutického okna“.
Viaceré štúdie ukázali, že funkcia krvných doštičiek u pacientov liečených klopidogrelom je dosť nestabilný ukazovateľ. Mnohí pacienti počas liečby prechádzajú v rôznych obdobiach od začiatku liečby z kategórie „nedostatočne odpovedajúcich“ („poor responders“) medzi „dobre odpovedajúcich“ („good responders“) [13]. Táto variabilita vo výsledkoch funkcií krvných doštičiek poukazuje na potrebu opakovaného testovania počas sledovania pacientov. Zatiaľ nie sú jasné informácie o tom, ktorý z funkčných testov poskytuje najlepšiu predikciu klinických príhod. V jednej z nedávnych prác sa ukázalo, že stanovenie reaktivity krvných doštičiek za 30 dní od začiatku liečby dokáže najlepšie predpovedať ischemické aj krvácavé príhody [15]. Výsledky pravdepodobne môže ovplyvniť aj časový interval medzi odberom krvi na vyšetrenie a užitím poslednej dávky klopidogrelu, najmä u pacientov s koronárnou chorobou srdca, u ktorých zvýšený obrat krvných doštičiek urýchľuje vstup novovytvorených, neinhibovaných krvných doštičiek do krvného obehu. Výsledky by mohol významne ovplyvniť aj čas odberu vzorky krvi, keďže funkcie krvných doštičiek sa riadia cirkadiánnym rytmom, s vrcholom aktivity v ranných hodinách [16].
Nedávny konsenzus pracovnej skupiny poskytol tzv. cut-off hodnoty HPR pre väčšinu bežne používaných funkčných testov krvných doštičiek, vrátane LTA a VASP fosforylácie [5]. Doterajšie štúdie poukazujú na to, že pri sledovaní vzťahu reaktivity krvných doštičiek k výskytu recidív ischemických príhod možno cut-off hodnoty pre HPR používať aj prenesene [17]. V našej práci sme preto pri hodnotení účinnosti protidoštičkovej liečby vychádzali z týchto publikovaných údajov. Hoci ide o významný krok dopredu v stratégii personalizovanej protidoštičkovej liečby u pacientov s vysokým KV rizikom, nemusí byť vždy úplná zhoda pri stanovení HPR pomocou rôznych funkčných testov hodnotiacich odlišné aspekty biológie krvných doštičiek. Zistilo sa, že frekvencia HPR posudzovaná podľa konsenzom definovaných cut-off hodnôt je najvyššia pri VASP fosforylácii > 50 % (47,5 %) v porovnaní s 5 µmol/l ADP-indukovanou agregáciou krvných doštičiek > 46 % (37,3 %), pričom je medzi oboma metódami stredne tesná korelácia [17].
Americká Food and Drug Administration (FDA) v marci roku 2010 upozornila v prípade klopidogrelu na to, že priaznivý účinok tohto lieku sa nemusí v plnej miere prejaviť u tých pacientov, ktorí ho pre svoje genetické danosti dostatočne nemetabolizujú. Napriek tomu však nepoukázala na to, ako ďalej manažovať týchto pacientov. Neskôr sa k tomuto problému vyjadrili americké kardiologické autority vo forme konsenzu, podľa ktorého je potrebné stanoviť úlohu genetického testovania a jeho dopadu na klinické rozhodovanie. Ako efektívne by sa mohli ukázať ďalšie možné stratégie personalizovanej liečby, napr. sériové testovanie, jeho kombinácia s vyšetrením genotypu, ale aj použitie nových P2Y12 inhibítorov namiesto vysokej dávky klopidogrelu u pacientov vykazujúcich nízku odpoveď na liečbu [13]. Použitie nových P2Y12 antagonistov typu prasugrelu alebo tikagreloru namiesto klopidogrelu by mohlo značne znížiť problém hyporesponzívnosti. Tieto lieky účinne inhibujú funkcie krvných doštičiek u veľkej väčšiny pacientov, hoci aj pri nich sa pozoroval určitý stupeň variability v odpovedi na liečbu [13]. Na druhej strane však prasugrel a tikagrelor môžu zvyšovať riziko krvácania. Výskyt krvácavých komplikácií je pritom viac vo vzťahu k stupňu inhibície funkcie krvných doštičiek než k typu použitého lieku.
Napokon, individualizovaný prístup v protidoštičkovej liečbe je potrebné zvalidovať v randomizovaných klinických štúdiách. Pokiaľ nebudú k dispozícii výsledky veľkých klinických štúdií s personalizovanou protidoštičkovou liečbou, nemožno odporúčať stanovovanie funkčných testov krvných doštičiek na rutinné použitie v starostlivosti o pacientov s KV ochoreniami. Z výsledkov jednej z nich (štúdia GRAVITAS) sa zatiaľ nedajú vyvodzovať jednoznačné závery [18]. V súčasnosti prebiehajú viaceré klinické štúdie s liečbou klopidogrelom individualizovanou podľa laboratórneho monitorovania a ich výsledky sa očakávajú v blízkej budúcnosti [5,13].
Záver
Záverom možno konštatovať, že laboratórne monitorovanie individuálnej odpovede umožňuje zefektívniť protidoštičkovú liečbu. Možno pritom selektovať pacientov, ktorí by mohli profitovať z iného typu protidoštičkovej liečby, napr. novšími generáciami liekov, akými sú prasugrel alebo tikagrelor. V snahe optimalizovať súčasnú protidoštičkovú liečbu poskytla naša štúdia prvé výsledky v domácich podmienkach.
Poďakovanie
Ďakujeme Mgr. Ľubici Mruškovičovej, Zuzane Janíčkovej a RNDr. Zdenke Šujanovej z HemoMediky Bratislava, s.r.o., za technickú spoluprácu a Mgr. Petrovi Bartekovi, PhD., z Onkologického ústavu svätej Alžbety v Bratislave za spoluprácu pri vyšetrení VASP fosforylácie.
prof. MUDr. Anna Remková, DrSc.
www.hemomedika.sk
e-mail: remkova@gmail.com
Doručeno do redakce: 10. 7. 2012
Přijato po recenzi: 1. 10. 2012
Zdroje
1. Yeung J, Holinstat M. Newer agents in antiplatelet therapy: a review. J Blood Med 2012; 3 : 33–42.
2. Pecka M, Malý J. Metabolické a aktivační děje v krevních destičkách a možnosti jejich inhibice. Vnitř Lék 2009; 55 : 263–266.
3. Pecka M (ed.). Praktická hematologie. Laboratorní metody. Český Těšín: Infiniti art 2010 : 343 s.
4. Remková A, Janušicová A, Šujanová Z et al. Máme monitorovať protidoštičkovú liečbu? Lek Obz 2011; 60 : 131–135.
5. Bonello L, Tantry US, Marcucci R et al. Consensus and future directions on the definition of high on-treatment platelet reactivity to adenosine diphosphate. J Am Coll Cardiol 2010; 56 : 919–933.
6. Chen WH, Lee PY, Ng W, Tse HF, Lau CP. Aspirin resistance is associated with a high incidence of myonecrosis after non-urgent percutaneous coronary intervention despite clopidogrel pretreatment. J Am Coll Cardiol 2004; 43 : 1122–1126.
7. Mega JL, Close SL, Wiviott SD et al. Cytochrome P-450 Polymorphisms and Response to Clopidogrel. New Engl J Med 2009; 360 : 354–362.
8. Collet JP, Hulot JS, Pena A et al. Cytochrome P450 2C19 polymorphism in young patients treated with clopidogrel after myocardial infarction: a cohort study. Lancet 2009; 373 : 309–317.
9. Wallentin L, Becker RC, Budaj A et al. PLATO Investigators. Ticagrelor versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2009; 361 : 1045–1057.
10. Graham I, Atar D, Borch-Johnsen K et al. European Guidelines on Cardiovascular Disease Prevention: Fourth Joint European Societies´ Task Force on Cardiovascular Disease Prevention in Clinical Practice. Executive Summary. Eur Heart J 2007; 28 : 2375–2414.
11. Breet NJ, van Werkum JW, Bouman HJ et al. High on-aspirin platelet reactivity as measured with aggregation-based, cyclooxygenase-1 inhibition sensitive platelet function tests is associated with the occurrence of atherothrombotic events. J Thromb Haemost 2010; 8 : 2140–2148.
12. Breet NJ, van Werkum JW, Bouman HJ et al. Do not adjust the platelet count in light transmittance aggregometry when predicting thrombotic events after percutaneous coronary intervention. J Thromb Haemost 2010; 8 : 2326–2328.
13. Cattaneo M. Response variability to clopidogrel: is tailored treatment, based on laboratory testing, the right solution? J Thromb Haemost 2012; 10 : 327–336.
14. Wang XD, Zhang DF, Liu XB et al. Modified clopidogrel loading dose according to platelet reactivity monitoring in patients carrying ABCB1 variant alleles in patients with clopidogrel resistance. Eur J Intern Med 2012; 23 : 48–53.
15. Campo G, Parrinello G, Ferraresi P et al. Prospective evaluation of on-clopidogrel platelet reactivity over time in patients treated with percutaneous coronary intervention relationship with gene polymorphisms and clinical outcome. J Am Coll Cardiol 2011; 57 : 2474–2483.
16. Pecháň J, Mikulecký M, Okrucká A. Circadian rhythm of plasma β-thromboglobulin in healthy human subjects. Blood Coagul Fibrinolysis 1992; 3 : 105–107.
17. Jeong YH, Bliden KP, Tantry US, Gurbel PA. High on-treatment platelet reactivity assessed by various platelet function tests: is the consensus-defined cut-off of VASP-P platelet reactivity index too low? J Thromb Haemost 2012; 10 : 487–489.
18. Price MJ, Angiolillo DJ, Teirstein PS et al. Platelet reactivity and cardiovascular outcomes after percutaneous coronary intervention: a time-dependent analysis of the Gauging Responsiveness with a VerifyNow P2Y12 assay: impact on thrombosis and safety (GRAVITAS) trial. Circulation 2011; 124 : 1132–1137.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2012 Číslo 12- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Péče o trvalé vstupy pacientů na domácí parenterální výživě – editorial
- Pozor na „přírodní“ léčbu – játra mohou trpět! – editorial
- Výsledky léčby AL-amyloidózy léčebnými režimy obsahujícími bortezomib, dexametazon a dále cyklofosfamid anebo doxorubicin
- Je protidoštičková liečba vždy účinná?
- Naše zkušenosti s léčbou primárních lymfomů centrálního nervového systému
- Artériová hypertenzia v gravidite – rizikový faktor kardiovaskulárnych ochorení
- Současný pohled na dnu, její diagnostiku a léčbu
- Primární řasinky buněk kardiovaskulárního aparátu
- Změny na úrovni populace zaměřené na podporu kardiovaskulárního zdraví
- Péče o tunelizované žilní katétry u nemocných na domácí parenterální výživě podle současných doporučení
- Toxická hepatitída po Polygonum multiflorum
- Používání koncentrátu protrombinového komplexu brzdí terapeutický nihilismus
- Oznámení o konání XXXII. Dnů mladých internistů
- Seznam členů výboru Slovenskej internistickej spoločnosti na roky 2011–2014
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Péče o trvalé vstupy pacientů na domácí parenterální výživě – editorial
- Artériová hypertenzia v gravidite – rizikový faktor kardiovaskulárnych ochorení
- Současný pohled na dnu, její diagnostiku a léčbu
- Péče o tunelizované žilní katétry u nemocných na domácí parenterální výživě podle současných doporučení
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



