-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Naše zkušenosti s léčbou primárních lymfomů centrálního nervového systému
Our experience with the treatment of primary lymphomas of the central nervous system
Introduction:
The aim of this study was to assess treatment efficiency, overall survival (OS) and identify risk factors with the influence on patients prognosis in patients with primary central nervous system lymphomas (PCNSL) who were treated with intensive chemotherapy based on high-dose methotrexate and cytosin-arabinoside followed by whole-brain radiotherapy (MPV regimen).Patients and methods:
From January 1998 to February 2011, 39 patients with PCNSL were diagnosed on our department. The median from the first clinical symptomatology to histological diagnosis was 4 weeks (range, 2–19). Thirty-seven patients were treated with MPV regimen.Results:
The therapeutic response was evaluated in 35 patients (2 patients died early during treatment). The overall response/complete remission rate was 63/60%. At the time of analysis (november 2011), the median of follow-up was 16,5 months; 31 patients died (the most often causes of death were poor treatment effect and treatment complications). The 2-year OS was 30% and median PFS and OS were 9 and 12 months. Patients with WHO performance status 0–1 and those with normal serum lactate dehydrogenase serum had significantly longer OS (p = 0.0495 and p = 0.0232).Conclusion:
The treatment results of our patients appear to be inferior than data from literature. The reason is probably high occurrence of negative prognostic factors. Early diagnosis and intensive treatment are crucial for improvement of prognosis.Keywords:
primary central nervous system lymphoma – chemotherapy – radiotherapy – methotrexate – risk factors – overall survival
Autoři: M. Motyčková; L. Smolej; D. Belada; J. Malý; P. Žák
Působiště autorů: IV. interní hematologická klinika Lékařské fakulty UK a FN Hradec Králové, přednosta doc. MUDr. Pavel Žák, Ph. D.
Vyšlo v časopise: Vnitř Lék 2012; 58(12): 915-921
Kategorie: Původní práce
Souhrn
Úvod:
Cílem projektu bylo zhodnotit léčebnou účinnost, celkové přežití (overall survival – OS) a určit rizikové faktory ovlivňující prognózu nemocných s primárními lymfomy centrálního nervového systému (PCNSL) léčených intenzivní chemoterapií na bázi vysokých dávek metotrexátu a následně cytosin-arabinosidu kombinované s radioterapií (režim MPV).Nemocní a metody:
Od ledna roku 1998 do února roku 2011 bylo na našem pracovišti diagnostikováno 39 pacientů s PCNSL. Medián období od první klinické symptomatologie do data stanovení histologické diagnózy byl 4 týdny (rozmezí 2–19 týdnů). Režimem MPV bylo léčeno 37 pacientů.Výsledky:
Léčebná odpověď byla hodnocena u 35 nemocných (2 nemocní zemřeli časně po podání léčby, hodnocení tedy nebylo možné). Celková léčebná odpověď byla 63 %, 21/35 pacientů (60 %) dosáhlo kompletní remise. V době analýzy (listopad roku 2011) byl medián sledování žijících nemocných 16,5 měsíce; k tomuto datu zemřelo 31 nemocných (nejčastější příčinou úmrtí byl nedostatečný efekt léčby a její komplikace). Pravděpodobnost 2letého OS celého souboru byla 30 %, medián OS byl 12 měsíců. Medián období do progrese byl 9 měsíců. Významně delší OS měli nemocní s dobrým vstupním výkonnostním stavem 0–1 dle WHO (p = 0,0495) a nemocní s normální hodnotou laktátdehydrogenázy v séru (p = 0,0232).Závěr:
Výsledky léčby v našem souboru pacientů jsou horší, než je udáváno v literatuře. Důvodem je pravděpodobně výskyt nepříznivých prognostických ukazatelů u většiny nemocných. Pro prognózu nemocných je stěžejní rychlé stanovení histologické diagnózy a včasné zahájení intenzivní léčby.Klíčová slova:
primární lymfomy centrálního nervového systému – chemoterapie – radioterapie – metotrexát – rizikové faktory – celkové přežitíÚvod
Primární lymfomy centrálního nervového systému (PCNSL) jsou vzácné extranodální lymfomy zahrnující postižení mozkového parenchymu, mozkových obalů, míchy a struktur oka (kromě očních adnex) s výrazně narůstající incidencí v uplynulých letech. Nejvyšší incidence PCNSL je u pacientů imunokompromitovaných (primárně i sekundárně, např. při HIV infekci), obecně výskyt PCNSL narůstá také s věkem [1]. Klinické projevy jsou velice pestré, neurologický deficit odráží místa postižení nervových struktur [2,3]. Z histologického hlediska se v naprosté většině případů jedná o nehodgkinovy lymfomy, nejčastějším histologickým typem je difuzní B velkobuněčný lymfom (diffuse large B-cell lymphoma – DLBCL), a to nejčastěji prognosticky nepříznivý „ABC-like“ typ (activated B-cell) [4,5]. Ve WHO klasifikaci z roku 2008 je nově zařazena samostatná jednotka primární difuzní velkobuněčný lymfom CNS [6]. Hodgkinův lymfom v CNS je zcela raritní [7]. V diagnostice PCNSL hraje stěžejní roli histologické vyšetření vzorku tumoru získané stereotaktickou biopsií. Radikální chirurgická exstirpace je zcela nevhodná, nevede totiž k prodloužení celkového přežití, naopak velmi často celkový stav nemocného zhorší a tím může zkrátit i přežití pacienta [3]. Před zahájením léčby je vhodné u každého nemocného určit klinické stadium dle Ann Arbor klasifikace a zhodnotit přítomnost rizikových faktorů, které umožní odhadnout prognózu. V současné době existují u PCNSL dva všeobecně uznávané nepříznivé prognostické ukazatele, a to věk 60 let a více a pokročilý vstupní výkonnostní stav (performance status – PS) 2 a více dle WHO klasifikace [2,8–11]. Na základě 2 rozsáhlých multicentrických retrospektivních studií však vedle těchto dvou byly identifikovány ještě další 3 rizikové ukazatele [hodnota proteinu v likvoru nad 0,6 g/l, zvýšená sérová koncentrace laktátdehydrogenázy a postižení hlubokých mozkových struktur (periventrikulární oblasti, bazální ganglia, mozeček a mozkový kmen)]. Medián celkového přežití pacientů s PCNSL tak kolísá od 1 do 8 let v závislosti na počtu těchto faktorů. Definitivní význam posledních 3 uvedených však musí být potvrzen v prospektivních studiích [2,8]. Kombinace vysokodávkované chemoterapie na bázi metotrexátu, následné radioterapie a cytosin-arabinosidu (režim MPV) se jevilo jako dosud nejúčinnější schéma léčby PCNSL. Na základě mnohých dat je však zřejmé, že radioterapie významně zvyšuje riziko pozdní neurologické toxicity (vyšší výskyt demence, autonomních dysfunkcí), a to zejména u pacientů starších 60 let [2,3,9,12,13]. U těchto nemocných je v současné době radioterapie zvažována vždy individuálně a u části pacientů je při dosažení kompletní remise po léčbě 1. linie vynechávána. Nově se jako slibné ukazuje přidání monoklonální anti-CD20 protilátky rituximabu ke standardní chemoterapii (režim R-MPV). K definitivnímu zhodnocení účinnosti této léčby je třeba dalších studií, dosud publikované výsledky jsou však natolik příznivé, že se v současné době režim R-MPV stává standardní léčbou pacientů s nově diagnostikovanými PCNSL [14,15]. Cílem naší práce bylo zhodnocení souboru nemocných s PCNSL – stanovení procenta léčebných odpovědí, zhodnocení celkového přežití (overall survival – OS) a určení vlivu rizikových faktorů na prognózu nemocných.
Nemocní a metody
Základní charakteristiky nemocných jsou uvedeny v tab. 1. Na IV. interní hematologické klinice Lékařské fakulty UK a FN v Hradci Králové bylo od ledna roku 1998 do února roku 2011 diagnostikováno 39 pacientů s primárním CNS lymfomem – 21 mužů (54 %) a 18 žen (46 %) s věkovým mediánem 65 let (rozmezí 38–82 let). Dvacet čtyři pacientů (62 %) bylo věku 60 let a více, pokročilý vstupní výkonnostní stav ≥ 2 dle WHO byl zaznamenán u 22 nemocných (56 %) (4krát PS 2, 7krát PS 3, 11krát PS 4), medián PS byl 2 (rozmezí 0–4). U všech pacientů byla před odběrem vzorku tkáně provedena magnetická rezonance (MRI) mozku k určení lokalizace lymfomu. V 17 případech (44 %) byl postižen mozkový parenchym (5krát parietální lalok, 5krát frontální lalok, 5krát frontotemporoparietální, 1krát temporoparietální, 1krát parietookcipitální výskyt), u 21 nemocných (54 %) ložiska lymfomu postihovala hluboké mozkové struktury (19krát talamus, hypotalamus, bazální ganglia či corpus callosum, 2krát mozeček). U 1 pacientky se jednalo o postižení oka. Pro diagnózu byla použita u 31 pacientů stereotaktická biopsie, u 7 radikální resekce tumoru, u pacientky s očním postižením byla provedena pravostranná vitrektomie a lymfom byl diagnostikován na základě cytologického a imunofenotypizačního vyšetření sklivce. Dnem stanovení diagnózy byl den výsledku histologického vyšetření. U 33 pacientů včetně nemocné s očním postižením se jednalo o DLBCL (84 %), u 3 (8 %) o folikulární lymfom (FL) a u 3 pacientů nebylo přesné histologické zařazení možné (klasifikováno jako blíže nezařazený B nehodgkinův lymfom). Ve 22 případech pacientů s DLBCL byl lymfom histologicky blíže klasifikován jako prognosticky nepříznivý „ABC-like“ typ (activated B-cell). Medián od prvních příznaků do data stanovení histologické diagnózy byl 4 týdny (rozmezí 2–19 týdnů). U 17 nemocných byla prodleva do stanovení histologické diagnózy více než 4 týdny od prvních neurologických příznaků. Mozkomíšní mok byl před zahájením léčby vyšetřen u 31 nemocných, pouze u nemocné s lymfomem oka bylo pozitivní imunofenotypizační vyšetření, ve všech ostatních případech bylo cytologické i imunofenotypizační vyšetření likvoru negativní. Stanovení hodnoty proteinu v likvoru bylo dostupné pouze u 10 nemocných, v 5 případech byla jeho hodnota zvýšena nad 0,6 g/l. Z dalších negativních prognostických ukazatelů byla hodnocena hladina LDH v séru u 38 nemocných, u 30 z nich byla zvýšena (79 %). K objektivizaci neurologického nálezu proběhlo u všech nemocných neurologické vyšetření, které prokázalo neurologický deficit v 92 % případů. K určení rozsahu onemocnění bylo u všech pacientů vstupně provedeno tomografické vyšetření hrudníku, břicha a pánve (CT) a bioptické vyšetření kostní dřeně, u mužů fyzikální či ultrasonografické vyšetření varlat. Třicet osm nemocných bylo diagnostikováno ve stadiu IE dle Ann Arbor klasifikace (pouze postižení CNS), 1 pacient ve stadiu IIE (kromě postižení mozku i histologicky ověřené postižení měkkých tkání okcipitálně vlevo). Klinický obraz byl různorodý. Šlo nejčastěji o neurologický deficit v podobě monoparézy, hemiparézy, afázie či křečí. U pacientů s postižením periventrikulárních struktur se objevily neuropsychiatrické změny typu deprese či zmatenosti. U pacientky s postižením oka dominovalo rozostřené vidění a tato nemocná byla zpočátku téměř 3 měsíce léčena kortikoidy pro idiopatickou chorioretinitidu (již jako 2. ataka idiopatické chorioretinitidy po roce). Při nedostatečném efektu léčby byla poté indikována vitrektomie a byl diagnostikován lymfom. U 2 pacientů se lymfom v úvodu manifestoval poruchou vědomí (soporózní stav).
Tab. 1. Charakteristika pacientů. 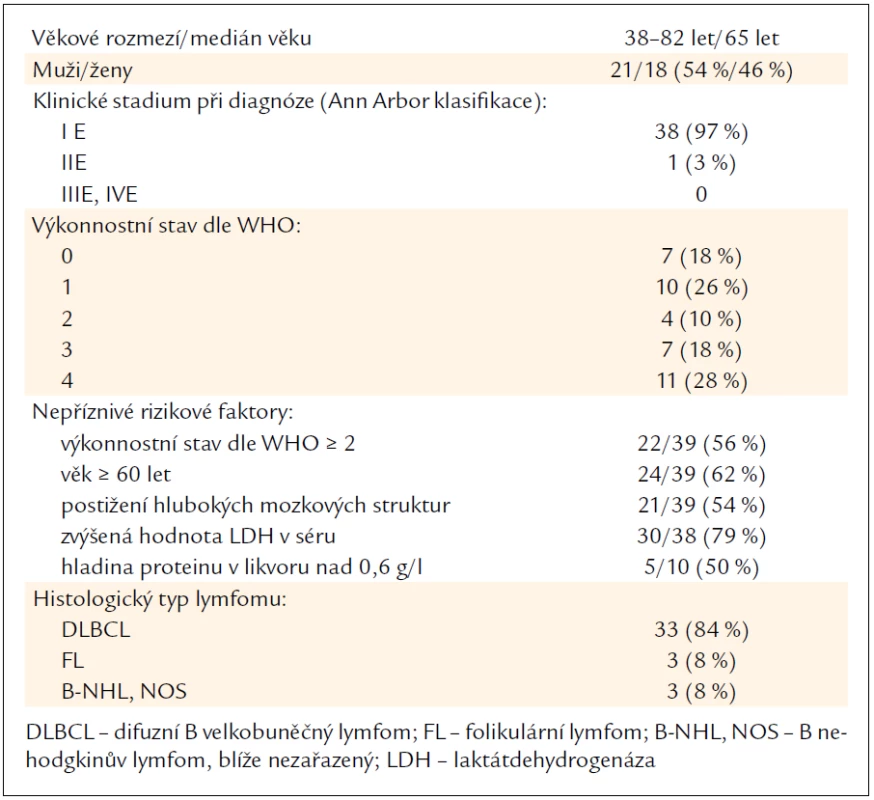
Intenzifikovaným protokolem kombinujícím chemoterapii na bázi vysokých dávek metotrexátu a cytosin-arabinosidu ± radioterapii mozku (režim MPV) bylo léčeno 37 nemocných (tab. 2) [16]. U 2 nemocných s poruchou vědomí v úvodu onemocnění vzhledem k věku, četným závažným přidruženým onemocněním a špatnému vstupnímu klinickému stavu léčba zahájena nebyla. U 8 pacientů byl od roku 2009 k léčbě přidán rituximab (MabThera) 1. den každého cyklu v dávce 500 mg/m2 (režim R-MPV) (tab. 2). U režimu R-MPV byl navíc podán granulocytární růstový faktor filgrastim (G-CSF) dle protokolu jako profylaxe neutropenie (tab. 2). Podání vysokodávkovaného metotrexátu bylo podmíněno normálními renálními funkcemi (zejména clearance kreatininu zjištěnou výpočtem) a jejich opakovanou laboratorní kontrolou a vyžadovalo podpůrnou terapii. Ta zahrnovala vydatnou nitrožilní hydrataci (minimálně 2,5 l/den), sledování diurézy, alkalizaci bikarbonátem s opakovanou kontrolou pH moče, které muselo být udržováno nad 7,5, a „rescue“ fázi leukovorinem do poklesu sérové koncentrace metotrexátu pod 0,01 μmol/l (tab. 2).
Tab. 2. Protokol pro léčbu PCNSL – režim MPV („klasické“ schéma bez rituximabu) a režim R-MPV (s rituximabem). 
Léčebná odpověď byla hodnocena dle mezinárodních kritérií pro PCNSL z roku 2005 (retrospektivně byla revidována i u nemocných léčených před rokem 2005). Základem hodnocení byl nález na zobrazovacích vyšetřeních CNS a cytologický nález v mozkomíšním moku. U pacientů s očním postižením v úvodu (či při objevení se nových příznaků podezřelých z postižení oka) se hodnotí i závěr oftalmologického vyšetření [17]. Zjednodušená verze kritérií odpovědí na léčbu je uvedena v tab. 3.
Tab. 3. Kritéria odpovědi na léčbu u PCNSL použitá v našem souboru. 
Celkové přežití bylo definováno jako období od data stanovení diagnózy do úmrtí na jakoukoliv, i nenádorovou příčinu. K hodnocení celkového přežití byly zkonstruovány Kaplan-Meierovy křivky přežití a jednotlivé podskupiny porovnány pomocí log rank testu.
Výsledky
Léčebná odpověď byla stanovena u 35 z 37 léčených pacientů. U 2 nemocných hodnocení možné nebylo pro krátkou dobu podání chemoterapie, v obou případech došlo k časnému úmrtí záhy po podání léčby na septický šok. Dvacet jedna pacientů dosáhlo po skončení léčby včetně radioterapie a podání cytosin-arabinosidu kompletní remise (21/35; 60 %), 11/35 pacientů (31 %) progredovalo v průběhu léčby první linie (medián doby do progrese 3 měsíce; rozmezí 1–6 měsíců), 1krát bylo dosaženo částečné odpovědi (parciální remise – PR; 1/35; 3 %), ve 2 případech (2/35; 6 %) se jednalo o stabilní onemocnění (PR i SD hodnoceny po podání I. bloku léčby, viz tab. 2).
V době analýzy v listopadu roku 2011 byl medián sledování žijících nemocných 16,5 měsíce (rozmezí 7–35 měsíců); 31 z 39 pacientů zemřelo. U 2 nemocných šlo o úmrtí bez zahájení léčby ihned po stanovení diagnózy, další 2 nemocní zemřeli záhy po zahájení léčby na septický šok. Čtrnáct nemocných zemřelo v důsledku nedostatečného efektu léčby první linie (11 pacientů pro progresi onemocnění, 2 pacienti se stabilní chorobou, 1 pacient v PR) i přes následnou změnu léčebné strategie. Pět nemocných, kteří progredovali na léčbě, podstoupilo v úvodu radikální chirurgický výkon. U dalších 8 nemocných došlo k úmrtí v důsledku komplikací léčby; v 7 případech šlo o septický šok v období neutropenie po chemoterapii, 1krát došlo k asystolii při hyperkalemii. U 5 pacientů v kompletní remisi došlo k relapsu lymfomu v CNS (medián do relapsu 2,5 roku) nereagujícímu na následnou léčbu, šlo tedy o pozdní úmrtí. Komplikace léčby lze rozdělit na časné a pozdní. Nejčastějším časným nežádoucím účinkem léčby byla hematologická toxicita v průběhu intenzivní chemoterapie (neutropenie stupně 3/4 dle Common Terminology Criteria for Adverse Events – CTCAE ve 21 případech, trombocytopenie stupně 3/4 v 8 případech) a infekční komplikace (9krát septický šok, 10krát sepse); u 4 nemocných se objevilo zvýšení jaterních testů, které se normalizovalo po přerušení chemoterapie, u 1 pacienta došlo k fatální asystolii při hyperkalemii. U pacientů s neutropenií stupně 3/4 dle CTCAE byla v následujících cyklech chemoterapie podána sekundární G-CSF profylaxe, u nemocných se závažným průběhem sepse či protrahovanou neutropenií i přes sekundární G-CSF profylaxi byla následná dávka MTX redukována o 30 %. U pacientů starších 60 let byla u režimu R-MPV provedena primární redukce dávky MTX na 1 500–2 500 mg/m2. Z pozdních komplikací dominovala pozdní neurologická toxicita po dokončení léčby u 4 pacientů v kompletní remisi bez známek relapsu. Všichni 4 pacienti podstoupili radioterapii CNS a byli starší 60 let. Klinicky se pozdní neurologická toxicita manifestovala příznaky demence.
Pravděpodobnost 2letého přežití celého souboru byla 30 %, medián OS byl 12 měsíců (graf 1). Medián období do progrese (progression free survival – PFS) byl 9 měsíců. Významně delší OS měli nemocní s dobrým vstupním výkonnostním stavem 0–1 vs nemocní s PS ≥ 2 (p = 0,0495) a nemocní s normální hodnotou LHD v séru (p = 0,0232) (graf 2 a 3). Na hranici statistické významnosti bylo hodnocení přežití nemocných stratifikovaných dle věku (nemocní mladší 60 let vs nemocní 60 let a více; p = 0,0529) (graf 4). Postižení hlubokých mozkových struktur naopak nemělo na celkové přežití nemocných v našem souboru vliv (p = 0,5396). Hodnota proteinu v likvoru nad 0,6 g/l byla dostupná pouze u malé části pacientů (n = 10), její prognostický vliv tedy nebyl hodnocen. Celkové přežití skupiny 17 pacientů, u kterých došlo ke stanovení diagnózy déle než za 4 týdny od prvních příznaků, nebylo významně rozdílné od pacientů, u kterých byla diagnóza stanovena časně (p = 0,62). Ani rozdíl v PFS u obou těchto skupin nemocných nebyl statisticky významný (p = 0,518). V hodnocení však může opět hrát vliv nízký počet nemocných.
Graf 1. Celkové přežití celého souboru nemocných. 
Graf 2. Porovnání celkového přežití dle vstupního výkonnostního stavu. 
Graf 3. Porovnání celkového přežití dle sérové koncentrace laktátdehydrogenázy (LDH). 
Graf 4. Porovnání celkového přežití podle věku. 
Diskuze a závěry
I když jsou PCNSL vzácnou diagnózou, je třeba na ni v případě nových neurologických symptomů a patologického nálezu na zobrazovacích vyšetřeních mozku vždy myslet a spolupracovat s ostatními odborníky, zejména neurochirurgy. V praxi je bohužel častým problémem nasazení kortikoidů bez znalosti histologické diagnózy nádorového procesu v CNS, což vede k zastření symptomů (klinických i radiologických) a zbytečnému oddálení diagnózy. Nezřídka je pak léčba zahajována i za několik měsíců od objevení se prvních příznaků. Dalším zásadním problémem je způsob stanovení diagnózy u těchto nemocných – místo minimálně invazivního výkonu typu stereotaktické biopsie je zvolena radikální exstirpace tumoru z důvodu, že tato metoda má jinak pro většinu ostatních nádorů CNS potenciálně léčebný efekt. Pro nemocného s PCNSL však radikální resekce mozkového tumoru nemá žádný přínos, naopak často vede ke zhoršení neurologického nálezu a prognózy. Dalšími důležitými ukazateli prognózy, které ovlivňují celkové přežití, jsou vedle šetrného a včasného diagnostického zákroku i brzké zahájení léčby, věk a celkový stav nemocného [18]. V posledních letech byly zaznamenány velké pokroky v léčbě PCNSL. Stěžejním krokem bylo jistě začlenění vysokodávkovaného metotrexátu (MTX). Ve studiích existují různá dávkovací schémata podání metotrexátu od použití 1 g/m2 až po vysokodávkovaná schémata léčby s 8 g/m2. Teprve dávky vyšší než 1 g/m2 pronikají dobře přes hematoencefalickou bariéru, přesto se nezdají být dostatečně účinné. Avšak ani vysoké dávky MTX 8 g/m2 nepřinesly uspokojivé výsledky; jejich použití v kombinaci s radioterapií bylo naopak spojeno s vyšší toxicitou [9]. Důležitým ukazatelem účinnosti léčby metotrexátem je kromě dávky také rychlost jeho podání. Prospektivní studie ukázaly, že intravenózní podání 3 g/m2 metotrexátu v 3hodinové infuzi vede k dosažení účinných koncentrací v mozkomíšním moku narozdíl od podání metotrexátu v dávce 8 g/m2 24hodinovou intravenózní infuzí, kdy požadovaných koncentrací v likvoru dosaženo není [12]. Doporučenou dávkou MTX je v současné době 3,5 g/m2 podané ve 2hodinové infuzi [15]. Stejně jako u MTX musí být k dosažení optimálních koncentrací v likvoru použita vyšší dávka cytosin-arabinosidu intravenózně [9].
Dalším pokrokem v léčbě PCNSL je přidání monoklonální protilátky rituximabu k chemoterapii (imunochemoterapie). V nedávno publikované studii fáze II byl použit rituximab ve vyšší dávce 500 mg/m2 (standardní dávka používaná k léčbě B nehodgkinových lymfomů v jiných lokalizacích, než je CNS, je 375 mg/m2) v kombinaci s režimem MPV (R-MPV), radioterapií a cytosin-arabinosidem u nově diagnostikovaných pacientů s PCNSL. Výsledky této léčby byly velice uspokojivé – celkových léčebných odpovědí bylo zaznamenáno 93 % (z toho 78 % kompletních remisí!) a při 37 měsících sledování souboru nebyl u pacientů v CR dosažen medián OS ani medián PFS. Očekávané 2leté OS a PFS v této práci bylo 67 %, resp. 57 %. Navíc nedošlo k rozvoji příznaků neurotoxicity – pacienti, kteří dosáhli CR po chemoterapii, obdrželi radioterapii CNS v redukované dávce 23,4 Gy [12,14]. Režim R-MPV se tak zdá být účinnějším než režim bez rituximabu a na základě těchto dat je v současné době doporučeným léčebným postupem u pacientů s nově diagnostikovanými PCNSL, a to i s přihlédnutím k faktu, že se nejedná o randomizovanou studii [15]. Bohužel vzhledem k vzácnému výskytu PCNSL je organizace a vytváření randomizovaných klinických studií pro tyto nemocné velmi obtížné. Klasický režim MPV tak ustupuje do pozadí, neboť v porovnání s R-MPV má jednoznačně horší výsledky (58 % kompletních remisí z 94 % celkových léčebných odpovědí, PFS 24 měsíců a medián OS 37 měsíců) [9,13]. Rutinní použití radioterapie u nemocných starších 60 let v rámci klasického schématu léčby MPV zvyšovalo riziko pozdní neurologické toxicity, která zhoršuje kvalitu života a vede i ke zkrácení celkového přežití [2,3,9,12,13]. Ustupuje se také od rutinního podání MTX intratekálně u každého cyklu, dle současných doporučení je pravidelná intratekální aplikace vyhrazena pouze pro nemocné s pozitivním záchytem maligních buněk v likvoru v úvodu léčby, což svědčí pro meningeální postižení, které je méně časté [15].
I když je počet kompletních remisí v našem souboru poměrně vysoký, celkové přežití souboru i období do progrese jsou kratší, než je při použití intenzivní léčby udáváno v literatuře, což má pravděpodobně několik příčin: většina pacientů měla v době stanovení diagnózy nepříznivé prognostické faktory, a to pokročilý PS (medián PS 2) a jednalo se převážně o starší nemocné. Prokázali jsme tedy v souladu s dobře známými fakty, že špatný PS (skóre 2 a více v úvodu) je silným negativním prognostickým ukazatelem přežití nemocných. Hodnocení vlivu vyššího věku na přežití nemocných bylo na hranici statistické významnosti, výsledky mohou být ovlivněny nízkým počtem pacientů. S horší prognózou bylo také spojeno zvýšení LDH v séru nad normální hodnotu, naopak postižení hlubokých mozkových struktur vliv na přežití nemocných nemělo. Prognóza mohla být také ovlivněna i faktem, že i v našem souboru se vyskytli nemocní, u kterých byla histologická diagnóza stanovena i za několik měsíců od prvních symptomů. Hlavním důvodem bylo časné podání kortikoidů bez znalosti histologické diagnózy a dočasné zmírnění nebo i vymizení příznaků, či dlouhý interval do provedení zobrazovacích vyšetření mozku (zejména magnetické rezonance). Medián od objevení prvních příznaků do data stanovení diagnózy byl 4 týdny s rozmezím 2–19 týdnů! I když byla poté hematologická léčba zahájena neprodleně po znalosti histologické diagnózy, její účinnost mohla být negativně ovlivněna. I když jsme v našem souboru neprokázali statisticky významný rozdíl v přežití mezi skupinou nemocných, kde byla diagnóza stanovena časně, a skupinou nemocných, kde došlo ve stanovení diagnózy k prodlevě, lze usuzovat, že na hodnocení mohl mít vliv nízký počet pacientů. Výsledky léčby a tím i prognóza nemocných mohly být také zhoršeny provedením radikálních chirurgických výkonů u 7 nemocných, 5 z těchto pacientů progredovalo na léčbě 1. linie a nereagovalo ani na léčbu 2. linie.
Ani vysoký výskyt časných úmrtí zaznamenaný v našem souboru není u pacientů s PCNSL neobvyklý. Léčba založená na vysokých dávkách cytostatik je značně toxická a vyžaduje důslednou podpůrnou léčbu. Zejména v období neutropenie může dojít k výskytu závažných infekcí, které vedou k rozvoji septického šoku, tak jako tomu bylo i u některých našich nemocných. Dle nových doporučení je proto součástí podpůrné léčby u režimu R-MPV i povinná profylaxe febrilní neutropenie pomocí G-CSF, která vede k omezení výskytu neutropenie a ke zkrácení jejího trvání [11,15]. Příznaky pozdní neurologické toxicity se objevily u 4 nemocných starších 60 let, kteří podstoupili radioterapii CNS. Všichni pacienti však byli v CR. Dle současných doporučení je tedy radioterapie mozku u nemocných starších 60 let v léčbě 1. linie používána jen u nemocných, kde léčbou 1. linie nebylo dosaženo kompletní remise, neboť její zařazení u pacientů v CR může výrazným způsobem zhoršit kvalitu jejich života z důvodu neurotoxicity. Navíc dle současných doporučení dochází i u nemocných mladších 60 let, kteří dosáhli CR po chemoterapii, k redukci dávky radioterapie na 23,5 Gy ve srovnání s původně podávanými 45 Gy. Srovnání efektu režimu MPV a R-MPV jsme neprováděli pro nízký počet nemocných léčených R-MPV.
Závěr
Závěrem lze konstatovat, že diagnostika a léčba PCNSL je příkladem nutnosti kvalitní mezioborové spolupráce. Klíčová je včasná a správná klinická a radiologická MRI diagnostika (což je nejčastěji záležitost neurologů a radiologů), poté šetrný histologický odběr vzorku neurochirurgem (nejlépe stereotaktickou biopsií), neodkladné stanovení histologické diagnózy patologem a v neposlední řadě včasná a správná léčba ve specializovaném hematologickém centru, které má s touto léčbou zkušenosti.
Tato práce byla podpořena výzkumným záměrem MZO 00179906.
MUDr. Monika Motyčková
www.fnhk.cz
e-mail: motyckova.monika@seznam.cz
Doručeno do redakce: 11. 6. 2012
Přijato po recenzi: 3. 10. 2012
Zdroje
1. Singh AD, Lewis H, Schachat AP. Primary lymphoma of the central nervous system. Ophthalmol Clin North Am 2005; 18 : 199–207.
2. Batchelor T, Loeffler JS. Primary CNS lymphoma. J Clin Oncol 2006; 24 : 1281–1288.
3. Fitzsimmons A, Upchurch K, Batchelor. T Clinical features and diagnosis of primary central nervous system lymphoma. Hematol Oncol Clin North Am 2005; 19 : 689–703.
4. Commins DL. Pathology of primary central nervous system lymphoma. Neurosurg Focus 2006; 21: E2.
5. Ferreri AJ, Reni M. Primary central nervous system lymphoma. Crit Rev Oncol Hematol 2007; 63 : 257–268.
6. Kluin PM, Ko YH, Kovrigina AM et al. World Health Organisation Classification of Tumors of Haematopoietic and Lymphoid Tissue. Lyon: Agency for Research on Cancer 2008.
7. Almhanna K, Wongchaowart N, Sweetenham J. Intracerebral Hodgkin‘s lymphoma in a patient with chronic lymphocytic leukemia/small lymphocytic lymphoma: a case report and literature review. Cancer Invest 2009; 27 : 215–220.
8. Ferreri AJ, Blay JY, Reni M et al. Prognostic scoring system for primary CNS lymphomas: the International Extranodal Lymphoma Study Group experience. J Clin Oncol 2003; 21 : 266–272.
9. Shah GD, DeAngelis LM. Treatment of primary central nervous system lymphoma. Hematol Oncol Clin North Am 2005; 19 : 611–627.
10. Ferreri AJ, Reni M. Prognostic factors in primary central nervous system lymphomas. Hematol Oncol Clin North Am 2005; 19 : 629–649.
11. Belada D, Trněný M, Campr V et al. Diagnostické a léčebné postupy u nemocných s maligními lymfomy. Hradec Králové: HK CREDIT, 2009 : 72–73.
12. Morris PG, Abrey LE. Therapeutic challenges in primary CNS lymphoma. Lancet Neurol 2009; 8 : 581–592.
13. DeAngelis LM, Iwamoto FM. An update on therapy of primary central nervous system lymphoma. Hematology Am Soc Hematol Educ Program 2006 : 311–316.
14. Shah GD, Yahalom J, Correa DD et al. Combined immunochemotherapy with reduced whole--brain radiotherapy for newly diagnosed primary CNS lymphoma. J Clin Oncol 2007; 25 : 4730–4735.
15. Belada D, Trněný M. Diagnostické a léčebné postupy u nemocných s maligními lymfomy IV. Hradec Králové: HK CREDIT, 2011: s. 72–73.
16. Belada D, Trněný M. Diagnostické a léčebné postupy u nemocných s maligními lymfomy II. Praha 2007 : 76.
17. Abrey LE, Batchelor TT, Ferreri AJ et al. Report of an international workshop to standardize baseline evaluation and response criteria for primary CNS lymphoma. J Clin Oncol 2005; 23 : 5034–5043.
18. Hrudková M, Belada D, Smolej L, Žák P, Malý J. Primární lymfomy centrálního nervového systému. Vnitř Lék 2010; 56 : 795–800.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2012 Číslo 12- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Péče o trvalé vstupy pacientů na domácí parenterální výživě – editorial
- Pozor na „přírodní“ léčbu – játra mohou trpět! – editorial
- Výsledky léčby AL-amyloidózy léčebnými režimy obsahujícími bortezomib, dexametazon a dále cyklofosfamid anebo doxorubicin
- Je protidoštičková liečba vždy účinná?
- Naše zkušenosti s léčbou primárních lymfomů centrálního nervového systému
- Artériová hypertenzia v gravidite – rizikový faktor kardiovaskulárnych ochorení
- Současný pohled na dnu, její diagnostiku a léčbu
- Primární řasinky buněk kardiovaskulárního aparátu
- Změny na úrovni populace zaměřené na podporu kardiovaskulárního zdraví
- Péče o tunelizované žilní katétry u nemocných na domácí parenterální výživě podle současných doporučení
- Toxická hepatitída po Polygonum multiflorum
- Používání koncentrátu protrombinového komplexu brzdí terapeutický nihilismus
- Oznámení o konání XXXII. Dnů mladých internistů
- Seznam členů výboru Slovenskej internistickej spoločnosti na roky 2011–2014
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Péče o trvalé vstupy pacientů na domácí parenterální výživě – editorial
- Artériová hypertenzia v gravidite – rizikový faktor kardiovaskulárnych ochorení
- Současný pohled na dnu, její diagnostiku a léčbu
- Péče o tunelizované žilní katétry u nemocných na domácí parenterální výživě podle současných doporučení
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



