-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Primární řasinky buněk kardiovaskulárního aparátu
Primary cilia of cells of cardiovascular apparatus
The primary cilium is a mechanosensory, solitary, non-motile microtubule-based structure that in the quiescent phase of the cell cycle projects from the surface of the majority of human cells, including embryonal, stem and mesenchymal cells, fibroblasts, myoblasts, cardiomyocytes, vascular smooth muscle and endothelial cells. Primary cilia are in increased frequency also present on the surface of endothelial cells in atherosclerotic predilection sites, lipoid streaks and dots and atheromatous plaques. The primary cilium is formed from the mother centriole. Primary cilia are currently studied in mechanobiology of cardiovascular apparatus and their role in cell migration, cell cycle control and atherogenesis. The aim of this paper is to provide a review of the current knowledge on the primary cilia of cells of cardiovascular apparatus.
Key words:
primary cilia – cardiomyocytes – endothelial cells – vascular smooth muscle cells – atherosclerosis
Autoři: J. Dvořák 1
; V. Sitorová 2; D. H. Nikolov 2; J. Mokrý 3; I. Richter 4,5; S. Filip 1; A. Ryška 2; J. Petera 1
Působiště autorů: Klinika onkologie a radioterapie Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MUDr. Jiří Petera, Ph. D. 1; Fingerlandův ústav patologie Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MUDr. Aleš Ryška, Ph. D. 2; Ústav histologie a embryologie Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MUDr. Jaroslav Mokrý, Ph. D. 3; Oddělení klinické onkologie Krajské nemocnice Liberec, a. s., Liberec, přednosta prim. MUDr. Jiří Bartoš, MBA 4; Lékařská fakulta UK a FN Hradec Králové, děkan prof. MUDr. RNDr. Miroslav Červinka, CSc. 5
Vyšlo v časopise: Vnitř Lék 2012; 58(12): 938-942
Kategorie: Přehledný referát
Souhrn
Primární řasinka je mechanosenzorická, solitární, nepohyblivá, mikrotubulární struktura, která se v klidové části buněčného cyklu vyskytuje na povrchu většiny lidských buněk, včetně buněk embryonálních, kmenových, mezenchymálních, fibroblastů, myoblastů, kardiomyocytů, hladkých svalových buněk (leiomyocytů) cévní stěny a buněk endotelu. Primární řasinky se ve zvýšené frekvenci nacházejí i na povrchu buněk endotelu v predilekčních místech aterosklerózy, lipoidních proužků a skvrn a ateromových plátů. Bazálním tělískem primární řasinky je mateřský centriol. V současné době se studuje význam primárních řasinek v mechanobiologii kardiovaskulárního aparátu a jejich vztah k migraci buněk, kontrole buněčného cyklu a aterogenezi. Tématem tohoto přehledového sdělení jsou současné poznatky o primárních řasinkách buněk kardiovaskulárního aparátu.
Klíčová slova:
primární řasinky – kardiomyocyty – buňky endotelu – hladké svalové buňky (leiomyocyty) cévní stěny – aterosklerózaÚvod
Primární řasinka je mechanosenzorická, solitární, nepohyblivá, mikrotubulární struktura, která se v klidové části buněčného cyklu nachází na povrchu většiny lidských buněk (obr. 1), včetně buněk stromatu nádorů. Bazálním tělískem primární řasinky je mateřský centriol [1]. Na povrchu většiny typů epitelových nádorů se primární řasinka nenachází. Přítomnost primární řasinky na povrchu buňky je přechodná: vyskytuje se v klidové fázi G1 (G0) a na počátku S fáze buněčného cyklu, před vstupem nebo v průběhu G2 fáze buněčného cyklu se resorbuje. Po ukončení mitózy centrosom (oba centrioly s pericentriolárním materiálem) migruje k povrchu buňky, kde se mateřský centriol diferencuje v bazální tělísko, které slouží jako nukleační centrum mikrotubulů primární řasinky [2]. Po většinu doby interfáze je centrosom lokalizován při povrchu buňky pod buněčnou membránou, kde jeho mateřský centriol, dočasně diferencovaný na bazální tělísko, slouží jako nukleační centrum mikrotubulů axonematu senzorické primární řasinky. Před zahájením mitózy se mikrotubuly primární řasinky depolymerizují. Tím se uvolní bazální tělísko/mateřský centriol a centrosom se může přemístit k jádru buňky, aby mohla být zahájena mitóza [3]. Typicky je délka primárních řasinek i podíl buněk s primárními řasinkami v populaci větší ve statických než v proliferujících buněčných populacích [4].
Obr. 1. Primární řasinka barvená červeně značenou protilátkou proti acetylovanemu α tubulinu na povrchu buňky mezotelu viscerálního epitelu epikardu srdce (označena žlutou šipkou). Jádra buněk barvená modře (DAPI). Zvětšení 1 000krát. 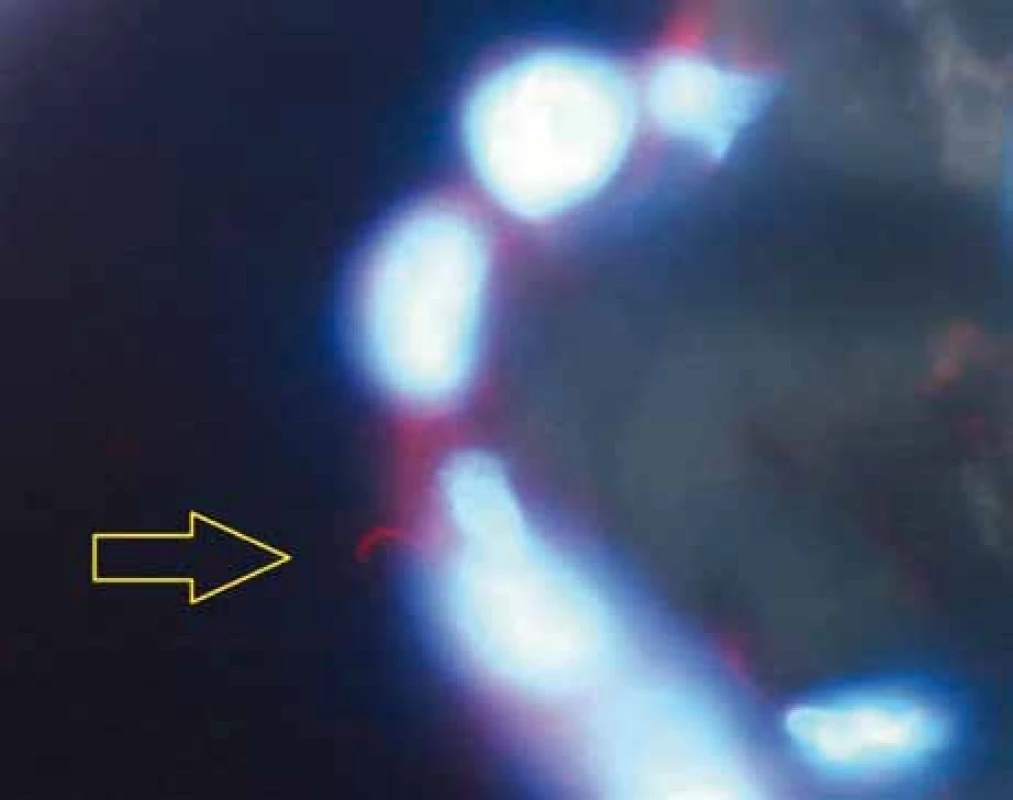
V primárních řasinkách různých typů buněk jsou přítomny různé typy iontových kanálů a receptorů, včetně receptorů destičkového růstového faktoru (platelet derived growth factor receptor – PDGFR) [5] a růstového faktoru podobnému inzulinu (insulin-like growth factor receptor – IGFR) [6]. V primární řasince jsou aktivní signální dráhy Hedgehog a Wnt. K poruše těchto signálních drah může dojít nejen poruchou genů nebo proteinů těchto signálních drah, ale i poruchou tvorby, struktury nebo funkcí primárních řasinek [7]. U těch typů lidských buněk, které mají primární řasinku – tedy u naprosté většiny buněk, je signální dráha Hedgehog aktivní výlučně právě jen v primární řasince. Signalizace Hedgehog může probíhat i v buňkách bez primární řasinky, ale primární řasinka tuto signalizaci výrazně zesiluje. Primární řasinky koordinují signalizaci Hedgehog při diferenciaci kardiomyocytů a v průběhu časné kardiogeneze. V experimentu na myších embryích měly poruchy primárních řasinek za následek vývojové srdeční vady [8].
Primární řasinky byly prokázány na povrchu buněk embryonálních [9], kmenových [10], mezenchymálních [11], fibroblastů [12], myoblastů [9], kardiomyocytů [9], buněk endotelu [13,14] a hladkých svalových buněk (leiomyocytů) aorty [15–17]. Primární řasinky se ve zvýšené frekvenci nacházejí i na povrchu buněk endotelu v predilekčních místech aterosklerózy [18], lipoidních proužků a skvrn [14] a ateromových plátů [13].
Poruchy tvorby, struktury nebo funkcí primárních řasinek se studují u několika desítek onemocnění, včetně některých vývojových vad [19], aterosklerózy [14–17], hypertenze [20] a některých typů obezity [21,22]. Porucha primárních řasinek lokalizovaných na ventrálním povrchu primitivního Hensenova uzlu lidského embrya, který se vytváří ve 3. týdnu vývoje embrya, zodpovídá za situs inversus [23,24].
Tématem tohoto přehledového sdělení jsou současné poznatky o primárních řasinkách buněk kardiovaskulárního aparátu.
Historie studia primární řasinky
Primární řasinka byla objevena ve 2. polovině 19. století postupně několika autory u buněk různých organizmů. V roce 1898 švýcarský anatom Zimmermann jako první tuto strukturu popsal u savců včetně člověka, předpověděl její senzorickou funkci a nazval ji centrální bičík (Zentralgeissel) [25]. Zimmermannovy správné závěry však byly zapomenuty.
Tato struktura byla znovu objevena v roce 1962 v období elektronové mikroskopie americkým autorem Sorokinem [26]. V elektronmikroskopické studii buněk epitelu dýchacích cest trachey a hlavních bronchů embrya krys Sorokin pozoroval, že acentriolární tvorbě několika set pohyblivých řasinek na povrchu řasinkové buňky o několik dní předchází dočasná tvorba solitární nepohyblivé řasinky, kterou nazval primární. Na základě této Sorokinovy práce se rozšířil název primární řasinka pro tuto strukturu i u všech ostatních typů buněk [27]. Dnes je známo, že přechodná tvorba primárních řasinek v určité fázi vývoje buňky je poměrně vzácná. Kromě řasinkových buněk epitelu dýchacích cest k dočasné tvorbě primárních řasinek dochází ještě např. u acinárních buněk pankreatu [28] a preadipocytů [29]. U většiny typů buněk se primární řasinky vytvářejí v klidové části buněčného cyklu ve všech fázích jejich vývoje. V období renesance zájmu o solitární ciliogenezi ve 2. polovině 20. století Zimmermannovy práce zpočátku nebyly citovány, později byly citovány, ale nebyly čteny.
V dnešní době se sice uznává, že terminologicky je pravděpodobně výstižnější a obecnější původní název této struktury z 19. století centrální bičík, který popisuje polohu této struktury, která je u buněk epitelu lokalizována obvykle v centru apikálního povrchu, včetně řasinkových buněk epitelu dýchacích cest [28], nicméně vžitým názvem zůstává americký termín primární řasinka. V 70. letech 20. století studovali primární řasinky i čeští autoři – Kraus, Martínek a Jirsová [30,31]. Z historického hlediska je zajímavé, že tato struktura nebyla po dobu více než 110 let uváděna v učebnicích, neboť nebyla považována za důležitou. V současné době je studium primární řasinky jednou z nejbouřlivěji se vyvíjejících oblastí buněčné biologie.
Typy řasinek
Fliegauf rozděluje řasinky na 4 typy: „klasické“ pohyblivé, s 9 páry vnějších mikrotubulů a 2 páry vnitřních mikrotubulů axonematu řasinky (uspořádání 9 + 2), nodální pohyblivé (9 + 0), nepohyblivé řasinky vláskových buněk (9 + 2) a nepohyblivé původně definované primární monocilie (9 + 0), kam spadají i cilie fotoreceptorů [32]. V současné době je známo, že každý typ řasinek obsahuje určité typy receptorů. Každý typ řasinek je proto do určité míry senzorický [33]. Jako primární řasinky se v současné době obvykle označují solitární řasinky (9 + 0), jejichž nukleačním centrem je transformovaný mateřský centriol centrosomu, čemuž dle Fliegaufovy klasifikace odpovídají nodální pohyblivé (9 + 0) a nepohyblivé monocilie (9 + 0), včetně cilií fotoreceptorů.
Mechanosenzorická funkce primárních řasinek buněk endotelu
Smykové napětí (shear stress) je třecí síla proudící krve, vztažená na jednotku plochy cévního povrchu, měřená v pascalech [19]. První studií, která prokázala, že primární řasinky endotelu reagují na změnu smykového napětí proudící tekutiny, byla studie na kultuře lidských endotelových buněk pupečníkové žíly (human umbilical vein endothelial cells – HUVEC). V této studii bylo pozorováno, že při zvýšení smykového napětí se primární řasinky endotelu resorbují [34]. Typická délka lidských primárních řasinek buněk endotelu činí 2,5 μm [19]. Průměr primárních řasinek všech typů buněk je stejný, 0,2 μm. Jsou popsány mezidruhové rozdíly v délce primárních řasinek buněk endotelu, jež je nepřímo úměrná velikosti smykového napětí. U kuřecího embrya, s délkou primárních řasinek buněk endotelu 5 μm [35], bylo naměřeno maximální smykové napětí 5 Pa [36], zatímco u embrya a dospělé myši s délkou primárních řasinek buněk endotelu 2 μm [18,37] bylo naměřeno maximální smykové napětí 14 Pa [38]. Na regulaci délky primárních řasinek se podílí intracelulární hladina Ca2+: snížení intracelulární hladiny Ca2+ aktivuje proteinkinázu A, což vede k prodloužení primárních řasinek epitelových a mezenchymálních buněk [19,39]. V primárních řasinkách buněk endotelu arterií se vyskytují dopaminové receptory typu 5. V experimentu na buněčné kultuře endotelu myších arterií bylo pozorováno, že podání dopaminu vede k prodloužení primárních řasinek. Naopak vyřazení dopaminových receptorů na primárních řasinkách má za následek ztrátu jejich mechanosenzorické funkce [40]. Primární řasinky mohou reagovat již na smykové napětí 0,0007 Pa [19]. Buňky endotelu bez primárních řasinek také odpovídají na změny smykového napětí řadou mechanizmů, ale méně účinně než buňky endotelu s primárními řasinkami [19,41].
Primární řasinky buněk endotelu se v průběhu embryonálního vývoje, i v dospělém věku, nacházejí v oblastech s nízkým smykovým napětím nebo turbulentním prouděním krve. Byla pozorována korelace mezi nízkým smykovým napětím nebo turbulentním prouděním krve, nízkou hladinou transkripčníno faktoru (Krüppel-like factor 2 – KLF2) v buňkách endotelu a přítomností primárních řasinek u těchto buněk endotelu [35,42]. Naopak nebyly pozorovány primární řasinky v oblastech s vysokým smykovým napětím a vysokou hladinou KLF2 v buňkách endotelu [19,43].
V dospělosti se primární řasinky nacházejí v predilekčních místech aterosklerózy, ve kterých je smykové napětí malé nebo proudění krve turbulentní [18]. Ve studii na myších se primární řasinky endotelu v predilekčních místech aterosklerózy vyskytovaly ve frekvenci 1 buňka endotelu s primární řasinkou na 3 buňky endotelu bez primární řasinky. Tyto primární řasinky dosahovaly délky 1–2 μm a směřovaly endoluminálně [18].
Mechanosenzorická funkce primárních řasinek je bifazická [12]. Proud krve vyvolá ohyb primární řasinky, který prostřednictvím polycystinových kalciových kanálů, lokalizovaných v primární řasince, vede k přechodnému vstupu Ca2+ do buňky v řádu sekund a tím iniciuje komplexní intracelulární biochemickou kaskádu, která zahrnuje kalcium, calmodulin, proteinkinázu B a proteinkinázu C, která vede k syntéze oxidu dusnatého [44]. Oxid dusnatý způsobuje účinkem na buňky hladkého svalstva cév vazodilataci. Kromě toho ohyb primární řasinky zprostředkovává mechanotransdukci do celé buňky. To je umožněno tím, že nukleačním centrem mikrotubulů axonematu primární řasinky je transformovaný mateřský centriol centrosomu, který je mikrotubuly organizujícím centrem, ze kterého vyrůstají mikrotubuly do celé buňky a mikrotubuly jsou spojeny s ostatními složkami cytoskeletu [18]. Mechanotransdukce cytoskeletu vede k prodlouženému účinku na expresi genů reagujících na napětí (shear-responsive genes), jako je transkripční faktor KLF2 a KLF4 [12].
Primární řasinky buněk endotelu embryonálního srdce
V embryonálním srdci se oblast s vysokým smykovým napětím nachází v místě endokardových polštářků, ve kterých se nepřítomnost primárních řasinek buněk endotelu shoduje s oblastmi endotelo-mezenchymálního přechodu [12]. Buňky endotelu endokardových polštářků procházejí procesem endotelo-mezenchymálního přechodu, v průběhu kterého se transdiferencují, získávají mezenchymální fenotyp a migrují do srdečního rosolu, kde vytvářejí základ srdečních chlopní. Vysoké smykové napětí spouští endotelo-mezenchymální přechod u buněk endotelu bez primárních řasinek, nikoliv však u buněk s primárními řasinkami [12].
Primární řasinky buněk endotelu fibrózních a ateromových plátů aorty
V elektronmikroskopické studii byl hodnocen výskyt primárních řasinek buněk endotelu v oblasti oblouku aorty. Vzorky byly odebrány při pitvě, do 3 hod po náhlém úmrtí, od 3 lidí ve věku 50–60 let [13]. Primární řasinky byly pozorovány na buňkách zdravého endotelu, endotelu fibrózních a ateromových plátů. Rozdíl byl ve frekvenci výskytu a v orientaci primárních řasinek. Primární řasinky na povrchu buněk zdravého endotelu a endotelu fibrózních plátů byly přítomny pouze u 20 % vyšetřených buněk. Dvě třetiny těchto primárních řasinek vyrůstaly z apikálního povrchu buněk endotelu směrem do lumina a pouze 1/3 primárních řasinek vyrůstala z bazálního povrchu buněk endotelu směrem subendotelově. Na povrchu buněk endotelu ateromových plátů však byly primární řasinky přítomny u více než 90 % vyšetřených buněk a všechny vyrůstaly z bazálního povrchu buněk endotelu směrem subendotelově. Dle autorů studie je zvýšená frekvence výskytu primárních řasinek a zejména jejich výskyt na bazálním povrchu charakteristickým rysem buněk endotelu ateromového plátu [13].
Tato studie je ve shodě se studií, ve které byly elektronovým mikroskopem pozorovány primární řasinky na povrchu buněk endotelu lipoidních proužků a skvrn lidské aorty, které směřovaly z apikálního povrchu buněk endotelu směrem do lumina aorty [14].
Primární řasinky hladkých svalových buněk (leiomyocytů) cévní stěny
Primární řasinky leiomyocytů aorty byly poprvé popsány v 80. letech 20. století [16,17]. V elektronmikroskopické studii a imunofluorescenčním vyšetření konfokálním optickým mikroskopem s 3D rekonstrukcí buněk leiomyocytů tunica media aorty myší bylo pozorováno, že primární řasinky leiomyocytů, oproti očekávání, neodstupují kolmo k průsvitu aorty či zevnímu povrchu stěny aorty, ale na příčném řezu aortou preferují orientaci 58,3° směrem dovnitř stěny. Toto naklonění primárních řasinek může souviset s pohyby leiomyocytů při formování a růstu cév. Délka těchto primárních řasinek činí 3–5 µm a 92 % (78 z 86 vyšetřených) primárních řasinek je ohnutých [15]. Primární řasinky byly popsány i v leiomyocytech aorty lipoidních proužků a skvrn králíků [16] a člověka [17].
V kultuře leiomyocytů jsou primární řasinky orientovány náhodně. Pokud však v experimentu byla pipetou vytvořena rýha (scratch-wound) napříč touto buněčnou kulturou a buňky po 3,5–5,5 hod byly fixovány a imunofluorescenčně vyšetřeny, většina primárních řasinek na okraji rýhy byla orientována směrem k této mezeře. V tomto experimentu 88,3 % (152 ze 172 vyšetřených) primárních řasinek leiomyocytů na okraji rýhy bylo orientováno směrem do této rýhy. Tato redistribuce orientace primárních řasinek leiomyocytů může mít význam v jejich cílené buněčné migraci a hojení ran [15]. Podobný jev byl v minulosti popsán i u primárních řasinek fibroblastů [45]. V primárních řasinkách leiomyocytů byla prokázána přítomnost polycystinu-1, polycystinu-2 a integrinu α3β1. Pokud byl experiment s kulturou leiomyocytů proveden s přidáním protilátky proti integrinu α3β1, byla reorientace primárních řasinek směrem do rýhy statisticky významně snížena na 29 % (34 ze 116 vyšetřených) primárních řasinek. Toto snížení reorientace primárních řasinek při blokování integrinu α3β1 může znamenat, že alespoň zčásti je tato reorientace zprostředkována interakcí integrinu α3β1 na primární řasince a extracelulárního prostředí. Pokud byl tento experiment proveden s přidáním chloralhydrátu, který vede ke ztrátě primárních řasinek bez současného poškození buněk, leiomyocyty bez primárních řasinek migrovaly směrem do rýhy statisticky významně pomaleji než buňky s primárními řasinkami. To ukazuje na roli primárních řasinek pro migraci leiomyocytů směrem k poranění [15].
Závěr
V posledních letech v mezinárodní literatuře exponenciálně přibývá publikací o patofyziologickém významu poruch tvorby, struktury a funkcí primárních řasinek při vzniku řady vývojových vad a onemocnění, od vzácných multiorgánových syndromů až po nejčastější civilizační onemocnění, jako je ateroskleróza, hypertenze a obezita. Studuje se role primárních řasinek v mechanobiologii kardiovaskulárního aparátu a jejich vztah k migraci buněk a kontrole buněčného cyklu. První skupinou léků, která v rámci klinických studií, prozatím v onkologických indikacích, cílí na signální dráhu, která je aktivní v primárních řasinkách, jsou inhibitory signální dráhy Hedgehog.
Práce byla podpořena výzkumným úkolem UK-LF HK: PRVOUK P37/06.
doc. MUDr. Josef Dvořák, Ph.D.
www.fnhk.cz
e-mail: dvorakj@fnhk.cz
Doručeno do redakce: 12. 6. 2012
Přijato po recenzi: 26. 9. 2012
Zdroje
1. Satir P, Pedersen LB, Christensen ST. The primary cilium at a glance. J Cell Sci 2010; 123 : 499–503.
2. Plotnikova OV, Golemis EA, Pugacheva EN. Cell cycle-dependent ciliogenesis and cancer. Cancer Res 2008; 68 : 2058–2061.
3. Dvořák J, Sitorová V, Hadži Nikolov D et al. Primary cilium – antenna-like structure on the surface of most mammalian cell types. J Phys Conf Ser 2011; 329 : 12–22.
4. Pugacheva EN, Jablonski SA, Hartman TRm Henske EP, Golemis EA. HEF1-dependent Aurora A activation induces disassembly of the primary cilium. Cell 2007; 129 : 1351–1363.
5. Dvořák J, Sitorová V, Hadži Nikolov D et al. Primární řasinky a jejich biologické funkce. Onkologie 2011; 5 : 234–238.
6. Zhu D, Shi S, Wang H, Liao K. Growth arrest induces primary-cilium formation and sensitizes IGF-1-receptor signaling during differentiation induction of 3T3-L1 preadipocytes. J Cell Sci 2009; 122 : 2760–2768.
7. Jenkins D. Hedgehog signalling: emerging evidence for non-canonical pathways. Cell Signal 2009; 21 : 1023–1034.
8. Clement CA, Kristensen SG, Møllrd K et al. The primary cilium coordinates early cardiogenesis and hedgehog signaling in cardiomyocyte differentiation. J Cell Sci 2009; 122 : 3070–3082.
9. Myklebust R, Engedal H, Saetersdal TS, Ulstein M. Primary 9 + 0 cilia in the embryonic and the adult human heart. Anat Embryol (Berl) 1977; 151 : 127–139.
10. Schatten H, Sun QY. The significant role of centrosomes in stem cell division and differentiation. Microsc Microanal 2011; 17 : 506–512.
11. Proulx-Bonneau S, Annabi B. The primary cilium as a biomarker in the hypoxic adaptation of bone marrow-derived mesenchymal stromal cells: a role for the secreted frizzled-related proteins. Biomark Insights 2011; 6 : 107–118.
12. Egorova AD, Khedoe PP, Goumans MJ et al. Lack of primary cilia primes shear-induced endothelial-to-mesenchymal transition. Circ Res 2011; 108 : 1093–1101.
13. Bystrevskaya VB, Lichkun VV, Antonov AS, Perov NA. An ultrastructural study of centriolar complexes in adult and embryonic human aortic endothelial cells. Tissue Cell 1988; 20 : 493–503.
14. Haust MD. Endothelial cilia in human aortic atherosclerotic lesions. Virchows Arch A Pathol Anat Histopathol 1987; 410 : 317–326.
15. Lu CJ, Du H, Wu J et al. Non-random distribution and sensory functions of primary cilia in vascular smooth muscle cells. Kidney Blood Press Res 2008; 31 : 171–184.
16. Haust MD. Ciliated smooth muscle cells in aortic atherosclerotic lesions of rabbit. Atherosclerosis 1984; 50 : 283–293.
17. Haust MD. Ciliated smooth muscle cells in atherosclerotic lesions of human aorta. Am J Cardiovasc Pathol 1987; 1 : 115–129.
18. Van der Heiden K, Hierck BP, Krams R et al. Endothelial primary cilia in areas of disturbed flow are at the base of atherosclerosis. Atherosclerosis 2008; 196 : 542–550.
19. Van der Heiden K, Egorova AD, Poelmann RE, Wentzel JJ, Hierck BP. Role for primary cilia as flow detectors in the cardiovascular system. Int Rev Cell Mol Biol 2011; 290 : 87–119.
20. Nauli SM, Jin X, Hierck BP. The mechanosensory role of primary cilia in vascular hypertension. Int J Vasc Med 2011; 2011 : 276–281.
21. Berbari NF, Lewis JS, Bishop GA, Askwith CC, Mykytyn K. Bardet-Biedl syndrome proteins are required for the localization of G protein--coupled receptors to primary cilia. Proc Natl Acad Sci U S A 2008; 105 : 4242–4246.
22. Davenport JR, Watts AJ, Roper VC et al. Disruption of intraflagellar transport in adult mice leads to obesity and slow-onset cystic kidney disease. Curr Biol 2007; 17 : 1586–1594.
23. Nonaka S, Shiratori H, Saijoh Y, Hamada H. Determination of left-right patterning of the mouse embryo by artificial nodal flow. Nature 2002; 418 : 96–99.
24. Leigh MW, Pittman JE, Carson JL et al. Clinical and genetic aspects of primary ciliary dyskinesia/Kartagener syndrome. Genet Med 2009; 11 : 473–487.
25. Zimmermann KW. Beiträge zur Kenntniss einiger Drüsen und Epithelien. Arch Mikrosk Anat 1898; 52 : 552–706.
26. Sorokin S. Centrioles and the formation of rudimentary cilia by fibroblasts and smooth muscle cells. J Cell Biol 1962; 15 : 363–377.
27. Sorokin SP. Reconstructions of centriole formation and ciliogenesis in mammalian lungs. J Cell Sci 1968; 3 : 207–230.
28. Seeley ES, Nachury MV. The perennial organelle: assembly and disassembly of the primary cilium. J Cell Sci 2010; 123 : 511–518.
29. Marion V, Stoetzel C, Schlicht D et al. Transient ciliogenesis involving Bardet-Biedl syndrome proteins is a fundamental characteristic of adipogenic differentiation. Proc Natl Acad Sci U S A 2009; 106 : 1820–1825.
30. Kraus MJ, Jirsová Z. A contribution to the solitary ciliogenesis. Folia Morphol (Praha) 1973; 21 : 265–268.
31. Martínek J, Kraus R, Jirsová Z. Differentiation and occurrence of the individual cilium. In: Dvořák M (ed.) Biogenesis of Cell Organelles. Acta Facultatis Medicae Universitatis Brunensis 1974; 49 : 261–263.
32. Fliegauf M, Benzing T, Omran H. When cilia go bad: cilia defects and ciliopathies. Nat Rev Mol Cell Biol 2007; 8 : 880–893.
33. Bloodgood RA. Sensory reception is an attribute of both primary cilia and motile cilia. J Cell Sci 2010; 123 : 505–509.
34. Iomini C, Tejada K, Mo W, Vaananen H, Piperno G. Primary cilia of human endothelial cells disassemble under laminar shear stress. J Cell Biol 2004; 164 : 811–817.
35. Van der Heiden K, Groenendijk BC, Hierck BP et al. Monocilia on chicken embryonic endocardium in low shear stress areas. Dev Dyn 2006; 235 : 19–28.
36. Vennemann P, Kiger KT, Lindken R et al. In vivo micro particle image velocimetry measurements of blood-plasma in the embryonic avian heart. J Biomech 2006; 39 : 1191–1200.
37. Poelmann RE, Van der Heiden K, Gittenberger-de Groot A, Hierck BP. Deciphering the endothelial shear stress sensor. Circulation 2008; 117 : 1124–1126.
38. Cheng C, Helderman F, Tempel D et al. Large variations in absolute wall shear stress levels within one species and between species. Atherosclerosis 2007; 195 : 225–235.
39. Besschetnova TY, Kolpakova-Hart E, Guan Y et al. Identification of signaling pathways regulating primary cilium length and flow-mediated adaptation. Curr Biol 2010; 20 : 182–187.
40. Abdul-Majeed S, Nauli SM Dopamine receptor type 5 in the primary cilia has dual chemo - and mechano-sensory roles. Hypertension 2011; 58 : 325–331.
41. Ando J, Yamamoto K. Vascular mechanobiology: endothelial cell responses to fluid shear stress. Circ J 2009; 73 : 1983–1992.
42. Slough J, Cooney L, Brueckner M. Monocilia in the embryonic mouse heart suggest a direct role for cilia in cardiac morphogenesis. Dev Dyn 2008; 237 : 2304–2314.
43. Groenendijk BC, Hierck BP, Gittenberger-De Groot AC, Poelmann RE. Development-related changes in the expression of shear stress responsive genes KLF-2, ET-1, and NOS-3 in the developing cardiovascular system of chicken embryos. Dev Dyn 2004; 230 : 57–68.
44. AbouAlaiwi WA, Takahashi M, Mell BR et al. Ciliary polycystin-2 is a mechanosensitive calcium channel involved in nitric oxide signaling cascades. Circ Res 2009; 104 : 860–869.
45. Katsumoto T, Higaki K, Ohno K, Onodera K. The orientation of primary cilia during the wound response in 3Y1 cells. Biol Cell 1994; 81 : 17–21.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2012 Číslo 12- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Nech brouka žít… Ať žije astma!
- Intermitentní hladovění v prevenci a léčbě chorob
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Péče o trvalé vstupy pacientů na domácí parenterální výživě – editorial
- Pozor na „přírodní“ léčbu – játra mohou trpět! – editorial
- Výsledky léčby AL-amyloidózy léčebnými režimy obsahujícími bortezomib, dexametazon a dále cyklofosfamid anebo doxorubicin
- Je protidoštičková liečba vždy účinná?
- Naše zkušenosti s léčbou primárních lymfomů centrálního nervového systému
- Artériová hypertenzia v gravidite – rizikový faktor kardiovaskulárnych ochorení
- Současný pohled na dnu, její diagnostiku a léčbu
- Primární řasinky buněk kardiovaskulárního aparátu
- Změny na úrovni populace zaměřené na podporu kardiovaskulárního zdraví
- Péče o tunelizované žilní katétry u nemocných na domácí parenterální výživě podle současných doporučení
- Toxická hepatitída po Polygonum multiflorum
- Používání koncentrátu protrombinového komplexu brzdí terapeutický nihilismus
- Oznámení o konání XXXII. Dnů mladých internistů
- Seznam členů výboru Slovenskej internistickej spoločnosti na roky 2011–2014
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Péče o trvalé vstupy pacientů na domácí parenterální výživě – editorial
- Artériová hypertenzia v gravidite – rizikový faktor kardiovaskulárnych ochorení
- Současný pohled na dnu, její diagnostiku a léčbu
- Péče o tunelizované žilní katétry u nemocných na domácí parenterální výživě podle současných doporučení
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



