-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Snížení srdeční frekvence u srdečního selhání: změny funkce levé komory a kvalita života v podstudiích SHIFT
Effects of selective heart rate reduction with ivabradine on left ventricular remodelling and health related quality of life: results from the SHIFT substudies
The SHIFT study showed a positive effect of ivabradine in patients with chronic heart failure, sinus rhythm and heart rate at rest above 70 beats per minute. The aim of the first sub-study was to ascertain the effect of ivabradine on changes to the left ventricle function using echocardiography; ivabradine significantly increased ejection fraction of the left ventricle and reduced terminal left ventricular end-systolic and end-diastolic volumes. The second sub-study explored changes to the quality of life in patients treated with ivabradine or placebo. This study also showed statistically significantly improved quality of life after treatment with ivabradine. Both sub-studies confirmed the positive effect of ivabradine on patients with optimal treatment of heart failure, including maximum tolerated dose of beta-blockers and sinus heart rate above 70/min.
Key words:
ivabradine – echocardiography – quality of life – heart failure
Autori: J. Vítovec 1; L. Špinarová 1; J. Špinar 2
Pôsobisko autorov: I. interní kardioangiologická klinika Lékařské fakulty MU a FN u sv. Anny Brno – ICRC, přednosta prof. MUDr. Jiří Vítovec, CSc., FESC 1; Interní kardiologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jindřich Špinar, CSc., FESC 2
Vyšlo v časopise: Vnitř Lék 2012; 58(7 a 8): 228-233
Kategória: 60. narozeniny prof. MUDr. Miroslava Součka, CSc.
Súhrn
Studie SHIFT ukázala příznivý účinek ivabradinu u nemocných s chronickým srdečním selháním, sinusovým rytmem a klidovou frekvencí nad 70 tepů/min. Cílem první podstudie bylo zjistit účinek ivabradinu na změny funkce levé komory pomocí echokardiografie, kde ivabradin významně zvýšil ejekční frakci levé komory a snížil konečné objemy levé komory na konci systoly i diastoly. Druhá podstudie zkoumala změny kvality života u nemocných léčených ivabradinem či placebem. I v této podstudii došlo po léčbě ivabradinem ke statisticky významnému zlepšení hodnocení kvality života. Obě podstudie potvrdily příznivý účinek ivabradinu u nemocných s optimální léčbou srdečního selhání, včetně maximální tolerované dávky beta-blokátorů a srdeční frekvencí sinusového rytmu nad 70 tepů/min.
Klíčová slova:
ivabradin – echokardiografie – kvalita života – srdeční selháníChronické srdeční selhání je časté, závažné a ekonomicky náročné onemocnění. Postihuje zhruba 2–3 % populace [1], v České republice je kvalifikovaně odhadováno 100 000 až 50 000 pacientů s chronickým srdečním selháním [2,3]. I při léčbě, která se za poslední 2 desetiletí podstatně zkvalitnila [4,5], je prognóza tohoto onemocnění stále špatná. Rozhodující je tedy vývoj nových terapeutických přístupů. Standardní farmakologická léčba zahrnuje beta-blokátory a antagonisty systému renin-angiotenzin-aldosteron (RAAS), event. diuretika [1,2]. Přidání beta--blokátorů snižuje morbiditu a mortalitu více než léčba samotnými antagonisty RAAS [6]. Dalším přínosem těchto léků při léčbě chronického srdečního selhání je zmírnění remodelace levé komory [7] a snížení výskytu náhlé smrti [8]. Tento přínos je dán, alespoň částečně, jejich účinky na snížení srdeční frekvence [9,10]. U chronického srdečního selhání může být snížení srdeční frekvence zvláště důležité – např. jako prevence vyčerpání energetických zásob myokardu [11].
V epidemiologických a observačních studiích se zvýšená klidová srdeční frekvence ukázala jako rizikový faktor mortality a kardiovaskulárních chorob [12,13]. Srdeční frekvence také přímo souvisí s rizikem mortality, kardiovaskulárního úmrtí a s hospitalizací pacientů se srdečním selháním [14]. Srdeční frekvence je však stále u většiny pacientů léčených beta-blokátory zvýšena [15], což představuje další důvod pro hledání nových terapeutických postupů.
Ivabradin je specifický inhibitor If proudu v sinoatriálním uzlu [16]. Na rozdíl od beta-blokátorů nemá ivabradin vliv na kontraktilitu myokardu ani na vedení vzruchu v srdci, dokonce ani u pacientů s narušenou systolickou funkcí [17]. Studie SHIFT (Systolic Heart failure treatment with the If inhibitor ivabradine Trial) byla navržena s cílem zhodnotit účinek ivabradinu, přidaného k terapii podle oficiálních doporučení, na kardiovaskulární výsledky, příznaky a kvalitu života pacientů s chronickým srdečním selháním a systolickou dysfunkcí (ejekční frakce levé komory – EF LK < 35 %), se sinusovým rytmem a srdeční frekvencí (SF) alespoň 70 tepů/min [18].
Studie SHIFT u 6 505 pacientů ukázala, že ivabradin přidaný k léčbě vedené podle oficiálních doporučení a podle medicíny založené na důkazech (prakticky všichni pacienti měli blokádu systému renin-angiotenzin-aldosteron a beta-blokátor) podstatně a statisticky významně snižuje hlavní rizika spojená se srdečním selháním [18]. U pacientů léčených ivabradinem kleslo relativní riziko výskytu primárního sledovaného parametru (kardiovaskulární mortalita nebo hospitalizace z důvodu zhoršení srdečního selhání) o 18 % v porovnání s podáváním placeba (p < 0,0001). Tento výsledek byl dán především příznivým vlivem na příhody související se srdečním selháním (úmrtí nebo hospitalizace z důvodu srdečního selhání), které ivabradin snížil oproti placebu o 26 % (p < 0,0001, resp. p < 0,014) (obr. 1), a byl zjevný již během prvních 3 měsíců po zahájení léčby a přetrval v průběhu celé studie. Účinek byl stejný u všech předem definovaných podskupin. SHIFT je první studií, která speciálně hodnotila účinek izolovaného snížení srdeční frekvence na stav pacientů se srdečním selháním. Léčba ivabradinem vedla ke snížení srdeční frekvence v průměru o 15 tepů/min ze vstupní hodnoty 80 tepů/min. Toto snížení se udrželo po celou dobu studie. V populaci studie SHIFT měli pacienti se srdeční frekvencí vyšší než medián zvýšené riziko vzniku příhod a dosáhli většího přínosu z léčby ivabradinem z hlediska snížení výskytu příhod než pacienti se srdeční frekvencí nižší než medián. To ukazuje, že srdeční frekvence hraje důležitou roli v patofyziologii srdečního selhání a že její korekce může ovlivňovat rozvoj choroby. Výskyt většiny kardiovaskulárních sledovaných parametrů (kardiovaskulární mortalita, hospitalizace z důvodu srdečního selhání, hospitalizace z jakékoli kardiovaskulární příčiny a sekundární sledovaný parametr složený z kardiovaskulární mortality, hospitalizace z důvodu srdečního selhání a nefatálního infarktu myokardu) se při podávání ivabradinu statisticky významně snížil. Fosfeny byly vzácné. Během celé studie nebyl zaznamenán žádný vliv na laboratorní hodnoty. Cílovou dávku ivabradinu 7,5 mg 2krát denně užívalo minimálně 70 % pacientů. Naopak pouze 49 % z 6 505 pacientů zařazených do studie bylo schopno užívat alespoň 50 % cílové dávky beta-blokátoru z důvodu kontraindikací nebo špatné snášenlivosti, i přes opakovaná doporučení řídicího výboru studie SHIFT. Důležité ovšem je, že dosažené dávky beta-blokátorů se obecně udržely po celou dobu studie. Toto zjištění odráží dobrou snášenlivost ivabradinu u pacientů s chronickým srdečním selháním, a naopak problémy se zahájením podávání nebo zvýšením dávky beta-blokátorů [18].
Obr. 1. Primární složený cíl ve studii SHIFT. 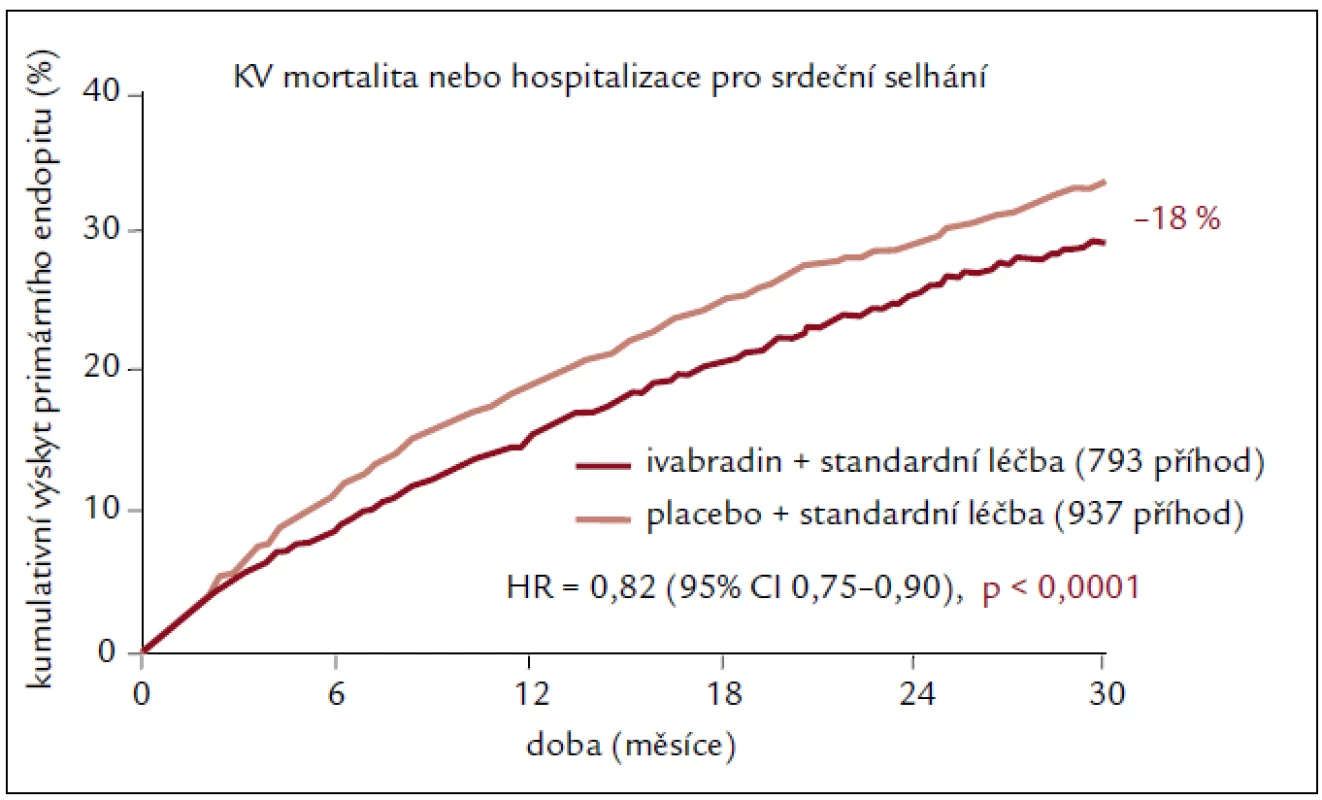
Podstudie echokardiografická
V patofyziologii srdečního selhání hraje důležitou roli remodelace srdce [19], která byla u pacientů se srdečním selháním potvrzena jako prognostický faktor. Ukázalo se, že zvětšení levé komory je spojeno se zvýšeným rizikem nežádoucích srdečních příhod [20], přičemž snížená ejekční frakce levé komory (EF LK) představuje spolehlivý prediktor vzniku kardiovaskulárních příhod a celkové mortality [21]. Účinky beta-blokády, inhibice angiotenzin konvertujícího enzymu (angiotensin-converting enzyme – ACE) a srdeční resynchronizační léčby spočívají mimo jiné i v příznivém ovlivnění remodelace srdce [19,22]. V rámci studie SHIFT byla proto předem plánovaná echokardiografická podstudie, jejímž cílem bylo zhodnotit účinky ivabradinu ve srovnání s placebem na remodelaci a funkci LK u 411 pacientů se srdečním selháním [23].
Výsledky echokardiografické podstudie prokazují u pacientů užívajících ivabradin regresi remodelace se statisticky významným zmenšením objemů LK a zvýšením EF LK po 8 měsících léčby. Léčba ivabradinem snížila index objemu LK na konci systoly (left ventricular end-systolic volume index – LVESVI) (primární sledovaný parametr) vs placebo [–7,0 ± 16,3 vs –0,9 ± 17,1 ml/m2; rozdíl (SE) –5,8 (1,6); 95% CI –8,8 až –2,7; p < 0,001]. Ivabradin zlepšil také index objemu LK na konci diastoly (–7,9 ± 18,9 vs –1,8 ± 19,0 ml/m2; p = 0,002) i EF LK (+2,4 ± 7,7 vs –0,1 ± 8,0 %; p < 0,001; obr. 2). Tyto příznivé účinky ivabradinu byly pozorovány ve všech předem specifikovaných podskupinách a nezávisely na vstupní hodnotě EF LK, etiologii srdečního selhání nebo léčbě beta-blokátory či blokátory RAAS, které užívalo více než 90 % pacientů. Cílem podstudie bylo také hledat spojitost mezi echokardiografickými parametry a klinickými kardiovaskulárními příhodami. Index objemu LK na konci systoly ≥ 59 ml/m2 při vstupu byl spojen s 62% zvýšením relativního rizika primárního sledovaného parametru studie SHIFT, kardiovaskulární mortality nebo hospitalizace pro zhoršení srdečního selhání ve srovnání s pacienty s LVESVI < < 59 ml/m2 (obr. 3). Kromě toho byl u pacientů s největším snížením LVESVI při léčbě zjištěn při následné kontrole početně nižší výskyt souhrnného sledovaného parametru studie SHIFT než u pacientů s menším snížením LVESVI. Výsledky podstudie jsou ve shodě se zjištěním, že krátkodobé účinky léků nebo přístrojové terapie na remodelaci jsou spojeny s dlouhodobým ovlivněním mortality. Navíc byla zjištěna statisticky významná, i když slabá negativní korelace mezi změnou srdeční frekvence a změnou EF LK, což znamená, že větší pokles srdeční frekvence během sledování byl spojen s větším zvýšením EF LK. Nález zlepšení funkce LK při léčbě ivabradinem prokazuje, že i při moderní léčbě srdečního selhání lze dosáhnout další regrese remodelace srdce a zpomalení progrese onemocnění [23,24].
Obr. 2. Změny LVESVI. Primární cíl echokardiografické podstudie SHIFT. 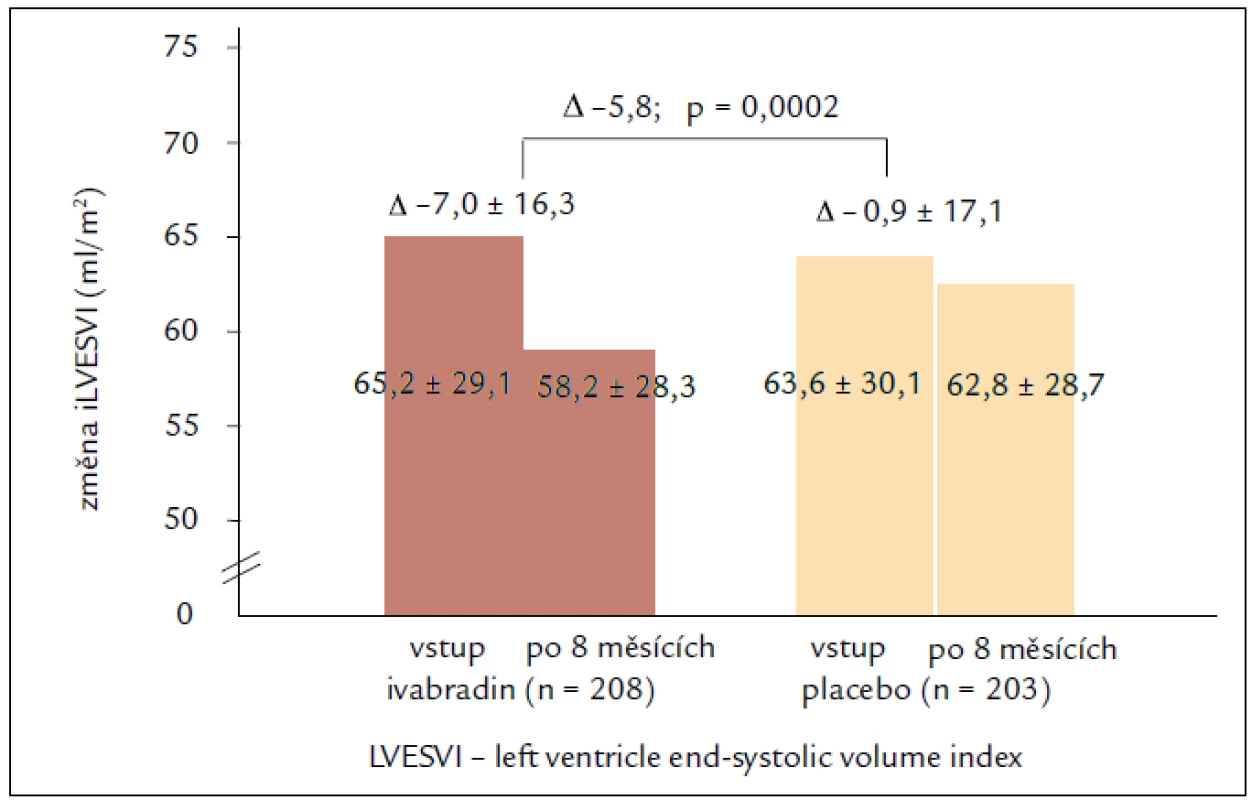
Obr. 3. Výskyt primárního složeného cíle. Závislost na průměrné hodnotě LVESVI v placebové větvi. 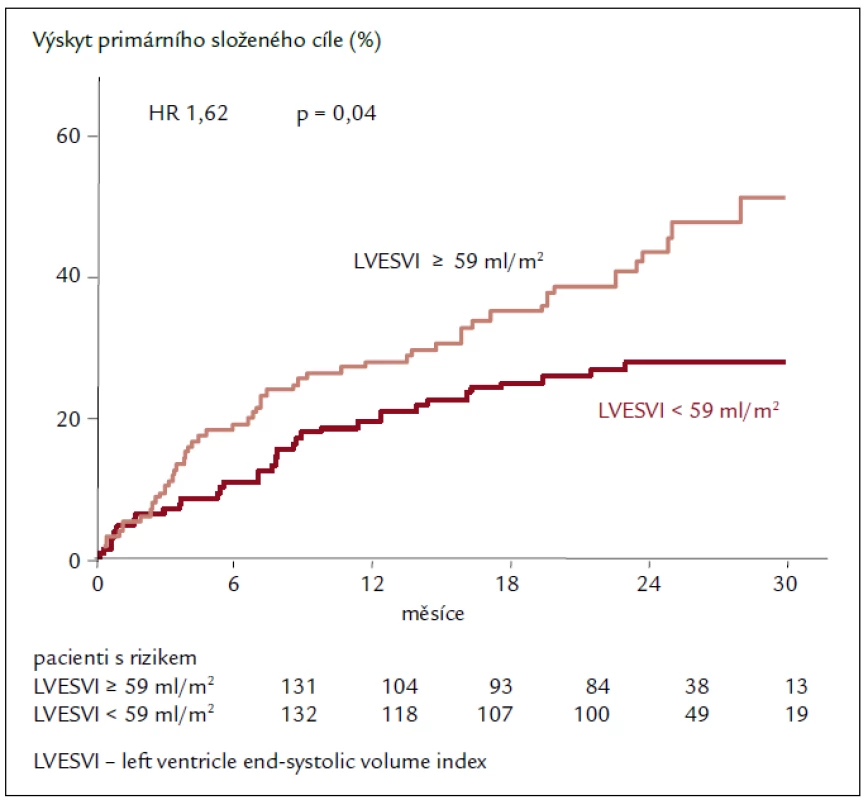
Podstudie změny kvality života
Srdeční selhání navíc významným způsobem ovlivňuje kvalitu života související se zdravotním stavem pacienta (health-related quality of life – HQoL), a to i ve srovnání s jinými chronickými onemocněními [1]. Nízké hodnoty HQoL jsou stále více spojovány s nepříznivou prognózou ve smyslu mortality a závažné morbidity [25,26]. Jednoznačných důkazů o vztahu mezi subjektivním pocitem pohody a různými objektivními kritérii, např. srdeční frekvencí (SF), je stále málo. Jednoznačné souvislosti se neprokazují snadno: pacienti uvádějí různé hodnoty HQoL s podobnými kritérii závažnosti onemocnění [27–29]. Zdravotní stav lze měřit pomocí objektivních a subjektivních kritérií. Objektivní kritéria umožňují definovat stupeň pacientova onemocnění, subjektivní hodnocení představuje vnímání skutečného zdravotního stavu samotným pacientem v podobě HQoL. To znamená, že 2 pacienti s naprosto stejným zdravotním stavem mohou v dotazníku HQoL uvést zcela odlišná skóre subjektivního stavu, očekávání i vnímání svého současného zdravotního stavu [30].
Výsledky studie SHIFT prokázaly, že snížení SF ivabradinem u pacientů se srdečním selháním vedlo také ke zlepšení subjektivní celkové kvality života (p = 0,0005) a funkční třídy NYHA (New York Heart Association; p = 0,001) [18]. Cílem této podstudie studie SHIFT bylo zhodnotit účinek ivabradinu na HQoL a zjistit, zda vstupní skóre HQoL souvisí s rizikem výskytu sledovaných parametrů a zda se změny SF pozorované při podávání ivabradinu mohou projevit v podobě příznivějších skóre HQoL současně s nižším výskytem příhod u nemocných s chronickým srdečním selháním a systolickou dysfunkcí [31]. Kvalita života související se zdravotním stavem se hodnotila pomocí dotazníku KCCQ (Kansas City Cardiomyopathy Questionnaire), který se vyplňoval při vstupním vyšetření, po 4, 12 a 24 měsících randomizované léčby a při posledním kontrolním vyšetření. Skóre z dotazníku KCCQ má přímo úměrný vztah, čím vyšší je skóre, tím lepší je subjektivně hodnocený zdravotní stav daného pacienta. Podstudie hodnotila 2 souhrnná skóre dotazníku KCCQ se stupnicí hodnot 0–100: celkové souhrnné skóre (overall summary score – OSS) představuje průměr skóre fyzického omezení, celkových symptomů, kvality života a sociálního omezení; klinické souhrnné skóre (clinical summary score – CSS) představuje průměr fyzického omezení a celkové skóre symptomové domény. V předem specifikované, prospektivní podstudii studie SHIFT u pacientů se systolickým chronickým srdečním selháním zlepšil ivabradin výsledky KCCQ o 1,8 bodu v CSS a o 2,4 body v OSS (adjustováno na placebo; p = 0,02, resp. p < 0,01) [31] (obr. 4). Ještě důležitější je zjištění, že pokles SF při podávání ivabradinu byl spojen se zvýšením skóre HQoL spolu se snížením výskytu primárních sledovaných parametrů. Podstudie studie SHIFT je tak první, která nejenže prokazuje, že klidová SF negativně koreluje s hodnotou HQoL, ale že i změna SF souvisí se změnou skóre HQoL po 12 měsících a že tento příznivý vliv zůstává zachován po dlouhou dobu. Navíc byla horší vstupní hodnota HQoL (tj. nižší skóre KCCQ) spojena se zvýšeným rizikem kardiovaskulárního úmrtí nebo hospitalizací pro zhoršení srdečního selhání (primární sledovaný parametr). Zajímavé bylo zjištění, že skóre CSS mělo vyšší predikční hodnotu. Protože CSS jako součást KCCQ se konkrétně věnuje symptomům, uvedené zjištění ukazuje na prognostickou hodnotu subjektivního vnímání symptomů samotnými pacienty (subjektivní složka onemocnění) při závažných kardiovaskulárních příhodách. Tato analýza naznačila, že snížení závažnosti srdečního selhání, pozorované při podávání ivabradinu (v podobě sníženého počtu hospitalizací a zlepšení funkční třídy podle NYHA), se příznivě projevuje v HQoL. Naproti tomu, jak ukázala metaanalýza autorů Dobre et al [29], nepřineslo užívání beta-blokátorů, které bylo spojeno s podobným snížením SF i mortality na srdeční selhání, zlepšení HQoL. Chronické srdeční selhání je spojeno s poměrně vysokou morbiditou a mortalitou. Proto se intervence zaměřily především na sledování mortality a počtů hospitalizací jako významných parametrů. Snižování mortality u chronického srdečního selhání je jistě nezbytné, ale nijak neukazuje, jak sami pacienti vnímají svůj stav a ani jak může léčba ovlivňovat jejich běžné aktivity. Pro pacienty může být kvalita života (např. symptomy a dopad onemocnění na jejich sociální a emocionální fungování i fungování v oblasti výkonu zaměstnání) stejně důležitá jako dlouhověkost [32], protože srdeční selhání ovlivňuje kvalitu života více než řada jiných chronických onemocnění [33]. Mimoto existuje vztah mezi zhoršujícími se symptomy a kvalitou života na jedné straně a zvýšenou mortalitou a počty hospitalizací na straně druhé [34–36]. Není pochyb o tom, že symptomy a subjektivní pocit pohody na straně pacienta představují nejenom významný cíl samotné léčby, protože naše zjištění spolu s předchozími zkušenostmi ukazuje, že zlepšení HQoL se může projevit i v delším přežití [34–36]. A to by mělo být součástí léčebného cíle u pacientů se srdečním selháním.
Obr. 4. Změna kvality života. Dle KCCQ po 12 měsících léčby. 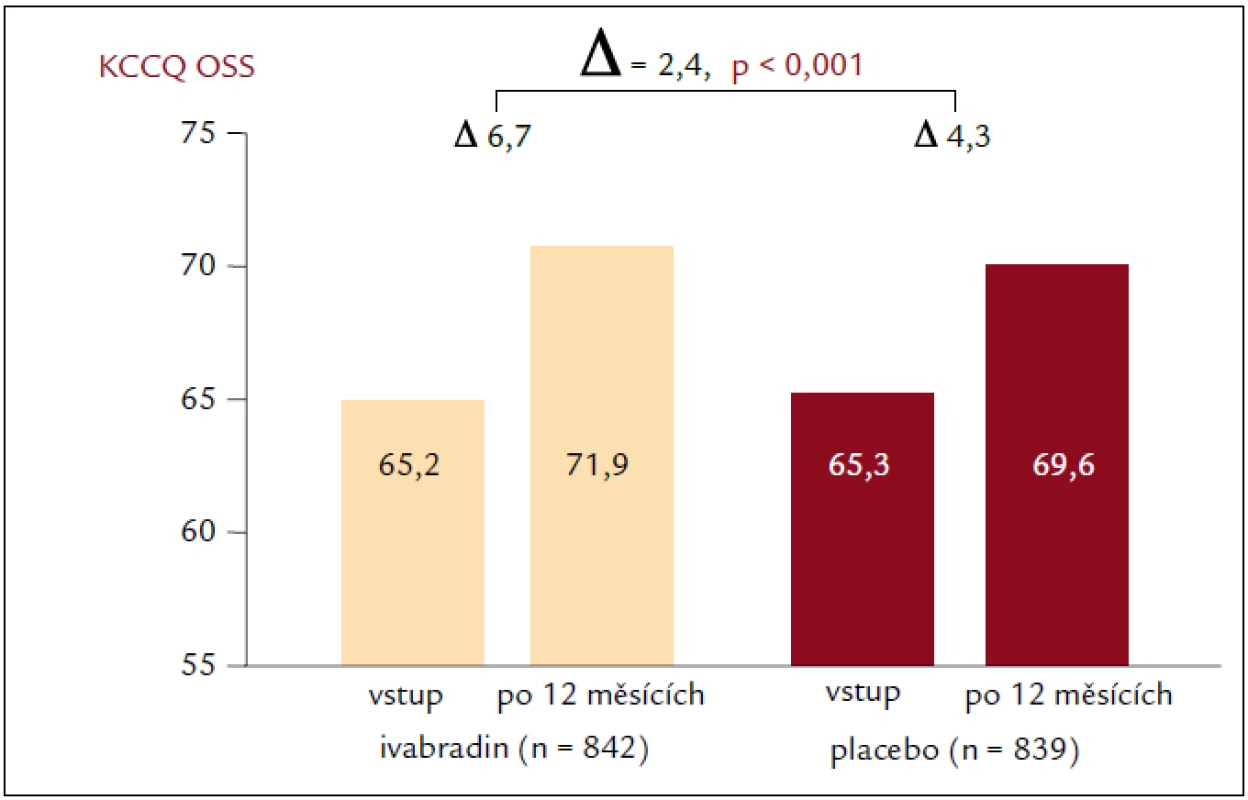
Současná medicína klade na nové léky požadavky evidence nejen klinických účinků, ale také bezpečnosti v reálné praxi. Ivabradin snižuje srdeční frekvenci selektivní inhibicí If proudu [37], který určuje rychlost diastolické depolarizace v buňkách sinusového uzlu. Ve studii SHIFT byl ivabradin podáván prakticky u všech pacientů v kombinaci s beta-blokátory. V rámci předem plánované podstudie studie SHIFT s 24hodinovým ambulatorním holterovským monitorováním EKG se tak naskytla možnost zhodnotit kardiální bezpečnost ivabradinu u pacientů se srdečním selháním [38]. Výsledky podstudie u 501 pacientů po 8 měsících sledování ukázaly, že ivabradin snížil průměrnou 24hodinovou SF o 9,5 tepů/min, na rozdíl od placeba. Podávání ivabradinu nevedlo ke zvýšenému výskytu závažných bradykardií (SF < 30 tepů/min) či AV bloků. Podstudie pak potvrdila vysokou kardiální bezpečnost ivabradinu u pacientů se srdečním selháním léčených blokátory RAAS a beta-blokátory [38].
Závěr
Obě podstudie ukázaly příznivý vliv ivabradinu u nemocných se srdečním selháním, sinusovým rytmem a srdeční frekvenci nad 70 tepů/min, jak na příznivé ovlivnění remodelace levé komory, tak na zlepšení kvality života. Na základě výsledků studie SHIFT a jejich podstudií je ivabradin uveden v nových Doporučeních pro diagnostiku a léčbu srdečního selhání České kardiologické společnosti 2011 jako lék indikovaný u nemocných se srdečním selháním na standardní léčbě, kteří mají klidovou srdeční frekvenci při sinusovém rytmu > 75 tepů/min [39].
Článek autoři věnují svému příteli, kamarádovi a jubilantovi profesoru Miroslavu Součkovi, kterému tímto přejí vše dobré, hojnost radostí a dobré vínko z vlastního vinohradu.
Ad multos annos
Jiří, Lenka a Jindra
prof. MUDr Jiří Vítovec, CSc., FESC
www.fnusa.cz
e-mail: jiri.vitovec@fnusa.cz
Doručeno do redakce: 18. 5. 2012
Zdroje
1. Dickstein K, Cohen-Solal A, Filippatos G et al. ESC Committee for Practice Guidelines (CPG). ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2008: the Task Force for the diagnosis and treatment of acute and chronic heart failure 2008 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association of the ESC (HFA) and endorsed by the European Society of Intensive Care Medicine (ESICM). Eur J Heart Fail 2008; 10 : 933–389.
2. Špinar J, Hradec J, Meluzín J et al. Doporučení pro diagnostiku a léčbu srdečního selhání ČKS 2006. Cor et Vasa 2007; 49: K5–K33.
3. Hradec J. Srdeční selhání – epidemie 21. století. Vnitř Lék 2004; 51 (Suppl 1): S23–S31.
4. Jhund PS, Macintyre K, Simpson CR et al. Long-term trends in first hospitalization for heart failure and subsequent survival between 1986 and 2003: a population study of 5.1 million people. Circulation 2009; 119 : 515–523.
5. Shafazand M, Schaufelberger M, Lappas G et al. Survival trends in men and women with heart failure of ischaemic and non-ischaemic origin: data for the period 1987–2003 from the Swedish Hospital Discharge Registry. Eur Heart J 2009; 30 : 671–678.
6. Gheorghiade M, Colucci WS, Swedberg K. Beta-blockers in chronic heart failure. Circulation 2003; 107 : 1570–1575.
7. Udelson JE. Ventricular remodeling in heart failure and the effect of beta-blockade. Am J Cardiol 2004; 93 : 43B–48B.
8. MERIT-HF Study Group. Effect of metoprolol CR/XL in chronic heart failure: Metoprolol CR//XL Randomised Intervention Trial in Congestive Heart Failure (MERIT-HF). Lancet 1999; 353 : 2001–2007.
9. Lechat P, Hulot JS, Escolano S et al. Heart rate and cardiac rhythm relationships with bisoprolol benefit in chronic heart failure in CIBIS II Trial. Circulation 2001; 103 : 1428–1433.
10. McAlister FA, Wiebe N, Ezekowitz JA et al. Meta-analysis: beta-blocker dose, heart rate reduction, and death in patients with heart failure. Ann Intern Med 2009; 150 : 784–794.
11. Katz AM. The myocardium in congestive heart failure. Am J Cardiol 1989; 63 : 12A–16A.
12. Diaz A, Bourassa MG, Guertin MC et al. Long-term prognostic value of resting heart rate in patients with suspected or proven coronary artery disease. Eur Heart J 2005; 26 : 967–974.
13. Wilhelmsen L, Berglund G, Elmfeldt D et al. The multifactor primary prevention trial in Göteborg, Sweden. Eur Heart J 1986; 7 : 279–288.
14. Pocock SJ, Wang D, Pfeffer MA et al. Predictors of mortality and morbidity in patients with chronic heart failure. Eur Heart J 2006; 27 : 65–75.
15. Komajda M, Follath F, Swedberg K et al. Study Group on Diagnosis of the Working Group on Heart Failure of the European Society of Cardiology. The EuroHeart Failure Survey programme – a survey on the quality of care among patients with heart failure in Europe. Part 2: treatment. Eur Heart J 2003; 24 : 464–474.
16. DiFrancesco D. Funny channels in the control of cardiac rhythm and mode of action of selective blockers. Pharmacol Res 2006; 53 : 399–406.
17. Savelieva I, Camm AJ. If inhibition with ivabradine: electrophysiological effects and safety. Drug Saf 2008; 31 : 95–107.
18. Swedberg K, Komajda M, Bohm M et al. SHIFT Investigators. Ivabradine and outcomes in chronic heart failure (SHIFT): a randomised placebo-controlled trial. Lancet 2010; 376 : 875–885. Erratum in Lancet 2010; 376 : 1988.
19. Cohn JN, Ferrari R, Sharpe N. Cardiac remodeling – concepts and clinical implications: a consensus paper from an international forum on cardiac remodeling. On Behalf of an International Forum on Cardiac Remodeling. J Am Coll Cardiol 2000; 35 : 569–582.
20. St John Sutton M, Pfeffer MA, Plappert T et al. Quantitative two-dimensional echocardiographic measurements are major predictors of adverse cardiovascular events after acute myocardial infarction. The protective effects of captopril. Circulation 1994; 89 : 68–75.
21. Solomon SD, Anavekar N, Skali H et al. Candesartan in Heart Failure Reduction in Mortality (CHARM) Investigators. Influence of ejection fraction on cardiovascular outcomes in a broad spectrum of heart failure patients. Circulation 2005; 112 : 3738–3744.
22. St John Sutton M, Ghio S, Plappert T et al. REsynchronization reVErses Remodeling in Systolic left vEntricular dysfunction (REVERSE) Study Group. Cardiac resynchronization induces major structural and functional reverse remodeling in patients with New York Heart Association class I/II heart failure. Circulation 2009; 120 : 1858–1865.
23. Tardif JC, O’Meara E, Komajda M et al. SHIFT Investigators. Effects of selective heart rate reduction with ivabradine on left ventricular remodelling and function: results from the SHIFT echocardiography substudy. Eur Heart J 2011; 32 : 2507–2515.
24. Kramer DG, Trikalinos TA, Kent DM et al. Quantitative evaluation of drug or device effects on ventricular remodeling as predictors of therapeutic effects on mortality in patients with heart failure and reduced ejection fraction: a meta-analytic approach. J Am Coll Cardiol 2010; 56 : 392–406.
25. Juenger J, Schellberg D, Kraemer S et al. Health related quality of life in patients with congestive heart failure: comparison with other chronic diseases and relation to functional variables. Heart 2002; 87 : 235–241.
26. Soto GE, Jones P, Weintraub WS et al. Prognostic value of health status in patients with heart failure after acute myocardial infarction. Circulation 2004; 110 : 546–551.
27. Russell SD, McNeer FR, Higginbotham MB. Exertional dyspnea in heart failure: a symptom unrelated to pulmonary function at rest or during exercise. Duke University Clinical Cardiology Studies (DUCCS) Exercise Group. Am Heart J 1998; 135 : 398–405.
28. Shah MR, Hasselblad V, Stinnett SS et al. Dissociation between hemodynamic changes and symptom improvement in patients with advanced congestive heart failure. Eur J Heart Fail 2002; 4 : 297–304.
29. Dobre D, van Jaarsveld CH, de Jongste MJ et al. The effect of beta-blocker therapy on quality of life in heart failure patients: a systematic review and meta-analysis. Pharmacoepidemiol Drug Saf 2007; 16 : 152–159.
30. Testa MA, Simonson DC. Assesment of quality-of-life outcomes. N Engl J Med 1996; 334 : 835–840.
31. Ekman I, Chassany O, Komajda M et al. Heart rate reduction with ivabradine and health related quality of life in patients with chronic heart failure: results from the SHIFT study. Eur Heart J 2011; 32 : 2395–2404.
32. Stanek EJ, Oates MB, McGhan WF et al. Preferences for treatment outcomes in patients with heart failure: symptoms versus. survival. J Card Fail 2000; 6 : 225–232.
33. Lesman-Leegte I, Jaarsma T, Coyne JC et al. Quality of life and depressive symptoms in the elderly: a comparison between patients with heart failure and age - and gender-matched community controls. J Card Fail 2009; 15 : 17–23.
34. Ekman I, Kjörk E, Andersson B. Self-assessed symptoms in chronic heart failure – important information for clinical management. Eur J Heart Fail 2007; 9 : 424–428.
35. Ekman I, Cleland JG, Swedberg K et al. Symptoms in patients with heart failure are prognostic predictors: insights from COMET. J Card Fail 2005; 11 : 288–292.
36. Zuluaga MC, Guallar-Castillón P, López-Garcia E et al. Generic and disease-specific quality of life as a predictor of long-term mortality in heart failure. Eur J Heart Fail 2010; 12 : 1372–1378.
37. DiFrancesco D, Camm AJ. Heart rate lowering by specific and selective I(f) current inhibition with ivabradine. A new therapeutic perspective in cardiovascular disease. Drugs 2004; 64 : 1757–1765.
38. Camm J, Talajic M, Komajda M at al. Cardiac safety of selective heart rate reduction with ivabradine in chronic heart failure: Insights from the SHIFT ECG-Holter Sub-study. Eur J Heart Failure 2011; 10: (Suppl S1): S134.
39. Špinar J, Vítovec J, Hradec J et al. Czech Society of Cardiology guidelines for the diagnosis and treatment of chronic heart failure 2011. Cor et Vasa 2012; 54: E113–E134.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2012 Číslo 7 a 8- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Statinová intolerance
- Genetický podklad a screening familiární hypercholesterolémie
- Metabolit živočišné stravy produkovaný střevní mikroflórou zvyšuje riziko závažných kardiovaskulárních příhod
- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
-
Všetky články tohto čísla
- Jubilant prof. Miroslav Penka, CSc.
- Profesor Miroslav Penka – jeden z běžců Maratónu pro hemofilii
- CZEMP – děcko prof. Penky
- Profylaxe a léčba antifosfolipidového syndromu – současné možnosti, úskalí a perspektivy do budoucna
- Změny kalcium-fosfátového metabolizmu při chronických nefropatiích
- Terapeutický přístup ke krvácení v souvislosti se „starými“ a „novými“ antikoagulans
- Možnosti diagnostiky heparinem indukované trombocytopenie v České republice
- Pokrok v oblasti mnohočetného myelomu a vývoj souvisejícího laboratorního zázemí
- Jak v ambulantní péči neprošvihnout rozvíjející se kritické poruchy hemostázy
- Frekvence nových trombofilních mutací antitrombinu (SERPINC1) (IVS +141G>A), glykoproteinu GPVI (Ser219Pro) a cytochromu CYP4V2 (Lys259Gln) u zdravých osob středního věku v oblasti středních Čech
- Megakaryopoéza a geneze destiček
- Získaná hemofilie A
- Současné možnosti diagnostiky a léčby myelomové kostní nemoci v klinické praxi
- Vysokodávková léčba a přípravné režimy před transplantací krvetvorných buněk
- Refeeding syndrom u mladého pacienta s anxiózně-depresivní poruchou
- K životnímu jubileu prof. MUDr. Miroslava Součka, CSc.
- Detekce KRAS a jeho mutace v biopsii pokročilého kolorektálního karcinomu při koloskopii
- Syndróm nepokojných nôh u dialyzovaných pacientov
- Tuhosť aorty zvyšuje centrálny aortový tlak u pacientov s hypertenziou
- Jak definovat osoby s vysokým rizikem pankreatického karcinomu
- Veľkosť LDL lipoproteínových partikúl u pacientov s náhlou mozgovocievnou príhodou
- Trojkombinační léčba chronické hepatitidy C
- Chronický zánět a metabolický syndrom
- Požadavky na předoperační vyšetření z pohledu anesteziologa
- Fixní kombinace v léčbě hypertenze
- Farmakoterapie hypertenze po transplantaci srdce
- Snížení srdeční frekvence u srdečního selhání: změny funkce levé komory a kvalita života v podstudiích SHIFT
- Antagonisty aldosterónu v liečbe chronického srdcového zlyhávania
- Manažment stabilnej anginy pectoris a iných foriem chronickej kardiovaskulárnej artériovej choroby
- Antiaterogénny účinok HDL subpopulácií u jedincov s novodiagnostikovanou končatinovocievnou artériovou chorobou
- Konečné stadium chronického onemocnění ledvin a metabolická acidóza
- Chronické ochorenie obličiek a vápniková homeostáza bunky
- Ischemické a neischemické příčiny elevace ST segmentu u pacientů s bolestí na hrudi: Systematický přehled literatury
- Koncentrace sodíku v dialyzačním roztoku – důležitý, ale opomíjený parametr hemodialýzy u nemocných s chronickým selháním ledvin
- Solit nebo nesolit při ledvinových chorobách? Ne více než quantum satis!
- Oxidačný stres a antioxidačné systémy u hemodialyzovaných chorých
- Infarkt myokardu v mladom veku – naše výsledky a skúsenosti
- Významné životné jubileum profesora MUDr. Miroslava Mydlíka, DrSc.
- Vzťah mikroalbuminúrie a obezity u zdravých mladistvých – predbežné výsledky štúdie „Rešpekt pre zdravie“
- Kontrastová nefropatie a možnosti její prevence
- Farmakogenetické aspekty liečby orálnymi antidiabetikami
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Infarkt myokardu v mladom veku – naše výsledky a skúsenosti
- Požadavky na předoperační vyšetření z pohledu anesteziologa
- Megakaryopoéza a geneze destiček
- Ischemické a neischemické příčiny elevace ST segmentu u pacientů s bolestí na hrudi: Systematický přehled literatury
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



