-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Současný pohled na onemocnění jater u srdečního selhání
Contemporary view on liver impairment in heart failure
Cardiac failure has a negative impact on the function of all parenchymatous organs, based both on the low organ perfusion in the left-sided forward failure and on the venous congestion in the right-sided backward failure. Current studies dealing with the cardiac hepatopathy focus not only on the liver enzyme changes, but also analyse its clinical and prognostic relevance. The aim of the article is to provide the comprehensive and contemporary view on liver dysfunction in heart failure patients.
Key words:
heart failure – liver function tests – bilirubin – congestive hepatopathy – ischemic hepatitis
Autoři: K. Vyskočilová; L. Špinarová
Působiště autorů: I. interní kardio-angiologická klinika Lékařské fakulty MU a FN u sv. Anny v Brně – ICRC Brno, přednostka prof. MUDr. Lenka Špinarová, Ph. D., FESC
Vyšlo v časopise: Vnitř Lék 2013; 59(12): 1065-1072
Kategorie: Přehledný referát
Souhrn
Srdeční selhání má negativní dopad na činnost všech parenchymatózních orgánů, a to jak na podkladě snížené orgánové perfuze u tzv. dopředného srdečního selhání, tak na základě zvýšené žilní kongesce u pravostranného selhání srdce dozadu. Práce zabývající se jaterním postižením kardiální etiologie nezkoumají jen změny enzymatických funkcí jater, ale i jeho klinický a prognostický dopad. Cílem této práce je poskytnout komplexní a aktuální pohled na jaterní dysfunkci u pacientů se srdečním selháním.
Klíčová slova:
srdeční selhání – funkční jaterní testy – bilirubin – kongestivní poškození jater – ischemická hepatitidaÚvod
Jaterní poškození u srdečního selhání je relativně často se vyskytující syndrom, přesto však bývá mnohdy opomíjen. Je známo, že srdeční selhání má negativní dopad na činnost všech orgánů, a to jak na podkladě snížené orgánové perfuze u tzv. dopředného srdečního selhání, tak i na základě zvýšené žilní kongesce u pravostranného selhání srdce dozadu. V posledních letech se pozornost odborné veřejnosti obrací především na poškození ledvin v souvislosti se srdečním selháním – kardiorenální syndrom [1,2], nicméně otázka jaterního postižení u srdeční nedostatečnosti zůstává neméně důležitá. Srdeční selhání podstatně ovlivňuje nejenom ledvinné funkce, ale má negativní dopad i na další parenchymatózní orgány, především na játra – tento vliv je možno také označit jako syndrom kardiohepatální, v klinické praxi méně používaný [3].
Játra se svým komplexním cévním systémem a vysokou metabolickou aktivitou spouštějí u pacientů se srdečním selháním četné metabolické i hemodynamické změny. Existuje mnoho prací zabývajících se postižením jater v důsledku srdečního selhání, přičemž tyto studie nezkoumají jen změny týkající se samotných enzymatických funkcí jater, ale i jejich hemodynamické a histopatologické korelace [4]. Neméně zajímavý je však i prognostický význam funkčních jaterních testů u pacientů s jak akutním, tak chronickým srdečním selháním.
Cílem této práce je poskytnout komplexní a aktuální pohled na jaterní dysfunkci v souvislosti se srdečním selháním.
Prevalence jaterního postižení u srdečního selhání
Jednou z prvních prací zkoumajících jaterní dysfunkci u městnavého srdečního selhání byla práce Joliffea z roku 1930 [5]. Ve své studii se Joliffe zaměřil na relativně vysokou četnost (2,1 %) ikteru jak obstrukčního, tak neobstrukčního typu u kardiálně dekompenzovaných pacientů. V následujících desetiletích bylo publikováno mnoho dalších prací potvrzujících negativní dopad srdečního selhání na funkci jater, přičemž převažovaly studie sledující odraz jaterního postižení na funkčních laboratorních testech [6–9].
Mnoho studií zabývajících se profilem funkčních jaterních testů, bilirubinu (BIL), laktátdehydrogenázy (LD) a albuminu (ALB) u kardiálně dekompenzovaných pacientů prokázalo relativně vysokou prevalenci abnormalit těchto laboratorních parametrů. Patologie v biochemickém nálezu odráží hemodynamický status pacienta – pacienti s hodnotou srdečního indexu pod 1,5 l/min/m2 mají abnormální funkční jaterní testy častěji než pacienti se srdečním indexem vyšším [7].
Z dostupných prací sledujících profil laboratorních jaterních testů převažují studie zahrnující pacienty s chronickým srdečním selháním, přičemž většina těchto pacientů se prezentuje tzv. cholestatickým profilem sérových jaterních testů – elevací alkalické fosfatázy (ALP); častá bývá také elevace gamaglutamyltransferázy (GGT) a BIL (přehled studií viz tab. 1). Dle různých zdrojů se prevalence abnormalit pohybuje v rozmezí 12–46 % u ALP, 32–48 % u GGT a 13–64 % u BIL [3,6,7,10–14]. Naproti tomu u hepatocelulárního profilu jaterního poškození, který bývá u srdečního selhání méně častý, je typickým nálezem zvýšení hodnot alaninaminotransferázy (ALT) a aspartátaminotransferázy (AST) – v odborné literatuře bývá hepatocelulární profil také někdy definován jako elevace ALT nad 3násobek horního limitu normy (HLN). Laboratorní profil jaterní léze s elevací jak ALP, tak ALT bývá označován jako smíšený [15]. Specifickým stavem je akutní ischemická hepatitida, často provázející šokové stavy, kdy vlivem akutního nekrotického poškození jater dochází ke zvýšení hodnot AST až nad 20násobek HLN [16,17].
Tab. 1. Abnormality funkčních jaterních testů, BIL, LD a ALB u pacientů se srdečním selháním. 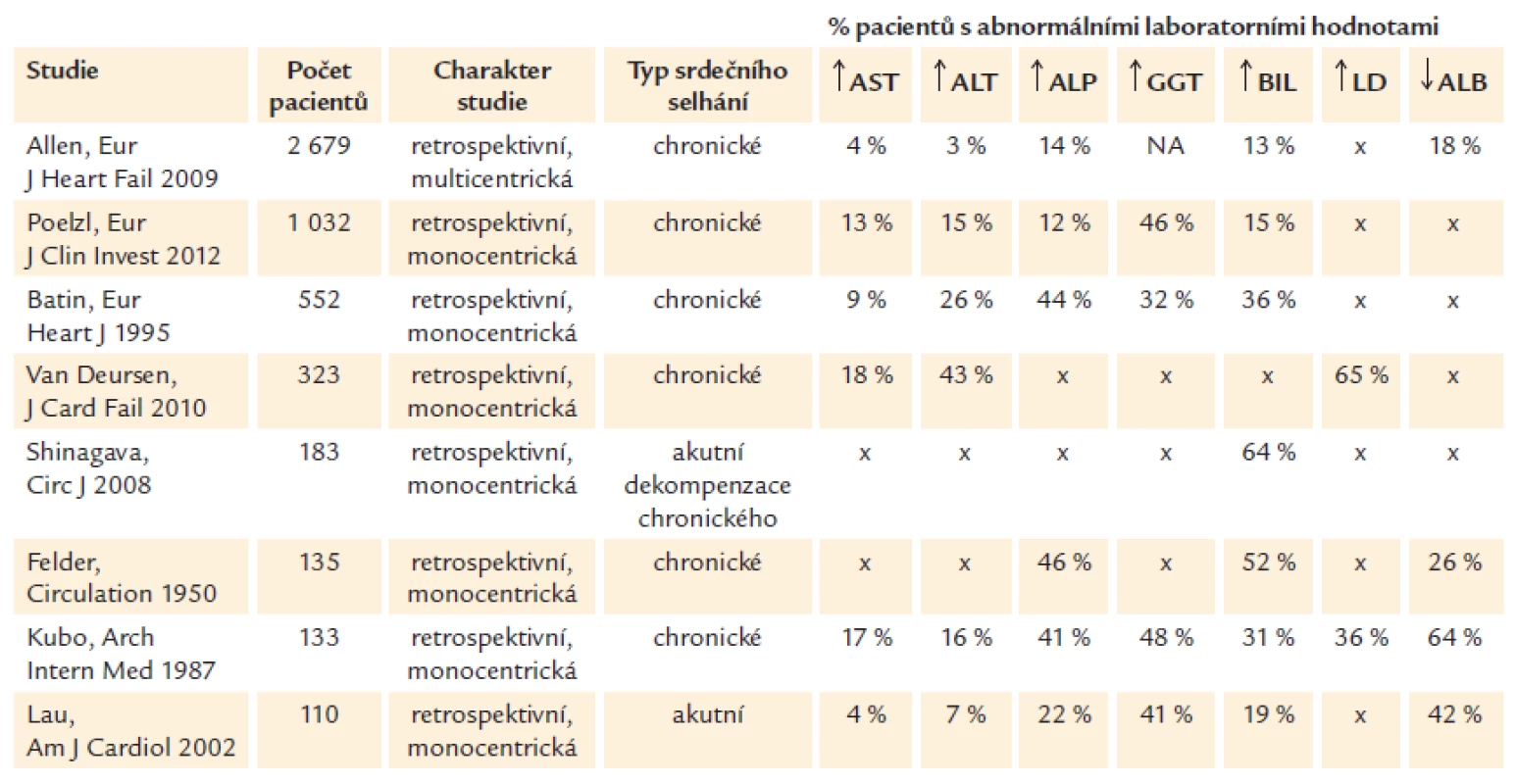
Jen málo prací zabývajících se postižením jater z kardiální příčiny sleduje kromě laboratorních parametrů i strukturální změny jaterního parenchymu (prostřednictvím pitevních nálezů či jaterních biopsií), což je dáno jak nižší dostupností těchto metod, tak i relativně vysokým rizikem periprocedurálních komplikací perkutánní jaterní biopsie ve srovnání s jednoduchostí a dostupností laboratorní diagnostiky. Při kontraindikaci perkutánní biopsie je u rizikových pacientů možné také provést transjugulární jaterní biopsii [18].
Strukturální změny jater u srdečního selhání
Historicky první zmínka o patologii jater v souvislosti se srdečním selháním je datována do počátku 19. století, kdy Kiernan poprvé popsal takzvaná „muškátová játra“ způsobená městnáním v jaterní cirkulaci. Tyto mají hnědou barvu a jejich makroskopická struktura připomíná vzhled jádra muškátového oříšku [6,19].
Obecně histopatologické nálezy u jaterní léze kardiální etiologie zahrnují především zánětlivé změny, dilataci jaterních sinusoid, apoptózu a nekrózu hepatocytů, a v neposlední řadě fibrózu – ta bývá přítomna jak v oblasti centrilobulární, tak periportální.
Dle Myersovy studie s jaterními biopsiemi mělo až 19 % pacientů s chronickým srdečním selháním pokročilé stadium fibrózy nebo cirhózu, typickou především pro pravostranné srdeční selhání. Naproti tomu u de novo akutního selhání se fibrotické změny nevyskytovaly. Ve skupině s akutním srdečním selháním (de novo nebo dekompenzací chronického) byla dominantním nálezem nekróza hepatocytů – jak periportální, tak centrilobulární [4]. Přítomnost centrilobulární nekrózy u pacientů s akutním srdečním selháním prokázala také unikátní Killipova práce z počátku 60. let minulého století prezentující kazuistiky a sekční nálezy 8 pacientů, kteří zemřeli na akutní srdeční selhání, přičemž u všech byla přítomna akutní centrilobulární nekróza (obr. 1) [9].
Obr. 1. Centrilobulární (perivenulární) nekróza u kongestivních jater – barvení hematoxylin-eozinem, zvětšení 400krát (obrázek byl poskytnut I. patologicko- -anatomickým ústavem FN u sv. Anny v Brně – MUDr. Lenz). 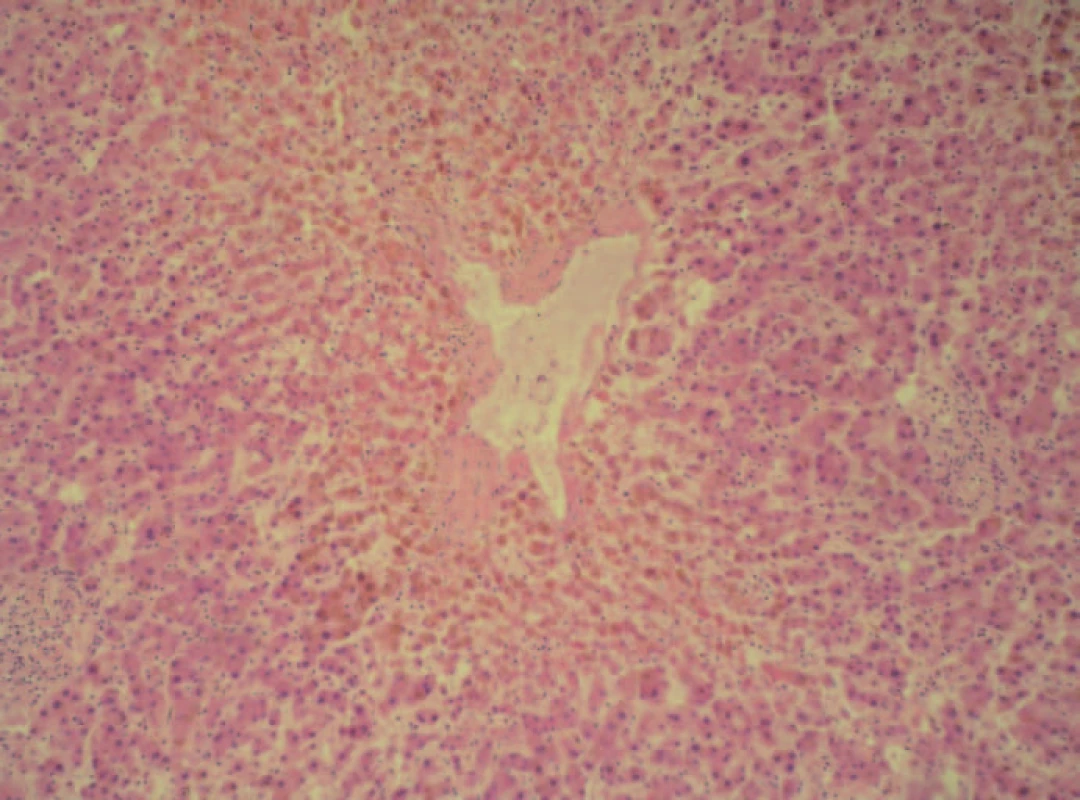
Masivní hepatocelulární nekróza bývá typickým nálezem také u ischemické hepatitidy a souvisí především s hypotenzí při levostranném srdečním selhání se syndromem nízkého srdečního výdeje [19].
Patofyziologie jaterního poškození v souvislosti se srdečním selháním
Mezi nejdůležitější faktory determinující jaterní poškození u akutní i chronické kardiální dekompenzace patří hemodynamické vlivy. Je známo, že pacienti se srdečním selháním mají zvýšený tlak v pravé srdeční síni, který je odrazem centrálního žilního tlaku a také tlaku ve volné jaterní žíle – FHVP (free hepatic vein pressure). Městnání v jaterních sinusoidách rezultuje v endoteliální poškození a následný přenos tohoto tlaku na hepatocyty. Žilní stáza zhoršuje deoxygenaci a vede k poškození jaterního parenchymu – jeho atrofii, nekróze, ukládání kolagenových depozit až fibróze. Jak již bylo zmíněno výše, nejen městnání, ale i ischemie hepatocytů může zhoršovat hepatopatii u srdečního selhání, a to především na podkladě poklesu systémového krevního tlaku u syndromu nízkého srdečního výdeje. Kromě cirkulatorních změn a oxidativního stresu se u srdečního selhání uplatňuje také celá řada zánětlivých cytokinů, jako interleukin 13 a tumour necrosis factor, které také přispívají k jaterní fibróze [19].
Na zániku hepatocytů u srdečního selhání se uplatňuje jak apoptóza, tak nekróza. Herzer et al ve své práci využili jako diagnostické markery pro buněčnou smrt jaterních buněk 2 epitopy jaterního cytokeratinu-18 – epitop M30 svědčící pro apoptózu a epitop M65 typický pro nekrózu. Na základě vyšší hodnoty poměru M30/M65 u akutního srdeční selhání prokázal Herzer převahu apoptózy, zatímco u chronického srdečního selhání převažovala nekróza (vyšší hodnoty M65 ve srovnání s M30). Navíc měli pacienti s elevací M30 horší prognózu, proto epitop M30 má nejenom diagnostickou hodnotu, ale také se jeví jako slibný prognostický marker jaterní léze u kardiálního selhávání [20].
Nejen morfologické změny, ale také pokles metabolické aktivity bývá patrný u pacientů s pokročilým srdečním selháním. Jednou z možností zkoumání velikosti funkční jaterní masy je 13C-methacetinový dechový test. Práce Málka et al využívající tuto metodu potvrdila, že funkční kapacita jater je signifikantně nižší u pacientů s pokročilejší funkční třídou NYHA, korelace mezi poklesem metabolické aktivity jater a ejekční frakcí levé srdeční komory však nalezena nebyla [21].
Faktory ovlivňující jaterní poškození u srdečního selhání
Polypragmazie a léková hepatotoxicita
Vzhledem k tomu, že převážné množství farmak je metabolizováno právě v játrech, je u pacientů se srdečním selháním potřeba brát v úvahu i potenciální riziko polypragmazie. Častěji než hepatotoxický vliv kombinace léků se však uplatňuje akutní jaterní léze po konkrétním preparátu. Hepatotoxicita léčiv v terénu srdečního selhání se z kardiovaskulárních farmak dotýká především statinů a amiodaronu (tab. 2) [15]. Při vzniku akutního jaterního poškození je doporučena redukce až vysazení hepatotoxického léčiva s následnou pečlivou monitorací funkčních jaterních testů. V případě normalizace hodnot jaterních enzymů je možné znovunasazení stejného preparátu v redukované dávce, vhodnější je však záměna za jiný preparát stejné lékové skupiny [22].
Tab. 2. Hepatotoxicita kardiovaskulárních farmak – modifikováno dle Changa [15]. ![Hepatotoxicita kardiovaskulárních farmak – modifikováno dle Changa [15].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/eab9218d1d0b7b62a73ec07b5025024d.png)
Hemodynamické vlivy
Dalším z důležitých faktorů je hemodynamický status pacienta. Vliv systémové hemodynamiky na jaterní postižení u kardiálního selhání je zřejmý, pacienti s nižším srdečním výdejem (cardiac index ≤ 1,5 l/min/m2) mají signifikantně vyšší hodnoty AST, ALT a BIL [7].
Také přítomnost a tíže trikuspidální regurgitace determinuje typ jaterního poškození u srdečního selhání. Při zkoumání souvislosti echokardiografických parametrů a abnormalit funkčních jaterních testů u pacientů se srdečním selháním bylo zjištěno, že pacienti se zvýšenými hodnotami obstrukčních jaterních testů měli signifikantně závažnější stupeň trikuspidální regurgitace [14].
Další vlivy
Z dalších vlivů se uplatňují konkomitantní jaterní onemocnění – kupříkladu infekční nebo autoimunitní hepatitida, primární biliární cirhóza, primární sklerózující cholangoitida, hemochromatóza, Wilsonova choroba nebo deficit α1-antitrypsinu.
Na zhoršení jaterních funkcí se také může podílet nealkoholická jaterní steatóza – NAFLD (nonalcoholic fatty liver disease), která je v dnešní době nejčastější příčinou zvýšení jaterních enzymů v západních zemích, je významně asociována s kardiálními rizikovými faktory jako obezitou, diabetem a dyslipidemií a je nezávislým rizikovým faktorem kardiovaskulární morbidity i mortality [23–25].
Nezanedbatelný je i efekt nadměrné konzumace alkoholu na jaterní funkce. Ten navíc zvyšuje senzitivitu jater na další hepatotoxické vlivy – nejenom potencuje toxicitu kardiofarmak, ale zhoršuje i průběh konkomitantních jaterních onemocnění.
Klinický obraz jaterního postižení asociovaného se srdečním selháním
Kromě obvyklých projevů srdečního selhání, jako jsou dušnost a periferní otoky, se často vlivem městnání v systémové cirkulaci také objevují hepatomegalie, hepatojugulární reflux, splenomegalie, ascites či břišní dyskomfort. Vzácně se může vyskytnout jaterní encefalopatie, zatímco přítomnost pavoučkovitých névů nebo krvácení z jícnových varixů jsou pro srdeční selhání atypické [19]. Žloutenka se vyskytuje u 2,1% případů srdečního selhávání [5]. Výjimečně může být i prvním projevem srdečního selhání, dle Van Lingena je celkem 1,2 % případů žloutenky z primárně kardiální příčiny [26].
Tab. 3 ukazuje nejčastější navzájem se ovlivňující srdeční a jaterní onemocnění a onemocnění jater a srdce se společnou etiologií dle Naschitze et al. Vliv srdečního selhání na játra se podle klinického i laboratorního obrazu dělí na mírnou alteraci funkčních jaterních testů, kongestivní poškození jater (kongestivní jaterní fibrózu a kardiální cirhózu) a akutní ischemickou (hypoxickou) hepatitidu [27].
Tab. 3. Asociovaná srdeční a jaterní onemocnění dle Naschitze [27]. ![Asociovaná srdeční a jaterní onemocnění dle Naschitze [27].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/3d2a00fa3db5c5317a346287e7f6211b.png)
Mírná alterace funkčních jaterních testů u městnavého srdečního selhání
Jak již bylo zmíněno, mírná alterace funkčních jaterních testů na podkladě snížené jaterní perfuze nebo pasivního městnání v jaterním řečišti bývá relativně častá. Tzv. cholestatický profil sérových jaterních testů, typický u převážně pravostranného srdečního selhání, bývá charakterizován lehkou elevací ALP, GGT a BIL. Naproti tomu u hepatocelulárního profilu, který se vyskytuje především u dopředného levostranného srdečního selhání, převažuje elevace jaterních transamináz. Méně častý je profil smíšený, ten je charakterizován elevací jak ALP, tak ALT [15]. Dále bývá v laboratorním obrazu častým nálezem také lehká elevace LD nebo mírný pokles ALB. Játra bývají zvětšená a tuhá, často bývá přítomna i splenomegalie.
Kongestivní poškození jater (kongestivní jaterní fibróza a kardiální cirhóza)
Dle Laua et al je diagnóza kongestivního poškození jater stanovena následujícím trias: klinické známky městnavého srdečního selhání, abnormální hodnoty funkčních jaterních testů a vyloučení jiné příčiny jaterního onemocnění, převážně autoimunitní nebo infekční [14].
Kongestivní postižení jater bývá přítomno především u pravostranného srdečního selhání – nejčastěji na podkladě konstriktivní perikarditidy, mitrální stenózy, trikuspidální regurgitace nebo chronického cor pulmonale [19].
Jaterní fibróza až cirhóza jsou způsobeny reakcí jaterního parenchymu na zvýšený žilní tlak, hypoxii a hepatocelulární nekrózu. Morfologický obraz se pohybuje od drobných kolagenových depozit v prostoru jaterních sinusoid, přes široká vazivová septa, až po extenzivní fibrózu s nodulárními formacemi – jaterní cirhózu [28].
Kardiální cirhóza, dříve provázející pokročilá stadia chronického srdečního selhání, je v současnosti velmi raritní. Kromě obvyklých příznaků srdečního selhání ji mnohdy doprovází ascites, který charakterizován vysokou koncentrací bílkovin v ascitické tekutině a také vyšší koncentrací LD a červených krvinek ve srovnání s ascitem jiné (nekardiální) etiologie [27]. V případě kardiální cirhózy mohou být hodnoty sérových jaterních testů, BIL a ALB v mezích normy [7].
Akutní ischemická (hypoxická) hepatitida
Ischemická hepatitida, poprvé popsaná Bynumem et al v roce 1979, je charakterizována jako akutní jaterní poškození v terénu srdečního selhání s doprovodnou centrilobulární nekrózou hepatocytů a taktéž výrazným nárůstem aktivity sérových transamináz. Jedná se tedy o triádu příznaků složenou z prvků jak klinických, tak histologických i biochemických [29]. Pro běžnou klinickou praxi však ke stanovení diagnózy slouží především laboratorní diagnostika – autoři odborné literatury obvykle ischemickou hepatitidu definují jako zvýšení aktivity alespoň jedné ze sérových jaterních transamináz (AST nebo ALT) nad 20násobek HLN [16,17,30].
Akutní ischemická hepatitida bývá v literatuře někdy nahrazována pojmem „šoková játra“, nicméně ne vždycky se musí současně prezentovat šokový stav, dle Henriona et al se šok vyskytuje jen u asi 50 % všech pacientů s hypoxickou hepatitidou [16].
Převažující etiologií ischemické hepatitidy je srdeční selhání (70,4 %), méně často se na jejím vzniku podílí exacerbace chronického respiračního selhání nebo septický šok [16].
Hemodynamický mechanizmus podílející se na hypoxické hepatitidě u kardiální dekompenzace je dvojí – jednak se vlivem levostranného srdečního selhání uplatňuje jaterní ischemie, jednak dochází k městnání v žilním systému jater sekundárně z důvodu srdečního selhání doprava. Pacienti s hypoxickou hepatitidou mají proto ve srovnání s kontrolní populací prokazatelně vyšší hodnoty centrálního žilního tlaku a také signifikantně nižší krevní průtok játry (měřeno metodou galaktózové clearance) [30].
Prevalence pacientů s hypoxickou hepatitidou hospitalizovaných na jednotkách intenzivní péče se pohybuje v rozmezí 2,4–2,6 %, přičemž hospitalizační mortalita je vysoká (61,5 %) [30,31]. U těchto pacientů bývá častým nálezem multiorgánové postižení – zejména renální selhání (67,2 %), rabdomyolýza (41,2 %) nebo ischemická pankreatitida (25,6 %). Nejsilnějšími rizikovými faktory pro zvýšenou mortalitu jsou prodloužený protrombinový čas, septický šok a nutnost hemodialýzy [31].
Možnosti diagnostiky jaterního poškození u pacientů se srdečním selháním
Laboratorní diagnostika
Vzhledem k vysoké metabolické aktivitě jater sehrává laboratorní diagnostika v diagnostice jaterního onemocnění významnou roli. Mezi indikátory poškození hepatocytu patří cytoplazmatické enzymy AST, ALT a LD. V případě poškození exkrečních funkcí dochází k elevaci ALP a GGT (na základě jejich uvolňování z kanalikulárních membrán hepatocytů při obstrukci). Zvýšení BIL v séru může být způsobeno jak poruchou vychytávání a konjugace v buňce (nekonjugovaný BIL), tak sníženým vylučováním do žluči (konjugovaný BIL). Poslední skupinou jsou indikátory poškození metabolických funkcí – ALB, cholinesteráza a koagulační faktory, jejichž koncentrace u chronických onemocnění jater klesají, dále sem patří amoniak, jehož sérová hladina při funkčním poškození jater naopak narůstá [32].
Jak již bylo uvedeno výše, z novějších laboratorních metod se uplatňují izotopy jaterního cytokeratinu-18 M30 a M65 – ty mají význam jak diagnostický, tak prognostický [20].
Zobrazovací metody
Kromě standardních zobrazovacích metod (RTG vyšetření hrudníku, ultrasonografie – abdominální i echokardiografie, výpočetní tomografie a magnetická rezonance) nacházejí uplatnění i nové metody. V současnosti je široce diskutována metoda měření elastického odporu jaterní tkáně tranzientní elastografií. Přístroj měřící tuhost jater je označován jako FibroScan®. Jedná se o ultrazvukový přístroj se speciálním softwarem, jehož sonda přiložená do mezižeberní oblasti vysílá mechanické vlny procházející játry, přičemž elasticita jaterní tkáně je hodnocena na základě rychlosti snímaných obrazů. Vhodnost využití metody FibroScan® u pacientů se srdečním selháním zkoumali Hopper et al na souboru 49 pacientů s akutním nebo chronickým srdečním selháním, u kterých prokázali signifikantně vyšší hodnoty jaterní tuhosti ve srovnání se zdravou populací. Hopper navíc na souboru dialyzovaných pacientů prokázal, že hodnoty jaterní tuhosti se vlivem akutních změn tekutinového objemu nemění [33]. Zajímavá je otázka možného kolísání hodnot jaterní tuhosti v průběhu léčby akutního srdečního selhání. Colli et al studiem menšího souboru (27) pacientů signifikantní rozdíl v tuhosti jaterní tkáně v průběhu hospitalizace nezjistili, nicméně až u 18 z nich došlo ke konci hospitalizace k poklesu hodnot jaterní tuhosti, přičemž tyto korelovaly s klinickým zlepšením pacientů. Hodnota jaterní tuhosti se podobně jako měření hodnot natriuretických peptidů jeví být slibnou diagnostickou metodou u srdečního selhání, k ověření možné diagnostické hodnoty tohoto parametru jsou však potřebné další studie na větším souboru pacientů [34].
Další zobrazovací metodou, založenou na měření tuhosti jaterní tkáně, je tranzientní elastografie využívající princip ARFI (acoustic radiation force impulse imaging) – speciální software implementovatelný do standardních ultrazvukových přístrojů. Na rozdíl od metody FibroScan® nevyžaduje mechanickou kompresi tkáně, přičemž při detekci jaterní fibrózy jsou tyto metody srovnatelné [35,36]. Ve srovnání s jaterní biopsií je však značnou nevýhodou těchto metod jejich nižší přesnost u mírnějších stadií fibrózy a taktéž nemožnost přesného odlišení jednotlivých mezistupňů jaterní fibrózy.
Invazivní metody
Biopsie jater se u pacientů s akutním srdečním selháním rutinně neprovádí. Důvodem je vysoké riziko periprocedurálních komplikací. Při kontraindikaci perkutánní biopsie je u rizikových pacientů možné získat bioptický vzorek jater také prostřednictvím transjugulární jaterní biopsie, která je spojena s minimálním rizikem krvácivých komplikací [18].
Endomyokardiální biopsie také nepatří mezi rutinní vyšetření, je však indikována při podezření na systémová onemocnění, jako např. hemochromatóza nebo sarkoidóza, či k vyloučení zánětlivé kardiomyopatie.
Z katetrizačních metod je zlatým standardem katetrizace jaterních žil, která představuje nejspolehlivější metodu hodnocení portální hypertenze na základě portohepatálního gradientu – HVPG (hepatic venous pressure gradient). Ten přestavuje rozdíl mezi tlakem jaterních žil v zaklínění, který odpovídá tlaku v portální žíle a tlakem ve volné jaterní žíle, který je odrazem centrálního žilního tlaku [37].
V případě přítomnosti plicní hypertenze se provádí pravostranná srdeční katetrizace. Ta umožňuje měření jak tlaků v plicnici, zaklínění a jednotlivých srdečních oddílech, tak minutového srdečního výdeje. Právě hodnota minutového srdečního výdeje, jak již bylo zmíněno výše, je významně asociována s rizikem rozvoje poškození jater u městnavého srdečního selhání [7].
Léčba jaterního postižení na podkladě srdečního selhání
Pokud je příčinou zhoršení jaterních funkcí srdeční selhání, ať již na podkladě městnání v pravostranných srdečních oddílech, nebo na podkladě ischemie jaterního parenchymu u selhání dopředu, působí terapie srdečního selhání současně na zlepšení jaterních funkcí. Ze standardní farmakoterapie srdečního selhání hrají důležitou roli v ovlivnění funkce jater především diuretika (jak kličková, tak antagonisté aldosteronu), které podporou diurézy redukují městnání v systémovém řečišti a tím snižují preload. V případě dysfunkce levé komory jsou nezbytnou součástí farmakoterapie také beta-blokátory a inhibitory angiotenzin-konvertujícího enzymu nebo sartany (blokátory receptoru pro angiotenzin II).
Co se týče kardiální cirhózy, v dostupné literatuře neexistují data, podle nichž by její přítomnost měla významně negativní vliv na morbiditu nebo mortalitu u pacientů se srdečním selháním. Neexistují ani specifická terapeutická doporučení nebo prospektivní studie ohledně managementu kardiální cirhózy. Obecně je u jaterní cirhózy doporučována léčba symptomatická a taktéž léčba důsledků portální hypertenze. U refrakterního ascitu kardiální etiologie se s výhodou provádí paracentéza. Použití transjugulárního portosystémového shuntu, často využívaného u portální hypertenze při alkoholické nebo postinfekční jaterní cirhóze, je u jaterního postižení kardiální etiologie kontraindikováno vzhledem k riziku plicní hypertenze v důsledku přetížení v pravostranných srdečních oddílech [27].
Terapie ischemické hepatitidy vyžaduje prostředí jednotky intenzivní péče a zaměřuje se především na zlepšení srdečního výdeje, vhodný je dopamin v nízkých dávkách nebo dobutamin ve snaze posílit prokrvení viscerálních orgánů [19].
Prognostický význam laboratorních parametrů asociovaných s postižením jater
Prognostický význam laboratorních parametrů asociovaných s postižením jater u pacientů se srdečním selháním byl prokázán mnoha studiemi (tab. 4) [3,10–13,38]. Je patrné, že jako dominantní ukazatel nepříznivé prognózy u pacientů s chronickým srdečním selháním se jeví především zvýšený BIL.
Tab. 4. Prognostický význam funkčních jaterních testů, BIL, LD a ALB u pacientů se srdečním selháním. 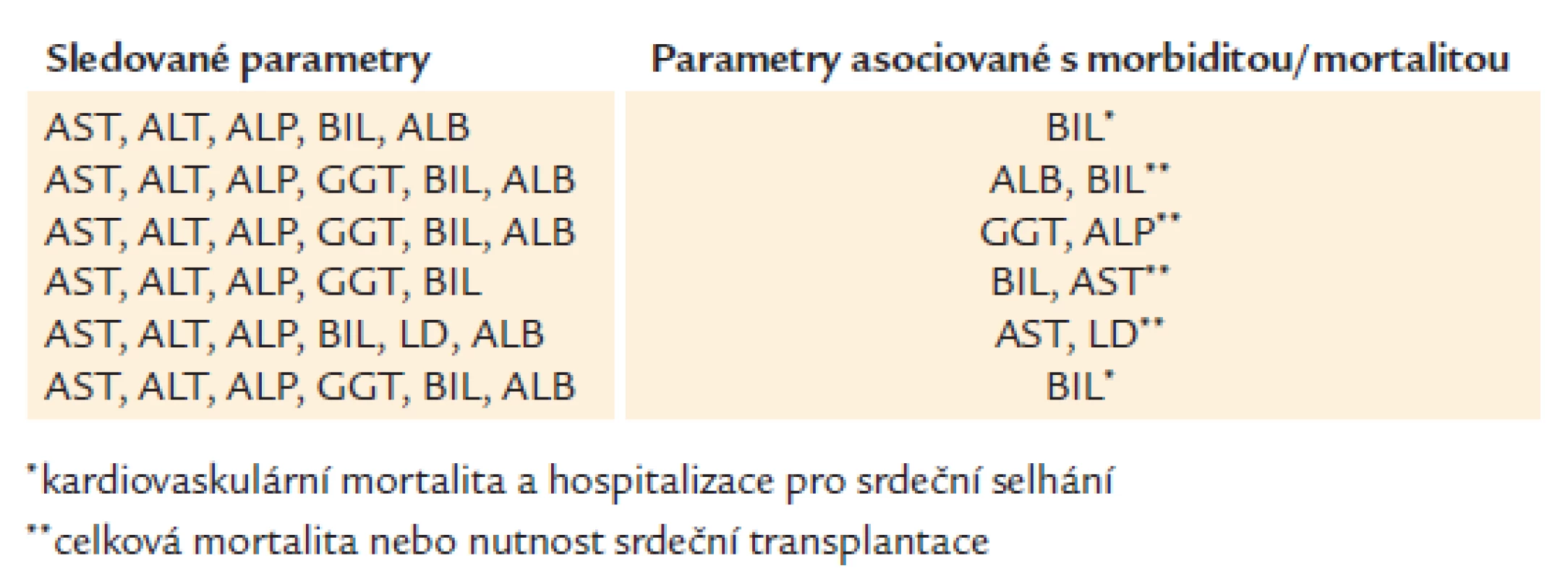
Domněnku, že BIL je nezávislým prognostickým faktorem predikujícím kardiovaskulární mortalitu a hospitalizaci pro srdeční selhání, prokázala také studie s největším souborem pacientů (2 679), subanalýza studie CHARM (Candesartan in Heart Failure: Assessment of Reduction in Mortality and Morbidity) [10]. Naproti tomu práce Van Deursena et al, která kromě laboratorní diagnostiky zkoumala i hemodynamické ukazatele, jednoznačnou souvislost abnormálních hodnot BIL s mortalitou neprokázala. V univariantní analýze byly signifikantně spojené s mortalitou hodnoty AST, ALP, GGT a LD, tyto laboratorní testy však po vztažení na invazivně změřené hemodynamické parametry (centrální žilní tlak a srdeční index) příčinnou souvislost s mortalitou neměly. Tato data naznačují, že víc než samotné hodnoty funkčních jaterních testů má prediktivní význam špatný hemodynamický status pacienta a s ním související jaterní poškození [12].
Překvapující, ve světle předchozích studií protichůdné výsledky, přinesla recentní práce Poelzla et al, kteří na populaci 1 032 pacientů prokázali prognostický význam u GGT a ALP, naproti tomu pro zvýšený BIL souvislost se stanovenými endpointy (celkovou mortalitou nebo srdeční transplantací) prokázána nebyla [3,39,40]. Tato práce však ve srovnání se studií Van Deursena et al nebrala v úvahu hemodynamické konsekvence srdečního selhání, navíc z retrospektivní analýzy nebyli vyňati pacienti s potenciálně hepatotoxickou farmakoterapií nebo anamnézou jaterního onemocnění.
Z dostupných klinických studií je také patrné, že v převážném množství prací byli zahrnuti pacienti s chronickým srdečním selháním, nicméně ojedinělá práce Shinagawy et al sledující prognostický význam funkčních jaterních testů a BIL u pacientů s akutní dekompenzací chronického srdečního selhání naznačuje podobné výsledky jako předešlé studie, a to že jako nejsilnější faktor predikující kardiovaskulární mortalitu a riziko rehospitalizace pro srdeční selhání je BIL [13].
Zajímavá je i otázka reverzibility jaterního poškození v důsledku srdečního selhání – unikátní Dichtlova studie naznačuje, že by se mohlo jednat o reverzibilní proces. Na 56 pacientech s terminálním srdečním selháním, kteří následně podstoupili srdeční transplantaci, Dichtl prokázal signifikantní pokles sérových hodnot ALP, GGT a BIL během prvních 3 měsíců po transplantaci [41]. Tyto výsledky svědčí pro potencionální reverzibilitu jaterního postižení u pacientů s terminálním srdečním selháním, pro které je typická jaterní léze cholestatického typu.
Závěr
Játra se svým komplexním cévním systémem a vysokou metabolickou aktivitou spouštějí u pacientů se srdečním selháním četné metabolické i hemodynamické změny, tyto změny v jaterním parenchymu vznikají jak na podkladě snížené orgánové perfuze u tzv. dopředného srdečního selhání, tak i na základě zvýšené žilní kongesce u pravostranného selhání srdce dozadu.
Pacienti se srdečním selháním se nejčastěji prezentují tzv. cholestatickým profilem jaterního poškození – elevací obstrukčních jaterních enzymů, naproti tomu u hepatocelulárního profilu, který bývá v případě kardiální etiologie méně častý, bývá typickým nálezem zvýšení hodnot transamináz. Neméně zajímavý je však i prognostický význam laboratorních parametrů u pacientů s jak akutním, tak chronickým srdečním selháním.
Vliv systémové hemodynamiky na jaterní postižení u kardiálního selhání je zřejmý, pacienti s nižším srdečním výdejem mají signifikantně vyšší hodnoty funkčních jaterních testů. Co se týče histopatologického obrazu postižení jater kardiální etiologie, u chronického srdečního selhání převažují fibrotické změny až jaterní cirhóza, zatímco u akutního srdečního selhání bývá dominantním nálezem hepatocytární nekróza.
Vliv srdečního selhání na játra se podle klinického i laboratorního obrazu dělí na klinicky málo významnou, mírnou alteraci funkčních jaterních testů, dále akutní ischemickou hepatitidu (mnohdy doprovázející šokové stavy) a kongestivní jaterní hepatopatii vyskytující se převážně u pravostranného srdečního selhání.
Znalost mechanizmu dopadu srdečního selhání na funkci jater a jejich role u srdeční nedostatečnosti má nejenom prognostickou hodnotu, ale umožňuje také exaktnější stanovení tíže srdečního selhání a optimalizaci terapie s ohledem na prevenci polypragmazie – vzhledem k tomu, že převážné množství kardiovaskulárních farmak je metabolizováno právě v játrech.
MUDr. Klaudia Vyskočilová
www.fnusa.cz
e-mail: klaudia.vyskocilova@fnusa.cz
Doručeno do redakce: 26. 5. 2013
Přijato po recenzi: 31. 7. 2013
Zdroje
1. Mebazaa A. Congestion and cardiorenal syndromes. Contrib Nephrol 2010; 165 : 140–144.
2. Mentz RJ, O’Conor CM. Cardiorenal syndrome clinical trial end points. Heart Fail Clin 2011; 7 : 519–528.
3. Poelzl G, Ess M, Mussner-Seeber C et al. Liver dysfunction in chronic heart failure: prevalence, characteristics and prognostic significance. Eur J Clin Invest 2012; 42 : 153–163.
4. Myers RP, Cerini R, Sayegh R et al. Cardiac hepatopathy: clinical, hemodynamic, and histologic characteristics and correlations. Hepatology 2003; 37 : 393–400.
5. Jolliffe N. Liver function in congestive heart failure. J Clin Invest 1930; 8 : 419–433.
6. Felder L, Mund A, Parker JG. Liver function tests in chronic congestive heart failure. Circulation 1950; 2 : 286–297.
7. Kubo SH, Walter BA, John DH et al. Liver function abnormalities in chronic heart failure. Influence of systemic hemodynamics. Arch Intern Med 1987; 147 : 1227–1230.
8. White TJ, Wallace RB, Gnassi AM. Hepatic abnormalities in congestive heart failure: needle biopsy studies. Circulation 1951; 3 : 59–64.
9. Killip T, Payne MA. High serum transaminase activity in heart disease. Circulatory failure and hepatic necrosis. Circulation 1960; 21 : 646–660.
10. Allen LA, Felker GM, Pocock S et al. Liver function abnormalities and outcome in patients with chronic heart failure: data from the Candesartan in heart failure: assessment of reduction in mortality and morbidity (CHARM) program. Eur J Heart Fail 2009; 11 : 170–177.
11. Batin P, Wickens M, McEntegart D et al. The importance of abnormalities of liver function tests in predicting mortality in chronic heart failure. Eur Heart J 1995; 16 : 1613–1618.
12. Van Deursen VM, Damman K, Hillege HL et al. Abnormal liver function in relation to hemodynamic profile in heart failure patients. J Card Fail 2010; 16 : 84–90.
13. Shinagawa H, Inomata T, Koitabashi T et al. Prognostic significance of increased serum bilirubin levels coincident with cardiac decompensation in chronic heart failure. Circ J 2008; 72 : 364–369.
14. Lau GT, Tan HC, Kritharides L. Type of liver dysfunction in heart failure and its relation to the severity of tricuspid regurgitation. Am J Cardiol 2002; 90 : 1405–1409.
15. Chang CY, Schiano TD. Review article: drug hepatotoxicity. Aliment Pharmacol Ther 2007; 25 : 1135–1151.
16. Henrion J, Schapira M, Luwaert R et al. Hypoxic hepatitis. Clinical and hemodynamic study in 142 consecutive cases. Medicine (Baltimore) 2003; 82 : 392–406.
17. Seeto RK, Fenn B, Rockey DC. Ischemic hepatitis: Clinical presentation and pathogenesis. Am J Med 2000; 15 : 109–113.
18. Bravo AA, Sheth SG, Chopra S. Liver biopsy. N Engl J Med 2001; 344 : 495–500.
19. Maleki M, Vakilian F, Amin A. Liver diseases in heart failure. Heart Asia 2011; 20 : 143–149.
20. Herzer K, Kneiseler G, Bechmann LP et al. Onset of heart failure determines the hepatic cell death pattern. Ann Hepatol 2011; 2 : 174–179.
21. Málek F, Hendrichová M, Krátká K et al. Correlation of functional liver mass with left ventricular ejection fraction and left atrial diameter in patients with congestive heart failure. Int J Cardiol 2008; 127 : 271–273.
22. Calderon RM, Cubeddu LX, Goldberg RB et al. Statins in the treatment of dyslipidemia in the presence of elevated liver aminotransferase levels: a therapeutic dilemma. Mayo Clin Proc 2010; 85 : 349–356.
23. Chalasani N, Younossi Z, Lavine JE et al. The diagnosis and management of non-alcoholic fatty liver disease: Practice guideline by the American Association for the Study of Liver Diseases, American College of Gastroenterology, and the American Gastroenterological Association. Hepatology 2012; 55 : 2005–2023.
24. Fracanzani AL, Burdick L, Raselli S et al. Carotid artery intima-media thickness in nonalcoholic fatty liver disease. Am J Med 2008; 121 : 72–78.
25. Kim D, Kim WR, Kim HJ et al. Association between noninvasive fibrosis markers and mortality among adults with nonalcoholic fatty liver disease in the United States. Hepatology 2013; 57 : 1357–1365.
26. Van Lingen R, Warshow U, Dalton HR et al. Jaundice as a presentation of heart failure. J R Soc Med 2005; 98 : 357–359.
27. Naschitz JE, Slobodin G, Lewis RJ et al. Heart diseases affecting the liver and liver diseases affecting the heart. Am Heart J 2000; 140 : 111–120.
28. Wanless IR, Liu JJ, Butany J. Role of thrombosis in the pathogenesis of congestive hepatic fibrosis (cardiac cirrhosis). Hepatology 1995; 21 : 1232–1237.
29. Bynum TE, Boitnott JK, Maddrey WC. Ischemic hepatitis. Dig Dis Sci 1979; 24 : 129–135.
30. Henrion J, Descamps O, Luwaert R et al. Hypoxic hepatitis in patients with cardiac failure: incidence in a coronary care unit and measurement of hepatic blood flow. J Hepatol 1994; 21: 696–703.
31. Raurich JM, Llompart-Pou JA, Ferreruela M et al. Hypoxic hepatitis in critically ill patients: incidence, etiology and risk factors for mortality. J Anesth 2011; 25 : 50–56.
32. Brodanová M. Choroby jater. In: Klener P et al (eds). Vnitřní lékařství. Praha: Galén-Karolinum 2006 : 631–632.
33. Hopper I, Kemp VV, Porapakkham P et al. Impact of heart failure and changes to volume on liver stiffness: non-invasive assessment using transient elastography. Eur J Heart Fail 2012; 14: 621–627.
34. Colli A, Pozzoni P, Berzuini A et al. Decompensated chronic heart failure: Increased liver stiffness measured by means of transient elastography. Radiology 2010; 257 : 872–878.
35. Ebinuma H, Saito H, Komuta M et al. Evaluation of liver fibrosis by transient elastography using acoustic radiation force impulse: comparison with Fibroscan®. J Gastroenterol 2011; 46: 1238–1248.
36. Sporea I, Sirli R, Bota S et al. Comparative study concerning the value of acoustic radiation force impulse elastography (ARFI) in comparison with transient elastography (TE) for the assessment of liver fibrosis in patients with chronic hepatitis B and C. Ultrasound Med Biol 2012; 38 : 1310–1316.
37. Petrtýl J, Brůhal R, Urbánek P et al. Katetrizace jaterních žil – vybrané aspekty hodnocení. Vnitř Lék 2013; 59 : 587–590.
38. Ambrosy AP, Vaduganathan M, Huffman MD et al. Clinical course and predictive value of liver function tests in patients hospitalized for worsening heart failure with reduced ejection fraction: an analysis of the EVEREST trial. Eur J Heart Fail 2012; 14 : 302–311.
39. Ess M, Mussner-Seeber C, Mariacher S et al. Gamma-glutamyltransferase rather than total bilirubin predicts outcome in chronic heart failure. J Card Fail 2011; 17 : 577–584.
40. Poelzl G, Eberl C, Achrainer H et al. Prevalence and prognostic significance of elevated gamma-glutamyltransferase in chronic heart failure. Circ Heart Fail 2009; 2 : 294–302.
41. Dichtl W, Vogel W, Dunst KM et al. Cardiac hepatopathy before and after heart transplantation. Transpl Int 2005; 18 : 697–702.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2013 Číslo 12- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Co dělat při intoleranci statinů?
-
Všetky články tohto čísla
- Indikátory zánětu u pacientů s koronární aterosklerózou – editorial
- Komentář ke studii EDGE – editorial
- Pozice tiotropia v nových léčebných doporučeních pro chronickou obstrukční plicní nemoc – editorial
- Prospektivní, multicentrická, neintervenční studie na zhodnocení současné léčby pacientů s diabetes mellitus 2. typu, nedostatečně kompenzovaných monoterapií metforminem – KOMETA CZ
- Účinnost a bezpečnost vildagliptinu jako léku druhé volby ve srovnání s jinými perorálními antidiabetiky u pacientů s diabetes mellitus 2. typu: české výsledky v rámci celosvětové prospektivní kohortové studie EDGE
- Indikátory zápalu u pacientov s koronárnou aterosklerózou – úloha usCRP v diagnostike a predikcii prognózy ochorenia
- Současný pohled na onemocnění jater u srdečního selhání
- Pozice tiotropia v nových léčebných doporučeních pro chronickou obstrukční plicní nemoc
- Súčasnosť a budúcnosť farmako-artériotromboprofylaxie v klinickej praxi. Odporúčania Angiologickej sekcie Slovenskej lekárskej komory
- Doporučené postupy v léčbě starších pacientů s diabetes mellitus v ČR
- Doporučení KDIGO pro léčbu zvýšeného krevního tlaku u chronického onemocnění ledvin
- Zánětlivá borreliová dilatační kardiomyopatie
- Závažná rizika spojená s užíváním natrium-fosfátových projímadel
- Histiocytární sarkom
- Effects of the angiotensin receptor blocker Valsartan (Valsacor®) on arterial pressure, indices of myocardial diastolic function and global longitudinal strain in patients with uncontrolled arterial hypertension
- Mechanizmus pleiotropního účinku sulodexidu
- Rifaximin v léčbě jaterní encefalopatie
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Současný pohled na onemocnění jater u srdečního selhání
- Rifaximin v léčbě jaterní encefalopatie
- Histiocytární sarkom
- Závažná rizika spojená s užíváním natrium-fosfátových projímadel
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



