-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Jak zlepšit adherenci k lékovému režimu u klinicky komplexních polymorbidních seniorů? Editorial
Autoři: E. Topinková
Působiště autorů: Geriatrická klinika 1. lékařské fakulty UK a VFN Praha, přednostka prof. MU Dr. Eva Topinková, CSc.
Vyšlo v časopise: Vnitř Lék 2013; 59(9): 760-763
Kategorie: Editorial
Vepřeková B et al. Compliance starších nemocných s kognitivní poruchou. Vnitř Lék 2013; 59(9): 794 – 799.
Stárnutí české populace i populace pacientů v péči všeobecného internisty je doprovázeno rostoucí spotřebou léků a obvykle i polyfarmakoterapií. Podle údajů WHO a recentní studie ze Spojených států více než 90 % seniorů užívá alespoň 1 lék, u 81 % se jedná o léky na předpis, u 42 % o léky volně prodejné a 49 % užívá potravinové doplňky [1,2]. Tyto údaje reflektují chronickou polymorbiditu, s níž se u seniorů zejména ve věku nad 75 – 85 let setkáváme. Nejde však jen o prostý součet přítomných chorob především chronických kardiovaskulárních, cerebrovaskulárních, metabolických, muskuloskeletálních a psychiatrických onemocnění, ale o klinicky vzájemně se ovlivňující a podmiňující nozologické jednotky v terénu stárnoucího organizmu, které dotvářejí obraz „klinicky komplexního“ („clinically complex“) geriatrického pacienta. Právě tito pacienti jsou chronickými uživateli zdravotní péče včetně chronické polyfarmakoterapie s častým výskytem závažných nežádoucích polékových reakcí.
Farmakologický management jednotlivých onemocnění se řídí mezinárodními a národními guidelines. Lékaři různých odborností předepisují staršímu pacientovi léčbu „své“ choroby, často jen s omezenou znalostí dalších léků, které nemocný užívá. K tomu přispívá nepochybně i zvyšující se výskyt kognitivních poruch, kdy informace o užívaných lécích a komplexním lékovém režimu získaná od pacienta je nespolehlivá a ne vždy dostupná. Tato situace může vést k závažným zdravotním rizikům způsobených non‑adherencí: selhání léčby, horšení funkčních schopností, nutnost opakovaných urgentních vyšetření, hospitalizací a následné zdravotně sociální péče [1].
V tomto čísle Vnitřního lékařství se autorky Vepřeková a Pokorná ve své původní práci „Compliance starších nemocných s kognitivní poruchou“ zaměřují na deklarovanou adherenci (complianci) s lékovým režimem u souboru starších pacientů průměrného věku 81 let v následné péči typu LDN v souvislosti s jejich kognitivními schopnostmi a fyzickou soběstačností [3]. Potvrzují nejen vysoký výskyt kognitivních poruch v této populaci (49 %) a očekávanou korelaci mezi kognitivním deficitem a non‑compliancí (nedostatečná znalost počtu, názvů a dávek užívaných léků a jejich indikací), ale také nespolehlivost údajů poskytnutých pacientem a subjektivní „nadhodnocení“ své compliance. Pacienti s kognitivní poruchou se prezentují zdravotníkům mnohem lépe, než je realita. Proto autorky doporučují kromě standardního dotazu typu „užíváte správně všechny předepsané léky?“ (na který u kognitivně postižených pacientů dostaneme vždy odpověď „ano“) provést orientační posouzení poznávacích funkcí a podrobnější zhodnocení schopností pacienta užívat správně léky, připravit si a správně obstarat užívané léky, zhodnotit jejich žádoucí i nežádoucí účinky a včas je signalizovat lékaři. Podle autorek článku je test MMSE dostatečně citlivý pro detekci kognitivní poruchy, a tedy pro identifikaci pacientů v riziku non‑compliance. Tito pacienti vyžadují specifický přístup k dosažení dostatečné compliance (zajištění dohledu a pomoci při užívání léků) a k předcházení nežádoucích efektů spojených s non‑compliancí [3].
Faktory ovlivňující adherenci seniorů
Starší pojem compliance definovaný jako míra souhlasu pacientova chování s doporučením lékaře je nově nahrazován termínem adherence, který odráží také míru spolupráce pacienta, jeho zapojení do rozhodovacího procesu a následné souhlasné chování s doporučeným postupem léčby [4]. V dalším textu proto budeme užívat termín adherence, definované v případě lékové adherence jako 80 – 120% shoda v užívání doporučených léků [1,4]. Dosažení plné adherence s užíváním medikace by však nemělo být považováno za primární cíl, je pouze prostředkem k dosažení co nejlepších léčebných výsledků a maximální bezpečnosti pacienta.
Adherence starších pacientů je obecně nižší než u dospělých, ale údaje z jednotlivých studií kolísají v rozmezí 40 – 75 % non‑adherentních pacientů. Široký rozptyl hodnot non‑adherence souvisí s odlišnostmi v metodologii (odlišné definice adherence, odlišné metody jejího posouzení), studovaných populacích i nemocnosti. Přesto všechny studie potvrzují, že věk samotný není prediktivním faktorem non‑adherence [1,5].
Adherence u starších pacientů je ovlivňována řadou faktorů vztahujících se k medikaci (počet léků, léková forma, komplexnost a délka léčby, výskyt nežádoucích účinků), preskribujícímu lékaři (vzdělání, postoje, časový faktor, cena) i pacientovi (závažnost choroby, komorbidity, fyziologické změny v důsledku stárnutí, zdravotní gramotnost, kognitivní a afektivní poruchy postoje a hodnotové orientace). V recentním systematickém přehledu studií Gellad et al potvrdili horší adherenci u pacientů užívajících vyšší počet léků, pacientů s vyšším stupněm komorbidity (hodnocenou Charlson Commorbidity Indexem), s horším subjektivně hodnoceným zdravotním stavem, s kognitivní poruchou, zejména s poruchou exekutivních funkcí, s nežádoucími účinky léků, s horší znalostí léčené nemoci a u pacientů s omezenou schopností obstarat si léky [5]. Podobné výsledky jsme popsali i v české seniorské populaci průměrného věku 82 let sledované v rámci mezinárodního projektu ADHOC [6]. Jako rizikové faktory non‑adherence jsme nalezli následující: užívání 7 a více druhů léků (OR 2,2), 10 a více jednotlivých aplikací denně (OR 2,5), podávání častěji než 2krát za den (OR 2,4),problémová manipulace s léky (OR 4,6), polypragmazie déle než 5 let (OR 5,5) a příprava léků bez dohledu nebo pomoci (OR 2,8). Nejvyšší výskyt non‑adherence byl zjištěn u antidepresiv (80 %), antiastmatik (68 %), fibrátů (60 %), nesteroidních antiflogistik, vazodilatancií a antikoagulancií/ antiagregancií (50 %).
Jak optimalizovat adherenci?
Přehled intervencí zlepšujících adherenci v obecné populaci publikovali recentně Vytřísalová a Češka [7]. U geriatrických pacientů metaanalýza 33 randomizovaných kontrolovaných studií (RCT) zahrnující 11 827 pacientů průměrného věku 67 let hodnotila efekt širokého spektra intervencí zaměřených na zlepšení adherence [8]. U intervenovaných pacientů došlo ke statisticky významnému lepšení adherence (effect size – ES = 0,33; 95% CI0,22 – 0,45) a zlepšení znalostí pacientů o užívané medikaci (ES = 0,48; 95% CI 0,20 – 0,76). Intervence však nevedly ke zlepšení výstupů péče, neovlivnily ani spotřebu zdravotních služeb. Jako účinnější se u starších nemocných ukázaly následující postupy: úprava vhodného balení a přípravy léků (např. dávkovače, individualizované balení více léků v blistru), dále byly účinné tištěné krátké instrukce pro užívání léků, nácvik pravidelného užití léků v rámci rutinních denních aktivit. Autoři uvádějí, že metaanalýza poskytuje dostatek vědeckých důkazů o metodách pro zlepšení adherence. Behaviorální intervence přinášejí lepší výsledky než intervence založené na prosté edukaci pacienta. Bohužel adherence byla studována v „laboratorních“ podmínkách RCT se seniory v kategorii „mladších“, obvykle s jednou nebo menším počtem léčených chorob (hypertenze, diabetes, artróza) a sledovanou adherencí k pouze malému počtu léků (medián počtu léků = 2). Proto sami autoři upozornili na relativně nízkou použitelnost vědeckých důkazů pro reálnou populaci polymorbidních seniorů vysokého věku nad 80 let s bohatou polypragmazií. Ve většině studií byla intervence prováděna farmaceuty (19 studií), lékař byl zapojen pouze v 6 ze 33 analyzovaných studiích.
Topinková et al (2012) publikovali přehled RCT studií hodnotících adherenci u starších pacientů s polymorbiditou (> 3 choroby) a vícečetnou medikací (> 3 – 4 léky) [4]. Ve všech 9 studiích byla prováděna komplexnější multimodální intervence obvykle kombinující kognitivní (verbální nebo písemná informace) a behaviorální přístupy. Jako přínosné pro zlepšení adherence se ukázaly tyto postupy: podrobné komplexní zhodnocení lékového režimu tzv. „medication review“ lékařem nebo farmaceutem a jeho zjednodušení, individualizovaná edukace pacienta kombinovaná s nástroji „připomínajícími“ užívání léku/ ů, např. s pomůckami formou dávkovačů, a dlouhodobější vedení pacienta a opakované návštěvy pacienta zaměřené na lékovou adherenci [4].
Celkově lze shrnout, že většina studií zaměřených na zlepšování adherence v užívání léků se zaměřuje na „technickou“ stránku věci. Jednak sleduje adherenci jako hlavní cílový parametr, pouze výjimečně se zaměřuje na sledování zdravotních dopadů (non)-adherence, jako např. zdravotního stavu, soběstačnosti, kvality života a nákladů na zdravotní služby. Ověřované intervence se výrazně zaměřují na lékovou (farmaceutickou) stránku problému. Nedostačující pozornost je věnována psychosociálním aspektům adherence, jako např. postojovým a hodnotovým orientacím pacienta, strategiím zvládání problému a vyrovnávání se danou situací, sociálním aspektům, jako jsou dostupnost, znalosti a spolupráce pečovatele, motivace pacienta. Současný výzkum v této oblasti zůstává převážně v rukou (klinických) farmaceutů. Je třeba rozvíjet zájem lékařů o tuto problematiku, spolupráci s klinickými farmaceuty a klinický výzkum v této oblasti.
Adherence u pacientů s kognitivní poruchou a demencí
Správné užívání medikace vyžaduje komplexní kognitivní dovednosti zahrnující obstarání si předepsané medikace, porozumění instrukcím o jejím užívání, užívání správné medikace a dávky ve správnou denní dobu, spojení užívání léku s denní rutinou (např. po snídani), plánování návštěv lékaře k doplnění využívané medikace, posouzení efektu léčby, řešení situace při vynechání dávky nebo užití většího počtu dávek apod. Tyto činnosti vyžadují neporušenou paměť, myšlení, řečové funkce, konstrukční praxi a exekutivní funkce. Proto i mírné kognitivní poruchy a demence významně zhoršují adherenci pacientů. Tito pacienti vyžadují zvýšenou pozornost k zajištění správného lékového režimu. Evidence o metodách, které jsou efektivní, je velmi sporá a je založena na několika málo studiích [9].
V klinické praxi se však stále potýkáme s problémem rozpoznání kognitivní poruchy i již klinicky vyjádřené demence, které mohou být lékařem v rámci krátké kontrolní nebo cílené návštěvy lehce přehlédnuty. Mnozí pacienti s kognitivní poruchou, a to i střední závažnosti, mohou být schopni uspokojivé konverzace a bez provedení alespoň krátkého screeningu není kognitivní porucha diagnostikována. Prvním krokem pro zlepšení adherence a účinnosti léčby je podrobná léková anamnéza, umožňující odhalit nesrovnalosti a nedostatky v informaci poskytnuté pacientem. Krátký screening kognitivních funkcí (vybavení fiktivní adresy, test kreslení hodin) či provedení podrobnějšího zhodnocení s po-užitím standardizovaného MMSE testuumožní odhalit přítomnost a závažnost kognitivní poruchy (a odeslat pacienta k dalšímu vyšetření specialistou). V rámci odbornosti vnitřního lékařství pak doporučujeme uplatnit strategie zlepšující adherenci – objektivizovat údaje o užívané medikaci od praktického lékaře, rodinného pečovatele nebo agentury domácí péče, snaha o maximální zjednodušení lékového režimu (minimum léků, optimálně podání 1krát denně), využití dávkovačů, zajištění podávání léků rodinným nebo profesionálním pečovatelem apod.
Vzhledem k častým chybám v užívání medikace v seniorské populaci doporučujeme také jednoduché zhodnocení schopnosti pacienta užívat samostatně medikaci. Zejména pro pacienty s mírnou kognitivní poruchou nebo lehkou formou demence je vhodné zhodnocení založené na pozorování pacienta, nespokojit se pouze se subjektivně hodnocenou mírou adherence nemocným. Optimální je vyšetření geriatrem, a to zejména u pacientů s komplikovaným lékovým režimem nebo podezřením na non‑adherenci. Geriatr v rámci komplexního geriatrického hodnocení obvykle kromě zhodnocení zdravotního stavu a geriatrických syndromů a rizik provádí i hodnocení soběstačnosti, kognitivních a afektivních funkcí a sociální situace. Posouzení medikace a schopností pacienta medikaci samostatně užívat je součástí instrumentálních ADL (vyjádřené pouze 1 položkou). Zkušený internista v ambulanci i u lůžka u geriatrických pacientů provádí rozšířenou podrobnější lékovou anamnézu. K podrobnějšímu zhodnocení schopnosti pacienta obstarat „lékový management“ („medication management“) se v zahraničí užívají standardizované testy, které však u nás nebyly formálně ověřovány ani validizovány.
Pro příklad uvádím v tab. 1 nejčastěji užívané testy včetně dovedností, které jsou v rámci nich hodnocené. Nejčastěji užívaný nástroj pro posouzení je DRUGS (Drug Regimen Unassisted Grading Scale) a dále MedMaIDE (Medication Management Instrument for Deficiencies in the Elderly), MMAA (Medication Management Ability Assessment) a MAT (Medication Administration Test) [4]. Tyto testy používají buď vlastní medikaci pacienta, nebo simulovanou medikaci. Jsou časově náročnější, 15 – 30 min, jsou většinou určeny pro klinické farmaceuty a pouze některé z nich byly validizovány a pilotovány na větších souborech starších pacientů. V současné době probíhá pilotní projekt na Geriatrické klinice v Praze. Jedna z novějších studií popisuje zkušenosti s použitím těchto testů, které u hospitalizovaných seniorů umožnily rozpoznat problémové oblasti v samostatném užívání léků a zahájit nácvik problémových činností ještě za hospitalizace před plánovaným propuštěním. Bylo dosaženo zlepšení schopností pacienta pro management své medikace a došlo ke zlepšení adherence pacienta po propuštění [10].
Tab. 1. Položky zahrnuté ve standardizovaných testech pro hodnocení schopnosti pacienta samostatně užívat léky. 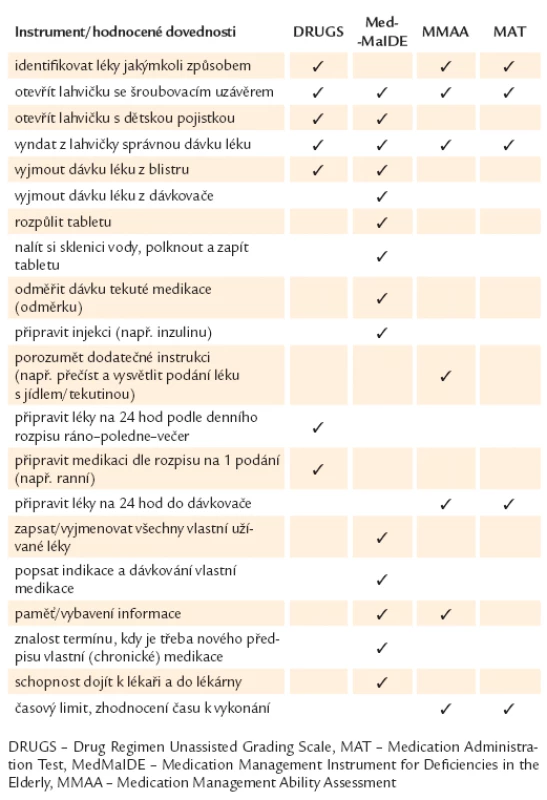
Závěr
Komplexní geriatrický pacient s polyfarmakoterapií vyžaduje komplexní přístup i s ohledem na zhodnocení adherence s lékovým režimem, objektivní posouzení schopností pacienta zvládat lékový management včetně jeho ochoty a motivace. Jako klíčové se jeví posouzení kognitivních schopností a soběstačnosti, preferujeme použití standardizovaných škál, např. MMSE (použití vázáno licenční smlouvou s poplatkem za jeho provedení). Alternativně lze dle našich zkušeností využít i MoCa (Montreal Cognitive Assessment), i když jeho validitu je třeba ověřit v českém prostředí. V případě problémů s dodržováním lékového režimu (non‑adherencí) pak jsou dostatečné vědecké důkazy o efektivitě některých intervenčních postupů.
prof. MU Dr. Eva Topinková, CSc.
www.vfn.cz
e‑mail: Eva.Topinkova@vfn.cz
Doručeno do redakce: 20. 8. 2013
Zdroje
1. World Health Organization (WHO). Adherence to long‑term therapies: evidence for action. Geneva, WHO 2003.
2. Campbell NL, Boustani MA, Skopelja EN et al.Medication adherence in older adults with cognitive impairment: A systematic evidence‑based review. Am J Geriatr Pharmacother 2012; 10 : 165 – 177.
3. Vepřeková A, Pokorná A. Compliance starších nemocných s kognitivní poruchou. Vnitř Lék 2013; 59 : 794–799.
4. Topinková E, Baeyens JP, Michel JP et al. Evidence.based strategies for the optimization of pharmacotherapy in older people. Drugs Aging 2012; 29 : 477 – 494.
5. Gellad WF, Grenard JL, Marcum ZA. A systematic review of barriers to medication adherence in the elderly: Looking beyond cost and regimen complexity. Am J Geriatr Pharmacother 2011; 9 : 11 – 23.
6. Topinková E, Fialová D, Carpenter GI et al. Mezinárodní srovnání lékové compliance a faktorů ovlivňujících non‑complianci u seniorů s polyfarmakoterapií. Čas Lék Česk 2006; 145 : 726 – 732.
7. Vytřísalová M, Češka R. Jak podpořit adherenci k farmakologické léčbě. Remedia 2009; 19 : 246 – 250.
8. Conn VS, Hafdahl AR, Cooper PS et al. Interventions to improve medication adherence among older adults: meta‑analysis of adherence outcomes among randomized controlled trials. Gerontologist 2009; 49 : 447 – 462.
9. Arlt S, Lindner R, Rösler A et al. Adherence to medication in patients with dementia: predictors and strategies for improvement. Drugs Aging 2008; 25 : 1033 – 1047.
10. Lam P, Elliot RA, George J. Impact of a self- - administration of medications programme on elderly in patients’competence to manage medications: a pilot study. J Clin Pharm Ther 2011; 36 : 80 – 86.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2013 Číslo 9- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Co dělat při intoleranci statinů?
-
Všetky články tohto čísla
- Využití natriuretických peptidů v diagnostice hypertrofie levé komory u obézních hypertoniků s metabolickým syndromem – editorial
- Jak zlepšit adherenci k lékovému režimu u klinicky komplexních polymorbidních seniorů? Editorial
- Vede fyzická aktivita při přerušení dodávky inzulinu inzulinovou pumpou u pacientů s diabetem 1. typu ke klinicky významným změnám?
- Využití natriuretických peptidů v diagnostice hypertrofie levé komory srdeční u obézních hypertoniků s metabolickým syndromem
- Význam stanovení kardiálních biomarkerů ve stratifikaci a sledování nemocných s AL‑ amyloidózou – zkušenosti jednoho centra
- Hodnocení vybraných ukazatelů apoptózy a angiogeneze u chronické lymfocytární leukemie
- Compliance starších nemocných s kognitivní poruchou
- Studie RESOLUTE v České republice: inzulin glargin zlepšuje kompenzaci diabetu 2. typu u pacientů s dosud neuspokojivým výsledkem terapie kombinací inzulin detemir a perorální antidiabetika. Výsledky neintervenčního projektu RESOLUTE v České republice
- Food intake regulation – 1st part
- Doporučení České endokrinologické společnosti pro léčbu Cushingova syndromu v dospělosti
- Cold agglutinin disease – no response to glucocorticoids and rituximab, what treatment is best for the 3rd line of therapy? Case report and review of the literature
- Regionální migrující osteoporóza – diferenciálně diagnostický problém
- Nová data a indikace pro sulodexid
-
ERS 2013
Duální bronchodilatace aneb Ve dvou (se) to lépe táhne - Dabigatran – klinická zkušenost z více než dvou miliónů pacientoroků
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Cold agglutinin disease – no response to glucocorticoids and rituximab, what treatment is best for the 3rd line of therapy? Case report and review of the literature
- Food intake regulation – 1st part
- Nová data a indikace pro sulodexid
- Doporučení České endokrinologické společnosti pro léčbu Cushingova syndromu v dospělosti
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



