-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Léčba Waldenströmovy makroglobulinemie v roce 2013
Therapy of Waldenström´s macroglobulinaemia in the year 2014
Therapy of Waldenström´s macroglobulinaemia (WM) is indicated in patients with clinically relevant symptoms. Therapeutic plasmapheresis should be performed in cases with hyperviscosity. The intensity of chemotherapy should be adjusted to the degree of cytopenia. Monotherapy with rituximab is recommended in cases with severe cytopenia, also combination of rituximab with dexamethasone should be possible. Patients with symptomatic WM without severe cytopenia should received a rituximab-containing regimens, optimal variant is combination of rituximab + dexamethasone + alkylation drug (such as cyclophosphamide or bendamustine). Possible treatment combinations are for instance R-CHOP (rituximab, cyclophosphamide, vincristine, and prednisone), R-COP (rituximab, cyclophosphamide, and prednisone), or RCD (rituximab, cyclophosphamide, and dexamethasone). The choice of regimen in individual patients will take into consideration performance status, clinical features including renal function, comorbidities and potential candidacy for stem cell transplantation.Chlorambucil and rituximab is possible treatment options for older patients. The choice of treatment of WM relapse depends on the time of treatment response. Retreatment with primary therapy may be appropriate in patients with duration of treatment response at least 2 years. Other treatment possibilities for WM relapse are regimens containing fludarabine, cladribine or bortezomib. Autologous transplantation of peripheral blood stem cells is feasible therapeutic option for relapsed WM in younger, fitter patients with aggressive chemosensitive disease.
Key words:
bendamustin – bortezomib – rituximab – hyperviscosity – cryoglobulinemia – cold agglutinin disease – monoclonal imunoglobulin related disorders – Waldenström´s macroglobulinaemia
Autoři: Zdeněk Adam; Marta Krejčí; Luděk Pour; Eva Ševčíková
Působiště autorů: Interní hematologická a onkologická klinika LF MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Mayer, CSc.
Vyšlo v časopise: Vnitř Lék 2014; 60(2): 139-157
Kategorie: Přehledný referát
Souhrn
Léčba Waldenströmovy makroglobulinemie se zahajuje až při klinických symptomech Při projevech hyperviskozity je indikována léčebná plazmaferéza. Při volbě léčebného postupu je třeba přihlédnout k míře cytopenie. Při závažné neutropenii či trombocytopenbii je vhodné podat rituximab v monoterapii, lépe však s dexametazonem, anebo v kombinaci s talidomidem případně s bortezomibem. Za vhodnou iniciální léčbu se obecně považuje kombinace rituximab + alkylační cytostatikum (anebo kombinace cytostatik) + kortikoidy ve vyšší dávce. Pro pacienty bez závažné cytopenie je vhodné schéma R-CHOP (rituximab, cyklofosfamid, doxorubicin, vinkristin a prednison). Tato léčba dosahuje až 9 % kompletních remisí a 94 % celkových léčebných odezev. S prohlubováním cytopenie je vhodné ubírat intenzitu cytostatické léčby a upřednostnit chemoterapii R-COP (rituximab, vinkristin, cyklofosfamid a prednison), případně RCD (rituximab, cyklofosfamid a dexametazon). U starších pacientů je možné použít chlorambucil v kombinaci s rituximabem. Trojkombinace RCD je používána jako standardní léčba jak v USA na Mayo Clinic, tak v Evropě skupinou European Myeloma Network.
Pokud léčebná odezva trvala alespoň 2 roky, lze při relapsu použít stejný léčebný postup jako v iniciální léčbě. Je-li trvání léčebné odezvy kratší než 2 roky, je vhodné použití vysokodávkované chemoterapie s autologní transplantací krvetvorné tkáně, pokud vzhledem k věku a komorbiditám přichází v úvahu. Pokud ne, volíme léčebný režim sestavený z léků, které mají prokázanou účinnost při léčbě Waldenströmovy makroglobulinemie a které nebyly použity v rámci léčby první linie (purinové analogum + rituximab + alkylační cytostatikum). Novými léky pro toto onemocnění jsou bortezomib a bendamustin. Monoterapie bortezomibem dosahuje 60–85% lečebné odezvy v rámci léčby druhé a další linie. Léčba bendamustinem v kombinaci s rituximabem dosáhla vyšší počet léčebných odezev o delším trvání než léčba kombinací R-CHOP.Klíčová slova:
bendamustin – bortezomib – hyperviskozita – kryoglobulinemie – nemoc chladových aglutininů – nemoci způsobené monoklonálním imunoglobulinem – rituximab – Waldenströmova makroglobulinemieÚvod
Je tomu téměř 70 let, co Jan Gosta Waldenström poprvé popsal případ 2 pacientů, trpících opakovaným krvácením z nosu a z úst, kteří měli lymfadenopatii, trombocytopenii, zvýšenou sedimentací erytrocytů, zvýšenou viskozitu séra, zvýšený počet lymfoidních buněk v kostní dřeni a normální nález na snímcích kostí [1]. Definice této nemoci byla od té doby postupně upřesňována, v současnosti platí WHO klasifikace lymfoproliferativních chorob, která Waldenströmovu makroglobulinemii definuje přítomností monoklonálního imunoglobulinu typu IgM při histologicky prokázané infiltraci kostní dřeně lymfoplazmocytárním lymfomem.
Epidemiologické údaje
Waldenströmova makroglobulinemie je vzácně se vyskytující monoklonální gamapatie. Wang uvádí incidenci Waldenströmovy makroglobulinemie 3,8/1 milion obyvatel, amyloidózy 8/1 milion obyvatel a mnohočetného myelomu 40/1 milion obyvatel. Waldenströmova makroglobulinemie je 2krát častější u mužů než u žen [2]. Vos uvádí incidenci kolem 3 případů na 1 milion [3].
V ČR by tedy ročně mělo být diagnostikováno 30–38 nových případů.
Příznaky nemoci
Specifické příznaky nemoci:
- projevy insuficience kostní dřeně
- projevy toxicity monoklonálního imunoglobulinu a hyperviskozitu
- projevy extramedulární proliferace lymfoplazmocytárního lymfomu (lymfadenopatie, splenomegalie)
K nespecifickým příznakůmpatří patologická únava (fatigue) související s normochromní normocytární anémií anebo s hyperviskozitou. Samotná anémie může mít více příčin: masivní infiltraci kostní dřeně s potlačenou fyziologickou krvetvorbou, hemodiluci při vysoké koncentraci monoklonálního imunoglobulinu anebo krevní ztráty. Anémie může být také důsledkem utlumení erytropoézy prozánětlivými cytokiny jako u anémie chronických chorob. U pacientů s Waldenströmovou makroglobulinemií bylo zjištěno, že patologické buňky produkují hepcidin a že jeho hladiny korelovaly s hladinami IL6 a C-reaktivního proteinu. Zvýšená tvorba hepcidinu přispívá k anémii, způsobuje poruchu reutilizace železa a vede k depozitům železa v nevyužitelné formě [4,5].
K nespecifickým příznakům patří také úbytek hmotnosti a febrilie či subfebrilie. Z patologických nálezů jsou to: hepatomegalie (20 %), splenomegalie (15 %), lymfadenopatie (15 %). Pacienti s Waldenströmovou makroglobulinemií mají vyšší riziko krvácení či trombózy vzhledem k nízkým hladinám von Willebrandova faktoru [6]. Příznaky jsou podrobně uvedeny v jiném textu [3,7] a zde je stručně shrnuje tab. 1.
Tab. 1. Příznaky Waldenströmovy makroglobulinemie 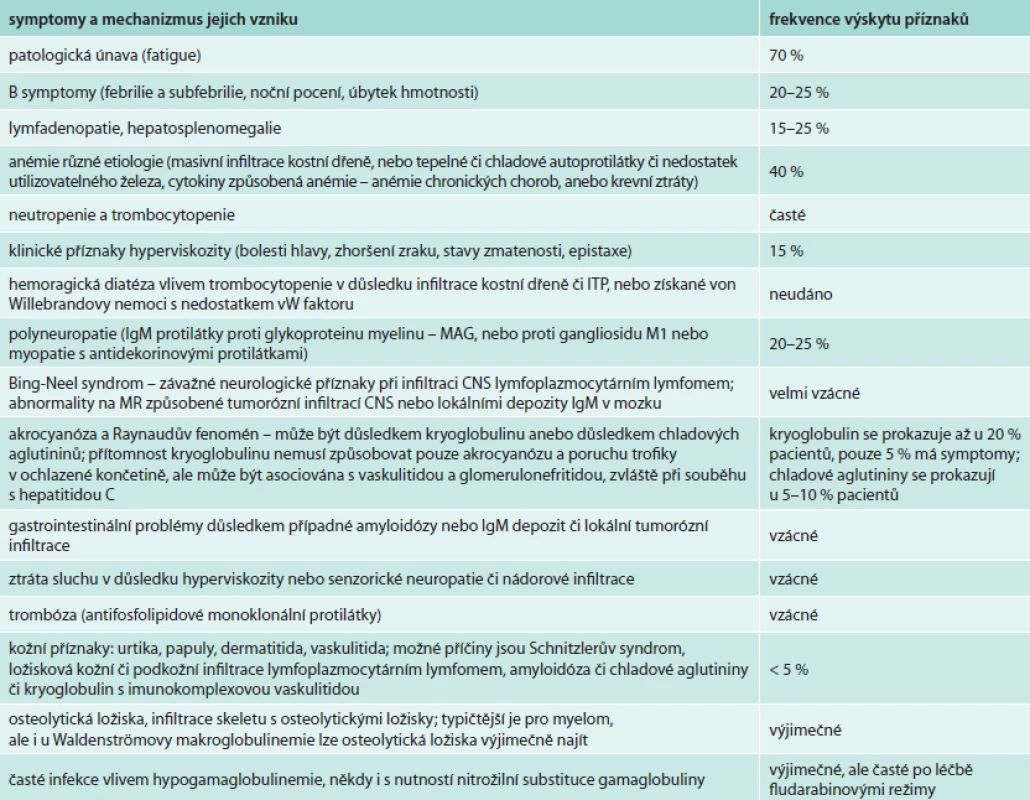
Některé publikace uvádějí, že u Waldenströmovy makroglobulinemie nedochází k patologické osteolýze. Není to tak zcela pravda, literatura popisuje vzácné případy, u nichž mezi projevy Waldenströmovy makroglobulinemie patřila i patologická osteolytická ložiska [8].
Kryoglobulinemie I. typu je způsobena monoklonálním imunoglobulinem typu IgM, který v chladu gelifikuje a způsobuje tak poruchu prokrvení prochlazené končetiny (obr. 1). V literatuře se popisuje asociace Waldenströmovy makroglobulinemie s hepatitidou C. U těchto nemocných je často přítomná kryoglobulinemie II. typu: kryoglobulin je komplex z polyklonálního imunoglobulinu typu IgG a monoklonálního imunoglobulinu typu IgM. Tento komplex má aktivitu revmatoidního faktoru. Kryoglobulinemie provázející pacienty s Waldenströmovou makroglobulinemií a hepatitidou C má pestřejší příznaky, způsobuje kožní purpuru, artralgie, Raynaudův fenomén a vaskulitidu postihující kůži, játra, ledviny i periferní nervy [9–22]. Chlad může manifestovat také nemoc chladových aglutininů (obr. 2).
Obr. 1. Kožní změny v důsledku prochlazení při kryoglobulinemii 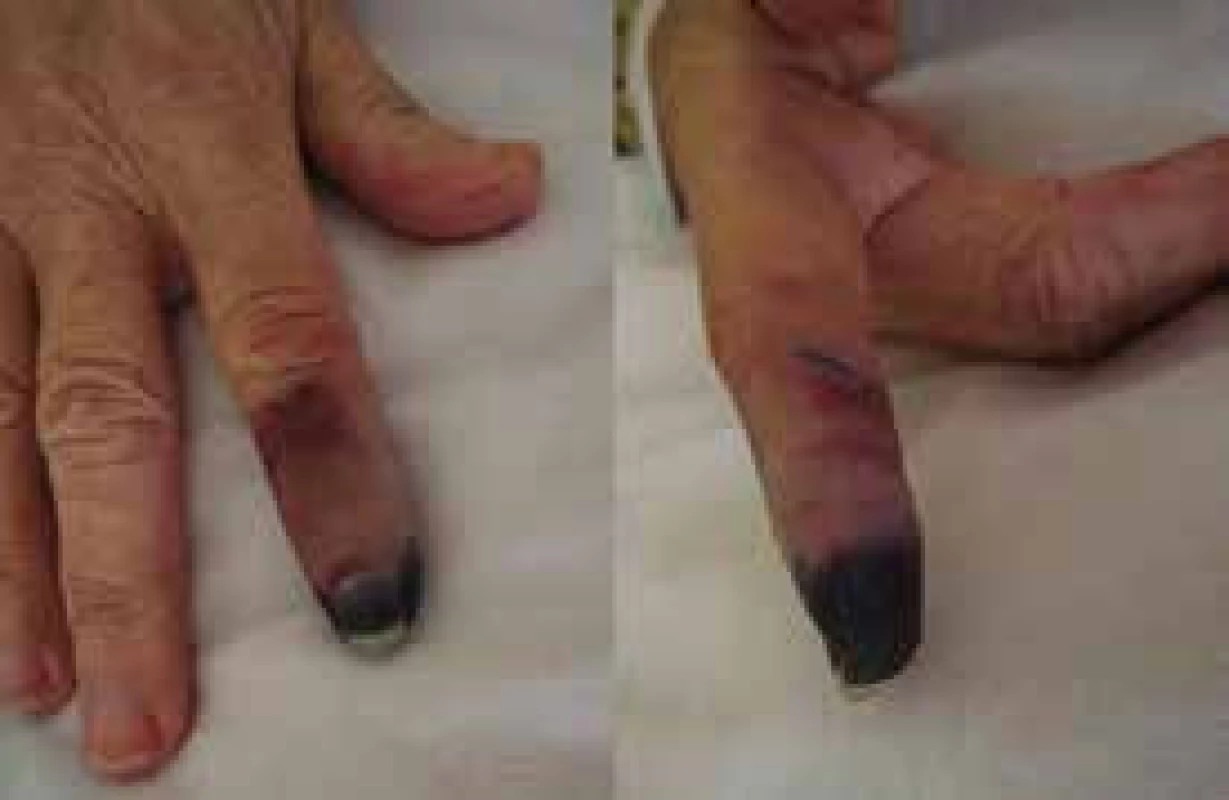

V chladu aglutinace erytrocytů blokuje průtok krve ušním boltcem a důsledkem je cyanóza ušního boltce. 
Po odběru krve a vystříknutí na misku blesková aglutinace erytrocytů v misce Obr. 2. Klasické projevy nemoci chladových aglutininů 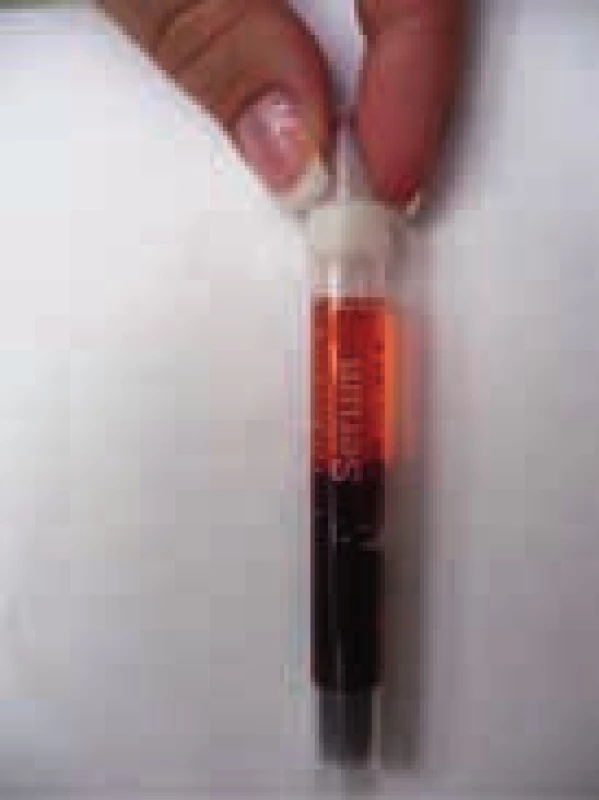
Krev ponechaná ve zkumavce při pokojové teplotě – červeně zbarvené sérum v důsledku hemolýzy Prvními příznaky nemoci je často hyperviskozita, jejíž reologické důsledky lze vidět na očním pozadí (obr. 3). Hyperviskozita způsobuje zvýšenou krvácivost sliznic nosu, dásní i sliznic zažívacího traktu, způsobuje poruchy zraku, trombózu retinálních cév, krvácení do retiny, exsudáty a edém papily. To může způsobovat bolesti hlavy, závratě, poruchy sluchu, diplopii a výjimečně vyústit v coma paraproteinemicum či krvácení do CNS. Hyperviskozita způsobuje srdeční insuficienci.
Obr. 3. Hemodynamické projevy hyperviskozity na očním pozadí 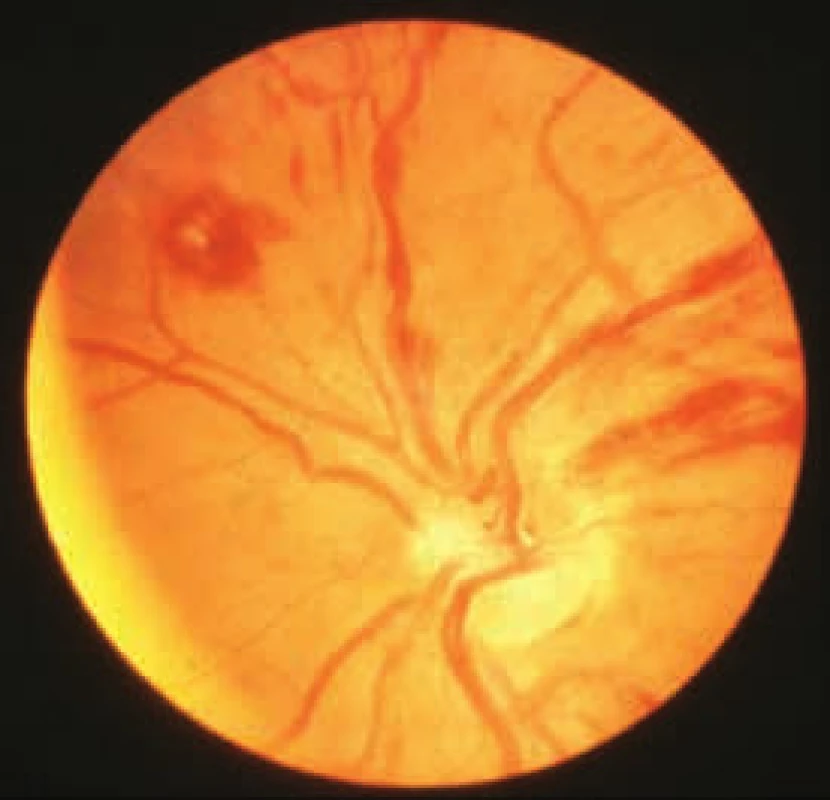
Zesílené cévy, retinální trombóza, krvácení do retiny, exsudáty a edém papily. Tyto změny pochopitelně vedou ke zhoršení zraku. Základní vyšetření
Základním vyšetřením je průkaz zvýšené koncentrace celkového a monoklonálního imunoglobulinu typu IgM a histologické a imunohistochemické vyšetření kostní dřeně, protože tento typ lymfomu pravidelně postihuje kostní dřeň. Ve většině případů je přítomna pouze infiltrace kostní dřeně, v menšině případů jsou však přítomna také extramedulární ložiska.
Cytogenetické vyšetření je možné provést, ale výsledky cytogenetického vyšetření zatím terapii neovlivňují. Jsou-li rozpaky, zda se jedná o Waldenströmovu makroglobulinemii či mnohočetný myelom, průkaz translokací v oblasti genů pro imunoglobuliny svědčí pro mnohočetný myelom.
Pokud je Waldenströmova makroglobulinemie prokázána, je nutné provést komplexní vyšetření, jehož cílem je dokumentovat rozsah nemoci a detekovat případné komplikace. Rozsah vyšetření uvádíme v tab. 2 a z ní pak plynoucí klasifikace v tab. 3. Monoklonální imunoglobulin typu IgM se může vyskytovat i u dalších lymfoproliferací [7].
Tab. 2. Vyšetření prováděná u Waldenströmovy makroglobulinemie 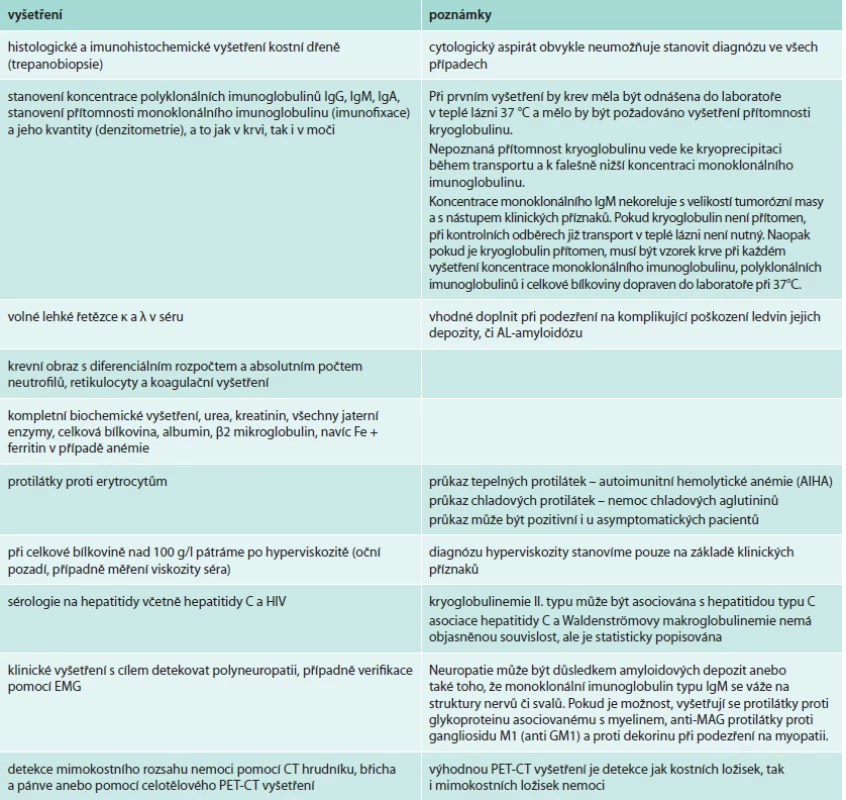
Tab. 3. Klasifikace Waldenströmovy makroglobulinemie (WM) a příbuzných poruch 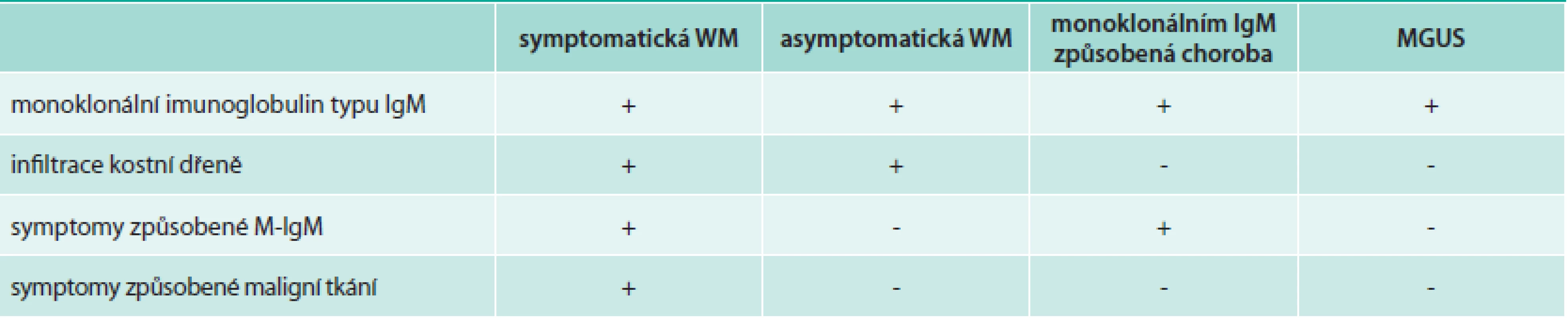
M-IgM monoklonální imunoglobulin typu IgM RTG vyšetření skeletu ve stejném rozsahu jako u mnohočetného myelomu se provádí pouze v případě klinického podezření na poškození skeletu.
PET-CT vyšetření přináší informace jak o postižení kostí, tak o mimokostních projevech, jako je lymfadenopatie anebo splenomegalie či hepatomegalie [23].
Vyhodnocování léčebné odezvy se klasicky provádí dle koncentrace monoklonálního imunoglobulinu IgM, hodnotit vývoj nemoci je však možné i dle koncentrace celkového IgM [24].
A podobně jako u dalších monoklonálních gamapatií je třeba sledovat funkci ledvin, protože i Waldenströmova makroglobulinemie může ledviny poškozovat [16, 25–30].
Prognóza
Waldenströmova makroglobulinemie je nemoc s poměrně příznivou prognózou. Velmi zajímavým zjištěním z Mayo Clinic je medián celkového přežití 6,4 roku. Celkové přežití je interval od stanovení diagnózy, případně zahájení léčby do smrti, přičemž se nerozlišuje, zda příčinou smrti byla sledovaná choroba nebo jiná příčina.
Autoři z Mayo Clinic vyřadili ze souboru nemocné, kteří zemřeli z jiné příčiny než důsledkem Waldenströmovy makroglobulinemie, a statisticky zpracovali pouze ty nemocné, kteří zemřeli pouze v důsledku Waldenströmovy makroglobulinemie. Tímto způsobem získali takzvaný disease specific survival a jeho medián činil 11,2 roku. Tuto informaci zde uvádíme proto, abychom dokumentovali, že ve srovnání s myelomem má nemoc méně agresivní průběh, a proto i léčba může být méně agresivní, aby její nežádoucí účinky nepřevážily nad přínosem při uvedeném dlouhém disease specific survival.
Osud nemocných je však velmi divergentní a více informací o prognóze poskytují prognostické indexy. Poslední Mezinárodní prognostický index pro léčbu Waldenströmovy makroglobulinemie uvádí tab. 4, s. 144 [31]. Vedou se diskuse, zda k nepříznivým faktorům přiřadit i vyšší LD.
Tab. 4. Mezinárodní prognostický index pro nemocné s Waldenströmovou makroglobulinemií [31] ![Mezinárodní prognostický index pro nemocné s Waldenströmovou makroglobulinemií [31]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/fdb33e63a6dcad4c48c087c178a187da.png)
Obecné informace o léčbě
Indikace k léčbě
Současné léčebné možnosti (chemoterapie i cílená léčba) mají potenciál dosáhnout léčebné odezvy (remise nemoci) u velkého počtu nemocných, ne však zcela eliminovat maligní klon a vést u většiny nemocných k úplnému uzdravení. Nemoc obvykle po remisi, trvající řádově měsíce či roky, opět recidivuje a vyžaduje další léčbu.
Proto se u Waldenströmovy makroglobulinemie doporučuje asymptomatické nemocné pouze sledovat a se zahájením léčby vyčkávat do prvních klinických příznaků nemoci [32].
Vzácné případy lymfoplazmocytárního lymfomu klinického stadia I či II (s limitovanou formou nemoci) se léčí ihned při stanovení diagnózy kurativní radioterapií, podobně jako je tomu u folikulárního lymfomu klinického stadia I anebo II A. S klinickým stadiem I či II jsme se však za naší medicínské praxe nesetkali.
Indikace k zahájení léčby Waldenströmovy makroglobulinemie:
- klinické příznaky a projevy hyperviskozity (neurologické nebo oční projevy)
- symptomatická periferní neuropatie
- AL-amyloidóza
- symptomatická kryoglobulinemie
- cytopenie (koncentrace hemoglobinu pod 100 g/l nebo počet trombocytů pod 100 × 109/l
- velká (tzv. bulky) lymfadenopatie nebo organomegalie nebo známky transformace ve velkobuněčný lymfom
- jiné problémy způsobené nemocí, které jsou natolik závažné, že vyžadují zahájení léčby (horečky, noční pocení, úbytek hmotnosti, fatigue, neuropatie či jiné poškození organizmu monoklonálním imunoglobulinem)
Koncentrace monoklonálního imunoglobulinu IgM sama o sobě není indikací k zahájení léčby, nicméně pokud by koncentrace dosáhla 50 g/l, doporučuje se velmi intenzivně pátrat po projevech hyperviskozity dotazováním na krvácení z nosu a z dásní, zhoršení vidění, bolesti hlavy, závratě, ataxii a změnu psychiky.
Viskozitu je možné i měřit, pokud je k tomu vybavena laboratoř, ale je nutné respektovat, že hodnota viskozity, při níž nastupují klinicky signifikantní projevy hyperviskozity, je interindividuálně velmi odlišná. Příznaky hyperviskozity obvykle nastupují až při vzestupu viskozity nad 4 cp (normální hodnota je 1,8 cp) [32]. Indikací k zahájení léčby jsou však klinické projevy hyperviskozity, a proto měření a sledování viskozity není obligátním vyšetřením.
Volba optimální léčby
Při volbě léčby je nutno zodpovědět následující otázky:
- Umožňuje věk a stav pacienta případnou vysokodávkovanou chemoterapii při neúspěchu klasické chemoterapie? Pokud ano, je nutno omezit dávky alkylačních cytostatik a neměla by se v léčbě první linie podávat purinová analoga.
- Má pacient závažnou cytopenii (neutropenii anebo trombocytopenii)? Pokud ano, zvolíme takovou léčbu, která cytopenii neprohloubí, a nezpůsobí tak závažné komplikace.
- Potřebuje pacient rychlý nástup léčebné odezvy? Pokud ano, zvolíme léky, po nichž se popisuje rychlý pokles koncentrace monoklonálního imunoglobulinu.
- Je klinicky přítomna symptomatická hyperviskozita či komplikace způsobené monoklonálním imunoglobulinem? Pokud ano, je nutno léčbu začít terapeutickou plazmaferézou [32].
Skutečnost, že Waldenströmova makroglobulinemie je velmi vzácnou nemocí s relativně dlouhým přežitím nemocných, limituje organizování velkých klinických studií. Proto informace o účinnosti léčby máme z menších studií, které obvykle hodnotí počet léčebných odpovědí a délku remise, zatímco studie fáze III, které by srovnávaly vliv léčebných postupů na délku celkového přežití, jsou ojedinělé.
Hodnocení léčebné odezvy
Při hodnocení účinku léčby se zohledňuje vývoj koncentrace monoklonálního imunoglobulinu, ale na rozdíl od mnohočetného myelomu se do hodnocení léčebné odpovědi zahrnují další parametry, jak uvádí tab. 5. Také pro hodnocení trvání léčebné odezvy byla v roce 2013 publikována pravidla [33].
Tab. 5. Definice léčebné odezvy dle 6. mezinárodního workshopu o Waldenströmově makroglobulinemii [33] ![Definice léčebné odezvy dle 6. mezinárodního workshopu o Waldenströmově makroglobulinemii [33]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/dd21cfc3a022df537001ea081cc89f3e.png)
Přehled léčebných možností
Glukokortikoidy
Přidání běžných dávek prednisonu (do 1 mg/kg) nezvyšuje počet léčebných odezev ani neprodlužuje délku přežití. Běžné dávky prednisonu jsou však účinné u pacientů s autoimunitní hemolytickou anémií, případně kryoglobulinemií II. typu, ale již ne u nemoci chladových aglutininů [34,35].
Vysoké dávky glukokortikoidů, konkrétně dexametazonu, však chorobu potlačily a navodily léčebnou odezvu u pacientů, u nichž pro cytopenii nepřipadala v úvahu léčba alkylačními cytostatiky [36,37].
Klasická cytostatika
Klasickým lékem pro Waldenströmovu makroglobulinemii byl chlorambucil, podobně jako u chronické B lymfocytární leukemie (B-CLL). U chronické B lymfocytární leukemie došlo již před několika lety k zásadní změně, léčba chlorambucilem byla nahrazena novým zlatým standardem, léčbou kombinací rituximab, fludarabin a cyklofosfamid. A ke stejné změně jako u B-CLL dochází u Waldenströmovy makroglobulinemie.
Léčebná odezva při léčbě chlorambucilem nastupuje u nemocných s Waldenströmovou makroglobulinemií velmi pomalu, interval do dosažení maximální léčebné odezvy byl 9 až dokonce 18 měsíců. Počet celkových léčebných odezev po chlorambucilu kolísá mezi 50–60 %, kompletní remise je touto léčbou dosaženo výjimečně. Nebyl zjištěn rozdíl mezi výsledkem kontinuální (0,1 mg/kg/den dlouhodobě) a intermitentní (0,3 mg/kg/den 7 dní v 6týdenních intervalech) aplikace chlorambucilu. Medián celkového přežití byl v obou skupinách 5,4 roku, medián intervalu od randomizace do dosažení objektivní léčebné odezvy byl 18 měsíců a medián trvání remise 26 měsíců [38].
Optimální délka podávání chlorambucilu není známa, v některých studiích byl podáván do dosažení maximálního efektu, v jiných studiích byl podáván fixně po dobu 1–2 let. Není prokázáno, že by podávání chlorambucilu v rámci udržovací léčby bylo jakýmkoliv přínosem [34].
Režimy obsahující více alkylačních cytostatik byly testovány podobně jako u mnohočetného myelomu, pro menší četnost choroby však pouze v nerandomizované formě. Tyto vícelékové režimy dosahovaly vyššího počtu léčebných odezev, než bylo dosaženo ve studiích testujících chlorambucil v monoterapii. Předpokládá se, že však není rozdíl v délce celkového přežití [35,39–42]. Chlorambucil v monoterapii tedy představuje dnes již překonaný zlatý standard minulého století.
Purinová analoga
Do skupiny purinových analog patří fludarabin, 2-chlorodeoxyadenozin a pentostatin. V klinických studiích byl použit dominantně fludarabin a 2-chlorodeoxyadenozin. Pentostatin má také prokázanou účinnost, ale by použit jen výjimečně [43].
Fludarabin
Fludarabin v monoterapii
Největší studie testující fludarabin v monoterapii jak u relabujících, tak u dříve neléčených nemocných s Waldenströmovou makroglobulinemií, je studie Southwest Oncology Group – SWOG zahrnující 182 nemocných. Celkový počet léčebných odezev dosáhl 38 %, z toho u nově diagnostikovaných (118 pacientů) to bylo 40 %. U pacientů dříve léčených (64 nemocných) to bylo 33 %. Kompletní remise bylo dosaženo výjimečně, pouze u 3 % případů. Medián bezpříznakového a celkového přežití byl 43 a 84 měsíců [44].
V literatuře jsme nalezli pouze 2 prospektivně randomizované studie, v nichž jsou porovnány výsledky léčby fludarabinem v monoterapii se staršími léčebnými postupy.
Randomizované srovnání léčby prvního relapsu fludarabinem anebo režimem CAP (cyklofosfamid, adriamycin a prednison) u 92 nemocných prokázalo lepší léčebnou odezvu po fludarabinu 30 % vs 11 % po režimu CAP (p = 0,019). Medián trvání léčebné odezvy byl 19 vs 3 měsíce (p < 0,01). Mezi mediány celkového přežití nebyl signifikantní rozdíl: 41 vs 45 měsíců. Nepřítomnost rozdílu v délce přežití souvisí s tím, že pacienti nereagující na léčbu CAP byli následovně léčeni také fludarabinem [45].
Ukončeno bylo také multicentrické prospektivní srovnání chlorambucilu s fludarabinem v monoterapii u nově diagnostikových nemocných. Tato studie proběhla ve 101 centrech a zařazeno bylo 414 nemocných. Počet léčebných odezev byl větší po fludarabinu (45,7 %) než po chlorambucilu (38,6 %) (p = 0,07) [46].
Od výsledků obou srovnávacích studií se odvíjí doporučení pro volbu fludarabinového režimu při léčbě prvního či dalšího relapsu a v iniciální léčbě při nutnosti použít lék s rychle nastupující léčebnou odezvou. Výsledky sumarizuje tab. 6, 146.
Tab. 6. Srovnání výsledků léčby fludarabinem v monoterapii vs chlorambucilem (25 mg/m2 i.v. 5 dní vs chlorambucil 8 mg/m2 p.o. po dobu 10 dnů v 28denních intervalech). U pacientů nad 75 let byl chlorambucil podavan v davce 6 mg/m2 p.o. Do studie bylo zařazeno celkem 414 pacientů [46]. ![Srovnání výsledků léčby fludarabinem v monoterapii vs chlorambucilem (25 mg/m2 i.v. 5 dní vs chlorambucil 8 mg/m2 p.o. po dobu 10 dnů v 28denních intervalech). U pacientů nad 75 let byl chlorambucil podavan v davce 6 mg/m2 p.o. Do studie bylo zařazeno celkem 414 pacientů [46].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/c188b0838e1fbad5b14e728674947498.png)
Dle klinických studií má monoterapie fludarabinem vyšší míru léčebné odezvy než klasická léčba chlorambucilem nebo kombinací alkylačního cytostatika, antracyklinu a prednisonu [22].
Poměrně vysoký počet léčebných odezev na fludarabinové režimy byl popsán také u dalších IgM tvořících lymfoproliferativních chorob (splenický lymfom s vilózními lymfocyty, cold aglutinin disease) [47].
Na otázku, zda fludarabin v monoterapii může být přínosem i pro pacienty, jejichž nemoc relabuje po 2-chlorodeoxyadenosinu, lze v literatuře nalézt jak pozitivní odpověď [48], tak i názor opačný, popisující zkříženou rezistenci na tato dvě purinová analoga [49].
Důležité je poznání, že léčba fludarabinem v monoterapii či v kombinaci může způsobit velmi pozvolna se rozvíjející léčebnou odezvu, maximální léčebná odezva (pokles koncentrace monoklonálního IgM) se může dostavit až několik měsíců po posledním cyklu léčby [50].
Fludarabin v kombinaci s alkylačním cytostatikem
Kombinace fludarabinu s cyklofosfamidem přináší vyšší počet léčebných odezev než fludarabin v monoterapii. Studie z posledních let popisují u dříve neléčených osob až 85 % léčebných odezev, u relabujících nemocných a nemocných refrakterních na alkylační cytostatika je počet dosahovaných léčebných odezev o něco nižší: 55–89 % [50–55]. Výsledky větších studií uvádí tab. 7.
Tab. 7. Výsledky léčebné kombinace purinového analoga a cyklofosfamidu 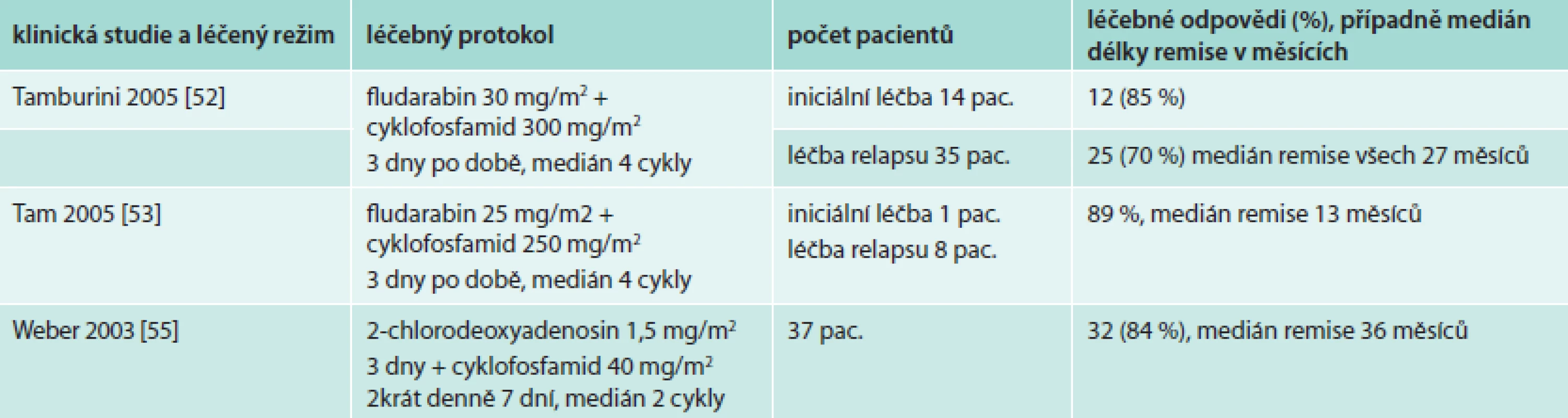
Z větších studií zmíníme pouze skupinu 49 nemocných (37 z nich bylo již dříve léčeno). V této skupině bylo dosaženo celkem 78 % léčebných odezev, u osob s relabující nemocí to bylo 76 %. Medián trvání remise byl 27 měsíců. Z dalších zajímavostí této studie je nutno uvést, že v průběhu sledování po léčbě se u 2 nemocných vyvinula akutní leukemie, histologická transformace do agresivního lymfomu byla pozorována u 1 nemocného a u 2 pacientů byla po ukončení léčby diagnostikována jiná maligní choroba (karcinom prostaty a maligní melanom) [52].
Podobně i další větší studie, testující fludarabin a cyklofosfamid a navíc ještě rituximab prokázaly sice dobrý počet léčebných odezev, ale nepřehlédnutelnou toxicitu.
Ve studii zveřejněné v roce 2012 léčili touto kombinací (rituximab 1. den, fludarabin 25 mg/m2, cyklofosfamid 250 mg/m2 2.–4. den) 43 pacientů, dosáhli sice 79 % léčebných odezev, z toho 11,6 % kompletních a 20,9 % velmi dobrých parciálních remisí. Nicméně závažná neutropenie 3. a 4. stupně dle klasifikace WHO se objevila u 45 % léčených a po ukončení léčby mělo 19 nemocných (44 %) dlouhotrvající neutropenii a 3 nemocní v průběhu dalšího sledování dospěli k diagnóze myelodysplastického syndromu (MDS) [56].
2-chlorodeoxyadenozin
2-chlorodeoxyadenozin v monoterapii
2-chlorodeoxyadenozin byl použit v malých studiích v dávce 0,1 mg/kg po 7 dní nebo 0,12 mg/kg i.v. po 5 dní, případně 0,14 mg/kg s.c. po 5 dní, tedy ve stejných dávkách jako jsou používány při léčbě vlasatobuněčné leukemie. Počet léčebných odezev se pohyboval v rozmezí 40–85 %, ale kompletní remise bylo dosaženo výjimečně [22]. Účinnost 2-chlorodeoxyadenozinu nebyla u této diagnózy srovnána s fludarabinem formou randomizované studie [3].
2-chlorodeoxyadenosin v kombinaci s alkylačními cytostatiky
Kombinace 2-chlorodeoxyadenozinu s alkylačním cytostatikem dosahuje vyššího počtu léčebných odezev než 2-chlorodeoxyadenozin v monoterapii, podobně jako kombinace fludarabinu a cyklofosfamidu, a léčebné odezvy může být dosaženo při menším počtu léčebných cyklů. Největší skupina nemocných léčená touto kombinací (37 nemocných), dostala v rámci iniciální léčby 2 cykly 2-chlorodeoxyadenozinu s cyklofosfamidem. Výsledkem bylo 84 % léčebných odezev, medián délky léčebné odezvy byl 36 měsíců. Ale i tento excelentní výsledek léčby byl později zlepšen přidáním rituximabu [22,55].
Zhodnocení přínosu purinových analog
Purinová analoga dosahují obzvláště v kombinaci vyššího počtu léčebných odpezev, než dosahovala monoterapie cyklofosfamidem či chlorambucilem. Maximální léčebné odezvy je obvykle dosaženo po 3–6 měsících, ale v 17 % případů byla maximální odezva popsána opožděně po 6 měsících a v 5 % případů po 12 měsících. Celkové 5leté přežití a bezpříznakové přežití dosahuje při této léčbě 62 % a 49 %. Hlavním nežádoucím účinkem této léčby je myelosuprese. Léčba purinovými analogy zmenšuje naděje na úspěšný sběr kmenových buněk krvetvorby pro následnou vysokodávkovanou chemoterapii. Purinová analoga dále způsobují dlouhodobý pokles T-lymfocytů (CD4+ i CD8+), neboli snižují efektivitu buněčné imunity a zvyšují riziko vzniku oportunních infekcí.
Purinová analoga, zvláště pokud jsou podávána s alkylačními cytostatiky, poškozují DNA a zároveň inhibují její opravy. V literatuře lze najít sporadické zprávy o vyšší incidenci transformace do high grade nehodgkinského lymfomu, o vzniku sekundárního myelodysplastického syndromu a akutní myeloidní leukemie a také hodnocení těchto komplikací několika klinickými retrospektivními studiemi. Incidence transformace do nehodgkinského lymfomu se pohybovala mezi 4,7–8,0 % a incidence transformace do MDS/AML mezi 1,4–8,9 %, což je vyšší frekvence než při jakékoliv jiné léčbě. Bawcock [56] popsal dokonce incidenci sekundárního myelodysplastického syndromu až u 20 % starších nemocných a podobně i další autoři [58–60]. Proto je vždy nutné pečlivě zvažovat přínos a rizika této léčby pro pacienta [61].
Rituximab
Rituximab v monoterapii
Rituximab v monoterapii je účinný nejenom u difuzního velkobuněčného lymfomu či folikulárního lymfomu a chronické B lymfocytární leukemie, ale také u nemocných s Waldenströmovou makroglobulinemií. Rituximab v monoterapii (podání 1krát týdně po dobu 4 týdnů) dosahuje 30–60 % léčebných odezev. V některých studiích vychází stejná účinnost rituximabu u dříve neléčených i u pacientů s relabující nemocí, v jiných studiích měl u první skupiny lepší efekt. Léčebná odezva nastupuje relativně pomalu, časový interval do maximální léčebné odezvy od zahájení léčby obvykle výrazně přesahuje 3 měsíce. Kompletní remise jsou při monoterapii vzácné a mediány délky léčebné odezvy se pohybují mezi 7–9 měsíci u osob již dříve léčených a dosahují až mediánu 27 měsíců u osob dříve neléčených. Ale i ti pacienti, kteří nesplňují kritéria parciální remise, mají často z této léčby prospěch, neboť vlivem léčby se zlepší hodnoty krevního obrazu. Přehled těchto menších studií uvádí tab. 8.
Tab. 8. Účinnost 4 aplikací rituximabu v týdenních intervalech u Waldenströmovy makroglobulinemie 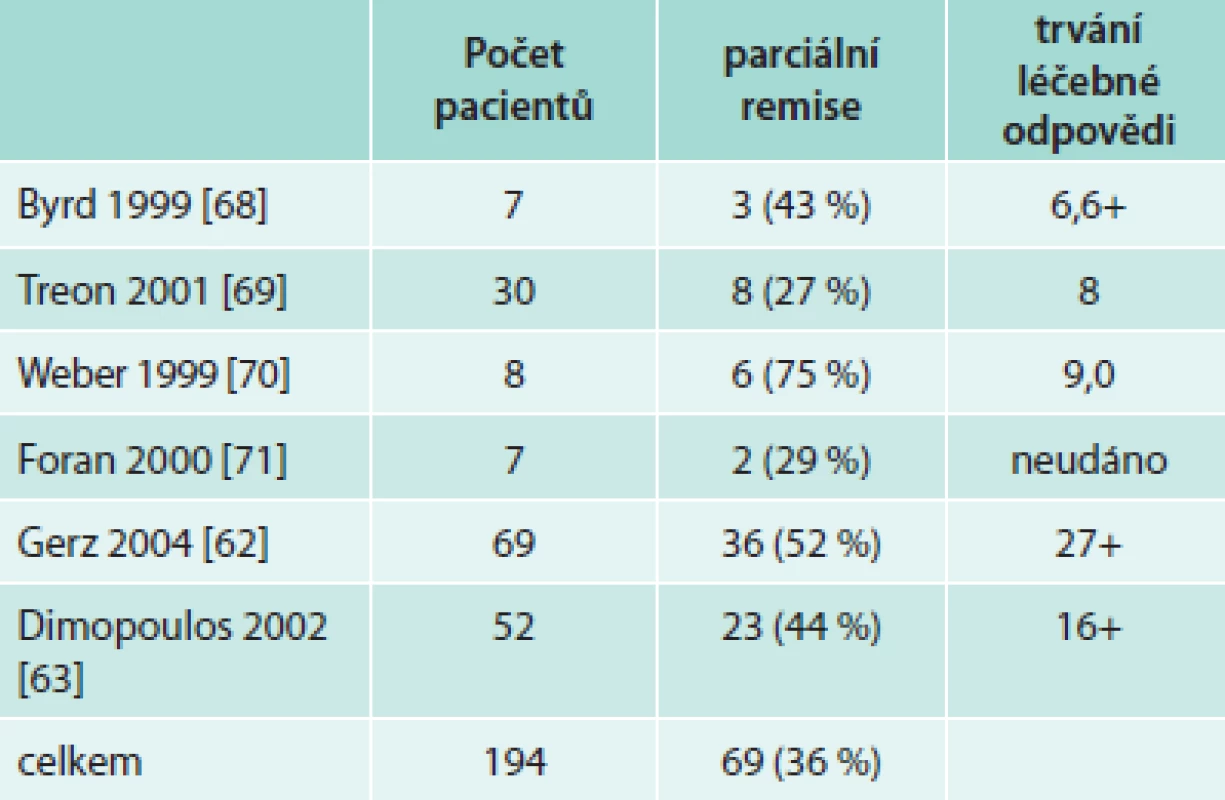
Efekt 4 aplikací rituximabu v týdenních intervalech dokládá největší studie (69 osob). Léčebné odezvy (nejméně PR) bylo dosaženo u 52 %, přičemž podskupiny dříve neléčených a léčených se nelišily počtem léčebných odezev. Medián délky léčebné odezvy u neléčených osob byl 27 měsíců [62].
Zdvojnásobení celkové dávky rituximabu ze 4 na 8 infuzí (aplikace v 1.–4. týdnu a dále ve 12.–16. týdnu) sice dále nezvýšila počet léčebných odezev (44 %), autoři této studie však uvádějí, že se výrazně prodloužilo trvání léčebné odezvy u dříve léčených osob na 16 měsíců, což bylo déle než u nemocných, kteří dříve dostali pouze 4 dávky [63].
V další podobné studii u 26 již dříve léčených pacientů zaznamenali 48,3 % parciálních remisí a 17,2 % menších léčebných odezev po aplikaci 8 infuzí rituximabu, medián intervalu do dosažení 50% léčebné odezvy byl 7 (3–19) měsíců. Medián intervalu do dosažení maximální léčebné odezvy byl 17 měsíců (3–32). Při mediánu sledování 29 měsíců došlo k progresi pouze u 2 pacientů [64].
Uvedené studie potvrzují efekt rituximabu u této choroby, odchylky v počtu léčebných odezev i jejich trvání souvisí s menším počtem osob v jednotlivých studiích a s výběrem nemocných.
Překvapivým jevem při monoterapii rituximabem byl dočasný vzestup koncentrace monoklonálního IgM a zvýšení viskozity po léčbě (tzv. IgM flare). Pod výchozí hodnotu se monoklonální IgM dostal ve většině případů do 4 měsíců. Předpokládá se, že apoptóza patologických buněk, navozená léčbou, uvolní monoklonální IgM do oběhu. Léčebné odezvy byly méně časté ve skupině nemocných s tímto vzestupem (28 %) než ve skupině nemocných bez vzestupu (80 %). Tento jev nebyl pozorován při aplikaci rituximabu spolu s chemoterapií [65]. Rituximab v monoterapii tedy nemá vyšší počet léčebných odezev než klasická chemoterapie. Proto se používá dominantně v kombinacích s chemoterapií, v monoterapii se podává při autoimunitních komplikacích (hemolytická anémie, nemoc chladových aglutininů, případně monoklonálním IgM vyvolaná neuropatie).
Prediktivní faktory účinnosti rituximabu
U pacientů s vysokou koncentrací monoklonálního IgM (> 40 g/l) byl zjištěn snížený počet léčebných odezev po aplikaci rituximabu (17 %), který se dále zmenšoval na 14 % při současně nízké hodnotě albuminu < 35 g/l. To znamená, že pacienti s hodnotou monoklonálního IgM pod 40 g/l a normálními hodnotami albuminu jsou optimálními kandidáty pro léčbu rituximabem [66].
Treon v roce 2005 pozoroval léčebnou odezvu u 75 % pacientů s koncentrací monoklonálního IgM pod 60 g/l a pouze u 20 % s hodnotou M IgM nad touto hranicí [64], zatímco Gerz v roce 2004 uvedl, že koncentrace monoklonálního IgM stejně jako koncentrace hemoglobinu před léčbou neměla signifikantní vliv na léčebnou odezvu [62]. Dále byl objeven vliv polymorfizmu FCγ IIIA (CD16) receptoru, který moduluje vazbu IgG1 a protilátkami mediovanou cytotoxicitu [67].
Rituximab v kombinaci s alkylačními cytostatiky a antracykliny
Vzhledem k tomu, že rituximab je u této nemoci aktivní a přitom nemyelosupresivní lék, je vhodné jej kombinovat s chemoterapií. Podobně jako u jiných maligních lymfomů, i zde se projevil aditivní efekt rituximabu a výrazně se zvýšil počet léčebných odezev. Kombinovaná léčba protilátkou antiCD20 spolu s cytostatiky dosahuje podstatně vyššího počtu léčebných odezev a také nezanedbatelný počet kompletních remisí.
CHOP je již léta používán pro léčbu vysoce i nízce agresivních lymfomů, a protože Waldenströmova makroglobulinemie (lymfoplazmocytární lymfom) je řazena do skupiny nízce agresivních lymfomů, je pochopitelné, že pacienti s touto chorobou byli léčeni chemoterapií CHOP, případně R-CHOP. Největší studie randomizovala celkem 69 pacientů do skupiny léčené režimy CHOP vs R-CHOP. Hodnotitelných bylo 64 pacientů. Pacienti léčení režimem R-CHOP měli signifikantně vyšší počet léčebných odezev a podstatně delší remisi než ve skupině bez rituximabu. V obou dvou skupinách nebylo signifikantního rozdílu v počtu nežádoucí účinků [72]. Výsledky této studie shrnuje tab. 9.
Tab. 9. Srovnání výsledků léčby pomocí chemoterapie bez a s rituximabem prokazují, že přidání rituximabu ke klasické chemoterapii je pro pacienty s Waldenströmovou makroglobulinemií přínosem 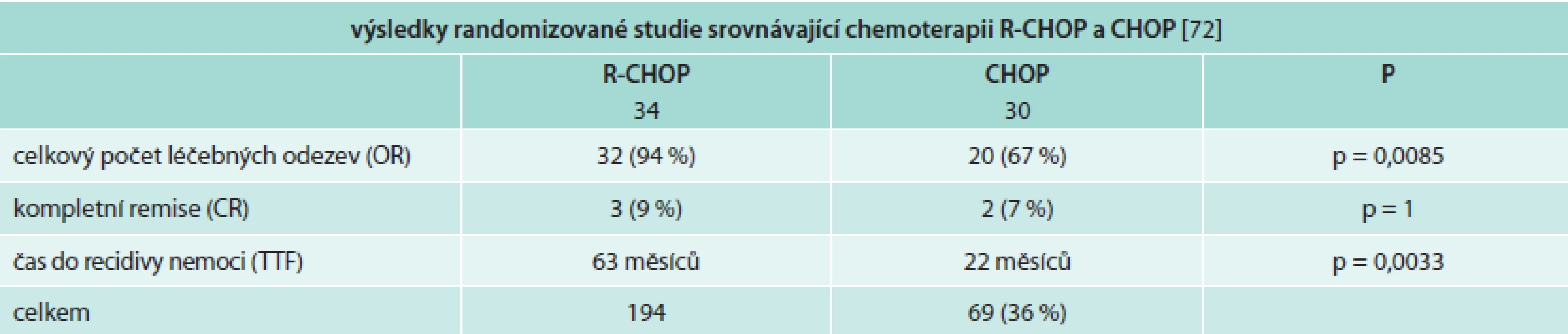
CHOP adriamycin, cyklofosfamid, vinkristin a prednison R-CHOP rituximab + CHOP Přínos přidání rituximabu k chemoterapii založené na alkylačním cytostatiku, případně dalších cytostaticích u lymfoplazmocytárního lymfomu potvrdily i další studie (tab. 10).
Tab. 10. Výsledky nerandomizovaných studií hodnotících podání rituximabu spolu s alkylačním cytostatikem 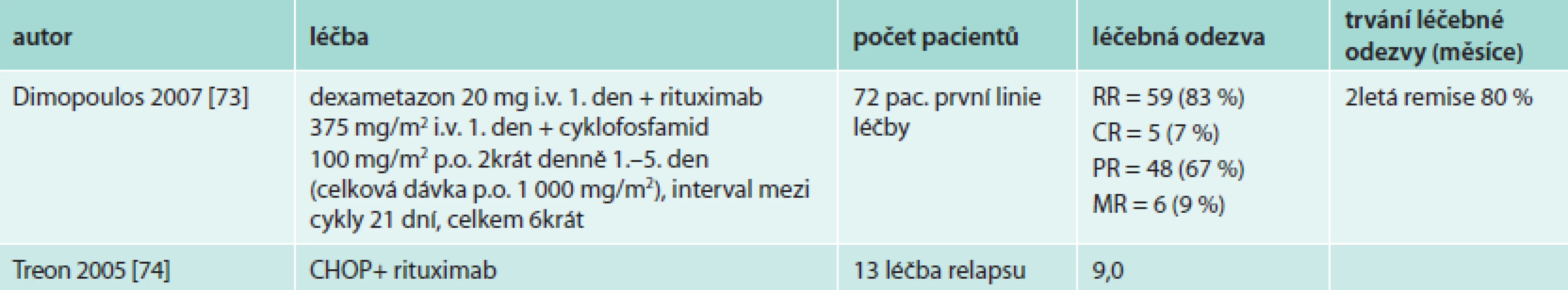
Otázka je, zda to musí být kompletní chemoterapie R-CHOP nebo zda by mohla intenzita podávané chemoterapie být o něco nižší při kombinaci s rituximabem.
Tuto otázku řešila pouze jedna studie, která srovnávala R-CHOP (23 pacientů, 96 % léčebných odezev a 17 % CR) s CVP-R (16 pacientů, 88 % léčebných odezev, z toho 12 % kompletních remisí) a CP-R (19 pacientů, 95 % léčebných odezev, 0 % CR). Autoři uvádějí, že sice u R-CHOP byl nejvyšší počet kompletních remisí, ale že efektivita dalších dvou kombinací s rituximabem je jen nepatrně nižší než u R-CHOP, zatímco o toxicitě se vyjádřili, že je výrazně nižší [75].
Trojkombinace cyklofosfamidu, dexametazonu a rituximabu dosáhla léčebné odezvy u 83 % léčených a 2leté přežití bez progrese bylo 67 % [73].
Na základě uvedených výsledků považují němečtí autoři pro svoje pacienty za optimální R-CHOP, zatím na Mayo Clinic v roce 2013 podávají jako základní nestudiovou léčbu kombinaci rituximabu, cyklofosfamidu a dexametazonu [73,76].
Léčba DRC (dexametazon + rituximab + cyklofosfamid) je používána jako standardní léčba ve srovnávacích studiích European Myeloma Group.
Rituximab v kombinaci s purinovými analogy
Také účinek purinových analog lze dále prohloubit a prodloužit přidáním rituximabu, jak shrnuje tab. 11. Kombinace rituximabu, purinového analoga a alkylačního cytostatika, která se používá jako standardní iniciální léčba u CLL, dosahuje u Waldenströmovy makroglobulinemie také úctyhodného počtu léčebných odezev, jak popisují četné studie (tab. 11). Nicméně, jak bylo v odstavci o fludarabinu uvedeno, tato léčba je spojena s poměrně vysokým výskytem MDS. Proto na rozdíl od B-CLL, při níž je kombinace s fludarabinem a rituximabem používána jako standardní iniciální léčba, u Waldenströmovy makroglobulinemie jsou purinová analoga doporučována pro léčbu relapsu nemoci.
Tab. 11. Léčba Waldenströmovy makroglobulinemie kombinací rituximabu a purinových analog 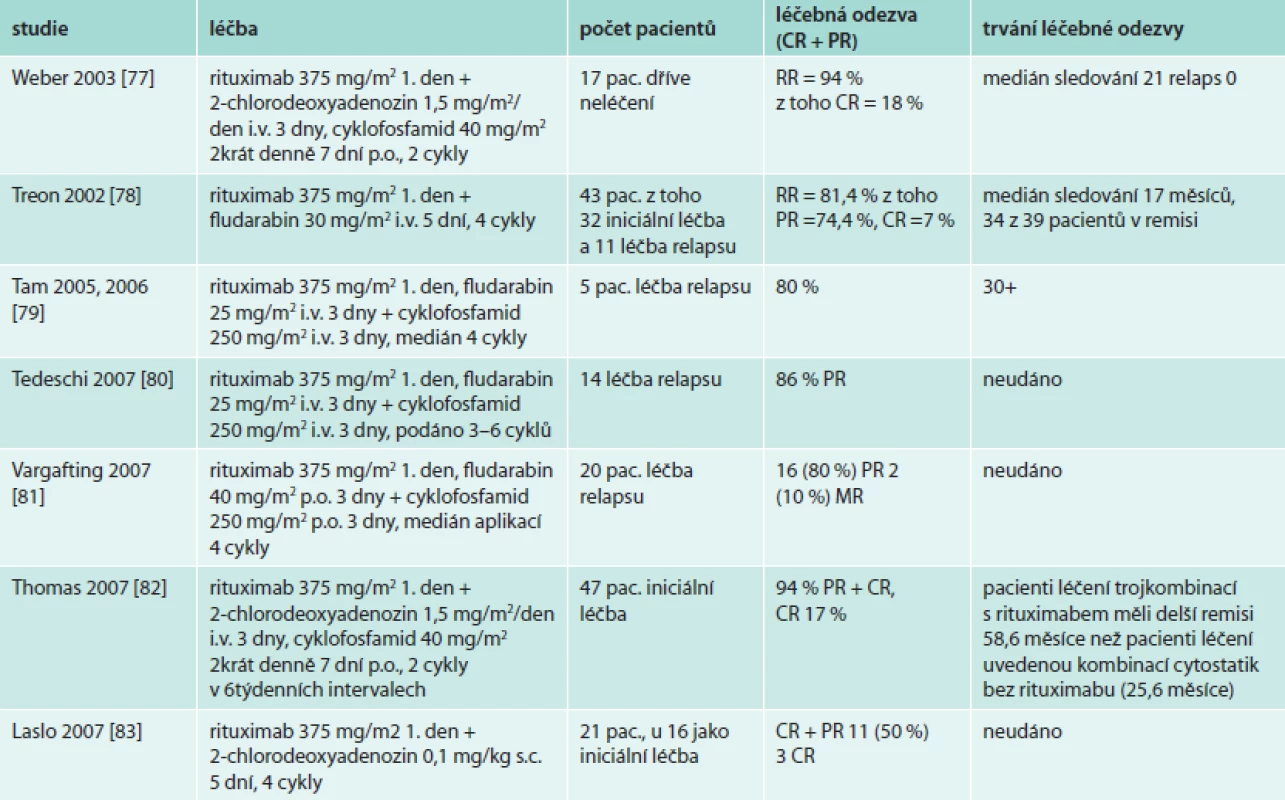
Udržovací léčba rituximabem
V retrospektivní studii 86 z 248 pacientů s Waldenströmovou makroglobulinemií, kterým byl podáván rituximab v rámci udržovací léčby (medián 8 podání) v průběhu 2 let po ukončené indukční léčbě, mělo delší interval bez progrese nemoci (56 vs 29 měsíců) a medián celkového přežití nebyl ještě ve skupině s udržovací léčbou dosažen. Ve skupině bez udržovací léčby již dosažen byl a činil 116 měsíců [84]. Udržovací léčba rituximabem má podobný přínos jako u jiných CD20 nízce agresivních malignit. Zatím však u Waldenströmovy makroglobulinemie není hrazená.
Další léčebné alternativy
Talidomid
Talidomid nalezl uplatnění u více hematologických chorob, standardně je v ČR používán u mnohočetného myelomu. Aktivita talidomidu byla také prokázána v monoterapii u Waldenströmovy makroglobulinemie, ale léčebná odezva byla dosažena jen u 25 % léčených. Talidomid v monoterapii je jen mírně účinný [85]. Proto, pokud je používán, tak vždy v kombinaci.
Nemyelosupresivní alternativou léčby je současná aplikace talidomidu s rituximabem, z 25 zařazených nemocných bylo vyhodnoceno 23. Z nich dosáhlo 12 parciální remise a 1 nemocný kompletní remise [86].
Efekt kombinované léčby talidomidem v kombinaci s rituximabem popisují i další 2 studie [87,88]. Pozitivem této léčby je, že není myelosupresivní. Častá přítomnost určité formy neuropatie u pacientů s Waldenströmovou makroglobulinemií však činí tyto pacienty velmi vnímavé na neurotoxické nežádoucí účinky talidomidu. Pro pacienty v cytopenii je to však možná léčebná strategie.
Lenalidomid
Lenalidomid je standardním lékem pro mnohočetný myelom. Do roku 2013 pouze jedna práce popisuje výsledky léčby lenalidomidem v kombinaci s rituximabem. Autoři popsali signifikantní pokles koncentrace hemoglobinu v souvislosti s podáváním lenalidomidu, a to při snížení dávky lenalidomidu. Celkový počet všech léčebných odezev dosáhl jen 50 % [89]. Lenalidomid, ač velmi užitečný pro léčbu jiných chorob, je při léčbě Waldenströmovy makroglobulinemie jen mírně účinný a jeho podání bývá spojeno s další anemizací.
Alemtuzumab
Exprese antigenu CD52 byla prokázána na všech lymfoidních buňkách Waldenströmovy makroglobulinemie, CD52 chybí pouze na plazmocytech náležících k patologickému klonu. Důležité bylo také zjištění, že mastocyty kostní dřeně, jejichž počet je v případě Waldenströmovy makroglobulinemie zvýšen, exprimují také antigen CD52 a jsou tedy zasažitelné alemtuzumabem. I to je přínosné, protože mastocyty mají pomocnou roli při růstu buněk lymfoplazmocytárního lymfomu [90,91].
Tato skutečnost vedla k aplikaci alemtuzumabu pacientům s Waldenströmovou makroglobulinemií. V malém souboru 5 pacientů, tvořících pilotní studii, bylo prokázáno, že alemtuzumab eradikoval patologický klon u 4 z nich [92]. Následující studie obsahovala již 27 hodnotitelných, většinou již dříve léčených nemocných. Alemtuzumab byl podáván v klasickém dávkování a bylo dosaženo 1 CR (4 %), 9 PR (37 %) a 11 MR (41 %) [93]. Uvedená léčba je spojena s četnými infekčními komplikacemi a zatím nepředstavuje běžně používaný postup.
Bortezomib
Bortezomib v monoterapii relabující či rezistentní choroby
Celkem 3 klinické studie testovaly účinek bortezomibu v monoterapii u pacientů s recidivující či rezistentní chorobou. V této indikaci navodil 60–85 % celkových léčebných odezev včetně MR a 41–60 % parciálních remisí. Pokles koncentrace monoklonálního imunoglobulinu byl velmi rychlý, v prvních 2 cyklech poklesl o více než 25 % výchozí koncentrace [94–97]. V monoterapii dosahuje bortezomib nejvyššího počtu léčebných odezev z léků dostupných v roce 2013.
Bortezomib v kombinované léčbě relabující či rezistentní choroby
Poté, co byla prokázána účinnost bortezomibu v monoterapii, začaly klinické studie ověřující jeho účinek v kombinované léčbě u pacientů s rezistentní či refrakterní nemocí. V klinické studii s 37 pacienty byl bortezomib podáván 1krát týdně v dávce 1,6 mg/m2 a rituximab 1krát měsíčně. Počet celkových léčebných odezev včetně MR dosahoval 81 %, parciálních 46 % a 5 % kompletních remisí. Medián intervalu do progrese činil 16,4 měsíce [98].
Bortezomib v iniciální léčbě
Po prokázání účinnosti bortezomibu v druhé linii léčby byly zahájeny klinické studie, v rámci nichž byl bortezomib použit pro léčbu dříve neléčených pacientů. V rámci kanadské studie bylo celkem 12 pacientů léčeno bortezomibem v monoterapii. Z nich celkem 25 % se dostalo nejméně do parciální remise [96,97].
Pro další zvýšení účinnosti léčby použil Treon se spolupracovníky u 23 pacientů kombinovanou léčbu bortezomibem, rituximabem a dexametazonem. Léčebné odezvy nastupovaly po této léčbě velmi rychle, medián intervalu do poklesu koncentrace monoklonálního imunoglobulinu o více než o 25 % činil 1,4 měsíce. Celkový počet léčebných odezev včetně MR byl 96 % a parciální remise či lepší léčebné odezvy dosáhlo 83 % pacientů, kompletní remise či téměř kompletní remise (near CR) byla zjištěna u 22 %. Po 2 letech zůstávalo 18 z 23 pacientů stále v remisi [99,100].
Vzhledem k tomu, že dle klinických zkušeností je podávání bortezomibu jen 1krát týdně spojeno s menší neurotoxicitou, ale se stejnou účinností, skupina European Myeloma Network zorganizovala klinickou studii testující bortezomib, dexametazon a rituximab (BDR) u dříve neléčených nemocných (60 pacientů). Léčba byla zahájena bortezomibem v monoterapii s cílem zabránit případnému tzv. IgM flare (bortezomib 1,3 mg/m2 i.v. den 1., 4., 8. a 11. ve 21denním cyklu a v dalším cyklu byl podáván bortezomib 1,6 mg/m2 den 1., 8., 15. a 22. v 35denním cyklu). Ve 2.–5. cyklu byl podáván nitrožilně dexametazon (40 mg) vždy s aplikací bortezomibu a dále rituximab (375 mg/m2, celkem 8 infuzí rituximabu).
Uvedeným postupem bylo léčeno 59 pacientů. Na léčbu pozitivně reagovalo celkem 85 % (3 % CR, 7 % VGPR, 58 % PR, 17 % MR). Medián intervalu bez progrese (PFS) byl 42 měsíců, 3leté trvání léčebné odpovědi dosáhlo 70 % a celkové 3leté přežití 81 % léčených. Léčba kombinací bortezomibu, dexametazonu a rituximabu se vyznačuje velmi rychlým nástupem léčebné odezvy, dobrou tolerancí, léčba není myelotoxická a dosahuje vysokého počtu dlouhodobých léčebných odezev. Bortezomib v monoterapii je velmi účinný pro nemocné s hyperviskozitou, protože rychle redukuje koncentraci monoklonálního imunoglobulinu [101,102].
Informace o nižší neurotoxicitě při stejné účinnosti při podávání bortezomibu 1krát týdně byla základem i další studie, která prověřovala účinnost bortezomibu v dávce 1,6 mg/m2 podávanou 1krát týdně (den 1., 8. a 15.) v 28denních cyklech, celkem 6 cyklů. V 1. a ve 4. cyklu (měsíci) aplikovali rituximab 375 mg/m2 i.v. 1krát týdně.
Celkem u 26 dříve neléčených pacientů dosáhli 88 % celkových léčebných odezev včetně MR, 58 % parciálních remisí a 8 % nCR nebo CR. Celkem 79 % léčených bylo déle než 1 rok od ukončení léčby bez známky recidivy nemoci [103].
Účinnost bortezomibu v této indikaci potvrzují i další publikované zkušenosti [104–107], nejdůležitější klinické studie uvádí tab. 12.
Tab. 12. Výsledky léčby Waldenströmovy makroglobulinemie bortezomibem 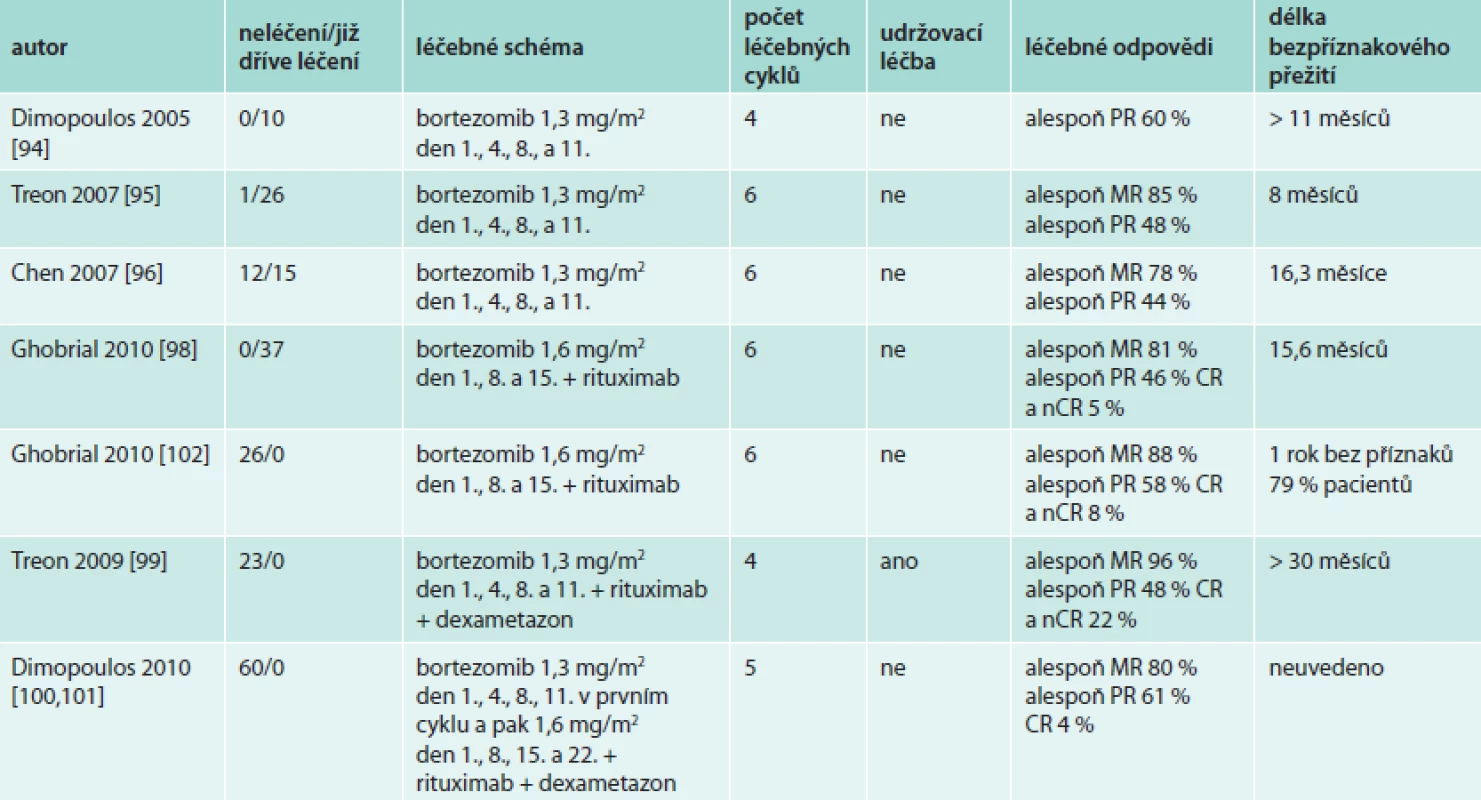
Na základě těchto klinických studií fáze II uvádějí mezinárodní doporučení bortezomib jako lék vhodný pro léčbu Waldenströmovy makroglobulinemie [3,108,109]. Jeho nevýhodou jsou jeho neurotoxické účinky [110].
Bortezomib však není v případě Waldenströmovy makroglobulinemie hrazen zdravotními pojišťovnami, protože neproběhly nákladné registrační studie, jejichž výsledkem by měla být registrace a domluva úhrady bortezomibu i pro pacienty s Waldenströmovou makroglobulinemií, kterých je však pouze 3–3,8/milion obyvatel. Zatím je bortezomib plně hrazen pouze u mnohočetného myelomu.
V případech, kdy byli pacienti léčeni rituximabem, jsou někdy patology popisovány změny v kostní dřeni, vymizení lymfoidní komponenty a přetrvávání klonální plazmocelulární komponenty, takže histologický nález mikroskopiky odpovídá plazmocytomu [111]. V případě histologicky popsané transformace Waldenströmovy makroglobulinemie do mnohočetného myelomu typu IgM je možné podat bortezomib.
Bendamustin
Vzhledem k tomu, že fludarabin má svá rizika, je žádoucí najít do kombinace k rituximabu další lék, který by měl dobrý efekt a menší toxicitu než fludarabin. V posledních letech se u nízce agresivních lymfoproliferací a u mnohočetného myelomu osvědčil lék bendamustin, který přináší lepší výsledky než klasická alkylační cytostatika a jeho akutní i pozdní toxicita je akceptovatelná [112].
Bendamustin byl srovnáván v rámci klinické studie fáze III s chlorambucilem u pacientů s chronickou B lymfocytární leukemií (B-CLL). Skupina s bendamustinem dosáhla kompletní remise ve 21 %, zatímco skupina s chlorambucilem jen v 10,8 %. Medián bezpříznakového intervalu byl v bendamustinové skupině 21,2 měsíce, zatímco v chlorambucilové jen 8,8 měsíců; p < 0,0001; a interval do další léčby činil 31,7 vs 10,1 měsíců [113]. Těmito daty jen ilustrujeme, že pro pacienty s B-CLL je bendamustin podstatně výhodnější než chlorambucil.
Také u mnohočetného myelomu byly výsledky léčby bendamustinem lepší z hlediska počtu léčebných odezev než po melfalanu a byl vyšší počet kompletních remisí: 32 % ve skupině léčené bendamustinem a 13 % ve skupině léčené melfalanem [114].
Vzhledem k tomu, že Waldenströmova makroglobulinemie (lymfoplazmocytární lymfom) je nemoc velmi podobná B-CLL a myelomu, lze usuzovat, že bendamustin bude mít u této nemoci podobné výsledky při srovnání se staršími alkylačními cytostatiky.
K dispozici je popis souboru 30 nemocných s refrakterní či relabující Waldneströmovou makroglobulinemií, kteří byli léčeni bendamustinem v kombinaci s rituximabem (90 mg/m2 i.v. den 1. a 2.) a rituximabem (375 mg/m2 i.v. 1. nebo 2. den cyklu). Celkový počet léčebných odezev byl 83,3 %, z toho 5 pacientů dosáhlo velmi dobré parciální remise a 20 parciální remise [115].
V roce 2013 je k dispozici jen jedna studie srovnávající léčbu R-CHOP vs R-bendamustin. Celkem 22 pacientů bylo léčeno bendamustinem a rituximabem a 19 bylo léčeno chemoterapií R-CHOP. Obě skupiny měly stejný počet léčebných odezev (95 %). Medián bezpříznakového přežití byl signifikantně delší ve skupině léčebné bendamustinem, ve skupině léčebné R-CHOP byl 36 měsíců, zatímco v bendamustinové skupině nebyl ještě v době hodnocení dosažen (p < 0,0001). V době analýzy došlo k relapsu u 4 pacientů (18 %) v bendamustinové skupině a k 11 (58 %) ve skupině léčené R-CHOP, přičemž v bendamustinové skupině bylo méně nežádoucích účinků [116].
Uvedené studie signalizují, že bendamustin v monoterapii dosahuje lepších výsledků než standardně používaná alkylační cytostatika nejen u chronické B lymfocytární leukemie a mnohočetného myelomu, ale zřejmě také u Waldenströmovy makroglobulinemie. Z uvedených publikací vyplývá, že kombinace bendamustinu s rituximabem dosahuje vysokého počtu léčebných odezev ve skupině s relabující či refrakterní Waldenströmovou chorobou, ale i u dalších IgM gamapatií. Bendamustin byl použit u pacienta s nemocí chladových aglutininů, u něhož nebyla účinná předchozí léčba. Bendamustin byl podán v dávce 70 mg/m2/den 2 dny po sobě v 4týdenních intervalech. V dalším cyklu již bylo použito dávky 90 mg/m2/den. Rituximab byl podáván ve standardních dávkách 375 mg/m2 1krát měsíčně vždy při aplikaci bendamustinu. Léčená odezva byla již zřetelná po 1. cyklu, kdy se výrazně zvýšila koncentrace hemoglobinu a pacient přestal být závislý na transfuzích [117].
Splenektomie
Indikace splenektomie je podobná jako u CLL – velká splenomegalie vyvolávající nepříjemné klinické příznaky. Tato situace není u Waldenströmovy makroglobulinemie častá, v literatuře je v těchto případech popsáno zlepšení [118].
Vysokodávkovaná chemoterapie
Informace o vysokodávkované chemoterapii lze čerpat z četných malých studií a pak z několika větších analýz. Použity byly jak režimy používané pro folikulární lymfomy, tak režimy používané pro mnohočetný myelom. Některé předtransplantační režimy zahrnovaly i celotělové ozáření.
Vysokodávkovaná chemoterapie má potenciál navodit u 45–65 % 5leté bezpříznakové přežití. Allogenní transplantace přináší ještě případný benefit tzv. graft vs lymfoma efektu. Místo vysokodávkované chemoterapie s autologní či alogenní transplantací není přesně definováno. Dle prognostického skórovacího systému lze vytipovat skupinu nemocných s nepříznivou prognózou. V této skupině je na zvážení návrh podávání vysokodávkované chemoterapie jako součást iniciální léčby.
Standardní místo má vysokodávkovaná chemoterapie u pacientů mladších 65 let bez závažných komorbidit v případě časného relapsu (do 2 let) Waldenströmovy makroglobulinemie od ukončení iniciální léčby [119–125].
Léčba hyperviskozity a další indikace plazmaferézy
Plazmaferéza je indikovaná u pacientů s klinicky závažnými příznaky hyperviskozity, samotná fyzikální hodnota naměřené viskozity není indikací pro plazmaferézu.
Výměna 1–1,5 plazmatického objemu sníží viskozitu asi o 60–75 %. U pacientů s klinicky závažnými projevy hyperviskozity se proto doporučuje provést 1–2 plazmaferézy [125,126].
Opakované plazmaferézy s cílem udržet viskozitu v přijatelných hodnotách jsou doporučovány jednak pro nemocné, jejichž nemoc je rezistentní na medikamentózní léčbu, a také pro nemocné, kteří nejsou schopni podstoupit účinnou medikamentózní léčbu. Efekt plazmaferézy nastupuje rychle a trvá 4–6 týdnů [125–131].
Dle omezených zkušeností je plazmaferéza také alternativou u nemocí způsobených monoklonálním imunoglobulinem (IgM related disorders), jako je závažná neuropatie či symptomatická kryoglobulinemie. Může být iniciálním krokem před podáním cytoredukční léčby, která utlumí aktivitu nemoci.
Závěry pro praxi
Léčba první linie
Při volbě iniciální léčby je vždy nutné zvážit, zda by v případě nedostatečné léčebné odezvy nebo časného relapsu připadal v úvahu sběr kmenových hemopoetických buněk z periferní krve a vysokodávkovaná chemoterapie s autologní transplantací. Pokud ano, nepodáváme v rámci první linie léčby léky, které by negativně ovlivnily sběr hemopoetických kmenových buněk, tedy purinová analoga. A také dlouhodobě nepodáváme alkylační cytostatika.
Dále je nutné zohlednit míru stávající cytopenie (neutropenie, trombocytopenie). Pokud je při zahájení léčby přítomna cytopenie (jsou sníženy počty neutrofilů či trombocytů), nepodáváme léčbu, která je výrazně myelotoxická a která dlouhodobě prohloubí současnou cytopenii.
Pokud je přítomna symptomatická hyperviskozita, zahájíme léčbu plazmaferézou.
Za vhodnou iniciální léčbu považují všechna mezinárodní doporučení kombinaci rituximabu + cytostatikum anebo kombinaci cytostatik + kortikoidy ve vyšší dávce.
Pro pacienty s výraznou aktivitou nemoci, bez závažné cytopenie, je vhodné schéma R-CHOP. S prohlubováním cytopenie je možno ubírat intenzity cytostatické léčby a podat chemoterapii R-COP, případně kombinaci DRC (dexametazon, rituximab a cyklofosfamid). Trojkombinace DRC je používána kooperativní skupinou European Myeloma Network ve standardním rameni ve srovnávacích studiích testujících nové léčebné postupy. Ale i v USA na Mayo Clinic používají v roce 2013 kombinaci DRC jako standardní léčebný postup mimo klinické studie. Proto lze tuto kombinaci doporučit i pro použití v ČR.
U starších pacientů je možné použít chlorambucil v kombinaci s rituximabem.
Rituximab je doporučován jako součást všech možných léčebných kombinací používaných pro primární terapii i pro léčbu relapsu [3,73,76,132–134].
V české modifikaci DRC je třeba nahradit perorální cyklofosfamid, který byl použit v původním Dimopoulusově schématu [73], nitrožilní formou cyklofosfamidu, protože perorální cyklofosfamid není dostupný bez vysokých finančních nákladů pro pacienta.
Při závažné cytopenii je vhodné podat rituximab s dexametazonem anebo i s talidomidem, případně podat jen rituximab v monoterapii.
Purinová analoga se dnes rezervují spíše pro kombinace v rámci léčby druhé linie, lze je však podat i v rámci léčby první linie [72,75].
Léčba druhé a další linie
Pro rozhodování, jak léčit relaps nemoci, je vždy zásadní délka trvání léčebné odezvy. Pokud léčebná odezva trvala alespoň 2 roky, lze použít stejný léčebný postup, jako byl použit v iniciální léčbě.
V případně recidivy nemoci v kratším intervalu než 2 roky od ukončení předchozí léčby je na zvážení použití vysokodávkované chemoterapie s autologní transplantací krvetvorné tkáně, pokud tento postup připadá u pacienta v úvahu vzhledem k věku a komorbiditám.
Pokud vysokodávkovaná chemoterapie není vhodná, je nutné zvolit jiný léčebný režim – kombinaci léků, které mají prokázanou účinnost při léčbě Waldenströmovy makroglobulinemie a které nebyly použity v rámci léčby první linie (purinová analoga + rituximab + případně ještě alkylační cytostatikum), nebo režimy obsahující bortezomib v kombinaci s rituximabem, případně bendamustin v kombinaci s dalšími účinnými léky.
Léčebné postupy používané v rámci druhé linie nebyly srovnávány v rámci randomizovaných klinických studiích, a proto volba léčebného postupu záleží na rozhodnutí ošetřujícího lékaře.
Schematicky současné léčebné postupy zobrazuje schéma 1 a 2.
Schéma 1. Schéma iniciální léčby Waldenströmovy makroglobulinemie (WM) 
Schéma 2. Schéma léčby relapsu Waldenströmovy makroglobulinemie 
Vzhledem k nízké incidenci Waldenströmovy makroglobulinemie zůstává problémem vysoká finanční náročnost registračních studií pro nové léky.
Podávání a úhrada rituximabu, bortezomibu, talidomidu a bendamustinu je možná pouze s povolením revizních lékařů zdravotních pojišťoven, kteří svým pozitivním rozhodnutím mohou odstranit neetickou diskriminaci, kterou trpí nemocní s chorobami s ekonomicky nezajímavou incidencí. Standardně jsou v ČR pro léčbu Waldenströmovy makroglobulinemie hrazena klasická cytostatika, kortikoidy a fludarabin. O vše ostatní je nutné v roce 2013 žádat revizní lékaře zdravotních pojišťoven.
Tato práce je podpořena granty IGA MZ ČR NT12215, NT12130 a NT13190 a grantem MUNI/A/0723/2012, a dále NT 12215–4/2011 a NT 13190–3/2012. Souvisí také s aktivitou MZ ČR – RVO (FNBr, 65269705).
prof. MUDr. Zdeněk Adam, CSc.
z.adam@fnbrno.cz
Interní hematologická a onkologická klinika LF MU a FN Brno, pracoviště Bohunice , Brno
www.fnbrno.cz
Doručeno do redakce: 14. 10. 2013
Přijato po recenzi: 11. 11. 2013
Zdroje
1. Waldenström J. Incipient myelomatosis or essential hyperglobulinemia with fibrinogenopenia – a new syndrome? Acta Med Scand 1944; 117 (3–4): 216–247.
2. Wang H, Chen Y, Li F et al. Temporal and geografic variations of Waldenström macroglobulinemia incidence: a large population-based study. Cancer 2012; 118(15): 3793–3800.
3. Vos JM, Minnema MC, Wijermans PW et al. Guidelines for diagnosis, treatment of Waldenström´s macroglobulinaemia. Neth J Med 2013; 71(2): 54–62.
4. Ciccarelli BT, Patterson CJ, Hunter ZR et al. Hepcidin is produced by lymphoplasmacytic cells and is associated with anemia in Waldenström’s macroglobulinemia. Clin Lymphoma Myeloma Leuk 2011; 11(1): 160–163.
5. Treon SP, Tripsas CK, Ciccarelli BT et al. Patients with Waldenström macroglobulinemia commonly present with iron deficiency and those with severely depressed transferrin saturation levels show response to parenteral iron administration. Clin Lymphoma Myeloma Leuk 2013; 13(2): 241–243.
6. Hivert B, Caron C, Petit S et al. Clinical and prognostic implications of low level of von Willebrand factor in patients with Waldenström macroglobulinemia. Blood 2012; 120(16): 3214–3221.
7. Adam Z, Šmardová J, Ščudla V. Waldenströmova makroglobulinémie – klinické projevy, diferenciální diagnostika a prognóza nemoci. Vnitr Lek 2007; 53 (12): 1325–1337.
8. Pujani M, Kushwaha S, Sethi N et al. Waldenstrom’s macroglobulinemia presenting with lytic bone lesions: a rare presentation. Blood Res 2013; 48(3): 230–233.
9. Ševčíková S, Novák L, Kubiczková L et al. Molekulární základy Waldenströmovy makroglobulinemie. Klin Onkol 2012; 25(6): 413–420.
10. Pochop P, Hochová I. Retinopatie jako komplikace Waldenströmovy makroglobulinemie. Cesk Slov Oftalmol 2003; 59(1): 23–27.
11. Churý Z, Drbal J, Jedlicková H et al. Erythema exsudativum multiforme s makroglobulinemií. Vnitr Lek 1999; 45(9): 552–554.
12. Tichý M, Hrnčír Z, Matĕja F et al. Paraprotein IgM N-K s vlastnostmi kryoglobulinu. Čas Lék Česk 1971; 110(33): 761–765.
13. Hrnčír Z, Matĕja F. Revmatoidní faktor u mnohočetného myelomu a Waldenströmovy makroglobulinemie. Čas Lék Česk 1966; 105(13): 351–354.
14. Rencová E, Malý J, Bláha M et al. Dynamika změn retiny v průběhu léčby Waldenströmovy makroglobuilnémie. Česk Oftalmol 1993; 49(1): 3–7.
15. Špička I, Cieslar P, Dyr JE et al. Hemostáza u monoklonálních gammopatií. Sb Lek 1991; 93(9–10): 277–286.
16. Ščudla V, Minařík J, Pika T. Light chain deposition disease. Vnitr Lek 2012; 58(1): 38–43.
17. Ščudla V, Herman M, Minařík J et al. Přínos celotělové MR pro diagnostiku monoklonálních gamopatií nejasného významu a mnohočetného myelomu. Vnitr Lek 2011; 57(1): 52–60.
18. Mysliveček M, Bačovský J, Ščudla V et al.18F-FDG PET/CT a 99mTc-MIBI scintigrafie u pacientů s mnohočetným myelomem a monoklonální gamapatií nejistého významu. Klin Onkol 2010; 23(5): 325–331.
19. Adam Z, Pejchalová A, Chlupová G et al. Nemoc chladových aglutininů nereagující na léčbu glukokortikoidy a na léčbu rituximabem. Jaký postup zvolit pro třetí linii léčby? Popis případu a přehled literatury. Vnitr Lek 2013; 59(9): 828–840.
20. Ščudla V, Bačovský J, Indrák K e al. Výsledky léčby a změny v prognóze pacientů s mnohočetným myelomem ve střední a severní Moravě v posledních 40 letech. Vnitr Lek 2002; 48(8): 707–717.
21. Ščudla V. Anémie chronických chorob, standardní postupy při diagnostice a léčbě. Doporučení Hematologické společnosti České lékařské společnosti J. E. Purkyně. Vnitr Lék 2002; 48(5): 422–426.
22. Adam Z, Ščudla V, Krejčí M et al. Léčba Waldenströmovy makroglobulinemie a léčba nemocí způsobených monoklonálním gamaglobulinem. Vnitr Lék 2008; 54(1): 68–83.
23. Banwait R, O’Regan K, Campigotto F et al. The role of 18F-FDG PET/CT imaging in Waldenstrom macroglobulinemia. Am J Hematol 2011; 86(7): 567–572.
24. Tripsas CK, Patterson CJ, Uljon SN et al. Comparative response assessment by serum immunoglobulin M M-protein and total serum immunoglobulin M after treatment of patients with Waldenström macroglobulinemia. Clin Lymphoma Myeloma Leuk 2013; 13(2): 250–252.
25. Salviani C, Guido G, Serriello I et al. Renal involvement in Waldenström’s macroglobulinemia: case report and review of literature. Ren Fail. 2014;36(1):114–8.
26. Gnemmi V, Leleu X, Provot F et al. Cast nephropathy and light-chain deposition disease in Waldenström macroglobulinemia. Am J Kidney Dis 2012; 60(3): 487–491.
27. Ramachandran R, Rathi M, Malhotra P. Light chain cast nephropathy in Waldenström’s macroglobulinaemia. Nephrol Dial Transplant 2012; 27(4): 1687–1688.
28. Feringa HH, Ardestani A, Gnanaraj J. Distal renal tubular acidosis in lymphoplasmacytic lymphoma Waldenström’s macroglobulinemia: a case report. Cases J 2009; 2 : 7198.
29. Castro H, Valenzuela R, Ruiz P et al. Nephrotic syndrome and kidney failure due to immunocomplex-mediated renal damage in a patient with Waldenström’s Macroglobulinemia: a case report. Cases J 2008; 1(1): 333.
30. Shaikh A, Habermann TM, Fidler ME et al. Acute renal failure secondary to severe type I cryoglobulinemia following rituximab therapy for Waldenström’s macroglobulinemia. Clin Exp Nephrol 2008; 12(4): 292–295.
31. Morel P, Duhamel A, Gobbi P et al. International prognostic scoring system for Waldenström macroglobulinemia. Blood 2009; 113(18): 4163–4170.
32. Johnson SA, Birchall J, Luckie C et al. Guidelines on management of Waldenström´s macroglobulinemia. Brit J Haematol 2006; 132(6): 683–697.
33. Owen RG, Kyle RA, Stone MJ et al. VI International Workshop on Waldenström macroglobulinemia. Response assessment in Waldenström macroglobulinemia: update from the VI international Worshop. Br J Haematol 2013; 160(2): 171–176.
34. Dimopoulos MA, Kyle RA, Anagnastopoulos A et al. Diagnosis and management of Wadenström´s macroglobulinemia. J Clin Oncol 2005; 23(7): 1564–1577.
35. Björkholm M Treatment options in Waldenström´s macroglobulinemia. Clin Lymphoma 2004; 5(3): 155–162.
36. O´Reilly RA, MacKanzie MR. Primary macroglobulinaemia: remission with adrenal corticosteroid therapy. Arch Intern Med 1967; 44: 889–890.
37. Jane SM, Salem HH. Treatment of resistant Waldenström´s macroglobulinaemia with high dose glucocorticosteroids. Aust NZJ Med 1988; 18(1): 77–78.
38. Kyle RA, Greipp PR, Gertz MA et al. Waldenström´s macroglobulinemia. A prospective study comparing daily with intermittent oral chlorambucil. Brit J Haematol 2000; 108(4): 737–742.
39. Annibali O, Petruci MT, Martini V et al. Treatment of 72 newly diagnosed Waldenström´s macroglobulinemia cases with oral melphalan, cyclophosphamide and prednisone: results and cost analysis. Cancer 2005; 103(3): 582–587.
40. Johnson SA. Waldenström macroglobulinaemia. Rev Clin Exp Hematol 2002; 6(4): 421–334 and discussion 449–450.
41. Gertz MA, Anagostopoulos A, Anderson K et al. Treatment recommendation in Waldström´s macroglobulinaemia. Consensus panel recommendation from the second international workshop on Waldenstöm´s macroglobulinaemia. Semin Oncol 2003; 30(2): 121–126.
42. Treon SP, Gertz MA, Dimopoulos M et al. Update on treatment recommendations from the Third International Worshop on Waldenström´s macroglobulinaemia. Blood 2006; 107(9): 3442–3446.
43. Hensel M, Villalobos M, Kornacker M et al. Pentostatin/cyclophosphamide with or without rituximab: An effective regimen for patients with Waldenström´s macroglobulinemia/lymphoplasmocytic lymphoma. Clin Lymphoma Myeloma 2005; 6(2): 131–135.
44. Dhodapkar MV, Jacobson JL, Gertz MA et al. Prognostic factors and response to fludarabine therapy in Waldenström´s macroglobulinemia: an update of a US Intergroup trial (SW0G S9003). Semin Oncol 2003; 30(2): 220–225.
45. Leblond V, Lévy V, Maloisel F et al. Multicenter randomized ¨comparative trial of fludarabine and the combination of cyclophosphamide doxorubicin prednisone in 92 patients with Waldenström´s macroglobulinaemia in first relapse or with primary refractory disease. Blood 2001; 98(9): 2640–2644.
46. Leblond V, Johnson S, Chevret S et al. Results of a randomised trial comparing chlorambucil versus fludarabine for patients with untreated Waldenström´s macroglobulinemia, marginal zone lymphoma or lymphoplasmocytic lymphoma. J Clin Oncol 2013; 31(3): 301–307.
47. Jacobs A. Cold aglutinin hemolysis responding to fludarabine therapy. Am J Hematol 1996; 53(4): 279–280.
48. Lewandowsky K, Halaburda K, Hellman A et al. Fludarabine therapy in Waldenström´s macroglobulinemia patients treated previously with 2-chlordeoxyadenosine. Leukemia Lymphoma 2002; 43(2): 361–363.
49. Dimopoulos MA, Weber D, Kantarjian H et al. 2Chlordeoxyadenosine therapy of Waldenström´s macroglobuliniaemia previously treated with fludarabine. Ann Oncol 1994; 5(3): 288–289.
50. Leblond V, Ben-Othman T, Deconinck E et al. Activity of fludarabine in previously treated Waldenstöm´s macroglobulinaemia: a report of 71 cases. Groupe Coopératif Macroglobulinémie. J Clin Oncol 1998; 16(6): 2060–2064.
51. Dimopoulos MA, Hamilos G, Efstathiou E et al. Treatment of Waldenström´s macroglobulinaemia with combination of fludarabine and cyclophosphamide. Leukemia Lymphoma 2003; 44(6): 993–996.
52. Tamburini JL, Chaleteix V, Cermane JP et al. Fludarabine plus cyclophoshamide in Waldenström´s macroglobulinemia. Results in 49 patients. Leukemie 2005; 19(10): 1831–1834.
53. Tam CS, Wolf MM, Westerman D et al. Fludarabine combination therapy is highly effective in fist line and salvage treatment of patients with Waldenström´s macroglobulinemia. Clin Lymphoma Myeloma 2005; 6(2): 136–139.
54. Tam CS, Wolf M, Prince HM et al. Fludarabine, cyclophosphamide and rituximab for the treatment of patients with chronic lymphocytic leukemia or indolent lymphoma. Cancer 2006; 106(11): 2412–2420.
55. Weber DM, Dimopoulos MA, Dalasalle K et al. 2-chlorodeoxyadenosine alone and in combination for previously untreated Waldenström´s macroglobulinemia. Semin Oncol 2003; 30(2): 243–247.
56. Tedeschi A, Benevolo G, Varettoni M et al. Fludarabine plus cyclophosphamide and rituximab in Waldenström´s macroglobulinemia. An effective but myelosupresive regiment to be offered to patients with advanced disease. Cancer 2012; 118(2): 434–443.
57. Bowcock SJ, Rassam SM, Lim Z et al. High incidence of therapy releated myelodysplasia and acute leukemia in general hematology clinic patients treated with fludarabine and cyclophosphamide for indolent lymphoproliferative disorders. Brit J Haematol 2006; 134(2): 242–243.
58. Tam CS, Seymour JF, Prince JM. Treatment releated myelodysplasia following fludarabine combinations chemotherapy. Haematologica 2006; 91(11): 1546–1550.
59. Leleu Y, Manning R, Soumerai J et al. Increased incidence of disease transformation and development of MDS/AML in Waldenström´s macroglobulinemia patients treated with nucleoside analogs. Haematologica 2007; Suplementum 2, abstr. WM3.10.
60. Souchet-Compain L, Nguyen S, Choquet S et al. Fludarabine in Waldenstrom’s macroglobulinemia. Expert Rev Hematol 2013; 6(3): 229–237.
61. Souchet-Compain L, Nguyen S, Choquet S et al. Primary therapy of Waldenström macroglobulinemia with nucleoside analogue-based therapy. Clin Lymphoma Myeloma Leuk 2013; 13(2): 227–230.
62. Gertz MA, Rue M, Blood E et al. Multicenter phase II trial of rituximab in Waldenström´s macroglobulinaemia. An Eastern Cooperative Oncology Group Study (E3A98). Leuk Lymphoma 2004; 45(10): 2047–2055.
63. Dimopoulos MA, Zervas C, Zomas A. Extended rituximab therapy for previously untreated patients with Waldenstöm´s macroglobulinaemia. Clin Lymphoma 2002; 3(3): 163–166.
64. Treon SP, Emmanoulides C, Kimby E et al. Extended rituximab therapy in Waldenström´s macroglobulinaemia. Ann Oncol 2005; 16(1): 132–138.
65. Ghobrial IR, Fonseca R, Greipp PR et al. Initial imunoglobulin M flare after rituximab therapy in patients diagnosed with Waldenström´s macroglobulinaemia: an Eastern Cooperative Oncology Group Study. Cancer 2004; 101(11): 2593–2598.
66. Dimopoulos MA, Anagnostopoulos A, Zervas C et al. Predictive factors for response to rituximab in Waldenström macroglobulinemia. Clin Lymphoma 2005; 5(4): 270–272.
67. Treon SP, Hansen M, Branagan AR et al. Polymorphismus in FCgama (CD16) receptor expression are associated with clinical response to rituximab in Waldenström macroglobulinemia. J Clin Oncol 2005; 23(3): 474–481.
68. Byrd JC, White CA, Link B et al. Rituximab therapy in Waldenström´s macroglobulinaemia: preliminary evidence of clinical activity. Ann Oncol 1999; 10(12): 1525–1527.
69. Treon SP, Agus DB, Link B et al. CD20 directed antibody mediated immunotherapy induces response and facilitates hematologic recovery in patients with Waldenström´s macroglobulinaemia. J Immunother 2001; 24(3): 272–279.
70. Weber DM, Gavino M, Huh Y et al. Phenotypic and clinical evidence supports rituximab for Waldenström´s macroglobulinemia. Blood 1999; 94(Suppl 1): abstr 549.
71. Foran JM, Rohatiner AZ, Cunningham D et al. European phase II study of rituximab for patients with newly diagnosed mantle cell lymphoma, imunocytoma and small B-cell lymphocytic lymphoma. J Clin Oncol 2000; 18(2): 317–324.
72. Buske C, Hoster E, Dreyling M. German Low-Grade Lymphoma Study Group. The addition of rituximab to front-line therapywith CHOP (R-CHOP) results in a higher response rate and longer time to treatment failure in patients with lymphoplasmacytic lymphoma: results of a randomizedtrial of the German Low-Grade Lymphoma Study Group (GLSG). Leukemia 2009; 23(1): 153–156.
73. Dimopoulos MA, Anagnastopoulos A, Kyrtsonis MC et al. Primary treatment of Waldenström´s macroglobulinemia with dexamethasone, rituximab and cyclophosphamide. J Clin Oncol 2007; 25(22): 3344–3349.
74. Treon SP, Hunter ZR, Branagan AR. CHOP plus rituximab therapy in Waldenström´s macroglobulinemia. Clin Lymphoma 2005; 5(4): 273–277.
75. Ioakimidis L, Patterson CJ, Hunter ZR et al. Comparative outcomes following CP-R, CVP-R, and CHOP-R in Waldenström’s macroglobulinemia. Clin Lymphoma Myeloma 2009; 9(1): 62–66.
76. Gertz MA. Waldenström macroglobulinemia: 2013 update on diagnosis, risk stratification, and management. Am J Hematol 2013; 88(8): 703–711.
77. Weber DM, Thomas S, Wang M et al. Rituximab alone or in combination in the frontline treatment of Waldenström´s macroglobulinemia. Haematologica 2003; 88(Suppl 2): abstr WM2.
78. Treon SP, Wasi P, Emmanoulides CA. Combination therapy with rituximab and fludarabine is highly active in Waldenström´s macroglobulinemia. Blood 2002; 100(Suppl 1): abstr.
79. Tam CS, Wolf M, Prince HM et al. Fludarabine, cyclophosphamide and rituximab for the treatment of patients with chronic lymphocytic leukemia or indolent lymphoma. Cancer 2006; 106(11): 2412–2420.
80. Tedeschi A, Miqueleiz AS, Ricci F et al. Fludarabine cyclophosphamide and rituximab an effective regimen characterized by high incidence of delayed responses in Waldenström´s macroglobulinaemia. Haematologica 2007; 92(Suppl 2): abstr 1225.
81. Vargaftig J, Pegourie-Bandelier B, Mahe B et al. Fludarabine plus cyclophosphamide and rituximab in Waldenström´s macroglobulinemia. Results in 25 patients. Haematologica 2007; 92(Suppl 2): abstr. 1226.
82. Thomas SK, Delassale KB, Gavino M et al. 2-CDA cyclophosphamide plus rutuximab for symptomatic WM. Haematologica 2007; 92(Suppl 2): abstr 1227.
83. Laszlo D, Andreola G, Rigacci L et al. Rituximab and subcutaneous 2-chloro-2’-deoxyadenosine as therapy in untreated and relapsed Waldenström’s macroglobulinemia. Clin Lymphoma Myeloma Leuk 2011; 11(1): 130–132.
84. Treon SP, Hanzis C, Manning RJ et al. Maintenance rituximab is associated with improved clinical outcome in rituximabe naive patients with Waldenström´s macroglobulinemia, who respond to rituximanb containing regimen. Br J Haematol 2011; 154(3): 357–362.
85. Dimopoulos MA, Zomas A, Viniou NA. Treatment of Waldenström macroglobulinemia with thalidomide. J Clin Oncol 2001; 19(16): 3596–3601.
86. Treon SP, Soumerai JD, Branagan AR et al. Thalidomide and rituximab in Waldenstrom macroglobulinemia. Blood 2008; 112(12): 4452–4457.
87. Coleman M, Leonard J, Lyons L et al. Treatment of Waldenstrom’s macroglobulinemia with clarithromycin, low-dose thalidomide, and dexamethasone. Semin Oncol 2003; 30(2): 270–274.
88. Dimopoulos MA, Tsatalas C, Zomas A et al. Treatment of Waldenstrom’s macroglobulinemia with single-agent thalidomide or with the combination of clarithromycin, thalidomide and dexamethasone. Semin Oncol 2003; 30(2): 265–269.
89. Treon SP, Soumerai JD, Branagan AR et al. Lenalidomide and rituximab in Waldenstrom’s macroglobulinemia. Clin Cancer Res 2009; 15(1): 355–360.
90. Santos DD, Hatjiharissi E, Tournilhac O. CD52 is expressed on human mast cells and is a potential therapeutic target in Waldenstrom’s Macroglobulinemia and mast cell disorders. Clin Lymphoma Myeloma 2006; 6(6): 478–483.
91. Tournilhac O, Santos DD, Xu L et al. Mast cells in Waldneström´s macroglobulinemia support lymphoplasmocytic cell growth trough CD154/CD40 signaling. Ann Oncol 2006; 17(8): 1275–1282.
92. Owen RG, Hillmen P, Rastron AC. CD52 expression inWaldenström´s macroglobulinaemia: Implication for alemtuzumab therapy and response assessment. Clin Lymphoma 2005; 5(4): 278–281.
93. Treon SP, Soumerai JD, Hunter ZR et al. Long-term follow-up of symptomatic patients with lymphoplasmacytic lymphoma/Waldenström macroglobulinemia treated with the anti-CD52 monoclonal antibody alemtuzumab. Blood 2011; 118(2): 276–281.
94. Dimopoulos MA, Anagnostopoulos A, Kyrtsonis MC et al. Treatment of relapsed or refractory Waldenström’s macroglobulinemia with bortezomib. Haematologica 2005; 90(12): 1655–1658.
95. Treon SP, Hunter ZR, Matous J et al. Multicenter clinical trial of bortezomib in relapsed/refractory Waldenstrom’smacroglobulinemia: results of WMCTG Trial 03–248. Clin Cancer Res 2007; 13(11): 3320–3325.
96. Chen CI, Kouroukis CT, White D et al. Bortezomib is active in patients with untreated or relapsem Waldenstrom’s macroglobulinemia: a phase II study of the National Cancer Institute of Canada Clinical Trials Group. J Clin Oncol 2007; 25(12): 1570–1577.
97. Chen C, Kouroukis CT, White D et al. Bortezomib in relapsed or refractory Waldenström’s macroglobulinemia. Clin Lymphoma Myeloma 2009; 9(1): 74–76.
98. Ghobrial IM, Hong F, Padmanabhan S et al. Phase II trial of weekly bortezomib in combination with rituximab in relapsed or relapsed and refractory Waldenstrom macroglobulinemia. J Clin Oncol 2010; 28(8): 1422–1428.
99. Treon SP, Ioakimidis L, Soumerai JD et al Primary therapy of Waldenström macroglobulinemia with bortezomib, dexamethasone, and rituximab: WMCTG clinical trial 05–180. J Clin Oncol 2009; 27(23): 3830–3835.
100. Dimopoulos MA, García-Sanz R, Gavriatopoulou M et al. Primary therapy of Waldenstrom’s macroglobulinemia (WM) with weekly bortezomib, low-dose dexamethasone and rituximab (BDR): long term results of a phase II study of the European Myeloma Network (EMN). Blood 2013; 122(19): 3276–3282.
101. Dimopoulos MA, Garcia-Sanz R, Gavriatopoulou M et al. Primary therapy of Waldenström´s macroglobulinemia with weakly bortezomib, low dose dexametazon and rituximab: a phase II study of the European Myeloma Network. ASH Annual Meeting Abstracts 2010; abstr 1941.
102. Ghobrial IM, Xie W, Padmanabhan S et al. Phase II trial of weekly bortezomib in combinatin with rituximab in untreated patients with Waldenström´s macroglobulinemia. Am J Hematol 2010; 85(9): 670–674.
103. Marchand T, Tas P, Houot R et al. Cutaneous macroglobulinosis treated with bortezomib and rituximab. Eur J Haematol 2011; 87(1): 98.
104. Agathocleous A, Rohatiner A, Rule S et al. Weekly versus twice weekly bortezomib given in conjunction with rituximab, in patients with recurrent follicular lymphoma, mantle cell lymphoma and Waldenström macroglobulinaemia. Br J Haematol 2010; 151(4): 346–353.
105. Laubach JP, Mitsiades CS, Roccaro AM et al. Clinical challenges associated with bortezomib therapy in multiple myeloma and Waldenströms Macroglobulinemia. Leuk Lymphoma 2009; 50(5): 694–702.
106. Roccaro AM, Sacco A, Leleu X et al. Role of proteasome inhibition in Waldenström’s macroglobulinemia. Clin Lymphoma Myeloma 2009; 9(1): 94–96.
107. Pascal L, Gay J, Willekens C et al. Bortezomib and Waldenstrom’s macroglobulinemia. Expert Opin Pharmacother 2009; 10(5): 909–916.
108. Dimopoulos MA, Gertz MA, Gastritis E et al. Update on treatment recommendation from the fourht International Workshop on Waldenström´s macroglobulinemia. J Clin Oncol 2009; 27(1): 120–126.
109. Dimopoulos MA, Chen C, Kastritis E et al. Bortezomib as a treatment option in patients with Waldenström macroglobulinemia. Clin Lymphoma Myeloma Leuk 2010; 10(2): 110–117.
110. Dimopoulos MA, Terpos E, Kastritis E. Proteasome inhibitor therapy for Waldenström´s macroglobulinemia. Clin Lymphoma Myeloma and Leuk 2013; 13(2): 235–237.
111. O’Connor SR, Rana SK. Selective loss of lymphoid component simulating myeloma in lymphoplasmacytic lymphoma treated with rituximab. Br J Haematol 2013; 161(4): 460.
112. Vidal L, Gafter-Gvili A, Gurion R et al. Bendamustine for patients with indolent B cell lymphoid malignancies including chronic lymphocytic leukaemia. Cochrane Database Syst Rev. 2012; 9: CD009045. Dostupné z DOI: <http://doi: 0.1002/14651858 .CD009045.pub2>.
113. Knauf WU, Lissitchkov T, Aldaoud A et al. Bendamustine compared with chlorambucil in previously untreated patients with chronic lymphocytic leukaemia: updated results of a randomized phase III trial. Br J Haematol 2012; 159(1): 67–77.
114. Pönisch W, Mitrou PS, Merkle K et al. Treatment of bendamustine and prednisone in patients with newly diagnosed multiple myeloma results in superior complete response rate, prolonged time to treatment failure and improved quality of life compared to treatment with melphalan and prednisone – a randomized phase III study of the East German Study Group of Hematology and Oncology (OSHO). J Cancer Res Clin Oncol 2006; 132(4): 205–212.
115. Treon SP, Hanzis C, Tripsas C et al. Bendamustine therapy in patients with relapsed or refractory Waldenström’s macroglobulinemia. Clin Lymphoma Myeloma Leuk 2011; 11(1): 133–135.
116. Rummel MJ, Niederle N, Maschmeyer G et al. Study Group for indolent lymphoma. Bendamustine plus rituximab versus CHOP plus rituximab as first line treatment for patients with indolent and mantle-cell lymphoma: an open-label, multicenter, randomised phase 3 non inferiority-trial. Lancet 2013; 381(9873): 1203–1210.
117. Gueli A, Gottardi D, Hu H et al. Efficacy of rituximab-bendamustine in cold agglutinin haemolytic anaemia refractory to previous chemo-immunotherapy: a case report. Blood Transfus 2013; 11(2): 311–314.
118. Takemori N, Hirai K, Onodera R et al. Durable remission after splenectomy for Waldenström´s macroglobulinaemia with massive splenomegaly in leukemic phase. Leukem Lymphoma 1997; 26(3–4): 387–393.
119. Gertz MA, Reeder CB, Kyle RA. Stem cell transplant for Waldenström macroglobulinemia: an underutilized technique. Bone Marrow Transplant 2012; 47(9): 1147–1153.
120. Bachanova V, Burns LJ. Hematopoietic cell transplantation for Waldenström macroglobulinemia. Bone Marrow Transplant 2012; 47(3): 330–336.
121. Kyriakou C, Canals C, Cornelissen JJ. Allogeneic stem-cell transplantation in patients with Waldenström macroglobulinemia: report from the Lymphoma Working Party of the European Group for Blood and Marrow Transplantation. J Clin Oncol 2010; 28(33): 4926–4934.
122. Kyriakou C, Canals C, Sibon D et al. High-dose therapy and autologous stem-cell transplantation in Waldenstrom macroglobulinemia: the Lymphoma Working Party of the European Group for Blood and Marrow Transplantation. J Clin Oncol 2010; 28(13): 2227–2232.
123. Garnier A, Robin M, Larosa F et al. Allogeneic hematopoietic stem cell transplantation allows long-term complete remission and curability in high-risk Waldenström’s macroglobulinemia. Results of a retrospective analysis of the Société Française de Greffe de Moelle et de Thérapie Cellulaire. Haematologica 2010; 95(6): 950–955.
124. Caravita T, Siniscalchi A, Tendas A et al. High-dose therapy with autologous PBSC transplantation in the front-line treatment of Waldenstrom’s macroglobulinemia. Bone Marrow Transplant 2009; 43(7): 587–588.
125. Gilleece MH, Pearce R, Linch DC et al. The outcome of haemopoietic stem cell transplantation in the treatment of lymphoplasmacytic lymphoma in the UK: a British Society Bone Marrow Transplantation study. Hematology 2008; 13(2): 119–127.
126. Einstein R. Therapeutic plasma exchange performed in tandem with hemodialysis for patients with M-protein disorders. J Clin Apheresis 2006; 21(2): 100–104.
127. Clark WF, Rock GA, Buskard N et al. Therapeutic plasma exchange: an update from the Canadian Apheresis Group. Ann Intern Med 1999; 131(6): 453–462.
128. Stone MJ, Bogen SA. Evidence-based focused review of management of hyperviscosity syndrome. Blood 2012; 119(10): 2205–2208.
129. Ansell SM, Kyle RA, Reeder CB et al. Diagnosis and management of Waldenström macroglobulinemia: Mayo stratification of macroglobulinemia and risk-adapted therapy (mSMART) guidelines. Mayo Clin Proc 2010; 85(9): 824–833.
130. Menke MN, Feke GT, McMeel JW et al. Ophthalmologic techniques to assess the severity of hyperviscosity syndrome and the effect of plasmapheresis in patients with Waldenström’s macroglobulinemia. Clin Lymphoma Myeloma 2009; 9(1): 100–103.
131. Drew MJ. Plasmapheresis in the dysproteinemias. Ther Apher 2002; 6(1): 45–52.
132. Dimopoulos MA, Gastritis E, Rousou M et al. Rituximab based treatments in Waldenström´s macroglobulinemia. Clin Lymphoma Myeloma 2009; 9(1): 59–61.
133. Dimopoulos MA, Gertz MA, Kastritis E et al. Update on the treatment recomendation from the Fourth International Workshop on Waldenström´s macroglobulinemia. J Clin Oncol 2009; 27(1): 120–126.
134. Anderson KC, Alsina M Bensinger W et al. Waldenström macroglobulinemia/lymfoplamocytic lymphoma. Version 2. 2013 J Natl Compr Canc Netw 2012; 10(10): 1211–1219.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2014 Číslo 2- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Nech brouka žít… Ať žije astma!
- Intermitentní hladovění v prevenci a léčbě chorob
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Úvodník po volbách aneb programové miniprohlášení předsedy ČIS
- VÝBOR ČIS pro funkční období 2014–2018
- Orální infekce a revmatická onemocnění – editorial
- Septický/infikovaný trombus prechodu hornej dutej žily a pravej predsiene v súvislosti so zavedeným centrálnym žilným katétrom – editorial
- Septický/infikovaný trombus přechodu horní duté žíly a pravé síně se zavedeným centrálním žilním katétrem – editorial
- Hodnocení diastolické funkce levé komory pomocí radionuklidové ventrikulografie u pacientů s chronickým srdečním selháním a sníženou ejekční frakcí
- Dynamika hladiny interleukinu 6 u pacientů v septickém a kardiogenním šoku a u pacientů s akutním infarktem myokardu s elevacemi ST
- MR kompatibilní kardiostimulátory a implantabilní kardiovertery-defibrilátory
- Orální infekce a revmatická onemocnění
- Renální denervace pro léčbu arteriální hypertenze – nezodpovězené otázky
- Léčba Waldenströmovy makroglobulinemie v roce 2013
- JAK2 inhibitory v léčbě primární myelofibrózy. Dodatek k doporučením pro diagnostiku a léčbu Ph negativních myeloproliferativních onemocnění České pracovní skupiny pro Ph negativní myeloproliferativní onemocnění České hematologické společnosti ČLS JEP (CZEMP)
- Izolovaná nonkompaktní kardiomyopatie: souhrnný článek s kazuistickým příkladem
- Septická trombóza horní duté žíly a pravé síně v souvislosti se zavedeným centrálním žilním katétrem
- David Školoudík, Daniel Šaňák et al. Rekanalizační terapie akutní ischemické cévní mozkové příhody.
- Omluva
- Ondřej Šimetka, Radovan Vlk, Martin Procházka. HELP syndrom.
- Oznam/Oznámení
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- MR kompatibilní kardiostimulátory a implantabilní kardiovertery-defibrilátory
- Dynamika hladiny interleukinu 6 u pacientů v septickém a kardiogenním šoku a u pacientů s akutním infarktem myokardu s elevacemi ST
- Septická trombóza horní duté žíly a pravé síně v souvislosti se zavedeným centrálním žilním katétrem
- JAK2 inhibitory v léčbě primární myelofibrózy. Dodatek k doporučením pro diagnostiku a léčbu Ph negativních myeloproliferativních onemocnění České pracovní skupiny pro Ph negativní myeloproliferativní onemocnění České hematologické společnosti ČLS JEP (CZEMP)
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




