-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Predklinické kardiovaskulárne ochorenia a tuhosť aorty
Preclinical cardiovascular diseases and aortic stiffness
Aim:
To compare aortic stiffness (represented by aortic pulse wave velocity – PWVao) as a marker of cardiovascular risk with cardiovascular risk estimated by standard scoring systems in treated hypertensive patients.Patients and methods:
In a group of 41 hypertensive patients without clinical manifestation of cardiovascular disease (18 men/23 women, mean age 59 years) we investigated the presence of risk factors and preclinical cardiovascular diseases. To estimate cardiovascular risk we have used SCORE-HDL model and categorical risk stratification recommended by ESC/ESH. Linear regression was used for evaluation of relation between risk estimation scores and PWVao values.Results:
We have found out statistically significant relationship between PWVao and cardiovascular risk assessment systems in our group of patients. The correlation between PWVao and ESC/ESH risk stratification (r = 0.414, P < 0.01) was the most relevant, the correlation between PWVao and SCORE-HDL values was also significant (r = 0.315; P < 0.05).Conclusions:
Increased aortic stiffness as one of the preclinical cardiovascular diseases can be an integrative marker of cardiovascular risk in patients with arterial hypertension.Key words:
preclinical cardiovascular diseases – cardiovascular risk – aortic pulse wave velocity – PWV – aortic stiffness
Autoři: Mária Potočárová 1; Jozef Bulas 1; Marta Filková Karabová 1; Ján Murín 1; Ivan Janiga 2
Působiště autorů: I. interná klinika LF UK a UN Bratislava, Slovenská republika, prednostka doc. MUDr. Soňa Kiňová, PhD. 1; Slovenská technická univerzita Bratislava, Slovenská republika, dekan prof. Ing. Ľubomír Šóoš, PhD. 2
Vyšlo v časopise: Vnitř Lék 2014; 60(4): 341-347
Kategorie: 60. narozeniny prof. MUDr. Petra Widimského, DrSc., FESC, FACC
Souhrn
Cieľ:
Porovnať tuhosť aorty (vyjadrenú ako rýchlosť šírenia pulzovej vlny v aorte – PWVao) ako ukazovateľa kardiovaskulárneho rizika u pacientov s liečenou artériovou hypertenziou, s kardiovaskulárnym rizikom odhadovaným podľa štandardných skórovacích systémov.Súbor a metódy:
V súbore 41 pacientov hypertonikov bez klinických prejavov kardiovaskulárneho ochorenia (23 žien/18 mužov, priemerného veku 59 rokov) sme zisťovali prítomnosť rizikových faktorov a predklinických kardiovaskulárnych ochorení. Na odhad kardiovaskulárneho rizika sme použili SCORE-HDL a kategorickú klasifikáciu doporučenú podľa ESH/ESC. Závislosť medzi jednotlivými odhadmi rizika a PWVao sme hodnotili regresnou analýzou.Výsledky:
V sledovanom súbore sme zistili štatisticky signifikantnú závislosť medzi PWVao a kardiovaskulárnym rizikom odhadovaným pomocou použitých skórovacích systémov; najvýznamnejšia korelácia bola medzi PWVao a odhadovaným kardiovaskulárnym rizikom podľa ESC/ESH (r = 0,414; p < 0,01); významný bol aj vzťah medzi PWVao a hodnotou SCORE-HDL (r = 0,315; p < 0,05).Záver:
Zvýšená tuhosť aorty ako jedno z predklinických kardiovaskulárnych ochorení môže byť integrujúcim ukazovateľom kardiovaskulárneho rizika u pacientov s artériovou hypertenziou.Kľúčové slová:
predklinické kardiovaskulárne ochorenia – kardiovaskulárne riziko – rýchlosť šírenia pulzovej vlny v aorte (PWV) – tuhosť aortyÚvod
Artériová hypertenzia je významný rizikový faktor prispievajúci k vzniku ochorení srdcovo-cievneho systému, pričom je známe, že v prípade súčasného výskytu viacerých rizikových faktorov je ohrozenie pacienta väčšie [1–5]. V priebehu života sa zdravotný stav jednotlivých pacientov vyvíja odlišne, u niektorých k manifestácii závažného klinického ochorenia nedôjde vôbec, u niektorých sa manifestuje klinická komplikácia v pomerne krátkom časovom horizonte od zistenia hypertenzie, alebo iných rizikových faktorov [6].
Vysoká prevalencia hypertenzie v celosvetovej populácii viedla k realizácii mnohých epidemiologických štúdií, cieľom ktorých bolo zistiť, ktoré rizikové faktory, alebo iné merateľné parametre ľudského organizmu prispievajú väčšou či menšou mierou k vzniku klinických ochorení, najmä ischemickej choroby srdca, cievnej mozgovej príhody, ale aj ďalších dôsledkov aterosklerózy a arteriosklerózy [7]. Stav kardiovaskulárneho zdravia pacienta je v rozhodujúcej miere určený stavom artériového riečiska.
Pretože proces vývoja degeneratívnych a patologických zmien na cievach a srdci je mnohoročný kontinuálny dej, boli vypracované viaceré schémy popisujúce tento vývoj formou kardiovaskulárneho kontinua [8]. Tieto prístupy pomohli ozrejmiť skutočnosť, že v organizme dochádza vplyvom pôsobenia rizikových faktorov (v teréne genetických predispozícií v súčinnosti s vplyvmi prostredia a životného štýlu jednotlivca) k postupnému pomalému vývoju funkčných, morfologických a anatomických zmien, ktoré sa dajú cielenými vyšetreniami zistiť a zhodnotiť ich závažnosť.
Z pohľadu kardiovaskulárneho kontinua sa tieto zmeny formujú v časovom úseku medzi zaevidovaním prítomnosti rizikových faktorov u mladého klinicky zdravého pacienta a stavom, kedy je pacient už starší, klinicky chorý, prípadne v preterminálnom štádiu s postihnutím srdca, mozgu, ciev alebo obličiek. Nakoľko ich prítomnosť je v organizme evidentná rôzne dlhé obdobie pred prípadnou manifestáciou klinického ochorenia, zaužíval sa pre túto skupinu zmien termín predklinické ochorenia kardiovaskulárneho systému (PKVO). V minulosti sa časť týchto zmien označovala termínom „poškodenie cieľových orgánov“ (Target Organ Disease – TOD), ktoré sa pripisuje pôsobeniu artériovej hypertenzie vo vzťahu k najčastejšie poškodzovaným orgánom [9,10].
Z hľadiska kardiovaskulárneho rizika sú predklinické ochorenia závažnejším negatívnym prognostickým ukazovateľom než akýkoľvek štandardný rizikový faktor. Prítomnosť orgánových zmien, ako aj počet abnormálnych parametrov, ktoré svedčia o poškodení orgánov, sú asociované so zvýšeným kardiovaskulárnym rizikom, nezávisle od získaného indexu SCORE. Preto niektorí autori navrhujú vypracovať kombinované modely SCORE s predklinickými orgánovými poškodeniami [11]. Zvýšená pozornosť tejto problematike sa odráža aj v odporúčaniach pre diagnostiku a liečbu artériovej hypertenzie príslušných odborných spoločností, prípadne v odporúčaniach zameraných na prevenciu kardiovaskulárnych ochorení [1].
Medzi najvýznamnejšie predklinické ochorenia, vyšetrovanie ktorých sa pri odhade kardiovaskulárneho rizika v klinickej praxi odporúča, patria: hypertrofia ľavej komory srdca (pomocou EKG alebo echokardiografického vyšetrenia), zhrubnutie intimomediálneho komplexu (IMT) cievnej steny (merané najčastejšie na a. carotic communis), detekcia aterosklerotických plátov, členkovo-brachiálny index krvného tlaku znížený pod 0,9, ľahké zvýšenie kreatinínu v sére, mikroalbuminúria a vysoká amplitúda krvného tlaku (takzvaný pulzný tlak – PP).
Novšie bola do tejto skupiny zaradená aj tuhosť aorty, ktorá je asociovaná s viacerými ochoreniami, ktoré sú časté vo vyššom veku, včítane ochorenia srdca, mozgovej príhody a poškodenia obličiek [1,12,13]. Rozsah odporúčaných vyšetrení, ich vhodnosť, alebo prínos niektorých parametrov k prehodnoteniu stanoveného rizika sú predmetom diskusie a analýz, ako je vidieť napríklad aj v najnovších európskych a amerických odporúčaniach pre odhad kardiovaskulárneho rizika [14,15]. Abnormálne vysoká tuhosť aorty koreluje s krvným tlakom, obezitou, body mass indexom (BMI), s vekom, poruchou glukózovej tolerancie a abnormálnym lipidogramom [16].
Niektorí autori považujú tuhosť artérií a odvodené parametre, najmä centrálny tlak, za silný a nezávislý ukazovateľ kardiovaskulárneho rizika, prípadne za integrujúci ukazovateľ kardiovaskulárneho poškodenia orgánov a kardiovaskulárneho rizika [17–19].
Dostupnosť a jednoduchosť používania niektorých prístrojov viedla v ostatných rokoch k značnému rozšíreniu merania tuhosti aorty v klinickej praxi [20,21]. Jednou z najdostupnejších a metodicky nenáročných metód je meranie globálnej/systémovej tuhosti aorty stanovovanej na základe analýzy tvaru pulzovej krivky. Na základe detekcie typických charakteristík tlakových kriviek počas systoly a diastoly (vrcholy a poklesy, „zárezy na krivke krvného tlaku“), ktoré sú snímané na ramene pacienta manžetou pri meraní tlaku, je možné odhadnúť aj rýchlosť šírenia pulzovej vlny v aorte (Pulse Wave Velocity – PWV) ako ukazovateľa tuhosti aorty [22]. V našej práci sme využili možnosti prístroja Arteriograf-TensioMed, ktorý okrem merania krvného tlaku manžetou na ramene pacienta súčasne poskytuje aj viaceré parametre neinvazívnej hemodynamiky, meria aj rýchlosť šírenia pulzovej vlny v aorte, a podľa literárnych údajov vykazuje dobrú zhodu s meraniami karotidofemorálnej rýchlosti, ktorá je považovaná za zlatý štandard na meranie rýchlosti pulzovej vlny v aorte [23].
S cieľom zistiť, či tuhosť aorty koreluje so stupňom kardiovaskulárneho rizika vyjadreného štandardnými skórovacími systémami a s prítomnosťou predklinických ochorení, sme vyšetrili súbor pacientov s artériovou hypertenziou, ktorí nemali žiadne klinicky manifestné kardiovaskulárne ochorenie.
Súbor a metódy
Súbor tvorilo 41 pacientov s artériovou hypertenziou (23 žien, 18 mužov) bez klinicky manifestného kardiovaskulárneho ochorenia, priemerného veku 59 rokov, ktorí boli vyšetrení na ambulancii pre hypertenziu. Boli to buď prvovyšetrenia odoslaných pacientov, alebo kontroly v rámci dispenzarizácie. Väčšina pacientov (88 %) užívala antihypertenzívnu liečbu, základom boli inhíbítory angiotenzín-konvertujúceho enzýmu (ACEI) alebo blokátory angiotenzínových receptorov (ARB), spolu v takmer 80 %, ako druhá najčastejšia lieková skupina boli používané blokátory kalciového kanála u 60 % pacientov, často v kombinácii. Ďalej boli používané diuretiká (u 41 % pacientov), beta-blokátory (u 32 % pacientov), blokátory α-receptorov (u 7 %) a centrálne pôsobiace lieky (u 15 %), priemerný počet liekov na 1 pacienta bol 2,3 lieku (tab. 1).
Tab. 1. Antihypertenzívna liečba pacientov v súbore 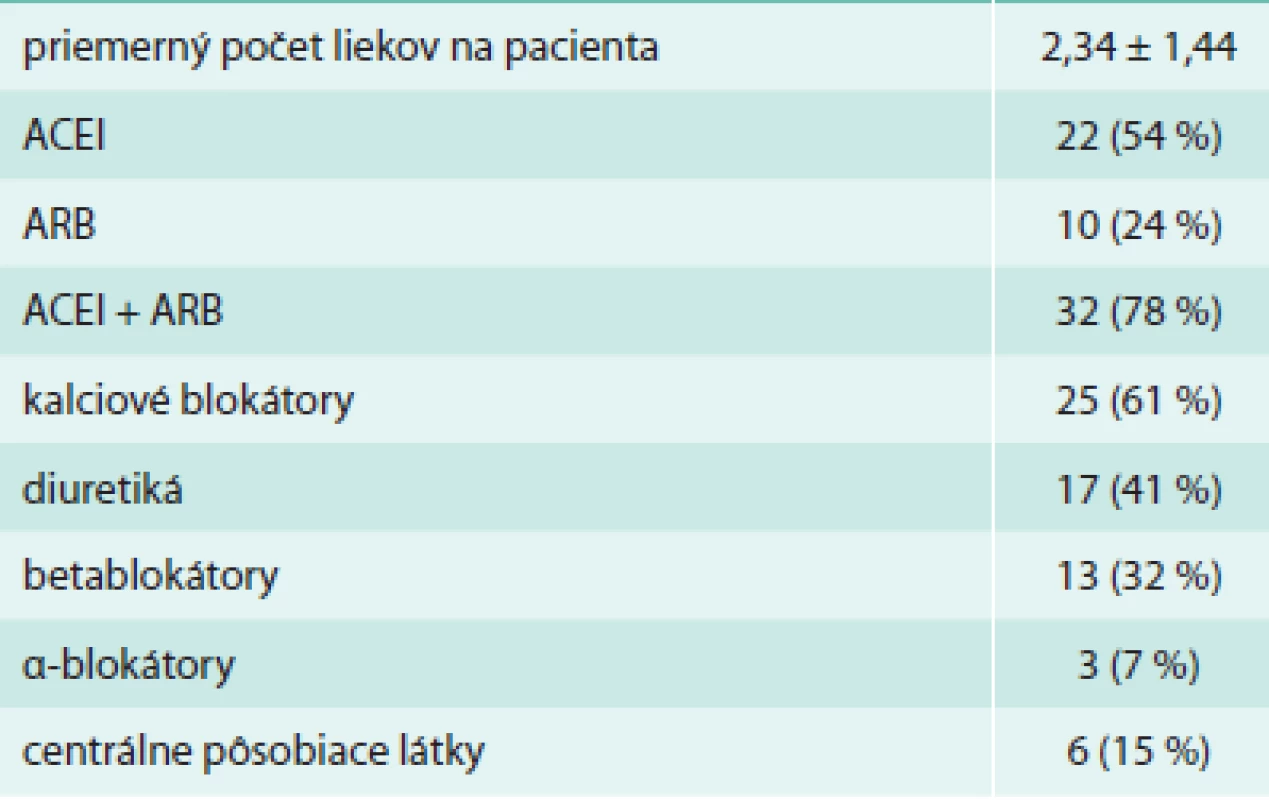
ACEI – inhíbítory angiotenzín-konvertujúceho enzýmu ARB – blokátory angiotenzínových receptorov Po absolvovaní základného klinického vyšetrenia a laboratórnych odberov bolo realizované vyšetrenie artériografom, echokardiografické vyšetrenie a skríningové vyšetrenie karotických tepien (meranie hrúbky intimomediálneho komplexu – IMT, jeho vzhľadu a prítomnosti aterosklerotických plakov).
Hodnoty tlaku krvi boli stanovené priemerom z 3 hodnôt krvného tlaku meraného automaticky oscilometricky prístrojom Arteriograf-TensioMed s manžetou primeranej šírky s odstupom minimálne 2 min. Merania boli vykonávané po minimálne 5 min pokoja u ležiaceho pacienta. Za zvýšenie pulzového tlaku (PP) ako prejavu predklinického kardiovaskuláreho ochorenia (PKVO) boli považované hodnoty PP ≥ 60 mm Hg [1].
Laboratórne boli stanovené sérové hodnoty celkového cholesterolu, LDL-cholesterolu, HDL-cholesterolu, triacylglyceridov a glykémie. Hodnoty sérového kreatinínu boli získané spriemerovaním 3 hodnôt sérového kreatinínu nameraných v období 3 mesiacov približne zodpovedajúcich dobe merania artériovej tuhosti; z hodnoty sérového kreatinínu, pohlavia, rasy a veku bola kalkulovaná približná hodnota glomerulárnej filtrácie (eGFR) vzorcom podľa štúdie MDRD [24]. Za PKVO sme pokladali ľahké až stredne ťažké zníženie eGFR t.j. hodnoty 30–60 ml/min/1,73 m2, za ťažké chronické ochorenie obličiek ako manifestné KVO sme pokladali hodnoty eGFR < 30 ml/min/1,73 m2 [1].
Vyšetrením vzorky prvého ranného moču sme zisťovali hodnotu pomeru albumín/kreatinín v moči (za PKVO sme považovali hodnoty 3,4–34 mg/mmol), u časti pacientov bol realizovaný zber moču so stanovením, kde sme prítomnosť mikroalbuminúrie (30–300 mg/24 hod) hodnotili ako prejav PKVO a proteinúriu (> 300 mg/24 hod) sme považovali za manifestné KVO [1].
Echokardiografické vyšetrenie bolo realizované na prístroji ALOKA. Hmotnosť ľavej komory srdca sme kalkulovali zo základných echokardiografických parametrov získaných štandardným spôsobom (Pennská konvencia) [25]. Zo získaných dát sme vo vzťahu k povrchu tela vypočítali index hmotnosti ľavej komory (LMVi). Za hypertrofiu ľavej komory sme považovali u žien LVMi ≥ 95 g/m2, u mužov 115 g/m2 [1].
Karotické artérie boli ultrasonograficky vyšetrované lineárnou sondou, prístroj ALOKA. Hrúbka intimomediálneho komplexu (IMT) bola stanovená osobitne na oboch karotických artériách spriemerovaním 3 hodnôt nameraných na 3 miestach 1 cm pod bifurkáciou mimo oblastí plakov, ak boli prítomné. Nález na karotídach sme tiež hodnotili semikvalitatívne stupnicou podľa Kritza (stupne 1–6) [26]. Za prejav PKVO sme považovali zhrubnutie IMT > 0,9 mm alebo prítomnosť plakov [1], v našom prípade reprezentovanú stupňom ≥ 4 podľa Kritza.
Tuhosť artérií sme vyšetrovali prístrojom Arteriograph-TensioMed, ktorý pracuje na oscilometrickom princípe snímania pulzácií a. brachialis manžetou na ramene pacienta pri niekoľkých úrovniach krvného tlaku, s následnou analýzou tvaru pulzovej krivky a za súčasného merania brachiálneho krvného tlaku [20,22,23]. Vzdialenosť jugulum-symfýza sme merali po povrchu tela neelastickým meracím pásmom rovnakým u všetkých vyšetrovaných osôb. Meranie umožňuje z nameraných údajov automaticky odvodiť viaceré charakteristiky globálnej tuhosti aorty (systémovej tuhosti artérií) – augmentačný index aorty (AIXao), augmentačný index a. brachialis (AIXb), hodnotu centrálneho systolického aortového tlaku (SBPao) a rýchlosť šírenia pulzovej vlny aortou (PWVao). Výhodou automatického merania je nezávislosť merania na operátorovi, a preto menšie riziko systematickej chyby v meraní; presnosť metodiky prístroja bola validizovaná paralelnými invazívnymi aj neinvazívnymi metodikami [20,22,27]. Za patologicky zvýšené PWVao sme považovali hodnoty > 10 m/s [1].
Kardiovaskulárne riziko pacientov sme odhadli podľa 2 stratifikačných schém v súčasnosti odporúčaných ESC/ESH. Hodnotu SCORE-HDL, zodpovedajúcu odhadovanému 10-ročnému riziku fatálneho KVO, sme vypočítali zo získaných dát vzťahom používaným pre krajiny s vysokým rizikom (ku ktorým patrí aj naša populácia) pomocou on-line kalkulátora dostupného na webovej stránke Európskej kardiologickej spoločnosti [28].
Celkové kardiovaskulárne riziko sme tiež stanovovali pomocou kategorickej klasifikácie doporučenej podľa Odporučení pre manažment artériovej hypertenzie ESH/ESC 2013. Spomínaná klasifikácia umožňuje pacientov rozdeliť na základe hodnôt ich systolického a diastolického tlaku, prevalencie rizikových faktorov, PKVO, diabetu, štádia chronického renálneho ochorenia a prítomnosti symptomatických KVO do viacerých kategórií rizikovosti – pacienti bez prídatného rizika, s nízkym, nízkym až priemerným, priemerným, priemerným až vysokým, vysokým, vysokým až veľmi vysokým a veľmi vysokým rizikom [1].
Štatistické spracovanie výsledkov bolo realizované pomocou programu Statgraphics Centurion XV.I. Všetky namerané dáta, pokiaľ nie je uvedené inak, sú prezentované ako aritmetický priemer ± smerodajná odchýlka (SD). Závislosť medzi normálne rozloženými premennými bola meraná pomocou lineárnej regresnej analýzy, a vyjadrená ako Pearsonov korelačný koeficient (r). Za štatisticky významné boli považované závislosti s hodnotou p < 0,05 pri ANOVA analýze.
Výsledky
Vyšetrený súbor tvorilo 41 pacientov, priemerného veku 58,6 ± 8,7 rokov, s priemernou dĺžkou trvania hypertenzie 11,9 ± 8,5 roka – bližšiu charakteristiku vlastností súboru viď tab. 2. U všetkých pacientov sme realizovali vyšetrenia na zistenie rôznych predklinických kardiovaskulárnych ochorení. Prítomnosť aspoň jedného PKVO sme zistili u 88 % pacientov, priemerný počet zistených PKVO na jedného pacienta bol 2,98. Najčastejším nájdeným PKVO vo vyšetrovanom súbore bola prítomnosť plakov v a. carotis, ktorá bola prítomná až u 51 % pacientov vo vyšetrovanom súbore. Hypertrofia ľavej komory bola prítomná u 46 %, zvýšenie rýchlosti šírenia pulzovej vlny v aorte u 46 %, zhrubnutie intimomediálneho komplexu a. carotis communis u 29 %, zvýšenie pulzového tlaku u 20 %, ľahšie až stredne ťažké chronické renálne ochorenia a mikroalbuminúria zhodne u 2 % pacientov (tab. 3).
Tab. 2. Základná charakteristika súboru a rizikové faktory 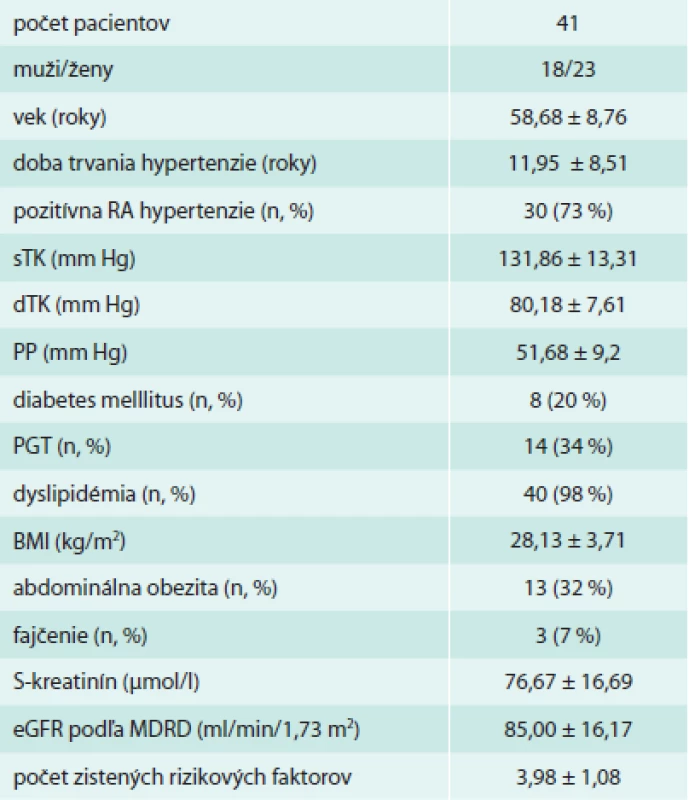
RA – rodinná anamnéza sTK – systolický tlak krvi dTK – diastolický tlak krvi PP – pulzový tlak PGT – porucha glukózovej tolerancie BMI – index telesnej hmotnosti eGFR – glomerulárna filtrácia Tab. 3. Výskyt predklinických kardiovaskulárnych ochorení (PKVO) 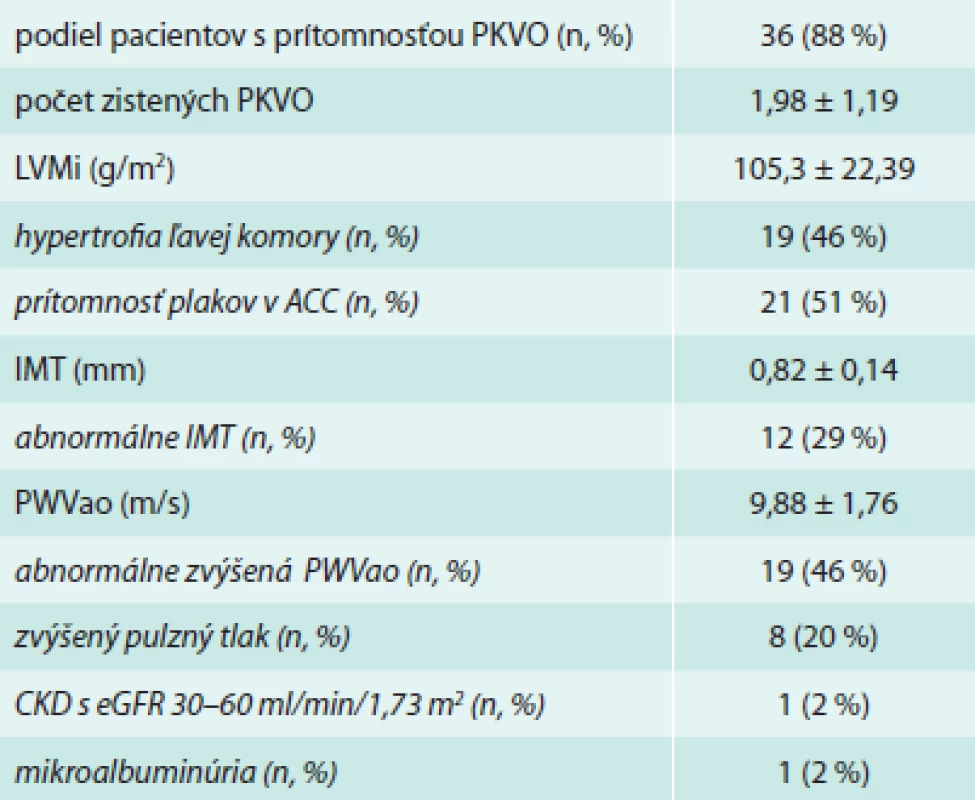
PKVO – predklinické kardiovaskulárne ochorenie LVMi – index hmotnosti ľavej komory IMT – intimo-medial thickness – hrúbka komplexu intima-média a. carotis PWVao – rýchlosť šírenia pulzovej vlny v aorte CKD – chronické ochorenie obličiek eGFR – odhadovaná glomeruálna filtrácia Pacienti boli stratifikovaní pomocou odhadovaného KV pripočítateľného rizika. Najpočetnejšie boli pacienti zastúpení v podskupinách s priemerným až vysokým rizikom (58 %) a vysokým rizikom (31,7 %); nízke až priemerné bolo KV pripočítateľné riziko u 7,3 % a nízke u pacientov 2,4 % pacientov. Pacienti bez prídatného rizika, s priemerným, vysokým až veľmi vysokým a veľmi vysokým rizikom neboli prítomní vo vyšetrovanom súbore. Priemerné 10-ročné riziko fatálneho KVO odhadovaného pomocou SCORE-HDL bolo 3,24 ± 2,23 %.
Hodnotili sme vzťah rýchlosti šírenia pulzovej vlny v aorte ku vybraným ukazovateľom slúžiacim na odhad KV rizika – SCORE-HDL, odhad KV pripočítateľného rizika a celkový počet zistených PKVO. Hoci hodnoty korelačného koeficientu poukazujú na pomerne slabú závislosť medzi skúmanými premennými, hodnota PWVao vo vyšetrovanom súbore však bola signifikantne závislá od všetkých spomínaných premenných (tab. 4, graf 1). Najvýznamnejšia korelácia bola prítomná medzi PWVao a odhadovaným kardiovaskulárnym rizikom podľa ESC/ESH (r = 0,414; p < 0,01) (graf 2). Štatistickú významnosť dosiahol aj vzťah medzi PWVao a hodnotou SCORE-HDL (r = 0,315; p < 0,05) a PWVao a počtom ostatných PKVO (r = 0,331; p < 0,05).
Tab. 4. Vzťah PWVao ku vybraným ukazovateľom (jednoduchá regresia) 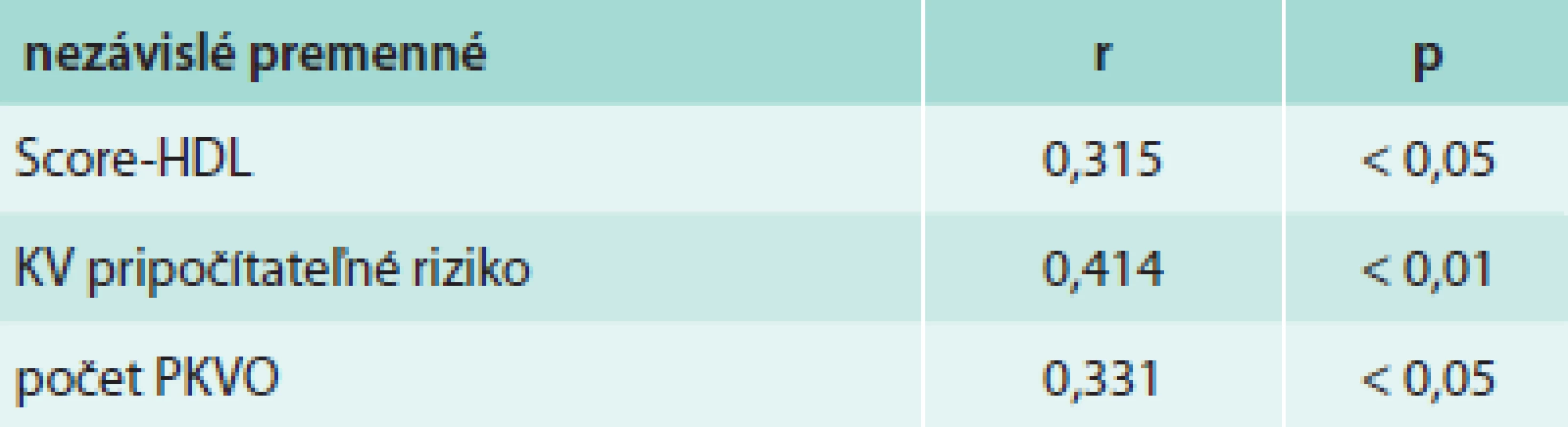
r – korelačný koeficient PWVao – závislá premenná PWVao – rýchlosť šírenia pulzovej vlny v aorte PKVO – predklinické kardiovaskulárne ochorenia Graf 1. Grafické vyjadrenie vzťahu rýchlosti šírenia pulzovej vlny v aorte (PWVao) k vybraným parametrom (jednoduchá regresia) 
Graf 2. Asociácia medzi PWVao a kardiovaskulárnym rizikom odhadnutým pomocou Risk-ESC 
Diskusia
V klinickej praxi sa na odhad kardiovaskulárneho rizika najviac používajú škálovacie schémy založené najmä na používaní prítomnosti rizikových faktorov, prípadne ich kombináciách; v Európe sa presadzuje zvlášť systém SCORE. Pretože nežiaduce zmeny kardiovaskulárneho systému a celého organizmu v procese starnutia sa vyvíjajú v priebehu mnohých rokov, ujal sa náhľad na tento proces charakterizovaný termínom kardiovaskulárne kontinuum, vystihujúci podstatnú charakteristiku týchto dejov [8,10,11]. Pred vznikom klinického ochorenia sa vhodnými vyšetrovacími metódami dá zhodnotiť miera poškodenia (najmä) artériového systému a odhadnúť riziko skorého vzniku ochorenia s klinickými dôsledkami.
V našej práci sme sa zameriavali na viaceré zmeny v kardiovaskulárnom systéme, ktoré podľa odporúčaní odborných spoločností vypovedajú o zvýšenom riziku s väčšou silou, než samotné rizikové faktory. Ultrasonografiou karotických artérií sme sa snažili zistiť prítomnosť arterosklerózy meraním hrúbky intimomediálneho komplexu , alebo detekciou plakov v karotickom riečisku; v našom súbore relatívne mladých (priemerný vek 59 rokov) klinicky zdravých pacientov s hypertenziou sme plaky zistili u 21 osôb (51 %). Cao et al [30] našli v populácii vyše 5 000 starších osôb (nad 65 rokov) s vysokým rizikom plaky v 56 %; po 12 rokoch sledovania sa prítomnosť plakov pri vstupnom vyšetrení ukázala ako významná pri prehodnocovaní a spresňovaní vstupných odhadov kardiovaskulárneho rizika.
Podobne hypertrofia ľavej komory je významný prognosticky negatívny marker; Verdecchia et al [31] popísali zvýšenie rizika kardiovaskulárnych príhod o 40 % pri každom zvýšení indexu masy ľavej komory o 39 g/m2 povrchu tela. V skupine našich pacientov sme zaevidovali miernu hypertrofiu ľavej komory u 46 % pacientov, avšak hodnoty presahovali len mierne horné limity aktuálne odporúčané pre zaradenie nálezu do kategórie hypertenzie. Zvýšené vylučovanie albumínu do moču sa tiež ukázalo ak veľmi prínosný ukazovateľ kardiovaskulárnej rizikovosti pacientov [32] a niektorí ho považujú za integrujúci ukazovateľ kardiovaskulárneho rizika u pacientov s hypertenziou [33].
Za vhodný integrujúci marker kardiovaskulárneho rizika, alebo ukazovateľ predklinického poškodenia orgánov je považovaná aj tuhosť aorty, odhadovaná pomocou merania rýchlosti pulzovej vlny v aorte (PWVao). V súbore našich pacientov sme zistili signifikantnú koreláciu medzi PWVao a odhadom rizika systémom SCORE s do výpočtu inkorporovanou hodnotou HDL-cholesterolu, ale tiež aj so stupňom kategórie pripočítateľného kardiovaskulárneho rizika podľa odporúčaní ESC/ESH a s počtom predklinických kardiovaskulárnych ochorení; tieto korelácie boli síce slabé, ale dosahovali štatistickú významnosť. Najsignifikantnejšou v našom súbore bola korelácia PWVao so stupňom rizika podľa ESC/ESH prístupu, ktorý pri kategorizovaní pacientov pracuje jednak s rizikovými faktormi, jednak s prítomnosťou predklinických a manifestných kardiovaskulárnych ochorení. Tieto výsledky by mohli svedčiť aj pre možnú integrujúcu pozíciu parametra tuhosti aorty pri výpovedi o rizikovosti pacienta.
Meranie tuhosti aorty a centrálneho systolického tlaku by sa s perspektívne zvýšenou dostupnosťou prístrojov a zjednodušením techniky merania mohlo stať súčasťou rutinného klinického vyšetrenia pacientov s artériovou hypertenziou v záujme spresnenia odhadu individuálneho kardiovaskulárneho rizika.
Záver
Prítomnosť predklinických ochorení kardiovaskulárneho systému predstavuje predstupeň v rozvoji manifestných kardiovaskulárnych ochorení a je preto vždy prognosticky negatívnym nálezom. Štandardné skórovacie systémy kardiovaskulárneho rizika založené len na hodnotení rizikových faktorov bez zohľadnenia prítomnosti a počtu predklinických ochorení môžu byť limitované v odhade individuálneho kardiovaskulárneho rizika jednotlivca. V našej práci sme potvrdili nielen vzťah medzi tuhosťou aorty reprezentovanou zvýšením rýchlosti pulzovej vlny v aorte (PWVao) a s rizikovými faktormi (SCORE), ale aj vzťah PWVao s počtom predklinických kardiovaskulárnych ochorení. Považujeme preto vyšetrovanie tuhosti aorty za prínosný integrujúci ukazovateľ kardiovaskulárneho rizika.
Táto práca vznikla v rámci plnenia úlohy grantu VEGA MŠ SR č. 1/1151/11.
MUDr. Mária Potočárová
maria.potocarova@gmail.com
I. interná klinika LF UK a UN, Bratislava
www.unb.sk
Doručeno do redakce: 5. 2. 2014
Zdroje
1. 2013 ESH/ESC guidelines for the management of arterial hypertension. The Task Force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). Eur Heart J 2013; 34(28): 2159–2219.
2. Leoncini G, Ratto E, Viazzi F et al. Increased ambulatory arterial stiffness index is associated with target organ damage in primary hypertension. Hypertension 2006; 48(3): 397–403.
3. Go AS, Bauman MA, Coleman King SM et al. An effective approach to high blood pressure control: a science advisory from the American Heart Association, the American College of Cardiology, and the Centers for Disease Control and prevention. Hypertension 2014; 63(4):878–85.
4. Kannel WB. Risk stratification in hypertension: new insights from the Framingham Study. Am J Hypertens 2000; 13(1 Pt 2): 3S-10S.
5. Thomas G Assessment of global risk: A foundation for a new, better definition of hypertension. J Clin Hypertens 2006; 8(Suppl 2): 5–14.
6. Kaplan NM. Arterial hypertension. In: Anderson DM et al.Mosby's medical, nursing, and allied health dictionary.6th ed. Mosby: St. Louis (USA) 2002. ISBN 9780323014304.
7. Basile J. Management of Global Risk Across the Continuum of hypertensive Heart disease. J Clin Hypertens (Greenwich) 2006; 8(Suppl 2): 21–30.
8. Dzau V, Braunwald E. Resolved and unresolved issues in the prevention and treatment of coronary artery disease: A workshop consensus statement. Am Heart J 1991; 121(4 Pt 1): 1244–1263.
9. Glasser SP, Krasikov T, Devereux RB et al. Sublinical, hemodynamic, and echocardiographic abnormalities of high pulse pressure in hypertensiove and non-hypertensive adults. Am J Cardiol 2012; 2(4): 309–317.
10. Devereux RB, Alderman MH. Role of preclinical cardiovascular disease in the evolution from risk factor exposure to development of morbid events. Circulation 1993; 88(4 Pt 1): 1444–1455.
11. Volpe M, Battistoni A, Tocci G et al. Cardiovascular risk assessment beyond Systemic Coronary Risk Estimation: a role for organ damage markers. J Hypertens 2012; 30(6): 1056–1064.
12. Practice Guidelines For Primary Care Physicians: 2003 ESH/ ESC Hypertension Guidelines. J Hypertens 2003; 21(10): 1779–1786.
13. Mancia G, De Backer G, Dominiczak A et al. 2007 Guidelines for the Management of Arterial Hypertension: The Task Force of European Society of Cardiology (ESC) and European Society of Hypertension. Eur Heart J 2007; 28(12):1462–1536.
14. Perk J., De Backer G., Gohlke H. et al. European Guidelines on cardiovascular disease prevention in clinical practice (version 2012). The Fifth Joint Task Force of The European Society of Cardiology and other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of nine societies and by invited experts). European Heart J 2012; 33(13): 1635–1701.
15. Goff jr. DC, Lloyd-Jones DM, Bennett G et al. 2013 ACC/AHA Guidelines on the Assessment of Cardiovascular Risk: A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation 2013. Dostupné z DOI: <http://doi:10.1161/01.cir.0000437741.48606.98>.
16. Mitchell GF, Chao-Yu Guo, Benjamin E et al. Cross-Sectional Correlates of Increased Aortic Stiffness in the Community. The Framingham Heart Study. Circulation 2007; 115(20): 2628–2636.
17. Sakuragi S, Abhayaratna WP. Arterial stiffness: Methods of measurement, physiologic determinants and prediction of cardiovascular outcomes. Int J Cardiol 2010; 138(2): 112–118.
18. Palatini P, Casiglia E, Gasowski J et al. Arterial stiffness, central hemodynamics, and cardiovascular risk in hypertension. Vasc Health Risk Manag 2011; 7 : 725–739.
19. Simon A, Mijiti W, Gariepy J et al. Current possibilities for detecting high risk of cardiovascular disease. Int J Cardiol 2006; 110(2): 146–152.
20. Miklos I. A new and fast screening method for measuring complex hemodynamical parameters and arterial stiffness non-invasively with a simple arm cuff. Am J Hypertens 2005; 18(5 Pt 2): 15A.
21. Boutouyrie P, Revera M, Parati G. Obtaining arterial stiffness indices from simple arm cuff measurements: the holy grail? J Hypertens 2009; 27(11): 2159–2161.
22. Baulmann J, Schillings U, Rickert S et al. A new oscillometric method for assessment of arterial stiffness: comparison with tonometric and piezoelectronic methods. J Hypertens 2008; 26(3): 523–528.
23. Jatoi NA, Mahmud A, Bennett K et al. Assessment of arterial stiffness in hypertension: comparison of oscillometric (Arteriograph), piezoelectronic (Complior) and tonometric (SphygmoCor) techniques. J Hypertens 2009; 27(11): 2186–2191.
24. Levey AS, Stevens LA, Schmid CH et al. A new equation to estimate glomerular filtration rate. Ann Intern Med 2009; 150(9): 604–612. Erratum in: Ann Intern Med 2011; 155(6): 408.
25. Devereux RB, Alonso RD, Lutas EM et al. Echocardiographic assessment of left ventricular hypertrophy: comparison to necropsy finding. Am J Cardiol 1986; 57(6): 450–458.
26. Kritz H, Schmid P, Karanikas G et al. Detection of Early Atherosclerotic Lesions in the Carotid Artery: Experimental and Preliminary Human Data. Int J Angiol 1997; 6 : 24–29.
27. Wilkinson IB, McEniery CM, Cockroft JR. Central blood pressure estimation for the massess moves a step closer. J Hum Hypertens 2010; 24(8): 495–497.
28. Perk J, De Backer G, Gohlke H et al. European Guidelines on cardiovascular disease prevention in clinical practice (version 2012). The Fifth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of nine societies and by invited experts). Eur Heart J 2012; 33(17): 1635–1701.
29. Špác J, Souček M, Řiháček I et al. Rychlost aortální pulzové vlny u nemocných s metabolickým syndromem a hypertenzí léčených sartany. Vnitř Lék 2010; 56(8): 880–883.
30. Cao JJ, Arnold AM, Manolio TA et al. Association of Carotid Artery Intima-Media Thickness, Plaques, and C-reactive Protein with Future Cardiovascular Disease and All-Cause Mortality. The Cardiovascular Health Study. Circulation 2007; 116(1): 32–38.
31. Verdecchia P, Carini G, Circo A et al. Left ventricular mass in essential hypertension: the MAVI Study. J Am Coll Cardiol 2001; 38(7): 1829–1835.
32. Olsen MH, Sehestedt T, Lyngbaek S et al. Urine albumin/creatinine ratio, high sensitivity C-reactive protein and N-terminal pro brain natriuretic peptide – three new cardiovascular risk markers – do they improve risk prediction and influence treatment? Current Vasc Pharmacol 2010; 8(1): 134–139.
33. Leoncini G, Sacchi G, Ravera M et al. Microalbuminuria is an integrated marker of subclinical organ damage in primary hypertension. J Hum Hypertens 2002; 16(6): 399–404.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Pečeň pri srdcovom zlyhávaníČlánek Mitrální stenózaČlánek Vliv zkušenosti na výsledky katetrové implantace aortální chlopně v léčbě významné aortální stenózyČlánek Pravá komora pri ťažkej pľúcnej hypertenzii pri vrodených chybách srdca – odlišná a špecifickáČlánek Kombinační léčba hypertenze
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2014 Číslo 4- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Intermitentní hladovění v prevenci a léčbě chorob
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Prof. MUDr. Petr Widimský, DrSc., FESC, FACC šedesátiletý
- Vývoj klinického zájmu o plicní hypertenzi v České republice
- 30 let programu transplantace srdce v Institutu klinické a experimentální medicíny v Praze
- Medikamentózní léčba plicní arteriální hypertenze v roce 2014
- Neobvyklá intervence na nativní tepně u pacienta po aortokoronárním bypassu
- Optická koherentní tomografie, oddálená implantace stentu a přímá perkutánní koronární intervence u nemocných s infarktem myokardu a elevací ST segmentu
- Pečeň pri srdcovom zlyhávaní
- Mitrální stenóza
- Léčba srdečního selhání u diabetiků
- Vliv zkušenosti na výsledky katetrové implantace aortální chlopně v léčbě významné aortální stenózy
- Plně vstřebatelný lékový koronární stent: kde jsme v roce 2014?
- Význam stanovení galektinu 3 jako ukazatele myokardiální fibrózy v klinické kardiologii
- Místo chirurgické revaskularizace v léčbě akutního infarktu myokardu
- Operace Ebsteinovy anomálie v dospělém věku – naše zkušenosti
- Predklinické kardiovaskulárne ochorenia a tuhosť aorty
- Acute heart failure and cardiogenic shock – trends at the beginning of 21st century
- Může léčba hypertenze ovlivnit výskyt demence?
- Pravá komora pri ťažkej pľúcnej hypertenzii pri vrodených chybách srdca – odlišná a špecifická
- Srovnání amerických a evropských (českých) doporučení pro diagnostiku a léčbu chronického srdečního selhání
- Význam vulnerabilních aterosklerotických plátů a možnosti jejich detekce pomocí intravaskulární spektroskopie
- Katetrizační renální denervace v léčbě rezistentní hypertenze: realita nebo fikce?
- Praktické otázky léčby novými antitrombotiky
- Kombinační léčba hypertenze
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Pečeň pri srdcovom zlyhávaní
- Pravá komora pri ťažkej pľúcnej hypertenzii pri vrodených chybách srdca – odlišná a špecifická
- Operace Ebsteinovy anomálie v dospělém věku – naše zkušenosti
- Mitrální stenóza
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



