-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Terapie inzulinem glargin v režimu bazál/bolus v klinické praxi: observační neintervenční multicentrický projekt LINDA (Lantus in daily practice – safety and efficacy in basal bolus regimen)
Basal insulin glargine using a basal-bolus regimen in a common clinical practice: observational, non-interventional, multicenter, national project LINDA (Lantus in daily practice – safety and efficacy in basal bolus regimen)
Objective:
To evaluate the safety and efficacy of basal insulin glargine using a basal-bolus regimen in a common clinical practice setting in the Czech Republic.Patients and methods:
The LINDA project was a non-interventional, multicenter (n = 255), national, observational project. A total of 4,998 patients with Type 1 and 2 diabetes mellitus (T1DM, T2DM) with predominantly insulin therapy (99,7 %), after switch on insulin glargine at basal-bolus regimen, were enrolled in this project. The patients were followed up for 6 months after initiation of the therapy with insulin glargine. The primary objective of the project was to investigate the incidence of severe hypoglycemic episodes during the treatment with basal insulin analogue glargine (Lantus®) in a common clinical practice setting. The secondary endpoints were changes in glycosylated hemoglobin (HbA1c) levels, fasting plasma glucose (FPG), body weight, insulin dose, change of number of hypoglycemic episodes in comparison the previous therapy and the frequency of adverse effects.Results:
Severe hypoglycaemia were observed during treatment with insulin glargine at 0.8 % patients. When comparing the incidence of hypoglycemia with the previous therapy, we demonstrated a clinically and statistically significant reduction in their frequencies. The percentage of patients with hypoglycemic episodes (17.6 %), severe hypoglycemia (0.8 %) and severe nocturnal hypoglycemia (0.3 %) over the last month of treatment with insulin glargine using the basal-bolus regimen was consistently lower compared to the last month of treatment before initiation of this therapy (42.5 %, 17.6 %, and 13.8 % of the patients, respectively). In patients with T1DM, the incidence of hypoglycemia decreased from 37.80 ± 15.95 episodes/patient/year to 8.76 ± 4.38 episodes/patient/year (p < 0.001) for all hypoglycemic episodes; from 5.64 ± 3.27 episodes/patient/year to 0.0396 ± 0.012 episodes/patient/year (p < 0.001) for severe hypoglycemia; and from 3.84 ± 2.04 episodes/patient/year to 0.0096 ± 0.003 episodes/patient/year (p < 0.001) for severe nocturnal hypoglycemia. In patients with T2DM, the incidence of hypoglycemia decreased from 12.48 ± 7.57 episodes/patient/year to 1.68 ± 0.78 episodes/patient/year (p < 0.001) for all hypoglycemic episodes; from 2.04 ± 0.94 episodes/patient/year to 0.0132 ± 0.005 episodes/patient/year (p < 0.001) for severe hypoglycemia; and from 1.32 ± 0.77 episodes/patient/year to 0.0048 ± 0.0008 episodes/patient/year (p < 0.001) for severe nocturnal hypoglycemia. A statistically significant improvement in the metabolic control was demonstrated when using insulin glargine. The glycated hemoglobin (HbA1c) decreased from 7.74 ± 1.71 % to 6.43 ± 1.39 % (∆ -1.31 ± 0.32 %, p < 0.001) in patients with T1DM, and from 8.13 ± 1.56 % to 6.72 ± 1.40 % (∆ -1.41 ± 0.28 %, p < 0.001) in patients with T2DM. A statistically significant (p < 0.001) increase in the number of patients with HbA1c < 5.4 % was further demonstrated. The decrease in fasting blood glucose (FBG) and 6-point blood sugar profile was also statistically significant in both types of diabetes (p < 0.001). Changes in therapy and subsequent treatment with insulin glargine were perceived positively by both physicians and patients.Conclusion:
In the common clinical practice setting, the initiation of treatment with insulin glargine using the basal-bolus regime in patients with previous insulin therapy resulted in a reduction in the incidence of hypoglycemic events, including severe hypoglycemia and severe nocturnal hypoglycemia, and improved metabolic control in patients with diabetes (reduced glycated hemoglobin, fasting glucose values and 6-point blood glucose profile). Greater satisfaction with the current treatment was reported by both patients and physicians.Key words:
basal-bolus regimen – diabetes mellitus – insulin glargine – observational project
Autoři: Denisa Janíčková Žďárská 1; Jan Brož 1; Bohumila Křivská 2; Zdeněk Rušavý 3; Milan Kvapil 1
Působiště autorů: Interní klinika 2. LF UK a FN Motol Praha, přednosta prof. MUDr. Milan Kvapil, CSc., MBA 1; Sanofi-Aventis, s. r. o., Praha 2; I. interní klinika LF UK a FN Plzeň, přednosta prof. MUDr. Martin Matějovič, Ph. D. 3
Vyšlo v časopise: Vnitř Lék 2014; 60(9): 712-719
Kategorie: 60. narozeniny prof. MUDr. Jana Škrhy, DrSc., MBA
Souhrn
Cíl práce:
Zhodnotit bezpečnost a účinnost léčby bazálním inzulinem glargin v režimu bazál/bolus v podmínkách běžné klinické praxe v České republice.Soubor a metodika:
Projekt LINDA byl neintervenční, multicentrický (n = 255), národní observační projekt, který probíhal v podmínkách běžné klinické praxe. Do sledování bylo zařazeno celkem 4 998 pacientů s diabetes mellitus 1. a 2. typu (DM1T, DM2T) s převážně inzulinovou terapií (99,7 %), po následném zahájení léčby inzulinem glargin v režimu bazál/bolus. Pacienti byli sledováni po dobu 6 měsíců od zahájení této terapie. Primárním cílem projektu bylo sledování četnosti výskytu závažných hypoglykemických příhod při léčbě bazálním inzulinovým analogem glargin (Lantus®) v podmínkách běžné klinické praxe. Sekundárními sledovanými parametry byla změna glykovaného hemoglobinu (HbA1c), glykemie nalačno (FPG), změna tělesné hmotnosti, změna dávek inzulinu, změna počtu hypoglykemických příhod ve srovnání s předchozí léčbou a sledování četnosti nežádoucích účinků.Výsledky:
Závažné hypoglykemie byly pozorovány během léčby inzulinem glargin u 0,8 % pacientů. Při srovnání výskytu hypoglykemií s předchozí terapií bylo prokázáno klinicky a statisticky významné snížení jejich četnosti. Procento pacientů s hypoglykemickou příhodou (17,6 %), závažnou (0,8 %) a závažnou noční hypoglykemií (0,3 %) bylo za poslední měsíc léčby s inzulinem glargin v režimu bazál/bolus konzistentně menší ve srovnání s posledním měsícem léčby před zahájením této terapie (42,5 %; 17,6 %; 13,8 % pacientů). U pacientů s DM1T došlo k poklesu všech hypoglykemií z hodnoty 37,80 ± 15,95 příhod/pacient/rok na 8,76 ± 4,38 příhod/pacient/rok (p < 0,001), závažných hypoglykemií z hodnoty 5,64 ± 3,27 příhod/pacient/rok na 0,0396 ± 0,012 příhod/pacient/rok (p < 0,001) a závažných nočních hypoglykemií z hodnoty 3,84 ± 2,04 příhod/pacient/rok na 0,0096 ± 0,003 příhod/pacient/rok (p < 0,001). U pacientů s DM2T poklesla četnost všech hypoglykemií z hodnoty 12,48 ± 7,57 příhod/pacient/rok na 1,68 ± 0,78 příhod/pacient/rok (p < 0,001), závažných hypoglykemií z hodnoty 2,04 ± 0,94 příhod/pacient/rok na 0,0132 ± 0,005 příhod/pacient/rok (p < 0,001) a závažných nočních hypoglykemií z hodnoty 1,32 ± 0,77 příhod/pacient/rok na 0,0048 ± 0,0008 příhod/pacient/rok (p < 0,001). Bylo prokázáno statisticky významné zlepšení metabolické kompenzace při užití inzulinu glargin. U DM1T došlo ke snížení hladiny glykovaného hemoglobinu (HbA1c) z hodnoty 7,74 ± 1,71 % na 6,43 ± 1,39 % (∆ -1,31 ± 0,32 %; p < 0,001) a u DM2T z hodnoty 8,13 ± 1,56 % na 6,72 ± 1,40 % (∆ -1,41 ± 0,28 %; p < 0,001). Statisticky významně (p < 0,001) se zvýšil počet pacientů s hodnotami HbA1c < 5,4 %. Statisticky významný byl také pokles glykemie nalačno (FBG) a hodnot 6bodového glykemického profilu, a to u obou typů diabetu (p < 0,001). Změna terapie a následná léčba inzulinem glargin byla lékaři a pacienty vnímána pozitivně.Závěr:
Za podmínek běžné klinické praxe zahájení léčby inzulinem glargin v režimu bazál/bolus u pacientů s předchozí inzulinovou terapií vedlo ke snížení četnosti výskytu hypoglykemických příhod včetně závažných a závažných nočních hypoglykemií a ke zlepšení metabolické kompenzace pacientů s diabetem (snížení glykovaného hemoglobinu, glykemie nalačno a hodnot 6bodového glykemického profilu). Byla zaznamenána větší spokojenost se stávající léčbou ze strany pacientů a lékařů.Klíčová slova:
diabetes mellitus – inzulin glargin - observační projekt – režim bazál/bolusÚvod
Inzulin glargin je dlouhodobě účinkující analog inzulinu s bezvrcholovým průběhem efektu a nízkou intraindividuální variabilitou. Podle metaanalýz je u pacientů s diabetes mellitus 1. typu (DM1T) převod z NPH inzulinu (neutral protamine Hagedorn insuline) na dlouhodobě účinkující analoga následován mírným zlepšením kompenzace a snížením rizika hypoglykemie [1,2]. Obdobné výsledky přinášejí studie realizované u pacientů s diabetes mellitus 2. typu (DM2T) [1–7].
Výhody inzulinu glargin vyniknou v kombinacích s krátkodobě účinnými analogy, v nichž vzájemná kombinace umožní přiblížit se principům fyziologické inzulinové produkce. Plného využití pak lze dosáhnout za podmínek titrace obou inzulinů. Studie AT.LANTUS přinesla důkaz o významu aktivní spolupráce pacienta s DM2T při léčbě inzulinem [8]. Prokázala, že pokud je pacient podrobně edukován a je-li mu dána možnost upravovat si dávku bazálního inzulinu (inzulin glargin) podle aktuální glykemie nalačno, může dosáhnout i lepší kompenzace diabetu bez zvýšení rizika závažných hypoglykemií než při úpravě dávky vedené lékařem.
Studie ORIGIN stanovila dlouhodobý kardiovaskulární bezpečnostní profil inzulinu glargin [9,10]. Léčba inzulinem glargin vedená k cílové glykemii nalačno v časných stadiích diabetu nevedla k navýšení makroangiopatických komplikací či případů rakoviny, a to vše s minimálním nárůstem hmotnosti. Další analýzy studie ORIGIN prokázaly benefit z časné inzulinové léčby u nemocných s HbA1c ≥ 6,4 % (46,4 mmol/mol) ve smyslu snížení rizika mikrovaskulárních komplikací [11]. Zda časná inzulinoterapie povede ke snížení kardiovaskulárního rizika, musíme vyčkat výsledků follow-up studie ORIGIN (ORIGINALE).
Ze všech výše uvedených důvodů se jeví inzulin glargin jako vhodný inzulin pro většinu pacientů s DM1 a DM2T.
Soubor a metody
Projekt LINDA byl neintervenční, multicentrický, národní observační projekt, na kterém spolupracovalo 255 diabetologů z celého území České republiky.
Hlavním cílem práce bylo sledování četnosti výskytu závažných hypoglykemických příhod při léčbě bazálním inzulinovým analogem glargin (Lantus®) v podmínkách běžné klinické praxe v České republice u pacientů s DM1T a DM2T léčených v režimu bazál/bolus. Hlavní sekundární cíle zahrnovaly srovnání výskytu hypoglykemických příhod za období 4 týdnů před zahájením léčby inzulinem glargin s obdobím 4 týdnů před kontrolou při léčbě inzulinem glargin, sledování změn parametrů kompenzace diabetu (HbA1c, glykemie nalačno, glykemický profil, hmotnost, dávky inzulinů) a sledování nežádoucích účinků během léčby.
Délka sledování byla stanovena na 6 měsíců od zahájení terapie inzulinem glargin. Lékaři zaznamenávali údaje při zařazení pacientů do projektu a dále v nejbližším termínu po 6 měsících od zahájení léčby inzulinem glargin. Údaje byly získány retrospektivně výpisem dat ze zdravotní dokumentace pacienta a následujícím prospektivním sledováním. Hodnocení spokojenosti s léčbou inzulinem glargin lékařem bylo hodnoceno pomocí 6stupňové škály jako „mnohem lepší, lepší, stejné, horší, mnohem horší a nelze hodnotit“ z hlediska bezpečnosti a účinnosti na konci sledování. Spokojenost pacientů s léčbou byla zaznamenána lékařem na základě rozhovoru s pacientem a k jejímu hodnocení byla použita stejná 6stupňová škála. Shromažďovány byly pouze výsledky vyšetření prováděných v rámci standardních terapeutických postupů. Každý pacient před zahájením sběru dat podepsal informovaný souhlas.
Hypoglykemická příhoda byla definována jako událost s charakteristickými příznaky hypoglykemie, které ustoupily po jídle nebo po perorálním podání cukru, a byla potvrzena měřením glykemie < 3 mmol/l, nebo jako asymptomatická hypoglykemie potvrzená měřením glykemie < 3 mmol/l. Jako závažná hypoglykemická příhoda byla definována událost s charakteristickými příznaky hypoglykemie, jejíž zvládnutí vyžadovalo asistenci jiné osoby, a byla spojena s hladinou glykemie < 3 mmol/l nebo s ústupem příznaků po perorálním příjmu jídla nebo nitrožilní aplikaci glukózy nebo po aplikaci glukagonu. Jako noční závažná hypoglykemie byla definována závažná hypoglykemická událost, která se vyskytla v čase spánku pacienta od večerního ulehnutí k rannímu vstávání a splňovala kritéria závažné hypoglykemické příhody.
Ke statistickému vyhodnocení byl použit program NCSS 2004. Výsledky jsou prezentovány jako průměrné hodnoty ± směrodatná odchylka.
Projekt byl v souladu s Českou legislativou ohlášen před svým zahájením Státnímu ústavu pro kontrolu léčiv (SÚKL).
Výsledky
Do projektu bylo zařazeno celkem 4 998 pacientů s diabetem, u kterých byla zahájena léčba inzulinem glargin v režimu bazál/bolus. Ve 40,3 % se jednalo o pacienty s DM1T a v 59,7 % o pacienty s DM2T.
Výskyt hypoglykemických příhod a účinnost byly hodnoceny u skupiny 4 819 pacientů, kteří splnili kritéria pro zařazení do projektu a kteří byli sledováni po dobu 6 měsíců. Výskyt nežádoucích účinků byl hodnocen u všech pacientů zařazených do projektu.
Základní údaje o hodnoceném souboru shrnuje tab. 1. Průměrná doba trvání diabetu byla při zahájení léčby inzulinem glargin u pacientů s DM1T 14,72 ± 10,90 roku a u pacientů s DM2T 12,57 ± 6,64 roku (p < 0,001). Při vstupu do projektu byly u pacientů s DM1T zaznamenány nižší průměrné hodnoty HbA1c a glykemie nalačno než u pacientů s DM2T (p < 0,001). Mikrovaskulární komplikace udávalo 54,08 % pacientů s DM1T a 66,63 % pacientů s DM2T, makrovaskulární komplikace pak 14,06 % pacientů s DM1T a 37,7 % pacientů s DM2T. V obou případech byl rozdíl ve výskytu komplikací diabetu statisticky významný (p < 0,001).
Tab. 1. Základní charakteristiky hodnocených pacientů před zahájením aplikace inzulinu glargin 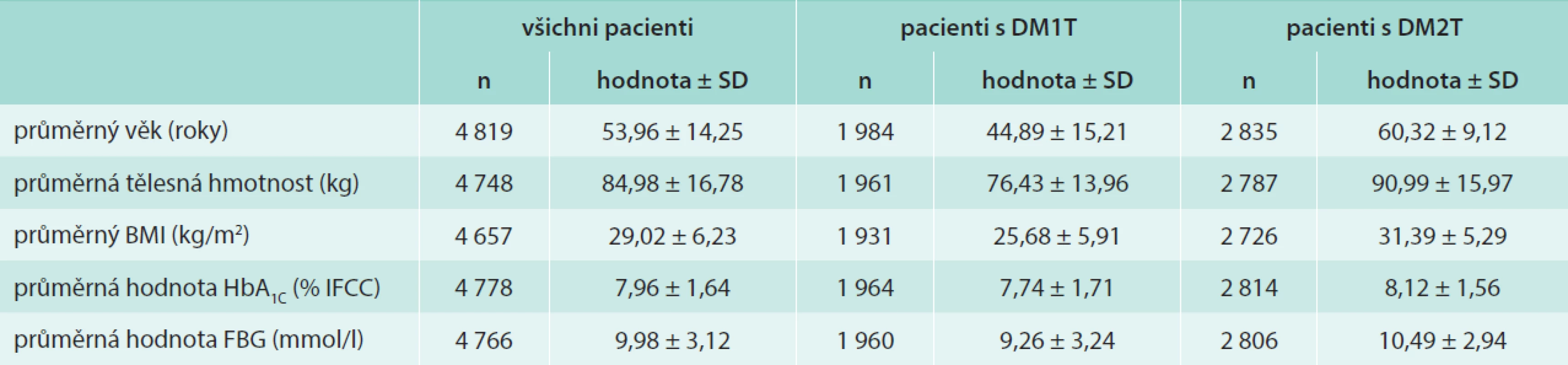
Před zahájením léčby inzulinem glargin bylo již 99,65 % pacientů léčeno inzulinem (n = 4 802), a to obvykle v intenzifikovaném inzulinovém režimu (n = 4 395, tj. 91,2 %). Bazální inzulin byl v 60,9 % pacientům aplikován 1krát denně a ve 36 % aplikován 2krát denně. V 87,23 % byl pacientům aplikován střednědobě působící inzulin typu NPH a ve 4,81 % inzulinový analog detemir. Jako prandiální inzulin byl aplikován 3 143 pacientům (tj. 65,22 %) humánní inzulin (RHI) a 1 525 pacientům (tj. 31,65 %) krátkodobě působící inzulinová analoga. Premixovaným inzulinem bylo léčeno 5,62 % pacientů.
Průměrná dávka inzulinu glargin byla při zahájení terapie u pacientů s DM1T 19,24 ± 7,84 U a u pacientů s DM2T 23,37 ± 9,58 U. Rozdíl průměrných dávek mezi jednotlivými typy diabetu byl statisticky významný (p < 0,001).
U 97,82 % pacientů (n = 4 714) byla zahájena aplikace inzulinu glargin 1krát denně, u 2,18 % pacientů 2krát denně.
Hypoglykemie
Během 6měsíčního sledování při terapii inzulinem glargin v režimu bazál/bolus se závažné hypoglykemie vyskytly celkem u 0,81 % pacientů (1,31 % pacientů s DM1T a 0,46 % pacientů s DM2T).
Při porovnání s jejich výskytem při předchozí terapii a při léčbě s inzulinem glargin došlo ke klinicky i statisticky významnému snížení jejich četnosti, a to jak při vyjádření v počtu příhod na pacienta a rok léčby, tak i při vyjádření v počtu osob (%) se zaznamenanou hypoglykemickou příhodou.
Při předchozí léčbě zaznamenalo v posledních 4 týdnech terapie hypoglykemickou příhodu 42,5 % pacientů; závažnou hypoglykemii 17,4 % pacientů a závažnou noční hypoglykemii 13,8 % pacientů. V posledních 4 týdnech terapie inzulinem glargin zaznamenalo hypoglykemii 17,6 % pacientů; závažnou hypoglykemii 0,8 % pacientů a závažnou noční hypoglykemii jen 0,3 % pacientů.
Během léčby došlo k výraznému snížení četnosti všech hypoglykemických příhod, a to o 79,77 %. Výskyt všech hypoglykemií v přepočtu na pacienta/rok se snížil u pacientů s DM1T z 37,80 ± 15,95 příhody/pacient/rok na 8,76 ± 4,38 příhody/pacient/rok (p < 0,001) a u pacientů s DM2T z 12,48 ± 7,57 příhody/pacient/rok na 1,68 ± 0,78 příhody/pacient/rok (p < 0,001).
U pacientů s DM1T došlo ke snížení závažných hypoglykemií z 5,64 ± 3,27 příhody/pacient/rok na 0,0396 ± 0,012 příhody/pacient/rok (p < 0,001) a u pacientů s DM2T z 2,04 ± 0,94 příhody/pacient/rok na 0,0132 ± 0,005 příhody/pacient/rok (p < 0,001). U závažných nočních hypoglykemií došlo ke snížení jejich výskytu u pacientů s DM1T z 3,84 ± 2,04 příhody/pacient/rok na 0,0096 ± 0,003 příhody/pacient/rok (p < 0,001) a u pacientů s DM2T z 1,32 ± 0,77 příhody/pacient/rok na 0,0048 ± 0,0008 příhody/pacient/rok (p < 0,001). Výskyt hypoglykemií v přepočtu na pacienta/rok je uveden v tab. 2.
Tab. 2. Incidence závažných hypoglykemií celkem a závažných nočních hypoglykemií před a po zahájení terapie inzulenem glargin vyjádřená na pacienta/rok 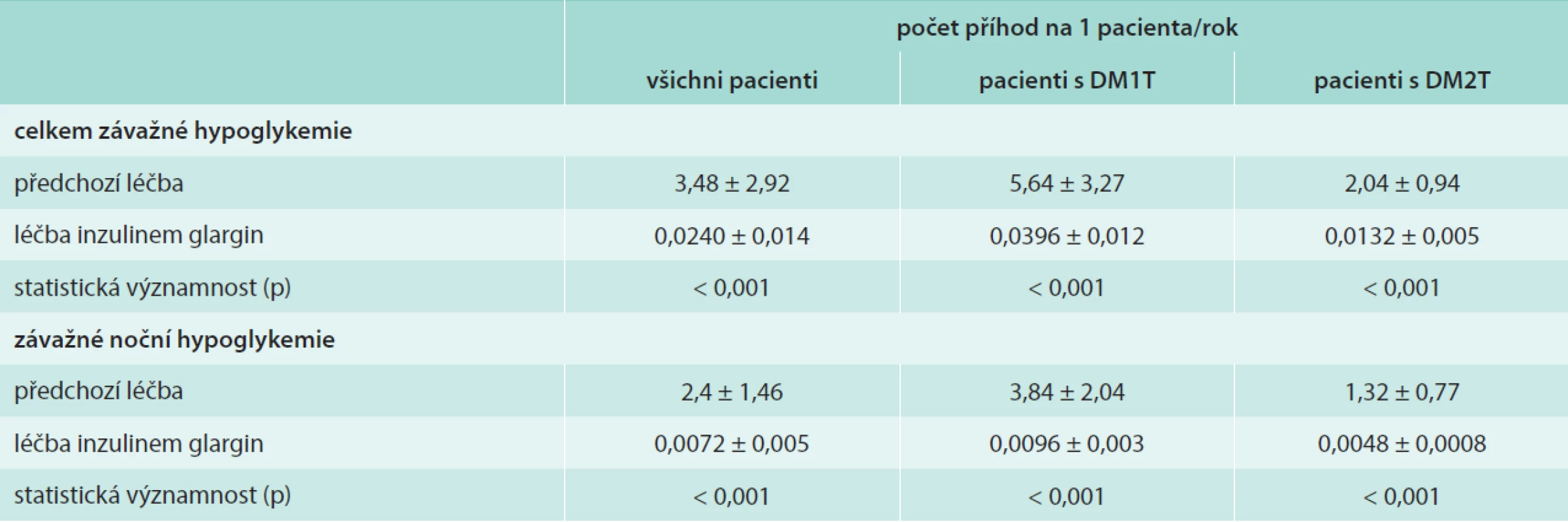
Metabolická kompenzace
Po 6měsíční terapii inzulinem glargin v režimu bazál/bolus došlo k výraznému poklesu HbA1c. U DM1T se snížil HbA1c z 7,74 ± 1,71 % na 6,43 ± 1,39 % (∆ -1,31 ± 0,32 %; p < 0,001) a u pacientů s DM2T poklesl HbA1c z 8,13 ± 1,56 % na 6,72 ± 1,40 (∆ -1,41 ± 0,28 %; p < 0,001). Změny HbA1c znázorňuje graf 1.
Graf 1. Změny průměrných hodnot HbA<sub>1c</sub> před zahájením a po 6 měsících aplikace inzulinu glargin 
Statisticky významně (p < 0,001) se zvýšil na konci sledování počet pacientů, kteří dosáhli doporučených cílových hodnot HbA1c pro kompenzaci diabetu dle ADA/EASD, tzn. HbA1c < 5,4 %. Hodnoty HbA1c < 5,4 % dosahovalo při zařazení do projektu pouze 6,73 % pacientů s DM1T a 2,13 % pacientů s DM2T. Po změně terapie cílové hodnoty HbA1c < 5,4 % dosáhlo 25,67 % pacientů s DM1T a 17,31 % pacientů s DM2T.
Statisticky významný byl i pokles glykemie nalačno (FBG – fasting blood glucose). U pacientů s DM1T došlo k poklesu FBG o 2,34 ± 2,51 mmol/l na hodnotu 6,83 ± 2,11 mmol/l (p < 0,001) a u pacientů s DM2T o 2,81 ± 3,12 mmol/l na hodnotu 7,68 ± 2,14 mmol/l (p < 0,001). Změny FPG jsou uvedeny v tab. 3.
Tab. 3. Průměrné hodnoty glykemie nalačno před zahájením aplikace inzulinu glargin a po 6 měsících jeho aplikace v mol/l 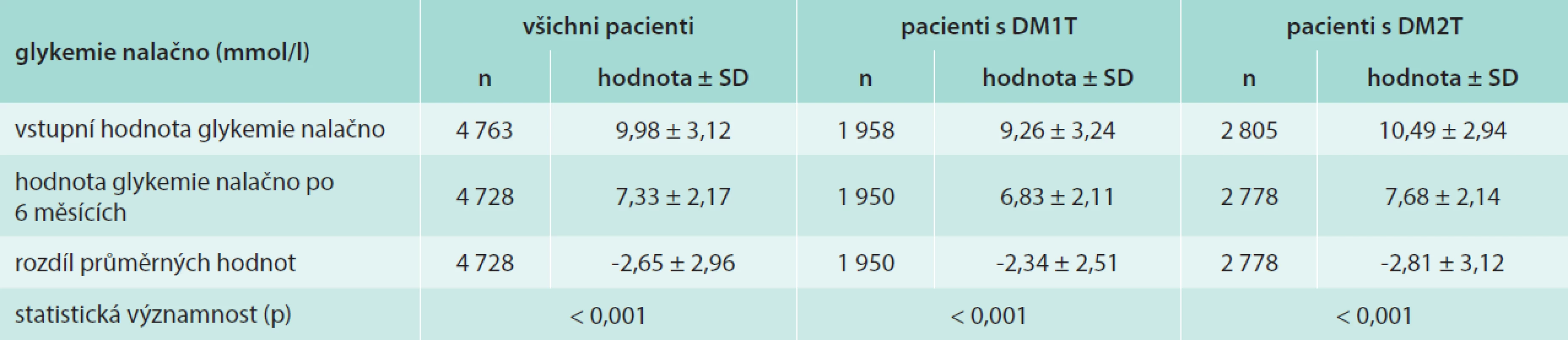
K výraznému poklesu došlo nejen u glykemie nalačno (p < 0,001), ale i u všech hodnot 6bodového glykemického profilu (graf 2 a 3). Tyto poklesy byly statisticky významné u obou typů diabetu (p < 0,001).
Graf 2. Průměrné hodnoty glykemie před a po jídle během dne před zahájením aplikace inzulinu glargin a po 6 měsících jeho aplikace v mmol/l - 6bodový glykemický profil pacientů s DM1T 
Graf 3. Průměrné hodnoty glykemie před a po jídle během dne před zahájením aplikace inzulinu glargin a po 6 měsících jeho aplikace v mmol/l – 6bodový glykemický profil pacientů s DM2T 
Tělesná hmotnost a BMI
Údaje o tělesné hmotnosti pacientů před zahájením aplikace inzulinu glargin byly dostupné pro 98,5 % hodnocených pacientů. U pacientů s DM1T došlo během 6 měsíců k mírnému zvýšení průměrné hmotnosti o 0,12 kg a u pacientů s DM2T byl zaznamenán průměrný pokles hmotnosti o 0,41 kg. Uvedené změny byly statisticky významné (p < 0,001) jak u pacientů s DM1T, tak u pacientů s DM2T.
Změny hmotnosti nevedly ke statisticky významné změně BMI během sledování.
Dávka inzulinu
Celková denní dávka inzulinu se během 6měsíčního sledování u pacientů s DM1T zvýšila ze 49,96 ± 17,21 IU na 52,06 ± 14,91 IU (p < 0,001). U pacientů s DM2T se celková denní dávka inzulinu naopak snížila z 62,36 ± 23,32 IU na 61,52 ± 18,01 IU (p < 0,001). Během sledování se mírně zvýšil podíl bazálního inzulinu v celkové denní dávce inzulinu ze 40,5 % na 42,0 %. Zároveň se zvýšil počet pacientů, kterým byl na konci sledování aplikován prandiální inzulinový analog (59,4 %) a poklesl počet pacientů s humánním prandiálním inzulinem (40,6 %).
Průměrná dávka bazálního analoga glargin byla na konci sledování u pacientů s DM1T 21,01 ± 8,41 U (zvýšení průměrné dávky inzulinu glargin během sledování o 1,77 U) a u pacientů s DM2T 26,45 ± 10,37 U (zvýšení průměrné dávky inzulinu glargin během sledování o 3,08 U). Vývoj dávek aplikovaných inzulinů během sledování je uvádí graf 4.
Graf 4. Změna dávek inzulinu během sledování u DM1T a DM2T 
Nežádoucí účinky
Během 6měsíčního sledování byly u pacientů zaznamenány 3 nežádoucí účinky. Jeden účinek byl hodnocen jako závažný. Jednalo se o závažnou hypoglykemickou příhodu u pacienta s DM1T, která vznikla pravděpodobně v důsledku porušení dietních návyků. Zbylé 2 účinky byly hodnoceny jako nezávažné a očekávané (mírná alergická reakce a váhový přírůstek).
Hodnocení léčby
Změna terapie a následná léčba inzulinem glargin byla lékaři a pacienty vnímána pozitivně. Lékaři označili léčbu inzulinu glargin z hlediska bezpečnosti jako mnohem lepší a lepší u 92,93 % pacientů a z hlediska účinnosti pak jako mnohem lepší a lepší u 94,94 % pacientů ve srovnání s předchozí léčbou. 96,05 % pacientů označilo svoji spokojenost s léčbou inzulinem glargin jako mnohem lepší a lepší.
Diskuse
Neintervenční observační projekt LINDA přináší výsledky, které dokumentují účinnost a bezpečnostní profil inzulinu glargin. Data byla získána sledováním téměř 5 000 nemocných za podmínek běžné klinické praxe, což činí projekt dosud nejrozsáhlejším svého druhu.
U pacientů s předchozí inzulinovou terapií převážně inzulinem NPH v režimu bazál/bolus (91,2 %) po změně bazálního inzulinu na bazální analog glargin došlo k významnému zlepšení metabolické kompenzace současně s významným snížením výskytu hypoglykemických příhod oproti předchozímu období, a to u obou typů diabetu. K výraznému snížení výskytu došlo jak u všech hypoglykemií (o 77 %), tak i u závažných a závažných nočních hypoglykemií. Hypoglykemie jistě představují největší překážku k dosažení uspokojivé metabolické kompenzace diabetu. Výsledky našeho sledování jsou v souladu s výsledky klinických studií, které prokazují snížení rizika hypoglykemických příhod s inzulinem glargin při srovnání s NPH inzulinem, a to především v nočních hodinách [1–4], i s výsledky observačních projektů realizovaných s inzulinem glargin [12,13]. Výše uvedené potvrzuje výhody bezvrcholového působení inzulinu glargin, protože u tohoto inzulinu můžeme titrovat dávku. Během léčby inzulinem glargin došlo k poklesu FBG a současně celého 6bodového glykemického profilu pacientů. Toto pozorování dokumentuje princip teorie tzv. fix fasting first/treat to target, podle něhož klesají vyšší hodnoty glykemií během dne, neboť jsou jen relativním navýšením v důsledku ranní hyperglykemie [14]. Statisticky významný pokles hodnot HbA1c u DM1T (-1,31%) i u DM2T (-1,41%) je v souladu s řadou publikovaných klinických studií, v nichž byl inzulin glargin srovnáván s NPH inzulinem [12,15–20]. Procento nemocných, kteří dosáhli cílového HbA1c < 5,4 % – DM1T (25,67 %) a DM2T (17,31 %) – je v porovnání s ostatními studiemi spíše nižší [20], což může být důsledkem nízkých konečných dávek inzulinu. U DM1T došlo k navýšení glarginu pouze o 1,77 U, u DM2T o 3,08 U, přičemž celková denní dávka u DM1T mírně stoupla (současně také více nemocných s HbA1c < 5,4 % než u DM2T), u DM2T celková denní dávka inzulinu dokonce klesla. Pro porovnání uveďme průměrné dávky inzulinu glargin v klinických studiích: DM2T 41–68 U [14,21–23], DM1T 29,6 u ve studii ATLANTUS [24].
Plného využití potenciálu dlouhodobě účinných analog, a to zejména v terapii DM1T, lze dosáhnout v kombinaci s analogy krátkodobě účinnými. U většiny pacientů by měla být celková denní dávka inzulinu rozdělena přibližně v poměru 1 : 1 mezi bolusový a bazální inzulin, což odpovídá fyziologické sekreci inzulinu (50 % bazální sekrece, 50 % sekrece postprandiální). Vysoké dávky prandiálního inzulinu (s cílem snížit preprandiální glykemie) mohou vést k rozkolísanosti a nestabilitě glykemických profilů. Naopak nízké dávky dlouhodobého inzulinového analoga nemohou zajistit dosažení požadovaných glykemií nalačno. V projektu LINDA se podařilo navýšit poměr bazálního inzulinu ze 40,5 % na 42,0 % a také více pacientů bylo na konci sledování léčeno krátkodobými inzulinovými analogy (59,4 % pacientů). Tento vývoj je v souladu s výše uvedenými principy.
Při zlepšení metabolické kompenzace bychom očekávali vzestup tělesné hmotnosti. Během sledování v projektu LINDA došlo k mírnému, nicméně statisticky významnému snížení hmotnosti v celém souboru pacientů (-0,22 kg). Pokles hmotnosti byl nejvíce vyjádřen u pacientů s DM2T (-0,41 kg), u pacientů s DM1T došlo k mírnému nárůstu hmotnosti (+0,12 kg). Změny hmotnosti se v průřezu klinickými studiemi různí: nacházíme výsledky hmotnostně neutrální [20,25], pozitivní [22,23] i negativní [26,27]. Během 6letého sledování ve studii ORIGIN přibrali pacienti v aktivní větvi (terapie inzulinem glargin) 1,6 kg (na rozdíl od standardní větvě, v níž nemocní zredukovali svoji hmotnost 0,5 kg) [28]. Léčba inzulinem glargin byla pozitivně vnímána jak lékaři, tak pacienty. Tento výsledek je v souladu s výsledky klinických studií, v nichž byl inzulin glargin srovnáván s NPH inzulinem [17,29] či s léčbou jinými léčebnými režimy [30]. Tento moment je zásadní pro akceptování terapeutických cílů a léčebných režimů pacientem a zajištění dlouhodobé kompliance pacientů s lékařem. Souhrnně lze léčbu inzulinem glargin v režimu bazál/bolus v tomto projektu hodnotit jako efektivní terapii. Celkově nízký výskyt nežádoucích účinků je v souladu s výsledky z obdobných observačních projektů z klinické praxe [31,32].
Závěr
Minimální výskyt nežádoucích účinků a prokazatelně nižší zatížení nemocných rizikem hypoglykemie při současném zlepšení HbA1c včetně minimálního ovlivnění tělesné hmotnosti, které byly zjištěny v observačním projektu LINDA, potvrzují, že inzulin glargin je v běžné klinické praxi efektivním inzulinem pro náhradu bazální sekrece inzulinu u nemocných s DM1T i DM2T.
Projekt byl sponzorován společností Sanofi-Aventis, s.r.o. Česká republika.
Prohlášení o střetu zájmů
D. Janíčková Žďárská obdržela honorář za přednáškovou činnost od společnosti Sanofi-Aventis, Johnson a Johnson, MSD. J. Brož obdržel honorář za přednáškovou činnost od společnosti Sanofi-Aventis. B. Křivská je zaměstnancem společnosti Sanofi-Aventis. Z. Rušavý obdržel honorář za konzultační a přednáškovou činnost od společností Sanofi-Aventis, Novartis, NovoNordisk, Eli Lilly, Astra Zeneca, Johnson a Johnson, Jansen Cilag, MSD, Merk. M. Kvapil obdržel honorář za konzultační a přednáškovou činnost od společností NovoNordisk, Sanofi-Aventis, Novartis, Eli Lilly, Astra Zeneca, ZAT, Johnson a Johnson, Takeda, Jansen Cilag, MSD, Merck.
MUDr. Denisa Janíčková Žďárská
denisa.janickova.zdarska@email.cz
Interní klinika 2. LF UK a FN Motol, Praha
www.fnmotol.cz
Doručeno do redakce 25. 6. 2014
Přijato po recenzi 17. 7. 2014
Zdroje
1. Monami M, Marchionni N, Mannucci E. Long-acting insulin analogues vs. NPH human insulin type 1 diabetes. A meta-analysis. Diabetes Obes Metab 2009; 11(4): 372–378.
2. Singh SR, Ahmad F, Lal A et al. Efficacy and safety of insulin analogues for the management of diabetes mellitus: a meta analysis. CMAJ 2009; 180(4): 385–395.
3. Bazzano LA, Lee LJ, Shi L et al. Safety and efficacy of glargine compared with NPH insulin for the treatment of Type 2 diabetes: a meta-analysis of randomized controlled trials. Diabet Med 2008; 25(8): 924–932.
4. Monami M, Marchionni N, Mannucci E. Long-acting insulin analogues versus NPH human insulin in type 2 diabetes: a meta-analysis. Diabetes Res Clin Pract 2008; 81(2): 184–189.
5. Sharplin P, Gordon J, Peters JR et al. Improved glycaemic control by switching from insulin NPH to insulin glargine: a retrospective observational study. Cardiovasc Diabetol 2009; 8 : 3. Dostupné z DOI: <http://doi: 10.1186/1475–2840–8-3>.
6. Yki-Järvinen H, Dressler A, Zieman M Less nocturnal hypoglycemia and better post-dinner glucose control with bedtime insulin glargine compared with bedtime NPH insulin combination therapy in type 2 diabetes. HOE 901/3002 Study Group. Diabetes Care 2000; 23(8): 1130–1136.
7. Zdarska DJ, Kvapil M, Rusavy Z et al. Comparison of glucose variability assessed by a continuous glucose-monitoring system in patients with type 2 diabetes mellitus switched from NPH insulin to insulin glargine: The COBIN2 study. Wien Klin Wochenschr 2014; 126(7–8): 228–237.
8. Davies M, Lavalle-Gonza F, Stormset F et al. Initiation of insulin glargine therapy in type 2 diabetes subjects suboptimally controlled on oral antidiabetic agents: results from the AT.LANTUS trial. Diabetes Obes Metab 2008; 10(5): 387–399.
9. Hanefeld M, Bramlage P. Insulin use early in the course of type 2 diabetes mellitus: the ORIGIN trial. Curr Diab Rep 2013; 13(3): 342–349.
10. Rusavý Z, Lacigová S, Kvapil M. What has the largest study in the history of diabetology brought us? Vnitř Lék 2013; 59(3): 160–164.
11. Gilbert RE, Mann JF, Hanefeld M et al (The ORIGIN trial investigators). Basal insulin glargine and microvascular outcomes in dysglycaemic individuals: results of the Outcome Reduction with an Initial Glargine Intervention (ORIGIN) trial. Diabetologia 2014; 57(7): 1325–1331.
12. Siegmund T, Weber S, Blankenfeld H et al. Comparison of insulin glargine versus NPH insulin in people with Type 2 diabetes mellitus under outpatient-clinic conditions for 18 months using a basal-bolus regimen with a rapid-acting insulin analogue as mealtime insulin. Exp Clin Endocrinol Diabetes 2007; 115(6): 349–353.
13. Maia FF, Melo FJ, Araujo IM et al. Switching of NPH insulin to glargine therapy in a cohort of poorly controlled diabetic patients: observational study. Arq Bras Endocrinol Metab 2007; 51(3): 426–430.
14. Riddle MC, Rosenstock J, Gerich J. The treat-to-target trial: randomized addition of glargine or human NPH insulin to oral therapy of type 2 diabetic patients. Diabetes Care 2003; 26(11): 3080–3086.
15. Porcellati F, Rossetti P, Pampanelli S et al. Better long-term glycemic control with the basal insulin glargine as compared with NPH in patients with type 1 diabetes mellitus given meal-time lispro insulin. Diabet Med 2004; 21 : 1213–1220.
16. Fulcher GR, Gilbert RE, Yue DK. Glargine is superior to neutral protamine Hagedorn for improving glycated haemoglobin and fasting blood glucose levels during intensive insulin therapy. Intern Med J 2005; 35(9): 536–542.
17. Chatterjee S, Jarvis-Kay J, Rengarajan T et al. Glargine versus NPH insulin: efficacy in comparison with insulin aspart in a basal bolus regimen in type 1 diabetes-the glargine and aspart study (GLASS) a randomized cross-over study. Diabetes Res Clin Pract 2007; 77(2): 215–222.
18. Pieber TS, Eugenie-Jolchine I, Derobert E Efficacy and Safety of HOE 901 Versus NPH insulin in Patients With Type1 Diabetes. Diabetes Care 2000; 23(2): 157–162.
19. Rossetti P, Pampanelli S, Fanelli C et al. Intensive replacement of basal insulin in patients with type 1 diabetes given rapid-acting insulin analog at mealtime: a 3-month comparison between administration of NPH insulin four times daily and Glargine insulin at dinner or bedtime. Diabetes Care 2003; 26(5): 1490–1496.
20. Sharplin P, Gordon J, Peters JR et al. Improved glycaemic control by switching from insulin NPH to insulin glargine: a retrospective observational study. Cardiovasc Diabetol 2009; 8 : 3. Dostupné z DOI: <http://doi: 10.1186/1475–2840–8-3>.
21. Yki-Järvinen H, Kauppinen-Makelin R, Tiikkainen M et al. Insulin glargine or NPH combined with metformin in type 2 diabetes: the LANMET study. Diabetologia 2006; 49(3): 442–451.
22. Davies M, Evans R, Storms F et al. Initiation of insulin glargine in suboptimally controlled patients with type 2 diabetes: sub-analysis of the AT.LANTUS trial comparing treatment outcomes in subjects from primary and secondary care in the UK. Diabetes Obes Metab 2007; 9(5): 706–713.
23. Yki-Järvinen H, Juurinen L, Alvarsson M et al. Initiate Insulin by Aggressive Titration and Education (INITIATE): a randomized study to compare initiation of insulin combination therapy in type 2 diabetic patients individually and in groups. Diabetes Care 2007; 30(6): 1364–1369.
24. Gomis R, Storms F, Conget I et al (AT.LANTUS Study Group). Improving metabolic control in sub-optimally controlled subjects with Type 1 diabetes: comparison of two treatment algorithms using insulin glargine. Diabetes Res Clin Pract 2007; 77(1): 84–91.
25. Schreiber S, Landgraf W, Bohler S. Efficacy and tolerability of insulin glargine in ICT. Diabetes, Stoffwechsel und Herz 2009; 18(8): 91–98.
26. Raskin P, Klaff L, Bergenstal R et al. A 16-week comparison of the novel insulin analog insulin glargine (HOE 901) and NPH human insulin used with insulin lispro in patients with type 1 diabetes. Diabetes Care 2000; 23(11): 1666–1671.
27. Rosenstock J, Schwarz SL, Clark JR CH et al. Basal insulin therapy in type 2 diabetes: 28-week comparison of insulin glargine (HOE901) and NPH insulin. Diabetes Care 2001; 24(4): 631–636.
28. 28., Gerstein HC, Bosch J, Dagenais GR et al (ORIGIN Trial Investigators). Basal insulin and cardiovascular and other outcomes in dysglycemia. N Engl J Med 2012; 367(4): 319–328.
29. Witthaus E, Stewart J, Bradley C. Treatment satisfaction and psychological well-being with insulin glargine compared with NPH in patients with type 1 diabetes. Diabet Med 2001; 18(8): 619–625.
30. Bradley C, Gilbride CJB. Improving treatment satisfaction and other patient-reported outcomes in people with type 2 diabetes: the role of once-daily insulin glargine. Diabetes Obes Metab 2008; 10(Suppl 2): 50–65.
31. Schreiber SA, Ferlinz K, Haak T. The Long-Term Efficacy of Insulin Glargine Plus Oral Antidiabetic Agents in a 32-Month Observational Study of Everyday Clinical Practice. Diabetes Technol Ther 2008; 10(2): 121–127.
32. Hammer H, Klinge A. Patients with type 2 diabetes inadequately controlled on premixed insulin: effect of initiating insulin glargine plus oral antidiabetic agents on glycaemic control in daily practice. Int J Clin Pract 2007; 61(12): 2009–2018.
33. SPC inzulin Lantus. Dostupné z WWW: <http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human/000284/WC500036082.pdf>.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Kalcium, vitamin D a zdraví
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2014 Číslo 9- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Profesor Jan Škrha šedesátiletý
- Gratulace prof. MUDr. Richarda Češky, CSc., FACP, FEFIM, předsedy České internistické společnosti ČLS JEP
- Dlouhodobě působící inzulinová analoga a riziko hypoglykemických příhod
- Faktory vedoucí k poškození a destrukci B-buněk Langerhansových ostrůvků pankreatu
- Kalcium, vitamin D a zdraví
- Studie SOLOSTAR prokázala vysoký stupeň spokojenosti pacientů s používáním inzulinového pera SoloStar® v České republice
- Novinky a perspektivy v léčbě inzulinem
- Terapie inzulinem glargin v režimu bazál/bolus v klinické praxi: observační neintervenční multicentrický projekt LINDA (Lantus in daily practice – safety and efficacy in basal bolus regimen)
- AGEs a RAGE – konečné produkty pokročilé glykace a jejich receptor v otázkách a odpovědích
- Játra, ledviny a diabetes: tři tváře deficitu genu HNF1B
- Problematika diferenciálnej diagnostiky paraneoplastickej hypoglykémie
- Hypoglykemie jako limitace léčby diabetes mellitus
- Změny kostního metabolizmu u diabetiků
- Inzulinová rezistence – příčiny a možnosti ovlivnění
- Glykemická variabilita a kontinuální monitorace glykemie
- Životní prognóza osob s diabetem 1. typu dříve a dnes
- Gliptiny: bezpečná a účinná léčba diabetu
- Jak dnes indikujeme perorální antidiabetika (od metforminu ke gliptinům a gliflozinům)
- Receptor pro konečné produkty pokročilé glykace (RAGE) – klíčový hráč diabetické angiopatie?
- Diabetes mellitus a karcinom pankreatu – příčina nebo následek?
- Inkretinová mimetika v léčbě diabetu 2. typu
- Retrospektívy a perspektívy personalizovanej liečby cukrovky
- První fixní trojkombinace perindopril arginin-indapamid-amlodipin: nový přístup v kombinační léčbě hypertenze
- Tisíce nalietaných hodín okolo celého sveta nemusia byť len vizitkou biznismena, ale aj úspešného lekára, výskumníka, pedagóga, manažéra a vysokého univerzitného hodnostára v jednej osobe
- Jindřiška Perušičová. Perorální léčba diabetu 2013.
- Jan Chlumský. Plicní funkce pro klinickou praxi.
- Jiří Knor, Jiří Málek. Farmakoterapie urgentních stavů.
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Životní prognóza osob s diabetem 1. typu dříve a dnes
- Gliptiny: bezpečná a účinná léčba diabetu
- Inzulinová rezistence – příčiny a možnosti ovlivnění
- AGEs a RAGE – konečné produkty pokročilé glykace a jejich receptor v otázkách a odpovědích
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



