-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Možnosti endoskopického řešení polypoidních a nepolypoidních lézí v kolon
Possible endoscopic solutions of polypoid and non-polypoid lesions in the colon
Colorectal cancer (CRC) is one of the most frequent malignant diseases in the Czech Republic. Almost 70 % of CRC develop based on adenomatous polyps, 30 % arise de novo. The pathogenesis of development of colorectal cancer confirms an adenoma to carcinoma sequence, based on the gradually developing mutations of oncogenes and suppressor genes. By removing the adenomatous mucosal neoplasia the pathway of CRC development is cut off, which is the practical goal of the screening programme. To meet the goals of the preventive programme the gastroenterologists performing endoscopy must be appropriately trained and experienced in the detection of and procedures of removing mucosal neoplasias. Surface mucosal neoplasias are morphologically divided based on the Paris and Japanese classification into 2 basic types: protruding type I, whose height is greater than 2.5 mm above the level of the surrounding mucous membrane, and flat type II, whose height is smaller than 2.5mm. We have the following procedures available for endoscopic removing of surface mucosal lesions: loop polypectomy, endoscopic mucosal resection and endoscopic submucosal dissection. The choice of method depends on the lesion morphology. Benign mucosal lesions (adenoma, hyperplastic polyp) can only be treated endoscopically. Non-invasive malignant mucosal lesions limited to mucosa can also be treated endoscopically, invasive cancers penetrating into submucosa (malignant polyp, T1N0M0) are treated based on the definitive histological finding, and on meeting Morson’s criteria the endoscopic removal can be seen as curative. The problem of flat malignant mucosal lesions is more complex and in most cases, when cancerous cells penetrate into submucosa, endoscopic resection cannot be performed and surgical solution follows.
Key words:
EMR – ESD – polypectomy – mucosal neoplasia – colon
Autoři: Milan Dastych; Radek Kroupa
Působiště autorů: Interní gastroenterologická klinika LF MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Aleš Hep, CSc.
Vyšlo v časopise: Vnitř Lék 2015; 61(7-8): 698-702
Kategorie: Vanýskův den 2015
Souhrn
Kolorektální karcinom (KRka) je jedním z nejčastějších maligních onemocnění v České republice. Téměř 70 % KRka vzniká na podkladě adenomových polypů, 30 % vzniká de novo. V patogenezi vzniku kolorektálního karcinomu je potvrzena sekvence adenom-karcinom, na podkladě postupně vznikajících mutací onkogenů a supresorových genů. Odstraněním adenomové slizniční neoplazie je přerušena cesta vývoje KRka, což je praktickým cílem screeningového programu. K naplnění cílů preventivního programu musí být endoskopující gastroenterologové dostatečně erudováni v detekci a v technikách odstraňování slizničních neoplazií. Povrchové slizniční neoplazie jsou morfologicky rozděleny dle Pařížško-Japonské klasifikace do 2 základních typů: protrudující typ I, jejichž výška je > 2,5 mm nad úroveň okolní sliznice, a plochý typ II, jejichž výška je < 2,5 mm. K endoskopickému odstranění povrchových slizničních lézí máme k dispozici kličkovou polypektomii, endoskopickou mukózní resekci a endoskopickou submukózní disekci. Volba metody závisí na morfologii léze. Benigní slizniční léze (adenom, hyperplastický polyp) lze řešit výhradně endoskopicky. Neinvazivní maligní slizniční léze omezené na mukózu lze taktéž řešit endoskopicky, invazivní karcinomy pronikající do submukózy (maligní polyp, T1N0M0) se řeší dle definitivního histologického nálezu, a při splnění Morsonových kritérií lze endoskopické snesení považovat za kurativní. U plochých maligních slizničních lézí je situace složitější a většinou, při průniku buněk karcinomu do submukózy, nelze endoskopickou resekci provést a navazuje chirurgické řešení.
Klíčová slova:
EMR – ESD – polypektomie – slizniční neoplazie – tlusté střevoÚvod
Kolorektální karcinom (KRka) je jedním z nejčastějších maligních onemocnění v České republice, která spolu se Slovenskem a Maďarskem tvoří vedoucí trojici v jeho výskytu v zemích Evropské unie. Incidence u mužů dosáhla v roce 2010 hodnoty 95 onemocnění na 100 000 osob, u žen 62 onemocnění na 100 000 osob. Prevalence v roce 2011 dosáhla 53 000 osob. I přes rostoucí nemocnost jsou hodnoty mortality dlouhodobě na stejné úrovni: asi 40 úmrtí na 100 000 osob. Toto zjištění je odrazem dostupné kvalitní zdravotní péče. Výše uvedené skutečnosti vedly k přípravě národního programu screeningu kolorektálního karcinomu, který byl zahájen v roce 2000. Screeningový program byl iniciálně založen na guajakovém testu na okultní krvácení, který byl v případě pozitivity následován provedením koloskopie. K zásadní úpravě programu došlo v roce 2009, a to zavedením primární screeningové koloskopie a změnou guajakového testu na přesnější test imunochemický. Screening je určen pro asymptomatické jedince ve věku od 50 do 54 let, kterým je prováděn v jednoročním intervalu test na okultní krvácení. V případě pozitivity je provedena koloskopie. Od věku 55 let je možné pokračovat v 2letých intervalech v testu na okultní krvácení, nebo jako alternativu provést primární screeningovou koloskopii. Aby byl screeningový program efektivní, to znamená, aby došlo k poklesu incidence KRka, je nutné vyšetřit více než 45 % cílové populace. K tomuto účelu slouží v posledních letech osvětové aktivity a adresné zvaní pacientů k vyšetření pojišťovnami. Účast cílové populace ve screeningovém programu se postupně zvyšuje a v roce 2010 byl poprvé zaznamenán pokles incidence KRka jak u mužů, tak u žen (UZIS 2014, NOR 2010). V roce 2013 bylo v rámci preventivního programu vyšetřeno více než 25 000 osob, ve 37 % případů byl diagnostikován a následně odstraněn adenomový polyp a u 3 % osob byl diagnostikován karcinom.
Téměř 70 % KRka vzniká na podkladě adenomových polypů, 30 % vzniká de novo. V patogenezi vzniku kolorektálního karcinomu je potvrzena sekvence adenom-karcinom na podkladě postupně vznikajících mutací onkogenů a supresorových genů. Odstraněním adenomové slizniční neoplazie je přerušena cesta vývoje KRka, což je praktickým cílem screeningového programu.
K naplnění cílů preventivního programu musí být endoskopující gastroenterologové dostatečně erudováni v detekci a v technikách odstraňování slizničních neoplazií.
Morfologická a histologická klasifikace slizničních neoplazií
Povrchové slizniční neoplazie jsou morfologicky rozděleny dle Pařížsko-Japonské klasifikace do 2 základních typů: protrudující typ I, jejichž výška je > 2,5 mm nad úroveň okolní sliznice, a plochý typ II, jejichž výška je < 2,5 mm. Typ III je typ vyhloubený, v kolon málo častý. Protrudující typ I (klasický polyp) je dále dělen na typ pendulující Ip, typ polopřisedlý Isp a typ přisedlý Is. Ploché slizniční léze jsou dále rozděleny na typ vyvýšený IIa, v úrovni sliznice IIb a vkleslý IIc. Tyto slizniční léze větší než 10 mm se také označují jako LST léze (lateraly spreading tumours) a mohou být granulární nebo negranulární. Morfologická klasifikace je graficky znázorněna na obr. 1.
Obr. 1. Pařížsko-Japonská morfologická klasifikace 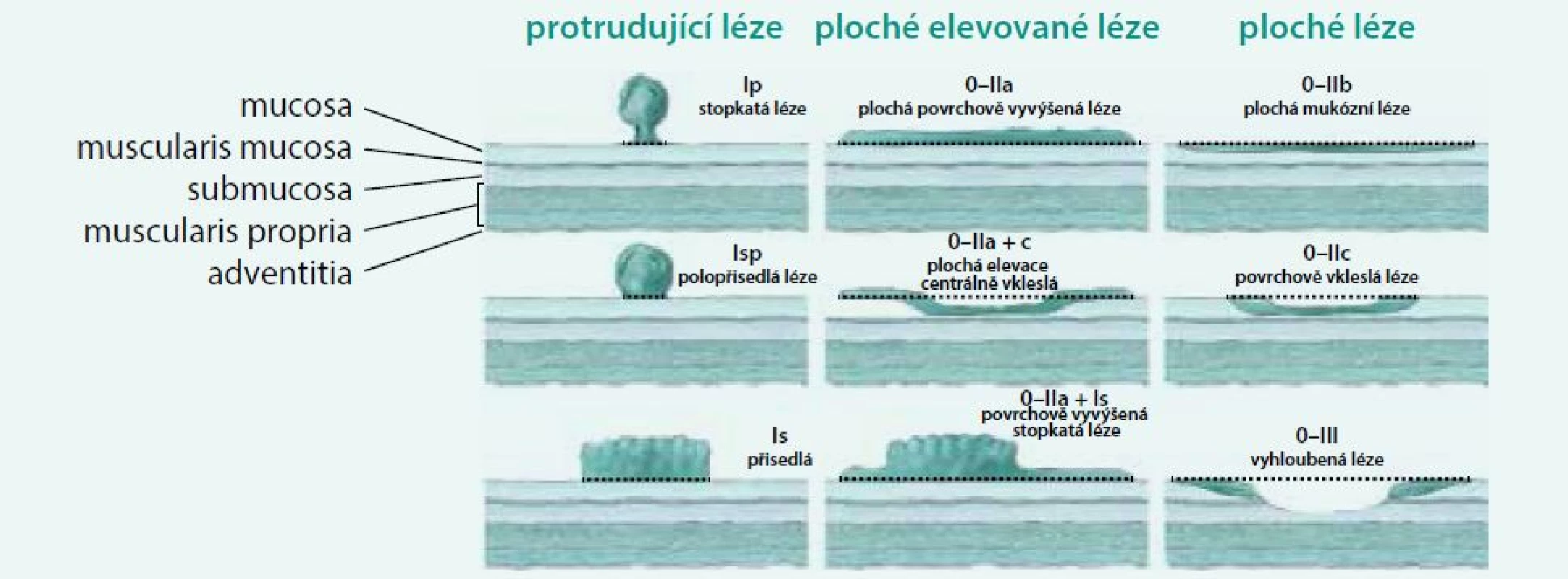
Histologická stavba povrchové slizniční léze rozhoduje o jejím biologickém chování a klinickém významu. Vzhledem k možné kancerogenezi stojí ve středu zájmu polypy adenomové a tzv. pilovité léze (hyperplastické polypy, ploché pilovité léze a pilovité adenomy – tzv. serrated adenoma). Slizniční léze této histologické stavby mají být odstraněny a jejich definitivní histologie pak určuje dispenzární interval kontrolní koloskopie. Základní histologické rozdělení povrchových slizničních lézí v tlustém střevu ukazuje tab. 1.
Tab. 1. Základní histologické rozdělení slizničních neoplazií 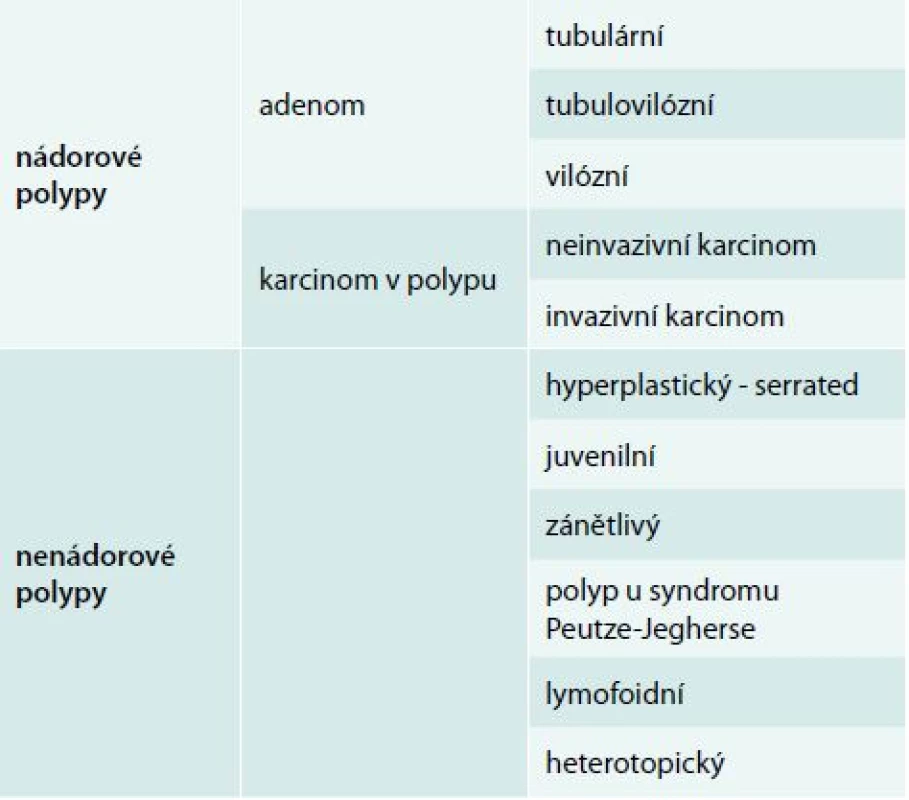
Metody endoskopické léčby kolorektálních neoplazií
K dispozici máme kličkovou polypektomii, endoskopickou mukózní resekci a endoskopickou submukózní disekci. Volba metody závisí na morfologii léze.
Kličková polypektomie (PE)
Tato metoda je použitelná pro léze typu I. Stopkaté a polopřisedlé polypy lze odstranit naložením polypektomické kličky s následným snesením pomocí koagulačního nebo smíšeného proudu generovaného elektrochirurgickou jednotkou. U přisedlých polypů, k prevenci perforace střeva a zajištění kompletního snesení léze je vhodné infiltrovat submukózu v okolí polypu např. fyziologickým roztokem za pomocí jehly. Následné snesení kličkou je pak bezpečnější (obr. 2,3).
Obr. 2. Stopkatý polyp sigmatu 20 mm, Ip 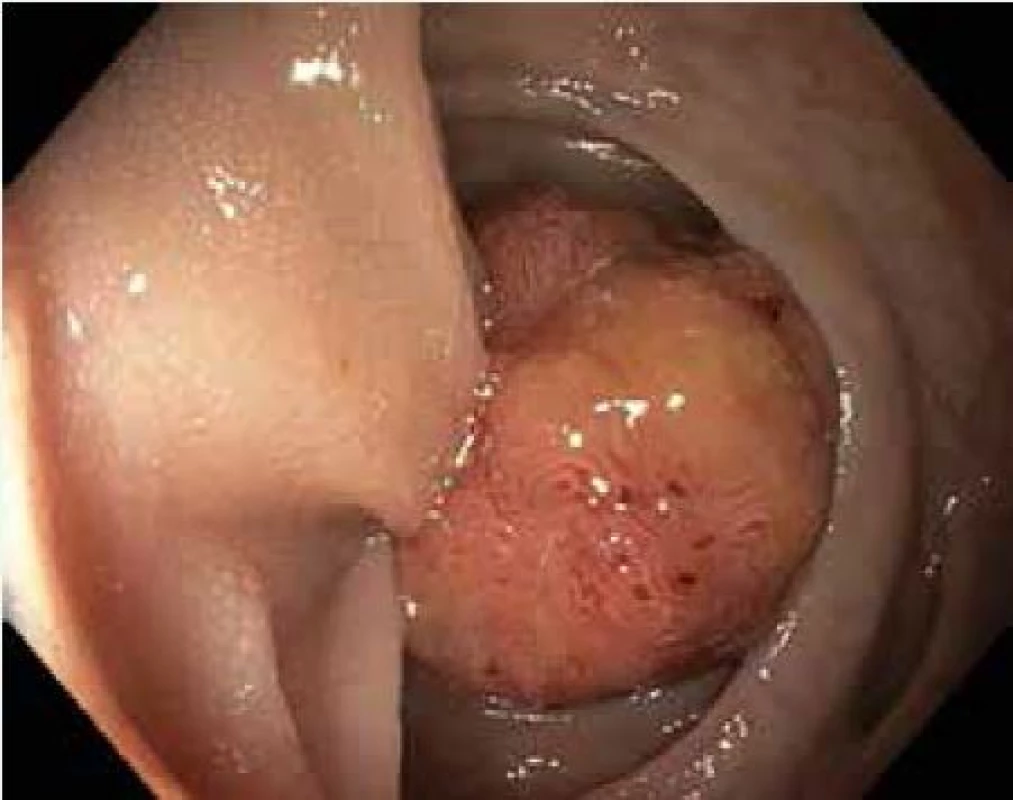
Obr. 3. Stav po snesení polypu kličkou, stopka zaškrcena smyčkou pro prevenci krvácení 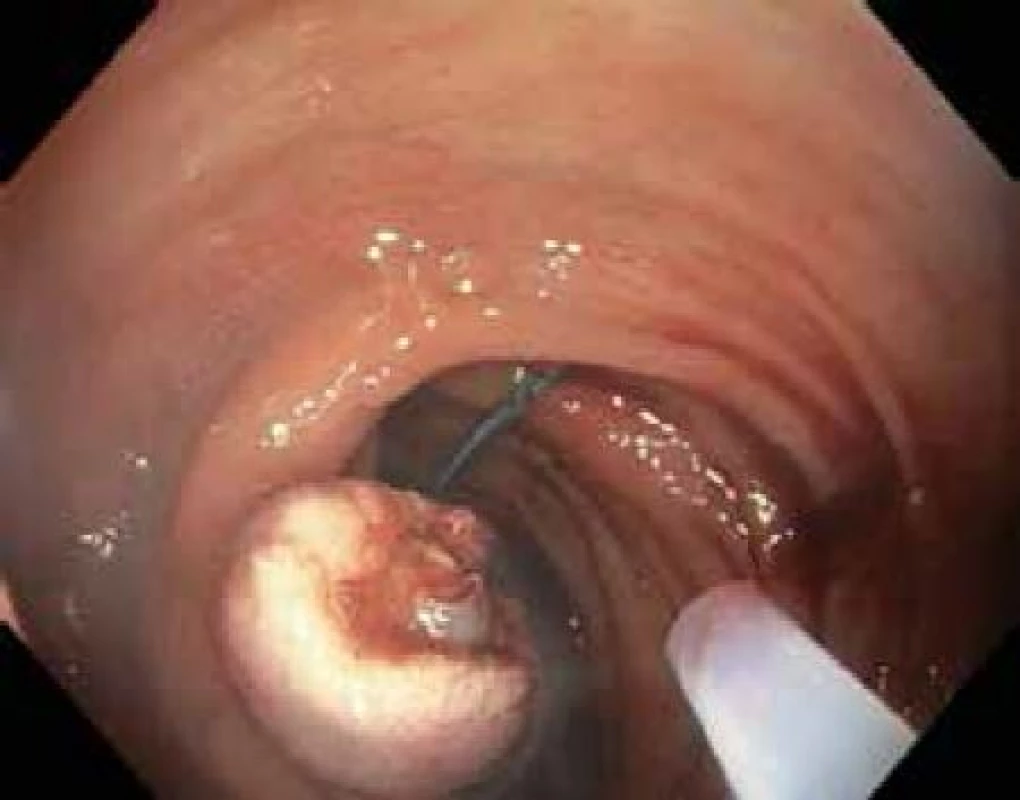
Endoskopická mukózní resekce a submukózní disekce (EMR, ESD)
Ploché slizniční léze typu II lze v kolon odstraňovat pomocí těchto 2 metod. Řez pomocí elektrického proudu je veden v submukóze pod lézí. Pokud je k řezu použita klička, hovoříme o endoskopické mukózní resekci (EMR), pokud je k řezu použit speciální nůž, mluvíme o endoskopické submukózní disekci (ESD). Slizniční léze je nejprve identifikována (důraz na kvalitní přípravu střeva!) a dle povrchové struktury a průběhu slizničních kapilár odhadnuta její histologie (hyperplastický polyp, adenomový polyp, karcinom). V případě potřeby jsou označeny její okraje špičkou kličky koagulačním proudem. Následně je pomocí jehly infiltrována submukóza v okolí léze a pod lézí. K infiltraci se používají různé roztoky krystaloidů i koloidů s příměsí barev (metylénová modř, patent blau) a vazokonstrikčních látek (adrenalin). Zásadní pro provedení EMR a ESD je po submukózní injekci zhodnocení elevace léze, tzv. lifting sign. Pokud není léze elevována, je to zřejmý průkaz infiltrace submukózy sm3 vrstvy a tuto lézi nelze řešit endoskopicky, nutná je chirurgická resekce. Následuje naložení kličky na vytvořený pseudopolyp (EMR) a po zaškrcení je sliznice s lézí snesena čistým řezacím proudem. Při ESD je nejprve proveden cirkulární řez kolem léze a následně je prováděna preparace nožem v submukóze pod lézí (obr. 4). Výhodou ESD oproti EMR je možnost snesení i velkých plochých lézí en bloc, neboť léze > 20 mm jsou často pomocí EMR snášeny po částech (piece meal) s rizikem zanechání rezidua adenomové tkáně. Nevýhodou ESD je větší procento perforačních komplikací, větší časová náročnost a nákladnější instrumentárium. V současné době je vyvinut kombinovaný nástroj – hybridní nůž, který umožňuje bez výměny instrumentária submukózní instilaci roztoku, řez i koagulaci případného krvácení. Jeho použití tak zkracuje dobu ESD. Odstraněná léze je extrahována z kolon, rekonstruována na korkové destičce a odeslána k histologickému vyšetření (obr. 5,6).
Obr. 4. Endoskopické řešení plochých slizničních lézí – EMR a ESD 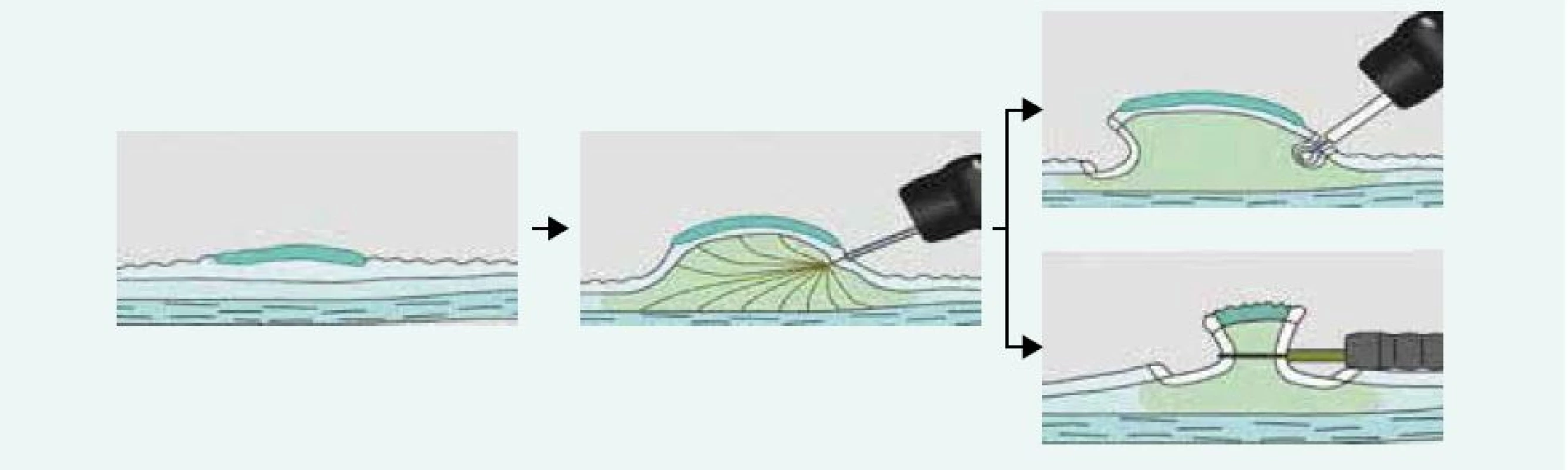
EMR – endoskopická mukózní resekce ESD – endoskopická submukózní disekce Obr. 5. Plochá granulární slizniční léze rekta 25 mm 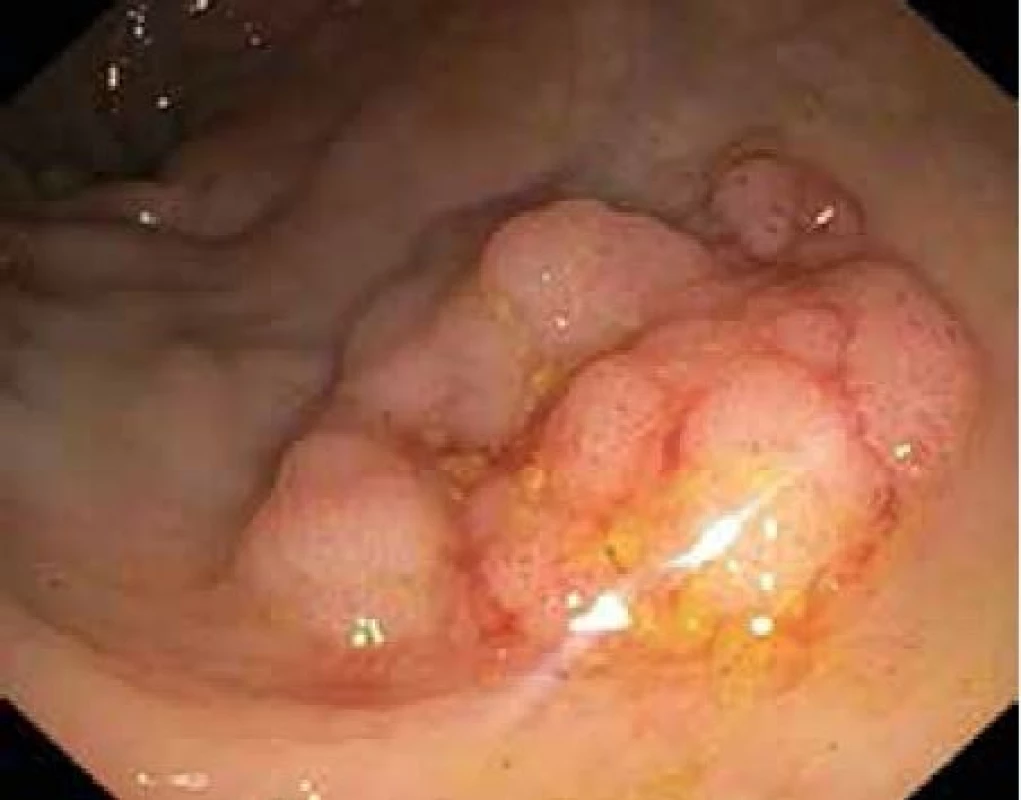
Obr. 6. Spodina po EMR ploché slizniční léze v rektu 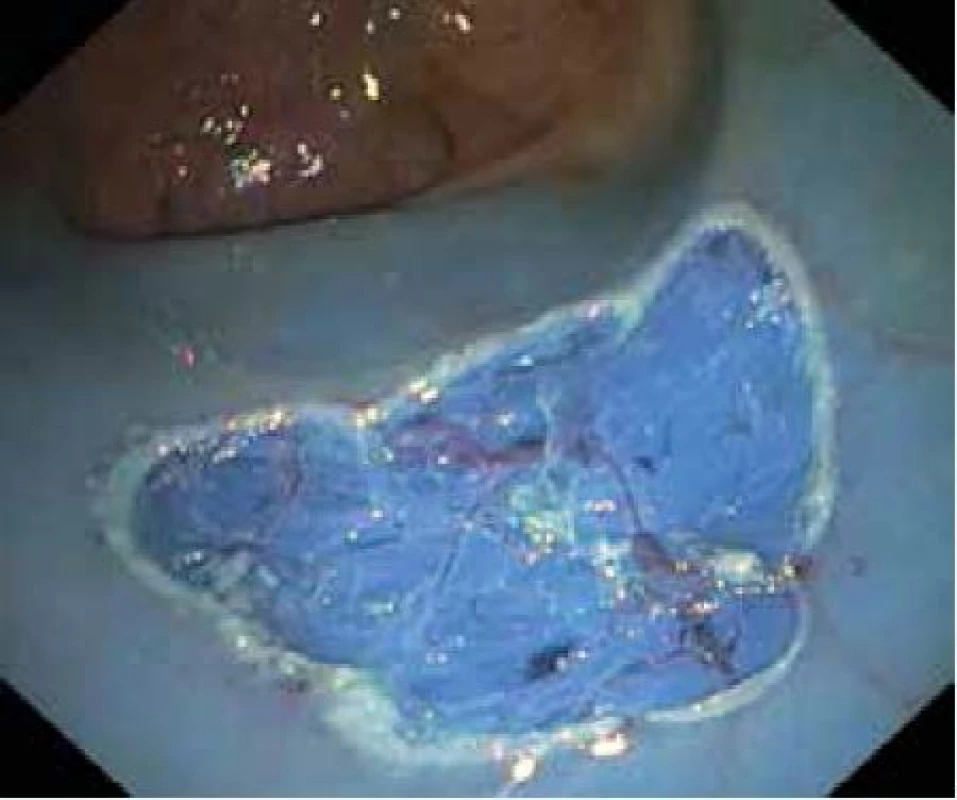
Endoskopická léčba benigních kolorektálních neoplazií
Endoskopické odstranění benigních slizničních lézí je kurativní metodou, která zabraňuje vzniku kolorektálního karcinomu. Jedná se o adenomy s low grade a high grade dysplazií, hyperplastické polypy > 10 mm. Slizniční léze uvedené histologické povahy a jakékoliv morfologie lze kompletně řešit endoskopicky.
Endoskopická léčba maligních kolorektálních neoplazií
Při splnění určitých kritérií lze kurativně endoskopicky řešit i maligní kolorektální léze. Histologicky je jako neinvazivní karcinom označována léze s maligními buněčnými rysy omezená pouze na epitelovou vrstvu sliznice (m1), dříve označován jako intraepiteliální karcinom neboli karcinom in situ. Hranice oproti high grade dysplazii bývá velmi úzká a změny v sebe plynule přecházejí. Histologicky je invazivní karcinom definován jako léze, která se invazivně šíře z m1 vrstvy mukózy přes její bazální membránu (m2 vrstva) do muscularis mucosae (m3 vrstva). Bývá označován jako intramukózní karcinom. Vzhledem k tomu, že v tlustém střevu lymfatické cévy nezasahují do slizniční vrstvy, maligní léze omezené na sliznici nemetastazují (obr. 7). Z praktického a endoskopického hlediska tedy můžeme za neinvazivní karcinom označit léze omezené na sliznici (m1, m2, m3), které nezasahují do submukózy. Tyto léze lze řešit výhradně endoskopicky a není třeba radikální chirurgický výkon. Prakticky je invazivní karcinom v adenomu léze, která proniká přes muscularis mucosae do submukózy. V tomto případě je možné metastazování do regionálních lymfatických uzlin. Podle hloubky invaze se zvyšuje pravděpodobnost jejich výskytu – sm1 (2 %), sm2 (8 %), sm3 (23 %). V literatuře bývá takovýto nález označován jako maligní polyp. U maligního stopkatého polypu je endoskopické řešení přijatelné, pokud jsou splněna tzv. Morsonova kritéria – dobrá diferenciace karcinomu, nepřítomnost vaskulární a lymfatické angioinvaze a vzdálenost 2 mm od řezu. Pokud kritéria splněna nejsou, měla by následovat chirurgická resekce. U přisedlých polypů Is (s nálezem invazivního karcinomu) je riziko metastazování větší (4,8 %), a proto by měla být chirurgická resekce provedena. U maligních plochých slizničních lézí závisí na hloubce invaze do submukózy a celkovém riziku operačního výkonu. Pokud invaze nepřesahuje sm1 vrstvu a jde o dobře diferencovaný karcinom, je endoskopické snesení přijatelné. V případě nepříznivé histologie, invaze do sm2, sm3, je chirurgické řešení nutné.
Obr. 7. TNM klasifikace a možnosti endoskopické resekce. Upraveno podle [6] ![TNM klasifikace a možnosti endoskopické resekce. Upraveno podle [6]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/f5de28c8cf35f6aa168bf71026073bc1.jpg)
Jako nejvýznamnější kritérium možnosti či nemožnosti odstranění ploché slizniční léze endoskopicky lze považovat lifting sign. Pokud lézi nelze elevovat submukózní injekcí roztoku, je nutná chirurgická resekce. Velikost slizniční léze je hledisko relativní.
Komplikace
Ke komplikacím endoskopické léčby slizničních neoplazií patří krvácení, perforace, koagulační syndrom a inkompletní snesení léze. Krvácení vzniklé při provádění výkonu je dobře ošetřitelné endoskopicky a nepočítá se mezi komplikace. Odložené krvácení vzniklé do 48 hod po výkonu provází spíše velké ploché slizniční léze a je častější u pacientů s nutností antiagregační nebo antikoagulační léčby nízkomolekulárními hepariny. V těchto případech je vhodné pacienty několik dní po výkonu observovat a ponechat na tekuté dietě. Vzácněji může vzniknout odložené krvácení do 7 dnů po výkonu. Prevencí těchto příhod je týden trvající tělesné šetření. Perforační příhoda vyžadující chirurgickou revizi připadá asi na 1 : 300 kličkových polypektomií a je nejčastější komplikací ESD v kolorektální oblasti, kde se vyskytuje v 8 % případů. I u těchto perforačních příhod může být endoskopická léčba za použití klipů efektivní. Prevencí koagulačního syndromu (koagulační nekróza střevní stěny – krytá perforace) je dostatečná elevace léze submukózní injekcí roztoku a správné použití řezací jednotky. Riziko recidivy ploché adenomové neoplazie po jejím odstranění EMR po částech (piece meal) se pohybuje v rozmezí 14–46 %. Proto je v těchto případech vhodná kontrolní koloskopie s odstupem 3–4 měsíců a doošetření zbývající léze.
Závěr
Endoskopická léčba povrchových slizničních neoplazií tlustého střeva je efektivním nástrojem v prevenci vzniku kolorektálního karcinomu. Pro správné provedení diagnostické a léčebné koloskopie je zcela zásadní dostatečná příprava střeva a erudice endoskopisty.
Podpořeno MZ ČR – RVO (FNBr, 65269705).
MUDr. Milan Dastych
dastychm@fnbrno.cz
Interní gastroenterologická klinika LF MU a FN Brno
www.fnbrno.cz
Doručeno do redakce 31. 3. 2015
Přijato po recenzi 20. 5. 2015
Zdroje
1. Kliment M, Falt P, Fojtík P et al. Endoskopická diagnostika a liečba povrchových kolorektálnych neoplázií. Endoskopie 2009; 18(4): 150–155.
2. The Paris endoscopic classification of superficial neoplastic lesions: esophagus, stomach and colon: November 30 to December 1, 2002. Gastrointest Endosc 2003; 58(Suppl 6): S3-S43.
3. Suchánek Š, Vepřeková G, Májek O et al. Epidemiologie, etiologie, screening a diagnostika kolorektálnho karcinomu, včetně diagnosticko-terapeutických zákroků na tlustém střevě. Onkologie 2011; 5(5): 261–265.
4. Národní program screeningu kolorektálního karcinomu v České republice. Zpráva o sběru dat prostřednictvím elektronického registru za rok 2013. Institut biostatistiky a analýzy MU. Informace dostupné z WWW: <http://www.iba.muni.cz>.
5. Mařatka Z et al. Gastroenterologie. Grada: Praha 1999. ISBN-10 : 80–7184–561–2.
6. Rejchrt S. Editorial. Gastrointestinal epithelial neoplasia. We can see only what we already know. Folia Gastroenterol Hepatol 2004; 2(4): 143–146.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Tumory a transplantace jater
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2015 Číslo 7-8- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Takotsubo (stresová) kardiomyopatie – co se změnilo? – editorial
- Rizikové faktory vzniku karcinomu štítné žlázy – editorial
- Takotsubo kardiomyopatie, klinické zkušenosti s onemocněním a jednoletá prognóza pacientů
- Infuzní toxicita rituximabu u nemocných s chronickou lymfocytární leukemií
- Kardiovaskulární účinky léčby GLP-1 agonisty se zaměřením na liraglutid
- Transkatétrová implantácia aortálnej chlopne – indikácie, priebeh intervencie a výsledky
- Hepatorenální syndrom – patofyziologie, diagnostika a léčba
- Rizikové faktory vzniku karcinomu štítné žlázy
-
Erektilná dysfunkcia ako prvý znak systémových cievnych chorôb a orgánovovaskulárnych artériových ischemických chorôb
Odporúčania a výzva Angiologickej sekcie Slovenskej lekárskej komory (2015) - Jan Brož et al. Léčba inzulinem
- Otakar Bleha. Endokrinolog vzpomíná
- XXXIV. dny mladých internistů České republiky a Slovenska v Olomouci
- Prof. MUDr. Josef Erben, DrSc., zomrel
- Nedožitých 88 rokov profesora Miroslava Mikuleckého
- Profesor Jaroslav Blahoš pětaosmdesátiletý
- Aktuální trendy v léčbě chronických onemocnění – program
- Novinky v léčbě akutního nevarikózního krvácení do horní části gastrointestinálního traktu
- Domácí nutriční péče v České republice
- Vitamin D – stará látka s novými perspektivami
- Možnosti endoskopického řešení polypoidních a nepolypoidních lézí v kolon
- Obyčejná nemoc – apendicitida
- Platí „LDL-hypotéza“ i pro pacienty s diabetem?
- Snížení krevního tlaku – léčbou dalších rizikových faktorů
- Jak na dyslipidemii u pacientů s metabolickým syndromem
- Transplantace ledviny při inkompatibilitě krevní skupiny – úvodní zkušenosti programu
- Transplantace pankreatu: současný stav a výhledy do budoucna
- Tumory a transplantace jater
- Transplantace solidních orgánů v České republice
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Obyčejná nemoc – apendicitida
- Transkatétrová implantácia aortálnej chlopne – indikácie, priebeh intervencie a výsledky
- Hepatorenální syndrom – patofyziologie, diagnostika a léčba
-
Erektilná dysfunkcia ako prvý znak systémových cievnych chorôb a orgánovovaskulárnych artériových ischemických chorôb
Odporúčania a výzva Angiologickej sekcie Slovenskej lekárskej komory (2015)
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



