-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Inhibitory protonové pumpy a jejich účinek na kosti
Proton pump inhibitors and their effect on the bone
Introduction:
The proton pump inhibitors are commonly used drugs for the treatment of the digestive disorders. Many patients require long-term maintenance therapy. The prolonged acid inhibition is considered to be safe, but recently, the attention has been paid to the possible effects on the bone metabolism and the higher incidence of the fractures in patients using the PPIs.
The aim of this work is to give a complex overview on the topic and analyse the source of information about the increased risk of the fractures.Results:
Several epidemiological studies describe the incidence of the fractures in the patients with PPIs. Further articles, mainly describing the effect of the bisphosphonate therapy for the osteoporosis, also track the PPI effects. The studies dealing with the articles on densitometry targeting on the effect of the PPIs on the bone metabolism are rare.Conclusion:
It is not possible to unequivocally determinate the risks of the long term PPI therapy on bone based on the existing studies due to the heterogenous populations, multimorbidity of the patients and the concurrent medication. Untill now, no study has evaluated the incidence of the risk events based on the indication of the long-term therapy. Routine monitoring of the bone parameters during the PPI therapy is not recommended. The safety of the long-term PPI therapy should be based on the clear indication of the prescription.Key words:
bisphosphonates – bone – calcium – fracture – proton pump inhibitors – osteoporosis
Autoři: Markéta Ječmenová; Radek Kroupa
Působiště autorů: Interní gastroenterologická klinika LF MU a FN Brno
Vyšlo v časopise: Vnitř Lék 2016; 62(2): 139-146
Kategorie: Přehledné referáty
Souhrn
Úvod:
Inhibitory protonové pumpy (PPI) jsou léky často užívané pro široké spektrum onemocnění horního trávicího traktu. U mnoha pacientů je léčba potřebná chronicky. Ačkoli je dlouhodobé podávání považováno za bezpečné, je v posledních letech věnována široká pozornost možnému zvýšenému výskytu fraktur u uživatelů inhibitorů protonové pumpy, což se promítá i do informací poskytovaných v příbalové dokumentaci léčiv.
Cílem práce je poskytnutí přehledu o aktuálních poznatcích v této oblasti a analýza podkladů, na jejichž základě je informace o zvýšeném riziku založena.Výsledky:
Základní informace o zvýšeném riziku fraktur u osob užívajících inhibitory protonové pumpy pochází z retrospektivních epidemiologických studií. Dalším zdrojem jsou studie, u nichž byl jako vedlejší cíl sledován vliv inhibitorů protonové pumpy na efekt léčby osteoporózy pomocí bisfosfonátů. Přímá pozorování efektu inhibitorů protonové pumpy na vstřebávání vápníku a vlivu na kosti při hodnocení denzitometrií jsou ojedinělá.Závěr:
Jednoznačné určení rizika ovlivnění kostí dle dosavadních pozorování není možné, zvláště při významné polymorbiditě a polypragmazii řady uživatelů inhibitorů protonové pumpy. Žádná práce dosud nehodnotila výskyt rizikových událostí v závislosti na indikaci pro dlouhodobou léčbu. Rutinní sledování kostních parametrů při léčbě PPI není doporučeno. Základem bezpečnosti je správná indikace a omezení nadbytečné preskripce léků.Klíčová slova:
bisfosfonáty – fraktury – inhibitory protonové pumpy – kalcium – osteoporózaÚvod
Indikace
Inhibitory protonové pumpy (proton-pump inhibitors – PPI) jsou nejčastěji používanými léky v terapii acidopeptických onemocnění. Vykazují lepší a rychlejší působení než blokátory H2 receptorů (H2-receptor antagonist – H2RA) a při jejich širokém rozšíření i přijatelnou cenu [1].
Jednotlivé preparáty byly do klinické praxe postupně uváděny od 80. let 20. století. V České republice jsou dostupné preparáty s omeprazolem, lanzoprazolem, pantoprazolem, esomeprazolem a rabeprazolem. Rozdíly mezi jednotlivými molekulami jsou především v jejich interakci s další medikací. V běžných klinických situacích není odlišnost v jejich terapeutickém účinku příliš velká, ale může být pozorovatelná [2].
Hlavními indikacemi pro podávání inhibitorů protonové pumpy jsou refluxní nemoc jícnu, peptický vřed, profylaxe gastropatie vyvolané nesteroidními antiflogistiky a v kombinaci s antibiotiky eradikace Helicobacter pylori. Příznivý efekt mohou mít i u funkční žaludeční dyspepsie, jako doplňkový lék u pacientů s chronickou pankreatitidou ke zlepšení účinnosti pankreatické substituce, u osob se syndromem krátkého střeva s cílem snížit množství žaludeční sekrece a u hospitalizovaných nemocných v profylaxi stresového poškození a krvácení ze žaludeční sliznice [3–5].
Významná terapeutická účinnost PPI na ovlivnění symptomů, slizničních změn a prevenci komplikací spolu se snadnou dostupností léků vede k nárůstu počtu osob, které tyto léky užívají [6,7]. Otázky týkající se bezpečnosti a rizik dlouhodobého utlumení tvorby žaludeční kyseliny ovšem mohou zasahovat do mnoha medicínských oblastí.
Nežádoucí účinky PPI obecně
Nežádoucí účinky PPI se dají rozdělit na akutní – bezprostředně po užití, tyto se vyskytují u 1–5 % uživatelů. Patří mezi ně: dyspepsie, bolesti hlavy, alergie, průjem a zácpa [8]. Výjimečně byly u pantoprazolu popsány poruchy krvetvorby [9]. Nežádoucí účinky jednotlivých PPI by se teoreticky neměly lišit, neboť rozdíly v chemické struktuře a mechanizmu účinku mezi jednotlivými PPI jsou minimální. Dle dosavadních poznatků nelze hodnotit, zda relativně delší a o něco účinnější působení některých preparátů, které je někdy zmiňováno ve snaze o podporu jejich používání, by mohlo být též podkladem pro výraznější nežádoucí účinky.
Rizika při dlouhodobém potlačení tvorby žaludeční kyseliny zahrnují malabsorpci určitých látek z potravy a jejich karenci, oslabení přirozené bariéry kyselého prostředí v žaludku a následné bakteriální přerůstání a zvýšený výskyt infekcí. Dalším teoretickým rizikem je ovlivnění proliferace žaludeční sliznice a buněk podílejících se na její regulaci včetně endokrinní a parakrinní sekrece hormonů. U pacientů s chronickou gastritidou (nejčastěji Helicobacter pylori) může být potencován úbytek žlázek s přechodem do atrofie, byla také pozorována hyperplazie enterochromafinních-like buněk v žaludeční sliznici a výraznější hypergastrinemie. Pod vlivem léčby PPI je popisován přesun antrálně predominantního typu gastritidy výrazněji do oblasti žaludečního těla. Mírné zvýšení sekrece gastrinu je obvyklým jevem, většinou bez progrese v čase [10,11]. Dle dostupných údajů je chronická léčba PPI spojována se zvýšeným rizikem osteoporózy a následnými frakturami. Je předpokládáno několik možných mechanizmů působení [12]. Cílem této práce je poskytnutí přehledu o aktuálních poznatcích v této oblasti a analýza podkladů, na jejichž základě je informace o zvýšeném riziku založena.
Vliv inhibitorů protonové pumpy na kosti
Možné mechanizmy ovlivnění metabolizmu kostí PPI a vznik fraktur
Efekt působení inhibitorů protonové pumpy na kostní minerálový metabolizmus je stále nejasný. Předpokládá se, že PPI mohou redukovat množství a denzitu kostní hmoty ovlivněním resorpce kalcia případně i prostřednictvím druhotné hypergastrinemie a následné hyperparatyreózy [13,14].
Střevní absorpce vápníku se děje jednak aktivním (transcelulárním) a jednak pasivním (paracelulárním) transportem. Aktivní transport skrze specifické iontové kanály na apikální membráně enterocytů je ovlivňován 1,25(OH) vitaminem D. Nejvíce se uskutečňuje v duodenu a proximálním jejunu a je ovlivněn věkem. Nízký perorální příjem kalcia stimuluje 1-α-hydroxylaci 25-OH-vitaminu D, což zvýší vstřebávání vápníku ze střeva. Vstřebávání vápníku není stále konstantní [15].
Mnoho vápenných solí (zejména CaCO3) je nerozpustných v pH neutrálním prostředí. V kyselém prostředí žaludku je vápník z nerozpustných solí uvolněn a teprve volné kalcium může být vstřebáno v tenkém střevě. Asi 40 % požitého vápníku je vázáno na proteiny, tato forma není při vstřebávání ovlivněna pH.
Stavy jako jsou perniciózní anémie, atrofická gastritida nebo stav po gastrektomii jsou považovány za rizikové pro vznik osteoporózy a fraktur [16]. Předpokládá se, že parciální blokáda sekrece kyseliny pomocí PPI má stejný mechanizmus jako absence produkce kyseliny chlorovodíkové při výše uvedených stavech.
Dalším potenciálním, i když vzácným rizikem léčby PPI, je hypomagnezemie. Mechanizmus vzniku hypomagnezemie není přesně znám. Byly zaznamenány případy závažné hypomagnezemie v souvislosti s podáváním PPI [17,18]. Po přerušení podávání léku se hladina hořčíku normalizovala [19]. Zdá se, že PPI interferují s aktivním transportem magnezia přes intestinální stěnu, a způsobují tak zvýšené ztráty hořčíku střevem [20]. Hypomagnezemie může vést k hypoparatyreoidizmu, což vede ke snížené osteoblastické a zvýšené osteoklastické aktivitě [21]. Nízký perorální příjem magnezia je asociován s nižší kostní minerální denzitou kyčle a celého těla, ale nebyla pozorována vyšší incidence fraktur [22].
Snížená sekrece kyseliny chlorovodíkové může mít za následek sekundární bakteriální přerůstání ve střevě, a tím zhoršenou absorpci vápníku a vitaminu B12 [23]. Malabsorpce vitaminu B12 může vést k jeho deficitu, a jeho deficit pak k periferní neuropatii, na jejímž podkladě hrozí zvýšené riziko pádu a fraktur. Dále deficit vitaminu B12 vede k hyperhomocysteinemii, která má negativní vliv na tvorbu příčných vazeb ve skeletálním kolagenu, a tím vzniku fragilnější kostní tkáně [24].
Inhibitory protonové pumpy by mohly blokovat osteoklastickou vakuolární protonovou pumpu. Ta přispívá ke kostní resorpci, a tímto k rozpuštění anorganické kostní matrix. Funkce těchto protonových pump může být in vitro inhibovaná omeprazolem, což by mohlo vést k menšímu kostnímu obratu, a tím pádem zhoršené reparaci mikrofraktur a mikroarchitektonických defektů kostí. Názor, zdali jsou PPI schopny ovlivnit protonové pumpy v jiných tkáních, se však v literatuře velmi liší [25].
Podklady pro hodnocení vlivu inhibitorů protonové pumpy na kosti v klinické praxi
Informace o zvýšeném riziku fraktur jsou založeny na pozorování z epidemiologických studií většinou využívajících informační databáze a ze studií primárně určených ke sledování pacientů s osteoporózou a její léčbou. Jen minimum dat pochází z přímého prospektivního sledování uživatelů PPI.
Epidemiologické studie
Hlavní zdroj informací o možném nežádoucím efektu PPI na kosti pochází z retrospektivních epidemiologických studií. První velkou studií prezentující tento problém byla studie Yanga et al v roce 2006 [33], která popisovala vztah mezi zvýšeným rizikem fraktur krčku femoru zejména u pacientů užívajících PPI ve vyšší dávce. Práce Vestergaarda et al [55], publikovaná ve stejném roce, popisovala asociaci mezi PPI a vznikem fraktur, nepotvrdila však závislost na dávce či délce trvání celkové terapie. Tyto 2 studie zvedly velký zájem o problematiku PPI a fraktur a další práce následovaly (tab. 1).
Tab. 1. Přehled studií, které potvrdily souvislost PPI a většího rizika fraktur 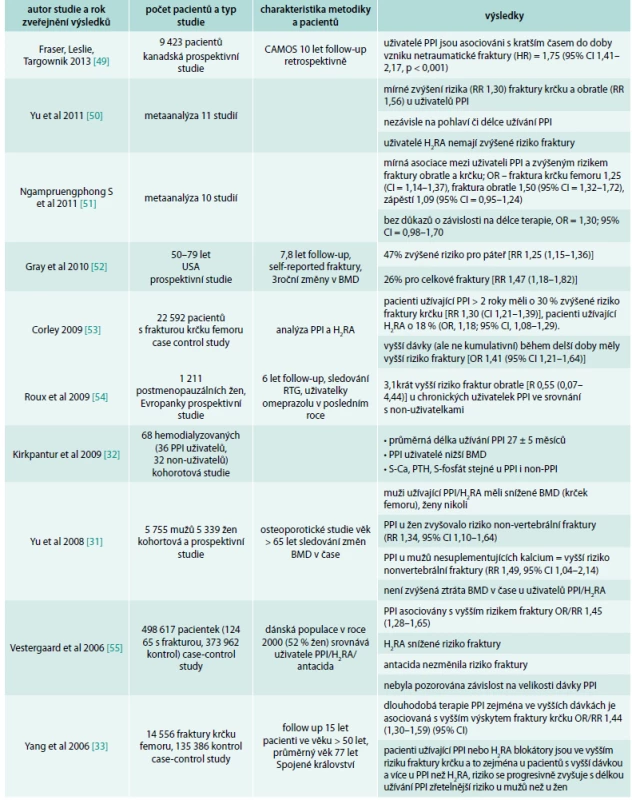
CAMOS – Canadian Multicenter Osteoporosis Study Souvislost mezi PPI a zvýšeným výskytem fraktur nepotvrdily 3 práce (Targownik et al, 2010; Kaye et al, 2008; Sharara et al, 2012) [57–59], přitom práce autorů Sharara et al, 2012, měla příliš krátký follow-up pacientů (3 měsíce), tedy výsledky se mohou zdát nepřesné.
Výsledky mnoha dalších prací ukázaly na složitost a nejednoznačnost problematiky. Souhrn publikací vztahujících se k tomuto tématu je uveden v přehledových tab. 1 a tab. 2.
Tab. 2. Přehled studií, které nepotvrdily souvislost PPI a rizika fraktur 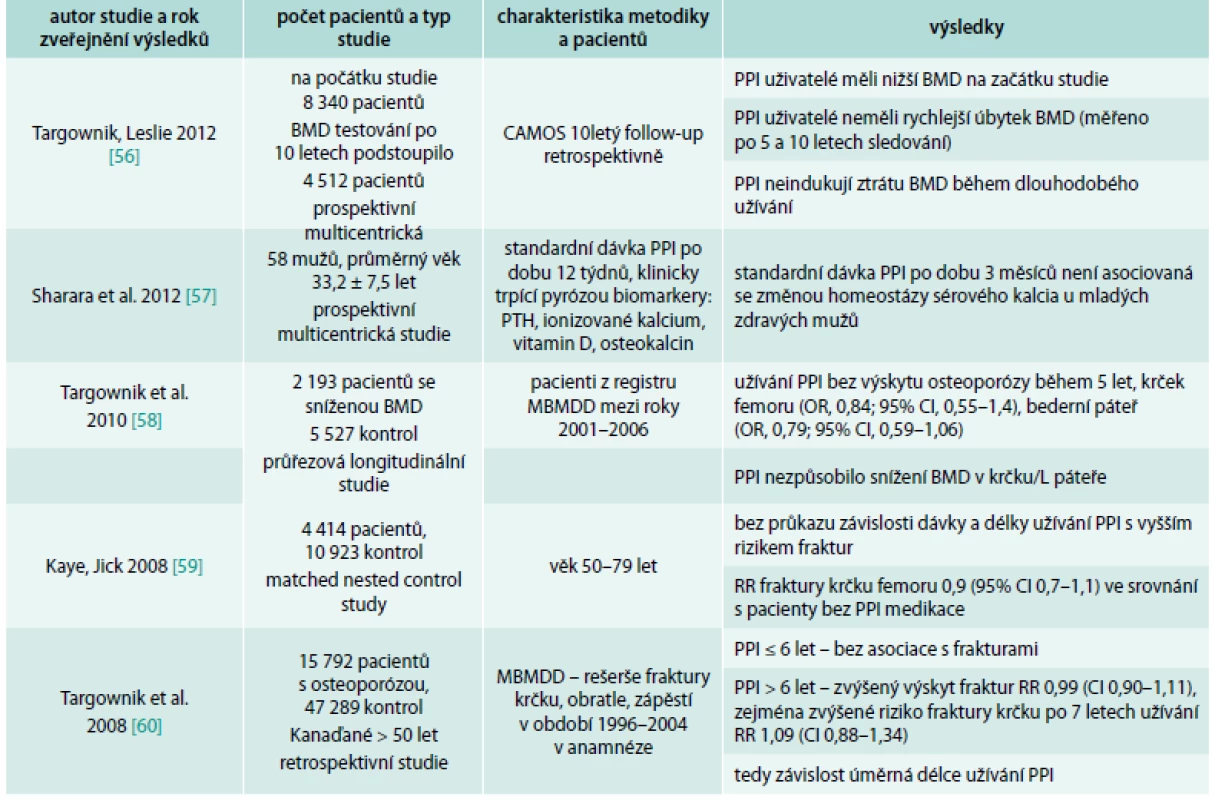
CAMOS – Canadian Multicenter Osteoporosis Study MBMDD – Manitoba Bone Mineral Density Database MHRD – Manitoba Health Research Data Interakce s antiosteoporotickými látkami – bisfosfonáty
Bisfosfonáty (BP) jsou syntetické látky inhibující aktivitu osteklastů. V současné době jsou na českém trhu alendronát, risendronát, ibandronát, zolendronát, klodronát a etidronát. Po perorálním podání se resorbuje méně než 1 % (žaludek a proximální část tenkého střeva), selektivně se vychytávají v místech zvýšené osteoresorpce, kde se rychle inkorporují do kosti a mají zde dlouhý poločas. Bisfosfonáty zachovávají kostní hmotu a snižují výskyt vertebrálních fraktur, a to především jsou-li nasazovány preventivně u pacientů dlouhodobě užívajících kortikoidy [26].
Několik studií primárně zaměřených na efekt bisfosfonátů na metabolizmus kosti a léčbu osteoporózy sledovalo vliv antisekreční terapie PPI na kost v kombinaci s bisfosfonátem. Pacienti užívající BP mají často v medikaci PPI kvůli gastroprotekci při užívání NSA v rámci analgetické terapie [27]. Také jako empirickou léčbu pro dyspeptické potíže při terapii bisfosfonáty [28,29] (tab. 3).
Tab. 3. Přehled studií s antiosteoporotickými látkami – bisfosfonáty a PPI 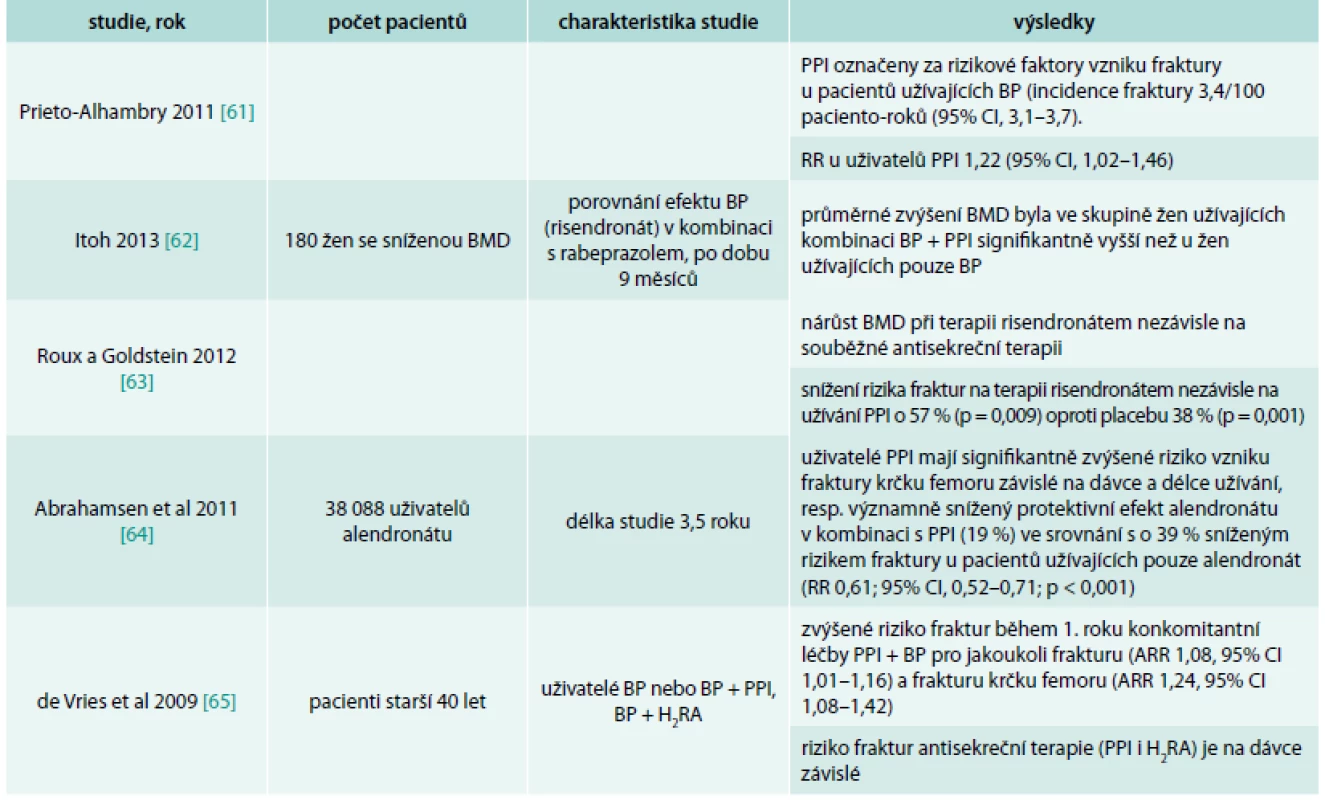
Výsledky studií s bisfosfonáty jsou opět inkonzistentní. Dle SPC není doporučována současná léčba BP a PPI, nicméně časté nežádoucí účinky a symptomy v oblasti trávicího traktu při terapií BP, ale i jinými léky u osob s osteoporózou, vedou k jejich častému podávání v praxi.
Přímé sledování vlivu PPI na metabolizmus kostí pomocí denzitometrie
Ozdil et al [30] vytvořili prospektivní studii, která zkoumala efekt PPI na kostní denzitu. Celkově na 114 pacientech s gastroezofageální refluxní chorobou a 110 zdravých kontrolách. BMD byla měřena na L páteři a krčku femoru na počátku studie a po 6 měsících. Pacienti užívající PPI byli rozděleni do skupin dle užívajícího preparátu (esomeprazol, lansoprazol, pantoprazol). Průměrná doba užívání PPI byla 8,5 měsíců. Bylo prokázáno signifikantní snížení T-skóre L obratlů, a to zejména u uživatelů lansoprazolu, a krčku femoru u uživatelů esomeprazolu.
Studie Yu et al [31] sledovala vývoj kostní minerální hustoty na kohortě pacientů se zvýšeným rizikem osteoporózy – 5 755 mužích a 5 339 ženách věku nad 65 let užívajících PPI nebo H2-blokátory. Tato studie zohledňovala medikaci na osteoporózu a anamnestická data fraktur. Muži užívající PPI nebo H2RA (antagonisté H2-receptorů) měli nižší BMD. U žen nebyl žádný signifikantní rozdíl, ale bylo zvýšené riziko nespinálních fraktur u uživatelek PPI. U mužů bylo riziko nespinální fraktury zvýšeno pouze v případě, že neužívali kalcium suplementující medikaci. U H2RA nebyla nalezena souvislost s nespinálními frakturami. Ani u PPI ani H2RA nebylo zvýšené riziko fraktury krčku femoru. Závěrem této studie bylo doporučeno u postmenopauzálních žen a starších mužů při užívání PPI zvýšit příjem kalcia ke snížení rizika fraktury.
Třetí studie Kirkpantur et al zaměřující se na denzitometrii u uživatelů PPI byla provedena u skupiny chronicky dialyzovaných pacientů [32]. Soubor se skládal z celkem 68 pacientů v chronickém hemodialyzačním programu, 36 pacientů užívajících pantoprazol v průměru 27 ± 5 měsíců, 32 kontrol – tj. neuživatelů PPI. Denzitometrie byla provedena na radiu, krčku femoru a L páteři. Uživatelé PPI měli menší BMD a T-skóre ve srovnání s kontrolní skupinou. Sérová hladina kalcia, ALP, PTH a vitaminu D byly přibližně stejné u všech pacientů, nezávisle na užívání PPI. Závěrem studie bylo doporučeno pečlivější zvažování nasazení PPI u chronicky dialyzovaných pacientů.
Diskuse
Rizikovost užívání PPI pro vznik fraktur je velmi relativní pojem. Absolutní čísla jsou nízká, ale při nevhodně zvoleném parametru může relativní riziko vypadat vysoké. Absolutní počty fraktur se většinou pohybují v rozmezí 1–4 na 1 000 osob za rok [33]. Zvýšené riziko je pak násobkem tohoto čísla. Ačkoli výsledky většiny studií se přiklání k závěru, že souvislost mezi užíváním PPI a frakturami kostí je pravděpodobná, nelze dojít ke konzistentním výsledkům.
Většina dat publikovaných studií byla primárně získána za jiným účelem (primárně studie pro osteoporózu nebo široké pacientské databáze či registry). Pro důkladnější posouzení vlivu PPI na kosti je nutné se cíleně zaměřit na určité parametry (anamnéza, výsledky laboratorních vyšetření a denzitometrie) také proto, že není přesně definován mechanizmus PPI na zvýšeném riziku kostní remodelace/resorpce.
V epidemiologických studiích není vůbec zohledňován důvod nasazení PPI. Je možné, že riziko fraktury se liší v závislosti na důvodu indikace a celkového stavu pacienta u různých diagnóz. Nelze tedy s jistotou říci, zdali je výskyt fraktur kostí způsoben užíváním PPI, či jinou současnou medikací nebo doprovodnými zdravotními problémy. Pro další studie by bylo vhodné se zaměřit právě na tyto faktory a v prezentovaných výsledcích na ně brát ohled.
Příznivé působení PPI na symptomy acidopeptických onemocnění může vést k odlišnému „životnímu stylu“ a způsobu stravování u osob léky pravidelně užívajících ve srovnání s těmi, kteří se snaží kontrolovat obtíže pomocí změny životosprávy a diety bez medikace [34].
Dánská studie zkoumala životní styl u uživatelů PPI ve srovnání s neuživateli v rámci národního zdravotnického průzkumu. Porovnávala data: biometrické ukazatele, prevalenci kuřáctví, excesivní konzumaci alkoholu, pohybovou aktivitu. Výsledkem bylo konstatování, že PPI uživatelé jsou obéznější (16,7 % vs 13,1 %), více kouří (26,2 % vs 22,3 %, pacienti nekuřáci 41,0 % vs 32,0 %), mají „nezdravější“ dietu (národní průzkum bral na zřetel obsah tuku, konzumaci zeleniny a ovoce, pečiva apod) a mají signifikantně vyšší komorbidity než ti, kteří PPI neužívají. Sportovní aktivita a konzumace alkoholu byla přibližně stejná v obou skupinách. Komorbidity diagnostikované u pacientů hospitalizovaných v nemocnici byly pozorovány u 35 % PPI uživatelů ve srovnání s kontrolní skupinou 15 % non-PPI uživatelů [35].
Švédská studie zkoumala riziko dlouhodobých uživatelů PPI v domově pro seniory v Helsinkách na souboru 1 987 pacientů v průměrném věku 83,7 let. Tato studie prokázala, že uživatelé PPI mají mnohem častější výskyt komorbidit (vředová choroba gastroduodena, nádorová onemocnění, nemoci koronárních tepen) a vyšší počet celkové užívané medikace než pacienti bez PPI. Výskyt fraktur krčku femoru byl u PPI uživatelů vyšší než u neuživatelů (28,5 % vs. 18,4 %, p < 0,001) [36].
Je mnoho léčiv s potenciálním či již prokázaným efektem na kost. Mezi nejznámější zástupce patří glukokortikoidy (GCS), které svým mechanizmem inhibují diferenciaci osteoblastů a jejich funkci a aktivují kostní resorpci. Zároveň také inhibují resorpci kalcia z tenkého střeva, která vede k hypokalcemii. Mezi další skupiny léčiv s negativním účinkem na kost patří levotyroxin, antinadrogeny a piaglitazon ze skupiny perorálních antidiabetik. Dále byly časté fraktury pozorovány u pacientů užívajících selektivní serotoninové reuptake inhibitory (SSRI), antiepileptika, diuretika a antikoagulancia [37].
Některá onemocnění trávicího traktu mohou sama kostní metabolizmus ovlivňovat. U pacientů s onemocněním pankreatu s nedostatečným efektem standardní enzymové substituce je léčba PPI indikována i bez přítomnosti poškození horní části trávicího traktu [38]. Podobně bývá klinická indikace (i když sporná) u některých nemocí jater spojených s portální hypertenzí, a to i přes absenci acidopeptického onemocnění, za účelem předcházení komplikací spojených s krvácením při portální hypertenzi. Některé práce však doporučují redukci dávky PPI s ohledem na snížený jaterní metabolizmus a zvýšené riziko infekčních komplikací [39]. Tato onemocnění mohou sama o sobě vést k metabolickým kostním změnám [40,41]. Hodnocení vlastního efektu antisekreční léčby je tedy prakticky nemožné.
Vliv snížené acidity žaludeční šťávy na vstřebávání vápníku nemusí být velký. Optimální vstřebávání anorganicky vázaného vápníku (zejména špatně rozložitelné kalcium karbonikum – CaCO3) vyžaduje přítomnost kyseliny chlorovodíkové. Ve skutečnosti jsou však velké dávky CaCO3 špatně absorbovány kvůli jejich neutralizačnímu efektu na HCl. Na bílkovinách vázaný vápník je vstřebáván lépe.
Při stavech hypochlorhydrie/achlorhydrie by měla být kalciová suplementa užívána s jídlem, aby se optimalizovala jejich absorpce. V těchto případech je výhodnější suplementovat kalcium citrátem než kalcium karbonikem [15]. Ke stejným závěrů došla i studie provedená na 19 pacientech po Roux-gastrickém bypassu pro obezitu, v níž se porovnávala sérová hladina kalcia po suplementaci kalcium citrátem a kalcium karbonikem a výhodnější v těchto případech byla suplementace kalcium citrátem [42]. Avšak ve studii na 301 postmenopauzálních ženách bylo prokázáno, že suplementace kalcium citrátem je efektivnější než kalciem karbonikem [43]. Recentní studie porovnávala rozdíl v biodostupnosti po jednorázovém užití kalcium citrátu v tabletách a kalcium karbonikum v prášku u skupiny premenopauzálních žen v průměrném věku 33,2 ± 8,71 let. Studie prokázala vyšší nárůst celkového sérového i ionizovaného kalcia po podání kalcium karbonikum než po kalcium citrátu [44].
Při ovlivnění kostí by měl hrát důležitou roli i časový faktor. Změna struktury kosti do osteoporózy se zvýšeným rizikem fraktury trvá mnoho let. Při přepokládaném ročním úbytku kostní tkáně kolem 1 % [45] by aditivní vliv PPI měl v čase narůstat. Inhibitory protonové pumpy jsou v širším užívání asi 20 let. Epidemiologické práce popisují vyšší výskyt fraktur již po několika letech. Reálně asi nejdéle PPI užívají ti, co mají jasné acidopeptické onemocnění (hlavně refluxní nemoc jícnu a vředovou chorobu). V ostatních indikacích bude délka užívání pravděpodobně kratší, protože PPI byly do preskripce i bez omezení i volného prodeje uvolněny později. Pokud bude vliv PPI na kosti opravdu významný, tak by mělo přibývat fraktur u osob i v relativně mladších skupinách uživatelů PPI současně s tím, jak narůstá jejich užívání v populaci [46]. Na výsledky takového pozorování budeme muset ještě několik let počkat.
Až 40 % hospitalizovaných osob má ve své medikaci inhibitory protonové pumpy [34,47]. Pacienti užívající PPI terapii dlouhodobě jsou často pacienti s četnými komorbiditami jako např. diabetes mellitus, renální insuficience nebo pacienti po prodělaných infekcích. Je tedy otázkou, zdali se riziko fraktur dá přičítat užívání inhibitorů protonové pumpy, nebo spíše celkovému souboru onemocnění, které pacient má a tedy podílu komorbidit na zdraví kosti.
Pacienti užívající PPI tvoří obecně velmi heterogenní skupinu. Lze předpokládat, že komorbidity a přídatné rizikové faktory pro vznik fraktur a osteoporózy se budou lišit podle indikace. Pravděpodobně v jiném riziku může být muž s refluxní nemocí jícnu a žena opakovaně hospitalizovaná pro srdeční onemocnění s antiagregační terapií, i když budou stejného věku. PPI jsou předepisovány až u 50 % uživatelů neindikovaně pro dlouhodobé použití [7]. Zejména u této skupiny pacientů by měla být snaha přerušit či zredukovat dlouhodobou PPI terapii [48].
Pokud bychom chtěli teoretické riziko PPI na kosti snížit, stojí za zvážení definovat rizikové skupiny pacientů s ohledem na vyšší riziko fraktur (postmenopauzální ženy, riziková medikace, renální kostní nemoc). A u těchto pacientů před zahájením antisekretorické léčby a po jisté době při terapii PPI provést denzitometrii. Z doposud vytvořených studií nevyplývá ani interval stanovení kontrol denzitometrie od začátku užívání PPI. Doporučení zvýšeného příjmu vápníku z přírodních a hlavně organických zdrojů současně s opakovaným předpisem PPI je jednoduché a levné opatření. Případně lze pacienty se zvýšeným rizikem PPI terapie indikovat hned při zahájení lečby PPI na perorální. substituci kalcia ve vhodné formě (kalcium citrát), případně i jinou léčbu osteoporózy.
Závěr
Problematika užívání PPI a jejich potenciální rizikovost ve smyslu fraktur je velmi složitá a multifaktoriální. Zvýšené riziko zvýšeného úbytku kostní hmoty nelze u uživatelů PPI vyloučit. Nejednoznačné závěry dosavadních studií mohou ukazovat spíše na to, že užívání PPI je spíše jakýmsi ukazatelem závažnosti stavu (a zvýšeného rizika) než vlastní příčinou kostních změn. Paušální vyšetřování kostního metabolizmu při užívání PPI by neúměrně zvýšilo náklady na léčbu, proto nelze obecně doporučit. Hlavním opatřením by mělo být důkladné zvážení indikace léčby PPI, zhodnocení dávky a doby léčby a posouzení konkomitantní terapie léky s potenciálně možnou interakcí. Zvláště u pacientů polymorbidních a rizikových pro osteoporózu je důležité terapii PPI zbytečně neprodlužovat. Současná substituce kalcia může být užitečná. Důkladné zvážení, zda přetrvává indikace pro preskripci PPI, snaha o redukci dávky a omezení dalších rizikových vlivů je esenciální pro eliminaci dlouhodobých nežádoucích účinků.
Podpořeno MZ ČR – RVO (FN Br, 65269705).
Doručeno do redakce 23. 2. 2015
Přijato po recenzi 17. 11. 2015
MUDr. Markéta Ječmenová
marketa.jecmenova@fnbrno.cz
Interní gastroenterologická klinika LF MU a FN Brno
www.fnbrno.cz
Zdroje
1. Khan M, Santana J, Donnellan C et al. Medical treatments in the short term management of reflux oesophagitis. Cochrane Database Syst Rev 2007; (2):CD003244.
2. Chubineh S, Birk J. Proton pump inhibitors: the good, the bad, and the unwanted. South Med J 2012; 105(11): 613–618.
3. Martínek J, Lukáš M. Inhibitory protonové pumpy – up to date. Gastroent Hepatol 2011; 65(6): 331–342.
4. Lukáš K, Bureš J, Drahoňovský V et al. Refluxní choroba jícnu. Standardy České gastroenterologické společnosti – aktualizace 2009. Vnitř Lék 2009; 55(10): 967–975.
5. Seifert B, Dítě P, Bureš J et al. Gastroenterologie. Doporučení diagnostické a terapeutické postupy pro všeobecné praktické lékaře. Novelizace 2012. Centrum doporučených postupů pro praktické lékaře – Společnost všeobecného lékařství ČLS JEP: Praha 2012. Dostupné z WWW: http://www.svl.cz/files/files/Doporucene-postupy-2008–2012/Gastro_2012.pdf.
6. Teramura-Grönblad M, Hosia-Randell H, Muurinen S et al. Use of proton-pump inhibitors and their associated risks among frail elderly nursing home residents. Scand J Prim Health Care 2010; 28(3): 154–159.
7. Reeve E, Andrews JM, Wiese MD et al. The Feasibility of a Patient-Centered Deprescribing Process to Reduce Inappropriate Use of Proton Pump Inhibitors. Ann Pharmacother 2015; 49(1): 29–38.
8. Laine L, Ahnen D, McClain C et al. Review article: potential gastrointestinal effects of long-term acid supression with proton pump inhibitors. Aliment Pharmacol Ther 2000; 14(6): 651–668.
9. Chubineh S, Birk J. Proton Pump Inhibitors: The Good, the Bad, and the Unwanted. South Med J 2012; 105(11): 613–618.
10. Brunner G, Creutzfeldt W, Harke U et al. Therapy with omeprazole in patients with peptic ulcerations resistant to extended high-dose ranitidine treatment. Digestion 1988; 39(2): 80–90.
11. Kroupa R, Dolina J. Rizika dlouhodobé antisekreční terapie. Vnitř Lék 2010; 56(2): 115–119.
12. Yang YX. Proton pump inhibitor therapy and osteoporosis. Curr Drug Saf 2008; 3(3): 204–209.
13. Stewart AF, Vignery A, Silvergate A et al. Quntitative bone histomorphometry in humoral hypercalcemia of malignancy: uncoupling of bone cell activity. J Clin Endocrinol Metab 1982; 55(2): 219–227.
14. Mizunashi K, Furakawa Y, Katano K et al. Effect of omeprazole, an inhibitor of H+, K(+)ATPasaxe, on bone resorption in humans. Calcif Tissue Int 1993; 53(1): 21–25.
15. Longo D, Fauci A, Kasper D. Harrison’s Principles of Internal Medicine. Voll. 2. 18th ed. McGraw-Hill 2012 : 2444–2457. ISBN 978–0-07174889–6.
16. Sipponen P, Härkönen M. Hypochlorhydric stomach: a risk condition for calcium malabsorption and osteoporosis? Scand J Gastroenterol 2010; 45(2): 133–138.
17. Ayuk J, Gittoes NJ. Contemporary view of the clinical relevance of magnesium homeostasis. Ann Clin Biochem 2014; 51(Pt 2): 179–188.
18. Hess MW, Hoenderop JG, Drenth JP et al. Systematic review: hypomagnesaemia induced by proton pump inhibition. Aliment Pharmacol Ther 2012; 36(5): 405–413.
19. Markovits N, Loebstein R, Halkin H et al. The association of proton pump inhibitors and hypomagnesemia in the community setting. J Clin Pharmacol 2014; 54(8): 889–895.
20. Cundy T, Dissanayake A. Severe hypomagnesaemia in long-term users of proton-pump inhibitors. Clin Endocrinol (Oxf) 2008; 69(2): 338–341.
21. Rude RK, Singer FR, Gruber HE. Skeletal and hormonal effects of magnesium deficiency. J Am Coll Nutr 2009; 28(2): 131–141.
22. Orchard TS, Larson JC, Alghothani N et al. Magnesium intake, bone mineral density, and fractures: results from the Women’s Health Initiative Observational Study. Am J Clin Nutr 2014; 99(4): 926–933.
23. Lewis SJ, Franco S, Young G et al. Altered bowel function and duodenal bacterial overgrowth in patients treated with omeprazole. Aliment Pharmacol Ther 1996; 10(4): 557–561.
24. Ito T, Jenses RT. Association of long term proton pump inhibitor therapy with bone fractures and efects on absorbtion of calcium, vit B12, iron and magnesium. Curr Gastroenterol Rep 2010; 12(6): 448–457.
25. Tuukkanen J, Vaananen HK. Omeprazole, a specific inhibitor of H+K+-ATPase, inhibits bone resorption in vitro. Calcif Tissue Int 1986; 38(2): 123–125.
26. Feng Z, Zeng S, Wang Y et al. Bisphosphonates for the prevention and treatment of osteoporosis in patients with rheumatic diseases: a systematic review and meta-analysis. PLoS One 2013; 8: e80890. Dostupné z DOI: http://dx.doi.org/10.1371/journal.pone.0080890.
27. Knopp-Sihota JA, Cummings GG, Homik J et al. The association between serious upper gastrointestinal bleeding and incident bisphosphonate use: a population-based nested cohort study. BMC Geriatr 2013; 13 : 36. Dostupné z DOI: http://dx.doi.org/10.1186/1471–2318–13–36.
28. Miyake K, Kusunoki M, Shinji Y et al. Bisphosphonate increases risk of gastroduodenal ulcer in rheumatoid arthritis patients on long-term nonsteroidal antiinflammatory drug therapy. J Gastroenterol 2009; 44(2): 113–120.
29. Peng YL, Hu HY, Luo JC et al Alendronate, a bisphosphonate, increased upper and lower gastrointestinal bleeding: risk factor analysis from a nationwide population-based study. Osteoporos Int 2014; 25(5): 1617–1623.
30. Ozdil K, Kahraman R, Sahin Aet al. Bone density in proton pump inhibitors users: a prospective study. Rheumatol Int 2013; 33(9): 2255–2260.
31. Yu EW, Blackwell T, Ensrud KE et al. Acid-suppressive medications and risk of bone loss and fracture in older adults. Calcif Tissue Int 2008; 83(4): 251–259.
32. Kirkpantur A, Altun B, Arici M et al. Proton pump inhibitor omeprazole use is associated with low bone mineral density in maintenance haemodialysis patients. Int J Clin Pract 2009; 63(2): 261–268.
33. Yang XY, Lewis JD, Epstein S et al. Long-term Proton Pump Inhibitor Therapy and Risk of Hip Fracture. JAMA 2006; 296(24): 2947–2953.
34. Pasina L, Nobili A, Tettamanti M et al. Prevalence and appropriateness of drug prescriptions for peptic ulcer and gastro-esophageal reflux disease in a cohort of hospitalized elderly. Eur J Intern Med 2011; 22(2): 205–210.
35. Hvid-Jensen F, Nielsen RB, Pedersen L et al. Lifestyle factors among proton pump inhibitor users and nonusers: a cross-sectional study in a population-based setting. Clin Epidemiol 2013; 5 : 493–499.
36. Teramura-Grönblad M, Hosia-Randell H, Muurinen S et al. Use of proton-pump inhibitors and their associated risks among frail elderly nursing home residents. Scand J Prim Health Care 2010; 28(3): 154–159.
37. Zofková I. Léky indukovaná osteoporóza (Drug induced osteoporosis). Vnitř Lék 2013; 59(1): 59–63.
38. Löhr J, Oliver MR, Frulloni L. Synopsis of recent guidelines on pancreatic exocrine insufficiency. United European Gastroenterol J 2013; 1(2): 79–83.
39. Lodato F, Azzaroli F, Di Girolamo M et al. Proton pump inhibitors in cirrhosis: tradition or evidence based practice? World J Gastroenterol 2008; 14(19): 2980–2985.
40. Dujsíková H, Novotný I, Tomandl J et al. Chronická pankreatitida a skelet (Chronic pancreatitis and the skeleton). Vnitř Lék 2010; 56(7): 656–662.
41. Luxon BA. Bone disorders in chronic liver diseases. Curr Gastroenterol Rep 2011; 13(1): 40–48.
42. Tondapu P, Provost D, Adams-Huet B et al. Comparison of the absorption of calcium carbonate and calcium citrate after Roux-en-Y gastric bypass. Obes Surg 2009; 19(9): 1256–1261.
43. Dawson-Hughes B, Dallal GE, Krall EA et al. A controlled trial of the effect of calcium supplementation on bone density in postmenopausal women. N Engl J Med 1990; 323(13): 878–883.
44. Wang H, Bua P, Capodice J. A comparative study of calcium absorption following a single serving administration of calcium carbonate powder versus calcium citrate tablets in healthy premenopausal women. Food Nutr Res 2014; 58. Dostupné z DOI: http://dx.doi.org/10.3402/fnr.v58.23229.
45. Bainbridge KE, Sowers M, Lin X et al. Risk factors for low bone mineral density and the 6-year rate of bone loss among premenopausal and perimenopausal women. Osteoporos Int 2004; 15(6): 439–446.
46. Cammarota S, Bruzzese D, Sarnelli G et al. Proton pump inhibitors prescribing following the introduction of generic drugs. Eur J Clin Invest 2012; 42(10): 1068–1078.
47. Dent J, El-Serag HB, Wallader MA et al. Epidemiology of gastro-esofageal reflux disease: a systematic review. Gut 2005; 54(5): 710–717.
48. Haastrup P, Paulsen MS, Begtrup LM et al. Strategies for discontinuation of proton pump inhibitors: a systematic review. Fam Pract 2014; 31(6): 625–630.
49. Fraser LA, Leslie WD, Targownik LE et al. The effect of proton pump inhibitors on fracture risk: report from the Canadian Multicenter Osteoporosis Study. Osteoporos Int 2013; 24(4): 1161–1168.
50. Yu EW, Bauer SR, Bain PA et al. Proton pump inhibitors and risk of fractures: a meta-analysis of 11 international studies. Am J Med 2011; 124(6): 519–526.
51. Ngamruengphong S, Leontiadis GI, Radhi S et al. Proton pump inhibitors and risk of fracture: a systematic review and meta-analysis of observational studies. Am J Gastroenterol 2011; 106(7): 1209–1218.
52. Gray SL, LaCroix AZ, Larson J et al. Proton pump inhibitor use, hip fracture, and change in bone mineral density in postmenopausal women: results from the Women’s Health Initiative. Arch Intern Med 2010; 170(9): 765–771.
53. Corley DA. Proton pump inhibitor, H2 antagonists, and risk of hip fracture: a large population-based study[abstract] Gastroenterology. 2009; 136(Suppl 1): A70.
54. Roux C, Briot K, Gossec L et al. Increase in vertebral fracture risk in postmenopausal women using omeprazole. Calcif Tissue Int 2009; 84(1): 13–19.
55. Vestergaard P, Rejnmark L, Mosekilde L. Proton pump inhibitors, histamine H2 receptor antagonists, and other antacid medications and the risk of fracture. Calcif Tissue Int 2006; 79(2): 76–83.
56. Targownik LE, Leslie WD, Davison KS et al. The relationship between proton pump inhibitor use and longitudinal change in bone mineral density: a population-based study [corrected] from the Canadian Multicentre Osteoporosis Study (CaMos). Am J Gastroenterol 2012; 107(9): 1361–1369.
57. Sharara AI, El-Halabi MM, Ghaith OA et al. Proton pump inhibitors have no measurable effect on calcium and bone metabolism in healthy young males: a prospective matched controlled study. Metabolism 2013; 62(4): 518–526.
58. Targownik LE, Lix LM, Leung S et al. Proton-pump inhibitor use is not associated with osteoporosis or accelerated bone mineral density loss. Gastroenterology 2010; 138(3): 896–904.
59. Kaye JA, Jick H. Proton pump inhibitor use and risk of hip fractures in patients without major risk factors. Pharmacotherapy 2008; 28(8): 951–959.
60. Targownik LE, Lix LM, Metge CJ et al. Use of proton pump inhibitors and risk of osteoporosis-related fractures. CMAJ 2008; 179(4): 319–326.
61. Prieto-Alhambra D, Pagès-Castellà A, Wallace G et al. Predictors of fracture while on treatment with oral bisphosphonates: a population-based cohort study. J Bone Miner Res 2014; 29(1): 268–274.
62. Itoh S, Sekino Y, Shinomiya K et al. The effects of risedronate administered in combination with a proton pump inhibitor for the treatment of osteoporosis. J Bone Miner Metab 2013; 31(2): 206–211.
63. Roux C, Goldstein JL, Zhou X et al. Vertebral fracture efficacy during risedronate therapy in patients using proton pump inhibitors. Osteoporos Int 2012; 23(1): 277–284.
64. Abrahamsen B, Eiken P, Eastell R. Proton pump inhibitor use and the antifracture efficacy of alendronate. Arch Intern Med 2011; 171(11): 998–1004.
65. De Vries F, Cooper AL, Cockle SM et al. Fracture risk in patients receiving acid-suppressant medication alone and in combination with bisphosphonates. Osteoporos Int 2009; 20(12): 1989–1998.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Fekálna mikrobiálna terapiaČlánek Otrava olovem – editorial
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2016 Číslo 2- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Intermitentní hladovění v prevenci a léčbě chorob
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Chronická pankreatitida diagnostikovaná po první atace akutní pankreatitidy
- Antagonisté receptorů pro angiotenzin II (AT1-blokátory) v léčbě hypertenze
- Pacient si stěžuje na bolesti v páteři nebo na únavu a slabost. Jak rozeznám, zda je příčinou spondylartróza, věk nemocného anebo mnohočetný myelom?
- Racionální diagnostika cholangiokarcinomu
- Použití systémových glukokortikoidů v terapii infekčních nemocí
- Inhibitory protonové pumpy a jejich účinek na kosti
- Fekálna mikrobiálna terapia
- Těžká osteoporóza aneb Příběh chronické polékové hyponatremie
- Otrava olovem – překvapivá příčina bolestí břicha, obstipace a anémie
-
PRAXBIND® – nová jistota při léčbě perorálním antikoagulanciem PRADAXA®
Zpráva z odborného sympozia Další krok k bezpečnější antikoagulaci pořádaného Českou společností pro trombózu a hemostázu ČLS JEP ve spolupráci se společností Boehringer Ingelheim - Ivana Štětkářová (ed) et al. Moderní farmakoterapie v neurologii
- Ladislav Hagara. Ottova encyklopédia húb.
- Chronická pankreatitida diagnostikovaná po první atace akutní pankreatitidy – editorial
- Kortikosteroidy v léčbě infekčních nemocí – editorial
- Fekální transplantace střevní mikroflóry – editorial
- Otrava olovem – editorial
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Pacient si stěžuje na bolesti v páteři nebo na únavu a slabost. Jak rozeznám, zda je příčinou spondylartróza, věk nemocného anebo mnohočetný myelom?
- Kortikosteroidy v léčbě infekčních nemocí – editorial
- Otrava olovem – překvapivá příčina bolestí břicha, obstipace a anémie
- Antagonisté receptorů pro angiotenzin II (AT1-blokátory) v léčbě hypertenze
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



