-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Fekálna mikrobiálna terapia
Fecal microbiota transplantation
Fecal microbiota transplantation (FMT) is a therapeutic method, in which the fecal microflora from healthy donors is transmitted to the patient to restore the healthy microbial composition of the gut. In the recent years, there is a growing interest in the therapeutic potential of FMT in various diseases. The standard FMT protocols do not exist. Procedures of FMT vary in several aspects such as donor selection, preparation of fecal material, preparation of the recipient and administration way. FMT appears to be the most successful in the treatment of recurrent Clostridium difficile infection (CDI), randomized controlled studies reported 90 % success rate. There is a limited evidence for FMT as a treatment of ulcerative colitis. FMT has been also studied as treatment of diseases with impaired gut microbiota, such as cardiovascular, autoimmune and metabolic diseases. Many unanswered questions with regard to FMT remain and further research is needed.
Key words:
Clostridium difficile – fecal microbiota transplantation – gut microbiota – inflammatory bowel diseases
Autoři: Igor Šturdík; Tibor Hlavatý; Juraj Payer
Působiště autorů: V. interná klinika LF UK a UN Bratislava, pracovisko Nemocnica Ružinov, Slovenská republika
Vyšlo v časopise: Vnitř Lék 2016; 62(2): 147-151
Kategorie: Přehledné referáty
Souhrn
Fekálna mikrobiálna terapia (FMT) je liečebná metóda, pri ktorej sa prenesie fekálna mikroflóra chorému jedincovi od zdravého darcu, a tým sa obnoví normálne mikrobiálne zloženie čreva. V súčasnosti vzrastá záujem o využitie FMT pri liečbe rôznych chorôb, avšak neexistujú štandardné terapeutické protokoly. Postupy pri realizácii FMT sa líšia vo viacerých aspektoch, ako je výber darcu, príprava fekálnych materiálov, príprava príjemcu a spôsob aplikácie. FMT sa zdá byť najúspešnejšia v liečbe rekurentnej infekcie Clostridium difficile, randomizované kontrolované štúdie dokázali úspešnosť približne 90 %. Existujú aj obmedzené výsledky pre liečbu ulceróznej kolitídy, publikované boli malé série prípadov, ktorých výsledky však nie sú jednotné. Využitie FMT sa skúma aj v liečbe iných chorôb, pri ktorých je narušená črevná mikroflóra, ako sú napr. kardiovaskulárne, autoimunitné a metabolické ochorenia. Nateraz je pri FMT veľa nezodpovedaných otázok, a preto je nevyhnutný ďalší výskum v tejto oblasti.
Kľúčové slová:
Clostridium difficile – črevná mikroflóra – fekálna bakterioterapia – fekálna mikrobiálna terapia – fekálna transplantácia – chronické zápalové ochorenia črievÚvod
Gastrointestinálny trakt obsahuje viac ako 1014 baktérií z viac ako 30 000 druhov. Počet baktérií u jedného človeka je 10-krát väčší ako je počet všetkých buniek v ľudskom tele. Črevná mikroflóra sa správa v ľudskom tele ako samostatný orgán a ovplyvňuje metabolizmus, výživu a imunitný systém hostiteľa. Tento vyrovnaný vzťah medzi hostiteľom a črevnou mikroflórou sa nazýva symbióza. Porušenie symbiózy môže viesť k rôznym chorobám, ako sú infekcia Clostridium difficile (CDI), chronické zápalové ochorenia čriev (IBD), syndróm dráždivého čreva (IBS), autoimunitné choroby, alergie, kardiovaskulárne ochorenia a metabolické poruchy. Fekálna mikrobiálna terapia (FMT) je liečebná metóda, ktorej cieľom je napraviť narušenú symbiózu prenosom stolice od zdravých darcov chorým jedincom. Táto liečebná metóda bola využívaná už v starej Číne a v stredoveku a po prvýkrát v modernom písomníctve bola FMT terapeuticky použitá v roku 1958 Eisemanom u pseudomembranóznej kolitídy [1]. Odvtedy bolo uverejnených viac ako 100 kazuistík ohľadom terapeutického využitia FMT pre rôzne ochorenia [2], avšak donedávna neexistovali kontrolované štúdie. Až v roku 2013 bola publikovaná prvá randomizovaná kontrolovaná klinická štúdia FMT u recidivujúcej CDI [3], a tak FMT vstúpila do éry medicíny založenej na dôkazoch. V súčasnosti rastie záujem o FMT v liečbe rôznych gastrointestinálnych, metabolických a kardiovaskulárnych chorôb.
Metodológia FMT
Výber donora
Donori – darcovia – sú zvyčajne vybraní z radov príbuzných, manželov, priateľov alebo zdravých dobrovoľníkov (tab). Každý typ darcu má svoje výhody a nevýhody. Ak sú darcami príbuzní alebo manželia, riziko prenosu infekčných agens je nízke, pretože zdieľajú s príjemcom niektoré infekčné rizikové faktory. Zdraví dobrovoľníci môžu najvýznamnejšie zmeniť črevnú mikroflóru príjemcu, pretože nezdieľajú genetické alebo enviromentálne pozadie s príjemcom, a medzi zdravými dobrovoľníkmi sa flexibilnejšie vyberajú donori ako medzi príbuznými. Nie je jasné, či zdroj donora ovplyvňuje účinnosť FMT, ale vyššia miera úspešnosti v liečbe CDI bola hlásená u nepríbuzenských darcov (93 %) než u príbuzenských (84 %) [4]. Darcovia musia byť dôkladne vyšetrení, pretože najväčším rizikom FMT je prenos infekčných agensov. Od kandidátov na donorov by mala byť odobratá anamnéza o minulých aj súčasných chorobách, cestovateľská anamnéza za posledných 6 mesiacov, anamnéza o sexuálnom správaní a defekačných návykoch. Známa musí byť tiež rodinná anamnéza o autoimunitných, onkologických a metabolických chorobách. Kandidát na donora s anamnézou užívania antibiotík počas posledných 3 mesiacov by mal byť vylúčený. Ďalší krok v skríningu donorov zahŕňa vyšetrenie krvi a stolice na vylúčenie chorôb potenciálne prenosných stolicou. Z týchto dôvodov musí byť stolica darcov negatívna na prítomnosť bežných črevných patogénov (Yersinia spp., Salmonella spp., Shigella spp., Campylobacter jejuni, Clostridium difficile, enteropatogénne Escherichia coli, Helicobacter pylori, parazity a ich vajíčka) a negatívna sérológia z krvi na syfilis, hepatitídu A, B a C a HIV1 a HIV2.
Príprava transplantačného materiálu
Na prípravu stolice pri FMT neexistuje štandardný protokol (tab). V doteraz publikovaných prácach autori pripravovali transplantačný materiál značne odlišnými spôsobmi, preto nasledovný popis prípravy je zovšeobecnením ich postupov. Stolica sa získa od darcu v deň transplantácie, pričom optimálne je použiť stolicu do 6 hodín po defekácii [5–10], maximálne do 24 hod [6,8]. Od 50 do 300 g stolice (v závislosti od publikovanej štúdie) [4] sa rozpustí v 200–500 ml fyziologického roztoku [4,11], vody [7,12] alebo iného dilučného materiálu (mlieko, jogurt) [13,14], homogenizuje a filtruje sa za účelom pretvorenia na tekutú kašu. Hamilton et al dokázali, že pri terapii recidivujúcich CDI boli zmrazené bakteriálne prípravky zo stolice darcov rovnako účinné ako čerstvé prípravky [15]. Postup pri príprave transplantačného materiálu je rovnaký pri všetkých spôsoboch aplikácie transplantátu.
Spôsob aplikácie
Cesty podávania materiálu pri FMT sú cez nazogastrickú sondu, nazojejunálnu sondu, sprejovaním pomocou kolonoskopie alebo rektálne klystírom (tab 1). Existujú obmedzené dôkazy o tom, ktorý spôsob aplikácie je najúčinnejší. Pri liečbe CDI je FMT cez nazojejunálnu sondu rovnako účinná ako cez kolonoskopiu [4,16]. Aplikácia stolice bude pravdepodobne závisieť od typu a anatomickej lokalizácie choroby, ale je nutné realizovať ďalšie štúdie, aby sa určil najlepší spôsob podávania pre každú indikáciu.
Tab. 1. Súhrn o fekálnej mikrobiálnej terapii 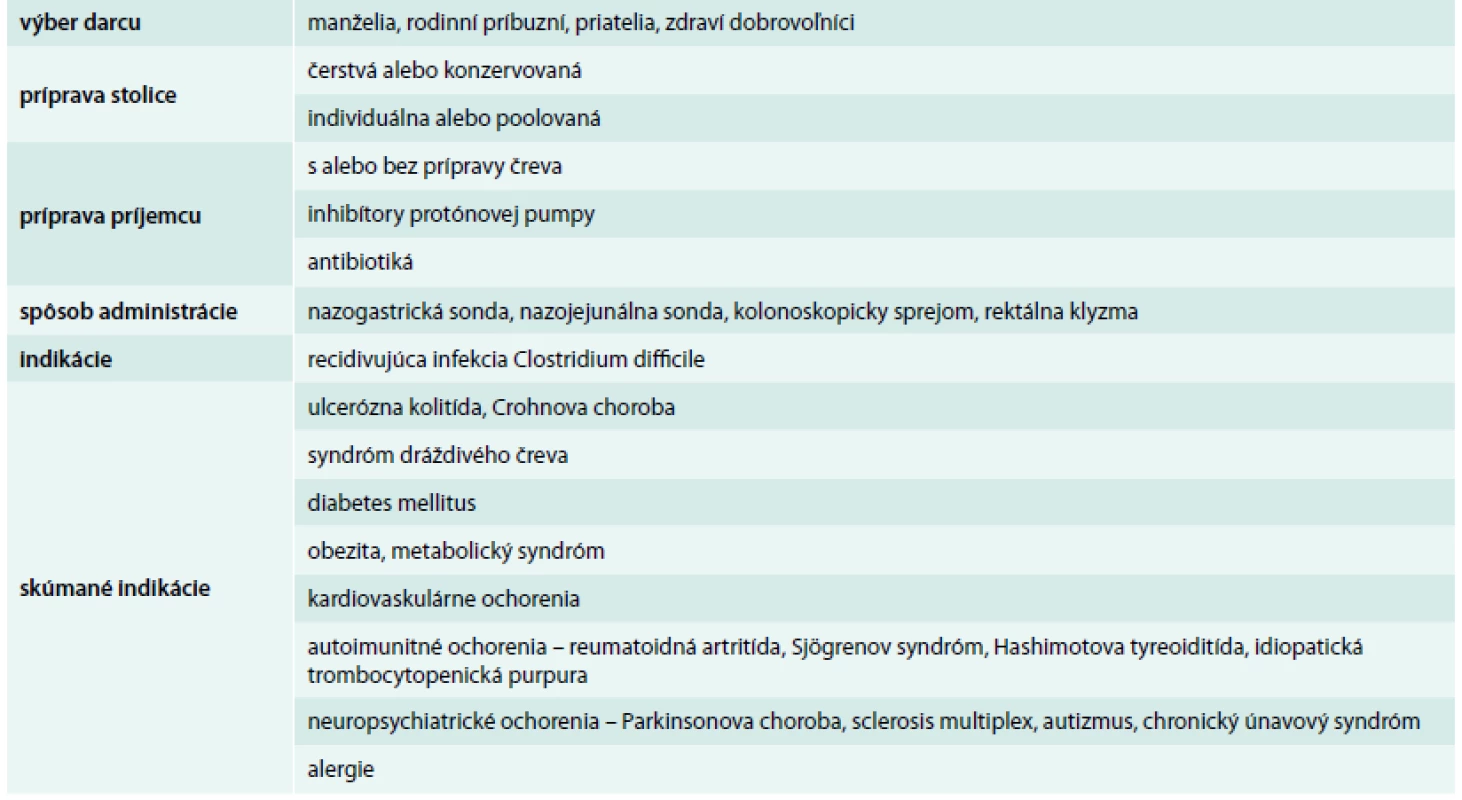
Príprava príjemcu
Ak sa fekálny materiál podáva sprejom pomocou kolonoskopie, príjemca podstúpi vyčistenie čriev ako pred klasickým kolonoskopickým vyšetrením. Takto sa vypláchnu preexistujúce baktérie a uľahčí sa mikroflóre darcu kolonizovať črevo príjemcu. Na udržanie fekálneho roztoku v čreve sa môže použiť loperamid (antidiarotikum). Ak sa materiál podáva cez nazojejunálnu sondu, najskôr sa podávajú inhibítory protónovej pumpy, aby sa zvýšila pravdepodobnosť prežitia transplantovaných baktérií. V niektorých prípadoch sa pred transplantáciou podávali antibiotiká, najčastejšie vankomycín, aby sa potlačila črevná mikroflóra príjemcu [17]. Rovnako aj v tomto prípade sú nutné ďalšie štúdie, ktoré by nám zodpovedali otázky o optimálnom prípravnom režime príjemcu.
Nežiaduce účinky
Z hľadiska závažných nežiaducich účinkov je FMT bezpečná terapeutická metóda. V systematickom prehľade o FMT v rámci CDI bolo hlásených 2,5 % (8/317 prípadov) nežiaducich účinkov. U asi 15 % pacientov s IBD, ktorí podstúpili FMT či už cestou nazojejunálnej sondy alebo sprejovaním kolonoskopicky, sa vyskytli vedľajšie účinky ako teplota, prechodná hnačka, kŕče v bruchu a zápcha. Teplota trvala niekoľko hodín až 2 dni od aplikácie FMT, u niektorých pacientov bola sprevádzaná triaškou a musel byť podaný paracetamol [18]. Prechodná zápalová odpoveď, ako je zvýšenie hodnoty C-reaktívneho proteínu a horúčka [17], a prechodná bakteriémia [19] boli pozorované u pacientov s IBD, zrejme z dôvodu narušenia integrity črevnej sliznice. Častejšie sa nežiaduce účinky vyskytujú, ak je FMT aplikovaná nazojejunálnou sondou. Potvrdzuje to aj štúdia o FMT u rekurentnej CDI, u ktorej sa až u 94 % pacientov vyskytla v deň podania infúzneho roztoku prechodná hnačka a u 31 % kŕče v bruchu [3]. Naopak u pediatrických pacientov s UC, u ktorých bola FMT aplikovaná cestou rektálnych klyziem, neboli hlásené žiadne závažné nežiaduce účinky [20]. Najviac obávaným nežiaducim účinkom je prenos infekčných patogénov. Doteraz boli hlásené len 2 prípady, pri ktorých mohlo dôjsť k prenosu infekčných agensov cestou FMT [21]. Z dlhodobého hľadiska je FMT bezpečná [22], hoci je stále nejasné, ako implantácia odlišnej črevnej mikroflóry ovplyvňuje fyziológiu hostiteľa v dlhodobom rozsahu.
Využitie FMT pri chorobách zažívacieho traktu
Infekcia Clostridium difficile (CDI)
Clostridium difficile je grampozitívna anaeróbna sporulujúca baktéria, ktorá produkuje toxíny. Zapríčiňuje pseudomembranóznu kolitídu a spôsobuje výrazné hnačky u pacientov so zníženou imunitou alebo po antibiotickej liečbe. Na liečbu CDI sa používa metronidazol, vankomycín, fidaxomicín, ale u 15–30 % pacientov sa príznaky infekcie po vysadení týchto antibiotík vrátia. Clostridium difficile prerastá v hrubom čreve, pretože je redukovaná diverzita črevnej mikroflóry podávaním antibiotík. U rekurentných CDI by bola liečba FMT potencionálne veľmi prínosná, pretože môže obnoviť rozmanitosť črevnej mikroflóry na podobnú, ako je u zdravých darcov. Niekoľko nekontrolovaných štúdií v poslednej dobe dokázalo účinnosť FMT pri rekurentnej CDI, pričom miera úspešnosti bola približne 90 % [15,22,23].
Prvá randomizovaná kontrolovaná štúdia o FMT pre CDI bola uverejnená v roku 2013: van Nood et al pozorovali markantnú účinnosť FMT u rekurentnej CDI [3]. Súbor 44 pacientov s recidivujúcou CDI bol rozdelený do 3 skupín. V 1. skupine bol iniciálne podaný vankomycín, následne bola realizovaná laváž hrubého čreva a bol podaný infúzny roztok darcovských fekálií cez nazojejunálnu sondu. 2. skupina pacientov bola liečená len vankomycínom v štandardnom režime a v 3. skupine bol štandardne podávaný vankomycín a jednorazovo realizovaná laváž hrubého čreva. Vymiznutie hnačiek spôsobených Clostridium difficile bol pozorovaný v skupine s FMT u 13 zo 16 pacientov (81 %), v druhej skupine u 4 z 13 pacientov (31 %) a v poslednej skupine u 3 z 13 pacientov (23 %). Traja pacienti z 1. skupiny, ktorí nezareagovali na prvú podanú infúziu, dostali druhú infúziu od iného darcu a následne došlo k rezolúcii stavu u 2 pacientov. Pre výrazne vyššiu účinnosť FMT v porovnaní s vankomycínom bola štúdia skoršie ukončená. U príjemcov FMT sa dokázala zvýšená rôznorodosť fekálnych baktérií po liečbe, a preto sa FMT stala sľubnou terapiou. Americká gastroenterologická spoločnosť uznala jej význam a v spolupráci s Americkým úradom na kontrolu jedla a liečiv (Food and Drug Administration – FDA) oficiálne schválila FMT ako liečebnú metódu rekurentnej CDI [24]. V súčasnosti je FMT zaradená do algoritmu liečby klostrídiových infekcií, a to aj v Českej republike, kde pomocou FMT bolo úspešne liečených viacero pacientov [25,26].
Zápalové ochorenia čriev
Zápalové ochorenia čriev (inflammatory bowel diseases – IBD) zahŕňajú ulceróznu kolitídu (UC) a Crohnovu chorobu (CD). Presné príčiny IBD sú neznáme, ale niektoré hypotézy predpokladajú, že u geneticky náchylných osôb môžu zmeny v črevnej mikroflóre vyvolávať aberantnú imunitnú reakciu v čreve, čo vedie ku IBD [27]. Hoci nebolo dokázané, že príčinou IBD sú konkrétne infekčné baktérie, pribúda dôkazov, že u IBD sú prítomné zmeny črevnej mikroflóry, dysbióza, ako napr. zmenené zloženie, zmenšená diverzita v črevnom mikrobióme.
Prvé využitie FMT u UC bolo publikované už v roku 1989. Nedávno boli zverejnené 2 prospektívne nekontrolované štúdie FMT u dospelých pacientov s UC, jedna zahŕňala 5 a druhá 6 pacientov [17,28], v prvej aplikovali FMT cestou nazojejunálnej sondy a kolonoskopom, v druhej len kolonoskopom. V každej zo štúdií boli u príjemcov FMT priebežne analyzované zloženie a zmeny baktérií v črevnej mikroflóre pomocou 16S rRNA gén-cieleného pyrosekvenovania. Ani jeden z 11 pacientov nedosiahol klinickú remisiu UC po FMT, avšak bola pozorovaná významná zmena v zložení črevnej mikrobiálnej flóry u 8 z 11 pacientov. Jedna z týchto štúdií hlásila, že úspešná kolonizácia darcovskej mikroflóry korelovala u 1 pacienta s klinickým zlepšením, ale druhá štúdia toto zistenie nepotvrdila. Obe práce zhodne potvrdili, že u väčšiny pacientov boli zmeny v črevnej mikroflóre len dočasné, čo naznačuje, že za účelom udržania zmenenej črevnej mikroflóry je nutné FMT pravidelne opakovať.
V roku 2015 kolektív Paula Moayyediho z Ontaria publikoval výsledky dvojito zaslepenej randomizovanej štúdie na 70 pacientoch s aktívnou UC. FMT bola aplikovaná klyzmou 1krát týždenne po dobu 6 týždňov. V 7. týždni dosiahlo remisiu 24 % pacientov s FMT oproti 5 % s placebom [29]. Zaujímavým faktom je, že 7 z 9 pacientov, ktorí dosiahli remisiu, obdržali transplantát od jedného darcu. Tento poznatok naznačuje, že úspešnosť FMT môže výrazne závisieť na výbere darcu a je to aj možné vysvetlenie nekoherentných výsledkov obdobných štúdií v minulosti.
Nedávno bola ukončená klinická štúdia vo fáze I pre FMT u 10 detských pacientov s UC s miernou až stredne ťažkou aktivitou choroby, kde bola FMT podávaná cestou rektálnych klyziem a bola preukázaná vysoká miera klinickej odozvy (79 %) počas 1. týždňa [20]. Tento objav je v kontraste s vyššie spomínanými štúdiami. Jednou z možných hypotéz vysvetľujúcich túto diskrepanciu je, že istá populácia pacientov s UC, ale nie všetky, môže mať benefit z FMT. Angelberger et al identifikovali fylotypy pacientov, ktoré svedčia o závažnosti ochorenia a úspechu FMT, ako je nadmerné zastúpenie Enterobacteriaceae a nízke zastúpenie Lachnospiraceae v črevnej mikroflóre [17]. Ide o dôležitý faktor pri výbere podskupiny pacientov s UC, ktorí budú citliví na FMT. Nutné je poznamenať, že v štúdiách boli používané rozdielne protokoly v postupe FMT, čo môže mať vplyv na výsledky o účinnosti FMT a je nevyhnutné optimalizovať FMT protokoly.
Údaje o účinnosti FMT u CD sú obmedzené, pretože k dnešnému dňu sú v literatúre hlásené len 2 prípady. Query et al aplikovali FMT pomocou kolonoskopie u pacienta s CD s recidivujúcou CDI, u ktorého vymizli klinické symptómy po FMT [19]. Gordon a Harbord popísali prípad pacienta s ťažkou CD, ktorý odpovedal na FMT podanú cestou hornej časti gastrointestinálneho traktu [30].
Napriek obmedzeným údajom o účinnosti FMT u IBD rastie záujem o jej využitie v ich liečbe a v súčasnosti je na internetovej stránke www.clinicaltrials.gov zaregistrovaných 17 štúdií pre FMT u IBD. Zostáva veľa nezodpovedaných otázok, ktoré sa týkajú použitia FMT u IBD, vrátane výberu pacientov, výberu darcu, prípravy transplantátu, cesty a frekvencie podávania.
Využitie FMT pri iných chorobách
Metabolické ochorenia
Obezita, diabetes mellitus a metabolický syndróm sú epidémie modernej spoločnosti. V literatúre existujú viaceré štúdie, ktoré potvrdili na zvieracích modeloch, že črevná mikroflóra má ústrednú úlohu v patogenéze týchto endokrinných ochorení. Zmeny v črevnej mikroflóre boli zaznamenané u obéznych ľudí s posunom ku kmeňom Firmicutes a Bacteroidetes [31]. Nedávne štúdie preukázali, že u pacientov s diabetes mellitus 2. typu je znížený počet baktérií Clostridiales spp. (Roseburia a Faecalibacterium prausnitzii), ktoré produkujú mastné kyseliny s krátkym reťazcom vrátane butyrátu, a naopak je zvýšený počet non-butyrát produkujúcich Clostridiales spp. a patogénov ako je Clostridium clostridioforme [32]. Vrieze et al realizovali dvojito zaslepenú randomizovanú kontrolovanú štúdiu ohľadom FMT na 18 mužoch s metabolickým syndrómom cestou hornej časti zažívacieho traktu. Polovica z nich dostala FMT od chudých darcov (alogénna skupina), druhá polovica dostávala vlastné autotransplantáty (kontrolná skupina). Štúdia dokázala, že sa po 6 týždňoch v alogénnej skupine výrazne zvýšili inzulínová citlivosť ako aj množstvo butyrát produkujúcich črevných agensov, zatiaľ čo žiadna významná zmena nenastala v kontrolnej skupine [33]. Z tohto dôvodu možno špekulovať, že FMT má potenciál na zvýšenie inzulínovej citlivosti u ľudí.
Ďalšie štúdie preukázali, že črevná mikroflóra pôsobí ako epigenetický faktor progresie nealkohololovej steatózy pečene, čo je metabolický syndróm, ktorý sa prejavuje v pečeni. Črevná dysbióza spôsobuje narušenie črevnej bariéry, tým dochádza k translokácii mikrobiálnych produktov a následne k zápalu a poškodeniu pečene [34].
Kardiovaskulárne ochorenia
V súčasnosti je známa úzka asociácia medzi črevnou translokáciou a rizikom kardiovaskulárnych ochorení. Probiotické baktérie modifikujú enterohepatálnu cirkuláciu, čím zvyšujú sérovú koncentráciu nekonjugovaných žlčových kyselín a súčasne znižujú absorpciu lipidov z čreva a plazmatickú hladina cholesterolu [35]. Tieto dáta naznačujú, že črevná mikroflóra je nepriamy rizikový marker kardiovaskulárnych chorôb a je nádejným terapeutickým cieľom týchto ochorení.
Iné ochorenia
Význam črevnej mikroflóry bol dokázaný štúdiami v etiopatogenéze aj iných chorôb, u ktorých sa FMT realizuje experimentálne alebo sa predpokladá jej využitie v liečbe len hypoteticky. Patria sem neuropsychiatrické choroby ako Parkinsonova choroba, sclerosis multiplex, autizmus, chronický únavový syndróm, autoimunitné ochorenia ako reumatoidná artritída, Sjögrenov syndróm, Hashimotova tyreoiditída, idiopatická trombocytopenická purpura a rôzne alergické ochorenia.
Záver
Vďaka novým poznatkom o etiopatogenéze chorôb súčasná medicína predpokladá, že u ľudí hrá črevná mikroflóra významnú úlohu pri fyziologických aj patologických stavoch. Bola jasne preukázaná účinnosť FMT v náprave dysbiózy črevnej mikroflóry pri rekurentnej CDI. V súčasnosti tiež prebiehajú klinické štúdie ohľadom využitia FMT v indikáciach, ako je metabolický syndróm, diabetes mellitus, nealkoholová steatohepatitída, autoimunitné a kardiovaskulárne ochorenia. Hoci FMT je nádejnou liečebnou metódou, zostáva mnoho nezodpovedaných otázok ohľadom vhodných indikácií, výberu pacientov a optimálnych protokolov prípravy a aplikácie fekálneho materiálu, a preto je potrebný ďalší výskum.
Doručeno do redakce 28. 10. 2015
Přijato po recenzi 23. 11. 2015
MUDr. Igor Šturdík
igor.sturdik@gmail.com
V. interná klinika LF UK a UN Bratislava, Slovenská republika
www.unb.sk
Zdroje
1. Eiseman B, Silen W, Bascom GS et al. Fecal enema as an adjunct in the treatment of pseudomembranous enterocolitis. Surgery 1958; 44(5): 854–859.
2. Di Bella S, Drapeau C, García-Almodóvar E et al. Fecal microbiota transplantation: the state of the art. Infect Dis Rep 2013; 5(2): e13. Dostupné z DOI: http://dx.doi.org/10.4081/idr.2013.e13.
3. van Nood E, Vrieze A, Nieuwdorp M et al. Duodenal Infusion of Donor Feces for Recurrent Clostridium difficile. N Engl J Med 2013; 368(5): 407–415.
4. Gough E, Shaikh H, Manges AR. Systematic Review of Intestinal Microbiota Transplantation (Fecal Bacteriotherapy) for Recurrent Clostridium difficile Infection. Clin Infect Dis 2011; 53(10): 994–1002.
5. Aas J, Gessert CE, Bakken JS. Recurrent Clostridium difficile colitis: case series involving 18 patients treated with donor stool administered via a nasogastric tube. Clin Infect Dis 2003; 36(5): 580–585.
6. Bakken JS, Borody T, Brandt LJ et al. Treating Clostridium difficile infection with fecal microbiota transplantation. Clin Gastroenterol Hepatol 2011; 9(12): 1044–1049.
7. Kelly CR, de Leon L, Jasutkar N. Fecal microbiota transplantation for relapsing Clostridium difficile infection in 26 patients: methodology and results. J Clin Gastroenterol 2012; 46(2): 145–149.
8. Landy J, Al-Hassi HO, McLaughlin SD et al. Review article: faecal transplantation therapy for gastrointestinal disease. Aliment Pharmacol Ther 2011; 34(4): 409–415.
9. Mellow MH, Kanatzar A. Colonoscopic fecal bacteriotherapy in the treatment of recurrent Clostridium difficile infection – results and follow-up. J Okla State Med Assoc 2011; 104(3): 89–91.
10. Rohlke F, Surawicz CM, Stollman N. Fecal flora reconstitution for recurrent Clostridium difficile infection: results and methodology. J Clin Gastroenterol 2010; 44(8): 567–570.
11. Borody TJ, Paramsothy S, Agrawal G. Fecal Microbiota Transplantation: Indications, Methods, Evidence, and Future Directions. Curr Gastroenterol Rep 2013; 15(8): 337.
12. Satokari R, Fuentes S, Mattila E et al. Fecal Transplantation Treatment of Antibiotic-Induced, Noninfectious Colitis and Long-Term Microbiota Follow-Up. Case Rep Med 2014; 2014 : 913867. Dostupné z DOI: http://dx.doi.org/10.1155/2014/913867.
13. Gustafsson A, Berstad A, Lund-Tonnesen S et al. The effect of faecal enema on five microflora-associated characteristics in patients with antibiotic-associated diarrhoea. Scand J Gastroenterol 1999; 34(6): 580–586.
14. Gustafsson A, Lund-Tonnesen S, Berstad A et al. Faecal short-chain fatty acids in patients with antibiotic-associated diarrhoea, before and after faecal enema treatment. Scand J Gastroenterol 1998; 33(7): 721–727.
15. Hamilton MJ, Weingarden AR, Sadowsky MJ et al. Standardized Frozen Preparation for Transplantation of Fecal Microbiota for Recurrent Clostridium difficile Infection. Am J Gastroenterol 2012; 107(5): 761–767.
16. Anderson JL, Edney RJ, Whelan K. Systematic review: faecal microbiota transplantation in the management of inflammatory bowel disease. Aliment Pharmacol Ther 2012; 36(6): 503–516.
17. Angelberger S, Reinisch W, Makristathis A et al. Temporal Bacterial Community Dynamics Vary Among Ulcerative Colitis Patients after Fecal Microbiota Transplantation. Am J Gastroenterol 2013; 108(10): 1620–1630.
18. Colman RJ, Rubin DT. Fecal microbiota transplantation as therapy for inflammatory bowel disease: a systematic review and meta-analysis. J Crohns Colitis 2014; 8(12): 1569–1581.
19. Quera R, Espinoza R, Estay C et al. Bacteremia as an adverse event of fecal microbiota transplantation in a patient with Crohn’s disease and recurrent Clostridium difficile infection. J Crohns Colitis 2014; 8(3): 252–253.
20. Kunde S, Pham A, Bonczyk S et al. Safety, Tolerability, and Clinical Response After Fecal Transplantation in Children and Young Adults With Ulcerative Colitis. J Pediatr Gastroenterol Nutr 2013; 56(6): 597–601.
21. Schwartz M, Gluck M, Koon S Norovirus gastroenteritis after fecal microbiota transplantation for treatment of Clostridium difficile infection despite asymptomatic donors and lack of sick contacts. Am J Gastroenterol 2013; 108(8): 1367.
22. Brandt LJ, Aroniadis OC, Mellow M et al. Long-Term Follow-Up of Colonoscopic Fecal Microbiota Transplant for Recurrent Clostridium difficile Infection. Am J Gastroenterol 2012; 107(7): 1079–1087.
23. Kelly CR, de Leon L, Jasutkar N. Fecal Microbiota Transplantation for Relapsing Clostridium difficile Infection in 26 Patients. J Clin Gastroenterol 2012; 46(2): 145–149.
24. Smith MB, Kelly C, Alm EJ. Policy: How to regulate faecal transplants. Nature 2014; 506(7488): 290–291.
25. Vejmelka J, Kohout P, Koten J et al. Fekální bakterioterapie a nové cesty v léčbě klostridiové střevní infekce. Prakt Lék 2014; 94(4): 195–200.
26. Polak P, Freibergerová M, Juránková J et al. První zkušenosti s fekální bakterioterapií v léčbě relabující pseudomembranózní kolitidy způsobené Clostridium difficile. Klin Mikrobiol Inf Lék 2011; 17(6): 214–217.
27. Sartor RB. Microbial Influences in Inflammatory Bowel Diseases. Gastroenterology 2008; 134(2): 577–594.
28. Kump PK, Gröchenig H-P, Lackner S et al. Alteration of Intestinal Dysbiosis by Fecal Microbiota Transplantation Does not Induce Remission in Patients with Chronic Active Ulcerative Colitis. Inflamm Bowel Dis 2013; 19(10): 2155–2165.
29. Moayyedi P, Surette MG, Kim PT et al. Fecal Microbiota Transplantation Induces Remission in Patients with Active Ulcerative Colitis in a Randomized Controlled Trial. Gastroenterology 2015; 149(1): 102–109.
30. Gordon H, Harbord M. A patient with severe Crohn’s colitis responds to Faecal Microbiota Transplantation. J Crohns Colitis 2014; 8(3): 256–257.
31. Armougom F, Henry M, Vialettes B et al. Monitoring bacterial community of human gut microbiota reveals an increase in Lactobacillus in obese patients and Methanogens in anorexic patients. PloS One 2009; 4(9): e7125. Dostupné z DOI: http://dx.doi.org/10.1371/journal.pone.0007125.
32. Qin J, Li Y, Cai Z et al. A metagenome-wide association study of gut microbiota in type 2 diabetes. Nature 2012; 490(7418): 55–60.
33. Vrieze A, Van Nood E, Holleman F et al. Transfer of Intestinal Microbiota From Lean Donors Increases Insulin Sensitivity in Individuals With Metabolic Syndrome. Gastroenterology 2012; 143(4): 913–916. Erratum in Gastroenterology 2013; 144(1): 250.
34. Schnabl B, Brenner DA. Interactions between the intestinal microbiome and liver diseases. Gastroenterology 2014; 146(6): 1513–1524.
35. Tuohy KM, Fava F, Viola R. “The way to a man’s heart is through his gut microbiota” – dietary pro - and prebiotics for the management of cardiovascular risk. Proc Nutr Soc 2014; 73(2): 172–185.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Otrava olovem – editorial
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2016 Číslo 2- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Nech brouka žít… Ať žije astma!
- Intermitentní hladovění v prevenci a léčbě chorob
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Chronická pankreatitida diagnostikovaná po první atace akutní pankreatitidy
- Antagonisté receptorů pro angiotenzin II (AT1-blokátory) v léčbě hypertenze
- Pacient si stěžuje na bolesti v páteři nebo na únavu a slabost. Jak rozeznám, zda je příčinou spondylartróza, věk nemocného anebo mnohočetný myelom?
- Racionální diagnostika cholangiokarcinomu
- Použití systémových glukokortikoidů v terapii infekčních nemocí
- Inhibitory protonové pumpy a jejich účinek na kosti
- Fekálna mikrobiálna terapia
- Těžká osteoporóza aneb Příběh chronické polékové hyponatremie
- Otrava olovem – překvapivá příčina bolestí břicha, obstipace a anémie
-
PRAXBIND® – nová jistota při léčbě perorálním antikoagulanciem PRADAXA®
Zpráva z odborného sympozia Další krok k bezpečnější antikoagulaci pořádaného Českou společností pro trombózu a hemostázu ČLS JEP ve spolupráci se společností Boehringer Ingelheim - Ivana Štětkářová (ed) et al. Moderní farmakoterapie v neurologii
- Ladislav Hagara. Ottova encyklopédia húb.
- Chronická pankreatitida diagnostikovaná po první atace akutní pankreatitidy – editorial
- Kortikosteroidy v léčbě infekčních nemocí – editorial
- Fekální transplantace střevní mikroflóry – editorial
- Otrava olovem – editorial
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Pacient si stěžuje na bolesti v páteři nebo na únavu a slabost. Jak rozeznám, zda je příčinou spondylartróza, věk nemocného anebo mnohočetný myelom?
- Kortikosteroidy v léčbě infekčních nemocí – editorial
- Otrava olovem – překvapivá příčina bolestí břicha, obstipace a anémie
- Antagonisté receptorů pro angiotenzin II (AT1-blokátory) v léčbě hypertenze
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



