-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
mikroRNA a vnitřní lékařství: od patofyziologie k novým diagnostickým a terapeutickým postupům
microRNA and internal medicine: from pathophysiology to the new diagnostic and therapeutic procedures
microRNAs (abbreviated miRNAs or miRs) represents one of the group of so called small non-coding RNAs which participate in the negative post-transcriptional regulation of gene expression. According to the base complementarity they target molecules of messenger RNAs (mRNAs) which results either in translational blockade or in degradation of target mRNA. One miRNA usually targets more mRNA and one mRNA is usually targeted by more than one miRNA – complicated and interconnected regulatory networks are thus created and their disruption leads to the abnormalities in development or results in the development of diseases. Within the past two decades, novel mechanisms were described that enable us to modulate miRNA levels (either causing upregulation or downregulation) – miRNAs can thus be considered as a novel potential group of therapeutic targets. First clinical trials using the blockade of liver specific miR-122 showed very promising results in the treatment of chronic hepatitis C virus infection. Results of preclinical and animal studies are also promising providing future rationale for the development of new therapeutics for various internal diseases including heart failure, bronchial asthma or inflammatory bowel diseases. Moreover, miRNAs are not only affecting the pathophysiology of internal diseases, but they can also reflect their presence – there is a group of miRNAs called extracellular, or circulating miRNAs, i.e. miRNAs that are present in extracellular space including all known body fluids such as plasma, serum, urine, saliva or sweat. Circulating miRNAs are stable; their levels are constant among the individuals of one species, methods determining their levels are reproducible and last but not least – levels of extracellular miRNAs differ between healthy and diseased individuals. They are released into the circulation either after the cell necrosis or by active transport. Except of being potential novel biomarkers, these miRNAs represent a novel mean of intercellular communication. Their levels thus reflect not only the organ damage but also the changes of the homeostasis during various illnesses. The aim of the current study is to provide the first insight into the miRNA world to clinicians, especially to internal medicine specialists. Using simple examples from clinical praxis or clinical pathophysiology, we are trying to present diagnostic and therapeutic potential that is hidden within these tiny interesting molecules.
Key words:
circulating microRNA – diagnostics – internal diseases – microRNA – therapy
Autoři: Jan Novák 1,2; Miroslav Souček 1
Působiště autorů: II. interní klinika LF MU a FN U sv. Anny v Brně 1; Fyziologický ústav LF MU v Brně 2
Vyšlo v časopise: Vnitř Lék 2016; 62(6): 477-485
Kategorie: Přehledné referáty
Souhrn
mikroRNA (zkráceně miRNA nebo miR) představují jednu ze skupin malých nekódujících RNA, které se podílejí na negativní posttranskripční regulaci genové exprese. Na podkladě komplementarity bází se vážou na cílové molekuly messengerové RNA (mRNA) a svou vazbou buď brání překladu mRNA do bílkoviny, nebo iniciují degradaci cílové mRNA. Jedna miRNA často cílí více různých mRNA a jedna mRNA je často cílem více různých miRNA – tímto způsobem vznikají rozsáhlé a propletené regulační sítě, jejichž narušení vede k poruchám vývoje tkání a orgánů a které je možné detekovat u řady různých onemocnění. Díky novým postupům, které nám umožňují hladiny miRNA modulovat (ať již navyšovat nebo snižovat) je možné miRNA považovat za novou skupinu terapeutických cílů, přičemž první klinické zkoušky s využitím blokády miR-122 v játrech již přinášejí své ovoce a ukazuje se, že terapie pomocí anti-miR-122 je možné využit v terapii chronické infekční hepatitidy C. Výsledky animálních studií pak dávají dobré předpoklady k tomu, že miRNA bude možné využít i v terapii dalších vnitřních onemocnění, včetně srdečního selhání, bronchiálního astmatu, či nespecifických střevních zánětů. Kromě zapojení miRNA do patofyziologie nemocí a možného terapeutického ovlivnění jejich hladin je intenzivně studován význam tzv. extracelulárních, též cirkulujících, miRNA, tj. miRNA přítomných v extracelulárním prostoru včetně všech známých tělních tekutin, jako je plazma, sérum, moč, sliny či pot. Cirkulující miRNA vykazují značnou stabilitu, jejich hladiny jsou konstantní u jedinců téhož druhu, stanovení těchto hladin je reproducibilní a co je nejdůležitější – hladiny extracelulárních miRNA se liší mezi jedinci zdravými a jedinci trpícími určitou nemocí. Do oběhu se dostávají pasivně při nekróze buněk, nebo jsou do něj aktivně pumpovány a zajišťují mezibuněčnou komunikaci mezi jednotlivými tkáněmi organizmu. Jejich hladiny tak mohou odrážet jak poškození tkání, tak změny ve vnitřním prostředí vyvolané přítomností nemoci. Cílem tohoto souhrnného článku je představit miRNA klinikům, zejména pak internistům. Na jednoduchých příkladech z klinické praxe nebo z klinické patofyziologie článek ukazuje jejich význam v patofyziologii vnitřních nemocí, poukázat na jejich možný léčebný potenciál a také na jejich možné využití v diagnostice vnitřních nemocí.
Klíčová slova:
cirkulující mikroRNA – diagnostika – mikroRNA – terapie – vnitřní nemociMalé nekódující RNA, mikroRNA a jejich funkce
Malé nekódující molekuly ribonukleových kyselin (RNA – ribonucleic acid) představují relativně nedávno objevené regulátory genové exprese [1]. Dle dřívějšího schématu, platného po více než 50 let a známého též jako dogma molekulární biologie, je genetická informace člověka uložena v molekulách deoxyribonukleové kyseliny (DNA – deoxyribonucleic acid), odkud jsou její úseky, označované jako geny, přepisovány do podoby přenašečové RNA (mRNA – messenger RNA) a vzniklé mRNA jsou matricí pro vznik bílkovin. Tyto mRNA jsou též známy jako „kódující“ RNA, protože ve své molekule kódují strukturu proteinů, avšak jejich podíl na genomu člověka tvoří pouze 1,5–2 % [2]. V posledních 2 dekádách se však náš náhled na definici slova „gen“ musel změnit, neboť se ukázalo, že velká část lidského genomu obsahuje nejen „protein-kódující geny“, ale také geny pro krátké (tj. dlouhé jen pár desítek nukleotidů) a nekódující (tj. nedávají vznik proteinům) molekuly RNA. Souhrnně se tyto molekuly RNA označují jako „malé nekódující RNA“ (sncRNA – small non-coding RNAs) a představují enormně rozsáhlou skupinu molekul, které se podílejí na regulaci genové exprese, a tím i na vývoji tkání a orgánů, na udržování homeostázy, avšak také na patogenezi řady onemocnění [1–3].
mikroRNA (miRNA, miR) jsou jednou z podskupin sncRNA o délce asi 22–24 nukleotidů. Jejich struktura je zakódována v genech, které jsou rozmístěny difuzně po celém našem genomu, ať již v intergenních oblastech (tj. v oblastech mezi známými protein-kódujícími geny) nebo v oblastech intragenních (tj. jsou např. uloženy v intronech již známých genů) [1]. Vznik miRNA je několikastupňový proces (obr. 1.1), který zahrnuje přepis DNA do molekuly primární miRNA (pri-miRNA) s využitím enzymu RNA-polymerázy, následně sestřih takto vzniklé pri-miRNA pomocí enzymu Drosha do podoby prekurzorové miRNA (pre-miRNA), jež je následně přemístěna z jádra buňky do cytosolu pomocí přenašečového systému exportin-5/RanGTP. pre-miRNA má charakteristický tvar vlásenky (obr. 1.2), která je v cytoplazmě rozštěpena pomocí enzymu Dicer – vzniká tak dvouvláknová zralá (maturovaná) molekula miRNA, v níž jedno vlákno (označované jako doprovodné) podléhá ve většině případů degradaci a druhé vlákno (označované jako vedoucí) vytvoří komplex s argonautovými proteiny [4]. Tento komplex nazýváme miRNA-indukovaný tlumící komplex (miRISC – miRNA-induced silencing complex), jehož cílem je utlumit expresi cílových genů. Na podkladě komplementarity bází (adenin-uracil, guanin-cytosin, tj. A-U, C-G) se miRNA váže na cílovou mRNA: je-li komplementarita bází úplná, následuje rozklad cílové mRNA; je-li komplementarita bází neúplná, způsobí vazba miRISC na cílovou mRNA blok translace, tj. takto zablokovaná mRNA nemůže být překládána do bílkovin. V obou případech zajišťuje miRISC tzv. negativní post-transkripční regulaci genové exprese, tj. svou vazbou na mRNA (tj. posttranskripčně) brání vzniku (tj. negativní regulace) cílových proteinů [4].
Obr. 1.1 a obr 1.2. Biogeneze a funkce mikroRNA 
1.1 Struktura mikroRNA je uložena v DNA. Z DNA miRNA vznikají přepisem pomocí enzymu RNA-polymerázy, čímž vzniká primární miRNA (pri-miRNA). Tato je následně štěpena enzymovým komplexem Drosha/DGCR8 za vzniku prekurzorové miRNA (pre-miRNA). pre-miRNA je transportována z jádra pomocí přenašečového komplexu Exportin-5/RanGTP, čímž se dostává do cytoplazmy, v níž je dále štěpena enzymem Dicer za vzniku zralých miRNA. Doprovodné vlákno zralé miRNA je po rozvinutí degradováno, hlavní vlákno je zavzato do komplexu s argonautovými proteiny za vzniku miRNAindukovaného tlumícího komplexu (miRISC). miRISC se váže na cílovou messengerovou RNA (mRNA): pokud je komplementarita bází úplná, dochází k její degradaci, je-li komplementarita neúplná, dochází k blokádě translace, a tím bloku vzniku bílkovin. 1.2 Struktura pre-miRNA: již po přepisu se jednovláknová molekula RNA na podkladě komplementarity bází skládá do podoby vlásenky („hairpin“). Regulace prostřednictvím miRNA je vysoce komplexní. Jedna miRNA poměrně často cílí na mRNA více různých proteinů; tyto proteiny mohou být součástí jedné signální/metabolické dráhy, nebo mohou patřit do několika různých drah [5]. Jako příklad uveďme miR-33: jedná se o miRNA důležitou pro metabolizmus cholesterolu, mastných kyselin i glukózy (to znamená, že ovlivňuje hladiny bílkovin/enzymů důležitých pro metabolizmus různých živin). V rámci metabolizmu cholesterolu tato miRNA cílí jak na molekuly důležité pro transport cholesterolu do žluče (např. transportéry závislé na přítomnosti adenozin-trisfosfátu, ABCB11, či ATP8B1), tak na molekuly zapojené do reverzního transportu cholesterolu z tkání do jater (např. ABCA1, ABCG1) [6,7]. Tímto způsobem ovlivňuje miR-33 metabolizmus cholesterolu na několika úrovních, a významně tak ovlivňuje jeho hladiny v krvi. Druhý stupeň komplexnosti vzniká tím, že jedna molekula mRNA je často cílem různých miRNA. Zůstaneme-li u metabolizmu cholesterolu, tak molekula ABCA1, která je kritická při transportu cholesterolu do lipoproteinových částic a pro vznik lipoproteinů o vysoké hustotě (HDL), je cílem nejen miR-33, ale také miR-10, miR-26, miR-27, miR-144, miR-145 a dalších miRNA [5]. S ohledem na výše řečené lze na miRNA nahlížet dvojím způsobem – některé miRNA se podílejí na jemném doladění („fine-tuning“) genové exprese a jiné miRNA představují významné regulátory genové exprese schopné přivést buňky do apoptózy, či naopak iniciovat jejich proliferaci (množení) a diferenciaci směrem k vybranému buněčnému typu.
mikroRNA v patofyziologii lidských onemocnění
Byť malé svou velikostí, jsou miRNA velké svým potencionálním významem. Zcela první miRNA, nazvaná lin-4, byla objevena v roce 1993 při studiích hlístice – háďátka obecného, Caenorhabditis elegans [8]. Na háďátku se ukázalo, že jsou miRNA nezbytné pro jeho zdárný vývoj a pro přechody z jednotlivých larválních stadií do stadia dospělého. Uplynulo pak asi 10 let a ukázalo se, že miRNA tvoří evolučně starou a vysoce zakonzervovanou skupinu molekul (jejich geny se v průběhu evoluce jen minimálně měnily a člověk má podobné geny kódující miRNA jako třeba laboratorní potkan, makak či zmiňované háďátko) a je možné je detekovat i u člověka [9]. Podobně jako u háďátka pak bylo i u dalších organizmů popsáno, že zvýšení, či snížení hladin určitých miRNA během embryogeneze či organogeneze vede k opoždění, či naopak urychlení diferenciace nebo množení buněk a může vyústit v řadu vývojových abnormalit [3]. Jedním z nejznámějších pokusů v této oblasti bylo vygenerování tzv. double knock-out myší, u nichž byla zcela vyřazena funkce Diceru (enzymu nezbytného pro zpracování miRNA, viz výše), což vyústilo v časnou embryonální letalitu, zřejmě na podkladě poruchy expanze žloutkového váčku a narušení vaskulogeneze [10].
První studie, které asociovaly změněnou expresi miRNA s lidskými onemocnění, pocházely z oblasti hematoonkologie. Calin et al prokázali, že u jedinců s chronickou lymfocytární leukemií (CLL) dochází ke snížení exprese miR-15 a miR-16 [11]. Již dlouhodobě je známo, že u jedinců s CLL dochází často k deleci genového lokusu 13q14. Právě v tomto krátkém úseku se nachází geny pro obě zmiňované miRNA, a tím že u jedinců s CLL dochází ke ztrátě jejich genů, dochází i ke snížení hladin miR-15 a miR-16, které se za běžných okolností chovají jako nádorové supresory. Jejich absence vede k odolnosti nádorových buněk vůči apoptóze (mj. proto, že tyto miRNA cílí antiapoptotický gen BCL2, jehož hladiny jsou v postižených buňkách zvýšeny) a urychluje proliferaci postižených buněk, což se následně projeví vznikem CLL [12]. Stejná skupina také prokázala, že zhruba 50 % genů pro miRNA se nachází v oblastech, které jsou deletovány nebo amplifikovány u různých typů rakoviny [13] a další práce v oblasti onkologie na sebe poté nedaly dlouho čekat – ukázalo se, že u různých typů nádorů dochází k dysregulaci hladin celých skupin miRNA, což může u postižených jedinců korelovat s přežitím, rychlostí růstu nádoru, či odezvou na terapii, neboť byly postupně popsány miRNA nezbytné pro procesy metastazování, apoptózy, či nádorové neoangiogeneze. Pro detailnější přehled miRNA zapojených do rozvoje nádorů odkazujeme na českou monografii O. Slabého a kolektivu, mikroRNA v onkologii [14].
Další nemoci, včetně všech oblastí vnitřního lékařství, na sebe nenechaly dlouho čekat a v dnešní době lze s nadsázkou říci, že se miRNA podílejí na patogenezi všech vnitřních nemocí, od problematiky plicní (např. chronická obstrukční plicní nemoc či asthma bronchiale [15]), gastroenterologické (např. vředová choroba gastroduodena [16], nespecifické střevní záněty [17]), hematologické (anémie a hematologické malignity [18]) přes problematiku kardioangiologickou (ischemická choroba srdeční a infarkt myokardu [19], srdeční selhání [20], hypertenze [21], arteriální aneuryzmata [22]), metabolických onemocnění (diabetes mellitus či dyslipidemie [23], osteoporóza [24]) či nefrologickou (tubulointersticiální poškození či chronická ledvinná nedostatečnost [25]) až k problematice infekčních a kožních onemocnění (např. hepatitida C [26], psoriáza [27]).
mikroRNA v terapii vnitřních nemocí
Z odstavců výše jasně vyplývá, že hladiny miRNA se u různých onemocnění mění, jak vlivem nemoci samotné, tak působením rizikových faktorů, léčiv nebo jiných vnějších vlivů. Otázkou nyní zůstává, zda by bylo možné tyto hladiny nějakým způsobem ovlivnit k našemu prospěchu, tedy zda je možné miRNA využít v terapii onemocnění. Odpověď není zatím zcela jednoduchá, avšak výsledky řady preklinických a pilotních klinických studií ukazují, že jednoho dne se terapie s pomocí nekódujících RNA možná dočkáme [28].
Obecně je možné na terapii s využitím miRNA nahlížet následovně: jsou-li hladiny miRNA vlivem nemoci sníženy, je nutné tyto hladiny substituovat/navýšit, a naopak jsou-li hladiny miRNA zvýšeny, je nutné tyto amplifikované miRNA zablokovat. Doplnění chybějících miRNA je značně složitější proces a zahrnuje v sobě využití demetylujících agens (léky, které demetylují ty části DNA, které kódují miRNA a tím umožní jejich vyšší expresi), virových vektorů (s využitím adenovirů lze do genomu buňky vpravit sekvenci miRNA, kterou chceme doplnit a zvýšit tak její expresi) nebo lze využít léky, které zefektivní biogenezi miRNA (např. látka enoxacin zvyšuje účinnost enzymu Dicer, a tím tvorbu miRNA) [1,28]. Zablokování zvýšeně exprimovaných miRNA pak lze dosáhnout s využitím tzv. „anti-miRNAs“ nebo „miRNA-inhibitorů“ – základem těchto molekul je sekvence RNA, která přesně odpovídá sekvenci miRNA, jejíž hladiny chceme snížit. Na podkladě komplementarity bází a s využitím jevu tzv. RNA-interference se podaný miRNA-inhibitor spojí s cílenou miRNA, čímž zablokuje její funkci. Molekula miRNA-inhibitorů jako taková je však málo stabilní (např. hrozí její štěpení vlivem lytických enzymů přítomných v plazmě) a je nutné ji modifikovat (např. napojením na molekuly cholesterolu), čímž je dosaženo větší stability, delšího eliminačního poločasu a dalších výhodných vlastností [28]. V preklinických zkouškách se setkáme s oběma výše popsanými postupy, do klinické praxe se však v současné době jeví jako slibnější využití miRNA-inhibitorů [29].
Přehled studií využívajících anti-miRNA v terapii různých vnitřních nemocí je uveden v tab. 1. Z této tabulky si dovolujeme upozornit na klinickou studii NCT01200420 (clinicaltrials.gov), která již proběhla ve fázi IIa v roce 2013 [26]. Tato studie zahrnovala 36 jedinců s chronickou hepatitidou C infikovaných virem HCV1. Postiženým jedincům byla po dobu 5 týdnů subkutánně aplikována léčivá látka zvaná miRavirsen, což je miRNA-inhibitor cílený proti jaterně specifické miR-122. Tato miRNA kromě toho, že plní řadu fyziologických funkcí v hepatocytech, je „zneužívána“ virem hepatitidy C a její přítomnost je nezbytná pro jeho efektivní replikaci. Blokáda miR-122 s využitím miRavirsenu způsobila signifikantní redukci v celkové náloži virové RNA a tento efekt přetrval i po ukončení aktivní terapie. U 5 jedinců dokonce virová RNA nebyla detekována vůbec [26]. Výsledky této první studie jasně poukazují na potenciál, který by miRNA mohly znamenat jako nové terapeutické cíle v léčbě vnitřních nemocí.
Tab. 1. mikroRNA s terapeutickým potenciálem u vnitřních nemocí 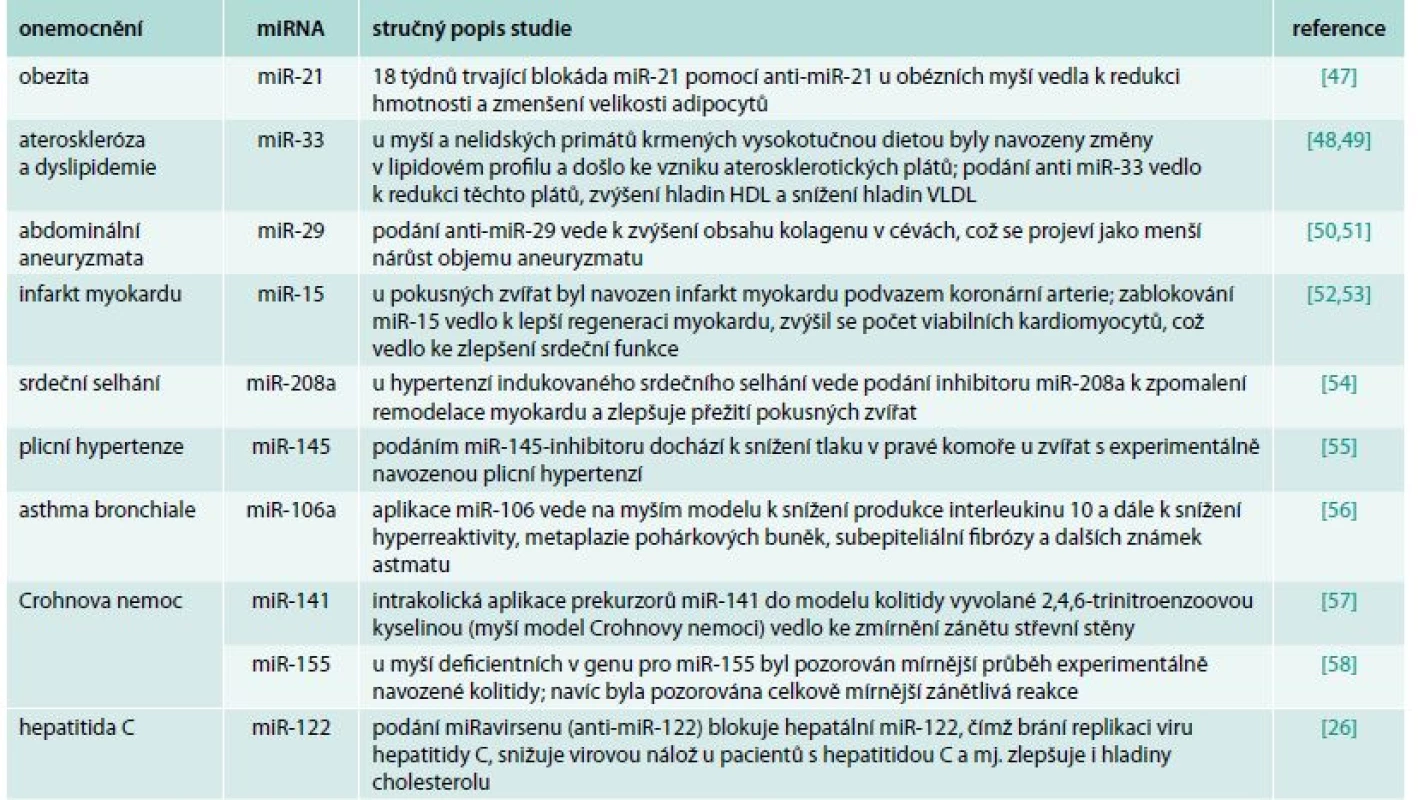
mikroRNA jako diagnostické a prognostické markery
Další přelomový objev týkající se možného využití miRNA v medicíně přišel v roce 2008. Ukázalo se, že krom výše popsaných intracelulárních funkcí je možné miRNA detekovat i v extracelulárním prostoru, ať již se jedná o krevní deriváty (sérum či plazmu), moč, sliny, pot, nebo třeba mateřské mléko [30–33]. Hladiny miRNA je možné stanovit reproducibilně a jsou stabilní u jedinců jednoho druhu, jsou nenáhodné a mění se vlivem různých patologických stavů [30,31]. O některých miRNA se dokonce hovoří jako o „tkáňově specifických“, což znamená, že jejich exprese je v určité tkáni 40krát vyšší než v ostatních tkáních [34] a přítomnost takových miRNA v krvi by mohla odrážet poškození jednotlivých orgánů. Význam cirkulujících miRNA se nyní jeví trojí – mohou sloužit jako biomarkery nemoci či poškození orgánu; mohou predikovat další vývoj nemoci a v neposlední řadě představují nové mediátory mezibuněčné komunikace [35].
Potencionální využití miRNA jako biomarkerů různých nemocí je nyní intenzivně studováno ve všech oborech vnitřního lékařství – tento zájem odstartovalo v již zmiňovaném roce 2008 zjištění, že miR-141 je zvýšena v séru u pacientů s rakovinou prostaty [30], dále že miRNA důležité pro funkci placenty jsou zvýšeny v cirkulaci u těhotných žen [32] a že u pacientů s rakovinou plic, kolorekta a u pacientů s diabetem dochází ke změnám hladin specifických miRNA oproti zdravým osobám [31]. Cirkulující miRNA se v cirkulaci nacházejí v komplexu s proteiny nebo uschované uvnitř apoptotických tělísek (tělísek vznikajících při zániku buňky apoptózou), exozomů a mikrovezikul nebo dokonce uvnitř lipoproteinových částic (HDL či LDL) [35]. Bylo prokázáno, že po infarktu myokardu se do oběhu dostávají srdečně specifické miRNA (např. miR-1, miR-208, či miR-499) a jejich hladiny se mění podobně, jako hladiny srdečně specifických troponinů [36]. Celé skupiny miRNA jsou v krvi dysregulovány u pacientů s diabetem a jsou asociovány s rozvojem jednotlivých skupin diabetických komplikací [37]; z nich uveďme např. miR-126, která byla prokazatelně snížena u diabetiků s preklinickým i klinickým postižením tepen dolních končetin [38], nebo např. miR-375, jejíž hladiny na myším modelu streptozocinem indukovaného diabetu korelovaly s odumíráním B-buněk pankreatu [39]. Jiné studie ukazují, že se hladiny miRNA mění u kuřáků, u nichž odrážejí vznik plicní fibrózy, jiné cirkulující miRNA jsou v krvi zvýšeny u jedinců s CHOPN či astmatem [40]. Přehled zmíněných a dalších příkladů možného využití miRNA v diagnostice vnitřních nemocí udává tab. 2. Obecně lze na základě doposud provedených studií říci, že hladiny cirkulujících miRNA citlivě odrážejí patologické změny v organizmu, jejich hladiny odrážejí nejen přítomnost, ale i aktivitu onemocnění a je možné je reprodukovatelně stanovit z tělních tekutin. Další studie zaměřené na precizní stanovení specificity a senzitivity na větších kohortách pacientů s různými onemocněními nebo studie cílící na nalezení vhodné vnitřní kontroly (tj. konkrétní miRNA, jejíž hladiny se nemění vlivem žádné z nemocí) jsou potřebné k tomu, aby se doposud zjištěné informace mohly převést do klinické praxe.
Tab. 2. mikroRNA jako diagnostické markery ve vnitřním lékařství 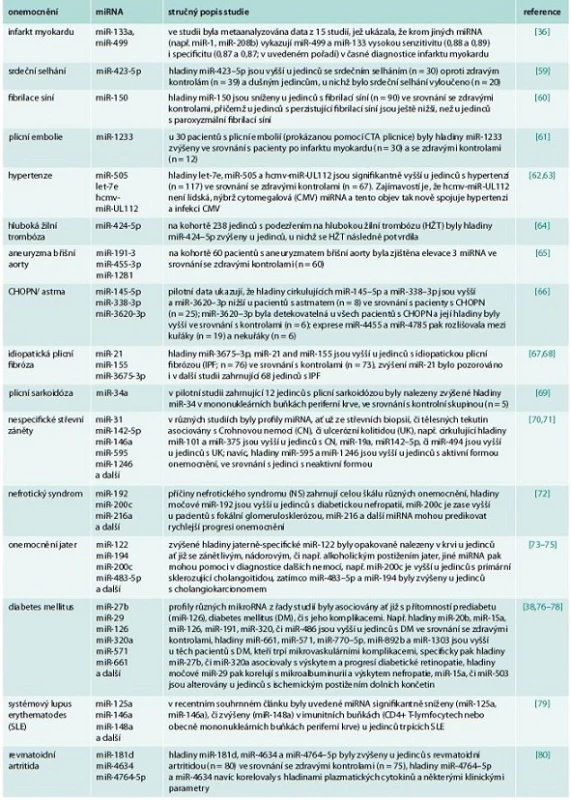
Kromě diagnostického potenciálu přinášejí změněné hladiny cirkulujících miRNA i řadu dalších informací o dalším možném vývoji onemocnění, tj. mají i prediktivní význam. U již zmiňovaných pacientů po infarktu myokardu predikují přetrvávající zvýšené hladiny miR-1 vznik časného srdečního selhání (do 1 roku od prodělání infarktu) nebo vznik závažných arytmií [41]. Již zmiňovaná miR-126 patří do panelu 5 miRNA (spolu s miR-15a, miR-320, miR-223 a miR-28–3p), jejichž změněné hladiny predikují budoucí vznik diabetu u jedinců, kteří jsou ještě normoglykemičtí – s využitím 10 let zamražených vzorků séra a dat z následného 10letého sledování vzorkovaných pacientů to ukazují data od Zampetaki et al [38]. U pacientů s různými typy rakoviny korelují hladiny cirkulujících miRNA s prognózou, přežitím pacientů či mohou predikovat odezvu nádoru na léčbu [42]. S ohledem na možný prognostický potenciál, který by cirkulující miRNA mohly mít ve všech oblastech vnitřního lékařství, jsou nyní potřeba dlouhodobé studie na velkých kohortách, které tento potenciál potvrdí, či vyvrátí.
V neposlední řadě je nutné u cirkulujících miRNA zmínit i potencionální význam v mezibuněčné komunikaci. Zde hrají roli zejména miRNA uschované v apoptotických tělíscích, exozomech a lipoproteinových částicích; ukazuje se, že takto uschované miRNA jsou do extracelulárních tělísek aktivně pumpovány při jejich vzniku a mohou z nich být aktivně předány do cílových buněk, což následně vede k ovlivnění genové exprese v těchto buňkách [35]. V rámci této práce uvedeme 3 zajímavé příklady umožňující náhled do patofyziologie vnitřních nemocí.
miR-126
miR-126, již zmiňovaná v kontextu biomarkerů postižení cév u pacientů s diabetem, je uvolňována do cirkulace buňkami, které vlivem aterosklerotického poškození a ischemie vstupují do apoptózy; miR-126 je uschovaná v apoptotických tělíscích a v této podobě je následně vychytána v okolních endotelových buňkách (parakrinní komunikace), v nichž navozuje odolnost vůči apoptóze a ovlivňuje infiltraci cévní stěny tkáňovými makrofágy [43]. miR-126 se tak významným způsobem podílí na ochraně endotelu před aterosklerózou.
miR-150
Další miRNA, miR-150, je aktivně uvolňována do oběhu makrofágy [44]. miR-150 produkovaná makrofágy je uschovaná do exozomů (malých membránových váčků), v této podobě se dostává k buňkám cévní stěny a zde podporuje neoangiogenezu, tedy tvorbu nových cév. Jedna ze signálních molekul, která by se tohoto procesu mohla účastnit je vaskulární endoteliální růstový faktor (VEGF), jehož hladiny jsou pomocí miR-150 nepřímo navyšovány [45]. Aplikace miR-150 by tak jednoho dne mohla být potencionálně užitečná u onemocnění spojených s ischemií.
miR-223
Jako poslední, avšak neméně důležitou, uvádíme roli miR-223; tato miRNA představuje nejvíce zastoupenou miRNA v lipoproteinových částicích [46] a recentní studie ukazují, že miR-223 je možné z HDL transportovat do endotelových buněk, v nichž se tato miRNA normálně nenachází, a přítomnost miR-223 v endotelových buňkách snižuje expresi intracelulární adhezní molekuly (ICAM1), která je důležitá pro rozvoj aterosklerózy. Extracelulární přenos miRNA pomocí HDL nám tak částečně osvětluje dlouhodobě známý fakt, že HDL je považován za „hodný cholesterol“.
Závěr
Z výše uvedeného jasně vyplývá, že mikroRNA představují potencionálně velice významnou skupinu biomolekul, jejichž zapojení do patofyziologie řady onemocnění již nemůže být v současnosti zpochybňováno. Animální i humánní studie modulující hladiny miRNA v organizmu, tkáni či jen na buněčných kulturách pak ukazují na jejich terapeutický potenciál v léčbě různých nemocí. Využití panelů (vybraných skupin) cirkulujících miRNA pak představuje nový atraktivní způsob jak zjednodušit diagnostiku některých onemocnění a jak zefektivnit sledování pacientů s cílem vytvoření terapie na míru toho či onoho konkrétního pacienta a splňuje předpoklady pro budoucí využití v rámci personalizované medicíny. Nutno podotknout, že stále zůstává řada nevyřešených otázek, ať již se jedná o možné nežádoucí vedlejší účinky terapie pomocí miRNA nebo o přesné určení senzitivity a specifity cirkulujících miRNA v diagnostice; rovněž není možné zanedbat fakt, že pro stanovení hladin miRNA jsou stále využívány technicky náročné metody izolace a časově náročné metody stanovení založené na polymerázové řetězové reakci v reálném čase (tzv. real-time PCR) – i zrychlení, standardizace a vylepšení těchto metod bude časem nezbytné pro zavedení miRNA do běžné klinické praxe. Po překonání všech těchto technických obtíží však mají miRNA velký předpoklad stát se novými pomocníky v péči o pacienty s vnitřními onemocněními.
Vznik této studie byl podpořen z projektu „Kardiovaskulární systém: od modelu přes terapii k prevenci“ číslo MUNI/A/1365/2015 podpořeného z prostředků účelové podpory na specifický vysokoškolský výzkum, kterou poskytlo MŠMT v roce 2016.
MUDr. Jan Novák
jan.novak@fnusa.cz
II. interní klinika LF MU a FN u sv. Anny v Brně
www.fnusa.cz
Doručeno do redakce 19. 11. 2015
Přijato po recenzi 21. 5. 2016
Zdroje
1. Esteller M. Non-coding RNAs in human disease. Nat Rev Genet 2011; 12(12): 861–874.
2. Alexander RP, Fang G, Rozowsky J et al. Annotating non-coding regions of the genome. Nat Rev Genet 2010; 11(8): 559–571.
3. Sayed D, Abdellatif M. MicroRNAs in development and disease. Physiol Rev 2011; 91(3): 827–887.
4. Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell 2004; 116(2): 281–297.
5. Novák J, Bienertová-Vašků J, Kára T et al. MicroRNAs involved in the lipid metabolism and their possible implications for atherosclerosis development and treatment. Mediators Inflamm 2014; 2014 : 275867. Dostupné z DOI: http://dx.doi.org/10.1155/2014/275867.
6. Rayner KJ, Suárez Y, Dávalos A et al. MiR-33 contributes to the regulation of cholesterol homeostasis. Science 2010; 328(5985): 1570–1573.
7. Allen RM, Marquart TJ, Albert CJ et al. miR-33 controls the expression of biliary transporters, and mediates statin - and diet-induced hepatotoxicity. EMBO Mol Med 2012; 4(9): 882–895.
8. Lee RC, Feinbaum RL, Ambros V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14. Cell 1993; 75(5): 843–854.
9. Pasquinelli AE, Reinhart BJ, Slack F et al. Conservation of the sequence and temporal expression of let-7 heterochronic regulatory RNA. Nature 2000; 408(6808): 86–89.
10. Yang WJ, Yang DD, Na S et al. Dicer is required for embryonic angiogenesis during mouse development. J Biol Chem 2005; 280(10): 9330–9335.
11. Calin GA, Dumitru CD, Shimizu M et al. Frequent deletions and down-regulation of micro - RNA genes miR15 and miR16 at 13q14 in chronic lymphocytic leukemia. Proc Natl Acad Sci USA 2002; 99(24): 15524–15529.
12. Cimmino A, Calin GA, Fabbri M et al. miR-15 and miR-16 induce apoptosis by targeting BCL2. Proc Natl Acad Sci USA 2005; 102(39): 13944–13949.
13. Calin GA, Sevignani C, Dumitru CD et al. Human microRNA genes are frequently located at fragile sites and genomic regions involved in cancers. Proc Natl Acad Sci USA 2004; 101(9): 2999–3004.
14. Slabý O, Svoboda M et al. mikroRNA v onkologii. Galén: Praha 2012. ISBN 978–80–7262–587–1.
15. Ebrahimi A, Sadroddiny E. MicroRNAs in lung diseases: Recent findings and their pathophysiological implications. Pulm Pharmacol Ther 2015; 34 : 55–63.
16. Bansal A, Hong X, Lee IH et al. MicroRNA Expression can be a Promising Strategy for the Detection of Barrett’s Esophagus: A Pilot Study. Clin Transl Gastroenterol 2014; 5: e65. Dostupné z DOI: http://dx.doi.org/10.1038/ctg.2014.17.
17. Kalla R, Ventham NT, Kennedy NA et al. MicroRNAs: new players in IBD. Gut 2015; 64(3): 504–517.
18. O’Connell RM, Baltimore D. MicroRNAs and hematopoietic cell development. Curr Top Dev Biol 2012; 99 : 145–174.
19. Economou EK, Oikonomou E, Siasos G et al. The role of microRNAs in coronary artery disease: From pathophysiology to diagnosis and treatment. Atherosclerosis 2015; 241(2): 624–633.
20. Kalozoumi G, Yacoub M, Sanoudou D. MicroRNAs in heart failure: Small molecules with major impact. Glob Cardiol Sci Pract 2014; 2014(2): 79–102. Dostupné z DOI: http://dx.doi.org/10.5339/gcsp.2014.30.
21. Shi L, Liao J, Liu B et al. Mechanisms and therapeutic potential of microRNAs in hypertension. Drug Discov Today 2015; 20(10): 1188–1204.
22. Fu X, Zhou Y, Cheng Z et al. MicroRNAs: Novel Players in Aortic Aneurysm. BioMed Res Int 2015; 2015 : 831641. Dostupné z DOI: http://dx.doi.org/10.1155/2015/831641.
23. Price NL, Ramírez CM, Fernández-Hernando C. Relevance of microRNA in metabolic diseases. Crit Rev Clin Lab Sci 2014; 51(6): 305–320.
24. Tang P, Xiong Q, Ge W et al. The role of microRNAs in osteoclasts and osteoporosis. RNA Biol 2014; 11(11): 1355–1363.
25. Trionfini P, Benigni A, Remuzzi G. MicroRNAs in kidney physiology and disease. Nat Rev Nephrol 2015; 11(1): 23–33.
26. Janssen HLA, Reesink HW, Lawitz EJ et al. Treatment of HCV infection by targeting microRNA. N Engl J Med 2013; 368(18): 1685–1694.
27. Lambert JLW, Grine L, Van Gele M. microRNAs in psoriasis: leaders or followers? Br J Dermatol 2015; 173(2): 323.
28. van Rooij E, Olson EN. MicroRNA therapeutics for cardiovascular disease: opportunities and obstacles. Nat Rev Drug Discov 2012; 11(11): 860–872.
29. van Rooij E, Purcell AL, Levin AA. Developing microRNA therapeutics. Circ Res 2012; 110(3): 496–507.
30. Mitchell PS, Parkin RK, Kroh EM et al. Circulating microRNAs as stable blood-based markers for cancer detection. Proc Natl Acad Sci USA 2008; 105(30): 10513–10518.
31. Chen X, Ba Y, Ma L et al. Characterization of microRNAs in serum: a novel class of biomarkers for diagnosis of cancer and other diseases. Cell Res 2008; 18(10): 997–1006.
32. Gilad S, Meiri E, Yogev Y et al. Serum microRNAs are promising novel biomarkers. PloS One 2008; 3(9): e3148. Dostupné z DOI: http://dx.doi.org/10.1371/journal.pone.0003148.
33. Weber JA, Baxter DH, Zhang S et al. The microRNA spectrum in 12 body fluids. Clin Chem 2010; 56(11): 1733–1741.
34. Lagos-Quintana M, Rauhut R, Yalcin A et al. Identification of Tissue-Specific MicroRNAs from Mouse. Curr Biol 2002; 12(9): 735–739.
35. Kinet V, Halkein J, Dirkx E et al. Cardiovascular extracellular microRNAs: emerging diagnostic markers and mechanisms of cell-to-cell RNA communication. Front Genet 2013; 4 : 214.
36. Cheng C, Wang Q, You W et al. MiRNAs as biomarkers of myocardial infarction: a meta-analysis. PloS One 2014; 9(2): e88566. Dostupné z DOI: http://dx.doi.org/10.1371/journal.pone.0088566.
37. Figueira MF, Monnerat-Cahli G, Medei E et al. MicroRNAs: potential therapeutic targets in diabetic complications of the cardiovascular and renal systems. Acta Physiol Oxf Engl 2014; 211(3): 491–500.
38. Zampetaki A, Kiechl S, Drozdov I et al. Plasma microRNA profiling reveals loss of endothelial miR-126 and other microRNAs in type 2 diabetes. Circ Res 2010; 107(6): 810–817.
39. Erener S, Mojibian M, Fox JK et al. Circulating miR-375 as a biomarker of β-cell death and diabetes in mice. Endocrinology 2013; 154(2): 603–608.
40. Wang M, Huang Y, Liang Z et al. Plasma miRNAs might be promising biomarkers of chronic obstructive pulmonary disease. Clin Respir J 2016; 10(1): 104–111.
41. Zhang R, Niu H, Ban T et al. Elevated plasma microRNA-1 predicts heart failure after acute myocardial infarction. Int J Cardiol 2013; 166(1): 259–260.
42. Zhao Q, Cao J, Wu YC et al. Circulating miRNAs is a potential marker for gefitinib sensitivity and correlation with EGFR mutational status in human lung cancers. Am J Cancer Res 2015; 5(5): 1692–1705.
43. Zernecke A, Bidzhekov K, Noels H et al. Delivery of microRNA-126 by apoptotic bodies induces CXCL12-dependent vascular protection. Sci Signal 2009; 2: ra81. Dostupné z DOI: <http://doi: 10.1126/scisignal.2000610>.
44. Li J, Zhang Y, Liu Y et al. Microvesicle-mediated transfer of microRNA-150 from monocytes to endothelial cells promotes angiogenesis. J Biol Chem 2013; 288(32): 23586–23596.
45. Liu Y, Zhao L, Li D et al. Microvesicle-delivery miR-150 promotes tumorigenesis by up-regulating VEGF, and the neutralization of miR-150 attenuate tumor development. Protein Cell 2013; 4(12): 932–941.
46. Wagner J, Riwanto M, Besler C et al. Characterization of levels and cellular transfer of circulating lipoprotein-bound microRNAs. Arterioscler Thromb Vasc Biol 2013; 33(6): 1392–1400.
47. Seeger T, Fischer A, Muhly-Reinholz M et al. Long-term inhibition of miR-21 leads to reduction of obesity in db/db mice. Obes Silver Spring Md 2014; 22(11): 2352–2360.
48. Rayner KJ, Esau CC, Hussain FN et al. Inhibition of miR-33a/b in non-human primates raises plasma HDL and lowers VLDL triglycerides. Nature 2011; 478(7369): 404–407.
49. Najafi-Shoushtari SH, Kristo F, Li Y et al. MicroRNA-33 and the SREBP host genes cooperate to control cholesterol homeostasis. Science 2010; 328(5985): 1566–1569.
50. Boon RA, Seeger T, Heydt S et al. MicroRNA-29 in aortic dilation: implications for aneurysm formation. Circ Res 2011; 109(10): 1115–1119.
51. Maegdefessel L, Azuma J, Toh R et al. Inhibition of microRNA-29b reduces murine abdominal aortic aneurysm development. J Clin Invest 2012; 122(2): 497–506.
52. Hullinger TG, Montgomery RL, Seto AG et al. Inhibition of miR-15 protects against cardiac ischemic injury. Circ Res 2012; 110(1): 71–81.
53. Porrello ER, Johnson BA, Aurora AB et al. MiR-15 family regulates postnatal mitotic arrest of cardiomyocytes. Circ Res 2011; 109(6): 670–679.
54. Montgomery RL, Hullinger TG, Semus HM et al. Therapeutic inhibition of miR-208a improves cardiac function and survival during heart failure. Circulation 2011; 124(14): 1537–1547.
55. Caruso P, Dempsie Y, Stevens HC et al. A role for miR-145 in pulmonary arterial hypertension: evidence from mouse models and patient samples. Circ Res 2012; 111(3): 290–300.
56. Sharma A, Kumar M, Ahmad T et al. Antagonism of mmu-mir-106a attenuates asthma features in allergic murine model. J Appl Physiol (1985) 2012; 113(3): 459–464.
57. Huang Z, Shi T, Zhou Q et al. miR-141 Regulates colonic leucocytic trafficking by targeting CXCL12β during murine colitis and human Crohn’s disease. Gut 2014; 63(8): 1247–1257.
58. Singh UP, Murphy AE, Enos RT et al. miR-155 deficiency protects mice from experimental colitis by reducing T helper type 1/type 17 responses. Immunology 2014; 143(3): 478–489.
59. Tijsen AJ, Creemers EE, Moerland PD et al. MiR423–5p as a circulating biomarker for heart failure. Circ Res 2010; 106(6): 1035–1039.
60. Liu Z, Zhou C, Liu Y et al. The expression levels of plasma micoRNAs in atrial fibrillation patients. PloS One 2012; 7(9): e44906. Dostupné z DOI: http://dx.doi.org/10.1371/journal.pone.0044906.
61. Kessler T, Erdmann J, Vilne B et al. Serum microRNA-1233 is a specific biomarker for diagnosing acute pulmonary embolism. J Transl Med 2016; 14(1): 120.
62. Yang Q, Jia C, Wang P et al. MicroRNA-505 identified from patients with essential hypertension impairs endothelial cell migration and tube formation. Int J Cardiol 2014; 177(3): 925–934.
63. Li S, Zhu J, Zhang W et al. Signature microRNA expression profile of essential hypertension and its novel link to human cytomegalovirus infection. Circulation 2011; 124(2): 175–184.
64. Wang X, Sundquist K, Elf JL et al. Diagnostic potential of plasma microRNA signatures in patients with deep-vein thrombosis. Thromb Haemost 2016; 116(2). [Epub ahead of print].
65. Zhang W, Shang T, Huang C et al. Plasma microRNAs serve as potential biomarkers for abdominal aortic aneurysm. Clin Biochem 2015; 48(15): 988–992.
66. Wang M, Huang Y, Liang Z et al. Plasma miRNAs might be promising biomarkers of chronic obstructive pulmonary disease. Clin Respir J 2016; 10(1): 104–111.
67. Li P, Li J, Chen T et al. Expression analysis of serum microRNAs in idiopathic pulmonary fibrosis. Int J Mol Med 2014; 33(6): 1554–1562.
68. Yang G, Yang L, Wang W et al. Discovery and validation of extracellular/circulating microRNAs during idiopathic pulmonary fibrosis disease progression. Gene 2015; 562(1): 138–144.
69. Jazwa A, Kasper L, Bak M et al. Differential Inflammatory MicroRNA and Cytokine Expression in Pulmonary Sarcoidosis. Arch Immunol Ther Exp (Warsz) 2014; 63(2): 139–146.
70. Schaefer JS, Attumi T, Opekun AR et al. MicroRNA signatures differentiate Crohn’s disease from ulcerative colitis. BMC Immunol 2015; 16 : 5. Dostupné z DOI: <http://dx.doi.org/10.1186/s12865–015–0069–0>.
71. Krissansen GW, Yang Y, McQueen FMM et al. Overexpression of miR-595 and miR-1246 in the Sera of Patients with Active Forms of Inflammatory Bowel Disease. Inflamm Bowel Dis 2015; 21(3): 520–530.
72. Szeto CC. Urine miRNA in nephrotic syndrome. Clin Chim Acta 2014; 436 : 308–313.
73. Bernuzzi F, Marabita F, Lleo A et al. Serum micrornas as novel biomarkers for primary sclerosing cholangitis and cholangiocarcinoma. Clin Exp Immunol 2016; 185(1): 61–71.
74. Roderburg C, Benz F, Vargas Cardenas D et al. Elevated miR-122 serum levels are an independent marker of liver injury in inflammatory diseases. Liver Int 2015; 35(4): 1172–1184.
75. McCrae JC, Sharkey N, Webb DJ et al. Ethanol consumption produces a small increase in circulating miR-122 in healthy individuals. Clin Toxicol Phila 2016; 54(1): 53–55.
76. Zampetaki A, Willeit P, Burr S et al. Angiogenic microRNAs Linked to Incidence and Progression of Diabetic Retinopathy in Type 1 Diabetes. Diabetes 2016; 65(1): 216–227.
77. Wang C, Wan S, Yang T et al. Increased serum microRNAs are closely associated with the presence of microvascular complications in type 2 diabetes mellitus. Sci Rep 2016; 6 : 20032. Dostupné z DOI: http://dx.doi.org/10.1038/srep20032.
78. Raffort J, Hinault C, Dumortier O et al. Circulating microRNAs and diabetes: potential applications in medical practice. Diabetologia 2015; 58(9): 1978–1992.
79. Stypińska B, Paradowska-Gorycka A Cytokines and MicroRNAs as Candidate Biomarkers for Systemic Lupus Erythematosus. Int J Mol Sci 2015; 16(10): 24194–24218.
80. Wang W, Zhang Y, Zhu B et al. Plasma microRNA expression profiles in Chinese patients with rheumatoid arthritis. Oncotarget 2015; 6(40): 42557–42568.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Roční sledování vedlejších účinků podávání sitagliptinu u pacientů s diabetem 2. typu – editorialČlánek Perkutánní endoskopická gastrostomie: analýza praxe v endoskopickém centru terciární lékařské péčeČlánek Roční sledování vedlejších účinků podávání sitagliptinu u pacientů s diabetes mellitus 2. typuČlánek Kardiomyopatie v MR obraze
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2016 Číslo 6- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Roční sledování vedlejších účinků podávání sitagliptinu u pacientů s diabetem 2. typu – editorial
- Kardiomyopatie v MR obraze – editorial
- Neinfekční a nenádorové lymfadenopatie – editorial
- Perkutánní endoskopická gastrostomie: analýza praxe v endoskopickém centru terciární lékařské péče
- Diabetic Kidney Disease 3rd stage – laboratory markers of mineral bone disorder
- Dlouhodobá léčba tromboembolické nemoci u pacientů se zhoubným nádorem
- Roční sledování vedlejších účinků podávání sitagliptinu u pacientů s diabetes mellitus 2. typu
- Akútne príčiny náhlych úmrtí u pacientov so závažnou hypoglykémiou
- Kardiomyopatie v MR obraze
- Studie HOPE-3: statiny snižují kardiovaskulární příhody u pacientů s intermediárním rizikem ICHS
- mikroRNA a vnitřní lékařství: od patofyziologie k novým diagnostickým a terapeutickým postupům
- Aplikační technika inzulinu u dospělých pacientů s diabetem
- Sinusová histiocytóza s masivní lymfadenopatií: FDG-PET/CT dokumentovaná parciální remise po léčbě 2-chlorodeoxyadenozinem
-
Odešel prof. MUDr. Bořivoj Semrád, CSc.
*7. 11. 1938 †19. 6. 2016 -
Bolest v diabetologické ambulanci
Zpráva z IX. mezioborového setkání diabetologických týmů, tentokrát s algeziology, psychiatry, psychology a psychoterapeuty - Symposium of the International Atherosclerosis Society – Anitschkow Days
- Debora Karetová, Jan Bultas. Farmakoterapie tromboembolických stavů
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Sinusová histiocytóza s masivní lymfadenopatií: FDG-PET/CT dokumentovaná parciální remise po léčbě 2-chlorodeoxyadenozinem
- Neinfekční a nenádorové lymfadenopatie – editorial
- Aplikační technika inzulinu u dospělých pacientů s diabetem
- Kardiomyopatie v MR obraze
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



