-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Endokrinní orbitopatie: aktuální pohled klinického endokrinologa
Endocrine orbitopathy: the present view of a clinical endocrinologist
Graves’ orbitopathy (GO) occurs in 25–50 % cases of Graves’ disease. Only in 5 % of patients the eye threatening GO is present. About 5–10 % and 10 % cases are present in euthyroid and hypothyroid patients respectively. All patients with GO should be assessed for activity (clinical activity score – CAS) and severity of the disease. Basic preconditions of the treatment are maintenance of euthyroidism, an effort to stop smoking, and referring of patients with moderate to severe and sight threatening GO to specialized thyroid eye centers. The first line treatment includes maintenance of wet eye (lubricants), supplementation of selenium deficiency, intravenous glucocorticoids, radiotherapy and surgery. Cases with moderate to severe GO should be treated with intravenous glucocorticoids in thyroid eye centers, however, the risk/benefit ratio in all cases should be considered. Cases with sight threatening GO should be immediately referred to thyroid eye centers, high-dose intravenous glucocorticoids are administered, and when the clinical response is absent within 2 weeks, surgical orbital decompression is recommended. Other immunosuppressive drugs (cyclosporine, mycophenolate mofetil) or biological therapy (teprotumumab) are not routinely recommended because of lack of evidence obtained by randomized controlled trials.
Key words:
clinical activity score – dysthyroid optic neuropathy – Graves’ orbitopathy – intravenous glucocorticoids – mycophenolate mofetil
Autori: Jan Jiskra
Pôsobisko autorov: III. interní klinika 1. LF UK a VFN v Praze
Vyšlo v časopise: Vnitř Lék 2017; 63(10): 690-696
Kategória: Přehledné referáty
Súhrn
Endokrinní orbitopatie (EO) se vyskytuje u 25–50 % pacientů s Gravesovou-Basedowovou chorobou. Většinou je lehká, zrak je ohrožen asi u 5 % pacientů. U 5–10 % může probíhat bez tyreoidální dysfunkce a až 10 % pacientů se vyskytne ve spojení s hypotyreózou. U každé EO by měla být provedena klinická klasifikace aktivity (CAS skóre) a závažnosti choroby. Základní podmínky léčby jsou udržení normální tyreoidální funkce, intervence směřující k zanechání kouření a u pacientů se střední až těžkou a zrak ohrožující EO odeslání do specializovaného centra. Základními léčebnými možnostmi jsou lokální léčba k udržení vlhkého oka (lubrikanty – umělé slzy), suplementace selenového deficitu, intravenózní glukokortikoidy, radioterapie a chirurgické metody. Střední až těžká aktivní EO se primárně léčí intravenózními glukokortikoidy ve specializovaných centrech, vždy je však třeba zvažovat individuální přínosy a rizika. Zrak ohrožující EO je indikací k okamžitému odeslání pacienta do specializovaného centra, podání pulzů intravenózních glukokortikoidů ve vyšší dávce, a pokud není do 2 týdnů odpověď, je na místě chirurgická dekomprese orbity. Rutinní použití jiných imunosupresiv (především cyklosporin a mykofenolát mofetil) nebo biologické léčby (především teprotumumab) nelze zatím pro nedostatek důkazů doporučit.
Klíčová slova:
dystyreózní neuropatie optického nervu – endokrinní orbitopatie – intravenózní glukokortikoidy – mykofenolát mofetil – skóre klinické aktivityÚvod
Klinicky významná endokrinní orbitopatie (EO) je ve srovnání s ostatními tyreopatiemi poměrně vzácné onemocnění. Incidence aktivní střední až těžké a zrak ohrožující EO se udává asi 16 žen a 3 muži na 100 000 obyvatel ročně [31], je ale závislá na geografické oblasti. Jakékoliv klinické známky jsou ale přítomny až u 25–50 % pacientů s Gravesovou-Basedowovou (GB) chorobou a CT či MR známky EO u 90 % pacientů s GB chorobou [4,12]. Většinou je EO lehká, zrak je ohrožen jen u 5 % pacientů [5]. U 5–10 % pacientů může probíhat EO bez tyreoidální dysfunkce a až 10 % EO se vyskytne ve spojení s hypotyreózou (jde buď o pacienty s autoimunitní hypotyreózou, nebo pacienty léčené pro GB chorobu) [5,31].
Patogeneze
Patogeneticky jde o autoimunitní odpověď namířenou proti receptoru TSH nebo i jiným dosud neznámým antigenům na strukturách orbity (fibroblasty, okohybné svaly, tuk, pojivová tkáň). V časných stadiích dochází k aktivaci především Th1 imunitní odpovědi s produkcí příslušných cytokinů (IFNγ, IL2, IL12, TNFα, GM-CSF), v pozdější stadiích se aktivuje Th2 imunitní odpověď (IL4, IL5, IL9, IL10, IL14, TGFβ) [4] a stoupá produkce protilátek proti TSH receptoru (TRAK), které u většiny pacientů (ale ne vždy) korelují s aktivitou EO [10,13,19]. Jsou ale popsány i případy EO s negativními TRAK.
Rizikové a zhoršující faktory
Dosud známými rizikovými a zhoršujícími faktory vzniku a průběhu EO je kromě vlastní GB choroby na prvním místě kouření, které zvyšuje riziko vzniku EO de novo (např. u pacientů s GB chorobou léčených radiojodem 131I), zhoršuje její průběh a snižuje reakci na léčbu, dále tyreoidální dysfunkce, ozáření radiojodem 131I (podle některých údajů dochází až u 15 % pacientů léčených radiojodem 131I pro GB chorobu ke zhoršení či vzniku EO de novo, zejména u kuřáků, a pokud dojde k rozvoji postradiační hypotyreózy, která není adekvátně léčená), zevní ozáření krku a horní poloviny těla a vysoké titry TRAK (> 7,5 IU/l při použití jediné standardizované metody s WHO referenčním standardem MRC 90/672) [5–7].
Následky a komplikace
Hlavními komplikacemi EO jsou:
- poškození zrakového nervu kompresí (DON – dystyreózní neuropatie optického nervu, která se projeví ztrátou barvocitu, snížením zrakové ostrosti nebo poruchou zorného pole)
- poškození a ulcerace rohovky při protruzi bulbu a lagoftalmu (ohrožení rohovky bývá většinou spojeno s nepřítomností Bellova fenoménu – stáčení bulbů vzhůru při pohybu předmětu proti oku simulujícím ohrožení oka)
- dvojité vidění – diplopie (intermitentní: přítomné jen při únavě očí, nekonstantní: přítomné jen při pohledu určitým směrem, konstantní: přítomné stále)
Klasifikace a vyšetření
Správná klasifikace onemocnění je zásadní pro racionální indikaci terapie, především systémové imunosuprese, která může mít závažné nežádoucí účinky. V současné době bychom se měli řídit podle klasifikace, kterou na základě předchozích schémat navrhla Evropská pracovní skupina pro endokrinní orbitopatii EUGOGO (Consensus statement of the European Group on Graves’ orbitopathy on management of GO) [5,6], a kterou s drobnými úpravami doporučuje i ATA (American Thyroid Association) [3,27]. Vychází se z oddělené klasifikace aktivity a závažnosti. Pro určení aktivity bylo upraveno původní 10bodové Mouritsovo skóre klinické aktivity CAS z roku 1989 [22] tak, že byly vypuštěny poslední 3 body a za aktivní EO se považuje přítomnost ≥ 3 bodů.
Skóre klinické aktivity endokrinní orbitopatie (EO) dle EUGOGO 2008 (za přítomnost každého příznaku 1 bod)
- spontánní retrobulbární bolest
- bolest při pohledu nahoru či dolů
- zarudnutí víček
- zarudnutí spojivky
- otok víčka
- zánětlivý otok karunkuly
- otok spojivky
EO – endokrinní orbitopatie EUGOGO – Consensus statement of the European Group on Graves’ orbitopathy on management of GO
K hodnocení závažnosti se používá klasická Wernerova klasifikace NOSPECS (tab. 1) [33] nebo jednodušší podle EUGOGO (tab. 2) [5]. Podle EUGOGO má lehká EO jen malý vliv na kvalitu života pacientů, není při ní ohrožen zrak, a proto není odůvodněná systémová imunosuprese nebo chirurgická intervence. Střední až těžká EO neohrožuje zrak, má však natolik významný vliv na každodenní kvalitu života pacientů, že je oprávněná systémová imunosuprese u aktivní EO nebo chirurgická intervence u neaktivní EO s vědomím možných rizik nežádoucích účinků. U zrak ohrožující EO je přítomno poškození rohovky nebo komprese optického nervu, což je důvodem k neodkladné intervenci systémovou imunosupresí, a pokud není účinná, pak k chirurgické dekompresi. K hodnocení kvality života doporučuje EUGOGO použít dotazník, který je ke stažení na webu: http://www.eugogo.eu/downloads.html. Kromě klinického vyšetření očí můžeme získat informaci o aktivitě onemocnění vyšetřením protilátek TRAK v séru (u jednotlivých případů poměrně dobře korelují se změnami aktivity v průběhu onemocnění a jeho léčby, někdy však selhávají však v určení vstupní aktivity a predikce klinického průběhu – EO s nízkými vstupními titry TRAK mohou mít závažný průběh a naopak) [5,10,13,19]. Vyšetření TSH je důležité z důvodu základního požadavku udržení normální tyreoidální funkce při léčbě všech případů EO. Pokud jsou nějaké pochybnosti o správnosti diagnózy EO (např. u jednostranného exoftalmu), pak je nutné k vyloučení jiné příčiny provést MRI nebo CT orbit. Tyto metody se však příliš nehodí k určení aktivity. K hodnocení aktivity EO je u nás poměrně často využívána ultrasonografie (USG) okohybných svalů, při které rozšíření, snížená echogenita a neostré ohraničení svědčí pro aktivní myopatii. Indikací k sonografii orbit však není každá aktivní EO, jak je někdy mylně interpretováno. USG okohybných svalů by se měla provádět, pouze pokud jsou z klinického vyšetření nějaké pochybnosti o aktivitě u střední až těžké EO, tj. v případech, u nichž není z klinického vyšetření jasná indikace k systémové imunosupresi nebo jsou pochybnosti o jejím „risk/benefit“ poměru. Druhou možnou indikací je ověření nízké aktivity a stability onemocnění (ultrasonograficky lze prokázat fibrotizaci okohybných svalů) před korekčními oftalmochirurgickými výkony. Podmínkou vyšetření je dostatečná zkušenost s touto metodou a interpretace výsledku musí být vždy prováděna v kontextu klinického obrazu a laboratorních nálezů. USG na rozdíl od CT a MR neumí odlišit jiné závažné příčiny exoftalmu.
Tab. 1. Klasifikace závažnosti endokrinní orbitopatie NOSPECS. 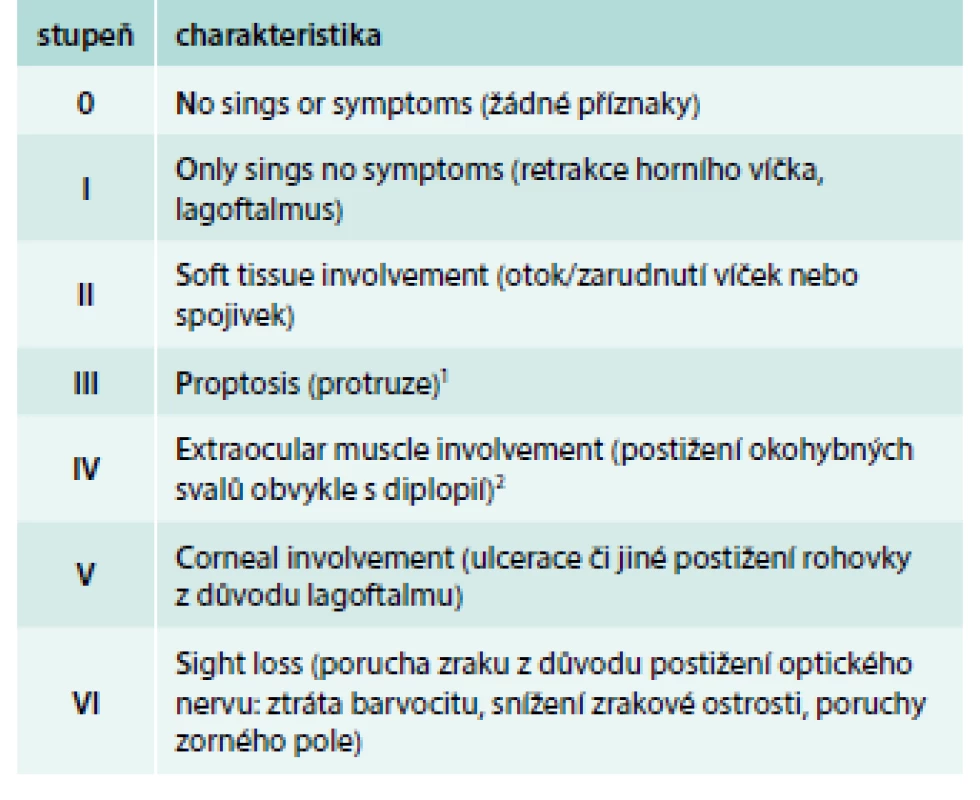
1 horní limit je závislý na pohlaví a rase: běloši ženy 19 mm/muži 21 mm afroameričané ženy 23 mm/muži 24 mm asiati ženy 16 mm/ muži 17 mm (Thajci) nebo 18,6 (Číňani) 2 intermitentní – přítomné jen při únavě očí nekonstantní – přítomné jen při pohledu určitým směrem konstantní – přítomné stále Upraveno podle [33] Tab. 2. Klasifikace závažnosti EO dle EUGOGO 2008 a 2016 a ATA 2011 a 2016. 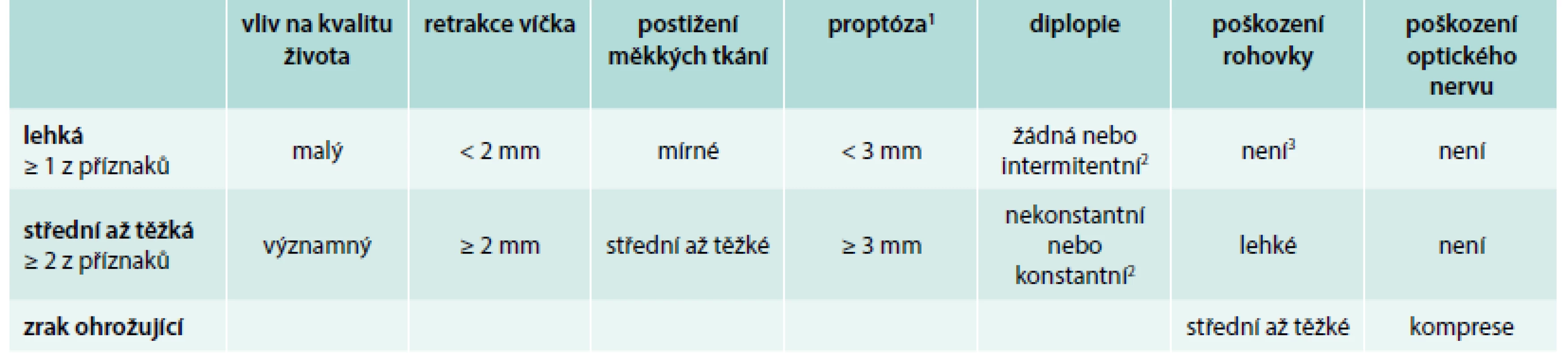
1 horní limit je závislý na pohlaví a rase: běloši ženy 19 mm/muži 21 mm afroameričané ženy 23 mm/muži 24 mm asiati ženy 16 mm/muži 17 mm (Thajci) nebo 18,6 (Číňané) 2 intermitentní – přítomné jen při únavě očí nekonstantní – přítomné jen při pohledu určitým směrem konstantní – přítomné stále 3 nebo je dobře kontrolováno lubrikanty EO – endokrinní orbitopatie EUGOGO – Consensus statement of the European Group on Graves’ orbitopathy on management of GO ATA – American Thyroid Association Upraveno podle [3,5,6,27] Standardní léčba endokrinní orbitopatie
Terapie EO vychází z doporučení EUGOGO 2008 a 2016 [5,6] a ATA 2011 a 2016 [3,27] a závisí na místních podmínkách a zvyklostech a na dosavadních zkušenostech ošetřujícího lékaře. Základní podmínky jsou udržení normální tyreoidální funkce, intervence k zanechání kouření, léčba ve specializovaném centru u střední až těžké/zrak ohrožující EO (tab. 3) a v každém konkrétním případě pečlivé zvážení poměru rizik a benefitů navrhované terapie.
Tab. 3. Doporučení pro odeslání pacienta s EO do specializovaného centra 
Základní standardní léčebné postupy:
- ve všech případech lokální léčba k udržení vlhkého oka (lubrikanty – umělé slzy)
- u aktivní střední až těžké a zrak ohrožující orbitopatie systémová imunosuprese (na prvním místě intravenózní glukokortikoidy) a zevní radioterapie
- oftalmochirurgické metody (urgentní dekomprese u aktivní zrak ohrožující EO a korekční výkony u neaktivní střední až těžké EO)
- u lehké aktivní EO suplementace selenového deficitu v dávce 2krát denně 100 μg perorálně [5,21]
Efekt kortikoidů a porovnání jejich perorálního (POGK) a pulzního intravenózního podávání (IVGK) byl v letech 1987–2009 hodnocen v 13 nerandomizovaných a 9 randomizovaných studiích celkem na 1 844 pacientech. Lze shrnout, že většina studií ukázala, že IVGK mají ve srovnání s POGK lepší terapeutickou odpověď (80 % vs 50 %) a méně nežádoucích účinků (43 % vs 73 %) a měly by tedy být první volbou u pacientů s aktivní střední až těžkou a zrak ohrožující EO [35]. Hlavní závažné nežádoucí účinky IVGK jsou hepatotoxicita závislá na kumulativní dávce (> 8 g metylprendisolonu) [5] a kardiovaskulární (KV) příhody, které jsou spíše než na dávce závislé na způsobu podání. Byla popsána 2 úmrtí a 3 případy závažných KV příhod při podání 1,0 g 5 dní po sobě [18]. Souhrnně lze říci, že závažné KV příhody se zřejmě vyskytují převážně při dávkách vyšších než 0,5 g metylprednisolonu podávaných denně nebo ob den. Celkem byla prevalence závažných nežádoucích účinků IVGK (hepatotoxicita a KV příhody) 6,5% a mortalita 0,6% (4 úmrtí na jaterní selhání 1 na CMP a 1 na plicní embolii z 1045 studovaných pacientů) [35]. Doporučení pro terapii IVGK uvádíme v následujícím přehledu na s. 693 [5].
Radioterapie se nedoporučuje u zrak ohrožující EO (jedině jako doplňková léčba k IVGK či chirurgické dekompresi), naopak může mít dobrý efekt u střední až těžké aktivní EO, která se projevuje převážně diplopií a sníženou motilitou bulbů [23,26]. Ukázalo se, že frakcionovaná kumulativní dávka 10 Gy v 1–2týdenních intervalech má stejný efekt a je lépe tolerována než dříve podávaných 20 Gy [15]. Kontraindikací k radioterapii jsou pacienti < 35 let, diabetická retinopatie a těžká arteriální hypertenze. Kombinovaná léčba IVIG s radioterapií je zřejmě efektivnější než každá z terapií samotná [20], randomizované studie ale nejsou k dispozici.
Chirurgická léčba EO zahrnuje akutní zrak zachraňující výkony, mezi které patří urgentní dekomprese orbity a blefarorafie, tarzorafie či injekce botulotoxinu. Dekomprese orbity je indikována především při kompresi zrakového nervu u tzv. dystyreózní optické neuropatie (DON), méně často při poškození a ulceraci rohovky. Blefarorafie, tarzorafie či injekce botulotoxinu jsou indikovány při (hrozícím) poškození a ulceraci rohovky. U neaktivní (CAS < 3) a stabilní (≥ 6 měsíců) EO s negativními protilátkami TRAK pak lze indikovat rehabilitační (korekční) oftalmochirurgické výkony (blefaroplastika, prodloužení víček, korekce strabizmu a diplopie, event. dekomprese z kosmetických důvodů).
Léčebné strategie EO uvádí schéma 1 a schéma 2.
Schéma 1. Postup u zrak ohrožující endokrinní orbitopatie 
1 0,5–1,0 g metylprednisolonu 3 dny po sobě nebo ob den 2 vyšetření indikováno dle individuálních zkušeností centra (hodnotí se známky aktivní myopatie) EO – endokrinní orbitopatie CAS – skóre klinické aktivity USG – ultrasonografie Léčba hypertyreózy u pacientů s endokrinní orbitopatií
V současné době nejsou k dispozici důkazy o superioritě některé z léčebných metod a lze tedy využít léčbu tyreostatiky, operaci i radiojod 131I. Platí, že důležité je dosažení a udržení eutyroidního stavu. U pacientů s EO se doporučuje prodloužená doba podávání tyreostatik až na 4 roky. Terapie radiojodem 131I se nepoužívá u střední až těžké a zrak ohrožující aktivní EO [3,27], niméně dostatečné důkazy z randomizovaných studií nejsou k dispozici.
Schéma 2. Postup u střední až těžké a lehké endokrinní orbitopatie 
1 vyšetření indikováno dle individuálních zkušeností centra, hodnotí se známky aktivní myopatie, nicméně indikace i.v. glukokortikoidů jen na základě nálezu na USG, u klinicky neaktivní EO je kontroverzní a není podpořena důkazy EO – endokrinní orbitopatie CAS – skóre klinické aktivity USG – ultrasonografie Prevence
U lehké aktivní EO se preventivně zajišťuje terapie radiojodem 131I glukokortikoidy, a to především u kuřáků (0,3–0,5 mg/kg prednisonu 1–3 dny po aplikaci radiojodu 131I na 4 týdny, pak postupné vysazení během 1–2 měsíců) [5]. Zajištění tyreoidektomie glukokortikoidy se rutinně nedoporučuje.
Farmakoterapie druhé linie a experimentální léčba
Dosud nemáme k dispozici žádnou dostatečně vědecky (randomizovaným kontrolovanými studiemi) ověřenou léčbu, která by byla účinnější a bezpečnější, než jsou IVGK. Většinou z malých, často nekontrolovaných a nerandomizovaných studií byly a jsou různé zprávy o možném příznivém i nepříznivém efektu imunosupresiv a biologické léčby (viz přehled Farmakoterapie druhé linie a experimentální léčba, s. 695). Tyto preparáty lze zvažovat, výhradně však jako léčbu druhé linie u aktivní střední až těžké EO po selhání IVIGK, jejich použití je však v ČR možné jen v rámci klinických studií nebo off-label. Očními lékaři je někdy předepisován pentoxyfyllin, který má minimum nežádoucích účinků a který zlepšoval kvalitu života v jedné malé placebem kontrolované studii u neaktivní EO.
Závěr
U každého pacienta s EO by měla být provedena klinická klasifikace aktivity a závažnosti choroby. Pokud jsou pochybnosti o správné diagnóze, mělo by být provedeno MRI či CT mozku a orbit. Pokud jsou pochybnosti o aktivitě EO nebo indikaci k intravenózním glukokortikoidům či korekčnímu oftalmochirurgickému výkonu, lze využít USG okohybných svalů na specializovaném pracovišti. Podmínky pro úspěšnou léčbu EO jsou udržení normální tyreoidální funkce, intervence směřující k zanechání kouření a u pacientů se střední až těžkou a zrak ohrožující EO odeslání do specializovaného centra. Základními léčebnými možnostmi jsou lokální léčba k udržení vlhkého oka (lubrikanty – umělé slzy), suplementace selenového deficitu, podání intravenózních glukokortikoidů, radioterapie a chirurgické metody. Střední až těžká aktivní EO se na prvním místě léčí intravenózními pulzy glukokortikoidů ve specializovaných centrech. Vždy je třeba zvažovat přínos a rizika této léčby. Zrak ohrožující EO je indikací k okamžitému odeslání pacienta do specializovaného centra, podání pulzů intravenózních glukokortikoidů ve vyšší dávce, a pokud není odpověď na léčbu do 2 týdnů, je na místě chirurgická dekomprese orbity.
doc. MUDr. Jan Jiskra, Ph.D.
jan.jiskra@vfn.cz
III. interní klinika 1. LF UK a VFN v Praze
www.vfn.cz
Doručeno do redakce 5. 9. 2017
Přijato po recenzi 27. 9. 2017
Zdroje
1. Alkawas AA, Hussein AM, Shahien EA. Orbital steroid injection versus oral steroid therapy in management of thyroid-related ophthalmopathy. Clin Exp Ophthalmol 2010; 38(7): 692–697. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1442–9071.2010.02332.x>.
2. Antonelli A, Saracino A, Alberti B et al. Highose intravenous immunoglobulin treatment in Graves’ ophthalmopathy. Acta Endocrinol (Copenh) 1992; 126(1): 13–23.
3. Bahn Chair RS, Burch HB, Cooper DS et al. [American Thyroid Association; American Association of Clinical Endocrinologists]. Hyperthyroidism and other causes of thyrotoxicosis: management guidelines of the American Thyroid Association and American Association of Clinical Endocrinologists. Thyroid 2011; 21(6): 593–646. Dostupné z DOI: <http://dx.doi.org/10.1089/thy.2010.0417>.
4. Bahn RS. Graves’ ophthalmopathy. N Engl J Med 2010; 362(8): 726–738. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMra0905750>.
5. Bartalena L, Baldeschi L, Boboridis K et al. [European Group on Graves‘ Orbitopathy (EUGOGO)]. The 2016 European Thyroid Association/European Group on Graves‘ Orbitopathy Guidelines for the Management of Graves‘ Orbitopathy. Eur Thyroid J 2016; 5(1): 9–26. Dostupné z DOI: <http://dx.doi.org/10.1159/000443828>.
6. Bartalena L, Baldeschi L, Dickinson A et al. [European Group on Graves‘ Orbitopathy (EUGOGO)]. Consensus statement of the European Group on Graves‘ orbitopathy (EUGOGO) on management of GO. Eur J Endocrinol 2008; 158(3): 273–285. Dostupné z DOI: <http://dx.doi.org/10.1530/EJE-07–0666>.
7. Bartalena L, Marcocci C, Bogazzi F et al. Relation between therapy for hyperthyroidism and the course of Graves’ ophthalmopathy. N Engl J Med 1998; 338(2): 73–78.
8. Dickinson AJ, Vaidya B, Miller M et al. Double-blind, placebo-controlled trial of octreotide longacting repeatable (LAR) in thyroid-associated ophthalmopathy. J Clin Endocrinol Metab 2004; 89(12): 5910–5915.
9. Ebner R, Devoto MH, Weil D et al. Treatment of thyroid associated ophthalmopathy with periocular injections of triamcinolone. Br J Ophthalmol 2004; 88(11): 1380–1386.
10. Eckstein AK, Plicht M, Lax H et al. Thyrotropin receptor autoantibodies are independent risk factors for Graves’ ophthalmopathy and help to predict severity and outcome of the disease. J Clin Endocrinol Metab 2006; 91(9): 3464–3470.
11. Finamor FE, Martins JR, Nakanami D et al. Pentoxifylline (PTX) – an alternative treatment in Graves‘ ophthalmopathy (inactive phase): assessment by a disease specific quality of life questionnaire and by exophthalmometry in a prospective randomized trial. Eur J Ophthalmol 2004; 14(4): 277–283. Dostupné z DOI: <http://dx.doi.org/10.5301/EJO.2008.5017>.
12. Forbes G, Gorman CA, Brennan MD et al. Ophthalmopathy of Graves’ disease: computerized volume measurements of the orbital fat and muscle. Am J Neuroradiol 1986; 7(4): 651–656.
13. Gerding MN, van der Meer JW, Broenink M et al. Association of thyrotrophin receptor antibodies with the clinical features of Graves’ ophthalmopathy. Clin Endocrinol (Oxf) 2000; 52(3): 267–271.
14. Kahaly G, Schrezenmeir J, Krause U et al. Ciclosporin and prednisone v. prednisone in treatment of Graves‘ ophthalmopathy: a controlled, randomized and prospective study. Eur J Clin Invest 1986; 16(5): 415–422.
15. Kahaly GJ, Rosler HP, Pitz S et al. Low - versus high-dose radiotherapy for Graves’ ophthalmopathy: a randomized, single blind trial. J Clin Endocrinol Metab 2000; 85(1): 102–108.
16. Krassas GE, Stafilidou A, Boboridis KG. Failure of rituximab treatment in a case of severe thyroid ophthalmopathy unresponsive to steroids. Clin Endocrinol (Oxf) 2010; 72(6): 853–855. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1365–2265.2009.03762.x>.
17. Lee SJ, Rim TH, Jang SY et al. Treatment of upper eyelid retraction related to thyroid-associated ophthalmopathy using subconjunctival triamcinolone injections. Graefes Arch Clin Exp Ophthalmol 2013; 251(1): 261–270. Dostupné z DOI: <http://dx.doi.org/10.1007/s00417–012–2153-y>.
18. Lendorf ME, Rasmussen AK, Fledelius HC et al. Cardiovascular and cerebrovascular events in temporal relationship to intravenous glucocorticoid pulse therapy in patients with severe endocrine ophthalmopathy. Thyroid 2009; 19(12): 1431–1432. Dostupné z DOI: <http://dx.doi.org/10.1089/thy.2009.0069>.
19. Lipman LM, Green DE, Snyder NJ et al. Relationship of long-acting thyroid stimulator to the clinical features and course of Graves’ disease. Am J Med 1967; 43(4): 486–498.
20. Marcocci C, Bartalena L, Bogazzi F et al. Orbital radiotheraphy combined with high-dose systemic glucocorticoids for Graves’ ophthalmopathy is more effective than orbital radiotherapy alone: results of a prospective study. J Endocrinol Invest 1991; 14(10): 853–860.
21. Marcocci C, Kahaly GJ, Krassas GE et al. [European Group on Graves‘ Orbitopathy]. Selenium and the course of mild Graves‘ orbitopathy. N Engl J Med 2011; 364(20): 1920–1931. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1012985>.
22. Mourits MP, Koornneef L, Wiersinga WM et al. Clinical criteria for the assessment of disease activity in Graves’ ophthalmopathy: a novel approach. Br J Ophthalmol 1989; 73(8): 639–644.
23. Mourits MP, van Kempen-Harteveld ML, Garcia MB et al. Radiotherapy for Graves’ orbitopathy: randomised placebo-controlled study. Lancet 2000; 355(9214): 1505–1509.
24. Paridaens D, van den Bosch WA, van der Loos TL et al. The effect of etanercept on Graves’ ophthalmopathy: a pilot study. Eye 2005; 19(12): 1286–1289.
25. Prummel MF, Mourits MP, Berghout A et al. Prednisone and cyclosporine in the treatment of severe Graves’ ophthalmopathy. N Engl J Med 1989; 321(20): 1353–1359.
26. Prummel MF, Terwee CB, Gerding MN et al. A randomized controlled trial of orbital radiotherapy versus sham irradiation in patients with mild Graves’ ophthalmopathy. J Clin Endocrinol Metab 2004; 89(1): 15–20.
27. Ross DS, Burch HB, Cooper DS et al. 2016 American Thyroid Association Guidelines for Diagnosis and Management of Hyperthyroidism and Other Causes of Thyrotoxicosis. Thyroid 2016; 26(10): 1343–1421.
28. Salvi M, Vannucchi G, Campi I et al. Rituximab treatment in a patient with severe thyroid-associated ophthalmopathy: effects on orbital lymphocytic infiltrates. Clin Immunol 2009; 131(2): 360–365. <http://dx.doi.org/10.1016/j.clim.2008.12.005>.
29. Salvi M, Vannucchi G, Campi I et al. Treatment of Graves’ disease and associated ophthalmopathy with the anti-CD20 monoclonal antibody rituximab: an open study. Eur J Endocrinol 2007; 156(1): 33–40.
30. Smith TJ, Kahaly GJ, Ezra DG et al. Teprotumumab for Thyroid-Associated Ophthalmopathy. N Engl J Med 2017; 376(18): 1748–1761. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1614949>.
31. Soeters MR, van Zeijl CJJ, Boelen A et al. Optimal management of graves orbitopathy: a multidisciplinary approach. Neth J Med 2011; 69(7): 302–308.
32. Stan MN, Garrity JA, Carranza Leon BG et al. Randomized controlled trial of rituximab in patients with Graves‘ orbitopathy. J Clin Endocrinol Metab 2015; 100(2): 432–441. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2014–2572>.
33. Werner SC. Modification of the classification of the eye changes of Grave’s disease. Am J Ophthalmol 1977; 83(5): 725–7257.
34. Ye X, Bo X, Hu X et al. Efficacy and safety of mycophenolate mofetil in patients with active moderate-to-severe Graves‘ orbitopathy. Clin Endocrinol (Oxf) 2017; 86(2): 247–255. Dostupné z DOI: <http://dx.doi.org/10.1111/cen.13170>.
35. Zang S, Ponto KA, Kahaly GJ. Intravenous Glucocorticoids for Graves’ Orbitopathy: Efficacy and Morbidity. J Clin Endocrinol Metab 2011; 96(2): 320–332. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2010–1962>.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2017 Číslo 10- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Základní interní kmen – pracovní verze významného dokumentu vzdělávacího programu
- Mnohočetná angiomatóza – několik poznámek – editorial
- Adherence k léčbě non-vitamin K perorálními antikoagulancii u nevalvulární fibrilace síní: přehled literatury
- Chirurgická léčba aneuryzmatu aortálního kořene: srovnání Bentallovy operace a reimplantace aortální chlopně podle Davida
- Strategie léčby diabetu 2. typu při selhání léčby metforminem používané českými lékaři nebo v České republice
- Problematika sekundárnej osteoporózy pri deficite rastového hormónu v dospelosti
- Lze zlepšit komplianci pacientů k dlouhodobé terapii statiny?
- COSYREL – účinná fixní kombinace pro léčbu hypertenze, stabilní ICHS a srdečního selhání
- Přínos nových inhibitorů angiogeneze (bevacizumab a aflibercept) pro léčbu mnohočetné angiomatózy: kazuistika
-
ESC Congress 2017
26.–30. august 2017, Barcelona, Španielsko - Peter Salaj et al. Poruchy hemostázy
- Ivana Štětkářová et al. Moderní terapie v neurologii
- Použití redukovaných dávek přímých perorálních antikoagulancií není vždy tou správnou volbou
- Prof. MUDr. Štěpán Svačina, DrSc., MBA, předseda České lékařské společnosti J. E. Purkyně slaví 65 let
- Endokrinní orbitopatie: aktuální pohled klinického endokrinologa
- Rychlejší aspart (Faster Insulin Aspart) – nový prandiální inzulinový analog
- Adaptační změny po střevní resekci
- Osteoartróza jako součást metabolického syndromu?
- Metabolický syndrom a postavení polypilu v prevenci jeho komplikací
- Diabetes mellitus a poruchy kognice z pohledu diabetologa
- Nové možnosti ovlivnění progrese diabetického onemocnění ledvin
- Pohybová aktivita – svatý grál moderní medicíny?
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- COSYREL – účinná fixní kombinace pro léčbu hypertenze, stabilní ICHS a srdečního selhání
- Chirurgická léčba aneuryzmatu aortálního kořene: srovnání Bentallovy operace a reimplantace aortální chlopně podle Davida
- Pohybová aktivita – svatý grál moderní medicíny?
- Endokrinní orbitopatie: aktuální pohled klinického endokrinologa
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy





