-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Myokarditidy a zánětlivé kardiomyopatie
Myocarditis and inflammatory cardiomyopathy
Myocarditis is an inflammation of the heart muscle. The most common cause of myocarditis is viral infection in industrialized countries. Myocarditis with left ventricular dysfunction is called inflammatory cardiomyopathy and is the major cause of dilated cardiomyopathy. The clinical picture is very diverse, most often the patient present with signs of heart failure, arrhythmic symptoms and chest pains. Despite significant advances in non-invasive diagnostics, particularly magnetic resonance imaging, endomyocardial biopsy remains the gold standard of myocarditis diagnosis. Myocarditis and inflammatory cardiomyopathy therapy is primarily based on the restriction of physical activity and the pharmacotherapy of heart failure. Specific treatment – immunosuppressive or antimicrobial – may be considered in some cases according to endomyocardial biopsy results. Implantation of mechanical cardiac support or heart transplantation is indicated only in the most serious cases.
Key words:
clinical course – diagnostics – inflammatory cardiomyopathy – myocarditis – treatment
Autori: Dalibor Mlejnek; Jan Krejčí
Pôsobisko autorov: I. interní kardio-angiologická klinika LF MU a FN u sv. Anny v Brně
Vyšlo v časopise: Vnitř Lék 2017; 63(7-8): 507-512
Kategória: Přehledné referáty
Súhrn
Myokarditida je zánětlivé postižení srdečního svalu. Nejčastější příčinou myokarditidy jsou v průmyslově vyspělých zemích virové infekce. Myokarditida s dysfunkcí levé komory srdeční se nazývá zánětlivá kardiomyopatie (ZKMP) a představuje hlavní příčinu vzniku dilatační kardiomyopatie. Klinický obraz je velmi různorodý, nejčastěji se onemocnění prezentuje známkami srdečního selhání, arytmickými příznaky a bolestmi na hrudi. Přes významný pokrok v neinvazní diagnostice, zejména ve využití magnetické rezonance srdce, zůstává endomyokardiální biopsie nadále zlatým standardem diagnostiky myokarditidy. Terapie myokarditidy a ZKMP je založena především na restrikci fyzické zátěže a farmakoterapii srdečního selhání. Specifická léčba – imunosupresivní či antimikrobiální – může být v určitých situacích zvážena dle výsledku endomyokardiální biopsie. Implantace mechanické srdeční podpory či transplantace srdce je indikována pouze v nejzávažnějších případech.
Klíčová slova:
diagnostika – klinický obraz – léčba – myokarditida – zánětlivá kardiomyopatieDefinice
Myokarditida je zánětlivé postižení srdečního svalu. Zánětlivá kardiomyopatie je definována jako myokarditida spojená s poruchou funkce levé komory (LK) srdeční, manifestující se nejčastěji pod obrazem dilatační kardiomyopatie (DKMP). Myokarditida může mít řadu infekčních (virové, bakteriální, protozoální) i neinfekčních příčin (autoimunitní, alergické, toxické) [1].
Patofyziologie
V průmyslově vyspělých zemích jsou za nejčastější příčinu myokarditidy považovány virové infekce. V posledních desetiletích došlo ke změně virového spektra. Dříve byly myokarditidy nejčastěji spojovány s enterovirovými a adenovirovými infekcemi, v současné době bývají nejčastěji asociovány s parvovirem B19 (PVB19) a lidským herpetickým virem 6 (HHV6) [2]. V některých regionech České republiky s endemickým výskytem Borrelia burgorferi byl prokázán zvýšený výskyt borreliových myokarditid [3,4]. Ve střední a jižní Americe je nejčastější příčinou zánětlivého postižení myokardu Chagasova choroba vyvolaná prvokem Trypanosoma cruzi [5].
Otázka patogeneze myokarditidy není dosud zcela jednoznačně vyřešena. Naše znalosti o průběhu myokarditidy jsou odvozovány především z animálních modelů enterovirové myokarditidy. Na základě těchto poznatků lze průběh onemocnění rozdělit na 3 fáze [6–8]. Akutní fáze je spojena se vstupem virů do myocytů přes virově specifické receptory. Buňky srdečního svalu jsou poškozovány cytotoxickým působením viru a rozvíjející se nespecifickou imunitní reakcí. Tato fáze trvá obvykle několik dní a často probíhá zcela asymptomaticky. V subakutní fázi, začínající obvykle po 2–4 týdnech, dochází k aktivaci specifické imunitní reakce. Ta zahrnuje jak celulární, tak i protilátkami zprostředkovanou imunitní odpověď. V této fázi může dojít také k rozvoji autoimunitních procesů proti myokardiálním strukturám. Chronická fáze nastupuje po několika týdnech až měsících od počátku onemocnění a může vést k remodelaci levé komory srdeční a ke vzniku zánětlivé kardiomyopatie (ZKMP). K rozvoji srdečního selhání však dochází jen u necelé poloviny nemocných, v ostatních případech zánět ustupuje (obvykle po předchozí eliminaci virů z myokardu) a funkce LK se normalizuje [9,10]. Informace o průběhu onemocnění u ostatních virů, a to zejména u virů v současnosti nejčastěji detekovaných (např. PVB19), jsou velmi limitované. Důležitou skutečností je i to, že u většiny jedinců i přes infekci kardiotropními viry nedojde k rozvoji myokarditidy. Předpokládá se tedy, že ke vzniku myokarditidy je nezbytná určitá genetická predispozice. Tato teorie je podporována i familiárním výskytem myokarditid [8,11]. Přítomnost virových agens (především PVB19) ve vzorcích myokardu u nemocných s DKMP je velmi častá [12,13], ovšem podobná situace je i u nemocných s normální funkcí LK podstupujících kardiochirurgický výkon [14]. Problematika významu virové přítomnosti (minimálně některých virů) v myokardu tak nadále zůstává nejasná. Podle některých autorů byla přítomnost virových agens asociována s horší prognózou [15,16], jiné studie toto tvrzení nepotvrdily [13,17].
Epidemiologie
Údaje o výskytu myokarditidy jsou vzhledem k složité definitivní diagnostice velmi rozdílné. Ve skupině jedinců do 35 let zemřelých náhlou smrtí byla myokarditida identifikována až ve 42 % případů [18]. Na základě prací zaměřených na bioptickou diagnostiku nemocných s DKMP byla v éře Dallaských kritérií detekována myokarditida v 9–16 % případech [19]. Současné studie, využívající senzitivnější metody diagnostiky myokarditid, tj. imunohistochemickou typizaci infiltrujících leukocytů v myokardu, ukazují, že téměř 50 % nemocných s DKMP má přítomen zánět v srdečním svalu [12,13].
Klinický nález
Klinický obraz myokarditidy a ZKMP je velmi různorodý a pohybuje se od prakticky zcela asymptomatického průběhu až po fulminantní srdeční selhání s maligními arytmiemi. Ne zcela výjimečně se myokarditida může manifestovat náhlou srdeční smrtí [11]. Předchozí virové onemocnění (nejčastěji respirační či GIT) bývá přítomno asi u 50–60 % nemocných. Iniciální virový infekt může proběhnout i asymptomaticky, jeho nepřítomnost tak s jistotou možnost zánětlivého postižení myokardu nevylučuje. Kardiální obtíže se obvykle rozvíjejí dny až týdny po infektu. Mezi nejčastější projevy onemocnění patří známky srdečního selhání (progredující dušnost, slabost, únavnost), bolesti na hrudi a arytmické příznaky (palpitace či synkopální stavy).
Diagnostika myokarditid a zánětlivé kardiomyopatie
Diagnostika myokarditidy zůstává nadále obtížná. Tato diagnóza bývá často stanovena až po vyloučení jiné možné příčiny pacientových obtíží a srdeční dysfunkce. V roce 2013 byl Pracovní skupinou pro onemocnění myokardu a perikardu Evropské kardiologické společnosti (ESC) přípraven Position statement, ve kterém byla vytvořena diagnostická kritéria ke stanovení klinicky suspektní myokarditidy. Ta je potvrzena přítomností alespoň jednoho klinického a jednoho diagnostického kritéria, případně 2 diagnostických kritérií u asymptomatických pacientů, při vyloučení jiných možných příčin pacientových obtíží (tab.). K definitivnímu potvrzení diagnózy myokarditidy je stále nezbytné provedení endomyokardiální biopsie (EMB), schéma [11,20].
Tab. Diagnostická kritéria pro klinickou diagnostiku myokarditidy 
Schéma. Diagnosticko-terapeutické schéma 
CS – srdeční sarkoidóza/cardiac sarcoidosis DKMP – dilatační kardiomyopatie EF LK – ejekční frakce levé komory EMB – endomyokardiální biopsie EoMC – eozinofilní myokarditida GCM – obrovskobuněčná myokarditida/giant cell myokarditis INFβ – interferon beta PCR – polymerázová řetězová reakce SS – srdeční selhání ZKMP – zánětlivá kardiomyopatie *Specifické příčiny dysfunkce levé komory: ischemická choroba srdeční, primární chlopenní vada, toxické příčiny (alkohol, drogy, chemoterapie), tachykardií indukovaná kardiomyopatie, endokrinní onemocnění. Elektrokardiografie
U všech nemocných s podezřením na myokarditidu provádíme EKG. Senzitivita EKG je u diagnostiky myokarditid nízká. EKG nález může být velmi různorodý a často nacházíme nespecifické změny ST-T úseku, prodloužení PQ intervalu či QRS komplexu, přítomnost Q kmitů. Dále mohou být zachyceny supraventrikulární či komorové arytmie. Některé EKG změny mohou svědčit pro určité postižení srdečního svalu. V případě boreliózy či sarkoidózy srdce můžeme nalézt atrioventrikulární (AV) blokády různého stupně. U části nemocných s obrovskobuněčnou myokarditidou a sarkoidózou bývají zachyceny komorové arytmie.
Echokardiografie
Myokarditida a ZKMP nemá žádný typický echokardiografický nález. Může být přítomna různě dilatovaná LK s globální či segmentární poruchou kinetiky, diastolická dysfunkce, hypertrofie stěn LK, perikardiální výpotek, různý stupeň funkční mitrální regurgitace. Pravá komora může mít normální či sníženou systolickou funkci. Echokardiografický nález může být i zcela normální, nicméně toto vyšetření je důležité i k vyloučení jiných příčin kardiálních potíží (chlopenní vady, postižení perikardu).
Zobrazení magnetickou rezonancí
Zobrazení magnetickou rezonancí (MRI – magnetic resonance imaging) je v současnosti v diagnostice myokarditid hlavní neinvazivní vyšetřovací metodou. Význam této metody spočívá v možnostech rozeznat změny charakteristické pro toto onemocnění, tj. přítomnost edému, zánětlivou hyperemii (tzv. časné sycení myokardu gadoliniem – early gadolinium enhancement – EGE) a nekrózu myokardu či fibrotické reparační změny (pozdní sycení gadoliniem – late gadolinium enhancement – LGE). Při přítomnosti 2 ze 3 kritérií je diagnostická přesnost vyšetření 78% [21]. Přítomnost pozdního sycení má nejen diagnostický význam, ale je také ukazatelem horší prognózy a zvýšeného rizika mortality [22]. Nález systolické dysfunkce LK či perikardiálního výpotku podporuje diagnózu myokarditidy. Senzitivita vyšetření je nejvyšší v akutní fázi onemocnění. Provedení MRI srdce by mělo být zváženo u všech nemocných s podezřením na myokarditidu, pokud není přítomna kontraindikace k vyšetření (zejména přítomnost feromagnetického materiálu) [11].
Laboratorní nález
Biochemickou známkou myokardiálního poškození je detekce kardiospecifických enzymů (troponin a CK-MB). Tyto markery bývají často zvýšeny v akutní fázi onemocnění a mají negativní prognostický význam [23]. Ve srovnání s akutním infarktem myokardu pozorujeme pozvolnější pokles a dlouhodobější perzistenci pozitivity kardiomarkerů. Elevace zánětlivých markerů (leukocytóza, zvýšený C-reaktivní protein či sedimentace) bývá přítomna u akutní myokarditidy, ale jejich negativita diagnózu nevylučuje. Vzhledem k významné promořenosti běžné populace kardiotropními viry při současné absenci virového postižení srdce se sérologické vyšetření jednotlivých virů ukázalo jako nepřínosné [24]. Detekce autoprotilátek proti myokardu může být přínosná při rozhodování o indikaci ke specifické léčbě. V současné době však není k dispozici žádná komerčně dostupná metoda k jejich rutinnímu stanovování [11].
Katetrizační vyšetření
Koronarografické vyšetření bývá často indikováno k vyloučení koronární nemoci jako možné příčiny kardiálních obtíží.
Endomyokardiální biopsie
Přes významný pokrok v neinvazivní diagnostice nadále zůstává endomyokardiální biopsie (EMB) zlatým standardem diagnosticky myokarditidy. Na základě doporučení Evropské kardiologické společnosti (ESC – European Society of Cardiology) by mělo být u všech pacientů s klinicky suspektní myokarditidou zváženo provedení EMB k definitivnímu potvrzení diagnózy [11]. Senzitivita vyšetření je dána především počtem odebraných vzorků. Při samotném provedení EMB je zavedeno bioptické instrumentárium nejčastěji cestou v. jugularis l. dx. do pravé komory, v níž je preferenčně z mezikomorového septa proveden odběr obvykle 5–10 vzorků myokardu. Získané vzorky jsou hodnoceny histologicky a imunohistochemicky. Nedílnou součástí hodnocení vzorků je i detekce virů metodou polymerázové řetězové reakce (PCR). Podle typu infiltrujících buněk a histologického charakteru lézí se myokarditida dělí na lymfocytární (obr. 1), obrovskobuněčnou, granulomatózní a eozinofilní. Pro histopatologické hodnocení biopsií byla v 80. letech vytvořena Dallaská kritéria [25].
Obr. 1. Histologický obraz lymfocytární myokarditidy: fokus inflamatorní celulizace označen šipkou. 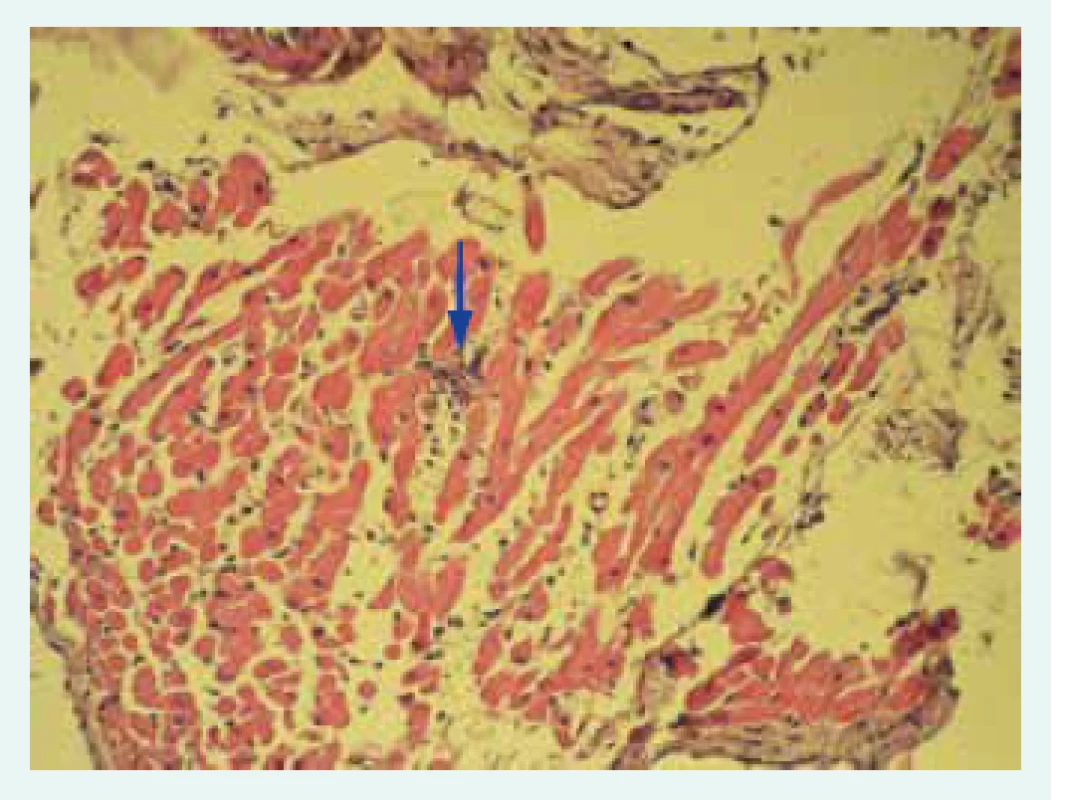
Snímek poskytnut MUDr. V. Žampachovou Na základě nálezu infiltrujících leukocytů a nekrózy kardiomyocytů rozlišujeme nález pozitivní, hraniční (borderline) a negativní. Dallaská kritéria však mají výrazné limitace, zejména nízkou senzitivitu a vysokou interindividuální variabilitu hodnocení [26]. Histologické hodnocení bylo překonáno zavedením imunohistochemické typizace infiltrujících leukocytů (obr. 2).
Obr. 2. Imunohistochemické vyšetření mononukleárních leukocytů: infiltrát označen šipkami. 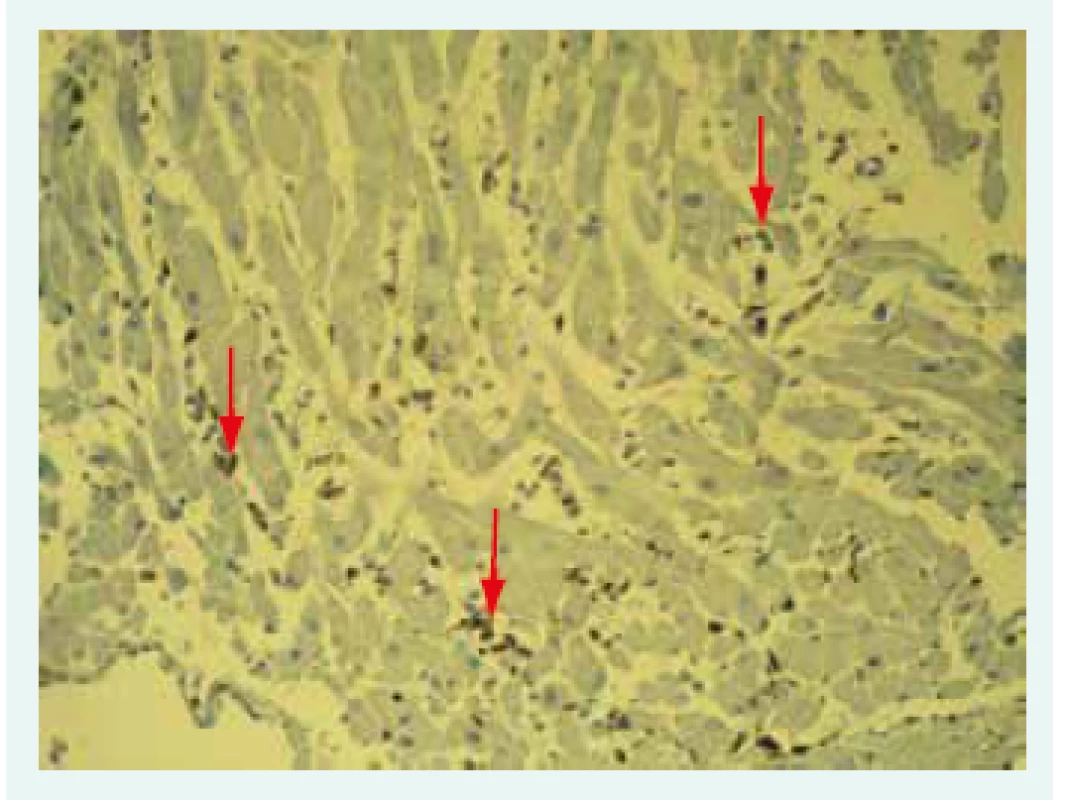
Snímek poskytnut MUDr. V. Žampachovou Současná imunohistochemická kritéria vycházející z odborného doporučení ESC vyžadují k potvrzení diagnózy přítomnost > 14 mononukleárních leukocytů/mm2 a > 7 T-lymfocytů/mm2 a zároveň ≤ 4 monocytů/mm2 [11]. Hlavní limitací EMB vedle její invazivní povahy nadále zůstává tzv. sampling error: při fokální myokarditidě nemusí být zánět v bioptických vzorcích zachycen. Při hodnocení bioptických vzorků pátráme vždy po infekčních agens, a to po herpetických virech (virus Epsteina a Barrové, Cytomegalovirus, HHV6), enterovirech, adenovirech a PVB19 a Borrelia burgdorferi. Minimálně v případě PVB19 by samotná detekce měla být doplněna o kvantifikaci tzv. virové nálože. Podle některých prací se totiž zdá, že nízká virová nálož by v případě PVB19 nemusela vést k indukci myokarditidy [27].
Terapie
Režimová opatření
V akutní fázi onemocnění je doporučováno minimálně po dobu 6 měsíců omezení fyzické aktivity [11].
Konvenční terapie
Základem léčby u nemocných s dysfunkcí levé komory srdeční je podávání standardní farmakoterapie srdečního selhání podle aktuálních doporučení (ACEI/ARB, betablokátory a antagonisty aldosteronu) [28]. Podávání nesteroidních antiflogistik ani digoxinu se nedoporučuje [9]. U hemodynamicky nestabilních pacientů může být indikováno použití mechanické srdeční podpory k překlenutí kritického období (bridge to recovery) nebo k provedení transplantace srdce (bridge to transplantation). V indikaci k srdeční transplantaci se snažíme být zdrženliví, protože často může po odeznění akutní fáze dojít k výraznému zlepšení funkce LK a klinického stavu [29]. Podobný přístup volíme i u přístrojové léčby arytmií: po odeznění akutní fáze vídáme též ústup arytmií. V případě kompletní AV blokády může být indikováno zavedení dočasné kardiostimulace.
Imunosupresivní léčba
V případě eozinofilní a obrovskobuněčné myokarditidy či sarkoidózy srdce je jednoznačně indikována imunosupresivní léčba [30–35]. Situace v oblasti lymfocytární myokarditidy však nadále zůstává nejednoznačná. Na základě metaanalýzy studií zaměřených na imunosupresivní léčbu bylo zjištěno, že tato léčba nemá vliv na mortalitu či nutnost srdeční transplantace. Podávání imunosuprese má ale příznivý efekt na zlepšení systolické funkce LK. Pokud není konvenční léčba efektivní a v případě absence mikrobiálních agens v EMB může být imunosupresivní léčba zvážena jako doplněk léčby konvenční [11,36].
Imunoadsorpce
Základem tohoto způsobu léčby je odstranění specifických cirkulujících protilátek proti kardiomyocytům z periferní krve. Efekt této terapie byl potvrzen v několika menších studiích, v nichž došlo ke zlepšení funkce LK a hemodynamických parametrů a byl pozorován i ústup zánětlivé infiltrace v kontrolní biopsii [37–39]. Přesto vzhledem k nedostatečným údajům a vysoké ceně není tato terapie v běžné praxi indikována [11].
Intravenózní imunoglobuliny
Podávání intravenózních imunoglobulinů má významný imunomodulační účinek včetně inaktivace autoprotilátek. V největší studii zabývající se touto léčbou však nebyl prokázán žádný benefit v porovnání s placebem [40]. Tato terapie také není v klinické praxi rutinně doporučována [11].
Antimikrobiální léčba
V případě bakteriálního původce myokarditidy je indikováno podávání antibiotické léčby. V České republice se setkáváme s myokarditidou vzniklou při lymeské borelióze. U nemocných s průkazem Borrelia burgdorferi v EMB byla při podávání cefalosporinů 3. generace (ceftriaxon) pozorována tendence k úpravě funkce LK a zlepšení symptomů [3]. Podávání antivirotické léčby se obvykle nedoporučuje, předpokládaný efekt této léčby by byl největší v prvních dnech onemocnění, tedy v období viremie. U většiny nemocných s myokarditidou je však toto onemocnění rozpoznáno až v pozdější fázi, v níž by již efekt podávání antivirotik byl málo významný. U nemocných s myokarditidou a průkazem enteroviru či adenoviru v myokardu byla přínosná léčba interferonem beta, po eliminaci viru z myokardu došlo ke zlepšení systolické funkce LK [41]. Podávání interferonu beta u ostatních virů, zejména v současné době nejčastěji detekovaného PVB19, však příznivý efekt nemělo [42].
Závěr
Myokarditida je zánětlivé onemocnění myokardu s velmi variabilními klinickými projevy. V našem regionu vznikají nejčastěji na podkladě virové infekce. Přes významný pokrok v neinvazivní diagnostice, především díky využití magnetické rezonance, zůstává nadále zlatým standardem diagnostiky endomyokardiální biopsie. Základem léčby jsou režimová opatření s restrikcí fyzické aktivity a farmakoterapie srdečního selhání. Specifická léčba, zejména imunosupresivní, může být indikována na základně výsledků endomyokardiální biopsie.
Práce byla podpořena grantem Ministerstva zdravotnictví ČR AZV 16–30537A a specifickým výzkumným projektem MUNI/A/1010/2016.
MUDr. Dalibor Mlejnek
dalibor.mlejnek@fnusa.cz
I. interní kardio-angiologická klinika LF MU
a FN u sv. Anny v Brně
www.fnusa.cz
Doručeno do redakce 20. 5. 2017
Přijato po recenzi 20. 6. 2017
Zdroje
1. Richardson P, McKenna W, Bristow M et al. Report of the 1995 World Health Organization/International Society and Federation of Cardiology Task Force on the Definition and Classification of cardiomyopathies. Circulation 1996; 93(5): 841–842.
2. Breinhold JP, Moulik M, Dreyer WJ et al. Viral epidemiologic shift in inflammatory heart disease: the increasing involvement of parvovirus B19 in the myocardium of pediatric cardiac transplant patients. J Heart Lung Transplant 2010; 29(7): 739–746. Dostupné z DOI: <http://dx.doi.org/10.1016/j.healun.2010.03.003>.
3. Palecek T, Kuchynka P, Hulinska D et al. Presence of Borrelia burgdorferi in endomyocardial biopsies in patients with new-onset unexplained dilated cardiomyopathy. Med Microbiol Immunol 2010; 199(2): 139–143. Dostupné z DOI: <http://dx.doi.org/10.1007/s00430–009–0141–6>.
4. Kubanek M, Sramko M, Berenova D et al. Detection of Borrelia burgdorferi sensu lato in endomyocardial biopsy specimens in individuals with recent-onset dilated cardiomyopathy. Eur J Heart Fail 2012; 14(6): 588–596. Dostupné z DOI: <http://dx.doi.org/10.1093/eurjhf/hfs027>.
5. Malik LH, Singh GD, Amsterdam EA. The Epidemiology, Clinical Manifestations, and Management of Chagas Heart Disease. Clin Cardiol 2015; 38(9): 565–569. Dostupné z DOI: <http://dx.doi.org/10.1002/clc.22421>.
6. Cooper LT. Myocarditis. N Engl J Med 2009; 360(15): 1526–1538. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMra0800028>.
7. Kindermann I, Barth C, Mahfoud F et al. Update on myocarditis. J Am Coll Cardiol 2012; 59(9): 779–792. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2011.09.074>.
8. Dennert R, Crijns HJ, Heymans S. Acute viral myocarditis. Eur Heart J 2008; 29(17): 2073–2082. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehn296>.
9. Schultheiss HP, Kühl U, Cooper LT. The management of myocarditis. Eur Heart J 2011; 32(21): 2616–2625. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehr165>.
10. D’Ambrosio A, Patti G, Manzoli A et al. The fate of acute myocarditis between spontaneous improvement and evolution to dilated cardiomyopathy: a review. Heart 2001; 85(5): 499–504.
11. Caforio ALP, Pankuweit S, Arbustini E et al. Current state of knowledge on ethiology, diagnosis, management, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J 2013; 34(33): 2636–2648, 2648a-2648d. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/eht210>.
12. Kühl U, Pauschinger M, Noutsias M et al. High prevalence of viral genomes and multiple viral infections in the myocardium of adults with „idiopathic“ left ventricular dysfunction. Circulation 2005; 111(7): 887–893.
13. Krejci J, Poloczkova H, Hude P et al. Impact of inflammatory infiltration and viral genome presence in myocardium on the changes of echocardiographic parameters. Cor et Vasa 2013; 55(4): e333-e340. Dostupné z DOI: <https://doi.org/10.1016/j.crvasa.2013.02.003>.
14. Kuethe F, Lindner J, Matschke K et al. Prevalence of parvovirus B19 and human bocavirus DNA in the heart of patients with no evidence of dilated cardiomyopathy or myocarditis. Clin Infect Dis 2009; 49(11): 1660–1666. Dostupné z DOI: <http://dx.doi.org/10.1086/648074>.
15. Caforio ALP, Calabrese F, Angelini A et al. A prospective study of biopsy-proven myocarditis: prognostic relevance of clinical and aetiopathogenetic features at diagnosis. Eur Heart J 2007; 28(11): 1326–1333.
16. Kühl U, Lassner D, von Schlippenbach J et al. Interferon-beta improves survival in enterovirus-associated cardiomyopathy. J Am Coll Cardiol 2012; 60(14): 1295–1296. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2012.06.026>.
17. Kindermann I, Kindermann M, Kandolf R et al. Predictors of outcome in patients with suspected myocarditis. Circulation 2008; 118(6): 639–648. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCULATIONAHA.108.769489>.
18. Philips M, Robinowitz M, Higgins JR et al. Sudden cardiac death in Air Force recruits. A 20-year review. JAMA 1986; 256(19): 2696–2699.
19. Mason JW, O´Connell JB, Herskowitz A et al. A clinical trial of immunosuppressive therapy for myocarditis. The Myocarditis Treatment Trial Investigators. N Engl J Med 1995; 333(5): 269–275.
20. Krejci J, Mlejnek D, Sochorova D et al. Inflammatory Cardiomyopathy: A Current View on the Pathophysiology, Diagnosis, and Treatment. Biomed Res Int 2016; 2016 : 4087632. Dostupné z DOI: <http://dx.doi.org/10.1155/2016/4087632>.
21. Friedrich MG, Sechtem U, Schulz-Menger J et al. Cardiovascular magnetic resonance in myocarditis: a JACC White paper. J Am Coll Cardiol 2009; 53(17): 1475–1487. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2009.02.007>.
22. Schumm J, Greulich S, Wagner A et al. Cardiovascular magnetic resonance risk stratification in patients with clinically suspected myocarditis. J Cardiovasc Magn Reson 2014; 16 : 14. Dostupné z DOI: <http://dx.doi.org/10.1186/1532–429X-16–14>.
23. Lauer B, Niederau C, Kühl U et al. Cardiac troponin T in patients with clinically suspected myokarditis. J Am Coll Cardiol 1997; 30(5): 1354–1359.
24. Mahfoud F, Gärtner B, Kindermann M et al. Virus serology in patients with suspected myocarditis: utility or futility? Eur Heart J 2011; 32(7): 897–903. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehq493>.
25. Aretz HAT, Billingham ME, Edwards WD et al. Myocarditis. A histopathologic definition and classification. Am J Cardiovasc Pathol 1987; 1(1): 3–14.
26. Baughman KL. Diagnosis of myocarditis: Death of Dallas criteria. Circulation 2006; 113(4): 593–595.
27. Bock CT, Klingel K, Kandolf R. Human parvovirus B19-associated myocarditis. N Engl J Med 2010; 362(13): 1248–1249. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMc0911362>.
28. Ponikowski P, Voors AA, Anker SD et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J 2016; 37(27): 2129–2200. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehw128>.
29. Krejci J, Hude P, Poloczkova H et al. Correlations of the changes in bioptic findings with echocardiographic, clinical and laboratory parameters in patients with inflammatory cardiomyopathy. Heart Vessels 2016; 31(3): 416–426. Dostupné z DOI: <http://dx.doi.org/10.1007/s00380–014–0618–0>.
30. Cooper LT, Berry GJ, Shabetai R. Idiopathic giant-cell myocarditis-natural history and treatment. Multicentre giant cell myocarditis study group investigators. N Engl J Med 1997; 336(26): 1860–1866.
31. Cooper LT, Hare JM, Tazelaar HD et al. Usefulness of immunosuppression for giant cell myocarditis. Am J Cardiol 2008; 102(11): 1535–1539. Dostupné z DOI: <http://dx.doi.org/10.1016/j.amjcard.2008.07.041>.
32. Kandolin R, Lehtonen J, Salmenkivi K et al. Diagnosis, treatment, and outcome of giant-cell myocarditis in the era of combined immunosuppression. Circ Heart Fail 2013; 6(1): 15–22. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCHEARTFAILURE.112.969261>.
33. Kawano S, Kato J, Kawano N et al. Clinical features and outcomes of eosinophilic myocarditis patients treated with prednisolone at a single institution over a 27-year period. Intern Med 2011; 50(9): 975–981.
34. Yanagisawa T, Inomata T, Watanabe I et al. Clinical significance of corticosteroid therapy for eosinophilic myocarditis. Int Heart J 2011; 52(2): 110–113.
35. Blauwet LA, Cooper LT. Idiopathic giant cell myocarditis and cardiac sarcoidosis. Heart Fail Rev 2013; 18(6): 733–746. Dostupné z DOI: <http://dx.doi.org/10.1007/s10741–012–9358–3>.
36. Cong L, Fang Q, Yafei Y et al. Immunosuppressive treatment for myocarditis: a meta-analysis of randomized controlled trials. J Cardiovasc Med (Hagerstown) 2016; 17(8): 631–637. Dostupné z DOI: <http://dx.doi.org/10.2459/JCM.0000000000000134>.
37. Gullestad L, Aass H, Fjeld JG et al. Immunomodulating therapy with intravenous immunoglobulin in patients with chronic heart failure. Circulation 2001; 103(2): 220–225.
38. Staudt A, Hummel A, Ruppert A et al. Immunoadsorption in dilated cardiomyopathy: 6-month results from randomized study. Am Heart J 2006; 152(4): 712.
39. Felix SB, Staudt A, Dörffer WV et al. Hemodynamic effects of immunoadsorption and subsequent immunoglobulin substitution in dilated cardiomyopathy: three-month results from a randomized study. J Am Coll Cardiol 2000; 35(6): 1590–1598.
40. McNamara DM, Holubkov R, Starling RC et al. Controlled trial of intravenous immune globulin in recent-onset dilated cardiomyopathy. Circulation 2001; 103(18): 2254–2259.
41. Kühl U, Pauschinger M, Schwimmbeck PL et al. Interferon-beta Treatment Eliminates cardiotropic viruses and improves left ventricular function in patients with myocardial persistence of viral genomes and left ventricular dysfunction. Circulation 2003; 107(22): 2793–2798.
42. Zimmermann O, Rodewald C, Radermacher M et al. Interferon β-1b therapy in chronic viral dilated cardiomyopathy – is there a role for specific therapy? J Cardiac Fail 2010; 16(4): 348–356. Dostupné z DOI: <http://dx.doi.org/10.1016/j.cardfail.2009.12.016>.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek PCR diagnostika infekcíČlánek Nozokomiální pneumonie
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2017 Číslo 7-8- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Co dělat při intoleranci statinů?
-
Všetky články tohto čísla
- 140. internistický den – XXVII. Vanýskův den – program
- Historie a současnost léčby hepatitid B a C
- PCR diagnostika infekcí
- Nozokomiální infekce a antibiotická rezistence v současnosti
- Vývoj názorů na patofyziologii sepse
- Cytomegalovirová a polyomavirová infekce po transplantaci ledviny
- Virová hepatitida A – možný diferenciálně diagnostický a terapeutický problém
- Infekce HIV jako nové onemocnění vnitřního lékařství
- Myokarditidy a zánětlivé kardiomyopatie
- Komunitní pneumonie – základy diagnostiky a léčby
- Nozokomiální pneumonie
- Infekční komplikace u transplantací jater
- Virová hepatitida C a transplantace orgánů
- Transplantace srdce a infekce
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Nozokomiální pneumonie
- PCR diagnostika infekcí
- Nozokomiální infekce a antibiotická rezistence v současnosti
- Komunitní pneumonie – základy diagnostiky a léčby
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



