-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Zánětlivá onemocnění myokardu
Inflammatory myocardial disease
Inflammatory diseases of the heart muscle include myocarditis and inflammatory cardiomyopathy, which is myocarditis associated with a heart muscle dysfunction. The causes of myocardial inflammatory disorders may be infectious, most commonly viral, as well as non-infectious. Diagnosing is difficult, the clinical suspicion of this diagnosis can be established based on clinical picture and non-invasive diagnostic methods, the most important of which is cardiac magnetic resonance imaging. The definitive diagnosis is based on histological and immunohistochemical evidence of inflammation directly from heart muscle samples. These can be obtained by endomyocardial biopsy which is also the gold standard of diagnosis. In addition to the demonstration of inflammatory changes, the examination of biopsy specimens allows for specification of their character and the obtained tissue can also be examined for presence of infectious agents in the myocardium. Based on the findings it is then possible to estimate the prognosis, set the timing of further therapeutic steps (especially device-based therapy) and, in some cases, administer specific treatments.
Keywords:
endomyocardial biopsy – immunosuppressive treatment – myocarditis
Autoři: Jan Krejčí; Hana Poloczková
Působiště autorů: I. interní kardioangiologická klinika LF MU a FN u sv. Anny v Brně
Vyšlo v časopise: Vnitř Lék 2019; 65(10): 636-642
Kategorie: Přehledné referáty
Souhrn
Mezi zánětlivá onemocnění srdečního svalu počítáme myokarditidu a zánětlivou kardiomyopatii, což je myokarditida spojená s dysfunkcí srdečního svalu. Příčiny zánětlivých postižení myokardu mohou být infekční, nejčastěji virové, a také neinfekční. Diagnostika je obtížná, klinické suspicium na tuto diagnózu lze stanovit na základě klinického obrazu a neinvazivních diagnostických metod, z nichž nejdůležitější je srdeční magnetická rezonance. Definitivní diagnóza je založena na histologickém a imunohistochemickém průkazu zánětu přímo ze vzorků srdečního svalu. Ty lze získat pomocí endomyokardiální biopsie, která je také zlatým standardem diagnostiky. Vyšetření bioptických vzorků umožní, kromě samotného průkazu zánětlivých změn, upřesnit jejich charakter a získanou tkáň lze rovněž vyšetřit na přítomnost infekčních agens v myokardu. Na podkladě nálezu lze potom odhadnout prognózu, načasovat další terapeutické kroky (zejména přístrojovou léčbu) a v některých případech podat specifickou léčbu.
Klíčová slova:
myokarditida – endomyokardiální biopsie – imunosupresivní léčba – zánětlivá kardiomyopatie
Úvod
Myokarditidou rozumíme zánět srdečního svalu, který může mít řadu příčin infekčních i neinfekčních. Pokud se myokarditida prezentuje obrazem srdečního selhání a je doprovázena poruchou funkce srdečního svalu, označujeme ji jako zánětlivou kardiomyopatii (ZKMP). Dalšími manifestacemi jsou bolesti na hrudi, které mohou imitovat akutní koronární syndrom, a také arytmické příznaky jako palpitace, závratě či synkopy [1–3].
ZKMP jsou nehomogenní skupinou onemocnění, takže se dnes někdy používá termín „syndrom zánětlivé kardiomyopatie“, což odráží různorodost možných etiologických příčin vedoucích k zánětlivému postižení srdečního svalu [4]. ZKMP má nejčastěji morfologický obraz dilatační kardiomyopatie (DKMP), do které může – a to i přes odeznění zánětu – v průběhu času vyústit. Je rovněž známo, že DKMP je nejčastější příčinou terminálního srdečního selhání vedoucího k srdeční transplantaci [5]. Myokarditida může být způsobena či indukována celou řadou podnětů, které mohou být infekční povahy (virové, méně často bakteriální nebo protozoální infekty), ale také neinfekční (např. myokarditidy doprovázející autoimunitní onemocnění nebo hypersenzitivita na některé noxy včetně řady farmak) [1–4,6–9].
V roce 2013 byl publikován Position statement Pracovní skupiny pro Onemocnění myokardu a perikardu Evropské kardiologické společnosti (ESC), který byl věnován problematice myokarditid [1]. Obsahuje diagnostický algoritmus vycházející z klinického obrazu a neinvazivních diagnostických metod, na jehož podkladě je možné vyslovit klinické suspicium na myokarditidu (tab). Tento algoritmus bude zmíněn dále v textu. Současně zdůrazňuje roli invazivní diagnostiky založené na endomyokardiální biopsii (EMB), protože pro stanovení definitivní diagnózy je nezbytný histologický (či lépe současně imunohistochemický) průkaz zánětlivých změn v srdečním svalu [1,10].
Tab. 1. Diagnostické schéma pro klinickou diagnostiku myokarditidy 
Vyhodnocení vzorků myokardu umožňuje vedle samotné diagnózy myokarditidy také její přesnější klasifikaci podle typizace infiltrujících buněk či histologického charakteru lézí (např. lymfocytární, eozinofilní, obrovskobuněčnou, granulomatózní, nekrotizující, autoimunitní apod), což má důležité prognostické a terapeutické konsekvence.
Nedílnou a klíčovou součástí hodnocení bioptických vzorků je také pátrání po potenciálním infekčním agens v myokardu (v našich končinách jde zpravidla o viry), nejčastěji metodou polymerázové řetězové reakce (Polymerase Chain Reaction – PCR) [1–4,6–9,11–14].
Patofyziologie myokarditid
Patofyziologické mechanizmy poškození srdečního svalu při myokarditidě vychází z experimentálních modelů virové myokarditidy. V posledních desetiletích byla pozorována změna zastoupení jednotlivých virů detekovaných v myokardu: původně zcela dominantně se vyskytující adenoviry a enteroviry byly vystřídány parvovirem B19 (PVB19) a lidským herpetickým virem 6 (HHV6) jakožto aktuálně nejčastěji izolovanými patogeny z myokardu postižených jedinců [15–17]. Na této skutečnosti je mimo jiné důležitý fakt, že zatímco enteroviry primárně postihují myocyty (a vedou tak k jejich přímému poškození), v případě PVB19 jsou infikovány endotelie cév, dochází k apoptóze a lýze endoteliálních buněk, což vede k vzniku endoteliální dysfunkce a indukci zánětlivé kaskády s konečnou poruchou mikrocirkulace a nekrózou myocytů [18–21]. Nicméně v případě obou agens jde o vícestupňový proces, při němž se v první fázi vedle přímého poškození myocytů či endoteliálních buněk viry na patofyziologii stavu podílejí nespecifické vrozené imunitní procesy. Ve druhé fázi, která nastupuje zpravidla s odstupem 2–4 týdnů po začátku onemocnění (a ve které také nejčastěji myokarditidu diagnostikujeme), je dominantní specifická imunitní reakce. Ta zahrnuje jak celulární, tak i protilátkami zprostředkovanou imunitní reakci, která často mívá autoimunitní rysy. Při rozvoji autoimunitních procesů se uplatňují 2 základní mechanizmy – jednak to je zkřížená reaktivita virových epitopů a některých kardiálních struktur (tzv. molekulární mimikry), další možností je expozice původně nitrobuněčných struktur imunitnímu systému, ke které dochází po virem indukovaném poškození myocytů [22–24]. Třetí fáze onemocnění nastupuje po několika týdnech či měsících a v jejím průběhu může dojít k ústupu zánětu a úpravě ejekční frakce levé komory (EF LK), k čemuž dochází přibližně v 50–70 % případů (obvykle po předchozím odstranění virů z myokardu). Druhou, méně příznivou variantou je perzistující dysfunkce levé komory (LK) s vývojem obrazu DKMP. O vývoji onemocnění spolurozhoduje množství faktorů, např. míra iniciálního poškození myokardu, intenzita a délka zánětlivých změn či perzistence virů v myokardu, resp. pokračující virová replikace [6,8,25].
Je rovněž pravděpodobné, že nezbytnou podmínkou vzniku myokarditidy je jistá genetická dispozice – u převážné většiny jedinců se totiž po setkání s tzv. kardiotropními viry myokarditida nerozvine. Této teorii nasvědčuje také častější výskyt myokarditid v některých rodinách [7,23].
Epidemiologie
Přesný výskyt myokarditid je vzhledem ke složité definitivní diagnostice (navíc s odlišně užívanými diagnostickými kritérii) obtížné s jistotou určit. U mladých jedinců zemřelých náhlou smrtí byla sekčně myokarditida (histologicky definovaná) nalezena v širokém rozmezí pohybujícím se mezi 2–42 %. Starší práce využívající histologickou diagnostiku založenou na tzv. Dallaských kritériích uváděly výskyt biopticky potvrzené myokarditidy v 9–16 % případů DKMP; novější studie ukazují, že až u 40 % nemocných s klinickou diagnózou DKMP lze imunohistochemicky zachytit myokarditidu, a jde tak vlastně o ZKMP [1–4,16,17,26].
Další zajímavou informací, kterou přinesla bioptická diagnostika kardiomyopatií, je častý průkaz virových nukleových kyselin v myokardu (v 60–80 % případů). Vzhledem k tomu, že některé viry (především PVB19) jsou často nalézány i u jedinců s normální funkcí LK, je význam jejich přítomnosti nejasný a tato problematika je předmětem intenzivního výzkumu. Zdá se pravděpodobné, že důležitou úlohu v případné patogenitě PVB19 a jeho etiologické roli při indukci myokarditidy může hrát nejen jeho samotná přítomnost v myokardu, ale především další faktory, jako je např. virová nálož, replikační aktivita virů, koinfekce dalšími viry, genetické pozadí, pohlavní rozdíly a jiné vnější vlivy [18–21,27].
Klinický obraz
Klinický obraz myokarditidy/ZKMP se pohybuje mezi prakticky asymptomatickým průběhem u mírně probíhajících forem onemocnění s menším rozsahem postižení myokardu na straně jedné, a těžkým fulminantním srdečním selháním s maligními arytmiemi na straně druhé. Někdy může být prvním projevem onemocnění náhlé úmrtí do té doby zcela zdravého jedince. Často zdůrazňovaný iniciální virový infekt u myokarditid může proběhnout subklinicky, a jeho nepřítomnost v anamnéze tedy s jistotou možnost zánětlivého postižení myokardu nevylučuje. U mírnějších případů je průběh aktivní fáze méně dramatický, nicméně to nemusí automaticky znamenat lepší dlouhodobou prognózu [1–4,6–9]. Míra poškození myokardu v akutní fázi, resp. podíl reverzibilních a ireverzibilních změn, je jedním z důležitých faktorů pro možnost úpravy funkce LK srdeční v pozdějším období. Reverzibilita dysfunkce myokardu u větší části případů myokarditid potvrzuje, že postižení kontraktility LK není způsobeno v plném rozsahu trvalou ztrátou myocytů či integrity buněčné i mezibuněčné matrix. Iniciální poškození je tedy podmíněno také produkcí negativně inotropních mediátorů spojených se zánětem, jako jsou např. tumor nekrotizující faktor α, interferony či interleukiny [25,28]. To potvrzují i naše vlastní výsledky, které ukazují, že pokles zánětlivé aktivity v kontrolní biopsii je spojen se zlepšením systolické funkce LK [29].
Nejčastějším projevem myokarditidy je srdeční selhání. Může mít pozvolný nástup a jen mírné symptomy, mnohdy lze ale vidět i případy rychle vznikajícího kardiogenního šoku, kdy pouze implantace mechanické srdeční podpory či urgentní srdeční transplantace mohou nemocnému zachránit život. Tento scénář je typický pro fulminantní myokarditidu, u níž (pokud nemocný přežije akutní fázi) po několika málo týdnech může dojít k výraznému zlepšení či dokonce úplné normalizaci systolické funkce LK s velmi dobrou dlouhodobou prognózou [30]. Zdá se tedy, že z hlediska dlouhodobé prognózy je iniciální bouřlivá imunitní reakce příznivým faktorem. Jinou klinicky rychle progredující a prognosticky závažnou formou myokarditidy je obrovskobuněčná myokarditida. Tento typ myokarditidy má vysokou mortalitu; pokud je ovšem léčen agresivní kombinovanou imunosupresivní léčbou, je prognóza výrazně lepší. Přesto může být často jediným řešením tohoto stavu srdeční transplantace; zajímavostí je, že byly popsány případy rekurence choroby v transplantovaném srdci [31,32].
Dalším klinickým scénářem je manifestace myokarditidy bolestmi na hrudi, které mohou připomínat anginu pectoris. Nemocní jsou často přivezeni na katetrizační sál k vyloučení akutního koronárního syndromu (zejména pokud je navíc přítomna elevace markerů myokardiálního postižení a pokud jsou při současném postižení perikardu přítomny elevace ST úseku na EKG). Normální nález na koronárních tepnách a vyloučení jiné nekardiální patologie v takových případech vede k úvaze o možné myokarditidě [33].
Třetí dominující obtíží, která nemocného přivede k lékaři, mohou být arytmické příznaky. Arytmie mohou být jak supraventrikulární, tak komorové: závažné komorové arytmie či přítomnost atrioventrikulárních blokád vyššího stupně upozorňují na možnost obrovskobuněčné myokarditidy (obr. 1), srdeční sarkoidózy či borreliové myokarditidy.
Obr. 1. Obrovskobuněčná myokarditida (hematoxylin- eozin, zvětšení 200krát). Zapůjčeno z archivu MUDr. V. Žampachové z Ústavu patologie LF MU a FN u sv. Anny v Brně 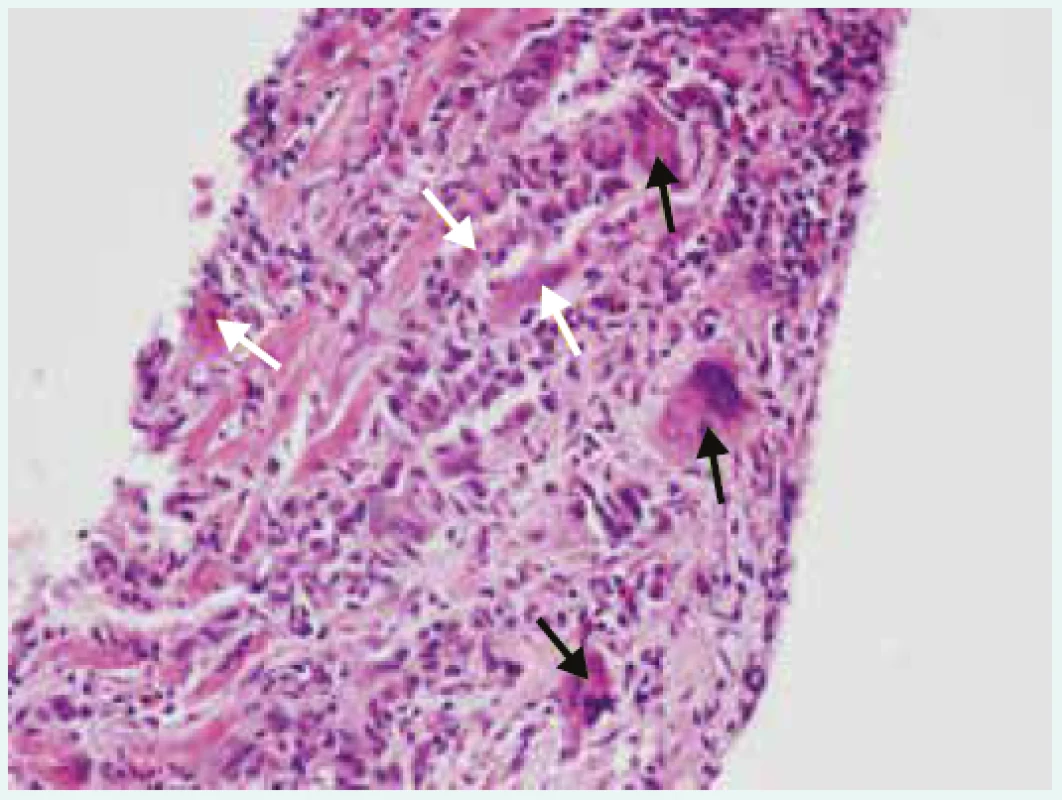
Z hlediska prognózy bylo popsáno, že případy s příznaky srdečního selhání – tedy ty, které hodnotíme jako zánětlivé kardiomyopatie – mají horší prognózu než případy projevující se bolestmi na hrudi nebo přítomností arytmií [26].
Diagnostika myokarditidy
Stanovení diagnózy myokarditidy bylo zejména v minulosti velmi obtížné a často spojené se značnou mírou nejistoty. I dnes, kdy máme k dispozici řadu moderních diagnostických metod, zůstává mnohdy tato diagnóza diagnózou per exclusionem. Ve zmíněném Position statement ESC jsou uvedena diagnostická kritéria pro klinickou diagnózu myokarditidy, která se opírají o přítomnost některého z výše uvedených symptomů (srdeční selhání, bolesti na hrudi, arytmické příznaky) v kombinaci s patologickým nálezem z neinvazivních vyšetřovacích metod (EKG, holterovské monitorování EKG, echokardiografie, magnetická rezonance) či laboratorních nálezů (elevace troponinu či CK-MB, detekce autoprotilátek); detaily jsou uvedeny v tab. 1 [1,4,6,8,9].
Diagnostický proces zahajujeme běžnými vyšetřeními, jako je EKG, které může mít velmi variabilní a bohužel také nespecifické nálezy (přítomnost arytmií, změny PQ a ST-T úseku, prodloužení PQ intervalu či QRS komplexu, přítomnost Q kmitů). Přítomnost četné komorové ektopie či atrioventrikulární blokády vyššího stupně je alarmujícím příznakem, který by měl vést k urgentnímu transferu nemocného do specializovaného centra disponujícího možností provedení EMB, stejně jako možností zajištění implantace mechanické srdeční podpory či srdeční transplantace právě pro zmíněnou vyšší pravděpodobnost výskytu obrovskobuněčné formy myokarditidy s velmi rychlou progresí a závažnou prognózou [1,6–8].
Echokardiografický nález rovněž nemá žádný zcela typický obraz; mohou být přítomny ložiskové či globální poruchy kinetiky levé/pravé komory, diastolická dysfunkce, hypertrofie stěn LK či perikardiální výpotek. Je třeba mít na paměti, že ani normální echokardiografický nález nevylučuje přítomnost myokarditidy. Význam echokardiografie tak leží spíše ve vyloučení jiné příčiny obtíží (chlopenní vady, postižení perikardu, plicní embolie apod), a také ve stratifikaci rizika odhalením případné systolické dysfunkce LK [1,8,9].
Nejdůležitější neinvazivní vyšetřovací metodou je zobrazení magnetickou rezonancí (MRI), která se v posledních letech stala rutinně dostupnou diagnostickou možností. Jde o zobrazovací metodu, která je schopna bez radiační zátěže nejen zhodnotit s vysokou přesností morfologii a funkci srdečního svalu, ale také se vyjádřit ke tkáňové charakteristice myokardu [33–37]. Ve snaze o standardizaci a zvýšení diagnostické přesnosti byla definována tzv. Lake Louise kritéria pro detekci myokarditidy, která zahrnují zhodnocení edému myokardu doprovázejícího akutní zánětlivé postižení pomocí T2 vážených obrazů, dále záchyt tzv. časného sycení myokardu gadoliniem (early gadolinium enhancement – EGE, který odráží zánětlivou hyperemii), a zejména zhodnocení přítomnosti pozdního sycení (late gadolinium enhancement – LGE) s nálezem charakteristického typu akumulace gadolinia v místech nekrózy myokardu či fibrotických reparačních změn (obr. 2) [38]. Přítomnost pozdního sycení je vedle diagnostického významu důležitá také pro prognostickou stratifikaci – nemocní s negativním nálezem mají dobrou prognózu, naopak přítomnost LGE se ukázala jako velmi významný negativní prediktor celkové i kardiovaskulární mortality [39]. Proto se MRI stala základním vyšetřením, které by při podezření na myokarditidu mělo být provedeno. Nejvyšší senzitivitu lze očekávat u akutních případů manifestujících se bolestmi na hrudi, na druhou stranu bylo prokázáno, že senzitivita pro kardiomyopatické formy je mnohem nižší a podle některých prací se pohybuje jen kolem 30 % [40]. Proto byl zcela recentně publikován expertní návrh s inovovanou metodikou hodnocení zahrnující vedle výše zmíněných klasických kritérií také T1 a T2 mapping (prodloužení T2 relaxačního času a zvýšení extracelulárního volumu, které ukazují na přítomnost zánětlivých změn). Tímto způsobem lze dosáhnout zvýšení senzitivity MRI, neodstraňuje však zásadní nedostatek MRI ve srovnání s EMB – neposkytuje nám informace nezbytné pro rozlišení jednotlivých typů myokarditidy a také nedává informaci o virové přítomnosti v myokardu [41].
Obr. 2. MRI LGE v oblasti laterální stěny. Zapůjčeno z archivu Kliniky zobrazovacích metod LF MU a FN u sv. Anny v Brně 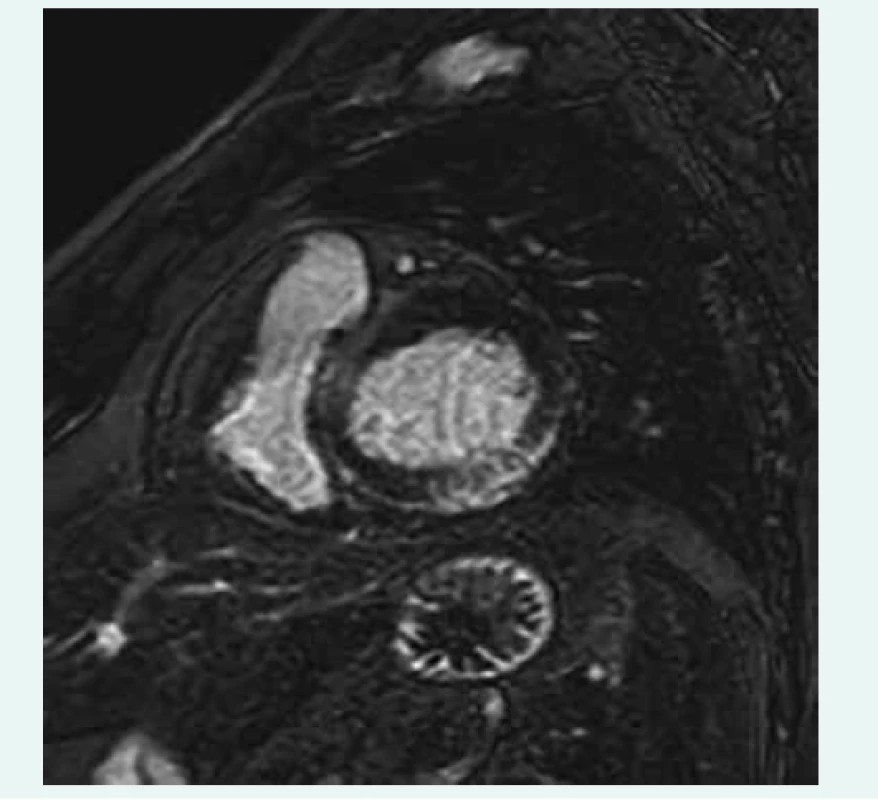
V diagnostice hrají důležitou roli laboratorní metody, zejména jde o detekci myokardiálního poškození, tedy elevace troponinů či CK-MB, které bývají přítomné v akutní fázi onemocnění a jejichž elevace má negativní prognostický význam. Mohou také sloužit k dlouhodobé monitoraci aktivity onemocnění. Zánětlivé markery mohou být elevovány, ale není to pravidlem, rovněž sérologická diagnostika z periferní krve se při srovnání s bioptickými nálezy neukázala jako přínosná [42].
Z invazivních diagnostických metod je zejména u nemocných nad 40 let vždy indikována koronarografie k vyloučení ischemické choroby srdeční jako možné příčiny obtíží. Měla by být provedena nejen u nemocných s klinickým podezřením na akutní koronární syndrom, ale také u všech ostatních klinických scénářů.
Zlatým standardem diagnostiky je endomyokardiální biopsie, která je vedle samotné detekce zánětu schopná určit i specifické podtypy myokarditid, a také případnou přítomnost patogenů v myokardu, což má zásadní prognostický i terapeutický dopad. Na indikaci EMB je jasná shoda v případech s klinickým podezřením na obrovskobuněčnou myokarditidu, na fulminantní myokarditidu, na eozinofilní myokarditidu či srdeční sarkoidózu, u nichž: máme k dispozici přesvědčivá data o profitu imunosupresivní léčby. V této situaci by mělo být provedení EMB bezodkladné, protože víme, že specifická léčba založená na znalosti výsledku EMB může přinést významný prognostický benefit [1–4,6–10,31,32]. V každodenní praxi se mnohem častěji než se zmíněnými typy myokarditid setkáváme s virovou či povirovou lymfocytární myokarditidou, která má lepší prognózu než tyto výše uvedené typy. Navíc data dokládající profit specifické léčby jsou u tohoto typu myokarditidy méně přesvědčivá, nicméně i zde existuje řada důvodů, proč EMB indikovat. Výsledek EMB může pomoci nejen ve stanovení správné diagnózy, ale současně je důležitý pro prognostickou stratifikaci, pro modifikaci běžné léčby či pro volbu specifické terapie, resp. zhodnocení jejího efektu, a také pro načasování některých terapeutických rozhodnutí, jako je indikace přístrojové léčby či rozhodnutí o srdeční transplantaci [16,17,25,28,29]. Poněkud problematickou skutečností však je, že neexistuje plná shoda na kritériích hodnocení, byť zmiňovaný Position statement ESC navrhl inovovaná kritéria pro bioptickou diagnostiku myokarditid [1]. Těmi se však ne všechna významná centra řídí a často používají svá vlastní kritéria.
Vedle těchto „tradičních“ diagnostických přístupů se objevuje snaha o využití nových metod, které by byly jednak senzitivnější a také méně invazivní (či zcela neinvazivní). Slibnými možnostmi se zdají být např. detekce odlišné transkripce některých genů umožňující s vysokou specificitou a senzitivitou odlišit myokarditidu/ZKMP od nezánětlivé DKMP. Další nadějí by mohlo být stanovení hladin určitých miRNA, což jsou malé nekódující RNA, která zasahují do regulace posttranskripční genové exprese a jejichž hladiny se v průběhu myokarditid mění [43–45].
Terapie
Problémem terapeutických doporučení pro oblast myokarditid a ZKMP je skutečnost, že máme k dispozici jen data z řady malých nekontrolovaných, monocentrických retrospektivních sledování. „Větší“ prospektivní randomizované studie jsou zcela ojedinělé, obvykle monocentrické, metodicky nesourodé a zahrnují často jen několik desítek nemocných [46–48].
Obecně panuje shoda na nezbytnosti omezení fyzické aktivity na dobu 6 měsíců, či do ústupu zánětu v kontrolní EMB anebo do restituce funkce LK. Základem farmakoterapie je při přítomné poruše systolické funkce LK podávání standardní léčby srdečního selhání podle platných Doporučení pro léčbu srdečního selhání sestávající zejména z ACEI/ARB, betablokátorů a antagonistů aldosteronu. U těchto lékových skupin máme navíc určitá experimentální i klinická data o možném pozitivním ovlivnění zánětlivých změn či prognózy nemocných se ZKMP. Naopak se nedoporučuje podávat nesteroidní antirevmatika a digoxin, což v animálních experimentech vedlo ke zhoršení funkce LK. V kritických případech je nezbytné využít mechanickou srdeční podporu, buď jako „most k úpravě“ nebo jako „most k srdeční transplantaci“. Přístup k léčbě arytmií či přístrojové prevenci náhlé srdeční smrti by v akutní fázi měl být pokud možno zdrženlivý vzhledem k možné reverzibilitě stavu při ústupu zánětlivých změn [1–4,6–9].
Efekt specifické či cílené léčby myokarditid je pro některé definované podtypy myokarditid relativně dobře doložen. Imunosupresivní léčba je spojena se zřetelně potvrzeným profitem především v případech obrovskobuněčné myokarditidy, dále u eozinofilní myokarditidy a také u myokarditidy doprovázející autoimunitní choroby a též u srdeční sarkoidózy. Terapeutická schémata se mezi těmito jednotlivými diagnózami liší, a proto je jejich odlišení důležité i z terapeutických důvodů. Jak bylo zmíněno, nejčastějším typem jsou virové (či povirové) lymfocytární myokarditidy. U tohoto typu myokarditid jsou k dispozici data ze 3 randomizovaných studií hodnotících efekt imunosupresivní léčby na echokardiografické a klinické ukazatele u nemocných se ZKMP. Největší a nejstarší z nich – Myocarditis Treatment Trial – pochází ještě z éry histologického hodnocení zánětlivých změn a bylo do ní zařazeno 111 nemocných. V této studii nebylo podání imunosuprese spojeno s žádným prospěchem, ale ani se zhoršením sledovaných parametrů [46]. Naopak ve 2 dalších studiích (Wojniczova studie a Frustaciho studie TIMIC), do nichž bylo zařazeno 84, resp. 85 nemocných s chronickou lymfocytární myokarditidou se symptomy delšími než 6 měsíců, byl doložen pozitivní vliv imunosupresivní léčby (kombinace prednisonu a azatioprinu) přidané k běžné léčbě srdečního selhání na vývoj echokardiografických parametrů ve srovnání se samotnou standardní léčbou srdečního selhání [47,48]. Metaanalýza z roku 2016 ukázala, že imunosupresivní léčba nemá vliv na mortalitu či nutnost srdeční transplantace, ale byl patrný příznivý efekt na zlepšení systolické funkce LK [49]. Výsledky retrospektivní bicentrické studie z roku 2018 naopak ukázaly zlepšené přežívání a výraznější zvýšení EF LK u nemocných, kteří byli léčeni imunosupresí oproti skupině léčené standardní terapií [50]. Podávání imunoglobulinů u dospělých jedinců přineslo v několika malých studiích vcelku příznivé výsledky, největší multicentrická práce McNamary však neprokázala žádný profit proti placebu, ovšem histologicky potvrzenou myokarditidu měla jen malá část zařazených nemocných [51]. Podobně nejasná je situace u imunoadsorpce: experimentální práce i některé malé studie prokázaly vliv na zlepšení funkce LK, snížení hladin biomarkerů a ústup zánětlivých změn v myokardu, větší multicentrická studie hodnotící tento způsob léčby ale chybí [1–4]. Také v oblasti antivirotické léčby existují značně kontroverzní data. Teoreticky by tato léčba byla opodstatněná v první fázi onemocnění spojené s virovou replikací, ovšem myokarditida je v klinické medicíně obvykle rozpoznána až ve fázi druhé, kdy je již jejich podání pravděpodobně málo přínosné. V některých studiích z berlínského centra se ukázala jako prospěšná léčba interferonem β, který dokáže odstranit enteroviry a adenoviry z myokardu, na jiné častější typy virů je však méně účinná. Podle německých autorů by minimálně v případě enterovirů mohla být léčba interferonem β spojena s dlouhodobým prognostickým benefitem [52]. Dlouho očekávané výsledky studie BICC přinesly ale zklamání: jediným statisticky významným efektem léčby interferonem β bylo zlepšení funkčního stavu nemocných v prvních 12 týdnech a zlepšení kvality života hodnocené minnesotským dotazníkem [53].
Závěr
Stanovení diagnózy myokarditidy zůstává přes velký rozmach diagnostických metod nadále značnou výzvou. Vyžaduje komplexní diagnostický přístup s využitím řady neinvazivních a také invazivních metod, stejně jako dostatečné laboratorní zázemí. V současnosti se z neinvazivních diagnostických metod stala první volbou MRI, jejíž hodnocení má však řadu úskalí. Zlatým standardem, zejména v případech s dysfunkcí levé komory, zůstává EMB – na základě bioptického nálezu lze nejen přesněji stratifikovat prognózu nemocných, ale také rozhodnout o terapii. Vzhledem k tomu, že u většiny nemocných s prokázanou myokarditidou dochází po odeznění akutní fáze nemoci ke zřetelnému zlepšení funkce LK, je v těchto případech vhodné (pokud to klinický stav umožní), odsunout zásadní terapeutická rozhodnutí (jako např. implantace kardioverteru/defibrilátoru, indikace srdeční transplantace apod) o 3–6 měsíců od začátku onemocnění. Evidence pro specifické léčebné postupy není až na specifické podtypy myokarditid zcela přesvědčivá, a proto v rozhodování hraje důležitou roli individuální posouzení každého konkrétního případu.
Podpořeno grantem AZV Ministerstva zdravotnictví ČR 16–30537A.
Doručeno do redakce 1. 4. 2019
Přijato po recenzi 23. 9. 2019
doc. MUDr. Jan Krejčí, Ph.D.
I. interní kardioangiologická klinika LF MU a FN u sv. Anny v Brně
Zdroje
- Caforio ALP, Pankuweit S, Arbustini E et al. Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J 2013; 34 : 2636–2648, 2648a-2648d. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/eht210>.
- Kindermann I, Barth C, Mahfoud F et al. Update on myocarditis. J Am Coll Cardiol 2012; 59(9): 779–792. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2011.09.074>.
- Cooper LT. Myocarditis. N Engl J Med 2009; 360(15): 1526–1538. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMra0800028>.
- Trachtenberg BH, Hare JM. Inflammatory Cardiomyopathic Syndromes. Circ Res 2017; 121(7): 803–818. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCRESAHA.117.310221>.
- Lund LH, Edwards LB, Dipchand AI et al. The Registry of the International Society for Heart and Lung Transplantation: Thirty-third Adult Heart Transplantation Report-2016; Focus Theme: Primary Diagnostic Indication for Transplant. J Heart Lung Transplant 2016; 35(10): 1158–1169. Dostupné z DOI: <http://dx.doi.org/10.1016/j.healun.2016.08.017>.
- Heymans S, Eriksson U, Lehtonen J et al. Quest for New Approaches in Myocarditis and Inflammatory Cardiomyopathy. J Am Coll Cardiol 2016; 68(21): 2348–2364. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2016.09.937>.
- Dennert R, Crijns HJ, Heymans S. Acute viral myocarditis. Eur Heart J 2008; 29(17): 2073–2082. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehn296>.
- Schultheiss HP, Kühl U, Cooper LT. The management of myocarditis. Eur Heart J 2011; 32(21): 2616–2625.Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehr165>.
- Krejci J, Mlejnek D, Sochorova D et al. Inflammatory Cardiomyopathy: A Current View on the Pathophysiology, Diagnosis, and Treatment. Biomed Res Int 2016; 2016 : 4087632. Dostupné z DOI: <http://dx.doi.org/10.1155/2016/4087632>.
- Richardson P, McKenna W, Bristow M et al. Report of the 1995 World Health Organisation/International Society and Federation of Cardiology Task Force on the Definition and Classification of cardiomyopathies. Circulation 1996; 93(5): 841–842. Dostupné z DOI: <http://dx.doi.org/10.1161/01.cir.93.5.841>.
- Aretz HAT, Billingham ME, Edwards WD et al. Myocarditis. A histopathologic definition and classification. Am J Cardiovasc Pathol 1987; 1(1): 3–14.
- Kühl U, Noutsias M, Seeberg B et al. Immunohistological evidence for chronic intramyocardial inflammatory process in dilated cardiomyopathy. Heart 1996; 75(3): 295–300. Dostupné z DOI: <http://dx.doi.org/10.1136/hrt.75.3.295>.
- Maisch B, Portig I, Ristic A et al. Definition of inflammatory cardiomyopathy (myocarditis): on the way to consensus. A status report Herz 2000; 25(3): 200–209.
- Caforio ALP, Marcolongo R, Basso C et al. Clinical presentation and diagnosis of myocarditis. Heart 2015; 101(16): 1332–1344. Dostupné z DOI: <http://dx.doi.org/10.1136/heartjnl-2014–306363>.
- Hufnagel G, Pankuweit S, Richter A et al. The European Study of Epidemiology and Treatment of Cardiac Inflammatory Diseases (ESETCID): first epidemiological results. Herz 2000; 25(3): 279–285.
- Kühl U, Pauschinger M, Noutsias M et al. High prevalence of viral genomes and multiple viral infections in the myocardium of adults with „idiopathic“ left ventricular dysfunction. Circulation 2005; 111(7): 887–893. Dostupné z DOI: <http://dx.doi.org/10.1161/01.CIR.0000155616.07901.35>.
- Krejci J, Poloczkova H, Hude P et al. Impact of inflammatory infiltration and viral genome presence in myocardium on the changes of echocardiographic parameters. Cor et Vasa 2013; 55(4): e333-e340. Dostupné z DOI: <https://doi.org/10.1016/j.crvasa.2013.02.003>
- Kuethe F, Lindner J, Matschke K et al. Prevalence of parvovirus B19 and human bocavirus DNA in the heart of patients with no evidence of dilated cardiomyopathy or myocarditis. Clin Infect Dis 2009; 49(11): 1660–1666. Dostupné z DOI: <http://dx.doi.org/10.1086/648074>.
- Escher F, Modrow S, Sabi T et al. Parvovirus B19 profiles in patients with acute myocarditis and chronic dilated cardiomyopathy. Med Sci Monit 2008; 14: CR589-CR597.
- Verdonschot J, Hazebroek M, Merken J et al. Relevance of cardiac parvovirus B19 in myocarditis and dilated cardiomyopathy: review of the literature. Eur J Heart Fail 2016; 18(12): 1430–1441. Dostupné z DOI: <http://dx.doi.org/10.1002/ejhf.665>.
- Bock CT, Düchting A, Utta F et al. Molecular phenotypes of human parvovirus B19 in patients with myocarditis. World J Cardiol 2014; 6(4): 183–195. Dostupné z DOI: <http://dx.doi.org/10.4330/wjc.v6.i4.183>.
- Wehlou C, Delanghe JR. Detection of antibodies in cardiac autoimmmunity. Clin Chim Acta 2009; 408(1–2): 114–122. Dostupné z DOI: <http://dx.doi.org/10.1016/j.cca.2009.08.002>.
- Caforio AL, Mahon NJ, Tona F et al. Circulating cardiac autoantibodies in dilated cardiomyopathy and myocarditis: pathogenetic and clinical significance. Eur J Heart Fail 2002; 4(4): 411–417. Dostupné z DOI: <http://dx.doi.org/10.1016/s1388–9842(02)00010–7>.
- Rose NR. Myocarditis: infection versus autoimmunity. J Clin Immunol 2009; 29(6): 730–737. Dostupné z DOI: <http://dx.doi.org/10.1007/s10875–009–9339-z>.
- Krejci J, Hude P, Ozábalová E et al. Improvement of left ventricular systolic function in inflammatory cardiomyopathy: What plays a role? Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2016; 160(4): 524–532. Dostupné z DOI: <http://dx.doi.org/10.5507/bp.2016.033>.
- Caforio ALP, Calabrese F, Angelini A et al. A prospective study of biopsy-proven myocarditis: prognostic relevance of clinical and aetiopathogenetic features at diagnosis. Eur Heart J 2007; 28(11): 1326–1333. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehm076>.
- Fairweather D, Cooper LT, Blauwet LA. Sex and gender differences in myocarditis and dilated cardiomyopathy. Curr Probl Cardiol 2013; 38(1): 7–46. Dostupné z DOI: <http://dx.doi.org/10.1016/j.cpcardiol.2012.07.003>
- D’Ambrosio A, Patti G, Manzoli A et al. The fate of acute myocarditis between spontaneous improvement and evolution to dilated cardiomyopathy: a review. Heart 2001; 85(5): 499–504. Dostupné z DOI: <http://dx.doi.org/10.1136/heart.85.5.499>.
- Krejci J, Hude P, Poloczkova H et al. Correlations of the changes in bioptic findings with echocardiographic, clinical and laboratory parameters in patients with inflammatory cardiomyopathy. Heart Vessels 2016; 31(3): 416–426. Dostupné z DOI: <http://dx.doi.org/10.1007/s00380–014–0618–0>.
- McCarthy RE, Boehmer JP, Hruban RH et al. Long-term outcome of fulminant myocarditis as compared with acute (nonfulminant) myocarditis. N Engl J Med 2000; 342(10): 690–695. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJM200003093421003>.
- Kandolin R, Lehtonen J, Salmenkivi K et al. Diagnosis, treatment, and outcome of giant-cell myocarditis in the era of combined immunosuppression. Circ Heart Fail 2013; 6(1): 15–22. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCHEARTFAILURE.112.969261>.
- Blauwet LA, Cooper LT. Idiopathic giant cell myocarditis and cardiac sarcoidosis. Heart Fail Rev 2013; 18(6): 733–746. Dostupné z DOI: <http://dx.doi.org/10.1007/s10741–012–9358–3>.
- Baccouche H, Mahrholdt H, Meinhardt G et al. Diagnostic synergy of non-invasive cardiovascular magnetic resonance and invasive endomyocardial biopsy in troponin-positive patients without coronary artery disease. Eur Heart J 2009; 30(23): 2869–2879. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehp328>.
- Olimunder MA, van Els J, Galjee MA. The importance of cardiac MRI as a diagnostic tool in viral myocarditis-induced cardiomyopathy. Neth Heart J 2009; 17(2): 481–486. Dostupné z DOI: <http://dx.doi.org/10.1007/bf03086308>.
- Bruder O, Wagner A, Lombardi M et al. European Cardiovascular Magnetic Resonance (EuroCMR) registry – multinational results from 57 centers in 15 countries. J Cardiovasc Magn Reson 2013; 15 : 9. Dostupné z DOI: <http://dx.doi.org/10.1186/1532–429X-15–9>.
- Lurz P, Eitel I, Adam J et al. Diagnostic performance of CMR imaging compared with EMB in patients with suspected myocarditis. JACC Cardiovasc Imaging 2012; 5(5): 513–524. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jcmg.2011.11.022>.
- Kuchynka P, Palecek T, Nemecek E et al. New therapeutic aspects on inflammatory cardiomyopathy. Curr Pharm Des 2015; 21(4): 459–465. Dostupné z DOI: <http://dx.doi.org/10.2174/138161282104141204142244>.
- Friedrich MG, Sechtem U, Schulz-Menger J et al. Cardiovascular magnetic resonance in myocarditis: a JACC White paper. J Am Coll Cardiol 2009; 53(17): 1475–1487. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2009.02.007>.
- Grün S, Schumm J, Greulich S et al. Long-term follow-up of biopsy-proven viral myocarditis: predictors of mortality and incomplete recovery. J Am Coll Cardiol 2012; 59(18): 1604–1615. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2012.01.007>.
- Francone M, Chimenti C, Galea A et al. CMR sensitivity varies with clinical presentation and extent of cell necrosis in biopsy-proven acute myocarditis. JACC Cardiovasc Imaging 2014; 7(3): 254–263. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jcmg.2013.10.011>.
- Ferreira VM, Schulz-Menger J, Holmvang G et al. Cardiovascular Magnetic Resonance in Nonischemic Myocardial Inflammation: Expert Recommendations. J Am Coll Cardiol 2018; 72(24): 3158–3176. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2018.09.072>.
- Mahfoud F, Gärtner B, Kindermann M et al. Virus serology in patients with suspected myocarditis: utility or futility? Eur Heart J 2011; 32(7): 897–903. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehq493>.
- Heidecker B, Kittleson MM, Kasper EK et al. Transcriptomic biomarkers for the accurate diagnosis of myocarditis. Circulation 2011; 123(11): 1174–1184. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCULATIONAHA.110.002857>.
- Cooper LT, Onuma OK, Sagar S et al. Genomic and proteomic analysis of myocarditis and dilated cardiomyopathy. Heart Fail Clin 2010; 6(1): 75–85. Dostupné z DOI: <http://dx.doi.org/10.1016/j.hfc.2009.08.012>.
- Corsten MF, Papageorgiou A, Verhesen W et al. MicroRNA profiling identifies microRNA-155 as an adverse mediator of cardiac injury and dysfunction during acute viral myocarditis. Circ Res 2012; 111(4): 415–425. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCRESAHA.112.267443>.
- Mason JW, O´Connell JB, Herskowitz A et al. A clinical trial of immunosuppressive therapy for myocarditis. The Myocarditis Treatment Trial Investigators. N Engl J Med 1995; 333(5): 269–275. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJM199508033330501>.
- Frustaci A, Russo MA, Chimenti C. Randomized study on the efficacy of immunosuppressive therapy in patients with virus-negative inflammatory cardiomyopathy: the TIMIC study. Eur Heart J 2009; 30(16): 1995–2002. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehp249>.
- Wojnicz R, Nowalany-Kozielska E, Wojciechowska C et al. Randomized, placebo controled study for immunosuppressive treatment of inflammatory dilated cardiomyopathy. Circulation 2001; 104(1): 39–45. Dostupné z DOI: <http://dx.doi.org/10.1161/01.cir.104.1.39>.
- Lu C, Qin F, Yan Y et al. Immunosuppressive treatment for myocarditis: a meta-analysis of randomized controlled trials. J Cardiovasc Med (Hagerstown) 2016; 17(8): 631–637. Dostupné z DOI: <http://dx.doi.org/10.2459/JCM.0000000000000134>.
- Merken J, Hazebroek M, Van Paassen P et al. Immunosuppressive Therapy Improves Both Short - and Long-Term Prognosis in Patients With Virus-Negative Nonfulminant Inflammatory Cardiomyopathy. Circ Heart Fail 2018; 11(2): e004228. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCHEARTFAILURE.117.004228>.
- Kühl U, Lassner D, von Schlippenbach J et al. Interferon-beta improves survival in enterovirus-associated cardiomyopathy. J Am Coll Cardiol 2012; 60(14): 1295–1296. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2012.06.026>.
- Schultheiss HP, Piper C, Sowade O et al. Betaferon in chronic viral cardiomyopathy (BICC) trial: Effects of interferon-β treatment in patients with chronic viral cardiomyopathy. Clin Res Cardiol 2016; 105(9): 763–773. Dostupné z DOI: <http://dx.doi.org/10.1007/s00392–016–0986–9>.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2019 Číslo 10- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Úvodník
- Interdisciplinární spolupráce k maximálnímu zrychlení dostupnosti moderní léčby ischemických iktů pro všechny nemocné, kteří potřebují endovaskulární trombektomii
- Novinky ve farmakologické léčbě srdečního selhání
- Nová evropská guidelines diagnostiky a léčby hypertenze 2018 – stručný komentář
- Akutní a rekurentní perikarditida
- Profylaxe infekční endokarditidy – nekonečný příběh s pestrou minulostí, neurčitou přítomností a nejasnou budoucností
- Zánětlivá onemocnění myokardu
- Současné a budoucí trendy v léčbě dyslipidemií
- Genetické vyšetření u pacientů s hypertrofickou kardiomyopatií
- Tako-tsubo syndrom
- Odešel profesor Marek, velký internista, endokrinolog, ale především velký člověk
- Z odborné literatury
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Akutní a rekurentní perikarditida
- Novinky ve farmakologické léčbě srdečního selhání
- Tako-tsubo syndrom
- Profylaxe infekční endokarditidy – nekonečný příběh s pestrou minulostí, neurčitou přítomností a nejasnou budoucností
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



