-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Heterogenita lymfocytov ako ústredných operačných jednotiek imunitného systému
Heterogeneity of lymphocytes as central operating units of the immune system
Immune response is divided into natural and adaptive although such strict division is rather contentious as one type of immunity influences another one and vice-versa; moreover, there are cells and immune mechanisms, which stay somewhere in an interface. B and T lymphocytes represent principal cells of adaptive immunity. Not one of them form a uniform population. B cells comprise of three subpopulations (follicular, B1, marginal zone). Concerning T cells, the situation is more complicated. There are two basic populations, that expressing T cell receptors α, β and that expressing γ, δ receptors. T cells αβ are very heterogeneous; we can distinguish helper, cytotoxic and regulatory cells. Moreover, among T helper cell, are there seven subsets. Except the above-mentioned effector B and T cells, each group has its counterpart in the form of memory cells, wherein the memory T cell are of three types. The other group of lymphocytes represent so-called unconventional cells. NK, NKT a MAIT are their representatives; they are also heterogeneous. Ultimately, a novel group of cells appeared recently. It stays just on the interphase between natural and adaptive immunity. We know these cells under the name innate lymphoid cells (ILCs). They are also not uniform – three basic populations are well characterized: ILC1, ILC2, ILC3. Moreover, in the frame of each family, we can distinguish more subsets. Enumeration of said cell types indicates complexity and mutual interconnection of immune processes in order to maintain biological integrity of an individual.
Keywords:
B cells – ILC cells – MAIT – NK – NKT – subsets of lymphoid cells – T cells
Autoři: Milan Buc
Působiště autorů: Imunologický ústav LF UK v Bratislave, Slovenská republika
Vyšlo v časopise: Vnitř Lék 2019; 65(2): 86-97
Kategorie: Přehledné referáty
Souhrn
Imunitnú odpoveď delíme na prirodzenú a adaptívnu, i keď takéto striktné delenie je sporné, lebo jeden typ imunity ovplyvňuje druhý a naopak. Navyše existuje skupina buniek a imunitných mechanizmov, ktoré stoja niekde na rozhraní. B-lymfocyty a T-lymfocyty sú základnými predstaviteľmi adaptívnej imunity. Ani jedni z nich netvoria jednotnú populáciu. B-lymfocyty majú 3 subpopulácie (folikulové, B1 a marginálnej zóny). Pri T-lymfocytoch je situácia zložitejšia. Existujú 2 základné skupiny, tie s antigénovým receptorom α, β a tie s antigénovým receptorom γ, δ. T-lymfocyty αβ sú veľmi heterogénne; poznáme pomocné, cytotoxické a regulačné. Navyše pomocné T-lymfocyty sa delia na 7 subpopulácií. Okrem uvedených efektorových B-lymfocytov a T-lymfocytov, každá skupina má svoj náprotivok v podobe pamäťových buniek, pričom pamäťové T-lymfocyty sú 3 typov. Ďalšie skupiny lymfocytov označujeme ako nekonvenčné. Reprezentujú ich bunky NK, NKT a MAIT. Napokon v nedávnej dobe sa objavila skupina buniek, ktorá je práve na rozhraní medzi prirodzenou a adaptívnou imunitou. Ide o prirodzené lymfoidné bunky (Innate Lymphoid Cells – ILC). Tie tiež nie sú jednotné; v súčasnosti rozlišujeme 3 ich základné populácie: ILC1, ILC2 a ILC3. Navyše v rámci danej rodiny možno rozlíšiť ďalšie subpopulácie. Vymenovanie uvedených typov buniek poukazuje na komplexnosť a vzájomnú prepojenosť imunitných procesov v záujme udržania biologickej integrity jedinca.
Klíčová slova:
B lymfocyty – ILC bunky – MAIT – NK – NKT – subpopulácie lymfocytov – T lymfocyty
Úvod
Ľudia sú počas svojho života kontinuálne exponovaní početným patogénnym i nepatogénnym mikroorganizmom a napriek tomu prežívajú mnoho dekád bez vážnych infekcií, a to dokonca i v pokročilom veku. Túto schopnosť organizmu človeka zabezpečujú mechanizmy prirodzenej a adaptívnej imunity. V rámci adaptívnej imunity majú principiálnu úlohu lymfocyty. Na začiatku našich poznatkov o tejto skupine buniek sme poznali len B-lymfocyty a T-lymfocyty. Dnes je situácia omnoho zložitejšia a pribudli k nim ďalšie bunky so špecifickými funkciami. Navyše, každá z týchto populácií buniek nie je uniformnou, ale zahrňuje v sebe viacero subpopulácií. Cieľom tohto prehľadného článku je podať základnú charakteristiku jednotlivých populácií a subpopulácií lymfocytov a poukázať nielen na ich fyziologickú funkciu, ale naznačiť aj na ich účasť v patologických procesoch.
B-lymfocyty
B-lymfocyty sa u človeka vyvíjajú z pluripotentnej kmeňovej bunky priamo v kostnej dreni. Vývoj B-lymfocytov možno rozdeliť na 2 štádiá – na štádium nezávislé a závislé od prítomnosti antigénu v organizme. Štádium nezávislé od antigénu sa odohráva v kostnej dreni a predstavuje dozrievanie nezrelých B-lymfocytov na zrelé, plne funkčné bunky. Zrelé B-lymfocyty, ktoré označujeme aj ako naivné, opúšťajú kostnú dreň a krvou a lymfou sa dostávajú do sekundárnych lymfoidných orgánov, najmä sleziny a lymfatických uzlín. Ak sa B-lymfocyt stretne s antigénom, pre ktorý nesie špecifický receptor, začne proliferovať a diferencovať sa na plazmatické bunky; súčasne sa diferencuje aj na pamäťové bunky a dlho žijúce plazmatické bunky. Diferenciácia B-lymfocytov na plazmatické bunky či pamäťové B-lymfocyty úplne závisí od prítomnosti antigénu v organizme, preto toto obdobie označujeme ako štádium závislé od antigénu. Ak sa naivný B-lymfocyt so „svojím“ antigénom nestretne, približne za 4–8 týždňov hynie. Plazmatické bunky, ktoré syntetizujú a secernujú špecifické protilátky (samotné B-lymfocyty protilátky neprodukujú), sú vysoko aktívne: jedna plazmatická bunka vyprodukuje viac ako 10 000 protilátok za sekundu. Jedna skupina plazmatických buniek žije len krátko, kým druhá mnoho mesiacov ba dokonca aj rokov [1].
Antigénový receptor zrelých B-lymfocytov tvorí membránový IgD (mIgD) a membránový IgM (mIgM), ktoré majú rovnakú špecifickosť (aktivované a pamäťové B-lymfocyty majú receptory iných tried). Cytoplazmový úsek mIgD, resp. mIgM je veľmi krátky, má len 3 aminokyselinové jednotky, čo už samo osebe naznačuje, že sa nebudú môcť podieľať na prenose signálu a budú ho zabezpečovať iné molekuly. Zistilo sa, že mIg sa spája s heterodimérom skladajúcim sa z α - a β-reťazca, ktoré navzájom spájajú disulfidové väzby. Antigénový receptor B-lymfocytov (B Cell Receptor – BCR) je teda komplexná štruktúra, ktorá sa skladá sa z mIg a Igα/Igβ-heterodiméru (schéma 1). Membránový imunoglobulín zodpovedá za rozpoznanie antigénu a heterodimér za prenos signálu [2,3].
Schéma 1. Receptor a koreceptor B-lymfocytov. Receptor B-lymfocytov (BCR) tvorí membránový IgD, alebo IgM. Jeho upevnenie v membráne a prenos signálu dovnútra bunky zabezpečujú postranné reťazce Igα a Igβ, ktoré majú ITAM úseky, na ktoré sa pripínajú tyrozínkinázy. Koreceptor B-lymfocytov tvorí komplex membránových molekúl CD81, CR2 a CD19. Väzbou CR2 na antigén s nadviazaným C3d, ktorý predtým rozpoznal a zachytil membránový IgM, sa CD19 priblíži ku BCR-kinázam, ktoré fosforylujú jeho ITAM úsek. Následne sa na fosforylovaný CD19 nadviaže fosfo-inozitol- 3 (PI-3) kináza, ktorá signalizačné procesy ďalej prehlbuje 
B-lymfocyty majú vo svojej membráne okrem komplexu antigénového receptora BCR ešte aj pomocný receptor. B-lymfocytový koreceptor sa skladá z 3 samostatných reťazcov, ktorých označenie je CD19, CD21 a CD81 (v praxi rozlišujeme jednotlivé skupiny buniek imunitného systému na podklade tzv. CD znakov; (CD – Cluster of Differentiation, schéma 1 [4]. CD21 je vlastne receptorom pre štiepne fragmenty C3d komplementového systému (CR2), ktoré sa predtým nadviazali na antigén rozpoznávaný antigénovým receptorom B-lymfocytov. CD81 je transmembránový proteín, ktorý prechádza membránou 4-krát (tetraspanín) a prepája CR2 s CD19 a umožňuje, aby CD19 sa dostal do blízkosti tyrozínkináz asociovaných s BCR, ktoré ho ľahko fosforylujú, čím sa aktivačný proces B-lymfocytu zosilňuje. Zníženie prahu aktivácie B-lymfocytu je dôležité najmä vo včasných fázach B-lymfocytovej proliferácie vo folikuloch, keď je afinita protilátok ešte malá a počet T-lymfocytov špecifických pre daný antigén je nízky [5,6].
B-lymfocyty nie sú jednotnou populáciou buniek. Vyššie opisované B-lymfocyty, ktoré na svoju aktiváciu potrebujú pomoc zo strany pomocných T-lymfocytov a usídľujú sa v oblastiach v blízkosti T-lymfocytovej zóny, teda vo folikuloch, označujeme ako folikulové B-lymfocyty a možno ich zaradiť k bunkám typickej adaptívnej imunity. Tu po aktivácii antigénom a pomoci zo strany pomocných T-lymfocytov (Th) sa diferencujú na plazmablasty. Tieto proliferujú a diferencujú sa na plazmatické bunky, ktoré produkujú protilátky príslušnej triedy imunoglobulínov, ktoré viažu antigén vysokoafinitne. Plazmablasty sa dostávajú aj do kostnej drene, v ktorej sa diferencujú na dlhodobo žijúce plazmatické bunky, a väčšina protilátok, ktoré máme v plazme, pochádza od nich [7,8].
Okrem folikulových B-lymfocytov existujú 2 subpopulácie, ktoré na antigén odpovedajú priamo, bez pomoci Th-lymfocytov. Ide o B1-lymfocyty a B2-lymfocyty. Pochádzajú zo samostatných kmeňových buniek. Najcharakteristickejšou črtou B1-lymfocytov je, že produkujú nízkoafinitné protilátky triedy IgM, ktoré rozpoznávajú niektoré autoantigény, ako sú polysacharidy, glykolipidy a glykoproteíny, ako aj antigény bunkovej steny baktérií či obalové proteíny vírusov. Tieto autoprotilátky nie sú patogénne a predpokladá sa, že odstraňujú starnúce bunky či proteíny a poskytujú prvú obrannú líniu v boji proti baktériám či vírusom; označujeme ich preto ako „prirodzené protilátky“. K prirodzeným protilátkam patria napr. aj izohemaglutiníny. B1-lymfocyty sú aj významným zdrojom produkcie IL10 [9]. Sú to teda bunky, ktoré nezávisia od pomoci T-lymfocytov, aj keď cytokíny, ktoré tieto bunky syntetizujú, ich ovplyvňujú. B1-lymfocyty sa vyznačujú prítomnosťou membránových molekúl CD5, CD20, CD27 a CD43 [9–11]. B1-lymfocyty u človeka prevažujú najmä vo fetálnom živote, neskôr sa ich počet znižuje. V cirkulácii plodu sa vyskytujú vo veľmi vysokom percente, v pupočníkovej krvi ich je 60–80 %; po narodení tento počet postupne klesá, takže v krvi dospelých predstavujú len 5 % z celkového množstva cirkulujúcich B-lymfocytov. Pri myšiach sídlia prevažne v omente, v zhlukoch lymfoidného tkaniva, ktoré označujeme ako „mliečne škvrny“; menej ich je v lymfatických uzlinách [12]. U človeka je situácia menej jasná, zistili sa v lymfatických uzlinách, slezine, peritonenálnej dutine, omente a v periférnej krvi [11,13].
S populáciou B1 B-lymfocytov sa spájajú autoimunitné procesy. Ich počet je zvýšený pri reumatoidnej artritíde, Sjögrenovom syndróme, SLE, Gravesovej chorobe, autoimunitnom diabetes mellitus a pri iných chorobách. Význam tohto zvýšenia nepoznáme, predpokladá sa, že fungujú ako bunky prezentujúce antigén pri prezentácii autoantigénu self-reaktívnym T-lymfocytom, ale na produkcii patogenetických protilátok sa pravdepodobne nepodieľajú [14].
Klasická aktivácia folikulových B-lymfocytov, ktorá si vyžaduje pomoc zo strany T-lymfocytov, trvá približne 7 dní. Je to pomerne dlhá doba, počas ktorej by napadnutý jedinec bol vlastne nechránený. Aby sa tomu predišlo, príroda vytvorila možnosť aktivácie B-lymfocytov bez pomoci T-lymfocytov. B-lymfocyty, ktoré takto dokážu reagovať, patria k skupine B2-lymfocytov. Usadzujú sa v plášťovej (marginálnej) zóne bielej pulpy sleziny, tesne pri sínusoch, označujú sa preto častejšie ako B-lymfocyty marginálnej zóny (BMZ-lymfocyty), obr. Okrem nich v sieti, ktorú vytvárajú strómové retikulové bunky, sa tu nachádzajú aj dendritové bunky (Dendritic Cells – DC), makrofágy a neutrofily. Táto ich pozícia im umožňuje ľahko prísť do kontaktu s antigénmi, pretože prietok krvi cez marginálnu zónu je pomalý, a tak promptne reagovať na antigény (najmä na polysacharidové), ktoré sa krvou dostávajú do sleziny, a tvoriť protilátky triedy IgM [6,7]. Najnovšie sa zistilo, že BMZ-lymfocyty sa nachádzajú aj pri vnútornej stene subkapsulových sínusov lymfatických uzlín, v kryptách tonzíl a v subepitelovom priestore Peyerových plakov [15,16]. Našli sa aj v krvi, čo znamená, že recirkulujú [17]. BMZ-lymfocyty sú vybavené nízkoafinitnými polyreaktívnymi imunoglobulínovými receptormi a vzorkovými receptormi, najmä rodiny TLR (Toll Like Receptors), čo im umožňuje rozpoznávať početné antigény mikroorganizmov. Dendritové bunky (DC), ktoré odpovedajú na infekčné zárodky, produkujú okrem iného aj transkripčné faktory BAFF a APRIL, a tie spolu so signálmi, ktoré B-lymfocyt získava rozpoznaním antigénov a TLR ligandov spôsobia, že začne produkovať aj protilátky triedy IgG, menej IgA [7]. Táto skutočnosť je nová, doteraz sa myslelo, že túto funkciu majú iba folikulové B-lymfocyty.
Obr. Rozmiestnenie B-lymfocytov a T-lymfocytov v slezine. T-lymfocyty obklopujú malé cievky – arterioly a vytvárajú okolo nich manžetu. B-lymfocyty sú v ich tesnom susedstve, vo folikuloch. Aj periarteriolové lymfoidné tkanivovo aj folikuly obklopuje pás, ktorý označujeme ako marginálnu zónu 
Napokon sa treba zmieniť o pamäťových B-lymfocytoch, ktoré vznikajú iba z folikulových B-lymfocytov. Naivné majú v svojej membráne IgM a IgD, pamäťové navyše ešte ďalší izotyp, pričom počet IgD býva často veľmi redukovaný, resp. chýba (čiže majú buď IgM + IgG, alebo IgM + IgA, alebo IgM + IgE). Niektoré pamäťové bunky vlastnia membránový imunoglobulín len jedného izotypu. Ďalší membránový znak, ktorým sa pamäťové bunky líšia od naivných, je molekula, ktorá sa označuje ako J11d. Naivné B-lymfocyty jej majú veľa, kým pamäťové presne naopak. Opačná situácia je s CD27 antigénom; naivné B-lymfocyty ho nemajú, pamäťové áno. Ďalej, pamäťové B-lymfocyty, v porovnaní s naivnými, majú väčšie množstvo rôznych adhezívnych molekúl. Rozdiely medzi naivnými a pamäťovými B-lymfocytmi sa uvádzajú v tab. 1. Jedna časť pamäťových B-lymfocytoch zostáva v mieste svojho vzniku, kým druhá časť recirkuluje medzi lymfoidnými orgánmi [18,19].
Tab. 1. Porovnanie vlastností naivných a pamäťových B-lymfocytov 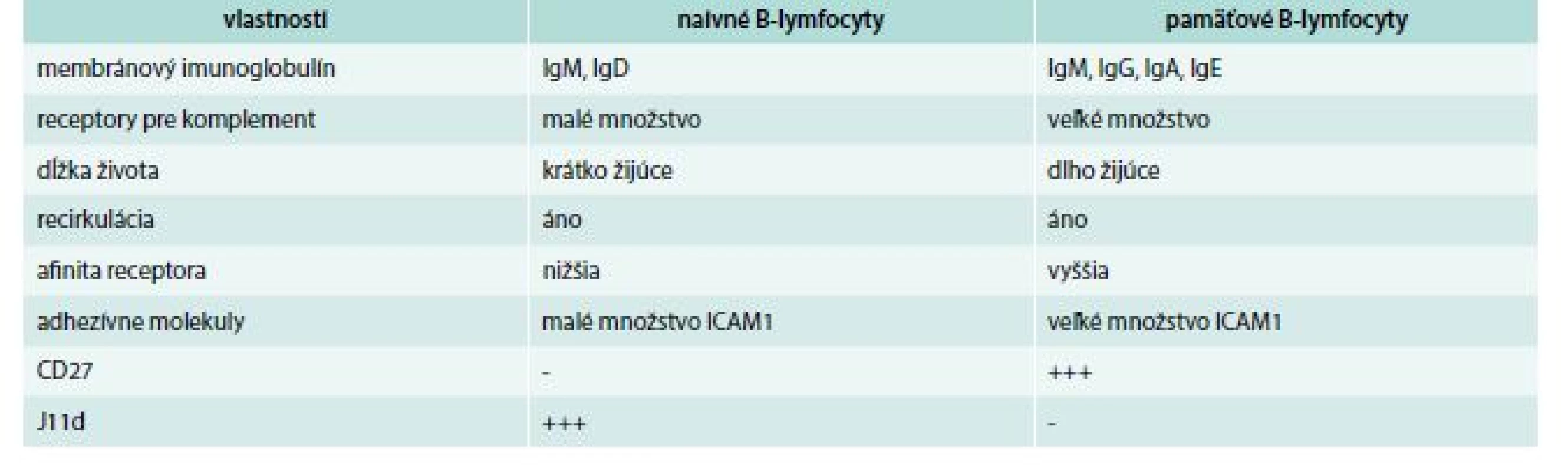
Imunitná odpoveď musí byť regulovaná, lebo v opačnom prípade by dochádzalo k rozvoju autoimunitných procesov. Táto imunosupresívna aktivita sa až donedávna pripisovala iba T-lymfocytom, avšak roku 2012 sa objavila skupina buniek s rovnakou aktivitou, ale patriaca B-lymfocytom [20]. B-regulačné lymfocyty (Breg) patria k bunkám, ktoré potláčajú imunitné procesy; nepredstavujú samostatnú populáciu buniek, podobajú sa teda indukovaným Treg-lymfocytom. Vznikajú v lymfoidnom tkanive, najmä v uzlinách a v slezine pod vplyvom cytokínov IL1β a IL6. Svoju tlmivú aktivitu presadzujú syntézou TGFβ, IL10 a najmä IL35. Okrem toho podporujú vznik a aktivitu prirodzených regulačných T-lymfocytov [21].
T-lymfocyty
T-lymfocyty svoju konečnú morfologicko-funkčnú podobu získavajú v týmuse. Vieme, že týmus postupne involuje a svoju najväčšiu veľkosť dosahuje v puberte. Vychádzajúc z tejto skutočnosti sa predpokladalo, že po puberte prestáva aj produkcia T-lymfocytov. Súčasné poznatky však potvrdzujú, že táto jeho schopnosť pretrváva až do 40 rokov života, u niektorých jedincov aj dlhšie [22]. T-lymfocyty predstavujú heterogénnu populáciu a na základe rozdielneho antigénového receptora (T-Cell Receptor – TCR), ich delíme na 2 základné populácie: s αβ-receptorom (asi 95 %) a γδ-receptorom (asi 5 %), schéma 2. Pokiaľ ide však ide o αβ TCR, treba podotknúť, že antigén rozpoznajú iba vtedy, ak ho prezentujú HLA-molekuly (ide o molekuly hlavného histokompatibilného komplexu človeka – Human Leucocyte Antigens – HLA), ktoré sa nachádzajú sa na našich bunkách. αβ-T-lymfocyty sa ďalej diferencujú na 3 základné populácie – pomocné (Th), cytotoxické (Tc alebo CTL) a prirodzene regulačné (nTreg). Celú populáciu αβ-T-lymfocytov charakterizujú znaky CD2 a CD3; ich pomocné T-lymfocyty navyše ešte charakterizuje znak CD4, cytotoxické T-lymfocyty CD8 a regulačné T-lymfocyty CD25 a Nrp-1 (neuropilín 1). Vzájomný pomer Th-lymfocytov a Tc-lymfocytov je geneticky regulovaný a za fyziologických okolností sa v periférnej krvi zdravého človeka pohybuje približne v pomere 1,5 : 1 [23].
Schéma 2. Antigénový receptor T-lymfocytov. Antigénový receptor T-lymfocytov αβ (TCRαβ) je heterodimér, skladá sa z α-reťazca a β-reťazca. Každý z nich má variabilnú (V) a konštantnú (C) doménu, transmembránový a cytoplazmový úsek. Aj vo V-doméne aj v C-doméne každého reťazca sa nachádza disulfidová väzba, čím sa vytvára slučka; navyše prepája aj oba reťazce. Oba reťazce majú len krátky cytoplazmový úsek, na ktorý sa nemôžu pripojiť tyrozínkinázy. Z tohto dôvodu sa TCR sa spája s CD3 antigénom. Tento sa skladá z 5 reťazcov: γ, δ, ε, ζ a η. Jednotlivé reťazce vytvárajú heterodiméry, príp. homodiméry: εγ, εδ, ζη (alebo ζζ). V svojej cytoplazmovej časti majú úsek ITAM (Immunoreceptor Tyrosine-Based Activation Motif), na ktoré sa pripájajú kinázy a po rozpoznaní antigénu receptorom T-lymfocytov (TCR) prenášajú aktivačný signál do jadra bunky. 
T-lymfocyty αβ, ktoré opúšťajú týmus, označujeme ako naivné a dostávajú do sekundárnych lymfoidných orgánov (lymfatické uzliny, slezina, Peyerove plaky a iné). Naivné T-lymfocyty neustále recirkulujú medzi krvou a sekundárnymi lymfoidnými orgánmi prostredníctvom lymfatického systému a vďaka adhezívnym molekulám, ktoré majú v svojej membráne (CD62L), a chemokínovým receptorom CCR7, ktoré im umožňujú rozpoznať svoje ligandy v periférnych lymfoidných orgánoch. Naivné T-lymfocyty u človeka žijú veľmi dlho (približne 6–9 rokov) a podliehajú homeostatickej proliferácii. V periférii potrebujú na svoje prežitie IL7 a rozpoznávať vlastné HLA-molekuly [24,25].
Pomocné T-lymfocyty dostali svoj názov podľa skutočnosti, že ich treba na aktiváciu, expanziu, diferenciáciu a izotypovú reguláciu B-lymfocytov. Bez ich pomoci B-lymfocyty nedokážu odpovedať na väčšinu antigénov. Uvedená vlastnosť je však iba jednou z mnohých. Th-lymfocyty produkujú cytokíny, ktoré zodpovedajú za obranu proti intracelulárne parazitujúcim mikroorganizmom (listérie, brucely, yersínie a iné), za oneskorený (IV.) typ hypersenzitívnych reakcií, usmrcujú vhodné terčové bunky a pod. Sú principiálnymi bunkami imunitného systému. Pri ich poškodení či zničení (napr. vírusmi imunitnej nedostatočnosti – HIV) sa imunitný systém zrúti. Tieto skutočnosti naznačovali, že ani populácia Th-lymfocytov nebude jednotná, čo sa neskôr potvrdilo aj in vitro aj in vivo.
Th-lymfocyty, ktoré charakterizujú znaky CD2, CD3 a najmä CD4, sa na poklade rozdielnej produkcie cytokínov a rozdielnej funkcie spočiatku delili na 2 subpopulácie: Th1 a Th2 [26], ku ktorým o 2 desaťročia neskôr pribudli Th17 a neskôr aj ďalšie [27]. Th1-lymfocyty produkujú IFNγ, IL2 a lymfotoxín, neprodukujú IL4, IL5 a IL6. Charakterizujú ich receptory pre chemokíny CCR5 a CXCR3, ktoré im umožňujú dostať sa do zápalového ložiska, v ktorom sa vyskytujú im prislúchajúce chemokíny MIP1α (CCL3) a MIG (CCL9). Th2-lymfocyty syntetizujú IL4, IL5, IL10 a IL13, ale nie IFNγ, IL2 alebo lymfotoxín. Th2-lymfocyty produkujú aj proteín PMCH (Pro-Melanin Concentrating Hormone), ktorý pôsobí na hypotalamus a zvyšuje chuť do jedla. Týmto sa vysvetľuje, aspoň čiastočne, spojitosť medzi obezitou a astmou. Charakteristické receptory pre chemokíny sú CCR4 a CCR8; im korešpondujúce chemokíny v zápalovom ložisku sú TARC (CCL17) a I309 (CCL1). Najcharakteristickejším povrchovým znakom tejto subpopulácie však je CRTH2 (CD294), ktorý je receptorom pre prostaglandín D2 [27]. Tretia subpopulácia, Th17, dostala svoj názov podľa principiálnych cytokínov, ktoré produkuje IL17A a IL17F; navyše produkuje ešte aj IL6, IL21, IL22, IL26, TNF a chemokín CCL20 (MIP3α). Pre účasť na zápalových procesov sa táto subpopulácia označuje aj ako prozápalová. Jej prozápalový charakter podčiarkuje aj značná expresia receptorov pre cysteinylové leukotriény vznikajúce v zápalovom ložisku a na podklade koncentračného gradientu potom priťahujú aj Th17-lymfocyty, ktoré zápalový proces rozvíjajú ďalej [28,29]. Najnovšie do palety subpopulácií pribudli ešte ďalšie, ktoré dostali svoje pomenovanie tiež podľa svojho najdôležitejšieho produkovaného cytokínu. Ide o subpopulácie Th9, Th22 a TFH. Subpopulácia Th9 sa vyznačuje produkciou IL9 a IL10. Zabezpečuje obranyschopnosť proti extracelulárnym parazitom, primárne proti nematódam. Napriek syntéze imunosupresívneho IL10 podporuje alergický zápal [30,31]. Lymfocyty Th22 sa vyznačujú predovšetkým syntézou IL22, ďalej IL13, FGF (Fibroblast Growth Factor) a chemokínov CCL15 a CCL17. Zúčastňujú sa hojenia rán a na povrchu v koži a GIT sa zúčastňuje na obrane proti baktériám, vírusom a plesniam; zabraňuje ich translokácii cez epitel, čím obmedzujú rozsah infekcie [32,33]. Napokon subpopulácia TFH sa vyznačuje syntézou IL21. Tieto bunky sú potrebné pre vznik zárodočných centier a poskytujú pomoc folikulovým B-lymfocytom pri zmene syntézy protilátok z jednej triedy na inú [34], tab. 2.
Tab. 2. Charakteristická produkcia cytokínov jednotlivými subpopuláciami pomocných T-lymfocytov 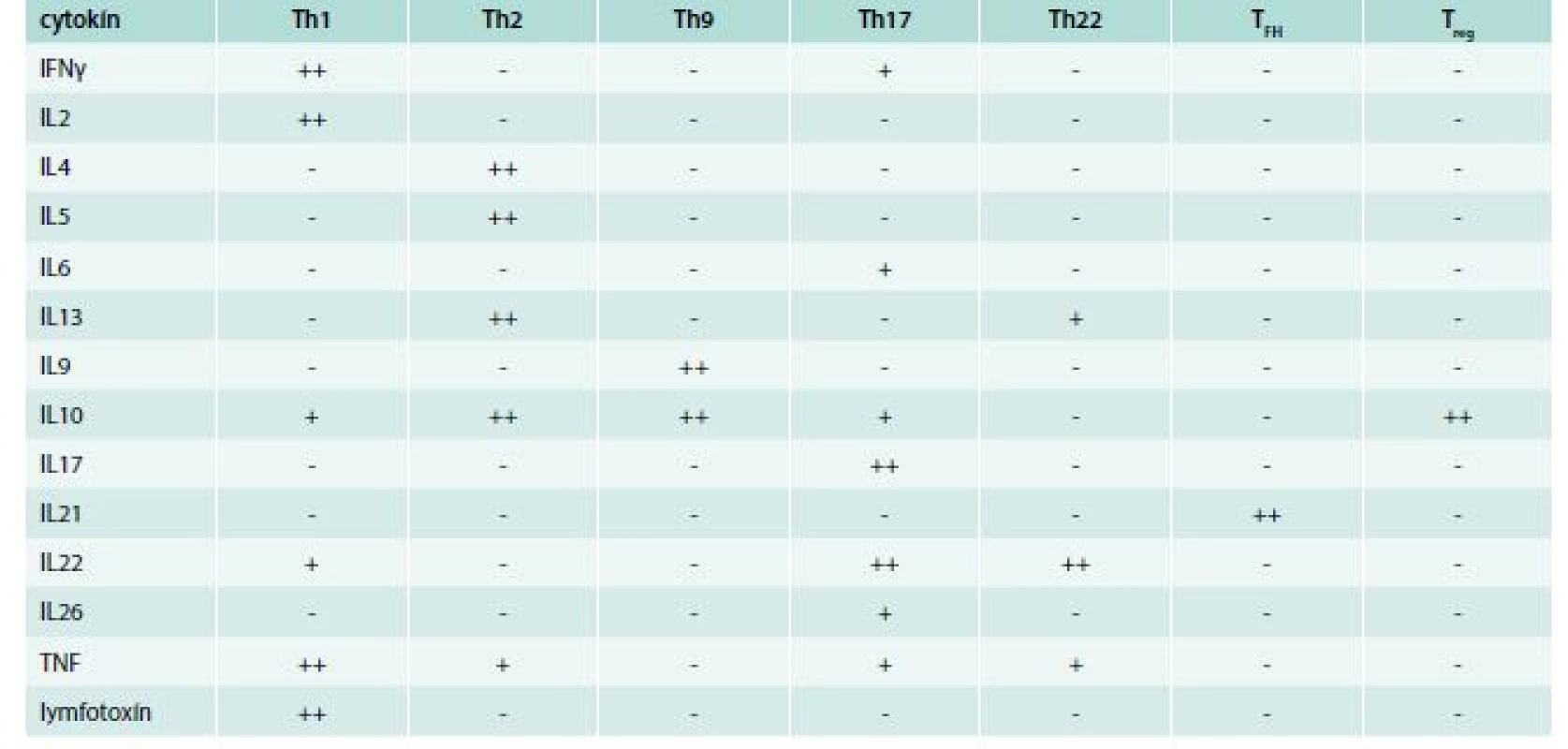
Druhou základnou subpopuláciou T-lymfocytov αβ sú cytotoxické (Tc alebo CTL). Naivné CTL charakterizuje najmä prítomnosť CD2, CD3 a najmä CD8. Po aktivácii produkujú IFNγ, IL3, α-lymfotoxín a β-lymfotoxín. Hlavnou funkciou CTL je deštrukcia terčových buniek nesúcich príslušný cudzorodý antigén. Ide predovšetkým o bunky infikované vírusmi, nádorové a alogénne bunky. Rozpoznanie antigénu na terčovej bunke sa uskutočňuje iba pri súčasnom rozpoznaní molekúl HLA prvej triedy; ide o fenomén imunitnej reštrikcie. Lýza terčovej bunky aktivovanými cytotoxickými T-lymfocytmi sa môže uskutočniť na 3 rozdielnymi mechanizmami. Prvý predstavuje kontaktná cytotoxicita závislá od Ca2+, druhý a tretí mechanizmus je indukcia apoptózy interakciou medzi Fas-molekulami a FasL-molekulami, resp. sekréciou TNF. Cytotoxický mechanizmus usmrcovania terčových buniek sa pozoruje najmä pri ničení buniek infikovaných vírusmi, apoptózu CTL využívajú viac pri likvidácii malígnych buniek a pri imunoregulačných mechanizmoch [35].
Každý biologický systém zahŕňa v sebe nielen efektorové, ale aj kontrolné mechanizmy, ktoré spôsobom spätnej väzby udržujú homeostázu organizmu. Nie je to inak ani pri imunitnom systéme. Najdôležitejšími imunitnými mechanizmami, ktoré bránia rozvoju autoagresívnych procesov (autoimunitných a alergických), sú tie, ktoré sprostredkúvajú prirodzené regulačné T-lymfocyty (nTreg), ktoré potláčajú aktivitu T-lymfocytov (aj αβ aj γδ), B-lymfocytov, NK-buniek, NKT-buniek a aj dendritových buniek. Lymfocyty nTreg sa vyvíjajú v dreni týmusu ako nezávislá, samostatná populácia buniek. Výrazne však tlmia indukciu imunitnej odpovede. Mechanizmy, akým to robia, sú viaceré; v podstate ich možno rozdeliť do 4 skupín:
- prostredníctvom inhibičných cytokínov
- indukciou apoptózy
- prostredníctvom indukcie zmien v metabolizme
- moduláciou dozrievania alebo funkcie DC [36,37]
Okrem prirodzených regulačných T-lymfocytov sa na regulácii imunitnej odpovede a zápalu zúčastňujú indukované regulačné T-lymfocyty (iTreg). Diferencujú z naivných T-lymfocytov CD4+ počas imunitnej odpovede a vznikajú najmä v slizničných priestoroch, najmä v čreve. Lymfocyty iTreg svoju imunosupresívnu aktivitu presadzujú podobne ako bunky nTreg [38].
T-lymfocyty sa po svojej aktivácii nielen diferencujú na efektorové bunky, ale aj na pamäťové (TM), ktoré prežívajú v organizme mnoho rokov, niektoré aj celoživotne, a po opakovanom stretnutí sa s antigénom zabezpečujú promptnú a intenzívnejšiu imunitnú odpoveď. Aj pamäťové T-lymfocyty sú heterogénne. V súčasnosti dobre poznáme 3 subpopulácie: TCM (T central memory cells), TEM (T effector memory cells) a TRM (Tissue-resident memory T cells).
TCM-lymfocyty vznikajú na diferenciačnej dráhe k efektorovým T-lymfocytom po získaní signálov slabej intenzity alebo krátkeho trvania (interakcia medzi DC a T-lymfocytmi je veľmi dynamická, môže trvať od niekoľko minút až po niekoľko hodín). Sídlia prevažne v kostnej dreni (85 %), menšia časť (15 %) v slezine a v lymfatických uzlinách.
Pamäťové B-lymfocyty sa nachádzajú najmä v slezine, kým dlhodobo žijúce plazmatické bunky sa nachádzajú v kostnej dreni v susedstve strómových buniek, ktoré pre ne poskytujú chemokín CXCL12 (SDF – stromal cell derived factor), čomu zodpovedajú aj „udomácňujúce“ molekuly v ich membránach, t. j. CCR7, CD62L. Sú to tie isté molekuly, ako majú naivné T-lymfocyty, ktoré ich potrebujú na extravazáciu do sekundárnych lymfoidných cez vysoké endotélium (High Endothelial Venules – HEV). Na rozdiel od naivných, TCM-lymfocyty majú nižší prah aktivácie, na antigén sú ďaleko citlivejšie a potrebujú aj menej kostimulačných signálov. Zvyšujú množstvo kostimulačných molekúl CD40L a objavuje sa aj „pamäťový“ antigén CD45RO. Pre svoju dlhodobú existenciu vyžadujú rozpoznávať molekuly HLA a IL7. TCM-lymfocyty sú pokojné bunky, ale po reaktivácii antigénom začnú intenzívne proliferovať a diferencovať sa na TEM-lymfocyty. Podobne ako naivné T-lymfocyty recirkulujú [39,40].
TEM-lymfocyty vznikajú pri interakcii naivných T-lymfocytov s bunkami prezentujúcimi antigén (Antigen Presenting Cells – APCs), ktoré im prezentujú antigén a poskytujú silné aktivačné signály alebo signály dlhšieho trvania. Neexprimujú „udomácňujúce“ receptory (sú CCR7- a CD62L-, CD45RO+), ale naopak zabudovávajú do svojich membrán receptor pre sfingozín 1 fosfát (S1P1), čo im umožňuje vycestovanie do krvi v smere jeho koncentračného gradientu, pretože tento sa nachádza vo vysokej koncentrácii práve v krvi (a v sínusoch lymfatických uzlín). Súčasne začnú exprimovať zodpovedajúce adhezívne, kostimulačné antigény a receptory pre chemokíny, čo ich predurčuje na lokalizáciu a vykonávanie svojej efektorovej funkcie v tkanivách. Po splnení svojej úlohy väčšina efektorových lymfocytov hynie apoptózou. Malá časť efektorových T-lymfocytov však tkanivovo-špecifické adhezívne molekuly stráca a namiesto nich sa v membránach objavuje aj CCR7 aj CD62L, čo im umožní návrat do kostnej drene, resp. lymfatických uzlín, v ktorých v homeostatickom prostredí strómových buniek prežívajú ako pamäťové TCM-bunky [41].
Nedávno sa opísala ďalšia skupina pamäťových T-lymfocytov, ktoré, keďže sa nachádzajú v tkanivách a nerecirkulujú. Označili sa ako rezidentné – TRM (Tissue Resident Memory T cells). Majú protektívne aj regulačné vlastnosti. Protektívne vlastnosti sa spájajú s ich schopnosťou, v porovnaní s TEM-lymfocytmi, produkovať vyššie množstvá aktivačných a prozápalových cytokínov (IFNγ, IL2, IL17, TNF a iné), čo im umožňuje plniť si svoje efektorové funkcie. Na druhej strane syntetizujú imunosupresívny IL10 a exprimujú v svojich membránach molekuly (PD1, CTLA4, LAG3, CD101) ktorých funkcia sa zakladá na schopnosti tlmiť imunitnú odpoveď. Exprimujú aj malé množstvo Ki67, znaku proliferácie buniek, čo naznačuje, že ide o pokojné bunky žijúce dlho. Táto vlastnosť, spolu s antiinflamačnými a regulačnými funkciami, zabezpečuje, aby sa zbytočne neaktivovali a nespôsobovali tak poškodenie tkaniva. Na druhej strane si však ponechávajú, po invázii patogénov, schopnosť okamžitej aktivácie a efektorovej funkcie [22,42].
T-lymfocyty γδ predstavujú samostatnú, nezávislú skupinu T-lymfocytov; nejde o bunky, ktoré majú vzhľadom k T-lymfocytom αβ iba alternatívny receptor [43]. Zaujímavá je ich distribúcia, menšia časť je v periférnej krvi (u človeka ich počet sa pohybuje od 0,2–20,0 %), slezine a v lymfatických uzlinách, kým druhá, väčšia, časť sa nachádza v tkanivách, najmä medzi epitelovými bunkami epidermy a epitelovými bunkami gastrointestinálneho či reprodukčného traktu; označujeme ich preto aj ako intraepidermové, resp. intraepitelové (IEL). Antigénový repertoár receptora T-lymfocytov γδ v lymfoidných tkanivách je väčší ako antigénový repertoár receptora IEL. IEL navyše nerecirkulujú, zostávajú usadené v tkanive a sú preň charakteristické; tvoria súčasť imunitného dohľadu a monitorujú externé prostredie epitelových buniek (pohraničné bunky). Pokiaľ ide o ich efektorové funkcie, T-lymfocyty γδ predovšetkým dokážu usmrcovať terčové (malígne transformované, vírusmi infikované) bunky. Produkujú baktericídne látky, ako je granulyzín a defenzíny, čím sa podieľajú na likvidácii baktérií. Svojou produkciou rôznych cytokínov ovplyvňujú priebeh imunitných reakcií. Syntetizujú prozápalové cytokíny TNF a IFNγ, čím sa podieľajú na boji proti intracelulárne parazitujúcim baktériám a IL4, IL5 a IL13, ktoré treba na boj proti helmintom. Navyše sa podieľajú na hojení tkaniva a regenerácii epitelových buniek a to svojou syntézou rastových faktorov KGF1 (Keratinocyte Growth Factor 1) a KGF2 [44].
Nekonvenčné lymfocyty
B-lymfocyty a T-lymfocyty patria k tzv. imunokompetentným bunkám, pretože exprimujú špecifické receptory, ktorými dokážu rozpoznať 109 až 1012 rôznych antigénov. Existujú však lymfocyty, ktoré takúto vysokú rozlišovaciu schopnosť nemajú, ale plnia iné dôležité biologické funkcie a sú pre zachovanie obranyschopnosti organizmu rovnako dôležité ako B-lymfocyty a T-lymfocyty. Označujeme ich všeobecným názvom nekonvenčné lymfocyty a zaraďujeme k nim NK-bunky, NKT-bunky, MAIT-bunky a K-bunky.
NK-bunky (NK – Natural Killer) sa diferencujú v kostnej dreni. Sú to bunky s priemerom 10–12 μm, s veľkým obličkovým jadrom a bohatou cytoplazmou, v ktorej sa nachádzajú azurofilné granuly. Vychádzajúc z tejto morfologickej charakteristiky, označujeme ich aj ako veľké granulárne lymfocyty – LGL (Large Granular Lymphocytes). V periférnej krvi je ich približne 5–10 % z celkového množstva lymfocytov. U človeka poznáme 2 základné subpopulácie, jedna je regulačná a druhá cytotoxická. Regulačné NK-bunky charakterizujú najmä znaky CD56+++ a CD16±. Nachádzajú sa najmä v sekundárnych lymfoidných orgánoch, predovšetkým v lymfatických uzlinách a tonzilách. Produkujú početné cytokíny a chemokíny. Navyše, nielenže produkujú cytokíny, ale na početné aj odpovedajú. Schopnosť odpovedať na početné cytokíny a aj ich syntetizovať naznačuje, že lokálne mikroprostredie, v ktorom sa tieto NK-bunky nachádzajú, môže začne ovplyvňovať priebeh zápalových a imunitných procesov [45]. Druhá subpopulácia NK-buniek je cytotoxická; v porovnaní s regulačnými NK-bunkami majú menej CD56, ale za to omnoho viac CD16 molekúl. Nachádzajú sa prevažne v krvi, kde zastupujú až 90 % všetkých NK-buniek, čo naznačuje na ich pripravenosť vycestovať v prípade potreby do rôznych orgánov tkanív a tam likvidovať či už vírusom infikované alebo nádorové bunky, a to buď priamo alebo prostredníctvom reakcie ADCC (pozri ďalej). NK-bunky sa aktivujú prostredníctvom svojich špecifických inhibičných a aktivačných receptorov, ktoré im umožňujú rozlišovať medzi zdravými a vírusmi infikovanými alebo malígne transformovanými bunkami. Aktivácia NK-buniek cez tieto receptory typicky vedie k produkcii cytokínov a cytotoxickej aktivite sprostredkovanej perforínmi, granzýmami a granulyzínom. Takýmto spôsobom NK-bunky môžu účinne bojovať najmä proti vírusom, odstraňovať pozmenené vlastné bunky a eliminovať malígne bunky [46,47]. Podobne ako T-lymfocyty, aj NK-bunky prekonávajú expanznú a kontrakčnú fázu svojej aktivity, po ktorej nasleduje vznik pamäťových buniek. Tieto v sekundárnej imunitnej odpovedi javia zvýšenú cytotoxickú aktivitu, produkujú viac cytokínov, čo poukazuje na to, že imunitná pamäť sa neobmedzuje iba na adaptívnu imunitnú odpoveď, ako sme si doteraz mysleli [48,49].
NKT-bunky (NKT – Natural Killer T cells) predstavujú nezávislú populáciu buniek; dozrievajú v týmuse, podobne ako T-lymfocyty αβ a γδ a časť NK-buniek. Sídlia ako dlho žijúce efektorové bunky v lymfoidných tkanivách a v mikrovaskulatúre orgánov najmä v pľúcach a pečeni. Stoja niekde na polceste medzi NK-bunkami a T-lymfocytmi αβ, pretože vlastnia súčasne antigénový receptor T-lymfocytov aj aktivačné receptory NK-buniek (NKG2D). Repertoár svojho antigénového receptora T-lymfocytov majú však oproti T-lymfocytov značne obmedzený. Navyše TCR na NKT-bunkách nerozpoznáva peptidy prezentované molekulami HLA, ale glykolipidy, ktoré im prezentujú nepolymorfné CD1d molekuly [50,51]. Najtypickejšou vlastnosťou NKT-buniek je, že po stimulácii dokážu veľmi rýchlo produkovať veľké množstvá cytokínov (IL4, IL10, IL13, IL17, IL21), a to bez klonovej expanzie [52]. Táto skutočnosť naznačuje, že NKT-bunky sa podieľajú na modulácii imunitnej odpovede. Svojou produkciou IL10 obzvlášť ovplyvňujú funkciu dendritových buniek v zmysle ich neschopnosti indukovať imunitnú odpoveď, ale naopak ju potláčať. Majú aj výraznú lytickú aktivitu, podobne ako CTL a NK-bunky a môžu sa tak spolu s nimi zúčastňovať na obrane proti nádorom. Rozpoznávajú baktérie, ktoré vo svojej stene nemajú lipopolysacharid, čo naznačuje na ich špecializovanú účasť v antimikrobiálnej imunite. V krvi dospelého jedinca sa ich počet pohybuje na úrovni 0,1 % z T-lymfocytovej populácie. Je tu značná interindividuálna variabilita – od 0,01 % až po 1 %, pričom u žien je ich viac [50,53].
Nedávno sa opísala skupina buniek, ktoré mali, podobne ako bunky iNKT, tiež semiinvariabilný TCRαβ, ale rozpoznávali iné antigény, a prezentačnými molekulami neboli molekuly CD1d, ale molekuly MR1. Ide bunky, ktoré sa, pretože ich najprv objavili v sliznici tenkého čreva, označili ako MAIT (Mucosal-Associated Invariant T cells). Podobne ako iNKT, aj bunky MAIT sa vyznačujú receptormi buniek NK (CD161, NKG2D a NKp30). Z iných znakov sa vyznačujú prítomnosťou CD26, CD45RO a majú CCR6 a CXCR6, čo sú receptory pre chemokíny, ktoré podporujú migráciu lymfocytov do periférnych tkanív (nemajú však CCR5, ktorý treba na migráciu do lymfatických uzlín). Diferencujú sa v týmuse, ktorý na rozdiel od naivných T-lymfocytov opúšťajú ako plne funkčné efektorové bunky [54]. Vyskytujú sa vo veľmi vysokom počte najmä v krvi, tenkom čreve, pečeni a v pľúcach, teda na miestach, v ktorých je väčšia pravdepodobnosť, že sa do nich mikroorganizmy dostanú. Podobne ako lymfocyty Th a bunky iNKT, aj bunky MAIT potrebujú pre svoju aktiváciu svoje prezentačné molekuly. Kým pre lymfocyty Th sú to molekuly HLA, pre molekuly NKT CD1d, tak pre bunky MAIT ide o molekuly MR1 [55,56]. Molekuly MR1 sú, podobne ako CD1d, invariabilné a tiež sa podobajú molekulám HLA prvej triedy. Nachádzajú sa na všetkých typoch buniek a sú evolučne konzervované [56]. Molekuly MR1 prezentujú bunkám MAIT metabolity, ktoré v baktériách vznikajú pri syntéze riboflavínu a kyseliny listovej [56]. Je zaujímavé, že sa molekuly MR1 nachádzajú intracelulárne a do membrány bunky sa dostávajú až po väzbe svojho ligandu [57]. MAIT bunky reagujú na veľmi široké spektrum grampozitívnych aj gramnegatívnych baktérií, ako aj mykobaktérií, ba dokonca reagujú aj na kandidy. Bunky MAIT produkujú totiž granzýmy a aj iné cytotoxické molekuly, takže infikované terčové bunky dokážu usmrtiť [58,59]. Predpokladá sa, že sa fyziologických okolností kontrolujú normálnu baktériovú flóru čreva (najmä v oblasti krýpt, v ktorých majú Panethove bunky MR1 a môžu aktivovať bunky MAIT). V prípade infekcie, v zápalovom prostredí (pod vplyvom IL18, IL12 alebo IL23, pre ktoré majú receptory) začnú produkovať IFNγ, čím bránia intracelulárnej replikácii baktérií. Svojou syntézou TNF a IL17 zase aktivujú neutrofily, čím zapájajú do obranných mechanizmov aj prirodzenú imunitu [57].
Na imunitných reakciách sa zúčastňujú aj K-bunky (killer cells). Morfologicky nepredstavujú samostatnú populáciu a tento pojem znamená skôr funkčné označenie buniek, ktoré sa zúčastňujú na ADCC reakcii (antibody-dependent cell-mediated cytolysis – bunkami sprostredkovaná cytotoxicita závislá od protilátky). Patria sem bunky, ktoré vlastnia receptor pre protilátky, t. j. neutrofily, eozinofily, makrofágy a predovšetkým NK-bunky [47]. Po nadviazaní sa na protilátku, ktorá už predtým reagovala s antigénmi na terčovej bunke, sa K-bunky aktivujú a uvoľňujú cytotoxické molekuly, ktoré terčovú bunku usmrcujú (schéma 3).
Schéma 3. Cytotoxicita sprostredkovaná bunkami závislá od protilátky (ADCC). Na terčovú bunku sa nadviaže špecifická protilátka, napr. IgG, ktorá v jej membráne rozpoznáva svoj špecifický antigén. Takto obalenú terčovú bunku rozpozná K-bunka, pretože vlastní Fc-receptory (v danom prípade Fcγ) pre protilátky. Aktivuje sa a do bezprostrednej blízkosti terčovej bunky uvoľní cytotoxické látky, ktoré ju zničia 
ILC-bunky a ich subpopulácie
V ostatnej dobe dostávajú do pozornosti ILC-bunky (Innate Lymphoid Cells). Patria k nedávno identifikovaným populáciám buniek imunitného systému, ktoré prispievajú k obranyschopnosti organizmu. Vznikajú zo spoločného lymfoidného progenitora v kostnej dreni, ktorú opúšťajú ako nezrelé bunky, ktoré dozrievajú na periférii. Nachádzajú sa vo všetkých tkanivách, ale najviac ich je v koži, respiračnom a gastrointestinálnom trakte, v periférnej krvi je ich málo. Morfologicky sa podobajú B-lymfocytom a T-lymfocytom, ale nemajú ich antigénovo-špecifické receptory. Druhým význačným rozdielom je, že sa neaktivujú v periférnych lymfoidných orgánoch a následne nemigrujú do tkanív a orgánov, ale naopak sú tam už primárne lokalizované a na stimul odpovedajú okamžite, nie až po klonovej expanzii. Neaktivujú ich bunky prezentujúce antigén, ale rôznorodé stimuly, ako sú cytokíny, alarmíny (alarmíny sú ekvivalentmi molekulových vzorov PAMP – Pathogens Associated Molecular Patterns, ale sú endogénneho pôvodu, napr. kyselina močová, HMGB1, HSP a ďalšie), lipidy a hormóny uvoľnené strómovými, epitelovými bunkami a bunkami myeloidnej rady. Takto sú ILC-bunky fyzicky a funkčne pripravené byť bezprostredným zdrojom efektorových cytokínov v periférnych tkanivách, čo ich zaraďuje k iným rýchlo odpovedajúcim bunkám tu sídliacim, ako sú NKT-bunky, T-lymfocyty γδ a rezidentné pamäťové T-lymfocyty. Minimálne požiadavky na ich aktiváciu im umožňuje byť prvými respondérmi vo včasných fázach primárnej imunitnej odpovede, ako aj zdrojom cytokínov v odpovedi na jemné pertubácie homeostatických procesov [60,61].
ILC-bunky predstavujú konzervovanú, evolučne staršiu populáciu buniek, ktorá predchádza vývoju adaptívnej imunitnej odpovede. Svojim charakterom by sme ich mohli zaradiť do prirodzenej imunity, ale v skutočnosti patria na priesečník adaptívnej a prirodzenej imunity, lebo svojou aktivitou zapájajú do obranných procesov aj mechanizmy adaptívnej imunity. Je zaujímavé, že selektívna imunodeficiencia ILC-buniek sa zatiaľ nepozorovala.
Pomocné T-lymfocyty sa delia na 3 základné subpopulácie, Th1, Th2 a Th17. Každá z uvedených subpopulácií sa vyznačuje vlastnou špecifickou syntézou cytokínov (tab. 2). Je pozoruhodné, že podobnú charakteristiku majú a ILC-bunky, ktoré možno rozdeliť podľa ich rozdielnej syntézy cytokínov a funkcie na 3 skupiny: ILC1, ILC2 a ILC2 [60,62]. Tieto sa podobajú polarizovaným subpopuláciám pomocných T-lymfocytov. Tak ILC1-bunky sa funkčne podobajú Th1-lymfocytom, ILC2-bunky Th2-lymfocytom a napokon ILC3-bunky Th17-lymfocytom. Vzniká otázka, prečo takáto redundancia funkcie existuje. Na jednej strane môže mať organizmus prospech vo zvýšenej imunitnej odpovedi a rýchlejšej eliminácii narušiteľa svojej integrity, na druhej strane niekedy stačí, aby odpovedali ILC-bunky samotné, bez pomoci Th-lymfocytov. Takto sa zabráni nadmernej aktivácii T-lymfocytov a následnému vývoju autoimunitných procesov [47].
Populácia ILC1 zahŕňa NK-bunky a im podobné ILC1-bunky. NK-bunky patria k prvým bunkám, pre ktoré sa hodí charakteristika ILC-buniek; boli objavené už pred 40 rokmi. Ich charakteristika je opísaná vyššie. ILC1-bunky sa podobajú NK-bunkám, ktoré sa po objavení ILC-buniek, preradili práve do tejto skupiny. ILC1-bunky na rozdiel od NK-buniek nie sú, až na určitú subpopuláciu, cytotoxické a produkujú hodne IFNγ a TNF. Odlíšime ich na základe expresie transkripčných faktorov T-BET a EOMES. NK-bunky exprimujú oba, ILC1-bunky len T-BET. Podobne, ILC1-bunky exprimujú CD127 (α receptor receptora pre IL7), kým NK-bunky nie [63,64]. ILC1-bunky nie sú jednotnou populáciou. Identifikovalo sa viacero podskupín, ktoré sa nachádzajú v sliznici čreva, pečeni, slinných žľazách a ženskom reprodukčnom trakte. ILC-1 bunky môžu vzniknúť aj transdiferenciáciou ILC2-buniek a ILC3-buniek [65]. Fyziologická úloha ILC1-buniek je v boji proti niektorým mikroorganizmom či parazitom (Clostridium difficile, Salomnella enterica, Toxoplasma gondii) a v účasti na imunitnom dohľade nad malígnym procesom i keď v jednotlivých prípadoch je v súčasnosti len veľmi ťažko odlíšiť úlohu ILC1-buniek od NK-buniek, v tejto oblasti sa čaká väčší pokrok v budúcnosti [66].
Populáciu ILC2 prirodzených lymfoidných buniek reprezentujú iba bunky ILC2. Vyznačujú sa tým, že ich aktivuje IL33, IL25 alebo TSLP, ktoré na začiatku imunitnej odpovede produkujú makrofágy, mastocyty, NKT-bunky alebo vznikajú ako alarmíny pri poškodení epitelových buniek. Po aktivácii začnú produkovať typické Th2-cytokíny, t. j. IL5 a IL13, navyše však aj IL6, IL9 a amfiregulín. ILC2-bunky exprimujú aj molekuly HLA triedy 2, čo im umožňuje zapojiť do imunitných procesov aj mechanizmy adaptívnej imunity. Za fyziologických okolností ich potrebujeme predovšetkým na boj proti helmintom. Významné sú najmä v patologických procesoch pri rozvoji asthma bronchiale, chronickej sinusitíde, nešpecifických zápalových chorobách čreva a iných [64,67].
Bunky ILC2 participujú svojou produkciou amfiregulínu na oprave epitelu pri infestácii parazitmi a pri infekcii organizmu vírusmi chrípky [68,69]. Táto vlastnosť buniek ILC2 potvrdzuje hypotézu, že imunitná odpoveď druhého typu sa vyvinula na to, aby zabezpečovala opravu poškodených tkanív, ako aj hypotézu že, imunitná odpoveď 2. typu sa vyvinula ako ochrana pred škodlivými xenobiotikami. Vnucuje sa tak predstava, že bunky ILC2 udržiavajú slizničné bariéry v prítomnosti kontinuálnej expozície environmentálnych alergénov v plne funkčnom stave, a to tým, že iniciujú druhý typ imunitnej odpovede nízkeho stupňa, vrátane produkcie hlienu a indukcie opravy tkanív [29]. Vychádzajúc z uvedeného môžeme si predstaviť, že bunky ILC2 nás môžu chrániť pred vývojom pravej alergickej odpovede sprostredkovanej adaptívnym imunitným systémom tým, že zabezpečujú prvú obrannú líniu obrany proti alergénom; ak je úspešná, zabráni vzniku „pravej alergie“ [70].
Populácia ILC3 sa na základe expresie chemokínového receptora CCR6 delí na 2 subpopulácie, CCR6+ a CCR6-. K prvej patria LTi-bunky (LTi – Lymphoid Tissue Inducer), ktoré podobne ako NK-bunky boli objavené ešte pred inými ILC-bunkami. Tieto v svojich membránach exprimujú lymfotoxínový heterotrimér (LTα1β2). Po väzbe na svoj receptor LTβ na strómových bunkách podmieni v nich syntézu chemokínov, ktoré pritiahnu lymfocyty, aby vytvárali sekundárne lymfoidné orgány, konkrétne lymfatické uzliny, Peyerove plaky a izolované lymfoidné folikuly, ale nie slezinu či NALT (Nasal Associated Lymphoid Tissue) [71,72].
Druhá subpopulácia delí na 2 skupiny. Ak exprimuje receptory NKp44, ktoré patria k receptorom NCR (Natural Cytotoxicity Receptors), označujú sa NCR+ alebo podľa svojho principiálneho cytokínu, ktorý produkujú, IL22, ako bunky ILC22. Ak NKp44 v svojich membránach nemajú, označujú sa ako NCR-, resp. ILC17, pretože sa vyznačujú značnou syntézou IL17. IL22 podporuje syntézu antibaktériových látok a podporuje prolifereráciu epitelových buniek. IL17 aktiváciou neutrofilov sa podieľa na antibaktériovej imunite v koži a na slizniciach [73–75]. Bližšie informácie o fyziologickej a patologickej aktivite ILC-buniek sa uvádzajú v časopise Alergie [76]. Celkový prehľad o jednotlivých skupinách lymfocytov sa uvádza v tab. 3.
Tab. 3. Prehľad rôznych typov lymfocytov a ich základná charakteristika 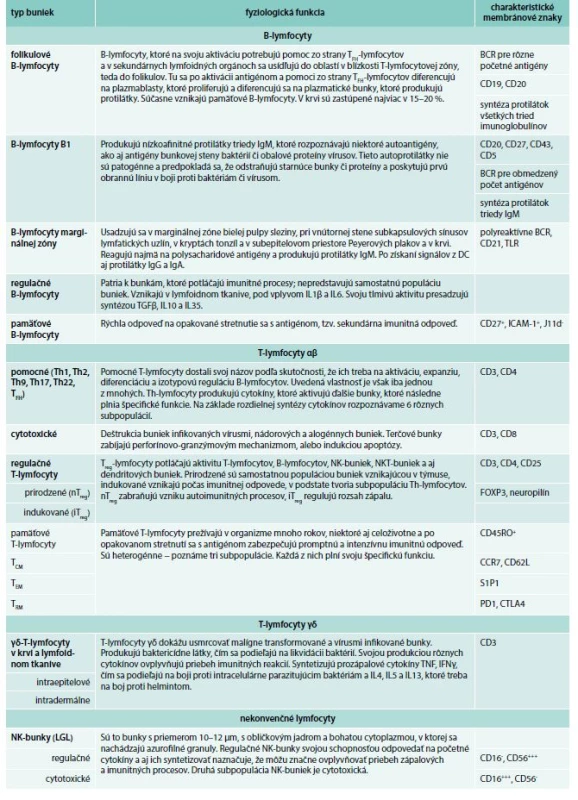

BCR – antigénový receptor B-lymfocytov CTL – cytotoxický T-lymfocyt DC – dendritová bunka ILC – prirodzené lymfoidné bunky NCR – natural cytotoxicity receptor LGL – large granular lymphocytes LTi – lymphoid tissue inducer TCR – antigénový receptor T-lymfocytov Th – pomocný T-lymfocyt Záver
Každá minca má dve strany. Nie je to inak ani pri lymfocytoch. Vznikli a existujú predovšetkým pre obranu organizmu pre vonkajším a vnútornými narušiteľmi integrity organizmu a snažia sa čo najskôr nastoliť homeostatickú rovnováhu. V niektorých prípadoch, a to je tá druhá strana mince, sa lymfocyty podieľajú na iniciácii a rozvoji rôznych imunopatologických stavov. Tejto problematike sa venuje samostatný článok v tomto čísle časopisu, tu uvádzame iba stručný a neúplný prehľad, ktoré lymfocyty sa na daných procesoch zúčastňujú a treba ich v diagnostickej činnosti lekára brať do úvahy (tab. 4).
Tab. 4. Príklady účasti jednotlivých typov lymfocytov na imunopatologických procesoch 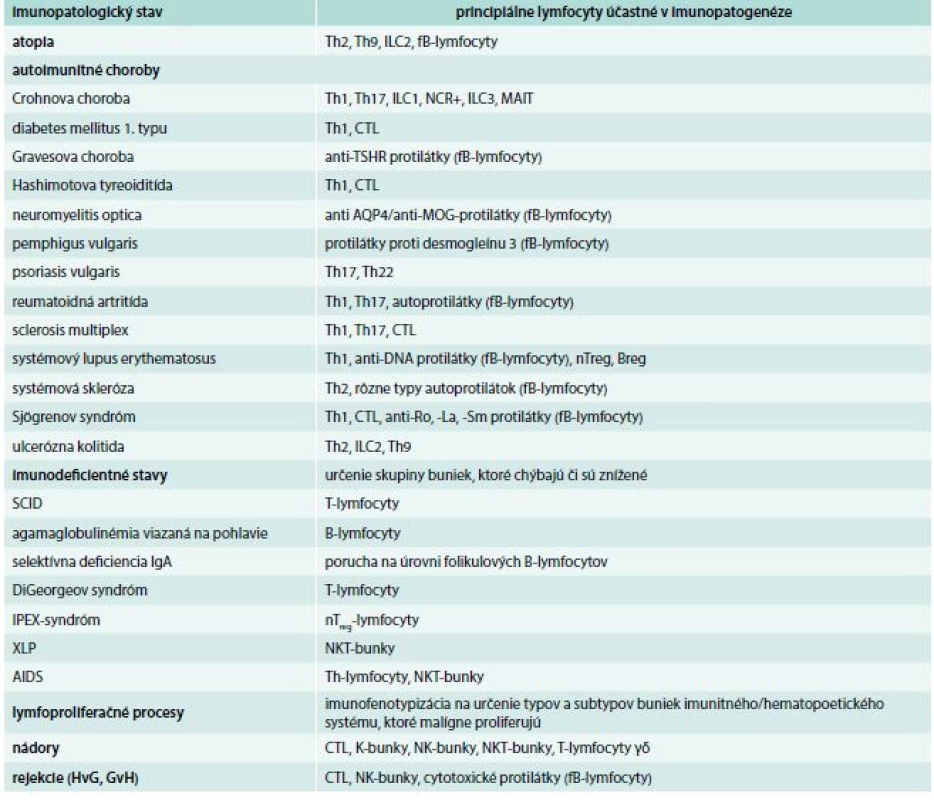
AQP4 – akvaporín 4 Breg – regulačný lymfocyt CTL – cytotoxický T-lymfocyt fB – folikulový B-lymfocyt GvH – graft versus host HvG – host-versusgraft ILC – prirodzené lymfoidné bunky MOG – myelínový oligodendrocytový glykoproteín NK – natural killer NKT – natural killer T cells Th – pomocný T-lymfocyt nTreg – prirodzený regulačný lymfocyt SCID – ťažká kombinovaná imunodeficiencia prof. MUDr. Milan Buc, DrSc.
Imunologický ústav LF UK v Bratislave, Slovenská republika
Doručeno do redakce 8. 6. 2018
Přijato po recenzi 26. 11. 2018
Literatúra
Následující seznam citované literatury obsahuje pouze recentní položky. Úplný seznam literatury je k dispozici na www.vnitrnilekarstvi.eu.
Zdroje
22. Kumar BV, Connors TJ, Farber DL. Human T Cell Development, Localization, and Function throughout Life. Immunity 2018; 48(2): 202–213. Dostupné z DOI: <http://dx.doi.org/10.1016/j.immuni.2018.01.007>.
25. van den Broek T, Borghans JAM, van Wijk F. The full spectrum of human naive T cells. Nat Rev Immunol 2018; 18(6): 363–373. Dostupné z DOI: <http://dx.doi.org/10.1038/s41577–018–0001-y>.
28. Kallies A, Good-Jacobson KL. Transcription Factor T-bet Orchestrates Lineage Development and Function in the Immune System. Trends Immunol 2017; 38(4): 287–297. Dostupné z DOI: <http://dx.doi.org/10.1016/j.it.2017.02.003>.
44. Nielsen MM, Witherden DA, Havran WL. γδ T cells in homeostasis and host defence of epithelial barrier tissues. Nat Rev Immunol 2017; 17(12): 733–745. Dostupné z DOI: <http://dx.doi.org/10.1038/nri.2017.101>.
47. Poli A, Michel T, Patil N et al. Revisiting the Functional Impact of NK Cells. Trends Immunol 2018; 39(6): 460–472. Dostupné z DOI: <http://dx.doi.org/10.1016/j.it.2018.01.011>.
64. Ebbo M, Crinier A, Vely F et al. Innate lymphoid cells: major players in inflammatory diseases. Nat Rev Immunol 2017; 17(11): 665–678. Dostupné z DOI: <http://dx.doi.org/10.1038/nri.2017.86>.
67. Buc M. Crohns disease and ulcerative colitis – current view on genetic determination, immunopathogenesis and biologic therapy. Epidemiol Mikrobiol Imunol 2017; 66(4): 189–197.
76. Buc M. Charakteristika a funkcia ILC-buniek za fyziologických a patologických podmienok. Alergie 2017; 19(1): 24–30.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2019 Číslo 2- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Primární imunodeficience u dospělých
- Sekundární imunodeficience jako následek chronických onemocnění
- Léčba humorálních imunodeficiencí
- Nežádoucí účinky imunoglobulinové léčby
- Současné trendy v imunosupresivní léčbě
- Co dnes znamená alergologie pro internu a naopak
- Anafylaktické příznaky a anafylaktický šok
- Helen Chapel et al. Základy klinické imunologie
- Imunitní systém ve fyziologickém řádu organizmu
- Zánět obranný a poškozující: základní charakteristiky
- Cytokiny rodiny IL1 u chronických zánětlivých procesů
- Heterogenita lymfocytov ako ústredných operačných jednotiek imunitného systému
- Mikrobiota, imunita a imunologicky mediované choroby
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Anafylaktické příznaky a anafylaktický šok
- Nežádoucí účinky imunoglobulinové léčby
- Současné trendy v imunosupresivní léčbě
- Primární imunodeficience u dospělých
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



