-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Sarkopenická obezita – aktuální přehled problematiky
Sarcopenic obesity – current view
Obesity is a serious disease with interdisciplinary medical overlap and important socio-economic implications for patients and society. Therefore, a great deal of attention is paid to the clarification of the exact pathophysiological mechanisms involved in the disease, the possibility of their influence and, consequently, the treatment of the already existing conditions and related complications. Sarcopenic obesity is a type of obesity that is caused by fat infiltration of muscle tissue, that replaces its volume and causes its strength loss. A key pathophysiological mechanism in the aetiology of this problem is the inflammatory activity of the excessive fat tissue. To assess the amount of muscle mass in the body, densitometry is used. Computer tomography or magnetic resonance is used to assess its morphology. Sarcopenic obesity increases health risks, mainly cardiovascular complications, increases insulin resistance, is a predictive risk factor for the development of cardiovascular disease in patients with diabetes mellitus type 2, increases incidence of postoperative complications, impairs cognitive function, weakens healing of acute and chronic diseases, reduces physical performance. The combination of aerobic and power exercises appears to be the most efficient in the treatment of sarcopenic obesity. Thermogenesis in brown adipose tissue appears to be promising in fighting obesity, however it is unknown whether pharmacologically induced thermogenesis can increase the risk of sarcopenia at the same time. The aim of this work is to provide an up-to-date overview of the problem and to outline the possibilities of further research.
Keywords:
obesity – pathophysiology – brown adipose tissue – sarcopenia – sarcopenic obesity
Autori: Matej Pekař 1,2; Anna Pekařová 1,3; Tereza Chovancová 2,4; Pavol Holéczy 2,4
Pôsobisko autorov: Fyziologický ústav LF MU Brno 1; Chirurgické oddělení Vítkovické nemocnice Ostrava 2; Klinika plicních nemocí a tuberkulózy LF OU a FN Ostrava 3; Katedra chirurgických oborů LF OU Ostrava 4
Vyšlo v časopise: Vnitř Lék 2020; 66(1): 39-43
Kategória:
Súhrn
Obezita je závažným onemocněním s mezioborovým medicínským přesahem a významnými socioekonomickými dopady na život pacientů a společnosti. Proto se nyní věnuje velká pozornost objasnění patofyziologických mechanismů podílejících se na vzniku tohoto onemocnění, možnosti jejich ovlivnění a následně i léčby již vzniklého stavu a navazujících komplikací. Sarkopenická obezita je typem obezity, při které dochází k infiltraci svalstva tukovou tkání, která nahrazuje jeho objem a zapříčiňuje ztrátu jeho síly. Klíčovým patofyziologickým mechanismem v etiologii tohoto problému je zánětlivá aktivita zmnožené tukové tkáně. K posouzení množství svalové hmoty v těle se používá denzitometrie, k posouzení morfologie počítačová tomografie nebo magnetická rezonance. Sarkopenická obezita zvyšuje zdravotní rizika, hlavně kardiovaskulární komplikace, zhoršuje inzulinovou rezistenci, je rizikovým prediktivním faktorem pro vznik kardiovaskulárních nemocí u pacientů s diabetes mellitus 2. typu, je ve vztahu se zvýšeným výskytem pooperačních komplikací, zhoršuje kognitivní funkce, oslabuje hojení akutních i chronických nemocí a snižuje fyzickou výkonnost. V léčbě sarkopenické obezity se ukazuje nejúčinnějším kombinované aerobní a silové cvičení. Termogeneze v hnědé tukové tkáni se zdá být nadějnou v boji proti obezitě, není ale známo, zda farmakologicky vyvolána nemůže zároveň navyšovat i riziko vzniku sarkopenie. Cílem této práce je přinést aktuální pohled na danou problematiku a nastínit možnosti dalšího výzkumu.
Klíčová slova:
hnědá tuková tkáň – obezita – patofyziologie – sarkopenická obezita – sarkopenie
Úvod
Sarkopenická obezita představuje důležitý rizikový faktor pro dvojí metabolické zatížení organismu vyplývající z nadbytku tukové tkáně (obezita) a ze snížení svalové hmoty a síly (sarkopenie) (1, 2).
Tuková tkáň se významně podílí na udržování energetické homeostázy zdravého lidského těla. Dysfunkce ve tvorbě endokrinních mediátorů (jako jsou mnohé adipokiny) může mít za následek vznik závažných metabolických nemocí včetně obezity, metabolického syndromu, lipodystrofie a kachexie. Hypertrofie a hyperplazie tukové tkáně má přitom za následek podobné metabolické důsledky jako nedobrovolná ztráta tuku (lipodystrofie a kachexie) (3). Tyto změny zvyšují riziko kardiovaskulárních komplikací, metabolických nemocí (diabetes, dyslipidemie a jiné), chronického selhávání orgánů, vzniku rakoviny, jakož i zhoršují hojení při akutních nemocech.
Sarkopenie, čili ztráta svalové masy a síly, představuje závažný zdravotní problém (4), který byl dlouhá léta opomíjen. Nyní se vědci z celého světa stále více snaží objasnit patofyziologické děje, které ovlivňují vznik sarkopenie, možnosti její léčby a určit, do jaké míry ovlivňuje hojení chronických nemocí.
Definice
Sarkopenie a sarkopenická obezita
Existuje více definicí sarkopenie. Na základě měření souboru pacientů vytvořili Baumgartner et al v roce 2000 tzv. relativní index kosterních svalů (z angličtiny relative skeletal muscle index), který se vypočítá jako poměr hmota svalů v kg/výška v m2 z dat získaných měřením DEXA. Jako sarkopenie je pak hodnocen index menší než 2× směrodatná odchylka průměrných hodnot zdravých mladších jedinců (v průměru 29 let) stejného pohlaví nebo absolutní hodnota menší než 7,26 kg/m2 u mužů a 5,45 kg/m2 u žen (5).
Dosud však chybí široký konsenzus v definici sarkopenie, a tedy i sarkopenické obezity. Otázkou zůstává, zda by měla být definice založena pouze na skladbě lidského těla nebo současně i na funkčních kritériích (svalová síla a výkonnost) (6, 7).
Zvýšení zdravotních rizik
Recentní studie ukazují výrazné zvýšení rizika zdravotních komplikací u pacientů trpících sarkopenickou obezitou. Přítomnost sarkopenické obezity se považuje za samostatný prediktivní faktor pro vznik kardiovaskulárních nemocí u pacientů s diabetes mellitus 2. typu (DM2T) (8), u pacientů s chronickou obstrukční plicní nemocí (CHOPN) snižuje spirometrické hodnoty (2), u pacientů v důchodovém věku zvyšuje pravděpodobnost vzniku metabolického syndromu anebo inzulinové rezistence (9) a indukuje kognitivní dysfunkce (10). Je popisována jako významný rizikový faktor pro komplikace hojení při terapii karcinomu prsu (11), kolorektálního karcinomu (12), karcinomu žaludku (13), snižuje fyzickou výkonnost u dialyzovaných pacientů (14).
Gaillard et al studovali v roce 2018 přímou souvislost mezi předoperační detekcí sarkopenické obezity a zvýšeným rizikem netěsnosti v resekční linii žaludku (gastric leak) u pacientů po rukávové resekci žaludku (Sleeve Gastrectomy). Na souboru 205 pacientů popsali předoperační hmotnost a předoperační sarkopenii jako 2 nezávislé prediktivní faktory pro vznik netěsnosti v resekční linii žaludku (15).
Jak ukazují mnohé studie, zdravotní rizika, která přináší sarkopenická obezita, jsou pro pacienty závažná. Proto by se měla věnovat zvýšená pozornost její diagnostice a možnostem prevence či terapie. Přehledný souhrn zvýšených rizik uvádí tabulka 1.
Tab. 1. Sarkopenická obezita (SO) a zvýšené riziko zdravotních komplikací 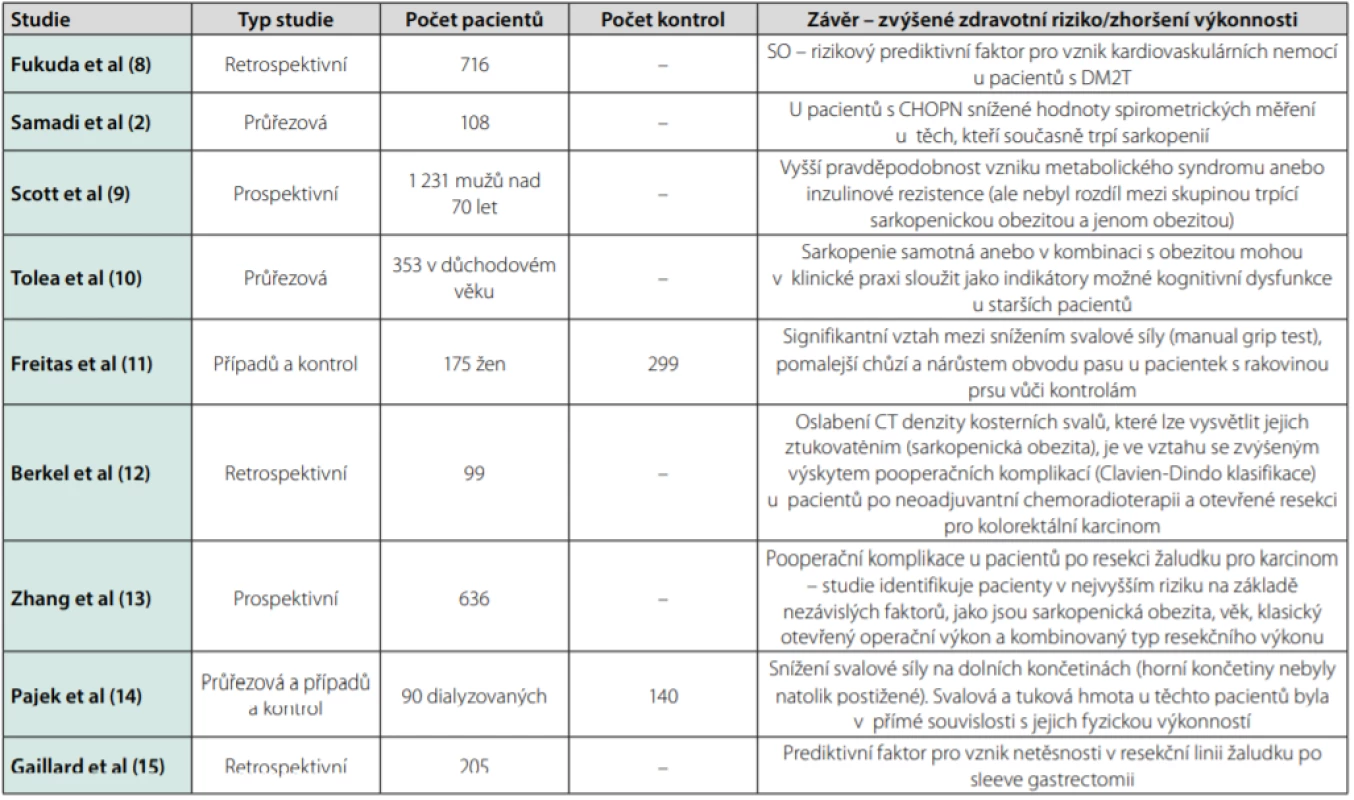
Patofyziologie
Ve svém přehledovém článku Kalinkovich a Livshits podrobně popisují na molekulární úrovni patofyziologické děje, které napomáhají vzniku sarkopenické obezity (16). Klíčovým mechanismem je zánětlivá aktivita zmnožené tukové tkáně.
U zdravých (neobézních) jedinců je tuková tkáň osídlena makrofágy typu M2, buňkami Th2 (T -helper cells), Tregs (T -regulatory cells), iNKT (invariant natural killer T cells) a eozinofily, které produkují protizánětlivé cytokiny (interleukiny IL4, IL10, IL13, IL33). Adipocyty secernují adipokiny (adiponektin a irisin) a některé BMPs (bone morphogenic proteins), které všechny udržují tukovou a svalovou tkáň ve zdravém nezánětlivém stavu. Tukovou tkání mediovaný IGFII/IGFBP5 (insulin growth factor II (IGF -II) a jeho binding protein-5) stimuluje proliferaci a diferenciaci myoblastů. Následně kosterní svalové buňky produkují myokiny (irisin, IL15, follistatin, fibroblastový růstový faktor 21 (FGF-21), BDNF – brain-derived neurotrophic factor a GDNF – glial cell line-derived neurotrophic factor), které zpětnovazebně tlumí inflamaci tukové tkáně. Tento funkční systém pak chrání organismus před vznikem sarkopenie (16).
U obezity dochází k hypertrofii, hyperplazii a zánětlivé aktivaci tukové tkáně, což vede k akumulaci M2 makrofágů, jakož i lymfocytů Th1, Th17 a Th22 a žírných buněk (mastocytů), které produkují prozánětlivé cytokiny (interferon γ, tumor nekrotizující faktor α, IL1, IL6, IL7, IL8, IL17, IL22). Na rekruci makrofágů (a jiných imunitních buněk) v tukové tkáni se podílí i další buňky imunitního systému – CD8+ T buňky, B buňky, dendritické buňky obsahující granule perforinu a s mukózou asociované invariantní T buňky, které tvoří nejrůznější prozánětlivé chemokiny (CCL2, CCL5, CXCL12, CXCL8, CXCL10). Tuková tkáň navíc přímo tvoří prozánětlivé adipokiny (leptin, CRP, osteopontin, chemerin, resistin, PEDF – pigment epithelium -derived factor, myostatin). Toto prostředí je pak zdrojem SASP (senescence-associated secretory phenotype), který indukuje a exacerbuje oslabení svalové masy a síly, ektopickou akumulaci tuku v kosterním svalu, která pak tvoří všechny tyto prozánětlivé působky a pozitivní zpětnou vazbou působí na původní tukovou tkáň, čímž se uzavírá circuluc vitiosus. Výsledkem je inzulinová rezistence, lipotoxicita, zhoršení inflamace tukové tkáně, rozvoj a zhoršení sarkopenické obezity (16).
Infiltrace svalů tukovou tkání má za následek, že objem svalů neodpovídá jejich síle (7).
Diagnostika
Steffl et al zkoumali vztah složení těla (poměr svalů a tuku pomocí bioimpedanční metody) u 730 dětí od 4 do 14 let, relativní svalové síly (měřené pomocí jednoduchého a finančně nenáročného handgrip dynamometru, který měří sílu stisku ruky) a BMI k výši rizika přítomnosti sarkopenické obezity. Výsledky jejich studie ukazují, že poměr grip-to-BMI dobře koreluje s přítomností sarkopenické obezity u dětí (17).
Mnoho studií kvantifikuje relativní svalovou masu za pomoci matematických výpočtů z dat získaných měřením DEXA (dual X ray absorptiometry) a bioelektrické impedance (18). Z těchto měření lze určit jak objem tukové, tak netukové tkáně, na druhé straně nepopisují morfologii. K určení jak objemu, tak morfologie svalové a tukové tkáně lze použít výpočetní tomografii (CT) nebo magnetickou rezonanci (MR).
Yang et al dokázali pozitivní korelaci ve stanovení svalové a tukové hmoty pomocí magnetické rezonance při srovnání objemu z celé střední třetiny stehna (cross -sectional areas) a objemu jenom z jediného řezu (single section) v polovině stehna. Tyto výsledky dobře korelovaly se základní diagnózou obezity, sarkopenie, sarkopenické obezity nebo zdravých kontrol. Vyšetření pouze jednoho MR řezu v polovině stehna při stanovení objemu svalové a tukové tkáně signifikantně zkracuje dobu vyšetření, dobu měření a výpočtu a snižuje cenu vyšetření (19).
Další cestou je potvrzení kandidátních molekul, které by sloužily jako markry sarkopenické obezity z periferní krve. Bano et al se zabývají studiem zánětlivých markerů stimulujících katabolismus proteinů a vznik sarkopenie. Metaanalýza na celkovém vzorku 11249 osob (3072 se sarkopenií a 8177 bez) ukázala, že pacienti se sarkopenií mají oproti kontrolní skupině signifikantně zvýšené hladiny CRP, neliší se však v hladinách Interleukinu 6 a TNF (20).
AGE/RAGE systém (advanced glycation end products a jeho receptor) je zapojený do procesu aktivace nuclear factor κB a dalších cest vedoucích k aktivaci transkripce prozánětlivých faktorů, zvyšujících oxidativní stres, což pozorujeme u vzniku sarkopenie. AGE se s narůstajícím věkem ukládají v různých částech lidského těla. Solubilní receptor pro AGE (sRAGE) se ukazuje jako protektivní proti vzniku různých nemocí (mezi nimi i sarkopenie), neutralizující účinky AGE. Kim et al popsali na 390 nediabetických korejských pacientech signifikantní snížení sérových hladin sRAGE u pacientů s úbytkem svalové hmoty oproti pacientům bez sarkopenie. Hladiny cirkulujících sRAGE molekul mohou tedy sloužit jako nezávislý rizikový faktor pro přítomnost úbytku svalové hmoty u pacientů (21).
Možnosti léčby
Cílem léčby je zvýšení svalové síly a snížení objemu tukové tkáně. V moderní medicíně nám pomáhá resetovat organismus a přenastavit ho na novou endokrinní hladinu bariatricko-metabolická chirurgie (rukávová resekce žaludku, gastrický bypass a jiné). Ta však musí být doplněna komplexní předoperační a pooperační péčí o pacienta (psychologická podpora, nutriční poradenství, cvičení, režimová opatření a jiné).
Dieli -Conwright et al popisují ve své randomizované studii efekt aerobního a rezistentního cvičení u 100 přeživších pacientů s karcinomem prsu na zlepšení tzv. z-skóre u jejich metabolického syndromu, nárůst svalové hmoty, snížení BMI a snížení cirkulujících biomarkrů (včetně inzulinu, leptinu a adiponektinu). Z-skóre počítají z těchto proměnných: HDL-cholesterol (HDL), triacylglyceroly (TAG), glykemie (GLUK), obvodu pasu, systolického a diastolického krevního tlaku (STK a DTK) (22): ((50 – HDL)/5,5) + ((TAG – 15)/25,5) + ((GLUK – 100)/15,9) + ((obvod pasu – 88)/8,8) + ((STK – 130)/11,4) + ((DTK – 85)/10,8).
Park et al testovali hypotézu vlivu 24týdenního kombinovaného cvičení na redukci poměrů intima media (cIMT – carotid intima-media thickness) u karotid u žen trpících sarkopenickou obezitou. Ve své studii dokázali, že 24týdenní kombinované cvičení efektivně snižuje cIMT a zvyšuje rychlost toku krve v karotidách a zlepšuje smykové napětí (které působí tangenciálně na povrch endotelu a zvyšuje riziko rozvoje aterosklerózy) v karotickém povodí (23), což zdůraznil v editorialu Journal of Atherosclerosis and Thrombosis i Gando (24).
Novou cestou v boji proti obezitě se zdá být aktivace termogeneze v hnědé tukové tkáni.
Hnědá tuková tkáň
Lidské tělo obsahuje 3 základní druhy tukových buněk. Jsou to buňky bílé, hnědé a béžové. Liší se svou funkcí. Zatímco bílé tukové buňky jsou majoritní a jejich funkce jsou již léta dobře popsané (metabolické, endokrinní, mechanické a jiné), byly hnědé buňky dlouho považovány jen za fetální a myslelo se, že v raném věku vymizí. Nové radiodiagnostické postupy však umožňují lokalizovat aktivní hnědou tukovou tkáň i u dospělých jedinců. Přítomnost metabolicky aktivní hnědé tukové tkáně primárně určujeme pomocí pozitronové emisní tomografie ve spojení s výpočetní tomografií (PET/CT) se značením 18fluorodeoxyglukózou (18FDG). Nicméně tento postup spíše než celkový objem odráží metabolickou aktivitu reflektující citlivost na inzulin a krevní průtok, kdy ne všechna energie je využita na termogenezi. Předpokládá se tedy, že celkový objem hnědé tukové tkáně bude mnohem větší, než běžně popisovaných 50–150 ml za použití 18FDG PET/CT zobrazení (25).
Hnědá tuková tkáň (BAT – brown adipose tissue) je hlavním nositelem beztřesové termogeneze u savců. Tato aktivita se ukazuje být ochrannou vůči obezitě. Ve studiích na hlodavcích byly popsané buněčné změny při diferenciaci hnědých buněk z buněk bílých – tzv. proces hnědnutí (browning) a tyto buňky pak nazýváme béžové. Klasické hnědé adipocyty pocházejí z mezenchymálních prekurzorů svalových buněčných linií, zatímco béžové buňky (tedy vzniklé procesem hnědnutí) derivují z prekurzorových buněk více podobných bílé tukové tkáni (popsáno ve studiích na hlodavcích). Přitom neexistuje žádný důkaz, že by se vlastnosti termogeneze hnědých a béžových buněk nějakým způsobem lišily (26).
Funkce hnědé tukové tkáně jsou pokládány za protektivní proti obezitě a metabolickým poruchám. Tento efekt je tradičně připisovaný jejich vysoké kapacitě při oxidaci mastných kyselin a glukózy se vznikem tepla při neuzavření Krebsova cyklu ve velkém počtu mitochondrií, které obsahují. Recentní data však poukazují i na jejich hormonální aktivitu. Experimentální transplantace hnědé tukové tkáně ukázala zlepšení glukózové tolerance, zvýšení inzulinové senzitivity hlavně ovlivněním funkce jater a srdce. Tento efekt je popisován přes uvolňování mediátorů, jako jsou inzulinu podobný růstový faktor I (ILGF I), iterleukin 6 (IL6) a fibroblastový růstový faktor 21 (FGF-21) (27).
Aktivita hnědé tukové tkáně je regulována více procesy. Krátkodobá indukce je způsobena hlavním proteinem působícím v jejich mitochondriích (uncoupling protein 1). Jako hlavní mediátor je popisován sympatický nervový systém (adrenalin, noradrenalin – aktivací β3-adrenergních receptorů), nové studie však poukazují i na tzv. non-sympatické cesty aktivace. Jedná se hlavně o proteiny z rodiny kostní tkáně (bone morphogenetic protein family), natriuretických peptidů ze srdeční tkáně, irisinu z kosterního svalstva a FGF 21 produkovaného hlavně v játrech. Pochopení a ovládnutí aktivity hnědých tukových buněk a nalezení vhodného aktivačního mediátoru by výrazně pomohlo v boji proti obezitě bez nežádoucích vedlejších účinků sympatomimetik (28). Na druhé straně proces hnědnutí bílé tukové tkáně vyvolaný pomocí parathyroid hormone-related proteinu a IL6 nacházíme u pacientů s nádorovým onemocněním, kde vede ke vzniku a progresu nádorové kachexie (29). Otázka vztahu hnědé tukové tkáně a sarkopenie proto zůstává otevřená a další výzkum v této oblasti by mohl objasnit vztahy mezi cílenou aktivací hnědé tukové tkáně, hubnutím a rizikem vzniku sarkopenie.
Závěr – další zaměření výzkumu
Problémem nadále zůstává chybějící konsenzus přesné definice sarkopenie a sarkopenické obezity (6, 18), což přispívá k nehomogenitě studií s touto problematikou. K lepšímu pochopení by tedy pomohlo nastolení konsensu diagnostických kritérií, zdokonalení znalostí o patofyziologických pochodech v tukové tkáni a kosterních svalech na molekulární úrovni, rozšíření randomizovaných studií na všechny věkové skupiny, získání jednoduchého a levného způsobu diagnostiky sarkopenické obezity a optimalizace v prevenci a terapii sarkopenické obezity (30).
Nápomocným by mohl být i dokonalý model pro sarkopenickou obezitu. Drey et al úspěšně testovali hypotézu odpovídajícího modelu pro sarkopenickou obezitu u pacientů trpících Cushingovou nemocí, která je léčitelná a je spojena s obezitou a svalovou atrofií u pacientů většinou bez jiných komorbidit. U pacientů s Cushingovým syndromem byla popsána ztráta svalové síly, kterou nelze vysvětlit ztrátou svalové hmoty. Jako vysvětlení se právě nabízí infiltrace svalové tkáně tukem (31).
Obezita a sarkopenie zvyšují zdravotní rizika zvláště, když koexistují. Dvě světové organizace zabývající se bojem proti obezitě – The European Society for Clinical Nutrition and Metabolism (ESPEN) a the European Association for the Study of Obesity (EASO) – vyzývají vědecké pracovníky ke studiu a boji proti sarkopenické obezitě (30).
Podpořeno specifickým výzkumem Masarykovy univerzity v Brně MUNI/A/1307/2019.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Matej Pekař,
Chirurgické oddělení Vítkovické nemocnice a. s.,
Zalužanského 15,
703 84 Ostrava
Cit. zkr: Vnitř Lék 2020; 66(1): 39–43
Článek přijat redakcí: 10. 10. 2018
Článek přijat k publikaci: 17. 3. 2019
Zdroje
1. Prado CMM, Wells JCK, Smith SR et al. Review: Sarcopenic obesity: A Critical appraisal of the current evidence. Clin Nutr 2012; 31 : 583–601.
2. Katayoun S, Shahram K, A Abedini et al. Sarcopenia and Sarcopenic Obesity in Chronic Obstructive Pulmonary Disease Patients with Different Levels of Severity. Intern Med Med Investig2018; 17 : 17–22.
3. Vegiopoulos A, Rohm M, Herzig S. Adipose tissue: between the extremes. EMBO J 2017; 36 : 1999–2017.
4. Zadák Z. Prevention and therapy of sarcopenia in the ageing. Vnitř Lék 2016; 62 : 671–677.
5. Baumgartner RN Body Composition in Healthy Aging. Ann NY Acad Sci 2000; 904 : 437.
6. Donini L, Poggiogalle E, Migliaccio S et al. Body composition in sarcopenic obesity: systematic review of the literature. Mediterr J Nutr Metab 2013; 6 : 191–198.
7. Krahulec B, Fabryova L, Holeczy P et al. Klinická obezitológia. Brno: Facta Medica 2013.
8. Tatsuya F, Ryotaro B, Takato T et al. Sarcopenic obesity assessed using dual energy X -ray absorptiometry (DXA) can predict cardiovascular disease in patients with type 2 diabetes: a retrospective observational study. Cardiovasc Diabetol 2018; 17 : 1–12.
9. Scott D, Cumming R, Naganathan V et al. Associations of sarcopenic obesity with the metabolic syndrome and insulin resistance over five years in older men: The Concord Health and Ageing in Men Project. Exp Gerontol 2018; 108 : 99–105.
10. Tolea MI, Chrisphonte S, Galvin JE. Sarcopenic obesity and cognitive performance. Clin Interv Aging 2018; 13 : 1111–1119.
11. De Freitas Junior R, Gonçalves LV, Martins KA et al. arcopenia and obesity sarcopenic are associated with recently diagnosed breast cancer? Eur Breast Cancer Conf 2018; 92: S44.
12. Berkel AEM, Klaase JM, de Graaff F et al. Patient’s Skeletal Muscle Radiation Attenuation and Sarcopenic Obesity are Associated with Postoperative Morbidity after Neoadjuvant Chemoradiation and Resection for Rectal Cancer. Dig Surg 2018; 19 : 1–8.
13. Zhang WT, Lin J, Chen WS et al. Sarcopenic Obesity Is Associated with Severe Postoperative Complications in Gastric Cancer Patients Undergoing Gastrectomy: a Prospective Study. J Gastrointest Surg Off J Soc Surg Aliment Tract 2018; Available from: http://ezproxy.muni.cz/login?url=https://search.ebscohost.com/login.aspx?direct=true & AuthType=ip, cookie, uid & db=mdc & AN=29943139 & lang=cs & site=eds -live & scope=site
14. Bučar PM, Pajek J. Original article: Characterization of deficits across the spectrum of motor abilities in dialysis patients and the impact of sarcopenic overweight and obesity. Clin Nutr 2018; 37 : 870–877.
15. Gaillard M, Tranchart H, Maitre S et al. Preoperative Detection of Sarcopenic Obesity Helps to Predict the Occurrence of Gastric Leak After Sleeve Gastrectomy. Obes Surg 2018; 28 : 2379–2385.
16. Kalinkovich A, Livshits G. Sarcopenic obesity or obese sarcopenia: A cross talk between age-associated adipose tissue and skeletal muscle inflammation as a main mechanism of the pathogenesis. Ageing Res Rev 2017; 35 : 200–221.
17. Steffl M, Chrudimsky J, Tufano JJ. Using relative handgrip strength to identify children at risk of sarcopenic obesity. Plos One 2017; 12: e0177006–e0177006.
18. Kyoung MK. Uncertainty and Diversity in the Methods Defining Sarcopenia and Sarcopenic Obesity. J Obes Metab Syndr 2017; 26 : 235–236.
19. Yang YX, Chong MS, Lim WS et al. Validity of estimating muscle and fat volume from a single MRI section in older adults with sarcopenia and sarcopenic obesity. Clin Radiol 2017; 72 : 427.
20. Bano G, Trevisan C, Carraro S et al. Review article: Inflammation and sarcopenia: A systematic review and meta -analysis. Maturitas 2017; 96 : 10–15.
21. Kim TN, Park MS, Lee EJ et al. The association of low muscle mass with soluble receptor for advanced glycation end products (sRAGE): The Korean Sarcopenic Obesity Study (KSOS). Diabetes Metab Res Rev 2018; Available from: http://ezproxy.muni.cz/login?url=https://search.ebscohost.com/login.aspx?direct=true & AuthType=ip, cookie, uid & db=mdc & AN=29271076 & lang=cs & site=edslive & scope=site
22. Dieli -Conwright CM, Courneya KS, Demark -Wahnefried W et al. Effects of Aerobic and Resistance Exercise on Metabolic Syndrome, Sarcopenic Obesity, and Circulating Biomarkers in Overweight or Obese Survivors of Breast Cancer: A Randomized Controlled Trial. J Clin Oncol 2018; 36 : 875.
23. Park J, Kwon Y, Park H. Effects of 24-Week Aerobic and Resistance Training on Carotid Artery Intima -Media Thickness and Flow Velocity in Elderly Women with Sarcopenic Obesity. J Atheroscler Thromb 2017; 24 : 1117–1124.
24. Gando Y. Carotid Artery Parameters After Combined Exercise Training in Women with Sarcopenic Obesity. J Atheroscler Thromb 2017; 24 : 1090–1091.
25. Carpentier AC, Blondin DP, Virtanen KA et al. Brown Adipose Tissue Energy Metabolism in Humans. Front Endocrinol 2018; Available from: http://ezproxy.muni.cz/login?url=https://search.ebscohost.com/login.aspx?direct=true&AuthType=ip, cookie, uid&db=edsdoj&AN=edsdoj.839501393fad4c8fbd5dedfb9d0b84f5&lang=cs&site=eds -live&scope=site
26. Giralt M, Villarroya F White, Brown Z. Beige/Brite: Different Adipose Cells for Different Functions? Endocrinology 2013; 154 : 2992–3000.
27. Villarroya J, Cereijo R, Villarroya F. An endocrine role for brown adipose tissue? Am J Physiol Endocrinol Metab 2013; 305: E567–E572.
28. Cereijo R, Villarroya J, Villarroya F. Non -sympathetic control of brown adipose tissue. Int J Obes Suppl 2015; 5: S40–S44.
29. Boengler K, Kosiol M, Mayr M et al. Mitochondria and ageing: role in heart, skeletal muscle and adipose tissue. J Cachexia Sarcopenia Muscle 2017; 8 : 349–369.
30. Barazzoni R, Bischoff S, Boirie Y et al. Sarcopenic Obesity: Time to Meet the Challenge. Obes Facts 2018; 11 : 294–305.
31. Drey M, Berr CM, Reincke M et al. Cushing’s syndrome: a model for sarcopenic obesity. Endocrine 2017; 57 : 481-485.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Ve spojení a jednotě je sílaČlánek Autoimunitní hepatitida
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2020 Číslo 1- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Ve spojení a jednotě je síla
- Hlavní téma: Metabolický syndrom
- Léčba hypertenze u metabolického syndromu – update 2019
- Aterogenní dyslipidemie typické pro metabolický syndrom
- Diabetes mellitus 2. typu v praxi – balancování mezi rezistencí a sekrecí
- Hepatotoxicita indukovaná bodybuilding suplementami
- Chronický stres, psychická nepohoda a deprese zvyšují četnost infekčních, autoimunitních, ale i maligních nemocí
- Sarkopenická obezita – aktuální přehled problematiky
- Autoimunitní hepatitida
- Dvacet let cesty nefrologa do hlubin toxicity fosforu
- Monitorovanie a individualizácia liečby inhibítormi P2Y12 ADP receptorov
- Prevalence a rizikové faktory T buňkami zprostředkované rejekce u pacientů po transplantaci jater od zemřelého dárce – retrospektivní studie v desetiletém období
- Infarkt myokardu u pacienta s metabolickým syndromem a prokázaným syndromem obstrukční spánkové apnoe
- Úskalí v diagnostice srdeční amyloidózy a možnosti terapie
- Bolesti a deformace dolní čelisti – projev fibrózní dysplazie čelisti
- K čemu lze využít výsledek vyšetření koncentrace celkového cholesterolu?
- Několik poznámek ze čtení posledních doporučených postupů pro léčbu DLP verze 2019
- Jak motivovat pacienta ke změně životního stylu?
- Založení profesního spolku SAI – sdružení ambulantních internistů, z. s.
- Odešel velký člověk a lékař prof. MUDr. Vítězslav Kolek, DrSc., FCCP
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Sarkopenická obezita – aktuální přehled problematiky
- Chronický stres, psychická nepohoda a deprese zvyšují četnost infekčních, autoimunitních, ale i maligních nemocí
- Odešel velký člověk a lékař prof. MUDr. Vítězslav Kolek, DrSc., FCCP
- Autoimunitní hepatitida
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



