-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Transplantace jater jako potenciální kurativní metoda těžké hemofilie A: popis případu a literární přehled
Liver transplantation as potential curative method in severe hemophilia A: case report and literature review
The authors present clinical case of orthotopic liver transplantation for cirhosis due to chronic viral hepatitis C in a subject with severe hemophilia A. Preoperatively performed pharmacokinetic study with recombinant F VIII confirmed satisfactory in vivo recovery of 2.1 %. A bolus application of 52 units F VIII/kg body weight with target F VIII activity over 100.0 % was administred shortly before the transplantation started. Totally, 30 000 units of recombinant F VIII, 3 thrombocyte concentrates, 2 erythrocyte concentrates, 5 units of virally inactivated plasma, 1 unit of fresh frozen plasma and 3 500 antithrombin units were used. There were no perioperative or postoperative bleeding complications, F VIII substitution was stopped on postoperative day 3. The patient was discharged on twentieth postoperative day.
Keywords:
liver transplantation – hemophilia A – chronic viral hepatitis C
Autori: Pavel Polák 1; Petr Smejkal 1,2; Gabriela Romanová 1; Jiřina Zavřelová 1,2; Radomíra Hrdličková 3; Šárka Blahutová 3; Libuše Husová 4,5; Marta Zvarová 6; Miroslav Penka 1,2
Pôsobisko autorov: Oddělení klinické hematologie FN Brno, pracoviště Bohunice 1; Katedra laboratorních metod LF MU Brno 2; Krevní centrum FN Ostrava 3; Interní gastroenterologická klinika LF MU a FN Brno, pracoviště Bohunice 4; Centrum kardiovaskulární a transplantační chirurgie Brno 5; Oddělení klinické hematologie FN u sv. Anny Brno 6
Vyšlo v časopise: Vnitř Lék 2020; 66(5): 85-89
Kategória: Kazuistika
Súhrn
Autoři popisují případ ortotopické transplantace jater pro cirhózu v důsledku chronické virové hepatitidy C u pacienta s těžkou hemofilií A. Předoperační farmakokinetická studie s rekombinantním faktorem VIII (F VIII) potvrdila uspokojivé in vivo recovery 2,1 %. Perioperačně byl podán bolus F VIII v dávce 52 j/kg hmotnosti s dosažením požadované aktivity F VIII nad 100,0 %. Celkem bylo perioperačně podáno 30 000 j rekombinantního F VIII, 3 trombocytární koncentráty, 2 erytrocytární koncentráty, 5 transfuzních jednotek (TU) protivirově ošetřené plazmy, jedna TU čerstvě zmražené plazmy a 3 500 j antitrombinu. Perioperačně ani pooperačně nebyly zaznamenány krvácivé komplikace, substituce F VIII byla ukončena 3. pooperační den. Pacient byl propuštěn do domácího ošetřování 20. den po transplantaci.
Klíčová slova:
hemofilie A – chronická virová hepatitida C – transplantace jater
Úvod
Hemofilie je jedno z nejlépe prozkoumaných vrozených onemocnění hemostázy. Podstatou hemofilie A je nedostatek koagulačního faktoru VIII (F VIII), zatímco u hemofilie B je nedostatek koagulačního faktoru IX (F IX). Incidence hemofilie A se pohybuje kolem 1 případu na 5 000 narozených chlapců, incidence hemofilie B je výrazně vzácnější (1 případ na 30 000 narozených chlapců). Geny kódující syntézu jak F VIII, tak F IX jsou umístěny na chromozomu X, a proto se onemocnění projevuje téměř výhradně u mužů, zatímco ženy jsou zpravidla asymptomatické přenašečky onemocnění. Koagulační F VIII je syntetizován především endoteliálními buňkami jaterních sinusoid, oproti tomu je F IX tvořen přímo hepatocyty. Dle reziduální aktivity příslušného koagulačního faktoru se hemofilie dělí na lehkou (aktivita 5–40 %), středně těžkou (aktivita 1–5 %) a těžkou (aktivita ≤ 1 %). Mezi typické klinické projevy patří excesivní krvácení z pupečníku, krvácení po operačních zákrocích a nezřídka i spontánní vznik hematomů ve svalech či krvácení do kloubů s dominantním postižením kloubů loketních, kolenních a hlezenních. Základem terapie je v současnosti cílená substituce deficitního koagulačního faktoru – a to buď preparátem plazmatickým (čili získaným koncentrací a purifikací z plazmy dárců) anebo preparátem rekombinantním syntetizovaným in vitro pomocí molekulárně‑genetických manipulací. Plazmatické koncentráty F VIII a F IX jsou v klinickém použití od konce 70. let 20. století, kdy představovaly prakticky jedinou dostupnou a účinnou léčbu hemofilie; rekombinantní preparáty se začaly používat na přelomu tisíciletí (1). Zpřísnění kritérií pro výběr dárců krve a současně protivirové ošetření transfuzních přípravků a krevních derivátů byly do praxe uváděny postupně až od poloviny 80. let 20. století, a to v návaznosti na objevení viru hepatitidy B (1976), lidského viru imunitní nedostatečnosti (HIV – human immunodeficiency virus, 1983) a viru hepatitidy C (1989). V mezičase však již byly výše uvedenými viry iatrogenně infikovány desetitisíce hemofiliků celosvětově (přibližně 80–90 % všech exponovaných hemofiliků!), nezřídka se jednalo o koinfekce v různých kombinacích a velmi často v chronické formě. Je dobře dokumentovaným faktem, že neléčená chronická virová hepatitida C způsobí během 15–30 let svého trvání cirhózu jater a v nezanedbatelném procentu i hepatocelulární karcinom; v případě koinfekce s HIV je progrese onemocnění rychlejší a celková prognóza výrazně horší. Léčba chronické virové hepatitidy C je dostupná od konce 80. let 20. století. Nejdříve byly zavedeny režimy založené na interferonu α, později i v kombinaci s ribavirinem – k dosažení setrvalé virologické odpovědi však došlo pouze ve 1/3 případů a léčba byla zatížena četnými vedlejšími účinky. V posledních letech jsou k dispozici zcela nová léčiva, tzv. přímo působící antivirotika (directly acting antiviral – DAA), která poskytují pacientům velmi vysokou pravděpodobnost vyléčení, a to při minimálních vedlejších účincích (2). Rozvinutá fibrotická přestavba jaterního parenchymu však může i navzdory vyléčení chronické virové hepatitidy C představovat ireverzibilní strukturální změny, které mohou být příčinou metabolické či vaskulární dekompenzace jaterní cirhózy. Jediným možným řešením tohoto stavu zůstává nadále pouze transplantace jater. Transplantace jater navíc představuje i možnost vyléčení hemofilie – přesněji řečeno možnost změny fenotypu z krvácivého na fenotyp s fyziologickou hemostázou (genetická terapie hemofilie A není stále přes všechny pokroky k dispozici).
Popis případu
Muž ve věku 46 let (narozen roku 1972) byl od raného dětství sledován pro těžkou formu hemofilie A. Opakovaná krvácení do loketních, kolenních a hlezenních kloubů byla již v dětství léčena podáváním plazmy, kryoglobulinu a později i plazmatického F VIII, tato léčba však nedokázala zabránit rozvoji pokročilé hemofilické artropatie ve zmíněných oblastech. V rámci snahy o zamezení dalšího kloubního poškození byla od roku 2012 zavedena tzv. terciární profylaxe rekombinantním faktorem VIII (Kogenate®) v dávce přibližně 17 j/kg hmotnosti 2× týdně. Navzdory této léčbě docházelo asi 1× měsíčně k dalšímu kloubnímu krvácení. U pacienta byla již v roce 1987 diagnostikována chronická virová hepatitida C (genotyp 1 b), navíc byly zjištěny celkové protilátky proti dřeňovému antigenu viru hepatitidy B (anti‑HBc Ig) svědčící pro dříve prodělanou infekci. K léčbě chronické virové hepatitidy C kombinací interferonu α a ribavirinu bylo přistoupeno až za dalších 11 let (v roce 1998). Zahájení protivirové léčby bylo oddáleno pro reálnou obavu především z psychických komplikací – bratr probanda, rovněž trpící těžkou formou hemofilie A, spáchal během léčby chronické virové hepatitidy C interferonem α suicidium. U probanda nevedla terapie interferonem α v kombinaci s ribavirinem k dosažení setrvalé virologické odpovědi. Asi v roce 2013 – čili přibližně po 16 letech dokumentované chronické virové hepatitidy C – byla poprvé diagnostikována cirhóza jater. Na podzim roku 2016 byla proto indikována terapie přímo působícími antivirotiky dasabuvirem a ombitasvirem s paritaprevirem potencovaným ritonavirem, díky níž bylo dosaženo vyléčení virové hepatitidy C. Cirhóza jater však vedla k dalším komplikacím – na jaře roku 2018 podstoupil pacient opakovanou ligaci jícnových varixů v návaznosti na hematemezu, navíc byla dokumentována splenomegalie (19,5 cm v podélné ose) a mírný deficit dalších koagulačních faktorů (F XI, F V, F VII, F X, antitrombin) – Tab. 1. V důsledku hypersplenismu byla přítomna trombocytopenie kolem 60,0 × 109/1 s možným podílem imunitní destrukce trombocytů (pozitivita protilátek proti trombocytům v testu MAIPA (monoclonal antibody specific immobilization of platelet antigen). Mikrocytóza a hypochromie erytrocytů byly projevem pravděpodobně chronických subklinických krevních ztrát do zažívacího traktu. Krevní skupina pacienta byla 0, Rh D negativní. Mezi další významné anamnestické faktory patřily arteriální hypertenze, diabetes mellitus 2. typu, stav po krvácení ze žaludečního vředu v roce 2016 (v důsledku užívání nesteroidních antiflogistik). V minulosti byl dokumentován exantém po aplikaci čerstvě zmražené plazmy. Dlouhodobá terapie – s výjimkou již výše uvedené substituční terapie rekombinantním F VIII – spočívala v kombinaci inhibitoru protonové pumpy, carvedilolu, antidepresiva paroxetinu, perorálního preparátu železa a linagliptinu. Pacient kouřil 20 cigaret měsíčně, alkohol nepil vůbec. Vzhledem k rozvinutým komplikacím cirhózy jater byla indikována ortotopická transplantace jater a pacient byl zařazen na čekací listinu. V rámci předoperační přípravy byla počátkem října roku 2018 provedena farmakokinetická studie s rekombinatnním F VIII, kdy byla po bolusové aplikaci 6 000 j rekombinantního F VIII dokumentována uspokojivá hodnota recovery 2,1 % při bazální aktivitě F VIII probanda 0,8 % (podrobněji v Tab. 2 a diskuzi). Vhodný dárcovský orgán (AB0 kompatibilní) byl získán dne 4. 1. 2019, pacient byl urgentně přijat k operaci. Při přijetí do nemocnice měl pacient hyperstenický habitus (hmotnost 115,8 kg, výška 192,0 cm, body mass index BMI 31,4 kg/m2), gynekomastii, redukci sekundárního ochlupení, břicho bez jednoznačných známek ascitu, bez hmatné hepatomegalie či splenomegalie, s ojedinělými petechiemi na bércích v terénu chronické žilní nedostatečnosti. V rámci přípravy k velkému operačnímu výkonu, kdy je doporučeno udržovat hladinu F VIII nad 80–100 % a F XI nad 45 %, bylo podáno 7 000 j rekombinantního faktoru VIII (Kovaltry®), 600 ml protivirově ošetřené plazmy (Octaplas®), 1 500 j antitrombinu a trombocytární koncentráty. V odstupu dalších 7 hod. dosahovala aktivita F VIII 176 %, koncentrace antitrombinu 65 %, počet trombocytů 52 × 109/l, koncentrace fibrinogenu 3,3 g/l, a postupně se zkracoval protrombinový čas PT‑R 0,57 svědčící pro časný nástup funkce štěpu, nebyly přítomny známky excesivního krvácení. Perioperační vývoj laboratorních parametrů a podávanou substituční terapii souhrnně podává Tab. 3. Další postoperační průběh byl již z hematologického hlediska nekomplikovaný, substituční terapie rekombinantním F VIII probíhala v postupně se snižujících dávkách ještě do 7. 1. 2019, kdy mohla být při aktivitě F VIII 190 % a F XI 76,8 % definitivně bezpečně ukončena (při kontrole dne 8. 1. 2019 byla aktivita F VIII 150,3 % a dne 11. 1. pak 173,6 %). Substituce F XI již rovněž nebyla nutná – aktivita F XI se po transplantaci jater rychle normalizovala. Za hospitalizace byly celkem podány 3 trombocytární koncentráty, 2 erytrocytární koncentráty, 5 transfuzních jednotek (TU) protivirově ošetřené plazmy a jedna TU čerstvě zmražené plazmy (bez alergických projevů), 3 500 j antitrombinu a 30 000 j rekombinantního F VIII. Hospitalizace byla komplikována septickým stavem způsobeným Staphylococcus epidermidis, který se podařilo zvládnout antibiotickou léčbou. Pacient byl propuštěn do domácího ošetřování dne 25. 1. 2019 (20. den po transplantaci) s nastavenou imunosupresivní terapií kortikoidy, mykofenolátem‑mofetilem, tacrolimem, s profylaktickou antiinfekční terapií co‑trimoxazolem, valganciklovirem, lamivudinem a clotrimazolem a s další podpůrnou medikací na interní komorbidity, již bez nutnosti další substituce F VIII. Při kontrolním ambulantním vyšetření v odstupu 3 měsíců od transplantace měl pacient fyziologické parametry krevního obrazu, mírnou hyperbilirubinemii a normální aktivitu aminotransferáz, aktivita F VIII se pohybovala mezi 39–47,1 %, pacient byl v klinicky dobrém stavu bez krvácivých komplikací. V září roku 2019 byly fyziologické parametry krevního obrazu a koagulogramu, aktivita F VIII 45,2 %, F IX 107,0 %, F XI 102,2 %, F XII 132,7 %, inhibitor F VIII nebyl přítomen. Pacient nadále zůstává ve specializované hepatologické i hematologické dispenzární péči.
Tab. 1. Aktivita jednotlivých koagulačních faktorů v předtransplantačním období 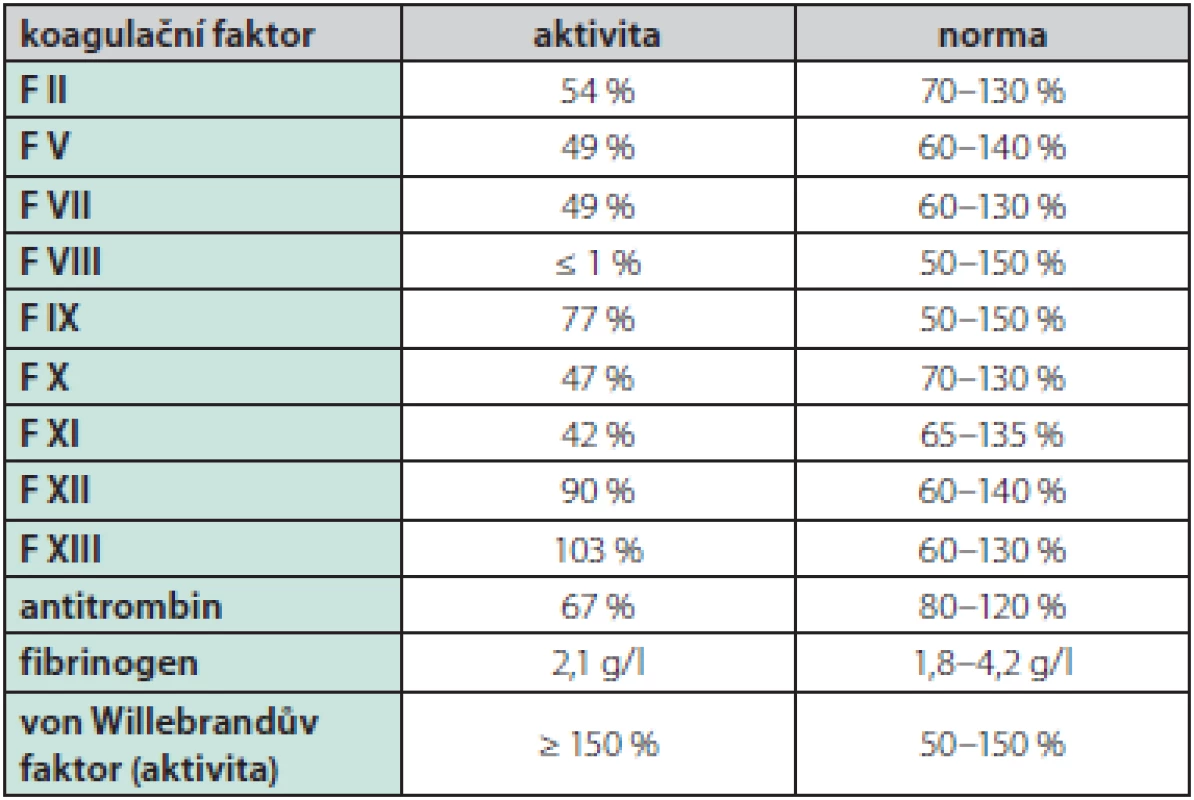
Tab. 2. Farmakokinetika rekombinantního F VIII 
Tab. 3. Vývoj laboratorních parametrů a substituce F VIII v perioperačním období 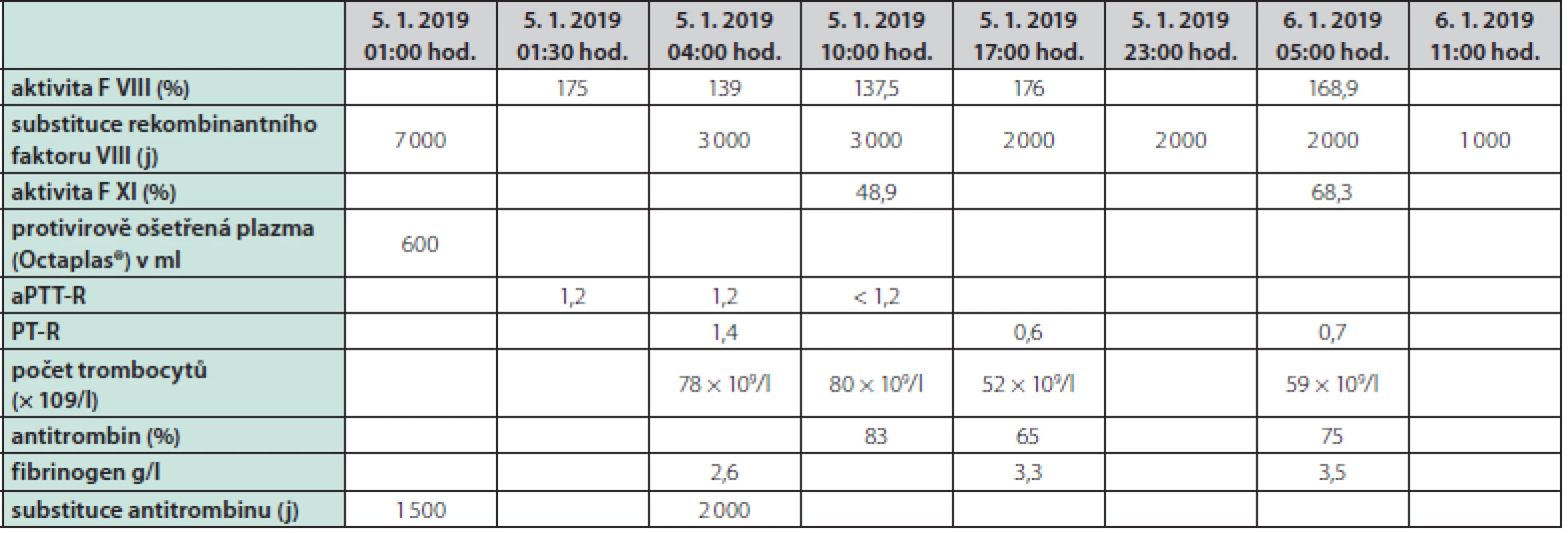
Diskuze
Navzdory dosaženým pokrokům v prevenci přenosu infekčních agens krevními deriváty i v oblasti samotné terapie těchto nákaz, představují onemocnění jater způsobená chronickými virovými hepatitidami B a C nadále hlavní příčinu morbidity i mortality pacientů s hemofilií. Např. statistické údaje ve Spojených státech amerických uvádí v letech 1979–1998 celkem 4 781 úmrtí pacientů s hemofilií A, přičemž v přímé souvislosti s nákazami HCV a HIV bylo 2 254 úmrtí (3). Jelikož k rozvoji cirhózy jater dochází zpravidla až za několik desetiletí od nákazy virem/viry chronických hepatitid, lze v globálním měřítku očekávat reálný pokles počtu těchto závažných a život ohrožujících komplikací teprve v nadcházejících letech (1). První úspěšnou transplantaci jater u jedince s hemofilií A publikoval Lewis et al v roce 1985 (4). Jejich práce se opírala o experimentální důkazy, že v játrech a slezině je syntetizován tzv. „antihemofilický faktor“, a o úspěšně prováděné ortotopické transplantace jater u psů počátkem 70. let 20. století (5–8). Teprve následně bylo prokázáno, že většina F VIII cirkulujícího v plazmě je secernována jaterními sinusoidálními endoteliálními buňkami a jen minoritně pochází z extrahepatálních zdrojů (monocytů, mezenchymálních stromálních buněk, endotelií kapilár sleziny, plic a ledvin) (8, 9). Secernovat F VIII dokáží i kmenové buňky krvetvorby, není však jasné, do jaké míry se reálně podílí na plazmatické koncentraci F VIII, ani zda by je bylo možno terapeuticky využít (10). Transplantace jater byla opakovaně a úspěšně použita i v léčbě jiných vrozených krvácivých stavů – např. u kongenitálního deficitu fibrinogenu, von Willebrandova faktoru, F IX či F XI (11–14). Samotná transplantace jater může sice vést ke změně fenotypu jedince (z fenotypu s krvácivými projevy na fenotyp s fyziologickou hemostázou), nicméně úspěch této náročné operace není nikdy předem zaručen. V literatuře je popsáno několik případů, kdy ani po jinak nekomplikované transplantaci jater nedošlo k setrvalému udržení hemostaticky fyziologických koncentrací F VIII. Pokles syntézy F VIII v endoteliálních sinusoidálních buňkách štěpu se přitom může projevit až v odstupu několika měsíců, a je proto důležité aktivitu F VIII opakovaně kontrolovat i v delším odstupu od operace. Jednou z možných příčin tohoto stavu je částečná migrace a kolonizace cév štěpu endoteliemi příjemce, které nejsou schopny adekvátní syntézy F VIII (mají hemofilický genotyp i fenotyp) (15). Obdobně byl popsán i případ nedostatečného vzestupu aktivity von Willebrandova faktoru po jaterní transplantaci a hemofilie B po transplantaci jater od jedince s nediagnostikovanou lehkou formou tohoto onemocnění (16). Hemostatickou aktivitu nově syntetizovaného F VIII po úspěšné transplantaci jater mohou též inhibovat protilátky se specificitou proti tomuto koagulačnímu proteinu (tzv. inhibitor). Tyto protilátky mohou být v séru pacienta přítomny již z předtransplantačního období, byly však popsány i případy jejich vzniku de novo až po transplantaci. Tito jedinci mají zpravidla fenotyp těžké hemofilie vyžadující alternativní bypassovou terapii buď pomocí rekombinantního faktoru VIIa (NovoSeven®) anebo pomocí přípravku FEIBA®. Kazuisticky byla dokonce popsána katastrofická mikroangiopatie při vysokém titru inhibitoru po transplantaci jater (16, 17).
Je zajímavé, že krvácivý fenotyp se může lišit i u jedinců se stejnou tíží deficitu příslušného koagulačního faktoru. Uplatňují se zde mimo jiné vlivy věku, tělesné hmotnosti, fyzické zátěže, celkového stavu muskuloskeletálního systému a adherence k terapii, ale i typ genetické mutace, krevní skupina pacienta a aktivita von Willebrandova faktoru (u krevní skupiny 0 je jeho aktivita až o 25 % snížena) a jiné. Tak lze vysvětlit, proč vykazuje poločas F VIII velké interindividuální rozdíly mezi 6–25 hod. (18–20). Proto je pro adekvátní léčbu akutního krvácení a pro přípravu k operačnímu zákroku důležité provést individuální farmakokinetickou studii s podávaným substitučním preparátem. Přímý vzestup aktivity příslušného koagulačního faktoru (nejčastěji se jedná o F VIII a F IX) charakterizuje parametr zvaný in vivo recovery, zkráceně pouze recovery. Recovery se počítá jako rozdíl aktivity faktoru po aplikaci a aktivity před aplikací dělený podanou dávkou v jednotkách na jeden kilogram tělesné hmotnosti. Uspokojivá hodnota recovery představuje 2,0 % a více po aplikaci 1 jednotky F VIII na kilogram hmotnosti, čehož bylo dosaženo i v prezentovaném případě (20–23). V perioperační péči je z hlediska prevence krvácivých komplikací významné dosahovat adekvátních vrcholových koncentrací po bolusové aplikaci příslušného koagulačního faktoru (pro velké operace je doporučena aktivita F VIII nad 80–100 %). Současně je třeba věnovat náležitou pozornost i tzv. údolním koncentracím v době těsně před další dávkou (tzv. trough level, zkráceně through), neboť příliš nízká údolní aktivita daného koagulačního faktoru rovněž znamená zvýšené riziko krvácení. Aplikace koagulačního faktoru může být řešena bolusově nebo kontinuální infuzí. Např. japonští autoři sestavili protokol perioperačního managementu substituční terapie F VIII s cílem aktivity F VIII nad 120 % od počátku operace až do reperfuze jaterního štěpu. V letech 1996–2014 provedli transplantaci jater celkem u 6 osob s hemofilií A a u 4 jedinců s hemofilií B (medián věku 32 let), z nichž všichni měli chronickou virovou hepatitidu C a 8 z nich i koinfekci s HIV. Ve 3 případech byla nutná časná chirurgická revize dutiny břišní pro krvácení – frekvence této komplikace odpovídala dle autorů výskytu u populace bez hemofilie. Pětileté přežití v této kohortě dosahovalo 60 % (23). Obdobné zkušenosti získané na relativně malém počtu pacientů jsou referovány i z jiných zemí. V jedné americké studii z let 2003–2010 bylo evidováno 7 hemofiliků po transplantaci jater, všichni s chronickou virovou hepatitidou C (během 3letého sledování 4 zemřeli) (24). V retrospektivní národní španělské studii bylo popsáno celkem 11 transplantací jater u hemofiliků v letech 1995–2008 (10× se jednalo o hemofilii A – z toho byli 4 jedinci současně infikováni HBV a 3 HIV; 1× se jednalo o hemofilii B). V časném pooperačním období zemřel 1 pacient na akutní rejekci štěpu, akutní krvácivé komplikace se nevyskytly, dlouhodobé přežití nebylo popsáno (14). Zhruba ve stejném časovém období bylo v King’s College v Londýně uskutečněno celkem 13 transplantací jater u hemofiliků A, 4 transplantace u hemofiliků B a 1 transplantace u kongenitálního deficitu F X (všichni jedinci měli chronickou virovou hepatitidu C – 4 již ve stadiu hepatocelulárního karcinomu, 5 z nich mělo koinfekci s HIV, medián věku byl 52 let). Spontánní adekvátní hemostázy bylo u všech dosaženo mezi 3. –8. postoperačním dnem. Tříleté přežití v této kohortě bylo 68 % (výrazně nižší přežití bylo zaznamenáno u osob s koinfekcí HCV/HIV) (25). Další britská retrospektivní studie autorů z Birminghamu popisuje celkem 35 transplantací jater u hemofiliků A v letech 1990–2014, z nichž 30 mělo cirhózu jater na podkladě chronické virové hepatitidy C (12 z nich mělo i hepatocelulární karcinom) a 5 bylo současně infikovaných HIV. Medián věku v této kohortě byl 51 let. Pětileté přežití bylo 54 % (16). V transplantačním centru v Bonnu bylo do roku 2015 provedeno celkem 10 transplantací jater (9× u hemofilie A, 1× u hemofilie B; 8 jedinců mělo koinfekci HCV/ HIV) s 8letým přežitím dosahujícím 70 %. Hemostaticky uspokojivé aktivity původně deficitních koagulačních faktorů bylo dosaženo v mediánu za 72 hod (26). Korejští autoři popsali zajímavou kazuistiku pomocné a pouze parciální transplantace jater u 37letého muže s hemofilií A na rozhraní středně těžké a těžké formy a s následnou setrvale zvýšenou aktivitou F VIII nad 20 % (27). V českém písemnictví byl referován případ úspěšné transplantace jater u hemofilika naposledy Charvátem v roce 2007 (28). Z výše uvedených prací vyplývá, že transplantace jater je u pacientů s vrozenou poruchou hemostázy možná a při důsledném vedení a monitoraci substituční terapie i relativně bezpečná, přesto je však ve střednědobém až dlouhodobém horizontu zatížena nezanedbatelnou mortalitou z jiných než hematologických příčin. Na mortalitě pacientů se mimo jiné může podílet i rekurence chronické hepatitidy ve štěpu (1). V popsaném případě proběhla transplantace jater při pečlivě monitorované aktivitě především F VIII zcela bez krvácivých komplikací s možností časného ukončení substituční léčby po přihojení štěpu zajišťujícího fyziologickou proteosyntetickou funkci.
Závěr
Ortotopická transplantace jater představuje v současnosti jednu z možností fenotypického vyléčení hemofilie A, pokud je operace indikována pro jinou komorbiditu. Výkon je v horizontu několika let od operace zatížen nezanedbatelnou mortalitou z jiných než hematologických příčin, a proto představuje spíše ultimum refugium i navíc z hlediska řešení chronického jaterního onemocnění. S nadějemi je sledován pokrok v oblasti genetických manipulací, díky němuž by snad bylo možno v budoucnu hemofilii zcela vyléčit.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Pavel Polák, Ph.D., polak.pavel@fnbrno.cz
Oddělení klinické hematologie FN Brno, pracoviště Bohunice, Jihlavská 20, 625 00 BrnoČlánek přijat redakcí: 9. 9. 2019
Článek přijat po recenzích k publikaci: 17. 11. 2019
Zdroje
1. Matýšková M, Penka M. Hemofilie. Vnitř Lék 1991; 37 : 397–403.
2. Maier KP. Hepatitis‑Hepatitisfolgen. 6. Aufl. Bern: Verlag Hans Huber 2010, 457 s.
3. Chorba TL, Holman RC, Clarke MJ, et al. Effects of HIV infection on age and cause of death for persons with hemophilia A in the United States. Am J Hematol 2001; 66 : 229–240.
4. Lewis JH, Bontempo FA, Spero JA, et al. Liver transplantation in a hemophiliac. N Engl J Med 1985; 312 : 1189–1190.
5. Norman JC, Lambilliotte JP, Kojima Y, et al. Antihemophilic factor release by perfused liver and spleen: relationship to hemophilia. Science 1967; 158 : 1060–1061.
6. Webster WP, Zukoski CF, Hutchin P, et al. Plasma factor VIII synthesis and control as revealed by canine organ transplantation. Am J Physiol 1971; 220 : 1147–1154.
7. Stel HV, van der Kwast TH, Veerman EC. Detection of factor VIII/coagulant antigen in human liver tissue. Nature 1983; 303 : 530–532.
8. Webster WP, Mandel SR, Reddick RL, et al. Orthotopic liver transplantation in canine hemophilia B. Am J Physiol 1974; 226 : 496–500.
9. Kleeberger W, Rothamel T, Glockner S, et al. High frequency of epithelial chimerism in liver transplants demonstrated by microdissection and STR‑analysis. Hepatology 2002; 35 : 110–116.
10. Zanolini D, Merlin S, Feola M et, al. Extrahepatic sources of factor VIII potentially contribute to the coagulation cascade correcting the bleeding phenotype of mice with hemophilia A. Haematologica 2015; 100 : 881–892.
11. Groth CG, Ringdén O. Transplantation in relation to the treatment of inherited disease. XXXXXXXXX XXXX; XXX: XXX–XXX.
12. Gupta E, Finn L, Johns G, et al. Correction of factor XI deficiency by liver transplantation. Blood Coagul Fibrinolysis 2015; 26 : 961–963.
13. Gallastegui N, Kimble EL, Harrington TJ. Resolution of fibrinogen deficiency in a patient with congenital afibrinogenemia after liver transplantation. Haemophilia 2016; 22: e36–e79.
14. Alonso Madrigal C, Dobón Rebollo M, Laredo de la Torre V, et al. Trasplante hepático en hemofilia A y enfermedad de von Willebrand tipo 3. Manejo perioperatorio y evolución postrasplante. Rev Esp Enferm Dig 2018; 110 : 522–526.
15. Suzuki Y, Kakisaka K, Matsumoto T, et al. Orthotopic liver transplantation for haemophilia A may not always lead to a phenotypic cure of haemophilia A: A case report. Haemophilia 2018; 24: e420-e422.
16. Murthy V, Murray D, Hebballi S, et al. Outcome of liver transplantation in patients with hereditary bleeding disorders: a single centre UK experience. Haemophilia 2016; 22: e139-e144.
17. Khakhar AK, Chan NG, Allan DS, et al. Catastrophic microangiopathy induced by high‑titre factor VIII inhibitors after liver transplantation for haemophilia A with cirrhosis. Haemophilia 2005; 11 : 623–628.
18. Srivastava A, Brewer AK, Mauser‑Bunschoten EP, et al. Guidelines for the management of hemophilia. Haemophilia 2013; 19: e1-e47.
19. Merlen C, Zourikian N, Bonnefoy A, et al. Effect of ABO blood group on haemostatic parameters in severe haemophilia A patients performing acute moderate‑intensity exercise. Blood Coagul Fibrinolysis 2018; 29 : 626–635.
20. Shapiro AD, Korth‑Bradley J, Poon MC. Use of pharmacokinetics in the coagulation factor treatment of patients with haemophilia. Haemophilia 2005; 11 : 571–582.
21. Björkman S, Folkesson A, Berntorp E. In vivo recovery of factor VIII and factor IX: intraand interindividual variance in a clinical setting. Haemophilia 2007; 13 : 2–8.
22. Hazendonka HCAM, van Moorta I, Mathô RAA, et al. Setting the stage for individualized therapy in hemophilia: What role can pharmacokinetics play? Blood Rev 2018; 32 : 265–271.
23. Togashi J, Akamatsu N, Tanaka T, et al. Living donor liver transplantation for hemophilia with special reference to the management of perioperative clotting factor replacement. Liver Transplant 2016; 22 : 366–370.
24. Ragni MV, Devera ME, Roland ME, et al. Liver transplant outcomes in HIV+ haemophilic men. Haemophilia 2013; 19 : 134–140.
25. Yokoyama S, Bartlett A, Dar FS, et al. Outcome of liver transplantation for haemophilia. HPB (Oxford) 2011; 13 : 40–45.
26. Goldmann G, Zeitler H, Marquardt N, et al. Long‑term outcome of liver transplantation in HCV/HIV coinfected haemophilia patients. A single centre study of 10 patients. Hamostaseologie 2015; 35 : 175–180.
27. Park YK, Kim HC, Kim BW, et al. Auxiliary partial orthotopic liver transplantation as a treatment for hemophilia a: a case report. Transplant Proc 2015; 47 : 161–164.
28. Charvát J, Vychodil P, Adamec M, et al. Vyléčení těžké formy hemofilie A transplantací jater – kazuistika. Trombóza a hemostáza. Hradec Králové: HK Credit 2007, 114 s.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Pulmo‑renální syndromČlánek Praluent (alirokumab)
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2020 Číslo 5- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Etiologie a management dyslipidemie u pacientů s chronickým onemocněním ledvin
- Katetrizační implantace aortální chlopně – co víme v roce 2020
- Chronické cholestatické jaterní choroby, primární biliární cholangitida a primární sklerozující cholangitida
- Doporučená očkování pro diabetiky
- Ropeginterferon alfa-2 b v léčbě pacientů s pravou polycytémií
- Onemocnění jater související s alkoholem (ALD)
- Diabetes mellitus a nelegální drogy
- Pulmo‑renální syndrom
- Konfokální laserová endomikroskopie v diagnostice onemocnění jícnu: pilotní studie
- Srovnání různých přístupů k určení prevalence diabetu 2. typu v ČR
- Terapie dušnosti zdrojem svízelné diagnózy neurologického onemocnění
- Akútna končatinová ischémia v dôsledku paradoxnej embolizácie liečená systémovou trombolýzou
- Náhodne zistený feochromocytóm u 33-ročného pacienta s Lynchovým syndrómom
- Transplantace jater jako potenciální kurativní metoda těžké hemofilie A: popis případu a literární přehled
- Osteolytická ložiska, hyperkalcemie a paraprotein, ale myelom to není
- Praluent (alirokumab)
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Osteolytická ložiska, hyperkalcemie a paraprotein, ale myelom to není
- Onemocnění jater související s alkoholem (ALD)
- Chronické cholestatické jaterní choroby, primární biliární cholangitida a primární sklerozující cholangitida
- Doporučená očkování pro diabetiky
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



