-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Deriváty sulfonylurey a riziko hypoglykemie u diabetiků 2. typu
Sulfonylurea derivatives and risk of hypoglycaemia in type 2 diabetic patients
Hypoglycemia related to treatment of type 2 diabetes mellitus patients constantly represents a substantial problem. It is connected with higher mortality and lower quality of life, mostly displayed with elder patients. Therefore it is vital to revise the antidiabetic therapy regularly and to inquire for the associated risks. Nevertheless, elder patiens are often following the inadvisable treatment by sulphonylureas derivates, which represent the second most risky medication causing hypoglycemia after insulin. In our retrospective study we analysed the occurence of serious hypoglycemia, caused by any factor, with severe diabetics urgently hospitalised at The Department of Internal Medicine of Masaryk Hospital in Ústí nad Labem, in relation to the applied antidiabetic therapy. We suspected a negative influence of hypoglycemizing therapy (above all sulphonylureas) with the elderly patiens. In sum, we hospitalised 32 patients with type 2 diabetes mellitus (average age 76,5 ± 8,2 years), 18 of these using sulphonylureas (average age 77,4, with a relatively wide range from 65 to alarming 93 years). The average figure of estimated glomerular filtration rate (eGFR) was 0,745 (±0,293) ml/s/1,73m2. Moreover, the patients manifested polmorbidity – the average of comorbidities was 3,125, and even 3,5 with patiens on sulphonylureas. Following the arguments summarised above, we believe that hypoglycemic episodes are extremely dangerous especially for elder patients with T2DM, and from this point of view, the medication using sulphonylureas derivates seems to be inappropriate.
Keywords:
sulphonylureas – hypoglycaemia – diabetes mellitus – elderly – antidiabetic therapy
Autori: Jakub Svěcený 1; Jana Jirušková 1; Karel Hrach 2; Lucie Radovnická 1; Jiří Laštůvka 1
Pôsobisko autorov: Interní oddělení Masarykovy nemocnice v Ústí nad Labem, Krajská zdravotní a. s. 1; Katedra zdravotnických studií, Univerzita J. E. Purkyně 2
Vyšlo v časopise: Vnitř Lék 2020; 66(6): 35-42
Kategória: Původní práce
Súhrn
Hypoglykemie spojená s léčbou pacientů s diabetem mellitem 2. typu stále představuje zásadní problém. Je spojena se zvýšenou mortalitou a významně snižuje i samotnou kvalitu života, což se nejvíce projevuje u starších nemocných. Proto je nutné neustále revidovat antidiabetickou terapii a pátrat po rizicích s ní spojených. Právě starší pacienti s diabetem jsou však často ponecháni na nevhodné léčbě deriváty sulfonylurey (DSU), které jsou po inzulinu nejrizikovější hypoglykemizující medikací. V naší retrospektivní studii jsme porovnávali výskyt těžké hypoglykemie z jakýchkoliv příčin u diabetiků 2. typu vedoucí k hospitalizaci na Interní oddělení Masarykovy nemocnice v Ústí nad Labem v závislosti na užívání různé antidiabetické terapie. Předpokládali jsme negativní vliv hypoglykemizující terapie ( především DSU) u starších pacientů. Celkem bylo přijato 32 pacientů s diabetem mellitem 2. typu (prům. věk 76,5 ±8,2 let), z nichž užívalo DSU 18 pacientů a jejich průměrný věk byl 77,4 let s poměrně širokým rozpětím 65 až alarmujících 93 let. Průměrná hodnota odhadované glomerulární filtrace (eGFR) činila 0,745 (±0,293) ml/s/1,73m2 a navíc se jednalo o relativně polymorbidní pacienty, průměrný počet komorbidit byl 3,125, u pacientů užívajících DSU dokonce 3,5. Epizody hypoglykemie jsou zejména pro starší pacienty s diabetem mellitem 2. typu z výše popsaných důvodů velmi nebezpečné a z tohoto pohledu se jeví deriváty SU jako preparáty nevhodné.
Klíčová slova:
deriváty sulfonylurey – hypoglykemie – diabetes mellitus – stáří – antidiabetická terapie
Úvod
Hlavním cílem léčby diabetu mellitu 2. typu je prevence chronických komplikací a zajištění kvality života. Těžká hypoglykemie, definovaná poruchou metnálních funkcí a fyzického stavu vyžadující pomoc druhé osoby (laboratorně spojená s glykemií < 3,0 mmol/l), stále patří i v dnešní době mezi nejobávanější komplikace léčby pacienta s diabetem, a to i u pacientů s diabetem mellitem 2. typu (T2DM) (1). Kromě samotné mortality hypoglykemie významně snižuje i samotnou kvalitu života, což je obzvláště patrné zejména u starších nemocných. Frekvence výskytu hypoglykemie je tedy u léčby obou typů diabetu mellitu klíčovým měřítkem adekvátnosti léčby (outcome measure). Největší riziko hypoglykemie je u léčby inzulinem (3–4×), z perorálních antidiabetik (PAD) pak představují po inzulinu druhé nejvyšší riziko hypoglykemie preparáty ze skupiny tzv. inzulinových sekretagog (2–3×), kam řadíme deriváty sulfonylurey (DSU) a glinidy a to ve srovnání s ostatní terapií. Ostatní PAD samy o sobě obvykle hypoglykemii nezpůsobují, v kombinaci s inzulinem či inzulinovými sekretagogy však riziko hypoglykemie zvyšují (2).
Riziko hypoglykemie dále stoupá s věkem (> 75 let), délkou léčby inzulinem (3) a dále kombinovanou antidiabetickou terapií, což dokládá řada observačních studií (4, 5, 6).
Hypoglykemie může ohrozit pacienta buď akutně (úraz při poruše vědomí, smrt zejména arytmogenním účinkem) nebo vede z dlouhodobého hlediska k poruchám mozkové funkce (diabetická encefalopatie), což má za následek akceleraci kognitivní dysfunkce zejména u starších pacientů (7, 8, 9).
Proto u diabetiků 2. typu používáme při hodnocení míry kompenzace glykovaný hemoglobin (HbA1c), a to i přes všechna známá úskalí tohoto parametru (interindividuální variabilita glykace, anémie, atd.). Cílové hodnoty HbA1c volíme vždy individuálně na základě komplexního posouzení přínosů a rizik léčby, což je výrazně akcentováno právě u starších pacientů s kardiovaskulárním onemocněním a častější kognitivní dysfunkcí, které případná hypoglykemie ohrožuje ještě více než komplikace hyperglykemie. Léčba je u těchto rizikových pacientů kompromisem mezi těmito riziky (10).
Léčebný efekt DSU na snížení HbA1c je dán stimulací sekrece inzulinu z beta buněk pankreatu, což vede ke snížením hladiny glukózy v séru. Ve srovnání s jinými PAD však u nich chybí váhová neutralita a nebylo prokázáno zlepšení kompenzace diabetu mellitu (snížením HbA1c) při navyšování dávky, které je naopak spojeno s vyšším výskytem hypoglykemie. Za účelem vyhnout se vysokým dávkám DSU je tedy někdy paradoxně k malé dávce přidán do kombinace inzulin, což opětovně zvyšuje riziko hypoglykemie (11).
Ačkoliv jsou nežádoucí účinky a rizika spojená s užíváním DSU známá již delší dobu, dřívější guidelines (ADA 2011, 2015) k nim byla celkem benevolentní (12, 13). Teprve poměrně nedávno byla vydána nová doporučení na základě společného konsenzu ADA/EASD 2018 (následnou aktualizaci 2019 záměrně neuvádíme, jelikož v těchto doporučený postupech ADA/EASD pro rok 2019 (14) nebyla učiněna změna ohledně terapie DSU v porovnání s doporučením z roku 2018 a změny v aktuálně platných doporučeních se týkaly skupin moderních antidiabetik (agonisté receptoru pro GLP-1) v reakci na výsledky dokončených kardiovaskulárních studií), zohledňující kardiovaskulární bezpečnost, kardiorenální protektivitu se snížením morbidity i mortality a nízkou míru rizika hypoglykemie u „nových“ antidiabetik (agonisté receptoru pro GLP-1, SGLT2-inhibitory). Ve snaze minimalizovat riziko hypoglykemie jsou DSU udávány až jako minimálně 4. volba z PAD a preferovány jsou preparáty z vyšší generace DSU s menším rizikem hypoglykemie (15).
Dle epidemiologických dat bylo k 31. 12. 2017 na území České republiky léčeno celkem 863 404 diabetiků a to jak pacientů s T1DM, T2DM, sekundárním diabetem, tak i pacientů s poruchou glukózové tolerance. Z tohoto počtu bylo 427 215 mužů a 436 189 žen. Jenom v Ústeckém kraji bylo registrováno 70 631 diabetiků (34 340 mužů a 36 291 žen). V léčbě převažuje u pacientů s T2DM léčba perorálními antidiabetiky a to celkem u 799 569 pacientů, z toho je DSU léčeno 157 079 pacientů, metformin užívá 487 371 pacientů, DPP4-inhibitory 106 118 pacientů a inzulinem 164 549 pacientů, z čehož intezifikovaný inzulinový režim má 92 962 pacientů a konvenční režim 70 588 pacientů. Jeden pacient může být přitom léčen kombinací více antidiabetik, data zde uvedená udávají každou naordinovanou léčbu, která byla předepsána k pravidelnému užívání alespoň na dobu 1 měsíce (16).
Cíl
Cílem naší observační retrospektivní analýzy bylo porovnání výskytu těžké hypoglykemie z jakýchkoliv příčin u diabetiků 2. typu vedoucí k hospitalizaci na Interním oddělení Masarykovy nemocnice v Ústí nad Labem v závislosti na užívání různé antidiabetické terapie.
Metodika
Data byla sebrána retrospektivně. K získání dat byl použit nemocniční informační systém Fons Enterprise, verze 1.137. Postupně byli screenováni všichni pacienti s uvedenou diagnózou hypoglykemie a to bez ohledu na komorbidity. Vlastní hodnota glykemie (v tabulce 1 uvedena jako „Hodnota vstupní glykemie“) byla 1. měřená hodnota ať cestou záchranné služby či na Emergency. Sledované období bylo 3,5 roku (konkrétně leden 2016 – srpen 2019). Zvažováni byli všichni pacienti přijatí pro těžkou hypoglykemii s nutností hospitalizace na našem pracovišti, a to jak s 1. epizodou, tak pro opakovanou hypoglykemii. K následnému posouzení byli zařazeni pouze pacienti s diagnózou diabetes mellitus 2. typu. Pacienti s diabetem mellitem 1. typu a pacienti s hypoglykemií spojenou s jinou příčinou než přítomností T2DM byli vyřazeni.
Tab. 1. Charakteristika pacientů s T2DM (n = počet zjistitelných údajů, uvedeno pouze tam, kde n ≠ 32) 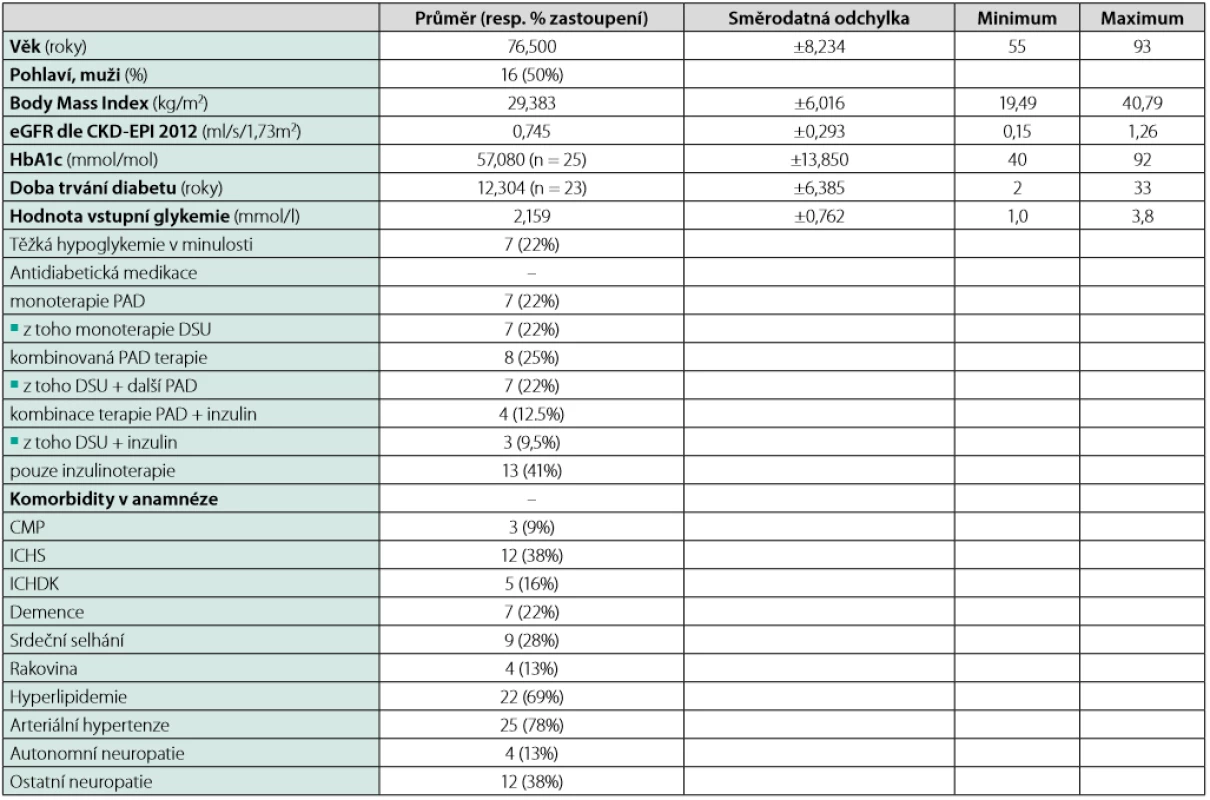
U výsledné skupiny byly určovány deskriptivní charakteristiky standardním způsobem, to znamená u číselných veličin průměr ±SD, u kategoriálních veličin četnosti.
Výsledky
Celkově bylo s hypoglykemií na naše pracoviště za sledované období přijato celkem 44 pacientů. Z toho sedm pacientů (15,9 %) s diabetem mellitem 1. typu, pět pacientů (11,4 %) mělo nediabetickou etiologii hypoglykemie a u 32 pacientů (72,7 %; resp. 82,1 % ze všech diabetiků, n = 39) se jednalo o pacienty s diabetem mellitem 2. typu.
Detailní charakteristika skupiny pacientů (T2DM, n = 32) je uvedena v Tabulce 1. Skupina se skládala z 16 mužů (50 %) a 16 žen. Průměrný věk byl 76,5 (±8,2) let a průměrná zjistitelná doba trvání diabetu činila 12,3 (±6,39) let (n = 23). Průměrná hodnota odhadované glomerulární filtrace (eGFR) činila 0,745 (±0,293) ml/s/1,73m2 (rozložení dle kategorií viz Tabulka 2), s čímž koreluje i nízký výskyt užívání metforminu (pouze 8 pacientů). Naproti tomu 18 z nich (59,4 %) užívalo v chronické medikaci DSU. Hodnota naměřené glykemie vstupně byla 2,159 (±0,762) mmol/l. Podrobný výčet ostatních kategoriálních veličin viz Tabulka 1.
Tab. 2. Kategoriální rozložení renální funkce dle hodnot eGFR 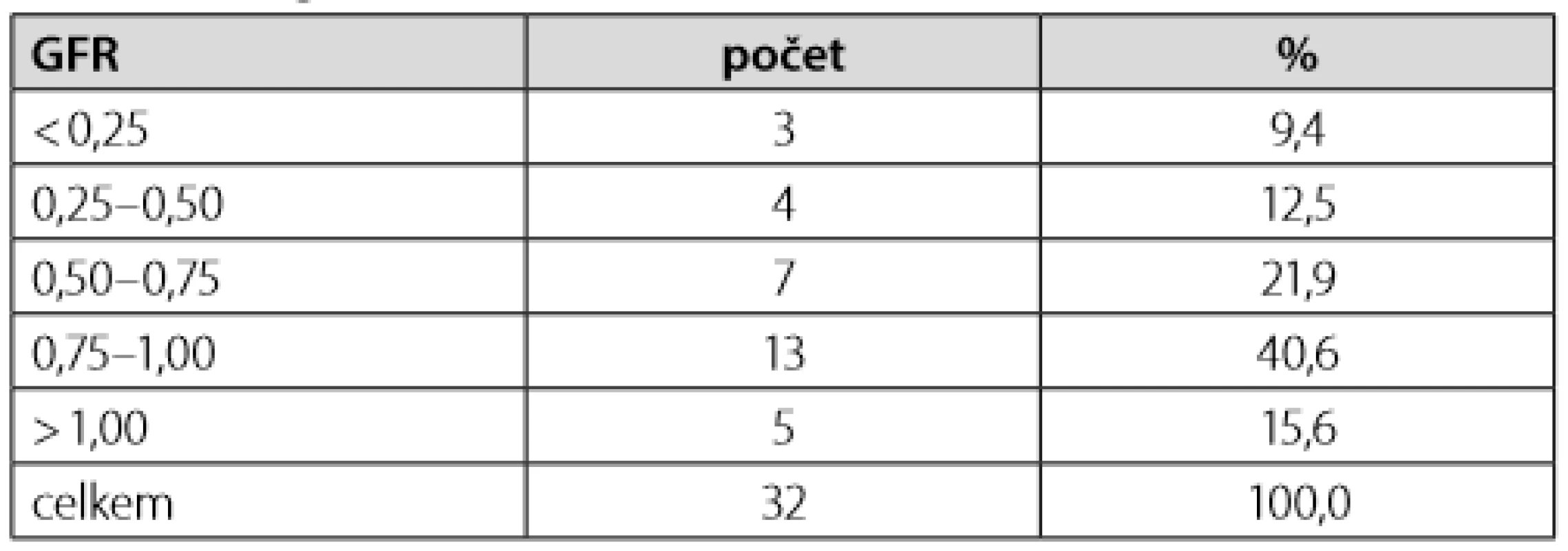
Průměrný věk diabetiků užívajících DSU byl v našem souboru 77,4 let s poměrně širokým rozpětím 65 až 93 let. Věkové rozložení pacientů užívajících, resp. neužívajícíh DSU viz Graf 1. Dvouvýběrovým t-testem nebyl však shledán statisticky významný rozdíl ve středním věku mezi oběma skupinami (p = 0,498). Dále se jednalo o relativně polymorbidní pacienty, kdy průměrný počet komorbidit všech pacientů (n = 32) byl 3,125, pacientů užívajících DSU (n = 18) dokonce 3,5 (detailní výčet komorbidit opět viz Tabulka 1).
Graf 1. Věkové rozložení pacientů neužvívajících (SU = 0), resp. užívajících (SU = 1) deriváty SU – boxplot 
Graf 2. Zastoupení jednotlivých antidiabetických přípravků mezi pacienty s T2DM 
Graf 3. Typ následné terapie a kategorické zastoupení jednotlivých antidiabetických preparátů při dimi 
Dále jsme ověřovali hypotézu rozdílu v počtu komorbidit mezi skupinou s a bez akutní infekce, a to pomocí neparametrického dvou-výběrového testu Mann-Whitney. Nebyl prokázán statisticky významný rozdíl ani v případě celé skupiny (n = 32, p = 0,065), ani v případě podskupiny pacientů užívajících DSU (n = 18, p = 0,587).
Akutní infekt při příjmu vykazovalo 11 pacientů (34,4 %) ze všech uvažovaných (n = 32). Z pacientů užívajících DSU (n = 18) vykazovalo akutní infekt 7 pacientů (38,9%). Testem typu chí-kvadrát nebyl prokázán významný rozdíl v zastoupení akutního infektu mezi pacienty s a bez DSU (p = 0,542).
Dále byla zjišťována korelovanost mezi renální funkcí (vyjádřeno pomocí eGFR) a tíží hypoglykemie, ta se ovšem v našem souboru neprokázala (korelační koeficient = -0,104)
Diskuze
Stále je nutno mít na paměti, že hlavním cílem léčby pacienta s diabetem mellitem 2. typu je prevence chronických komplikací a zajištění kvality života. Při výběru léčby se snažíme minimalizovat riziko hypoglykemie a to zejména u starších pacientů s ohledem na komorbidity a „komedikaci“.
Dle doporučení (konsenzus ADA/EASD 2018) je akcentována volba antidiabetické medikace právě s ohledem na komorbidity a terapeutický cíl. Ačkoliv je užívání DSU nepříliš bezpečné (až 10% pacientů užívajících DSU je každoročně v riziku výskytu závažné hypoglykemie (17)), tak podle doporučení konsenzu ADA/ EASD 2018 patří tyto preparáty mezi široce rozšířené a cenově dostupné (11). Pokud je už zvolena díky výše uvedeným důvodům tato léčba, pak jsou preferovány glipizid, glimepirid a gliklazid se svým nižším rizikem hypoglykemie ve srovnání s ostatními DSU (18, 19).
V našem souboru jsme pozorovali, že 11 pacientů z 18 užívajících DSU mělo prokázánu některou z forem neuropatie, a tedy sníženou schopnost rozpoznat blížící se hypoglykemii, která je tak zejména u starších pacientu s diabetem mellitem často nerozpoznaná, a tedy vysoce prevalentní, což je ještě zhoršováno právě volbou terapie ze skupiny DSU či inzulinem (zejéna humánním a premixovaným). Naproti tomu u 14 pacientů na jiné formě medikace byla známá neuropatie pouze u 5 z nich. Pokud se přistupuje k inzulinoterapii u starších, pak je dnes s ohledem na riziko hypoglykemie jednoznačně preferován inzulin ze skupiny tzv. dlouhých analog druhé generace, kam řadíme glargin 300 a degludec.
Naopak pokud volíme PAD medikaci s cílem minimalizovat riziko hypoglykemie, pak je vhodnou volbou např. léčba pomocí DPP4inhibitorů jako regulátorů glukózové homeostázy závislých na výši glykemie, což dokládá řada již relativně starších publikovaných studií. Například již v roce 2011 Ahren et al. (20) prokázal, že DPP4-inhibitory jsou asociovány s nižším rizikem hypoglykemie ve srovnání s deriváty SU a exogenně podaným inzulinem. Nižší výskyt závažné hypoglykemie u DPP4-inhibitorů ve srovnání DSU u starších pacientů byl potvrzen i v dalších observačních studiích (21). Curkendall et al. v roce 2014
publikoval výsledky studie prokazující snížení rizika hypoglykemie u kombinované terapie saxagliptin + metformin oproti kombinaci glipizid + metformin (22), což odpovídá výsledkům příslušných klinických studií se saxagliptinem. Podobné výsledky byly publikovány i s vildagliptinem (Detournay et al., 2015), kde analýza velké skupiny pojištěnců francouzského zdravotního systému ukázala signifikantní redukci frekvence závažné hypoglykemie s nutností hospitalizace u pacientů léčených DPP4-inhibitory oproti DSU (23). Výsledky těchto dat se odrazily i v diabetologických doporučeních (konsenzus ADA/ EASD 2018), kde DPP4-inhibitory jsou z tohoto pohledu vedle agonistů receptoru pro GLP-1, SGLT2-inhibitorů a thiazolidindionů preferovanou skupinou antidiabetik. DPP4-inhibitory jsou dobře tolerovány, váhově neutrální a s minimálním rizikem hypoglykemie. V kombinaci s DSU však roste riziko hypoglykemie až o 50% (24,25). Konkrétní preparát je nutno volit s ohledem na renální funkce (15).Jedním ze zásadních problémů hypoglykemie u starší populace je, že zejména při opakování vede ke zhoršování kognitivních funkcí a tyto epizody hypoglykemie zvyšují riziko rozvoje demence u starších pacientů s T2DM (26). Např. němečtí autoři (Bramlage et al., 2012) analyzovali 3810 diabetiků s cílem dobré kompenzace diabetu 2. typu a z 10,7% výskytu hypoglykemie za 12 měsíců ve své studii pozorovali častější výskyt hypoglykemie u pacientů nad 70 let oproti mladším pacientům < 60 let, což dávají do asociace s přítomností dalších komorbidit jako srdečního selhání, deprese a užívání derivátů SU. Problémem těchto hypoglykemií bylo navíc to, že byly převážně asymptomatické (27). Výše uvedené komorbidity byly prevalentní i v našem souboru. Snižování pocitu vnímání hypoglykemie ve stáří popisuje i jiná německá práce (Bremen et al., 2012) (28). S ohledem na kognitivní funkce starších diabetiků si např. američtí autoři (Vimalananda et al., 2017) dali za cíl odhadnout potenciálně „přeléčené” pacienty na inzulinu či právě derivátech SU. Vstupními kritérii byl věk > 74 let, HbA1c < 7% dle DCCT (< 53 mmol/mol), dg. demence či kognitivní dysfunkce. Pomocí klinického dotazníku bylo vybráno 2 830 pacientů z řad amerických veteránů. Tento dotazník měl pomoci lékařům identifikovat pacienty, u nichž je potencionální riziko opakované hypoglykemie z důvodu jejich hypoglykemizující medikace, kterou následně ponížili nebo vysadili. Touto intervencí došlo k signifikantnímu poklesu počtu „rizikových“ pacientů po 6 a po 18 měsících a nabízí využití těchto dotazníků v běžné klinické praxi (29). V našem souboru bylo celkem 6 pacientů z různých důvodů odkázaných na celodenní pomoc druhé osoby, z toho 5 z nich užívalo DSU. Diagnóza demence byla známá u 7 pacientů (n = 32), 3 z těchto užívali DSU.
Také průzkum sledující výskyt hypoglykemie na emergentních odděleních řeckých zdravotnických zařízení u pacientů s diabetem mellitem 2. typu ukázal jako nejsilnější nezávislý prediktor těchto epizod užívání DSU (30). Obdobné výsledky vykazovala i studie německých autorů (Breuer et al., 2012), kde největší asociace hypoglykemie byla opět s DSU či inzulinem. V rámci terapie DSU však poukázala na spojitost častějšího výskytu pokročilé renální insuficience u starších pacientů (31). Nutno konstatovat, že sledované období bylo 8/2003 – 9/2007, a tedy před příchodem DPP4-inhibitorů do běžné klinické praxe.
Dále bylo opakovaně prokázáno, že hypoglykemie je u starších diabetiků spojena i se zvýšeným rizikem pádů a zlomenin (32), čímž výrazně ovlivňuje nejen kvalitu života.
Kromě těžkých hypoglykemií vedoucích k výše popsaným závažným komplikacím hrají roli v kvalitě života i lehké hypoglykemie, které u pacienta mohou vyvolávat pocity úzkosti a strachu z hypoglykemie a vedou ke zhoršení compliance, a to u pacientů s diabetem mellitem 1. i 2. typu (33).
Další významnou kapitolou zejména u starších pacientů s diabetem mellitem jsou časté akutní infekce. Pacienti jsou ohroženi nejen dekompenzací diabetu, ale i interakcí PAD s podávanou antibiotickou terapií (ATB). V roce 2016 byla publikována práce (Parekh, 2014) týkající se interakce derivátů SU a ATB u starších pacientů vedoucí ke zvýšenému riziku hypoglykemie. Nejvíce bylo zvýšené riziko hypoglykemie asociováno s clarithromycinem, levofloxacinem, sulfomethoxazole-trimethoprimem, metronidazolem a ciprofloxacinem (34). Tedy běžně užívanými antibiotiky. Z těchto výsledků rezultuje úvaha nad dočasným vysazením DSU při probíhajícím infekčním onemocnění s nechutenstvím. Akutní infekci při příjmu byla diagnostikována u našeho souboru (n = 32) u 11 pacientů (34 %), ATB před hospitalizací sice neužíval žádný z nich a ač by měla přítomnost infektu vést spíše k dekompenzaci diabetu mellitu ve smyslu hyperglykemie, přítomnost hypoglykemie zde přičítáme spíše podílu snížené nutrice u starších pacientů. Průměrný počet komorbidit byl v našem souboru 3,125 (n = 32), pro pacienty bez akutního infektu vycházelo v průměru 2,714 komorbidit, zatímco pro ty s akutní infekcí (n = 11) vychází průměrný počet komorbidit 3,909, průměrný věk těchto pacientů byl 75,5 (±6,4) let. Hypotéza o rozdílu v počtu komorbidit mezi skupinou bez akutní infekce a s infekcí, která byla ověřena pomocí neparametrického dvou-výběrového testu typu Mann-Whitney, se však neprokázala (p = 0,065).
Deriváty SU dále pro jejich úzký terapeutický index významně zvyšují riziko zejména těžké a prolongované hypoglykemie, což vede kromě neurologického poškození k arytmiím a akutnímu koronárnímu syndromu s rizikem smrti a to aktivací sympatického nervového systému. Vše je umocněno ještě terénem minerálové dysbalance a komorbiditami (35, 36), je mimo jiné spojeno s častější nutností hospitalizace a zvyšuje náklady na léčbu (37, 38). Negativní vliv hypoglykemie na myokard u pacientů s diabetem a preexistujícím srdečním onemocněním dokládá i zvýšené riziko komorové tachykardie a fibrilace komor během epizody hypoglykemie (39). V našem souboru mělo v anamnéze ischemickou chorobu srdeční 8 pacientů z 18 užívajících DSU oproti 4 pacientům ze 14 užívajících ostatní medikaci.
Dále je vhodné uvést, že v našem souboru nebyla dostačující velikost souboru dat k otestování případné asociace závislosti velikosti denní dávky jednotlivých DSU a tíže hypoglykemie, ale např. opět němečtí autoři (Holstein et al., 2010) ve své analýze na stotisícovém souboru starších pacientů s diabetem mellitem 2. typu (průměrný věk 77,5, ± 9,4 let) dokládají, že se hypoglykemie spojená s užíváním DSU objevovala bez ohledu na dávku a to v širokém rozmezí dávky (40).
Nejužívanějším parametrem k posouzení kompenzace diabetu je u pacientů s diabetem mellitem 2. typu stále hodnota glykovaného hemoglobinu (HbA1c), která však spíše zprůměruje v běžné rutině obtížně dosažitelné, ale prognosticky důležité ukazatele (time in range, time under a above range, variabilitu glykemií) a neodráží tedy ani benefit, ani příp. rizika intenzivní léčby diabetu, což dokládají např. dnes již notoricky známé výsledky studií ACCORD (41) a ADVANCE (42), kde došlo k signifikantnímu nárůstu těžkých hypoglykemií v intenzivně léčených větvích (cílový HbA1c < 6%, resp. 6,5 % dle DCCT, což odpovídá < 42,1, resp. 47,8 mmol/mol), spojených s vyšší kardiovaskulární mortalitou i celkovou mortalitou. Průměrná hodnota HbA1c u naší skupiny byla sice 57,1 mmol/mol, avšak nejnižší dokumentovaná hodnota byla 40 mmol/mol a to zrovna u 91 letého pacienta na terapii gliclazid 90 mg/den! Přitom dle doporučení u starší polymorbidní populace volíme individuálně cílový HbA1c okolo 60 mmol/mol a glykemie kolem 10 mmol/l. Toto dokládá i práce amerických autorů ((Duckworth et al., 2009), ve které ani intenzivní léčba u špatně kontrolovaných amerických veteránů (vstupní HbA1c > 7,5 %, resp. 58,5 mmol/mol) s již proběhlou kardiovaskulární příhodou nevedla signifikantně ke snížení počtu nových kardiovaskulárních příhod, smrti či mikrovaskulárních komplikací a to ani za cenu vyššího výskytu hypoglykemií oproti kontrolní skupině (43). V neposlední řadě je nutno vzít v úvahu i vliv ostatní medikace. Například betablokátory v rámci léčby srdečního selhání (a to jak se systolickou, tak diastolickou dysfunkcí se zachovalou ejekční frakcí levé komory), které se u pacientů s diabetem často vyskytuje, tlumí svým účinkem důležité projevy provázející hypoglykemii a pacient si ji ani nemusí uvědomovat (44).
Jedním z nejdůležitěších aspektů u DSU je zvýšené riziko hypoglykemie při přítomnosti chronické renální insuficience. Ta je celosvětově nejčastěji způsobena právě diabetem mellitem a je považována za významný rizikový faktor hypoglykemie obecně (tedy i u nediabetiků), avšak přítomnost diabetu mellitu (a tedy i volba medikace) signifikantně zvyšuje toto riziko se všemi důsledky (45). V našem souboru (n = 32) mělo renální insuficienci stadia 3 a horší 27 pacientů. Mezi pacienty užívající DSU to bylo 16 z 18, což považujeme za jeden z nejdůležitějších faktorů výskytu hypoglykemie u těchto pacientů.
Dle SPC by měla být u glimepiridu redukována dávka při zhoršení renálních funkcí, při závažné poruše renálních funkcí, za což považujeme renální selhání 4. a 5. stupně, by měl být vysazen. Toto bylo u našeho souboru (n = 12) splněno. Ani dávka gliclazidu (n = 3) a gliquidonu (n = 3) nebyla podána mimo doporučení SPC s ohledem na renální funkce. Přesto se tyto preparáty dle našeho předpokladu na hypoglykemii podílely.
S ohledem na výše uvedené je až s podivem, že ačkoliv u nás spotřeba derivátů SU každoročně klesá i přes nárůst počtu diabetiků (dle Ústavu zdravotnických informací a statistiky užívalo deriváty SU v ČR v roce 2011 196 681 pacientů, v roce 2015 177 845 pacientů a v roce 2017 157 079 pacientů (16, 46, 47)), stále užívá v České republice téměř 20 % (19,64 %) pacientů s diabetem mellitem 2. typu tuto rizikovou medikaci.
Pro úplnost zmiňme ještě jeden aspekt DSU. Průměrná hodnota BMI byla v rámci celkého souboru 29,4 (±6,02) kg/m2 a to i u pacientů užívajících DSU (n = 18) 29,4 (±6,17) kg/m2, při čemž je známo, že DSU nejen, že nejsou hmotnostně neutrální, ale dokonce váhu ještě zvyšují.
Mezi nevýhody studie patří zejména malý rozsah sledované skupiny. Malý soubor pacientů může být důvodem statisticky nesignifikantních výsledků provedených testů při ověřování jednotlivých hypotéz. Další možné úskalí spatřujeme metodologicky v tom, že část pacientů byla možná vyřešena v rámci pracoviště Emergency a k hospitalizaci nedošlo, dále pak v nedůslednosti při vykazování DRG kódu E16.x., dále pak, že nebyly dostupné podrobnější údaje z ambulantního sledování. Nebylo naší snahou podat vyčerpávající výčet prací na toto téma charakteru přehledových článků. S ohledem na rozsah článku jsme se rozsáhleji nevyjadřovali k dostupným možnostem terapie v uvedeném období (nové léky ze skupiny GLP-1 RA, SGLT2i, degludec).
Závěr
Epizody hypoglykemie, i opakované, jsou zejména pro starší pacienty s T2DM z výše popsaných důvodů velmi nebezpečné. Pacienty jednak ohrožují akutně na životě (málo substrátu pro mozek, srdeční arytmie), dále vedou k rozvoji diabetické encefalopatie se zhoršováním kognitivních funkcí a rozvojem demence. Z pohledu pacienta pak vyvolává jejich riziko anxietu, nonadherenci k terapii a paradoxně tedy akceleraci chronických komplikací diabetu při nedostatečné kompenzaci. Zejména u starších a polymorbidních pacientů (srdeční selhání, porucha vnímání hypoglykemie, neuropatie, porucha kognitivních funkcí) s častou současnou přítomností chronické renální insuficience však musíme mít při volbě antidiabetické medikace stále na mysli nejen potenciální přínos, ale i možná rizika zvolené terapie. Z tohoto pohledu se jeví deriváty SU jako preparáty nevhodné. Komplexním mechanismem snižují kvalitu života a o tu by mělo jít u starých křehkých seniorů především.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Jakub Svěcený
Krajská zdravotní, a. s. – Masarykova nemocnice v Ústí nad Labem, o. z. Sociální péče 3 316/12A,
400 11 Ústí nad Labem
Cit. zkr: Vnitř Lék 2020; 66(6): e35–e42
Článek přijat redakcí: 13. 1. 2020
Článek přijat po recenzích k publikaci: 2. 6. 2020
Zdroje
1. Agiostratidou G, Anhalt H, Ball D, Blonde L, Gourgari E, Harriman KN, Kowalski AJ, Madden P, McAuliffe-Fogarty AH, McElwee-Malloy M, Peters A, Raman S, Reifschneider K, Rubin K, Weinzimer SA. Standardizing Clinically Meaningful Outcome Measures Beyond HbA1c for Type 1 Diabetes: A Consensus Report of the American Association of Clinical Endocrinologists, the American Association of Diabetes Educators, the American Diabetes Association, the Endocrine Society, JDRF International, The Leona M. and Harry B. Helmsley Charitable Trust, the Pediatric Endocrine Society, and the T1D Exchange. Diabetes Care. 2017 Dec;40(12):1622-1630. doi: 10.2337/dc17-1624. Review. PubMed PMID: 29162582; PubMed Central PMCID: PMC5864122.
2. Minimizing Hypoglycemia in Diabetes. Diabetes Care. 2015; 38(8): 1583–1591. doi: 10.2337/dc15-0279.
3. Wright AD, Cull CA, Macleod KM, Holman RR. Hypoglycemia in Type 2 diabetic patients randomized to and maintained on monotherapy with diet, sulfonylurea, metformin, or insulin for 6 years from diagnosis: UKPDS73. J Diabetes Complications. 2006; 20(6): 395 – 401. doi: 10.1016/j.jdiacomp.2005.08.010.
4. Quilliam BJ, Simeone JC, Ozbay AB. Risk factors for hypoglycemia-related hospitalization in patients with type 2 diabetes: a nested case-control study. Clin Ther. 2011; 33(11): 1781–1791. doi: 10.1016/j.clinthera.2011.09.020.
5. Misra-Hebert AD, Pantalone KM, Ji X, Milinovich A, Dey T, Chagin KM, Bauman JM, Kattan MW, Zimmerman RS. Patient Characteristics Associated With Severe Hypoglycemia in a Type 2 Diabetes Cohort in a Large, Integrated Health Care System From 2006 to 2015. Diabetes Care. 2018; 41(6): 1164–1171. doi: 10.2337/dc17-1834.
6. Davis TM, Brown SG, Jacobs IG, Bulsara M, Bruce DG, Davis WA. Determinants of severe hypoglycemia complicating type 2 diabetes: the Fremantle diabetes study. J Clin Endocrinol Metab. 2010; 95(5): 2240–2247. doi: 10.1210/jc.2009-2828.
7. McCoy RG, Van Houten HK, Ziegenfuss JY, Shah ND, Wermers RA, Smith SA. Increased mortality of patients with diabetes reporting severe hypoglycemia. Diabetes Care. 2012; 35(9): 1897–1901. doi: 10.2337/dc11-2054.
8. Hemmingsen B, Lund SS, Gluud C, Vaag A, Almdal T, Hemmingsen C, Wetterslev J. Intensive glycaemic control for patients with type 2 diabetes: systematic review with meta-analysis and trial sequential analysis of randomised clinical trials. BMJ. 2011; 343: d6898. doi: 10.1136/bmj.d6898.
9. Bolek T, Samoš M, Mokáň M, et al. Akútne príčiny náhlých úmrtí u pacientov so závažnou hypoglykemiou. Vnitř Lék 2016; 62(6): 462–466. https://www.prolekare.cz/casopisy/ vnitrni-lekarstvi/2016-6/akutne-priciny-nahlych-umrti-u-pacientov-so-zavaznou-hypoglykemiou-58811
10. Svačina Š, Jurašková B, Karen I, et al. Doporučené postupy v léčbě starších pacientů s diabetes mellitus v ČR. DMEV 2013; 2 : 82–92.
11. Hirst JA, Farmer AJ, Dyar A, Lung TW, Stevens RJ. Estimating the effect of sulfonylurea on HbA1c in diabetes: a systematic review and meta-analysis. Diabetologia. 2013; 56(5): 973–984. doi: 10.1007/s00125-013-2856-6.
12. Standards of medical Care in Diabetes“ Introduction. Diabetes Care. 2011, 34. (Suppl 1): S1–2., doi: 10.2337/dc11-S001.
13. Standards of mediacal care in diabetes--2015. Diabetes Care. 2015 Jan;38 Suppl:S1-2. doi: 10.2337/dc15-S001.
14. Buse JB, Wexler DJ, Tsapas A, Rossing P, Mingrone G, Mathieu C, D‘Alessio DA, Davies MJ. 2019 Update to: Management of Hyperglycemia in Type 2 Diabetes, 2018. A Consensus Report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2020; 43(2): 487–493. doi: 10.2337/dci19-0066.
15. Davies MJ, D‘Alessio DA, Fradkin J, Kernan WN, Mathieu C, Mingrone G, Rossing P, Tsapas A, Wexler DJ, Buse JB. Management of hyperglycaemia in type 2 diabetes, 2018. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia. 2018 Dec;61(12):2461-2498. doi: 10.1007/s00125-018-4729-5.
16. Ústav zdravotnických informací a statistiky ČR. (2019). Zdravotnická ročenka České republiky 2017. Retrieved November 5, 2019, from http://www.uzis.cz/katalog/rocenky/zdravotnicka-rocenka-ceske-republiky-1961-az-2013.
17. Kitten AK, Kamath M, Ryan L, Reveles KR. National ambulatory care non-insulin antidiabetic medication prescribing trends in the United States from 2009 to 2015. PLoS One. 2019; 14(8): e0221174. doi: 10.1371/journal.pone.0221174.
18. Khunti K, Chatterjee S, Gerstein HC, Zoungas S, Davies MJ. Do sulphonylureas still have a place in clinical practice?. Lancet Diabetes Endocrinol. 2018 Oct;6(10):821-832. doi: 10.1016/S2213-8587(18)30025-1.
19. Chan SP, Colagiuri S. Systematic review and meta-analysis of the efficacy and hypoglycemic safety of gliclazide versus other insulinotropic agents. Diabetes Res Clin Pract. 2015; 110(1): 75–81. doi: 10.1016/j.diabres.2015.07.002.
20. Ahrén B. Are sulfonylureas less desirable than DPP-4 inhibitors as add-on to metformin in the treatment of type 2 diabetes?. Curr Diab Rep. 2011; 11(2): 83–90. doi: 10.1007/ s11892-011-0179-x.
21. Penfornis A, Bourdel-Marchasson I, Quere S, Dejager S. Real-life comparison of DPP4-inhibitors with conventional oral antidiabetics as add-on therapy to metformin in elderly patients with type 2 diabetes: the HYPOCRAS study. Diabetes Metab. 2012; 38(6): 550–557. doi: 10.1016/j.diabet.2012.08.003.
22. Curkendall SM, Zhang B, Lenhart G, Thomson E, Bell KF. Rate of hypoglycemia in patients with type 2 diabetes receiving metformin plus saxagliptin versus metformin plus sulfonylurea: a retrospective observational cohort study using administrative claims data. Expert Rev Endocrinol Metab. 2014; 9(2): 183–191. doi: 10.1586/17446651.2014.870471.
23. Detournay B, Halimi S, Robert J, Deschaseaux C, Dejager S. Hypoglycemia hospitalization frequency in patients with type 2 diabetes mellitus: a comparison of dipeptidyl peptidase 4 inhibitors and insulin secretagogues using the French health insurance database. Vasc Health Risk Manag. 2015; 11 : 417–425. doi: 10.2147/VHRM.S84507.
24. Wu S, Chai S, Yang J, Cai T, Xu Y, Yang Z, Zhang Y, Ji L, Sun F, Zhan S. Gastrointestinal Adverse Events of Dipeptidyl Peptidase 4 Inhibitors in Type 2 Diabetes: A Systematic Review and Network Meta-analysis. Clin Ther. 2017 Sep;39(9):1780-1789.e33. doi: 10.1016/j. clinthera.2017.07.036.
25. Salvo F, Moore N, Arnaud M, Robinson P, Raschi E, De Ponti F, Bégaud B, Pariente A. Addition of dipeptidyl peptidase-4 inhibitors to sulphonylureas and risk of hypoglycaemia: systematic review and meta-analysis. BMJ. 2016; 353: i2231. doi: 10.1136/bmj.i2231.
26. Whitmer RA, Karter AJ, Yaffe K, Quesenberry CP Jr, Selby JV. Hypoglycemic episodes and risk of dementia in older patients with type 2 diabetes mellitus. JAMA. 2009; 301(15): 1565–1572. doi: 10.1001/jama.2009.460.
27. Bramlage P, Gitt AK, Binz C, Krekler M, Deeg E, Tschöpe D. Oral antidiabetic treatment in type-2 diabetes in the elderly: balancing the need for glucose control and the risk of hypoglycemia. Cardiovasc Diabetol. 2012; 11 : 122. doi: 10.1186/1475-2840-11-122.
28. Bremer JP, Jauch-Chara K, Hallschmid M, Schmid S, Schultes B. Hypoglycemia unawareness in older compared with middle-aged patients with type 2 diabetes. Diabetes Care. 2009; 32(8): 1513–1517. doi: 10.2337/dc09-0114.
29. Vimalananda VG, DeSotto K, Chen T, Mullakary J, Schlosser J, Archambeault C, Peck J, Cassidy H, Conlin PR, Evans S, McConnell M, Shirley E. A Quality Improvement Program to Reduce Potential Overtreatment of Diabetes Among Veterans at High Risk of Hypoglycemia. Diabetes Spectr. 2017; 30(3): 211–216. doi: 10.2337/ds16-0006.
30. Liatis S, Mylona M, Kalopita S, Papazafiropoulou A, Karamagkiolis S, Melidonis A, Xilomenos A, Ioannidis I, Kaltsas G, Lanaras L, Papas S, Basagiannis C, Kokkinos A. Hypoglycaemia requiring medical assistance in patients with diabetes: a prospective multicentre survey in tertiary hospitals. Diabetes Metab. 2015; 41(2): 126–131. doi: 10.1016/j. diabet.2014.10.006.
31. Breuer HW, Ptak P. (Hypoglycemia – frequency, causes, induced costs). Dtsch Med Wochenschr. 2012; 137(19): 988–992. doi: 10.1055/s-0031-1299014.
32. Nelson JM, Dufraux K, Cook PF. The relationship between glycemic control and falls in older adults. J Am Geriatr Soc. 2007; 55(12): 2041–2044. doi: 10.1111/j.1532-5415.2007.01430.x.
33. Fulcher G, Singer J, Castañeda R, Fraige Filho F, Maffei L, Snyman J, Brod M. The psychosocial and financial impact of non-severe hypoglycemic events on people with diabetes: two international surveys. J Med Econ. 2014; 17(10): 751–761. doi: 10.3111/13696998.2014.946992.
34. Parekh TM, Raji M, Lin YL, Tan A, Kuo YF, Goodwin JS. Hypoglycemia after antimicrobial drug prescription for older patients using sulfonylureas. JAMA Intern Med. 2014; 174(10): 1605–1612. doi: 10.1001/jamainternmed.2014.3293.
35. Clayton D, Woo V, Yale JF. Hypoglycemia. Can J Diabetes. 2013; 37 Suppl 1: S69–71. doi: 10.1016/j.jcjd.2013.01.022.
36. Stahn A, Pistrosch F, Ganz X, Teige M, Koehler C, Bornstein S, Hanefeld M. Relationship between hypoglycemic episodes and ventricular arrhythmias in patients with type 2 diabetes and cardiovascular diseases: silent hypoglycemias and silent arrhythmias. Diabetes Care. 2014; 37(2): 516–520. doi: 10.2337/dc13-0600.
37. Bron M, Marynchenko M, Yang H, Yu AP, Wu EQ. Hypoglycemia, treatment discontinuation, and costs in patients with type 2 diabetes mellitus on oral antidiabetic drugs. Postgrad Med. 2012; 124(1): 124–132. doi: 10.3810/pgm.2012.01.2525.
38. Majumdar SR, Hemmelgarn BR, Lin M, McBrien K, Manns BJ, Tonelli M. Hypoglycemia associated with hospitalization and adverse events in older people: population-based cohort study. Diabetes Care. 2013; 36(11): 3585–3590. doi: 10.2337/dc13-0523.
39. Nordin C. The case for hypoglycaemia as a proarrhythmic event: basic and clinical evidence. Diabetologia. 2010; 53(8): 1552–1561. doi: 10.1007/s00125-010-1752-6.
40. Holstein A, Hammer C, Hahn M, Kulamadayil NS, Kovacs P. Severe sulfonylurea-induced hypoglycemia: a problem of uncritical prescription and deficiencies of diabetes care in geriatric patients. Expert Opin Drug Saf. 2010; 9(5): 675–681. doi: 10.1517/14740338.2010.492777.
41. Gerstein HC, Miller ME, Byington RP, Goff DC Jr, Bigger JT, Buse JB, Cushman WC, Genuth S, Ismail-Beigi F, Grimm RH Jr, Probstfield JL, Simons-Morton DG, Friedewald WT. Effects of intensive glucose lowering in type 2 diabetes. N Engl J Med. 2008; 358(24): 2545–2559. doi: 10.1056/NEJMoa0802743.
42. Patel A, MacMahon S, Chalmers J, Neal B, Billot L, Woodward M, Marre M, Cooper M, Glasziou P, Grobbee D, Hamet P, Harrap S, Heller S, Liu L, Mancia G, Mogensen CE, Pan C, Poulter N, Rodgers A, Williams B, Bompoint S, de Galan BE, Joshi R, Travert F. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. N Engl J Med. 2008; 358(24): 2560–2572. doi: 10.1056/NEJMoa0802987.
43. Duckworth W, Abraira C, Moritz T, Reda D, Emanuele N, Reaven PD, Zieve FJ, Marks J, Davis SN, Hayward R, Warren SR, Goldman S, McCarren M, Vitek ME, Henderson WG, Huang GD. Glucose control and vascular complications in veterans with type 2 diabetes. N Engl J Med. 2009; 360(2): 129–139. doi: 10.1056/NEJMoa0808431.
44. Elliott WJ, Meyer PM. Incident diabetes in clinical trials of antihypertensive drugs: a network meta-analysis. Lancet. 2007; 369(9557): 201–207. doi: 10.1016/S01406736(07)60108-1.
45. Moen MF, Zhan M, Hsu VD, Walker LD, Einhorn LM, Seliger SL, Fink JC. Frequency of hypoglycemia and its significance in chronic kidney disease. Clin J Am Soc Nephrol. 2009; 4(6): 1121–1127. doi: 10.2215/CJN.00800209.
46. Ústav zdravotnických informací a statistiky ČR. (2019). Zdravotnická ročenka České republiky 2011. Retrieved November 5, 2019, from http://www.uzis.cz/katalog/rocenky/zdravotnicka-rocenka-ceske-republiky-1961-az-2013.
47. Ústav zdravotnických informací a statistiky ČR. (2019). Zdravotnická ročenka České republiky 2015. Retrieved November 5, 2019, from http://www.uzis.cz/katalog/rocenky/ zdravotnicka-rocenka-ceske-republiky-1961-az-2013.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2020 Číslo 6- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Alergie a imunopatologie – hlavní téma
- Anafylaxe – akutní a dlouhodobý management
- Potravinová alergie a intolerance
- Poruchy v komplementovém systému
- Imunosenescence – západ slunce nad imunitním systémem
- Chřipka a její komplikace
- Familiární plicní fibróza – doporučení pro diagnostiku a léčbu
- Nové dělení krystalopatií z pohledu nefrologa
- Infarkt myokardu nebo syndrom zlomeného srdce?
- Dieulafoy lézia jejuna ako zdroj život ohrozujúceho krvácania
- Co nového internistům přinášejí doporučené postupy pro diagnostiku a léčbu plicní embolie z roku 2019?
- Perkutánní okluze ouška levé síně
- Současné postavení dietních opatření u pacientů s pokročilým stupněm chronického onemocnění ledvin
- Dysfunkčný dialyzačný cievny prístup a jeho endovaskulárna liečba
- Histiocytózy a neoplazie odvozené od makrofágů a dendritických buněk. Srovnání WHO klasifikace z roku 2017 a klasifikace Histiocyte society z roku 2016
- Glykovaný hemoglobín ako marker zvýšenia LDL a TAG – kohortná štúdia
- Deriváty sulfonylurey a riziko hypoglykemie u diabetiků 2. typu
- Endoskopická diagnostika a terapie pankreatobiliárních onemocnění u osob po resekci žaludku podle Billrotha I
- Nozokomiální methemoglobinemie
- Postihnutie tráviaceho traktu pri zmiešanej chorobe spojivového tkaniva (Sharpovom syndróme)
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Infarkt myokardu nebo syndrom zlomeného srdce?
- Postihnutie tráviaceho traktu pri zmiešanej chorobe spojivového tkaniva (Sharpovom syndróme)
- Potravinová alergie a intolerance
- Poruchy v komplementovém systému
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



