-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Biomarkery pro neendoskopické vyšetření sliznice jícnu
Biomarkers for non-endoscopic examination of esophageal mucosa
Gastroesophageal reflux disease (GERD) is a multifactorial disease; an individual´s genetic predisposition may contribute to the development of this disorder. Endoscopic methods and histological examination are commonly used to diagnose GERD and its complications such as Barrett’s esophagus (BE) and esophageal adenocarcinoma (EAC). For BE screening in high-risk individuals as well as monitoring the development of BE dysplasia, esophageal mucosa samples could be taken using modern non-endoscopic procedures to minimize invasiveness of the procedure and improve patient adherence and compliance with a treatment. Esophageal mucosa samples taken by non-endoscopic or endoscopic biopsy can be analyzed both by immunohistochemistry and molecular biology analysis for specific biomarkers. Markers such as caudal type homeobox 2 (CDX2) and protein p53 have found their use in GERD diagnosis, and therefore research in recent years has focused on identifying other biomarkers that could reliably predict the development and progression of BE or EAC. This review article summarizes information on modern non-endoscopic methods of sampling from the esophagus mucosa and biomarkers, which have been studied in connection with the prediction and diagnosis of BE and EAC and have a potential for the use in clinical practice.
Keywords:
Barrett’s esophagus – esophageal adenocarcinoma – biomarkers – CytospongeTM – EsoCheck – EsophaCapsTM – miRNA – protein p53
Autori: Tereza Deissová 1,2; Zdeněk Kala 3; Ondřej Slabý 2; Jiří Dolina 4; Radek Kroupa 4; Lumír Kunovský 3,4; Lydie Izakovičová Hollá 1,5; Petra Bořilová Linhartová 1,5,6,7
Pôsobisko autorov: Ústav patologické fyziologie LF MU Brno 1; CEITEC MU Brno 2; Chirurgická klinika LF MU a FN Brno, pracoviště Bohunice 3; Interní gastroenterologická klinika LF MU a FN Brno, pracoviště Bohunice 4; Stomatologická klinika LF MU a FN u sv. Anny v Brně 5; Klinika ústní, čelistní a obličejové chirurgie LF MU a FN Brno, pracoviště Bohunice 6; Ústav lékařské genetiky LF MU Brno 7
Vyšlo v časopise: Vnitř Lék 2020; 66(7): 13-19
Kategória:
Súhrn
Refluxní choroba jícnu (gastroesophageal reflux disease – GERD) je multifaktoriální onemocnění, na kterém se mimo jiné podílí i genetická predispozice jedince. Při diagnostice GERD a jejich komplikací, jako je Barrettův jícen (Barrett‘s esophagus – BE) a adenokarcinom jícnu (esophageal adenocarcinoma – EAC), jsou standardně využívány endoskopické metody a histologické vyšetření. Pro screening BE u osob se zvýšeným rizikem vzniku tohoto onemocnění i při sledování rozvoje dysplazie BE by vzorky jícnové sliznice mohly být odebrány pomocí novodobých neendoskopických postupů, kterými lze minimalizovat invazivnost zákroku a zlepšit compliance a adherenci pacientů k léčbě. Neendoskopicky odebraný vzorek sliznice jícnu je možné stejně jako vzorek získaný endoskopickou biopsií analyzovat jak imunohistochemickým vyšetřením, tak provést molekulárně biologickou analýzu na specifické biomarkery. Markery jako caudal type homeobox 2 (CDX2) a protein p53 již našly své uplatnění v diagnostice GERD, a proto se výzkum v posledních letech zaměřuje na identifikaci dalších biomarkerů, pomocí kterých by bylo možné spolehlivě predikovat vznik a rozvoj BE nebo EAC. Tento přehledový článek shrnuje informace o moderních neendoskopických metodách odběru vzorků sliznice jícnu a o biomarkerech, které byly v souvislosti s predikcí a diagnostikou BE a EAC studovány v neendoskopicky odebrané tkáni a mají potenciál pro využití v klinické praxi.
Klíčová slova:
Barrettův jícen – adenokarcinom jícnu – biomarkery – CytospongeTM – EsoCheck – EsophaCapsTM – miRNA – protein p53
Úvod
Barrettův jícen (Barrett‘s esophagus – BE) vznikající v důsledku chronické refluxní choroby jícnu (gastroesophageal reflux disease – GERD) je stav, při kterém dochází v distální části jícnu k transformaci dlaždicového buněčného epitelu na cylindrický epitel s intestinální metaplazií. Onemocnění je standardně diagnostikováno na základě endoskopického vyšetření, bioptického odběru tkáně jícnu a nálezu metaplastického epitelu intestinálního typu při histologickém vyšetření (1).
BE bývá náhodně zachycen u přibližně 1,2–25% osob se zcela chybějícími refluxními symptomy (s tzv. tichou GERD) (2). Přibližně 40% pacientů s adenokarcinomem jícnu (esophageal adenocarcinoma – EAC) nemá v předchozí anamnéze nález symptomů GERD (1). Na základě přítomnosti nebo nepřítomnosti BE lze charakterizovat 2 typy EAC, u téměř poloviny pacientů se EAC nevyskytuje v terénu intestinální metaplazie (3). Celopopulační screening, tak jak ho známe např. u kolorektálního karcinomu, by byl s ohledem na náklady a nízkou míru prevalence BE neefektivní. Avšak mohl by najít své uplatnění u jedinců s rizikovými faktory, mezi které patří: věk nad 50 let, mužské pohlaví, bílá rasa, intraabdominální obezita, chronické GERD symptomy, ale také pozitivní rodinná anamnéza BE nebo EAC u příbuzných prvního stupně (1, 4). Pacienti, kteří podstoupili jak endoskopii, tak neendoskopické vyšetření, uvedli, že vyšetření neendoskopickými metodami je rychlejší a komfortnější, což by mohlo přispět ke zlepšení compliance a adherence k léčbě u těch pacientů, kteří z endoskopického vyšetření mají obavy (5).
Včasné zachycení pacientů s dysplastickými a neoplastickými změnami je klíčové pro možnost jejich kurativního řešení (4). U pacientů s BE bez dysplastických změn (NDBE – non-dysplastic Barrett‘s esophagus) je endoskopie indikována jednou za 3–5 let, u dysplastických nálezů BE se intervaly zkracují (6), nicméně EAC se vyvine během sledování asi u 0,2–0,5% pacientů s NDBE za rok (7).
Přestože standardní endoskopie a biopsie zůstávají nejdůležitějším nástrojem pro hodnocení onemocnění slizničních změn v jícnu, při screeningu BE by mohly být nahrazeny jednoduchými neendoskopickými metodami odběru vzorku, které mají lepší toleranci, a které lze provádět v prostředí primární péče a při nižších časových nákladech. Stejně jako endoskopicky odebraná tkáň i tyto neendoskopicky získané vzorky mohou být analyzovány pomocí histologické a imunohistochemické (IHC) diagnostiky a molekulárně biologickými metodami (8, 9). Ačkoliv je endoskopický přístup při odběru vzorků vhodnější pro následnou histologickou analýzu (především cytologickou), tak u neendoskopických metod odběru vzorku je možnou předností to, že stěr obsahuje buňky z celé cirkumference distálního jícnu, čímž se šance na zjištění intestinální metaplazie zvyšuje.
Neendoskopické metody odběru vzorků sliznice jícnu
K neendoskopickému získání vzorku sliznice jícnu může být využit EsophaCapsTM (Capnostics LLC; Doylestown PA) nebo podobný systém CytospongeTM (Medtronic GI Solutions) (10). V obou případech se jedná o malou houbičku uzavřenou v želatinové kapsli s navázaným vláknem (Obr. 1). Pacient si vloží kapsli do úst a spolkne ji při zapití vodou, přitom vlákno volně drží v ruce. Po 5 minutách se želatinová kapsle v žaludku rozpustí a uvolní se kulovitá polyuretanová houbička o průměru 3 cm. Pacientovi je pomocí spreje aplikováno lokální anestetikum (např. 1% lidokain) do dutiny ústní a následně je houbička pomocí vlákna vytažena. Po odběru je vlákno od houbičky odděleno a houbička s přilnutými povrchovými buňkami jícnu je umístěna do konzervační tekutiny (CytoLyt) pro následné zpracování. Pro cytopatologické a IHC vyšetření je třeba buněčnou suspenzi centrifugovat, buněčný pelet zafixovat resuspendací ve formalinu, opět centrifugovat a převést jej do parafinu. Parafinový bloček je následně nařezán, přenesen na sklíčko a nabarven standardním postupem hematoxylin-eozinem, nebo je zpracován pro IHC detekci vybraných proteinů (11). K detekci genetických biomarkerů pomocí molekulárně biologických přístupů (PCR nebo sekvenování nové generace – next generation sequencing – NGS) je třeba ze suspenze buněk izolovat RNA nebo DNA, a tu analyzovat (12, 13).
Obr. 1. EsophaCapTM s uzavřenou houbičkou (A), s extrahovanou houbičkou (B) (11), CytospongeTM (C) (10) 
Další alternativu představuje EsoCheck (PAVmed Inc), který na rozdíl od předchozích dvou metod disponuje malým nafukovacím balonkem s hrubým povrchem a 68 cm dlouhým katétrem, díky kterému může být balonek v žaludku nafouknut a opětovně vyfouknut asi 5 cm proximálně od gastroezofageální junkce, což výrazně snižuje riziko kontaminace vzorku během vyjmutí aparátu (Obr. 2) (14).
Obr. 2. EsoCheck je spolknut (1), balónek je v žaludku nafouknut (2), pomocí orientačních značek na katetru je EsoCheck vytažen asi 5 cm proximálně od gastroezofageální junkce (3), balónek je vyfouknut pro zabránění kontaminace a vyjmut (4) (14) 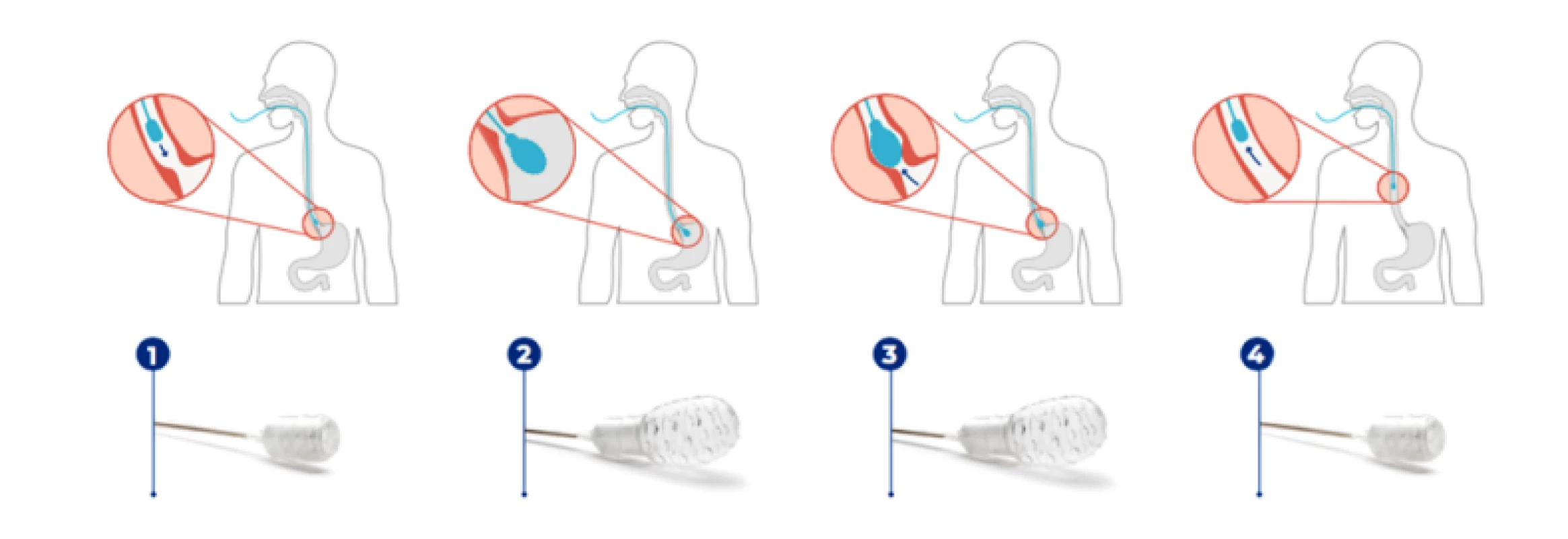
Tyto neendoskopické postupy odběru jícnové tkáně jsou kontraindikovány u pacientů s dysfagií, poruchami polykání, známými anatomickými abnormalitami jícnu a u pacientů užívajících antikoagulancia (10).
Slizniční (tkáňové) biomarkery pro Barrettův jícen
Analýzou vhodných biomarkerů ve sliznici jícnu je možné predikovat vznik a rozvoj BE i EAC. Pojmem biomarker v souvislosti s tímto kontextem rozumíme indikátor, u kterého sledujeme jeho:
i) genové alterace (mutace),
ii) epigenetické modifikace (metylace, acetylace),
iii) genovou expresi mediátorové RNA (mRNA) i mikroRNA (miRNA) a/nebo iv) detekujeme protein nebo peptid ve tkáni.
K analýze genových alterací, epigenetických modifikací a exprese genů je využíváno molekulárně biologických přístupů, jejichž výhodami jsou automatizace pro zpracování velkého počtu vzorků a objektivita, neboť metody obchází subjektivní hodnocení při IHC využívané při detekci proteinových biomarkerů (Obr. 3) (15, 16).
Obr. 3. Vyšetření biomarkerů ve vzorku jícnové sliznice získaných neendoskopickou metodou (vytvořeno pomocí programu BioRender.com) 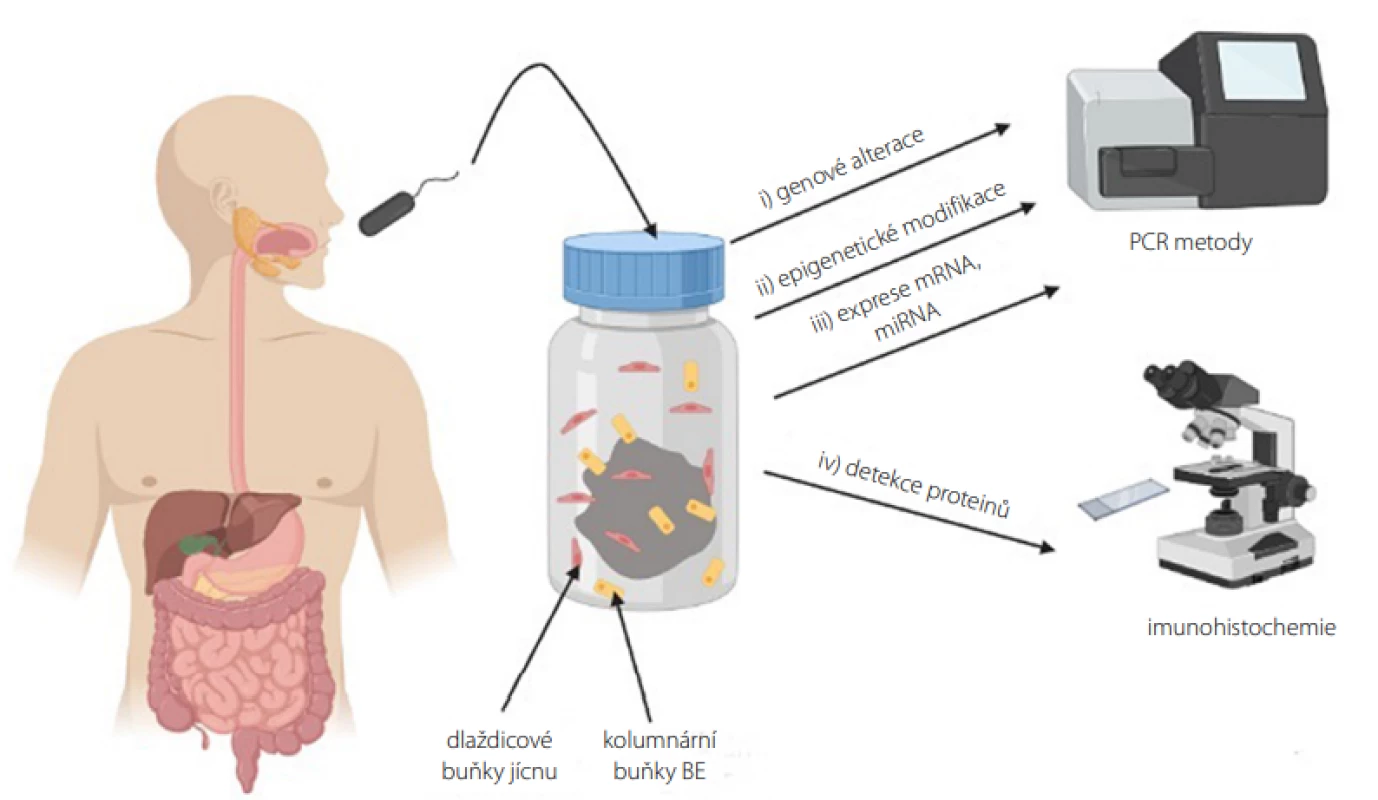
Genetické biomarkery v kombinaci s neendoskopickými metodami
Protein p53 je transkripční faktor, který reguluje buněčný cyklus při poškození DNA. Inaktivující mutace v genu pro p53 (TP53) vznikající v průběhu neoplazie vedou buď k úplné ztrátě proteinu p53, nebo ke zvýšené expresi genu TP53 (Obr. 4) (17). Pro detekci mutací ve struktuře genu pro tento nádorový supresor lze využít techniky založené na PCR i NGS. Genetické změny typické pro nádorové buňky mohou být užitečným prognostickým markerem, slouží k hodnocení „low“ a „high grade“ dysplazií (LGD a HGD). Mutační analýzu genu TP53 zprostředkovává např. Oddělení lékařské genetiky FN Brno (18).
Obr. 4. Genetické a epigenetické markery pro BE v kombinaci s neendoskopickým odběrem vzorků sliznice jícnu (vytvořeno pomocí programu BioRender.com) 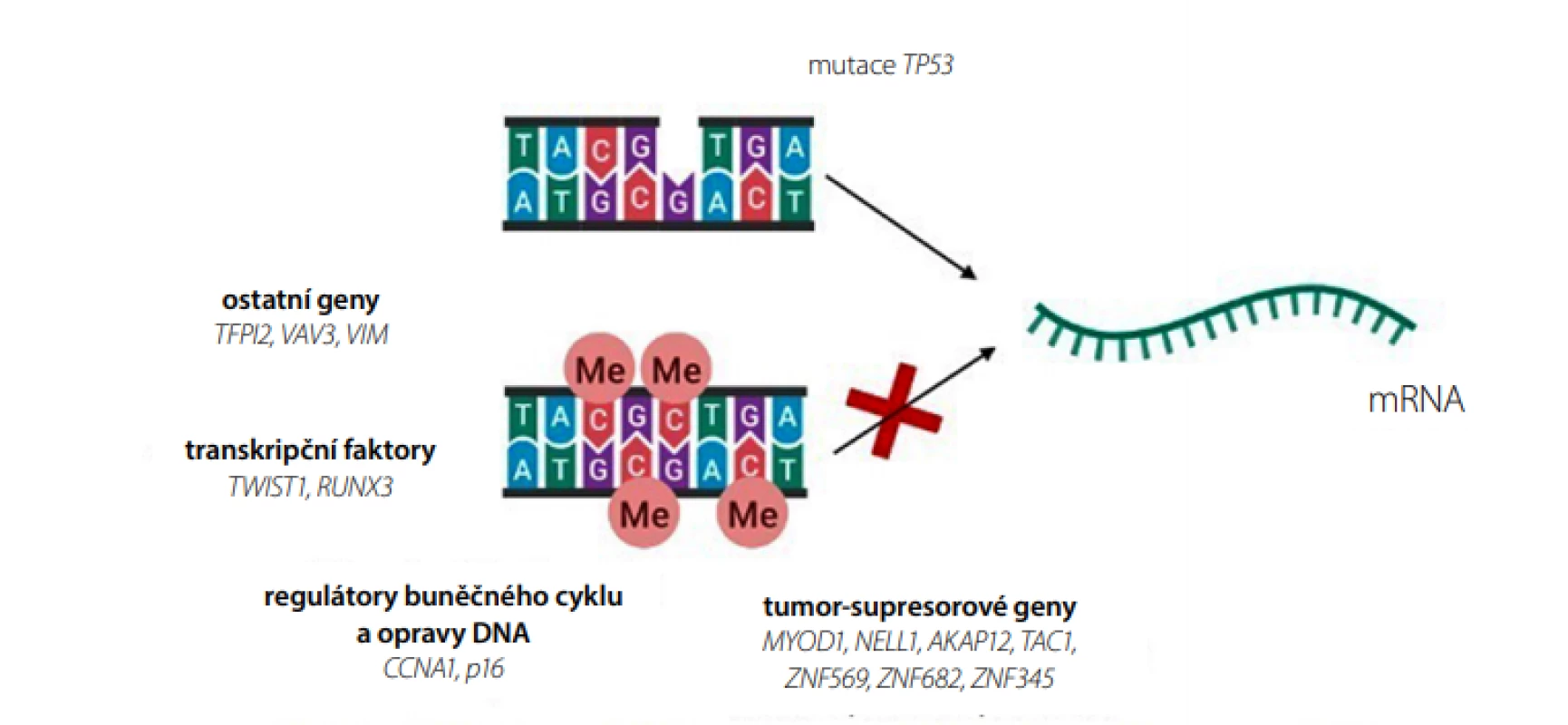
Epigenetické biomarkery v kombinaci s neendoskopickými metodami
Epigenetické alterace sice nezasahují do primární sekvence molekuly DNA, nicméně mohou významně ovlivňovat genovou expresi a v konečném důsledku i koncentraci proteinu, který kódují (Obr. 4) (16).
K identifikaci hypermetylovaných genů lze využít systém Illumina 27k array, díky kterému jsme schopni kvantifikovat úroveň metylace ve specifických lokusech genomu (19), nebo lze sekvenovat celý metylom (20). Výsledky získané sekvenováním DNA ze zdravé dlaždicové tkáně jícnu jsou následně porovnávány se vzorky BE (19). Tímto způsobem byly analyzovány metylace genů pro faktor výměny guanidinových nukleotidů (VAV3), transkripční faktor Twist-related protein 1 (TWIST1), regulátor buněčného cyklu cyklin A1 (CCNA1) a vimentin (VIM) a shledány jako vhodné biomarkery pro BE (15, 19, 20). V souvislosti s BE byly dále studovány hypermetylace a s nimi spojené inaktivace proapoptických genů jako Runt-related transkripční faktor 3 (RUNX3), genů zapojených do kontroly buněčného cyklu jako cyklin dependentní kináza p16 nebo reparace DNA a tumor-supresorových genů, jako jsou myoblast determinující protein 1 (MYOD1), protein kináza C-vázající protein (NELL1), A-kináza ukotvující protein 12 (AKAP12) nebo protachykinin 1 (TAC1) (21). Dále z rodiny tumor-supresorových genů byly analyzovány metylace genů pro některé proteiny se strukturními motivy zinkových prstů (ZNF). Tyto proteiny jsou díky své struktuře schopny interakce s DNA, RNA i jinými proteiny a podílejí se tak na transkripční regulaci, ubikvitinem zprostředkované degradaci proteinu, transdukci signálu, migraci buněk a opravě DNA. Navíc bylo zjištěno, že mohou být zapojené jak do karcinogeneze, tak do tvorby metastáz (22).
V procesu metastazování, tedy uvolnění nádorových buněk z primárního ložiska, je zapotřebí degradace extracelulární matrix, na které se podílejí různé druhy proteináz. Inhibitor cesty tkáňového faktoru 2 (TFPI2) vykazuje silnou inhibiční aktivitu proti celé řadě těchto proteináz, tím chrání extracelulární matrix proti degradaci a s ní spojenou migraci nádorových buněk. TFPI2 je často metylován u karcinomu jícnu (23).
Biomarkery exprese genů v kombinaci s neendoskopickými metodami
Mezi tyto biomarkery můžeme zařadit méně studované exprese mRNA a miRNA, k jejichž analýze se využívá expresních čipů nebo RNA sekvenování (16).
miRNA jsou malé nekódující molekuly RNA, které rozpoznají cílovou sekvenci mRNA a inhibují tak překlad mRNA do proteinu (24). Kromě toho jsou profily miRNA úzce spojovány se specifickou tkání nebo onemocněním a v biologických vzorcích jsou vysoce stabilní. Například ve vzorcích jícnu odebraných neendoskopickými metodami byly s BE asociovány miR-192, miR-194, miR-196a a miR-215 (Obr. 5) (12). Problematice miRNA v kontextu s GERD se v České republice věnuje tým prof. Slabého, který v endoskopicky odebrané tkáni BE i EAC zaznamenal signifikantně zvýšenou expresi miR-192 a miR-194 v porovnání s normální jícnovou tkání (25).
Obr. 5. Biomarkery exprese genů a proteinové biomarkery pro BE v kombinaci s neendoskopickým odběrem vzorků sliznice jícnu (vytvořeno pomocí programu BioRender.com) 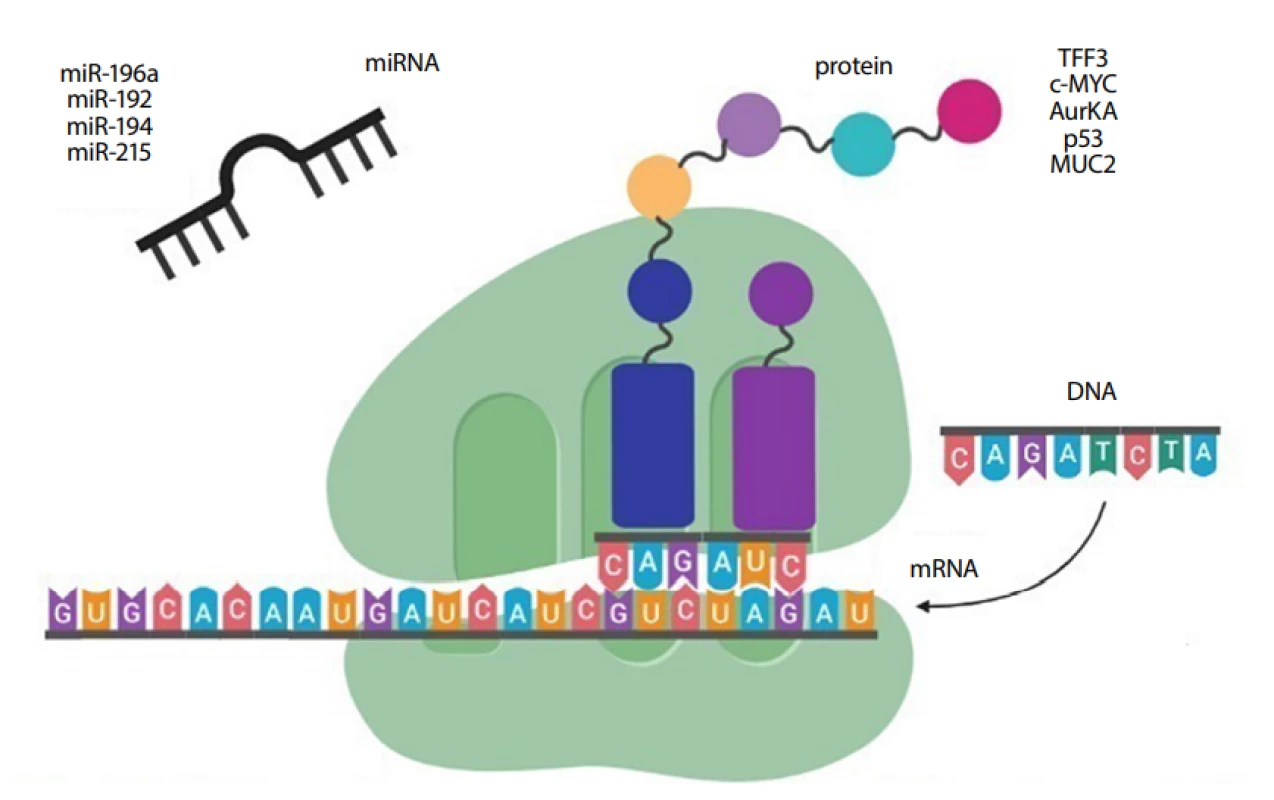
Proteinové a peptidové biomarkery v kombinaci s neendoskopickými metodami
Ke stanovení koncentrace proteinového biomarkeru ve vzorku jícnové tkáně je nejčastěji využívána technika IHC, tedy barvení proteinu specifickými protilátkami. Pro posouzení dysplazie u pacientů s BE doporučuje Britská gastroenterologická společnost IHC vyšetření výše zmíněného proteinu p53 (26).
Dalšími studovanými biomarkery v souvislosti s needoskopickými metodami jsou peptidy z rodiny trifolátového faktoru (TFF). Rodina je tvořena třemi peptidy TFF1, TFF2 a TFF3 vyskytujícími se v buňkách produkujících mucin, který se svými protizánětlivými, angiogenními a reparačními účinky podílí na ochraně a obnově žaludeční a intestinální sliznice. Za fyziologických podmínek je exprese genů těchto peptidů tkáňově (buněčně) specifická (Obr. 6), proto může být stanovení jejich koncentrace využito k detekci a hodnocení intestinální metaplazie (27).
Obr. 6. Exprese peptidů TFF v gastrointestinálním traktu (vytvořeno pomocí programu BioRender.com) 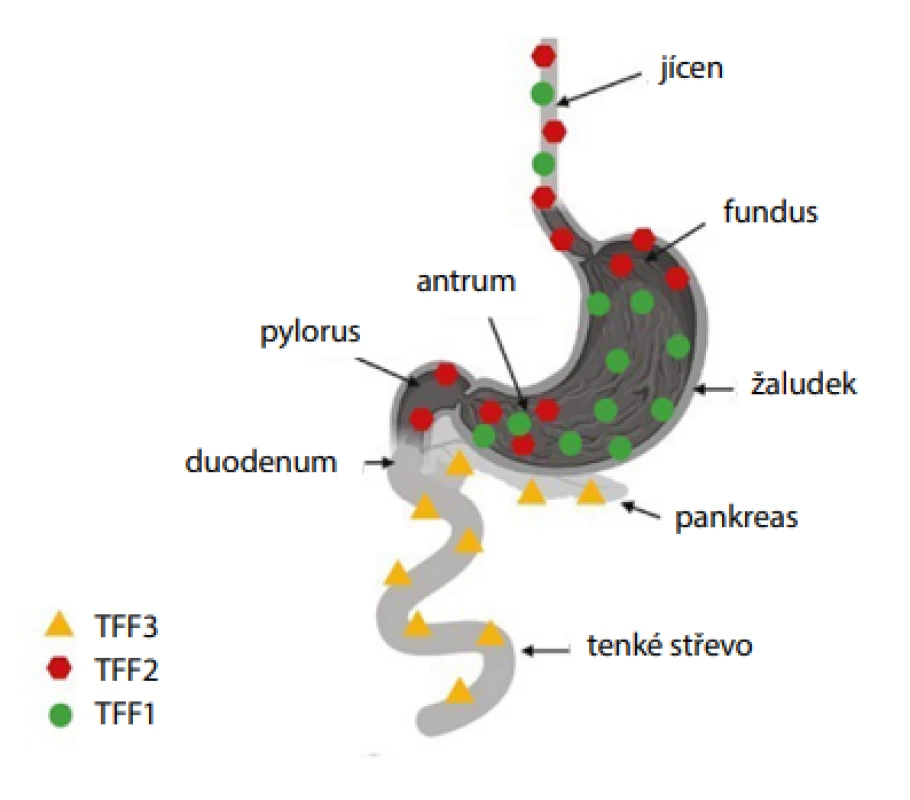
Dále jsou s BE asociovány potenciální biomarkery proto-onkogen c-Myc, aurora kináza A (AurKA) a mucin 2 (MUC2) (Obr. 5). Protein c-Myc se uplatňuje v regulaci buněčného metabolismu či růstu a nadměrná exprese jeho genu je spojována s metabolickými procesy vedoucími ke zvýšené tvorbě nukleových kyselin, proteinů a lipidů, které jsou nezbytné pro rychlou buněčnou proliferaci transformovaných buněk (28). AurKA je regulátorem mitózy, přičemž její zvýšená exprese je asociována s nestabilitou chromozomů a aneuploidií (změna počtu chromozomů) ovlivňující vývoj BE směrem k EAC (29). MUC2 je hlavní intestinální mucin produkovaný pohárkovými buňkami v gastrointestinálním traktu. V dysplastických a EAC vzorcích je však IHC proteinu MUC2 negativní, což výrazně snižuje senzitivitu screeningového testu pro BE (11).
Přestože se žádný biomarker zatím nedostal do stadia rutinního klinického používání (26), některé laboratoře nabízejí ke standardnímu histologickému vyšetření endoskopicky odebrané jícnové tkáně také IHC doplňkové vyšetření proteinu p53, kterým lze dobře hodnotit stupeň dysplazie, nebo analýzu specifického proteinu pro intestinální epitel tzv. caudal type homeobox 2 (CDX2), který se využívá pro potvrzení BE s pohárkovými buňkami, ale i bez nich (30, 31).
V literatuře jsou prezentovány výsledky studií, jejichž cílem je identifikace dalších biomarkerů, které by mohly spolu s klinickými a enviromentálními faktory predikovat vznik a rozvoj BE nebo EAC (26). Všechny dosud studované biomarkery, které byly testovány v kombinaci s neendoskopickými metodami odběru vzorků sliznice jícnu a u kterých byla hodnocena senzitivita a specifita, jsou shrnuty v Tab. 1.
Tab. 1. Studované biomarkery v kombinaci s neendoskopickými metodami odběru vzorků jícnové sliznice 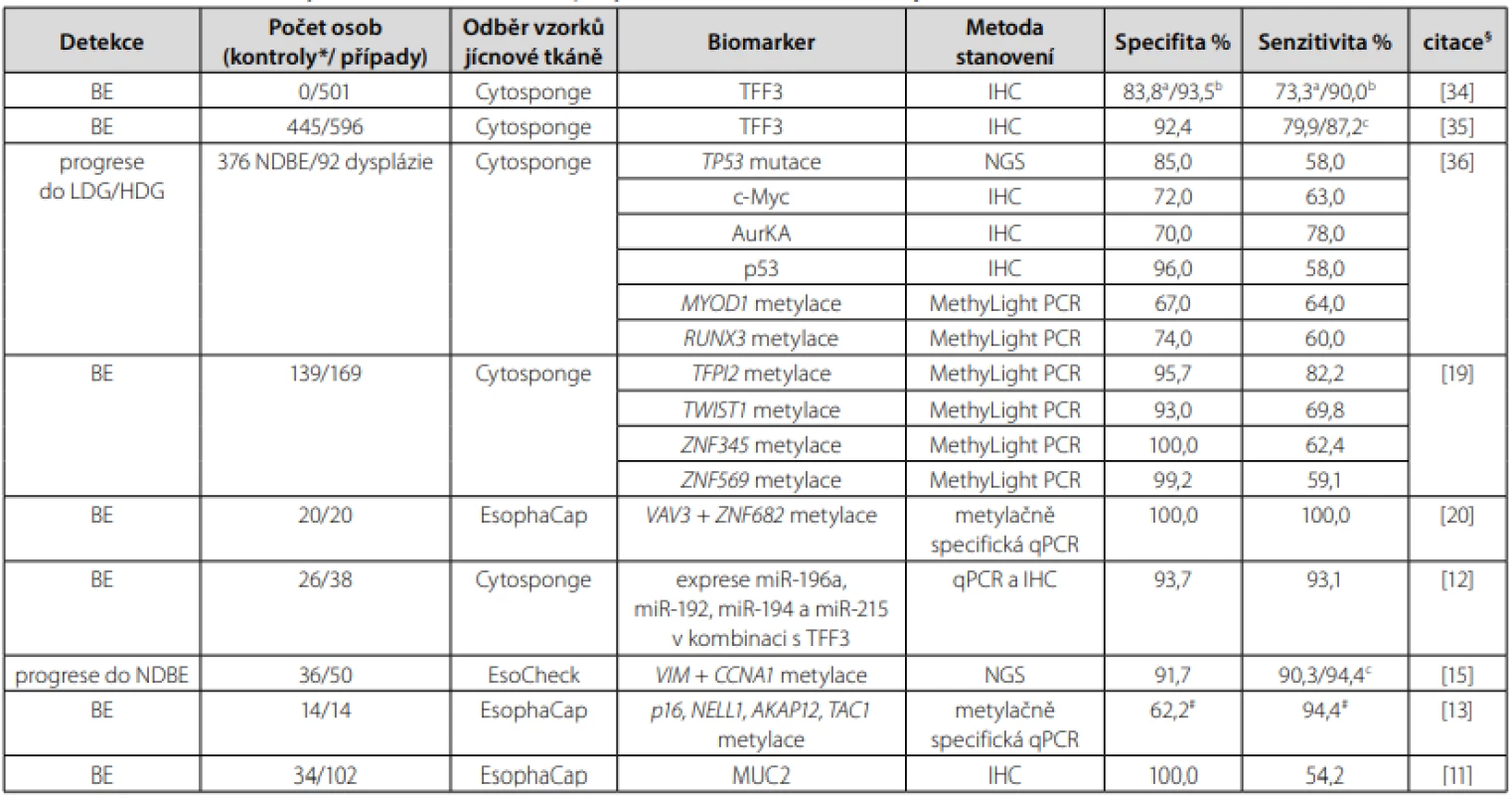
*kontroly – jedinci s dyspepsií nebo refluxními symptomy bez endoskopické evidence NDBE, BE, dysplazie nebo EAC a ≥1 cm dlouhý segment BE, b ≥2 cm dlouhý segment BE, c ≥3 cm dlouhý segment BE
#v kombinaci s věkem
§studie seřazené dle roku publikování vzestupněAby se neendoskopická screeningová technika pro BE mohla stát součástí standardní klinické praxe, měla by být její specifita a senzitivita alespoň 90% nebo vyšší. Zatímco specifita je definována jako pravděpodobnost, že test je negativní u osob bez hledaného onemocnění, tak senzitivita udává charakteristiku klinického testu korektně identifikovat pacienty s daným onemocněním (32). Specifita i senzitivita mohou být ovlivněny délkou segmentu Barrettova jícnu. Tento trend je analogický i u endoskopické metody, kdy se diagnostika intestinální metaplazie zlepšuje s délkou segmentu Barrettova jícnu a počtem odebraných biopsií (1).
Testovací technika by dále měla být nákladově efektivní, přijatelná pro testovanou populaci, dobře implementovatelná do prostředí primární péče nebo do rutinní gastroenterologické praxe, a především účinná ve snížení incidence a mortality EAC (33).
Závěr
Včasná detekce dysplazie a časného EAC jícnu může být nesnadná, protože většina pacientů je asymptomatická, dokud neprogredují do pokročilejších a kurabilně neléčitelných stadií. Celoplošný endoskopický screening těchto asymptomatických jedinců je z hlediska invazivnosti, časové náročnosti, a především nízké míry prevalence BE a EAC nereálný.
Řešením by mohlo být využití neinvazivních neendoskopických metod (CytospongeTM, EsophaCapsTM, Esocheck) s následným stanovením genetických, epigenetických, genově expresních a proteinových či peptidových biomarkerů u rizikové populace a pacientů s NDBE. Vyšetření neendoskopickými metodami je rychlé a komfortnější, což by mohlo zlepšit compliance a adherenci k vyšetření a následné léčbě u těch pacientů, kteří mají z endoskopického vyšetření obavy. Ve zdravotních systémech (např. v USA) s vysokou cenou endoskopie mohou být pro využití jiné než endoskopické diagnostiky i ekonomické důvody (37). Tímto přístupem je možné zachytit BE s vysokou specifitou a senzitivitou u asymptomatických rizikových jedinců či sledovat vznik LGD/ HGD a vyselektovat pacienty s vysokým rizikem vzniku EAC. Největší potenciál v tomto směru mají epigenetické biomarkery, tj. metylace VAV3 + ZNF682 (senzitivita i specifita 100 %) a VIM + CCNA1 (senzitivita 90,3%; specifita 91,7%), biomarkery genové exprese miR-196a, miR-192, miR-194 a miR-215 v kombinaci s detekcí proteinu TFF3 (senzitivita 93,1%; specifita 93,7%).
Stále se hledají efektivnější možné kombinace potenciálních biomarkerů, díky kterým by bylo možné včas diagnostikovat samotné onemocnění, ale také zachytit progresi onemocnění, které by predikovaly terapeutickou odpověď a které by otvíraly možnosti nových terapeutických cílů (38). Pro implementaci poznatků do klinické praxe je zapotřebí dalších studií a spolupráce multidisciplinárních týmů vědců základního a klinického výzkumu a odborných lékařů (gastroenterologů, patologů a chirurgů).
Granty a finanční podpora
Podpořeno z programového projektu Ministerstva zdravotnictví ČR s reg. č. NU20-03-00126 a z grantu MZČR-RVO (FNBr, 65269705, Sup 16/19).
KORESPONDENČNÍ ADRESA AUTORA:
doc. RNDr. Petra Bořilová Linhartová, Ph.D., MBA,
Ústav patologické fyziologie LF MU
Kamenice 5,
625 00 Brno
Cit. zkr: Vnitř Lék 2020; 66(7): e13–e19
Článek přijat redakcí: 22. 11. 2019
Článek přijat po recenzích k publikaci: 28. 1. 2020
Zdroje
1. Clermont M, Falk WG. Clinical guidelines update on the diagnosis and management of Barrett´s esophagus. Dig Dis Sci 2018; 63 : 2122–2128.
2. Fass R, Dickman R. Clinical Consequences of Silent Gastroesophageal Reflux Disease. Curr Gastroenterol Rep 2006; 8 : 194–200.
3. Sawas T, Killcoyne S, Iyer PG, et al. Identification of Prognostic Phenotypes of Esophageal Adenocarcinoma in 2 Independent Cohorts. Gastroenterology 2018; 155 : 1720–1728.
4. Kroupa R. Barrettův jícen, rizikové faktory, léčba. Interní Med 2012; 14 : 104–106. 5. Freeman M, Offman J, Walter MF, et al. Acceptability of the Cytosponge procedure for detecting Barrett’s oesophagus: a qualitative study. BMJ Open 2017; 7: e013901.
6. Shaheen N, Falk GW, Iyer PG, et al. ACG Clinical Guideline: Diagnosis and Management of Barrett’s Esophagus. Am J Gastroenterol 2016; 111 : 30–50.
7. Fitzgerald RC, di Pietro M, Ragunath K, et al. British Society of Gastroenterology guidelines on the diagnosis and management of Barrett’s oesophagus. Gut 2014; 63 : 7–42.
8. Iqbal U, Siddique O, Ovalle A, et al. Safety and efficacy of a minimally invasive cell sampling device (‘Cytosponge’) in the diagnosis of esophageal pathology: a systematic review. Eur J Gastroenterol Hepatol 2018; 30 : 1261–1269.
9. Katzka AD. Recent Advances in Non-invasive Esophageal Tissue Sampling. Curr Gastroenterol Rep 2017; 19 : 9.
10. Szoka N, Fazi J. 2019. Cytosponge™ – A SAGES Technology and Value Assessment. SAGES - Society of American Gastrointestinal and Endoscopic Surgeons (online). Dostupné z: https://www.sages.org/publications/tavac/cytosponge/
11. Zhou Z, Kalatskaya I, Russell D, et al. Combined EsophaCap cytology and MUC2 immunohistochemistry for screening of intestinal metaplasia, dysplasia and carcinoma. Clin Exp Gastroenterol 2019; 12 : 219–229.
12. Li X, Kleeman S, Coburn SB, et al. Selection and Application of Tissue microRNAs for Nonendoscopic Diagnosis of Barrett’s Esophagus. Gastroenterology 2018; 155 : 771–783.
13. Wang Z, Kambhampati S, Cheng Y, et al. Methylation Biomarker Panel Performance in EsophaCap Cytology Samples for Diagnosing Barrett’s Esophagus: A Prospective Validation Study. Clin Cancer Res 2019; 1 : 2127–2135.
14. EsoCheck | Lucid Diagnostics | United State. Lucid Diagnostics | Biomarkers for Esophageal Cancer | New York (online). Copyright © 2019 Lucid Diagnostics (cit. 23.10.2019). Dostupné z: https://www.luciddx.com/esocheck
15. Moinova HR, LaFramboise T, Lutterbaugh JD, et al. Identifying DNA methylation biomarkers for non-endoscopic detection of Barrett’s esophagus. Sci Transl Med 2018; 17: pii: eaao5848.
16. Qureshi AP, Stachler MD, Haque O, et al. Biomarkers for Barrett’s esophagus – a contemporary review. Expert Rev Mol Diagn 2018; 18 : 939–946.
17. Naini VB, Souza FR, Odze DR. Barrett’s Esophagus: A Comprehensive and Contemporary Review for Pathologists. Am J Surg Pathol 2016; 40: e45–e66.
18. Mutační analýza genu p53 – Oddělení lékařské genetiky FN Brno. Oddělení lékařské genetiky FN Brno (online). Copyright © 2016 (cit. 25.10.2019). Dostupné z: https://genetikabrno.eu/vysetrujeme/mutacni-analyza-genu-p53/
19. Chettouh H, Mowforth O, Galeano-Dalmau N, et al. Methylation panel is a diagnostic biomarker for Barrett’s oesophagus in endoscopic biopsies and nonendoscopic cytology specimens. Gut 2018; 67 : 1942–1949.
20. Iyer PG, Taylor WR, Johnson ML, et al. Highly Discriminant Methylated DNA Markers for the Non-endoscopic Detection of Barrett’s Esophagus. Am J Gastroenterol 2018; 113 : 1156–1166.
21. Kailasam A, Mittal KS, Agrawal KD. Epigenetics in the Pathogenesis of Esophageal Adenocarcinoma. Clin Transl Sci 2015; 8 : 394–402.
22. Cassandri M, Smirnov A, Novelli F, et al. Zinc-finger proteins in health and disease. Cell Death Discov 2017; 3 : 17071.
23. Jia Y, Yang Y, Brock VM, et al. Methylation of TFPI-2 is an early event of esophageal carcinogenesis. Epigenomics 2012; 4 : 135–146.
24. Shivdasani RA. MicroRNAs: regulators of gene expression and cell differentiation. Blood 2006; 108 : 3646–3653.
25. Slaby O, Srovnal J, Radova L, et al. Dynamic changes in microRNA expression profiles reflect progression of Barrett’s esophagus to esophageal adenocarcinoma. Carcinogenesis 2015; 36 : 521–527.
26. Konda AJV, Souza FR. Biomarkers of Barrett’s Esophagus: From the Laboratory to Clinical Practice. Dig Dis Sci 2018; 63 : 2070–2080.
27. Fabisiak A, Bartoszek A, Kardas G, et al. Possible application of trefoil factor family peptides in gastroesophageal reflux and Barrett’s esophagus. Peptides 2019; 115 : 27–31.
28. Miller MD, Thomas DS, Islam A, et al. c-Myc and Cancer Metabolism. Clin Cancer Res 2012; 18 : 5546–5553.
29. Rugge M, Fassan M, Zaninotto G, et al. Aurora kinase A in Barrett’s carcinogenesis. Hum Pathol 2010; 41 : 1380–1386.
30. CGB laboratoře. CGB laboratoře (online). Copyright © 2016, CGB laboratoř a.s. (cit. 20.09.2019). Dostupné z: http://www.pathology.cz/
31. Groisman MG, Amar M, Meir A. Expression of the intestinal marker Cdx2 in the columnar-lined esophagus with and without intestinal (Barrett’s) metaplasia. Mod Pathol 2004; 17 : 1282–1288.
32. Lalkhen GA, McCluskey A. Clinical tests: sensitivity and specificity. Continuing Education in Anaesthesia Critical Care & Pain 2008; 8 : 221–223.
33. Thota, Chak. Mass Screening for Barrett’s esophagus: Myth or Reality? Clin Gastroenterol Hepatol 2018; 17 : 610–612.
34. Kadri SR, Lao-Sirieix P, O’Donovan M, et al. Acceptability and accuracy of a non-endoscopic screening test for Barrett’s oesophagus in primary care: cohort study. BMJ 2010; 10; 341: c4372.
35. Ross-Innes CS, Debiram-Beecham I, O’Donovan M, et al. Evaluation of a minimally invasive cell sampling device coupled with assessment of trefoil factor 3 expression for diagnosing Barrett’s esophagus: a multi-center case-control study. PLoS Med 2015; 29; e1001780.
36. Ross-Innes CS, Chettouh H, Achilleos A, et al. Risk stratification of Barrett’s oesophagus using a non-endoscopic sampling method coupled with a biomarker panel: a cohort study. Lancet Gastroenterol Hepatol.2017; 2 : 23–31.
37. Kroupa R, Konečný Š, Dolina J. Současné trendy v diagnostice a léčbě refluxní nemoci jícnu. Vnitř Lék 2018; 64 : 588–594.
38. Svoboda P, Dítě P, Klvaňa P, et al. Rizikové faktory a prediktory progrese Barretova jícnu do adenokarcinomu. Vnitř Lék 2014; 60 : 467–473.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Hypoglykemie u nediabetiků
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2020 Číslo 7- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Koagulopatie asociovaná s onemocněním COVID-19
- Současná diagnostika a terapie sarkoidózy
- Obštrukčné spánkové apnoe a arteriálna hypertenzia: úloha črevného mikrobiómu
- CAR T-lymfocyty: horká novinka v léčbě nádorů
- Renální selhání u mnohočetného myelomu a jeho léčba
- Kostní metabolismus u idiopatických střevních zánětů 2
- Metformin -asociovaná laktátová acidóza
- Tangierská nemoc v rodině s fenotypem familiární hypercholesterolemie
- Hypoglykemie u nediabetiků
- Screening a krátká intervence u uživatelů nelegálních drog
- Kostní metabolismus u idiopatických střevních zánětů 1
- Etické konotace léčby onemocnění covid-19
- Biomarkery pro neendoskopické vyšetření sliznice jícnu
- Riziko kardiovaskulárních komplikací v závislosti na hladině glykemie: od diabetes mellitus k prediabetu
- ERCP u pacientů po choledochoduodenoanastomóze
- Přidělovaná ošetřovatelská péče jako jeden z indikátorů výskytu medikačního pochybení
- Small bowel adenocarcinoma diagnosed by video capsule endoscopy in a patient with celiac disease: a case report and review of literature
- Raritní koincidence chylothoraxu a hydrothoraxu při adenokarcinomu žaludku – kazuistika
- Muž s dysthymií (převážně negativním hodnocením všeho prožitého) indukoval depresi u senzitivní blízké osoby
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Hypoglykemie u nediabetiků
- Metformin -asociovaná laktátová acidóza
- Koagulopatie asociovaná s onemocněním COVID-19
- CAR T-lymfocyty: horká novinka v léčbě nádorů
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



