-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Současná diagnostika a terapie sarkoidózy
Current diagnosis and therapy in sarcoidosis
Sarcoidosis is a disorder of unknown etiology, that may affect any organ in human body, most often lungs and lymph nodes. New diagnostic guidelines and new treatment recommendations were recently published. Since differential diagnosis of sarcoidosis is broad, diagnostic algorithm has to be complex. Diagnosis needs to be confirmed before initiation of any any treatment regimen – it is a severe mistake to start treatment before confirmation of diagnosis (histologic pattern of epitheloid non necrotising granuloma, exclusion of other possible causes of granulomatous diseases, exclusive situations mentioned in the article body). Not every patient with sarcoidosis needs pharmacologic treatment. Treatment decision should involve extent of involvement, risk of damage of affected organs and patient symptoms. While in patients with Löfgren syndrome both histologic verification and systemic corticotherapy is not needed (systemic corticotherapy should be avoided), pharmacologic treatment is necessary in patients with myocardial involvement.
Keywords:
sarcoidosis – diagnosis – therapy – granuloma
Autori: Martina Šterclová
Pôsobisko autorov: Pneumologická klinika 1. LF UK a Thomayerovy nemocnice, Praha ; Pneumologická klinika 2. LF UK a FN Motol, Praha
Vyšlo v časopise: Vnitř Lék 2020; 66(7): 409-413
Kategória:
Súhrn
Sarkoidóza je onemocnění neznámé etiologie, které může postihovat jakýkoliv orgán v těle, nejčastěji však plíce a uzliny. Recentně byla publikována nová diagnostická doporučení a nové poznatky týkající se vhodných léčebných postupů. Protože diferenciální diagnostika sarkoidózy je široká, vyžaduje vyšetřovací algoritmus komplexní přístup. Před zahájením jakékoliv léčby je nutné mít diagnosticky jasno. Je hrubou chybou zahajovat terapii, pokud není jednoznačně stanovena diagnóza, což v případě sarkoidózy vyžaduje histologický průkaz epiteloidního nenekrotizujícího granulomu (výjimky uvedeny ve sdělení) a vyloučení jiných chorob, které jsou tvorbou granulomů provázeny. Ne u všech nemocných se sarkoidózou je nutné přistoupit k farmakologické léčbě. Při rozhodování, zda léčit nebo sledovat, bychom vždy měli vzít v úvahu rozsah postižení, vliv onemocnění na funkci postižených orgánů a symptomy pacienta. U nemocných s Löfgrenovým syndromem není nezbytně nutná ani histologická verifikace, ani systémová kortikoterapie (ta se naopak důrazně nedoporučuje), u nemocných se sarkoidózou myokardu naopak bývá farmakologická léčba nezbytná.
Klíčová slova:
sarkoidóza – diagnostika – terapie – granulom
Úvod
Sarkoidózu lze označit jako nemoc mnoha tváří, a kdyby výraz „magna simulatrix“ nesloužil k označení systémového lupusu, mohl by posloužit i pro sarkoidózu. Etiologii nemoci neznáme, i když faktorů asociovaných se vznikem sarkoidózy se nabízí celá řada (Tab. 1) (1). Postihovat může jakýkoliv orgán a obtíže pacienta mohou odrážet jednak orgánové postižení jako takové, často v kombinaci se systémovými příznaky. Diagnostika spočívá zejména ve vyloučení nemocí, které mohou být provázeny podobnými nálezy. Jelikož příčina sarkoidózy nebyla odhalena, nemáme k dispozici kauzální léčbu. Naštěstí farmakologická léčba není nezbytná u všech pacientů s tímto onemocněním. V roce 2019 byly vytvořeny české doporučené postupy pro diagnostiku, léčbu a sledování vývoje sarkoidózy (2), protože se ale nejedná o nejnovější doporučení (ta byla publikována v dubnu 2020 (3)), jsou ve sdělení reflektována právě tato nejnovější doporučení a poznatky. V následujícím sdělení se zaměříme na některé problematické body v diagnostice sarkoidózy a na léčebné možnosti, které jsou u nemocných s různým typem postižení k dispozici.
Tab. 1. Faktory asociované s rozvojem sarkoidózy 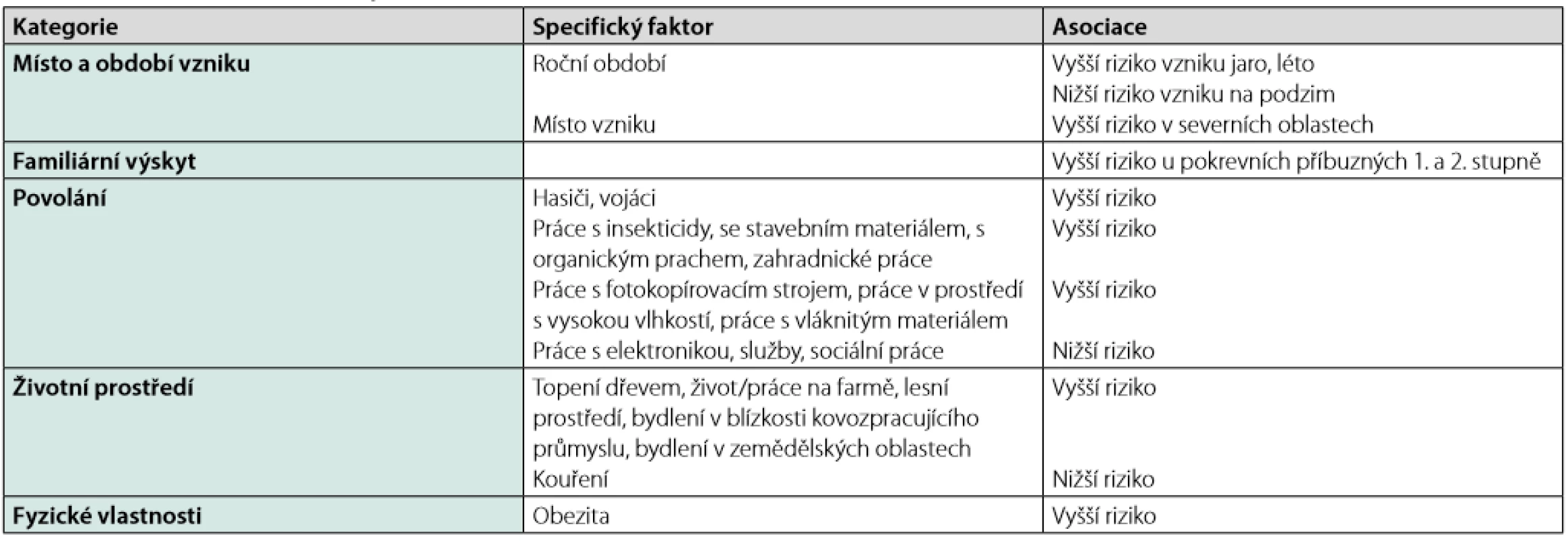
Diagnostika sarkoidózy
Abychom mohli s jistotou tvrdit, že nemocný má sarkoidózu, měli bychom získat tkáň s epiteloidním nenekrotizujícím granulomem (sarkoidním granulomem) a vyloučit všechny ostatní příčiny, které mohou vést k podobnému nálezu (Tab. 2). Výjimku tvoří pacienti s Löfgrenovým syndromem (erytema nodosum, bilaterální hilová lymfadenopatie, systémové příznaky) a pacienti s typickou bilaterální hilovou lymfadenopatií, ovšem za předpokladu dalšího sledování (2). Zejména u nemocných, u kterých uvažujeme o zahájení systémové léčby, je nutné mít jistotu, že se skutečně jedná o sarkoidózu a k tomu je nezbytně nutná histologie.
Tab. 2. Diferenciální diagnostika granulomatózních procesů (4) 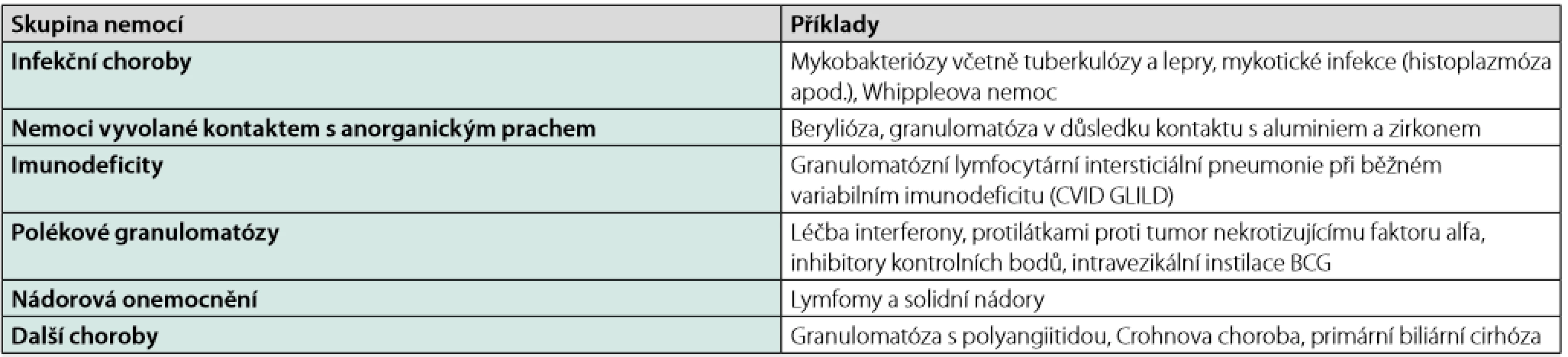
BCG – Bacillus Calmette-Guérin Následující dvě krátké kazuistiky dokumentují, jaká rizika pro pacienta s sebou nese, pokud je léčba zahajována bez znalosti diagnózy.
Kazuistika 1
64letá obézní nemocná s arteriální hypertenzí, anamnesticky má několik let trvající kašel, za jehož příčinu byl považován extraesofageální reflux. V roce 2019 absolvovala náhradu kolenního kloubu pro progredující valgozitu a nestabilitu kloubu v souvislosti s úrazem v minulosti. Po výkonu se objevily dechové obtíže, bylo pomýšleno na plicní embolii a nemocná postoupila ventilačně perfuzní sken. Ten jednak prokázal plicní embolii a jednak na jeho podkladě vzniklo podezření na další plicní onemocnění. Proběhlo vyšetření počítačovou tomografií s vysokou rozlišovací schopností (HRCT) (Obr. 1, 2), pak bronchoskopie s bronchoalveolární laváží, ovšem bez jakékoliv biopsie. Autoprotilátky byly negativní, nebyla prokázána mykobakteriální infekce. Na základě HRCT nálezu byl případ nemocné uzavřen jako sarkoidóza II. stadia. Navzdory zcela normálním plicním funkcím byla nemocná indikována k systémové kortikoterapii.
Obr. 1. Radiologický obraz onemocnění – kazuistika 1 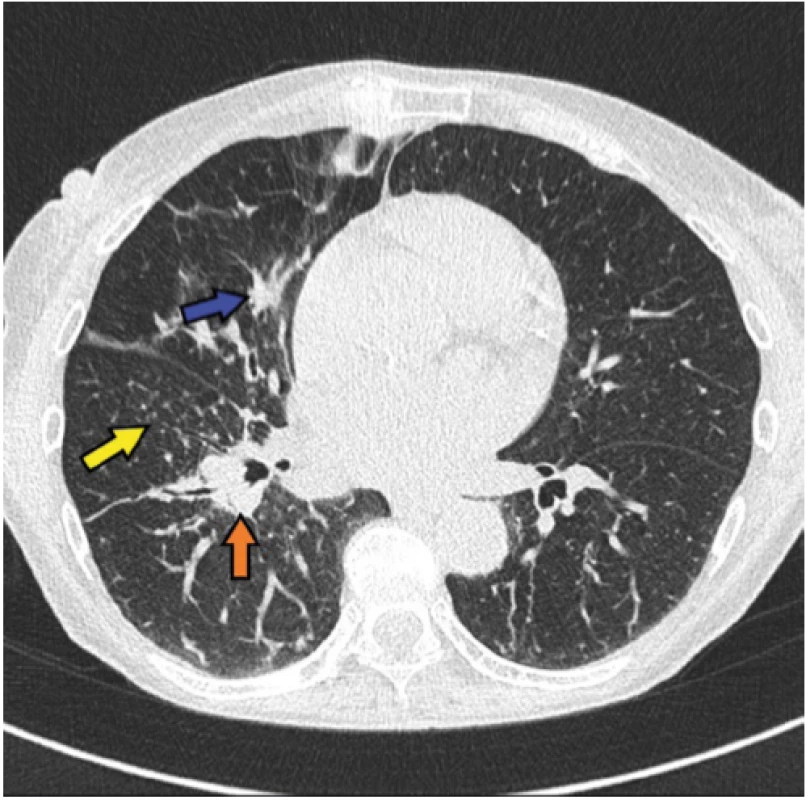
Dominují drobné noduly (žlutá šipka), peribronchiálně vázané infiltráty (modrá šipka), pravostranná hilová lymfadenopatie (oranžová šipka) Obr. 2. Radiologický obraz onemocnění – kazuistika 1 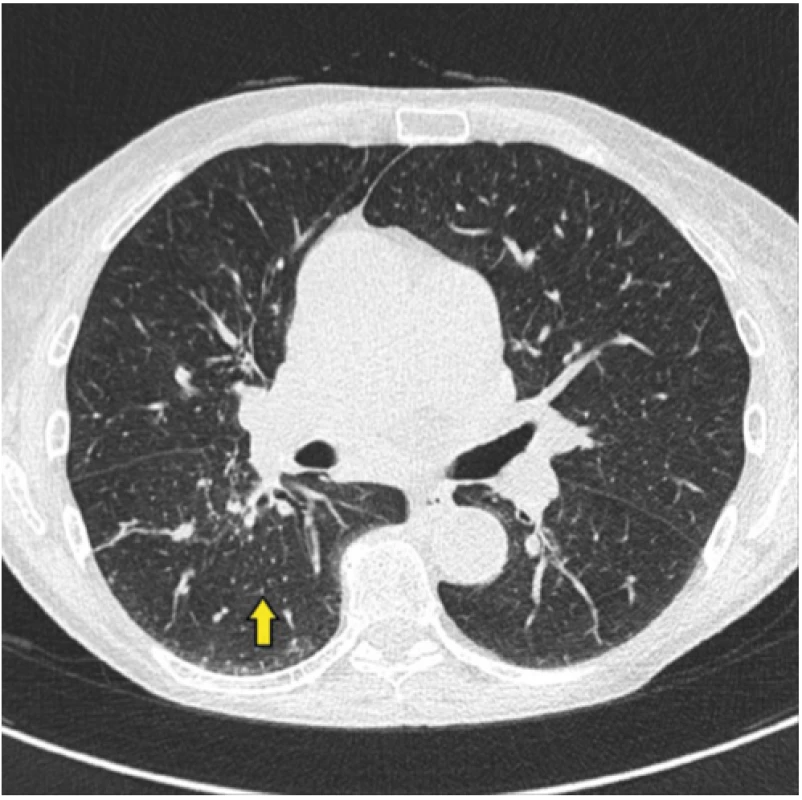
Mnohočetné drobné noduly (žlutá šipka) Rozbor případu
- V algoritmu vyšetření pacientky chybí bioptická verifikace procesu – nemocná nemá symptomy odpovídající Löfgrenovu syndromu, proto je nutná histologická verifikace procesu.
- Nálezy nemocné nevzbuzují podezření, že by byla pacientka ohrožena selháním funkce životně důležitých orgánů. Riziko komplikací systémové kortikoterapie výrazně převažuje velmi sporný benefit. Zvažujeme - li farmakologickou léčbu, měla by být diagnóza histologicky podpořená.
- Stadia sarkoidózy vycházejí z původní Scaddingovy klasifikace z roku 1961 založené na nálezech na skiagramu hrudníku, nesouvisí s nálezem na HRCT hrudníku (5).
K posouzení rozsahu orgánového postižení, místa vhodného pro bioptickou verifikaci nebo v případě suspekce poškození některých orgánů se nabízí využití vyšetření, která v době tvorby původních celosvětových doporučených postupů diagnostiky a léčby sarkoidózy v roce 1999 nebyla buď k dispozici nebo nebyla široce používána (6). Mezi tato vyšetření patří zejména pozitronová emisní tomografie s využitím značení pomocí fluorodeoxyglukózy (FDG -PET). Při podezření na sarkoidózu myokardu nebo centrálního nervového systému (CNS) lze tuto metodu kombinovat s magnetickou rezonancí (MRI) (7, 8). Rámeček 1 shrnuje diagnostická doporučení z roku 2020 (rámeček 1).
Kazuistika 2
45letá nemocná se sarkoidózou II. stadia, diagnóza podpořena histologicky z materiálu získaného pomocí punkce mediastinálních uzlin pod kontrolou endobronchiálním ultrazvukem (EBUS), s podezřením na sarkoidózu myokardu (dle MRI) a s výraznými celkovými symptomy (únava, bolesti celého těla, slabost) navzdory systémové kortikoterapii přichází pro úporné bolesti pravostranných končetin. V noci ji budí bolest kyčle, ramene, přes den ji omezují v běžných denních aktivitách. Obtíže byly tak výrazné, že navštívila centrum bolesti, kde jí byla zahájena léčba opiáty formou transdermální náplasti (fentanyl), do kombinace přidán tramadol. Bolesti přetrvávají, přidala se nauzea a vertigo. Ve sprše si nemocná omylem sloupla fentanylovou náplast, do 4 hodin došlo k rozvoji syndromu z odnětí opiátů. Indikováno doplnění FDG -PET/CT k vyloučení myositidy, zjištěna výrazná artritida a entezopatie v oblasti pravého kyčelního kloubu a pravého ramene (Obr. 3, 4), dobře vysvětlující obtíže nemocné.
Obr. 3. Radiologický obraz onemocnění – kazuistika 2 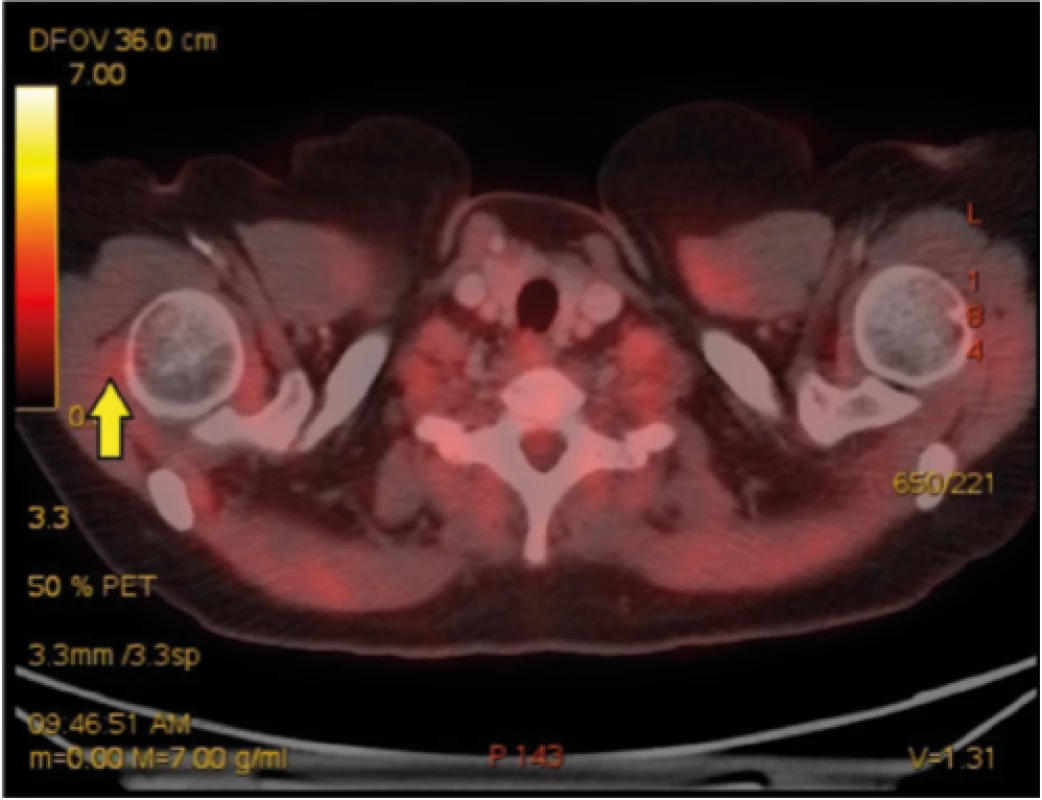
Entezopatie v oblasti pravého ramenního kloubu (žlutá šipka) Obr. 4. Radiologický obraz onemocnění – kazuistika 2 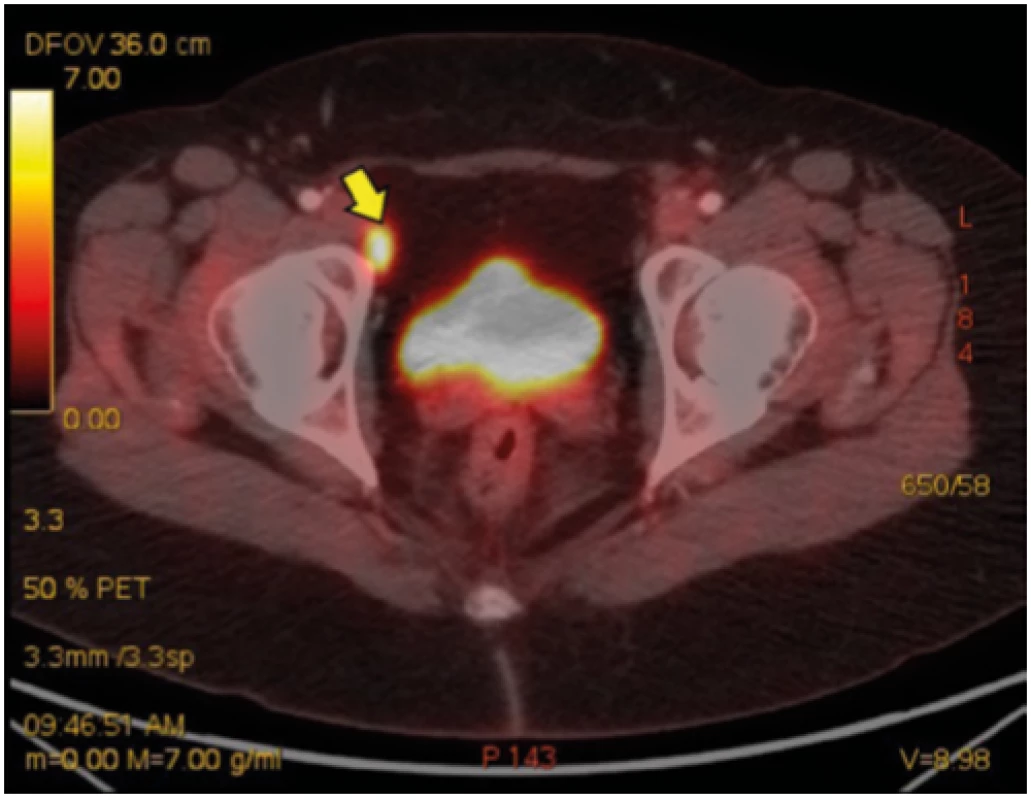
Entezopatie v oblasti pravého kyčelního kloubu (žlutá šipka) Rozbor případu
U nemocných se sarkoidózou se může v čase obraz onemocnění měnit – může se manifestovat mimoplicní postižení. Je třeba mít na paměti, že sarkoidóza může probíhat jako multiorgánové one
- mocnění, u nemocných s multiorgánovým postižením je větší riziko chronického průběhu onemocnění (9).
- V době nasazení opiátů nemocná nebyla v terminální fázi onemocnění s krátkou životní prognózou, příčina bolesti nebyla před zahájením léčby vůbec zjišťována. U nemocné se během několika týdnů rozvinul syndrom závislosti na omamných látkách, nevhodná kombinace opiátů a opioidů vedla k manifestaci nežádoucích účinků.
- Diagnostická doporučení z roku 2020 zahrnují i navrhovaná vyšetření u nemocných se suspekcí na mimoplicní postižení, zaměřena jsou ale především na sarkoidózu srdce – u nemocných s podezřením na sarkoidózu myokardu by měla být doplněna MRI srdce, pokud není MRI dostupná, tak FDG - PET s patřičnou přípravou, v případě podezření na plicní hypertenzi stojí na prvním místě transtorakální echokardiografie.
- Únava je složkou tzv. parasarkoidózního syndromu (parasarcoidosis syndrome). Ten je definován jako symptomy nesouvisející s poškozením tkáně granulomy a zahrnuje především únavu, zhoršení kognitivních funkcí (po vyloučení sarkoidózy CNS), depresi, neuropatii malých vláken a bolest, která není vázána na granulomatózní poškození tkáně (10). Syndrom výrazně zhoršuje kvalitu života postižených pacientů a je obtížně léčebně ovlivnitelný. Vždy je třeba nejprve pátrat po známkách aktivity základní choroby (ve výše zmíněném případě PET), protože i toto může stát za uvedenými symptomy, pak se nabízí posílení dosavadní léčby. Další možnou příčinou obtíží může být syndrom spánkové apnoe, únava může být spojena s dlouhodobou léčbou systémovými kortikosteroidy, s diabetem mellitem (často steroidní) nebo hypotyreózou. Léčba parasarkoidózního syndromu je ještě o něco zapeklitější než léčba sarkoidózy, a to zejména proto, že nemáme žádná data systematicky se touto oblastí zabývající. Kromě psychosociální podpory a rehabilitace doporučují někteří autoři stimulanty typu dexmethylfenidát nebo armodafinil (11).
Léčba sarkoidózy
Průběh sarkoidózy je značně variabilní a nemáme k dispozici žádný biomarker, který by sloužil k predikci průběhu onemocnění. Situaci dále komplikuje skutečnost, že např. postižení oka nebo myokardu může být zpočátku asymptomatické, nicméně prognosticky závažné. Je -li léčba sarkoidózy indikována a zahájena, u více než 40 % pacientů trvá déle než pět let (12). Nejzávažnějšími prognostickými indikátory jsou: vyšší věk, fibrotické postižení plicního parenchymu a přítomnost plicní hypertenze (13).
Zahájení léčby bývá obvykle zvažováno u symptomatických pacientů, se sníženou funkcí postižených orgánů, s rizikem selhání funkce postiženého orgánu a s progresivní chorobou. Jako možná indikace k zahájení léčby symptomatických pacientů bývá uváděn i aktivní granulomatózní zánět a nízká pravděpodobnost dosažení remise.
Observace bývá upřednostňována u nemocných s minimálními příznaky, dobrou funkcí postižených orgánů, neohrožených selháním funkce postiženého orgánu, u nichž je vysoká pravděpodobnost spontánní remise. Léčeni by teoreticky nemuseli být pacienti, u nichž onemocnění v čase neprogreduje, ovšem tuto informaci získáme až dlouhodobým sledováním pacienta, v době stanovení diagnózy samozřejmě k dispozici není.
Je třeba si uvědomit, že je - li u nemocného zahájena farmakologická léčba sarkoidózy, u 50–82 % pacientů bude dlouhodobá (14). V léčbě plicního postižení jsou doporučovány nejčastěji systémové kortikosteroidy, následované kombinací s methotrexátem. Léčba je zatížena značným rizikem vedlejších účinků, v čase se můžeme dostat i do situace, kdy vedlejší účinky pacienta omezují více než sarkoidóza.
Přestože v literatuře nadále najdeme doporučenou iniciální dávku kortikosteroidů 40–60 mg prednisonu, nemá úvodní dávka nejspíš žádný vliv na vývoj plicních funkcí v čase nebo riziko relapsu. U velké části nemocných nebo při exacerbacích sarkoidózy můžeme vystačit i s iniciální dávkou prednisonu 20 mg/den (15).
Kortikosteroidy hrají hlavní roli v léčbě výrazně symptomatických pacientů (vyjma Löfgrenova syndromu!!!), pokud potřebujeme v krátkém čase získat kontrolu nad onemocněním, u nemocných plánujících koncepci a u pacientů s postižením jater a ledvin.
Při jaterní nebo renální insuficienci není doporučováno použít jako kortikosteroidy šetřící lék methotrexát. Kumuluje se i extravaskulárně a neměl by být lékem volby u nemocných s pleurálním/perikardiálním výpotkem/ascitem.
Leflunomid by neměl být zahajován u nemocných s preexistující polyneuropatií (16). Léčba azathioprinem s sebou nese nejnižší riziko jaterního postižení, podávání je ale zatíženo vyšším rizikem infekčních komplikací a sekundárních malignit.
Pokud stav pacienta vyžaduje použití biologické léčby, v úvahu připadá především infliximab a adalimumab. Biologika jsou imunogenní, zejména podávání infliximabu je zatíženo rizikem tvorby anti -chimerických protilátek. Po dobu léčby se doporučuje nevysazovat imunosupresiva, protože jejich podání snižuje tvorbu těchto protilátek (17). Adalimumab je doporučován při selhání léčby infliximabem právě v důsledku vytvoření protilátek proti infliximabu. Přítomnost těchto protilátek je možné testovat z krve, a pokud není efekt léčby zejména infliximabem uspokojivý, měli bychom na možnost této imunologické komplikace pomýšlet.
Souhrn terapeutických možností u nemocných se sarkoidózou shrnuje tabulka 3.
Tab. 3. Souhrn terapeutických možností u nemocných se sarkoidózou plic 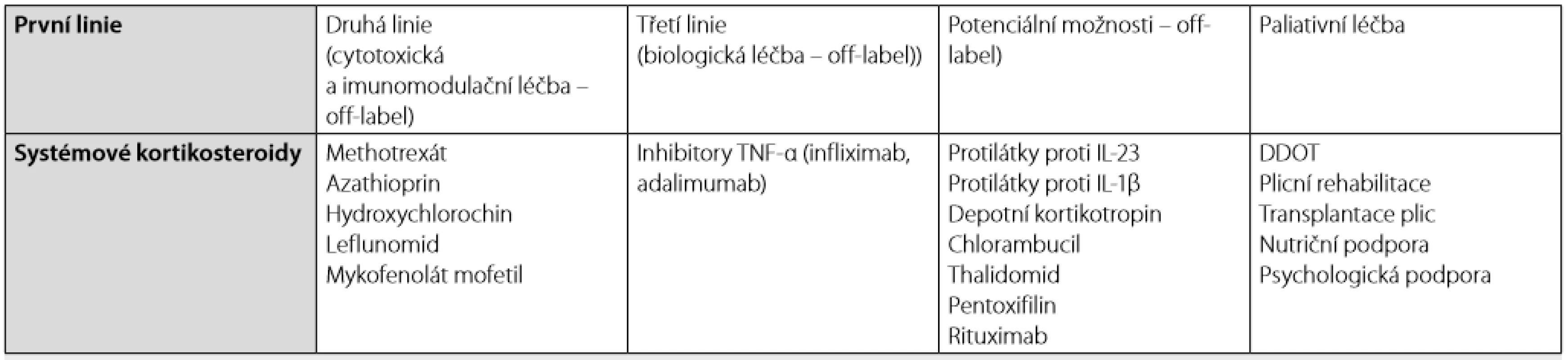
TNF-α – tumor nekrotizující faktor alfa; IL – interleukin, DDOT – dlouhodobá domácí oxygenoterapie Závěr
Navzdory dostupnosti nových diagnostických a léčebných metod je pro diagnostiku sarkoidózy nezbytné, aby lékaře tato možnost vůbec napadla. Je pravda, že onemocnění není časté a vzhledem k tomu, že etiologie nebyla zatím odhalena, postižený může být jakýkoliv orgán a stesky pacientů bývají dosti polymorfní, může být pro lékaře sarkoidóza obtížně uchopitelná. Pacienti s Löfgrenovým syndromem bývají odesíláni do péče revmatologa, který nezřídka sáhne po systémových kortikosteroidech ještě před tím, než indikuje skiagram hrudníku, čímž nevědomky zvýší riziko relapsu po vysazení léčby. Sarkoidóza myokardu se může projevit poruchou srdečního rytmu, ale i fibrilací komor nebo náhlou srdeční zástavou, lékařem prvního kontaktu pak může být kardiolog nebo anesteziolog. Nepomyslí -li v diferenciální diagnostice na sarkoidózu, je vysoké riziko, že se událost může opakovat s méně příznivým průběhem. Pacienti s dominujícími systémovými příznaky navštěvují nezřídka psychology, psychiatry, ale i léčitele nebo homeopaty, byť je nemoc nemusí nutně ohrožovat na životě, celkové příznaky, zejména únava a bolesti, mohou významně snižovat kvalitu jejich života.
V současné době probíhají i četné studie, testující nové léčebné přípravky (tofacitinib, abatacept, kortikotropin). Pokud ale nebude lékař pacienta v diferenciální diagnostice na sarkoidózu pomýšlet, uzavře tím nemocnému přístup k jakékoliv léčbě a k zmírnění jeho obtíží.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Martina Šterclová, Ph.D.,
Pneumologická klinika 1. LF a Thomayerovy nemocnice,
Vídeňská 800,
140 00 Praha 4
Cit. zkr: Vnitř Lék 2020; 66(7): 409–413 Článek přijat redakcí: 22. 7. 2020 Článek přijat po recenzích k publikaci: 27. 8. 2020
Zdroje
1. Culver DA, Judson MA. New advances in the management of pulmonary sarcoidosis. BMJ 2019; 367 : 15553.
2. Kolek V, Losťáková V, Vašáková M, Žurková M. Sarkoidóza (Doporučený postup diagnostiky, terapie a sledování vývoje onemocnění). Dostupné na: www.pneumologie.cz/guidelines, navštíveno: 8. 8. 2020.
3. Crouser ED, Maier LA, Wilson KC, et al. Diagnosis and detection of sarcoidosis. AJRCCM 2020; 8: e26–e51.
4. Jeny F, Bernaudin JF, Cohen Aubart F, et al. Diagnosis issues in sarcoidosis. Respir Med and Res 2020; 77 : 37–45.
5. Scadding JG. Prognosis of intrathoracic sarcoidosis in England. A review of 136 cases after five years‘ observation. Br Med J 1961; 2 : 1165–1172.
6. Statement on sarcoidosis. Joint statement of American Thoracici Society (ATS), the European Respiratory Society (ERS) and the World Association of Sarcoidosis and Other Granulomatous Disorders (WASOG). AJRCCM 1999; 160 : 736–755.
7. Kidd DP. Neurosarcoidosis: clinical manifestations, investigation and treatment. Pract Neurol 2020; 20 : 199–2121.
8. Roth D, Kadoglou N, Leeflang M, et al. Diagnostic accuracy of cardiac MRI, FDG - PET, and myocardial biopsy for the diagnosis of cardiac sarcoidosis: a protocol for a systematic review and meta -analysis. Diagnostic and Prognostic Research 2020; 4 : 5.
9. Baughman RP, Scholand MB, Rahaghi FF. Clinical phenotyping: role in treatemnt decisions in sarcoidosis. Eur Respir Rev 2020; 29 : 190145.
10. Jammal TE, Jamilloux Y, Gerfraud - Valentin M, et al. Refractory sarcoidosis: A Review. Therapeutics and Clinical Risk Management 2020; 16 : 323–345.
11. Vis R, van de Garde EWM, Grutters J, Korenromp IHE. The effects of pharmacological interventions on quality of life and fatigue in sarcoidosis: a systematic review. Eur Respir Rev 2020; 29 : 190057.
12. Baughman RP, Nagai S, Balter M, et al. Defining the clinical outcome status (COS) in sarcoidosis: results of WASOG Task Force. Sarcoidosis Vasc Diffuse Lung Dis 2011; 28 : 56–64.
13. Kirkil G, Lower EE, Baughman RP. Predictors of mortality in pulmonary sarcoidosis. Chest 2018; 153 : 105–113.
14. Gottlieb JE, Israel HL, Steiner RM, et al. Outcome in sarcoidosis. The realtionship of relapse to corticosteroid therapy. Chest 1997; 111 : 623–631.
15. McKinzie BP, Bullington WM, Mazur JE, Judson MA. Efficiancy of short - course, low-dose corticosteroid therapy for acute pulmonary sarcoidosis exacerbations. Am J Med Sci 2010; 339 : 1–4.
16. Martin K, Bentaberry F, Dumoulin C, et al. Peripherall neuropathy associated with leflunomide: is there a risk patient profile? Pharmacoepidemiol Drug Saf 2007; 16 : 74–78.
17. Drent M, Cremers JP, Jansen TL, Baughman RP. Practical eminence and experienca-based recommendations for use of TNF -alpha inhibitors i sarcoidosis. Carcoidosis Vasc Diffuse Lung Dis 2014; 31 : 91–107.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Hypoglykemie u nediabetiků
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2020 Číslo 7- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Intermitentní hladovění v prevenci a léčbě chorob
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Koagulopatie asociovaná s onemocněním COVID-19
- Současná diagnostika a terapie sarkoidózy
- Obštrukčné spánkové apnoe a arteriálna hypertenzia: úloha črevného mikrobiómu
- CAR T-lymfocyty: horká novinka v léčbě nádorů
- Renální selhání u mnohočetného myelomu a jeho léčba
- Kostní metabolismus u idiopatických střevních zánětů 2
- Metformin -asociovaná laktátová acidóza
- Tangierská nemoc v rodině s fenotypem familiární hypercholesterolemie
- Hypoglykemie u nediabetiků
- Screening a krátká intervence u uživatelů nelegálních drog
- Kostní metabolismus u idiopatických střevních zánětů 1
- Etické konotace léčby onemocnění covid-19
- Biomarkery pro neendoskopické vyšetření sliznice jícnu
- Riziko kardiovaskulárních komplikací v závislosti na hladině glykemie: od diabetes mellitus k prediabetu
- ERCP u pacientů po choledochoduodenoanastomóze
- Přidělovaná ošetřovatelská péče jako jeden z indikátorů výskytu medikačního pochybení
- Small bowel adenocarcinoma diagnosed by video capsule endoscopy in a patient with celiac disease: a case report and review of literature
- Raritní koincidence chylothoraxu a hydrothoraxu při adenokarcinomu žaludku – kazuistika
- Muž s dysthymií (převážně negativním hodnocením všeho prožitého) indukoval depresi u senzitivní blízké osoby
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Hypoglykemie u nediabetiků
- Metformin -asociovaná laktátová acidóza
- Koagulopatie asociovaná s onemocněním COVID-19
- CAR T-lymfocyty: horká novinka v léčbě nádorů
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




