-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Optimální hladina kalia u pacientů se srdečním selháním
Optimal potassium levels in patients with heart failure
Heart failure therapy involves the use of a number drugs that significantly affect potassium levels. While diuretics decrease potassium levels, others (angiotensin converting enzyme inhibitors, AT2 receptor blockers, sacubitril/valsartan, spironolactone) increase. Patients also have several comorbidities that can significantly reduce renal function and thus affect the resulting potassium level. Decreased or elevated potassium levels can be very dangerous for the patient and therefore need to be monitored. In recent years, the results of several studies have been published that have focused on potassium levels and mortality and have shown that the optimal potassium levels in patients with heart failure should be between 4–5 mmol/L.
Keywords:
heart failure – mortality – optimal level of kalemia – potassium
Autori: Radek Pudil
Pôsobisko autorov: 1. interní kardioangiologická klinika LF UK a FN Hradec Králové
Vyšlo v časopise: Vnitř Lék 2021; 67(8): 459-464
Kategória:
Súhrn
Terapie srdečního selhání zahrnuje používání řady léků, které významně ovlivňují hladinu draslíku. Zatímco diuretika hladinu draslíku snižují, jiné léky (inhibitory angiotenzin konvertujícího enzymu, blokátory AT2 receptorů, sakubitril/valsartan, spironolakton) naopak zvyšují. Pacienti mají rovněž řadu komorbidit, které mohou významně snížit renální funkce, a tedy ovlivnit výslednou hladinu draslíku. Snížená nebo naopak zvýšená hladina draslíku může být pro pacienta velmi nebezpečná, a proto je potřeba ji sledovat. V posledních letech byly publikovány výsledky řady studií, které analyzovaly vztah hladiny draslíku a mortality u nemocných se srdečním selháním a prokázaly, že optimální hladina draslíku by se v této skupině pacientů měla pohybovat v rozmezí 4–5 mmol/.
Klíčová slova:
mortalita – srdeční selhání – draslík – optimální hladina kalemie
Úvod
Srdeční selhání je patří mezi velmi častá onemocnění, podle posledních údajů dosahuje jeho prevalence 1–2 % celé populace v evropských zemích, má relativně vysokou incidenci (3 na 1000 dospělých a rok) a mortalitu (1). Základem jeho terapie je kombinace farmakologických a nefarmakologických přístupů, které vedou ke snížení morbidity, mortality a zlepšení kvality života těchto pacientů. I přes pokroky v léčbě srdečního selhání se hledají další cesty, jak zlepšit prognózu těchto pacientů. Jednou z oblastí, která je v posledních 5 letech intenzivně studována, je problematika určení optimální hladiny draslíku v této skupině pacientů. Ukazuje se, že tato oblast je velmi důležitá z několika hledisek: a) snížená nebo zvýšená hladina draslíku může vést ke vzniku potenciálně smrtících arytmií, b) terapie srdečního selhání je založena na použití léků, které významně ovlivňují hladinu kalemie oběma směry (diuretika, léky zasahující do systému renin‑angiotenzin‑aldosteron) a c) v neposlední řadě relativně vysoký výskyt komorbidit, které mohou významně ovlivnit hladinu kalia.
Proto byla v posledních letech publikována řada studií zaměřených na určení optimální hladiny kalemie s ohledem na prognózu pacientů se srdečním selháním.
Draslík a jeho role v organismu
Draslík byl poprvé v čisté podobě izolován sirem Humphry Davisem elektrolyticky v roce 1807 a byl označen slovem potassium, které odvodil od slova potaš (potash) odkazujícího se na předchozí způsob získávání draselných solí odpařováním z popela spáleného dřeva umístěného do nádoby (angl. „pot“ a „ash“) (2). Nezbytnost draslíku pro fyziologický růst byla potvrzena v roce 1923 Millerem (3). V roce 1942 bylo poprvé popsáno poškození myokardu při hypokalemii (4). V roce 1957 byl objeven základní mechanismus transmembránové výměny sodíku a draslíku – Na+/K+-ATPáza (5).
Celkové množství draslíku v lidském těle se pohybuje mezi 100–150 g, přičemž jeho absolutní množství závisí na aktivní svalové hmotě, která je jeho hlavním zdrojem. Draslík je hlavním intracelulárním kationtem. Intracelulární podíl kalia v organismu dosahuje 98 % hodnoty celkového množství a jeho intracelulární koncentrace se pohybuje v rozmezí 100–140 mmol/l. Extracelulární podíl kalia se pohybuje kolem 2 %, jeho koncentrace se pohybuje v rozmezí 3,6–5,2 mmol/l. Zatímco většina intracelulárního draslíku se váže na makromolekulární struktury, hlavně na polysacharidy a bílkoviny, extracelulární draslík je prakticky zcela ionizován (kation K+).
Mezi základní role draslíku v těle patří: udržování osmotického tlaku (společně s natriem, fosfáty a bílkovinami), je klíčovým prvkem pro udržování elektrofyziologické stability buněk, kdy ovlivňuje dráždivost a kontraktilitu, má význam pro stabilitu buněčných membrán nervové soustavy, je nezbytný pro správnou funkci řady enzymů (např. pyruvátkinázy), má význam pro růst a dělení buněk, hraje významnou roli v udržování acidobazické rovnováhy, je nezbytný pro metabolismus glukózy a syntézu glykogenu.
Ke vstřebávání draslíku do těla dochází v horních částech trávicího traktu pasivním mechanismem. V oblasti tračníku dochází v závislosti na celkovém obsahu draslíku v těle jak k resorpci, tak sekreci v případě jeho nadbytku.
Na úrovni buněk má hlavní roli v transportu kalia do nitra buňky sodíko‑draslíková pumpa (Na+/K+-ATPáza), která umožňuje směnu 2 kationtů draslíku do nitra buňky za 3 kationty sodíku, které směřují vně buňky. Tato pumpa je lokalizována na všech buněčných membránách, které mají elektrickou aktivitu (svalové a nervové buňky). Hlavní funkcí je stabilizace klidového rozložení iontů, resp. klidového membránového potenciálu.
Vylučování draslíku ledvinami je komplexní děj. V proximálním tubulu je draslík vylučován funkcí Na+/K+-ATPázy, v tlustém raménku Henleovy kličky je vylučování draslíku závislé na správné funkci několika membránových kanálů: NKCC2 („furosemid‑senzitivní“) kanál, ROMK či ClC‑Kb kanál. V distálních částech tubulu je to pak ROMK kanál a dále NCCT („thiazid‑senzitivní“) kanál. Z hlediska kvantity je největší množství K+ transportováno v kortikální části sběrných kanálků, kde kromě ROMK kanálu se K+ směňuje K+/Cl- kotransportem a K+/H+ směnou; současně je zde aktivní i Na+/K+-ATPázová pumpa (6).
Udržení optimální koncentrace draslíku v intra - a extracelulárním prostoru je zásadní. Hlavní roli má Na+/K+-ATPázová pumpa. Na udržení optimální koncentrace mezi intra - a extracelulárním prostorem mají vliv některé významné faktory. Aktivitu Na+/K+-ATPázy ovlivňuje kalemie, aldosteron, inzulin a katecholaminy. Vstup draslíku do buňky zvyšuje inzulin, beta-2 adrenergní stimulace, alkalické pH a glukóza. Následkem může být pokles kalemie. Naopak acidóza či katabolismus zvyšují hladinu extracelulárního kalia.
Hypokalemie a její rizika u nemocných se srdečním selháním
Hypokalemie je definovaná snížením hladiny kalia v periferní krvi pod hodnotu 3,5 mmol/l. Mezi hlavní příčiny hypokalemie patří:
snížení příjmu kalia v důsledku dlouhodobého hladovění, nedostatečné suplementace kalia,
zvýšený přesun do buněk v důsledku alkalózy, zvýšené hladiny inzulinu, aktivace β‑adrenergních receptorů (β‑mimetika, stres), hypokalemická periodická paralýza, zvýšená syntéza buněk (anabolismus, leukemie), hypotermie a další,
zvýšené ztráty do zažívacího traktu v důsledku průjmů, sekrece střevními píštělemi, při nadužívání laxativ, při vilózních adenomech a podobně,
zvýšenými ztrátami ledvinami v důsledku používání diuretik, primárního hyperaldosteronismu, ztrát žaludečních tekutin zvracením, v důsledku metabolické acidózy (diabetická ketoacidóza, renální tubulární acidóza, některých onemocnění ledvin (Bartterova a Gitelmanova syndromu), hypomagnezemie, polyurie,
zvýšené ztráty potem,
dialýza,
hemodialýza či plazmaferéza (pokud se jako náhradní roztok používal albumin).
Pro kardiologické pacienty je relevantní především chronické používání diuretik, dlouhodobě snížený příjem potravy v pokročilých stadiích srdečního selhání, nedostatečná suplementace kalia v případě používání diuretiky, z dalších faktorů se může uplatnit zvýšená hladina katecholaminů, která provází chronické srdeční selhání.
Klinická manifestace hypokalemie zahrnuje široké spektrum příznaků, mezi které patří kardiální, neuromuskulární, metabolické, renální a endokrinní symptomy, které sumarizuje tabulka 1.
Tab. 1. Hypokalemie – klinická manifestace. 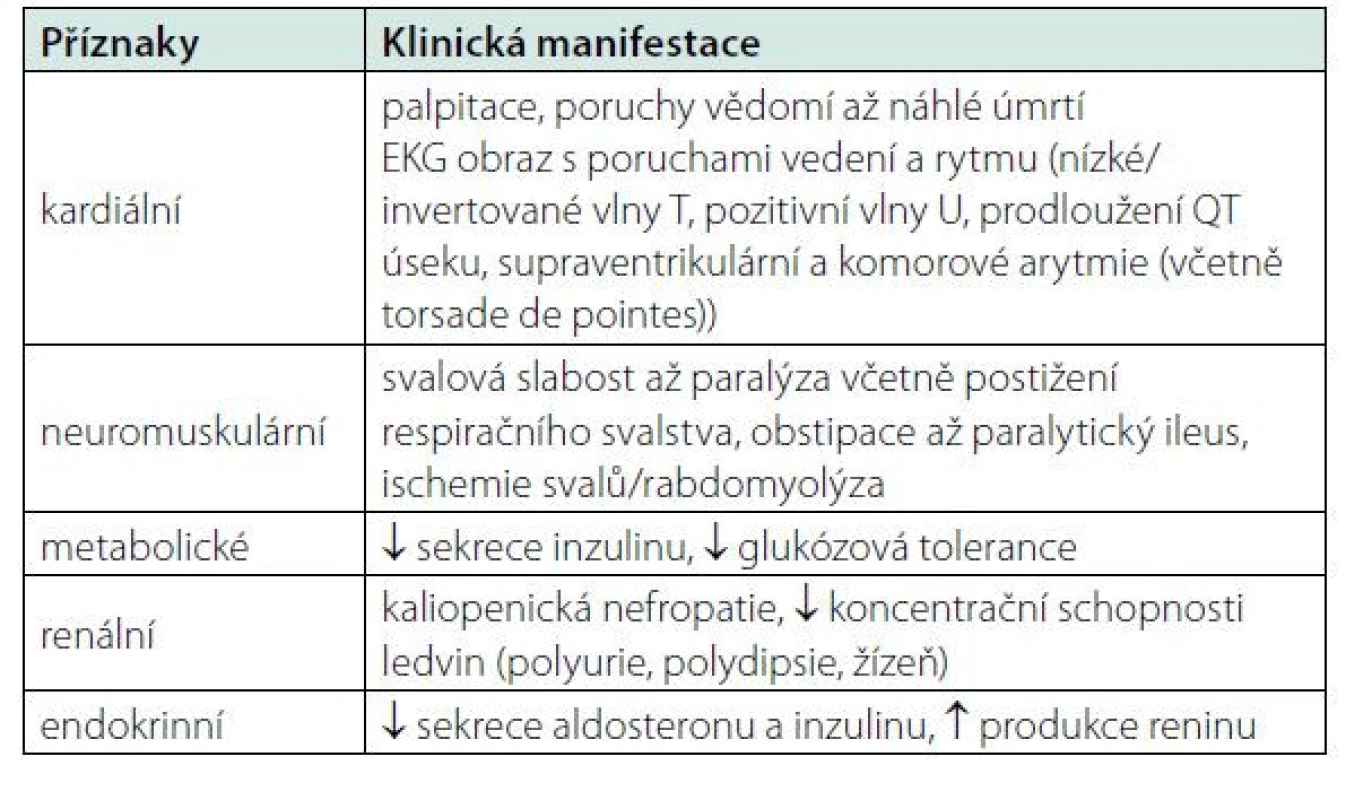
Při diagnostice hypokalemie je nutné věnovat pozornost anamnéze (detekce vyvolávajících příčin), při laboratorní diagnostice je nutné věnovat pozornost nejenom hladině kalia, ale také ostatních minerálů (magnezia) a stavu acidobazické rovnováhy. Při posouzení renální a extrarenální etiologie významně pomůže vyšetření kaliurie (hodnota pod 20 mmol/24 hod. svědčí pro extrarenální příčinu).
U nemocných se srdečním selháním může mít hypokalemie fatální následky. Mezi její hlavní patofyziologické mechanismy uplatňující se u nemocných s hypokalemií a srdečním selháním patří vznik hypokalemií indikovaných komorových arytmií. Nedávné experimentální studie naznačují, že hypokalemií vyvolané arytmie jsou iniciovány sníženou aktivitou Na+/K+-ATPázy, což následně vede k přetížení Ca2+, aktivaci Ca2+/kalmodulin‑dependentní kinázy II a rozvoji následných depolarizací. Výsledkem je nárůst výskytu především komorových extrasystol a komorových tachyarytmií, které mohou být příčinou smrti pacienta (7). Hlavními mechanismy vzniku komorových arytmií jsou arytmie vzniklé na podkladě abnormální automacie (spouštěné aktivity při časné či opožděné následné depolarizaci) a arytmie vznikající na podkladě návratného vzruchu (reentry arytmie).
Ukazuje se, že riziko těchto arytmií významně stoupá již při poklesu kalemie pod 4 mmol/l (8, 9). Mezi hlavní příčiny hypokalemie v této skupině nemocných patří používání diuretik a aktivace systému renin‑angiotenzin‑aldosteron (RAAS), které způsobují zvýšené ztráty kalia močí (10, 11). Dalším mechanismem je zvýšený přesun kalia do intracelulárního prostoru v důsledku chronicky zvýšené aktivity sympatického nervového systému (12). U některých nemocných se srdečním selháním se může podílet také diluční efekt (10).
U nemocných se srdečním selháním může hypokalemie významně měnit bezpečnostní profil medikace. Toto platí především pro digitalis, který sice nepatří mezi základní léky pro terapii srdečního selhání, avšak při hypokalemii dochází ke zvýšení toxických projevů.
V terapii hypokalemie u nemocných se srdečním selháním se uplatňuje několik přístupů: suplementace kalia, úprava medikace (použití kalium šetřících diuretik, antagonistů mineralokortikoidních receptorů, zvýšení dávky inhibitorů angiotenzin konvertujícího enzymu/sartanů či u nemocných se srdečním selháním sakubitrilu/valsartanu), vždy je nutné odstranění vyvolávající příčiny.
V případě výskytu arytmií typu torsade de pointes při hypokalemii je nutná korekce kalemie (s opatrností intravenózně), podání magnezium sulfátu, případně izoproterenolu či dočasná srdeční stimulace s cílem zvýšení srdeční frekvence.
Hyperkalemie a její rizika u nemocných se srdečním selháním
Hyperkalemie je definovaná zvýšením hladiny kalia v periferní krvi nad hodnotu 5,2 mmol/l. Mezi její hlavní příčiny patří:
retence draslíku:
v důsledku zvýšeného příjmu (infuze s K+, transfuze krve, při významně snížené funkci ledvin v důsledku zvýšeného příjmu potravou),
při snížení eliminace ledvinami: při oligurické fázi selhání ledvin, v důsledku snížené sekrece při tubulárních poruchách ledvin (buňky nejsou citlivé na aldosteron), při hypokortikalismu či neúměrném podávání K+ šetřících diuretik,
přesun draslíku z buněk do ECT (distribuční hyperkalemie):
rozpad buněk (crush syndrom, nekrotický rozpad, hemolýza, extrémní zátěž),
acidóza (výměna K+ za H+), hyperosmolarita, katabolismus, deficitu inzulinu (podporuje přesun K+do buněk), podávání β‑blokátorů (antagonizují působení adrenalinu).
Pod pojmem pseudohyperkalemie rozumíme falešné zvýšení hladiny kalia při nesprávném odběru krve při dlouhotrvající venostáze (dlouhé zaškrcení, hemolýza krve) či po delším cvičení.
Klinická manifestace zahrnuje řadu nespecifických příznaků (svalová slabost, únava, nevýkonnost). Svalová slabost může imitovat syndrom Guillain‑Barré. EKG změny jsou velmi časté a nemusí korelovat s tíží hyperkalemie. Patří mezi ně vysoké, úzké hrotnaté vlny T spolu, zkrácení QT intervalu, vlna P je často nízká, může absentovat (elektrokardiogram pak imponuje jako junkční rytmus), prodlužuje se PR interval, mohou se objevit AV blokády, QRS komplex je často rozšířený, může se objevit obraz poruchy vedení v Tawarových raménkách. Obraz může ústit ve vznik komorových arytmií (komorové tachykardie a fibrilace komor) či asystolie vedoucí k náhlé smrti.
Terapie hyperkalemie
Při terapii hyperkalemie je doporučeno zhodnotit stav pacienta, zhodnotit 12svodové EKG, zajistit monitoraci pacienta, vyloučit pseudohyperkalemii. V případě mírné hyperkalemie (5,5–5,9 mmol/l) je na místě odstranění vyvolávající příčiny, případně podání kalcia resonia (např. 4 x 15 g per os nebo 2 x 30 g per rectum). V případě středně závažné hyperkalemie (6–6,4 mmol/l) je třeba monitorovat klinický stav, elektrokardiogram (monitorace nemocného). V případě změn na EKG (hrotnaté vlny T, ploché/nepřítomné vlny P, široké QRS komplexy, AV rytmy, bradykardie, komorová tachykardie) nebo závažné hyperkalemie (K+ ≥ 6,5 mmol/l) je indikováno intravenózní podání kalcia (10 ml 10% kalcium chlorid nebo 30 ml 10% kalcium gluconicum), opakovat EKG a sledovat klinický stav. Pokud změny přetrvávají, je na místě podání intravenózní infuze glukózy s inzulinem – glukóza (25 g) s 10 IU krátkodobého inzulinu během 15 minut nebo 125 ml 20% glukózy. Současně je doporučována nebulizace 10–20 mg salbutamolu. V případě přetrvávání stavu je na místě provedení hemodialýzy.
Hyperkalemie u nemocných se srdečním selháním
Mezi nejčastější příčiny hyperkalemie u pacientů se srdečním selháním patří medikace léky zasahujícími do systému renin‑angiotenzin‑aldosteron: inhibitory angiotenzin‑konvertujícího enzymu (ACEi), blokátory AT1 receptorů (ARB) či sakubitril/valsartan způsobují hyperkalemii inhibicí sekrece aldosteronu zprostředkované angiotenzinem‑II nadledvinami. Současně ovlivňují průtok krve ledvinami (způsobují eferentní arteriolární vazodilataci, která vede ke snížení glomerulární filtrace). Antagonisté mineralokortikoidních receptorů (MRA) přímo blokují sekreci aldosteronu a tím snižují exkreci draslíku, následkem může být hyperkalemie (13, 14). Metanalýza 39 studií přinesla data o frekvenci hyperkalemie při terapii léky ovlivňujícími RAAS, kdy při medikaci jedním lékem je výskyt hyperkalemie (definované jako K+ ≥ 5,5 mmol/l) pod 2 %, avšak u nemocných s poruchou funkce ledvin či při terapii dvěma léky této skupiny se výskyt hyperkalemie pohybuje mezi 5–10 % (14). V této skupině pacientů je doporučeno věnovat se prevenci vzniku hyperkalemie. Zásadní roli zde má monitorace hladin kalia a renálních funkcí při ambulantních kontrolách a úprava terapie diuretiky a léky zvyšujícími hladinu kalia (ACEi, ARB, sakubutril/valsartan a MRA). Diuretika významně zvyšují exkreci draslíku ledvinami a jsou relativně dobře tolerována. U nemocných se zachovalými renálními funkcemi upřednostňujeme thiazidy nebo thiazidům podobná diuretika, u nemocných se snížením glomerulární filtrace (< 30–40 ml/min) upřednostňujeme kličková diuretika. Současně sledujeme celkovou hydrataci organismu (nadměrné snížení hydratace je spojeno s prerenálním snížením glomerulární filtrace, které je provázeno snížením exkrece draslíku). Další možností je snížení dávkování či vynechání terapie léky zvyšujícími hladinu kalia.
Optimální hodnota kalemie u nemocných se srdečním selháním
V posledních letech se objevila řada studií analyzujících vztah hodnoty kalemie k prognóze pacientů se srdečním selháním. Výsledkem těchto studií je doporučení optimální hladiny kalemie u nemocných se srdečním selháním, která je spojena s nejlepší prognózou.
Aldahl M et al. provedli analýzu vztahu kalemie a celkové mortality v souboru 19 549 pacientů se srdečním selháním, kteří byli léčeni diuretiky a léky ovlivňujícími systém RAAS alespoň 3 měsíce. Studie ukázala, že nejenom hladiny kalemie pod 3,5 mmol/l a nad 5 mmol/l, ale také hladiny, které leží ještě v rámci normálního laboratorního rozmezí (3,5–4,1 mmol/l a 4,8–5,0 mmol/l), jsou spojeny s významným zvýšením krátkodobého rizika úmrtí u pacientů s chronickým srdečním selháním. Studie uzavírala, že nejlepší prognózu měli pacienti, jejichž kalemie se pohybovala v rozmezí 4,1–4,8 mmol/l (9). Další studii analyzující vztah mortality a hladiny kalemie u pacientů se srdečním selháním provedli Linde C et al (15). Retrospektivní analýza byla provedena v souboru 21 334 pacientů se srdečním selháním a ukázala, že vztah mortality a hladiny kalia u nemocných se srdečním selháním má tvar písmene U, s nejnižší mortalitou při kalemii mezi 4–5 mmol/l.
Komplexní rozsáhlou analýzu vztahu mortality kalemie u pacientů se srdečním selháním včetně nejčastějších komorbidit (diabetu a renálního selhání) provedl Collins AJ et al (16). Tato analýza byla velmi robustní a zahrnovala data ze souboru zahrnujícího 911 698 pacientů se srdečním selháním, diabetem a selháním ledvin. Doba sledování byla 18 měsíců. I v tomto souboru měl vztah kalemie a mortality tvar písmene U, a to pro všechny skupiny pacientů s optimální kalemií v intervalu 4,0–5,0 mmol/l.
Podobná data přinesly i další studie, jejichž výsledky jsou uvedeny v tabulce 2.
Tab. 2. Kalemie a mortalita v observačních studiích u pacientů se srdečním selháním. Upraveno podle Ferreiry et al. (22) 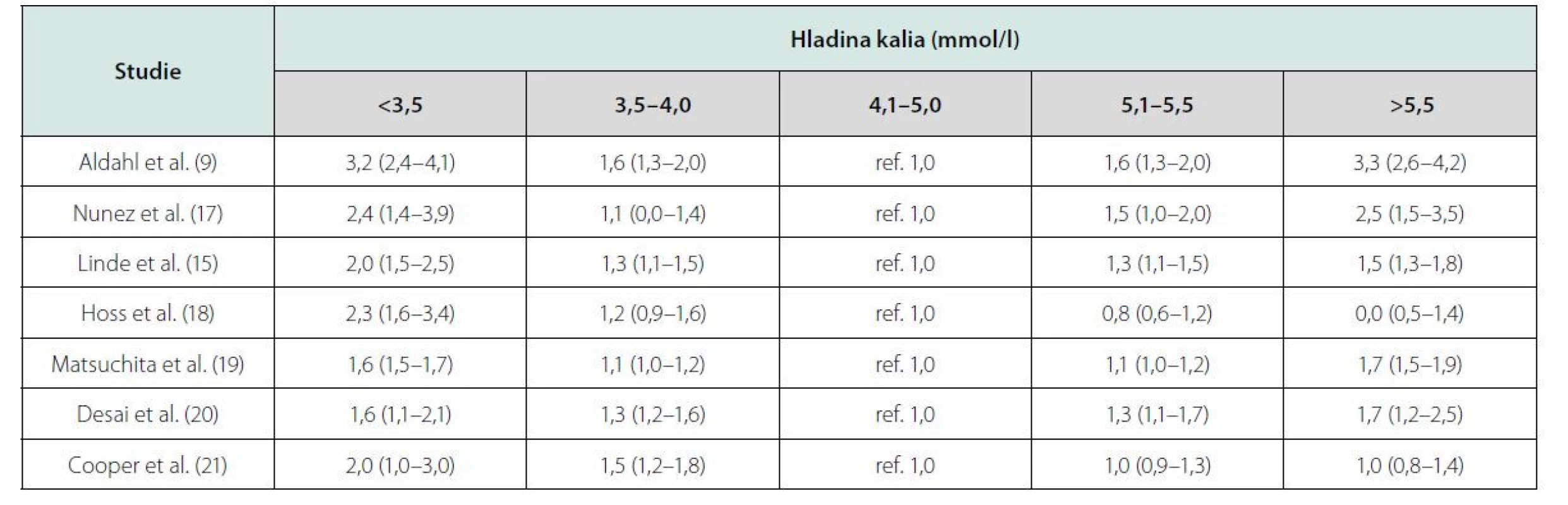
Na základě těchto výsledků Ferreira JP et al. přinesli doporučení pro běžnou praxi (22). Jejich analýza výše uvedených studií prokázala, že tzv. relativní hypokalemie (K+: 3,5–4,0 mmol/l) je stejně riziková jako hyperkalemie (K+: 5,5–6 mmol/l) a podle jejich doporučení je u nemocných se srdečním selháním nutné udržovat hladinu kalemie mezi 4–5 mmol/l. V užším slova smyslu pak za „kalemické optimum“ můžeme považovat hodnoty K+ 4,3–4,5 mmol/l, jak plyne z křivek závislostí rizika na hodnotě kalemie (9, 15, 16).
Závěr
U nemocných se srdečním selháním je hladina draslíku v krvi velmi úzce spojena s mortalitou. Ukazuje se, že křivka mortality a hladiny draslíku má tvar písmene U a že nejnižší mortalitu mají pacienti s hladinou draslíku mezi 4 a 5 mmol/l. Tyto výsledky naznačují, že normální laboratorní rozmezí pro hodnoty kalia by nemuselo ve vztahu k mortalitě platit přinejmenším v rozmezí 3,5–4,0 mmol/l). Z těchto výsledků vyplývá nutnost pravidelných kontrol kalemie u nemocných se srdečním selháním, především pak v situaci, kdy jsou tito nemocní léčeni léky, které významně ovlivňují hladinu kalemie oběma směry a mají navíc řadu komorbidit, které mohou ovlivňovat renální funkce, a tedy i hladinu kalia. Proto je velmi aktuální doporučení pravidelných kontrol hladiny draslíku u nemocných se srdečním selháním, ale také před zahájením a s určitým odstupem i po zahájení terapie hladinu draslíku ovlivňujícími léky (1). Při hladinách nižších, než je „kalemické optimum“, je vedle léků majících vliv na hladinu draslíku doporučována intervence v podobě suplementace Rx přípravkem s obsahem kalia (1).
Obr. 1. Vztah kalemie a relativního rizika mortality u pacientů se srdečním selháním. Plná čára – relativní riziko, přerušované čáry vymezují 95% konfidenční interval. Upraveno podle Ferreiry et al. (22) 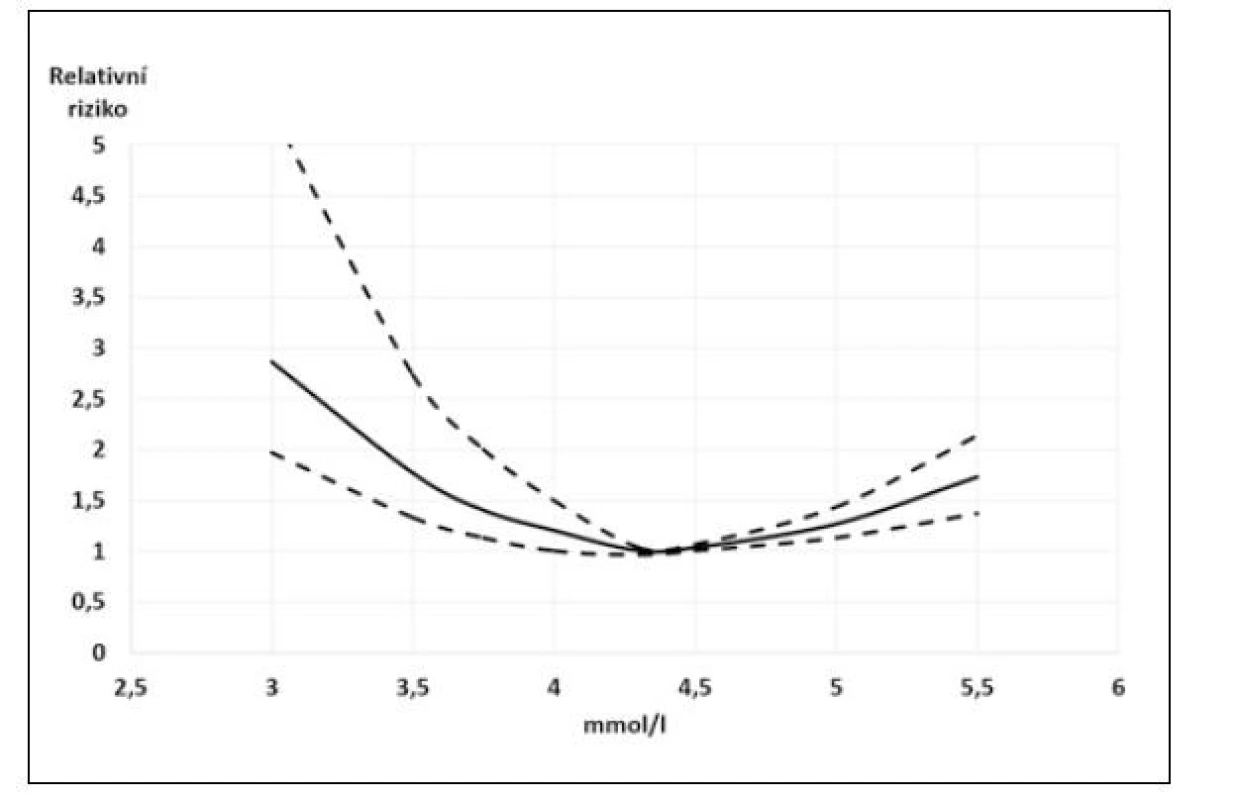
Práce byla podpořena výzkumným projektem AZV NV19-02-00297.
KORESPONDENČNÍ ADRESA AUTORA:
prof. MUDr. Radek Pudil, Ph.D.
Interní kardioangiologická klinika LFUK a FN Sokolská 581, 500 05 Hradec Králové
Cit. zkr: Vnitř Lék 2021; 67(8): 459–464
Článek přijat redakcí: 4. 11. 2021
Článek přijat po recenzích: 6. 11. 2021
Zdroje
LITERATURA 1. McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, Bohm M, Burri H, Butler J, Celutkiene J, Chioncel O, Cleland JGF, Coats AJS, Crespo‑Leiro MG, Farmakis D, Gilard M, Heymans S, Hoes AW, Jaarsma T, Jankowska EA, Lainscak M, Lam CSP, Lyon AR, McMurray JJV, Mebazaa A, Mindham R, Muneretto C, Francesco Piepoli M, Price S, Rosano GMC, Ruschitzka F, Kathrine Skibelund A, Group ESCSD. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021;42(36):3599–3726.
2. Siegfierd R. The Discovery of Potassium and Sodium, and the Problem of the Chemical Elements. Isis. 1963;54 : 247–258.
3. Miller HG. Potassium in animal nutrition, potassium in its relation to the growth of young rats. Jour Biol Chem. 1923;55 : 61–78.
4. Follis RH O‑KE, McCollum EV. The Production of Cardiac and Renal Lesions in Rats by a Diet Extremely Deficient in Potassium. Am J Pathol. 1942;18(1):29–39.
5. Skou JC. The influence of some cations on an adenosine triphosphatase from peripheral nerves. Biochim Biophys Acta. 1957;23(2):394–401.
6. Rysava R. Hypokalémie. Interní Med. 2006;9 : 385–388.
7. Skogestad J, Aronsen JM. Hypokalemia‑Induced Arrhythmias and Heart Failure: New Insights and Implications for Therapy. Front Physiol. 2018;9 : 1500.
8. Bowling CB, Pitt B, Ahmed MI, Aban IB, Sanders PW, Mujib M, Campbell RC, Love TE, Aronow WS, Allman RM, Bakris GL, Ahmed A. Hypokalemia and outcomes in patients with chronic heart failure and chronic kidney disease: findings from propensity‑matched studies. Circ Heart Fail. 2010;3(2):253–260.
9. Aldahl M, Jensen AC, Davidsen L, Eriksen MA, Moller Hansen S, Nielsen BJ, Krogager ML, Kober L, Torp‑Pedersen C, Sogaard P. Associations of serum potassium levels with mortality in chronic heart failure patients. Eur Heart J. 2017;38(38):2890–2896.
10. Leier CV, Dei Cas L, Metra M. Clinical relevance and management of the major electrolyte abnormalities in congestive heart failure: hyponatremia, hypokalemia, and hypomagnesemia. Am Heart J. 1994;128(3):564–574.
11. Osadchii OE. Mechanisms of hypokalemia‑induced ventricular arrhythmogenicity. Fundam Clin Pharmacol. 2010;24(5):547–559.
12. Packer M. Potential role of potassium as a determinant of morbidity and mortality in patients with systemic hypertension and congestive heart failure. Am J Cardiol. 1990;65(10):45E–51E; discussion 52E.
13. Sidhu K, Sanjanwala R, Zieroth S. Hyperkalemia in heart failure. Curr Opin Cardiol. 2020;35(2):150–155.
14. Weir MR, Rolfe M. Potassium homeostasis and renin‑angiotensin‑aldosterone system inhibitors. Clin J Am Soc Nephrol. 2010;5(3):531–548.
15. Linde C, Qin L, Bakhai A, Furuland H, Evans M, Ayoubkhani D, Palaka E, Bennett H, McEwan P. Serum potassium and clinical outcomes in heart failure patients: results of risk calculations in 21 334 patients in the UK. ESC Heart Fail. 2019;6(2):280–290.
16. Collins AJ, Pitt B, Reaven N, Funk S, McGaughey K, Wilson D, Bushinsky DA. Association of Serum Potassium with All‑Cause Mortality in Patients with and without Heart Failure, Chronic Kidney Disease, and/or Diabetes. Am J Nephrol. 2017;46(3):213–221.
17. Nunez J, Bayes‑Genis A, Zannad F, Rossignol P, Nunez E, Bodi V, Minana G, Santas E, Chorro FJ, Mollar A, Carratala A, Navarro J, Gorriz JL, Lupon J, Husser O, Metra M, Sanchis J. Long‑Term Potassium Monitoring and Dynamics in Heart Failure and Risk of Mortality. Circulation. 2018;137(13):1320–1330.
18. Hoss S, Elizur Y, Luria D, Keren A, Lotan C, Gotsman I. Serum Potassium Levels and Outcome in Patients With Chronic Heart Failure. Am J Cardiol. 2016;118(12):1868-1874.
19. Matsushita K, Sang Y, Yang C, Ballew SH, Grams ME, Coresh J, Molnar MZ. Dyskalemia, its patterns, and prognosis among patients with incident heart failure: A nationwide study of US veterans. PLoS One. 2019; 14(8): e0219899.
20. Desai AS, Liu J, Pfeffer MA, Claggett B, Fleg J, Lewis EF, McKinlay S, O‘Meara E, Shah SJ, Sweitzer NK, Solomon S, Pitt B. Incident Hyperkalemia, Hypokalemia, and Clinical Outcomes During Spironolactone Treatment of Heart Failure With Preserved Ejection Fraction: Analysis of the TOPCAT Trial. J Card Fail. 2018;24(5):313–320.
21. Cooper LB, Hammill BG, Peterson ED, Pitt B, Maciejewski ML, Curtis LH, Hernandez AF. Consistency of Laboratory Monitoring During Initiation of Mineralocorticoid Receptor Antagonist Therapy in Patients With Heart Failure. JAMA. 2015;314(18):1973–1975.
22. Ferreira JP, Butler J, Rossignol P, Pitt B, Anker SD, Kosiborod M, Lund LH, Bakris GL, Weir MR, Zannad F. Abnormalities of Potassium in Heart Failure: JACC State‑of‑the‑Art Review. J Am Coll Cardiol. 2020;75(22):2836–2850.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2021 Číslo 8- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Intermitentní hladovění v prevenci a léčbě chorob
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Problematika antibiotické léčby u pacientů s covidem-19
- Aktivní vyhledávání a časná diagnostika HCV infikovaných osob
- Optimální hladina kalia u pacientů se srdečním selháním
- Lokalizovaná (unicentrická) forma Castlemanovy nemoci. Klinické projevy, diagnostika a léčba
- Glifloziny – nové léky pro pacienty se srdečním selháním?
- Renoparenchymatózní hypertenze – aktuality v diagnostice a léčbě
- Oboustranné vícečetné pneumatokély jako vzácná pozdní komplikace pneumonie covid-19
- Jaká jsou specifika syndromu diabetické nohy a proč potřebujeme mezioborová doporučení pro jeho diagnostiku a léčbu?
- Expertní konsenzus k významu deficitu železa a možnosti jeho korekce u pacientů se srdečním selháním
- Memorandum z jednání zástupců ČIS a ČPFS dne 6. 5. 2021 v Lékařském domě ČLS JEP v Praze
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Renoparenchymatózní hypertenze – aktuality v diagnostice a léčbě
- Glifloziny – nové léky pro pacienty se srdečním selháním?
- Optimální hladina kalia u pacientů se srdečním selháním
- Problematika antibiotické léčby u pacientů s covidem-19
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



