-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
D-laktátová acidóza – zriedkavá komplikácia syndrómu krátkeho čreva
D-lactic acidosis – a rare complication of short bowel syndrome
D-lactic acidosis represents a rare form of metabolic acidosis that occurs most commonly in patients with short bowel syndrome. This is a serious, sometimes life-threatening complication. The cause is the accumulation of D-lactate in the body, which is formed in excessive amounts by fermentation of unabsorbed carbohydrates by the intestinal microbiota. The nervous system is predominantly affected, which also results in clinical manifestations. The clinical picture is dominated by a wide range of non-specific neurological symptoms. The disease can sometimes manifest as somnolence to coma. From the aspect of laboratory diagnostics, the disease is characterized by severe metabolic acidosis with an increased anion gap. In this case report, we present a unique case of a 54-year-old woman with Crohn’s disease and short bowel syndrome who in a short time was repeatedly hospitalized for recurrence of severe metabolic acidosis with severe impaired consciousness. Based on the evaluation of anamnestic data, clinical picture and laboratory tests, the patient was diagnosed with D-lactic acidosis. In the discussion we discuss the individual steps that led to this diagnosis and compare our experience with data in the world literature.
Keywords:
short bowel syndrome – D-lactic acidosis – encephalopathy
Autori: Vladimír Podušel 1; Simona Morgošová 1; Pavol Majdák 1; Jurina Sadloňová 2
Pôsobisko autorov: Interné oddelenie, NsP Prievidza so sídlom v Bojniciach 1; I. interná klinika Jesseniovej lekárskej fakulty UK a Univerzitnej nemocnice v Martine 2
Vyšlo v časopise: Vnitř Lék 2021; 67(E-5): 28-33
Kategória: Kazuistika
Súhrn
D-laktátová acidóza reprezentuje zriedkavú formu metabolickej acidózy, ktorá sa vyskytuje najčastejšie u pacientov so syndrómom krátkeho čreva. Ide o závažnú, niekedy až život ohrozujúcu komplikáciu. Príčinou je akumulácia D-laktátu v organizme, ktorý vzniká v nadmernom množstve fermentáciou nevstrebaných sacharidov mikrobiotou hrubého čreva.
Predominantne býva postihnutý nervový systém, z čoho vyplýva aj klinická manifestácia. V klinickom obraze dominuje široká škála nešpecifických neurologických príznakov. Ochorenie sa môže niekedy manifestovať somnolenciou až kómou. Z aspektu laboratórnej diagnostiky ochorenie charakterizuje ťažká metabolická acidóza so zvýšenou aniónovou medzerou. V tejto kazuistike prezentujeme ojedinelý prípad 54-ročnej ženy s Crohnovou chorobou a syndrómom krátkeho čreva, ktorá bola v krátkom čase opakovane hospitalizovaná pre recidívu ťažkej metabolickej acidózy so závažnou poruchou vedomia. Na základe zhodnotenia anamnestických údajov, klinického obrazu a laboratórnych vyšetrení bola pacientke diagnostikovaná D-laktátová acidóza. V diskusii rozoberáme jednotlivé kroky, ktoré viedli k tejto diagnóze a porovnávame našu skúsenosť s údajmi vo svetovej literatúre.
Klíčová slova:
syndróm krátkeho čreva – D-laktátová acidóza – encefalopatia
Úvod
Syndróm krátkeho čreva (short bowel syndrome, SBS) predstavuje sekundárny malabsorpčný syndróm, ktorý je dôsledkom funkčnej alebo anatomickej straty absorpčného povrchu sliznice tenkého čreva z rôznych príčin (1, 2). Z narastajúcej incidencie SBS rezultuje stúpajúci výskyt následných komplikácií. Závažnou a menej známou komplikáciou SBS je raritná forma metabolickej acidózy, tzv. D-laktátová acidóza (D-LA). Ide o acidózu spôsobenú D-laktátom, ktorý vzniká fermentáciou nevstrebaných sacharidov mikrobiotou hrubého čreva (3, 4).
V ľudskom organizme sa laktát vyskytuje vo forme dvoch izomérov – D a L izomér (5, 6). V klinickej praxi sa štandardne využíva len vyšetrenie hladiny L-laktátu, ktorý je markerom anaerobného metabolizmu (hypoxia, sepsa, multiorgánové zlyhanie, intoxikácia metformínom, šok a iné). Rutínne laboratórne testy na vyšetrenie hladiny D-laktátu nie sú k dispozícii vzhľadom na obmedzené klinické využitie. Z toho vyplýva aj nemožnosť priamej laboratórnej diagnostiky D-laktátovej acidózy v podmienkach bežnej klinickej praxe (7).
U pacientov so SBS sa v dôsledku rozsiahlej resekcie tenkého čreva dostáva veľké množstvo nevstrebaných sacharidov do hrubého čreva, kde vytvárajú substrát pre črevné baktérie. Pôsobením črevnej mikrobioty dochádza k ich fermentácii za vzniku veľkého množstva organických kyselín (predovšetkým acetát, propionát a butyrát). Tieto organické kyseliny znižujú intraluminálne pH, čím dochádza k prerastaniu acidorezistentných baktérií v hrubom čreve, ktoré sú zodpovedné za produkciu laktátu, v prevažnej miere D-laktátu a ktorý sa následne absorbuje sliznicou čreva do krvi. Vzhľadom na obmedzené možnosti jeho metabolizovania v pečeni nastáva hromadenie D-laktátu v organizme (7). Akumulovaný D-izomér kyseliny mliečnej predilekčne poškodzuje CNS, zatiaľ nie presne známym mechanizmom. Predpokladá sa, že plní funkciu falošného neurotransmitera (8). Avšak nie u všetkých pacientov so SBS vznikne D-LA. Patomechanizmus je pomerne zložitý a existuje viacero predisponujúcich faktorov jej vzniku – množstvo a druh požitých sacharidov, metabolická aktivita a zloženie črevnej mikrobioty jednotlivca, individuálna schopnosť metabolizovať D-laktát, znížená motilita hrubého čreva, užívanie antibiotic (9, 10, 11). Rizikovým faktorom môže byť použitie niektorých probiotických kmeňov laktobacilov (tzv. D-laktát produkujúce probiotické baktérie), ktoré môžu u pacientov so SBS indukovať D-LA (12). V klinickom obraze dominuje pestrá neurologická symptomatológia a klinické prejavy acidózy. Základom diagnostiky je podrobná anamnéza, klinický obraz a laboratórne vyšetrenie krvi (13, 14). Klinický obraz je nešpecifický, neurologická symptomatológia môže byť prechodná a stanovenie D-laktátu v krvi v bežnej praxi nie je dostupné (15). V laboratórnej diagnostike sa preto opierame o nepriamu diagnostiku stanovením metabolickej acidózy (MAC) so zvýšenou aniónovou medzerou (marker nemerateľných aniónov ako sú napr. vyššie uvádzané organické kyseliny) (9, 16).
Nosným pilierom terapeutických opatrení je korekcia acidózy a odstránenie vyvolávajúcej príčiny. Dôležitá je parenterálna hydratácia, čím sa zvyšuje renálne vylučovanie D-laktátu. Treba sa vyhnúť aplikácii prípravkov obsahujúcich laktát (napr. Ringer laktát). Okrem farmakoterapie majú dôležité postavenie v liečbe dietetické opatrenia. V akútnom štádiu je potrebné úplne zastaviť alebo výrazne obmedziť podávanie sacharidov, obzvlášť jednoduchých cukrov s ohľadom na vyššie uvedené patofyziologické konzekvencie (17).
Kazuistika
Vo februári roku 2020 bola na ambulanciu urgentného príjmu privezená posádkou RZP 54-ročná pacientka pre kvantitatívnu poruchu vedomia na úrovni soporu (Glasgow Coma Scale, GCS 5 bodov). Direktnú anamnézu nebolo možné od pacientky pre poruchu vedomia odobrať. Na základe heteroanamnézy od posádky RZP sme zistili, že pacientka mala v priebehu dňa trikrát riedku stolicu a trikrát zvracala žalúdočný obsah, bez prímesi krvi, následne sa u nej vyvinula v priebehu niekoľkých hodín porucha vedomia.
Pacientka mala od roku 1985 diagnostikovanú Crohnovu chorobu a bola po opakovaných operáciach tenkého čreva (r. 1994 – resekcia ilea v dĺžke cca 40 cm pre striktúru s vytvorením ileocekálnej anastomózy, r. 2014 – strikturoplastika pre recidivujúcu striktúru tenkého čreva). V novembri 2019 podstúpila ďalšiu resekčnú operáciu pre ileózny stav na podklade stenózy tenkého čreva s prítomnosťou tumoróznej masy v distálnom ileu (ponechaných cca 90 cm tenkého čreva). U pacientky bol diagnostikovaný dobre až stredne diferencovaný adenokarcinóm v teréne Crohnovej choroby s metastatickým postihnutím pečene. V decembri 2019 podstúpila jeden cyklus chemoterapie. V januári roku 2020 bola akútne hospitalizovaná na inom pracovisku pre kvantitatívnu poruchu vedomia. Stav bol záverovaný ako ťažká metabolická acidóza vs pri strate bikarbonátov pri SBS s poruchou vedomia (kompletný záznam z tejto hospitalizácie sme nemali k dispozícii).
V čase prijatia do našej nemocnice pacientka užívala perorálne kálium, magnézium, vitamín D, inhibitor protónovej pumpy, kyselinu maslovú a prípravok enterálnej výživy. Od roku 1994 bola v liečbe mesalazínom a azatioprinom, od roku 2014 v liečbe adalimumabom, od septembra 2019 jej bol nasadený pre exacerbáciu ochorenia prednizón s postupným znižovaním dávky. Biologická liečba spolu s ostatnou liečbou Crohnovej choroby jej bola ukončená po diagnostikovaní malignity.
Pri prijatí bola pacientka soporózna, tachykardická, afebrilná, s tachypnoe a prítomným Kussmaulovým dýchaním, kachektického habitu s hmotnosťou 47 kg a BMI (Body Mass Index) 17,1 kg/m2 .
Vo vstupnom laboratórnom obraze bola prítomná závažná metabolická acidóza s ťažkou depléciou bikarbonátov a vysokou aniónovou medzerou (anion gap, AG). Prítomná bola ľahká hyperchlorémia, známky miernej hepatálnej dysfunkcie obštrukčného rysu, ktoré sme pripisovali metastatickému poškodeniu pečene. Laboratórne sme neregistrovali retenciu dusíkatých látok ani významnejší posun v mineralograme, zápalová humorálna aktivita bola len minimálne zvýšená. V rámci nízkej hodnoty pH pacientke bola vyšetrená hladina laktátu v sére, ktorá bola len mierne zvýšená čo nekorešpondovalo so závažnosťou metabolickej acidózy (Tab. 1).
Tab. 1. Prehľad výsledkov biochemických vyšetrení u pacientky v deň prijatia a prepustenia 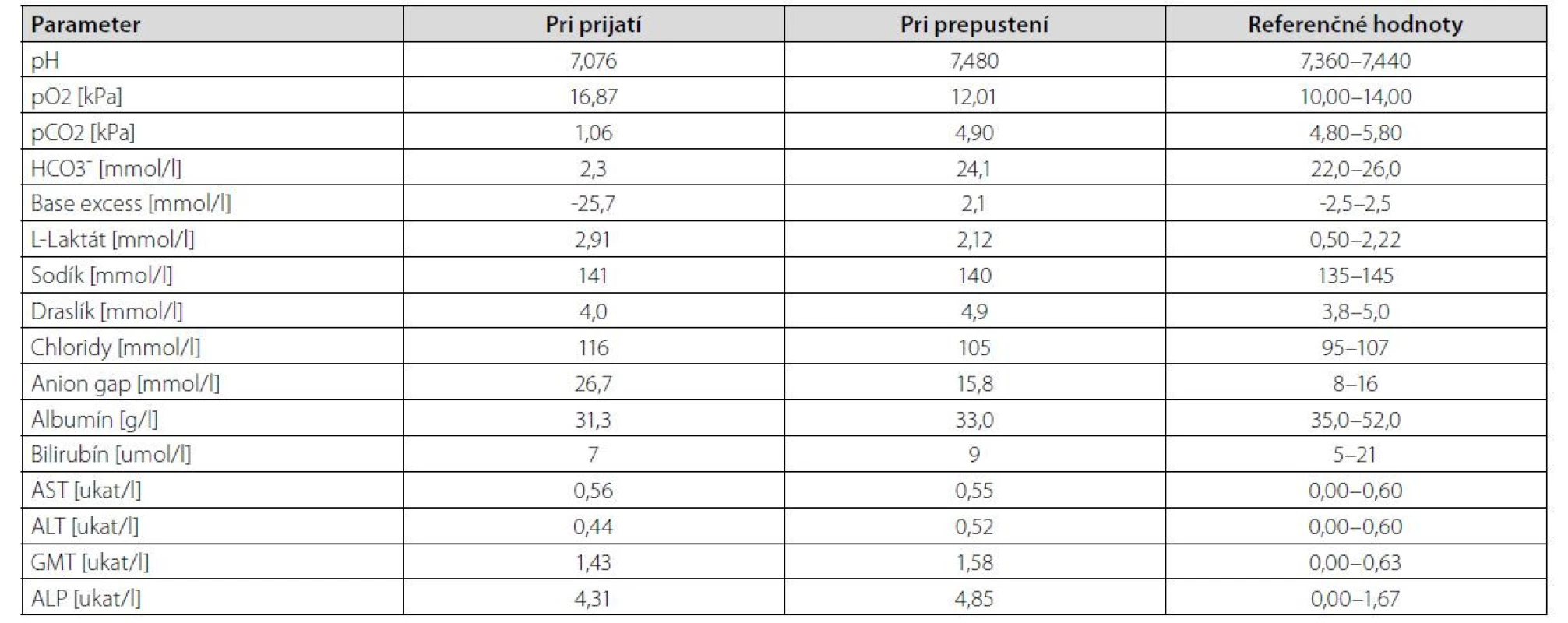
Poruchu vedomia sme pripísali ťažkej metabolickej acidóze, preto akútne CT vyšetrenie mozgu ani neurologické vyšetrenie sme neindikovali. Pacientka okrem poruchy vedomia nejavila žiadnu inú neurologickú symptomatológiu ani známky traumatického poškodenia.
Pacientku sme s pracovnou diagnózou ťažkej metabolickej acidózy, s vysokou aniónovou medzerou a kvantitatívnou poruchou vedomia (sopor, GCS 5 bodov) v pokračujúcej diferenciálnej diagnostike hospitalizovali na jednotke intenzívnej starostlivosti. Pristúpili sme ku korekcii ťažkej metabolickej acidózy podávaním intravenózneho 4,2 % roztoku hydrogenuhličitanu sodného, pacientku sme intenzívne rehydratovali fyziologickým roztokom a roztokmi glukózy, pozastavený bol u nej perorálny príjem.
Po úvodnej korekcii ťažkej metabolickej acidózy sme zaznamenali signifikantný vzostup hodnoty pH sprevádzaný poklesom hodnoty AG a úpravu poruchy vedomia. Avšak v priebehu prvých 3 dní sme opakovane zaznamenali nízke hodnoty pH s vysokými hodnotami AG, ktoré korelovali s recidivujúcimi epizódami ťažkej poruchy vedomia. Po úprave parametrov acidobázickej rovnováhy došlo k úprave poruchy vedomia. Klinický priebeh si vyžadoval intravenózne podanie vysokých dávok 4,2 % roztoku hydrogenuhličitanu sodného.
V ďalšom priebehu hospitalizácie sa už porucha vedomia neopakovala, kontrolné hodnoty pH a AG sa pohybovali v referenčných medziach. Vývoj zmien hodnôt AG a pH krvi počas hospitalizácie znázorňuje graf 1 a graf 2.
Graf 1. Priebeh zmien hodnôt aniónovej medzery (AGF, anion gap) 
Graf 2. Vývoj hodnôt pH krvi v závislosti od liečby 
Súčasťou terapeutických opatrení bola parenterálna nutričná podpora, polyvitaminózna liečba (vitamín A, D, E, K, kyselina listová, tiamín a vitamín B12), podávanie minerálov a stopových prvkov (magnézium, kalcium, zinok, selén). Pacientka bola hospitalizovaná na internom oddelení sedem dní a následne dimitovaná do ambulantnej starostlivosti onkológa a gastroenterológa, odporúčaná jej bola konzultácia v centre pre domácu parenterálnu výživu nakoľko sa u pacientky predpokladala potreba dlhodobej nutričnej podpory. Pacientka bola poučená o dôslednom dodržiavaní dietetických opatrení. V rámci medikamentóznej liečby u pacientky naďalej pokračovala vyššie uvedená suplementácia vitamínov, minerálov a stopových prvkov, ako aj prípravok enterálnej výživy.
Diskusia
D-LA predstavuje špecifickú a raritnú metabolickú poruchu, ktorá sa v bežnej praxi vyskytuje iba u pacientov so SBS. Prvýkrát toto ochorenie popísal Oh a kol. v roku 1979 u pacienta so SBS a encefalopatiou (3). Presná incidencia D-LA nie je známa, výsledky väčšiny publikovaných údajov z prospektívnych a retrospektívnych prác sa v tomto smere výrazne líšia a publikované práce nemali charakter robustných epidemiologických štúdií.
Diagnostika D-LA je v bežnej praxi problematická a môžeme hovoriť skôr o diagnóze per exclusionem, po vylúčení iných príčin metabolickej acidózy. V klinickom obraze dominuje neurologická symptomatológia, klinický nález sa môže vyvíjať od niekoľkých hodín až do niekoľkých dní. Vzhľadom na nemožnosť stanovenia plazmatickej hladiny D-laktátu v podmienkach bežnej klinickej praxe diagnózu je možné postaviť len na základe anamnestického, klinického a nepriameho laboratórneho vyšetrenia.
Diagnóza je založená v prvom rade na osobnej anamnéze, ktorá pacienta zaradí do rizikovej skupiny. Najrizikovejšiu skupinu tvoria pacienti po rozsiahlej črevnej resekcii pri zachovanom intaktnom hrubom čreve, kedy je možná fermentácia nevstrebaných sacharidov mikrobiotou hrubého čreva za vzniku nadmerného množstva D-laktátu (9). Do tejto rizikovej skupiny patrila aj naša pacientka, ktorá sa 34 rokov liečila na Crohnovu chorobu a bola po opakovaných resekciách tenkého čreva, s neporušeným hrubým črevom.
V rámci diferenciálnej diagnostiky je potrebné zamerať pozornosť na eventuálnu renálnu príčinu ťažkej metabolickej acidózy. V prípade našej pacientky sa akútne obličkové zlyhanie laboratórne nepotvrdilo. V kontexte chronickej tubulointersticiálnej nefritídy a SBS sa síce môžeme stretnúť s hyperchloremickou MAC, avšak hodnoty AG sú v medziach normy (18). Naša pacientka sa neliečila na cukrovku, sérová hladina glykémie bola v norme a preto diabetická ketoacidóza ako ďalšia možná príčina závažnej MAC bola vylúčená. U pacientky absentovala šoková cirkulácia, pri prijatí ako aj v priebehu celej hospitalizácie bola hemodynamicky stabilizovaná, bez významnejšej elevácie zápalových markerov, preto sme sepsu a šok v etiologickej súvislosti s MAC vylúčili. S prihliadnutím na chýbajúcu pozitívnu anamnézu a normálne hodnoty osmolálnej medzere v sére bola rovnako vylúčená intoxikácia alkoholom alebo inou noxou (metanol, etylénglykol, salicyláty) ako jedna z možných príčin MAC (19). Straty bikarbonátov stolicou, ktoré môžu participovať pri vzniku MAC, boli málo pravdepodobné, pretože pacientka negovala hnačky v predchorobí a hnačky neboli objektivizované ani počas hospitalizácie. Dôležitým údajom bola aj tá skutočnosť, že pacientka mala len mierne elevovanú hladinu laktátu, čo nekorelovalo s hodnotami ťažkej MAC a tým nevysvetľovalo závažnú poruchu acidobázickej rovnováhy. Po vylúčení vyššie uvedených možných príčin MAC zvažujeme raritnú diagnózu D-laktátovú acidózu.
Klinický obraz D-LA zahŕňa širokú škálu nešpecifických neurologických symptómov a zvyčajne aj prejavy malabsorpčného syndrómu v rámci zlyhania funkcie čreva u pacientov so SBS.
V dostupných literárnych zdrojoch sa uvádza, že u všetkých pacientov sa D-LA manifestuje určitou formou encefalopatie. Najčastejšie registrovanými klinickými prejavmi sú poruchy chôdze, ataxia, zrýchlená reč, v menšej miere bolesti hlavy, ospalosť, nystagmus, agresivita, depresia (20-24). U našej pacientky v klinickom obraze dominovala metabolicko-toxická forma encefalopatie s kvantitatívnou poruchou vedomia, ktorá oscilovala od somnolencie cez sopor až po kómu. V dostupnej literatúre nebol uvedený žiadny prípad, kde by D-LA prebiehala pod obrazom tak ťažkej poruchy vedomia ako v nami prezentovanej kazuistike. Vo väčšine prípadov, ktoré boli publikované, neurologické symptómy korelovali s hladinou acidémie (22, 25). Tak to bolo aj u našej pacientky. Jasne zreteľný vzťah medzi neurologickou symptomatológiou a acidózou bol preukázateľný počas prvých troch dní hospitalizácie, keď pacientka bola komatózna a somnolentná a v rámci laborat. vyšetrení sme zaznamenali opakovane nízke pH s vysokou hodnotou AG, s následnou úpravou vedomia po korekcii acidózy.
V rámci zvýšenia klinického suspícia D-LA má svoje opodstatnenie identifikácia precipitujúcich faktorov vzniku ochorenia. Jednou zo základných podmienok vzniku D-laktátovej acidózy je perorálny príjem sacharidov, predovšetkým jednoduchých cukrov. Údaje zistené od pacientov, ktoré sa týkajú množstva prijatých sacharidov často nemusia byť relevantné a presné. V tomto smere je vhodné pátrať, či sa uvedené ťažkosti opakujú a či recidíva ťažkostí nemá súvis s určitým druhom jedla, hlavne cukrov eventuálne potravín, ktoré obsahujú baktérie mliečneho kvasenia. Vzhľadom na to, že naša pacientka bola nedávno hospitalizovaná pre ťažkú metabolickú acidózu s rovnakým klinickým priebehom aký bol počas našej hospitalizácie, v ktorom dominovala kvantitatívna porucha vedomia, podporuje to fakt, že existoval u nej precipitujúci faktor, ktorý sa podieľal na vzniku acidózy. S vysokou pravdepodobnosťou mohlo ísť o diétnu chybu s vysokým príjmom cukrov. Medzi ďalšie rizikové faktory vzniku ochorenia patria poruchy pečene a obličiek, pretože tieto orgány sa podieľajú na metabolizme D-laktátu (20, 23). Naša pacientka mala metastatické postihnutie pečene, čo mohlo facilitovať a zhoršovať klinický priebeh ochorenia. Ďalšími rizikovými faktormi vzniku D-LA je užívanie antibiotík, ktoré môžu meniť črevnú mikrobiotu v prospech prerastania baktérií produkujúcich D-laktát. V literatúre bolo opísaných niekoľko prípadov D-LA po podaní tetracyklínu, metronidazolu, trimetoprimu-sulfametoxazolu a vankomycínu (26–28). Tiež pacienti, ktorí užívali probiotiká obsahujúce baktérie produkujúce D-laktát majú zvýšené riziko vzniku D-LA (29). Naša pacientka neužívala v recentnom predchorobí žiadne antibiotiká, probiotiká a prebiotiká. V tejto súvislosti je potrebné mať na pamäti, že D-LA môže byť tiež veľmi zriedkavá komplikácia liečby laktulózou v dôsledku črevnej stázy alebo obštrukcie, kedy laktulóza nemôže byť eliminovaná a zostáva v čreve ako substrát pre metabolizmus baktérií (30).
Klinický obraz s dôkladne odobratou anamnézou a vedomosťou o tomto ochorení sú základom správnej diagnostiky, avšak k stanoveniu definitívnej diagnózy nestačia. Klinický obraz je veľmi nešpecifický. Priama laboratórna diagnostika v bežnej praxi nie je možná, pretože hladina D-laktátu v krvi sa štandardne nevyšetruje. Je možné stanoviť iba plazmatickú hladinu L-laktátu, ktorý je markerom anaeróbneho metabolizmu a v diagnostike D-LA nemá veľký význam. Jeho hladiny môžu byť mierne zvýšené, kedže baktériami mliečneho kvasenia vzniká aj malé množstvo L-laktátu. Táto zvýšená hodnota je však nesignifikantná a nedokáže navodiť acidózu. Tak to bolo aj v prípade našej pacientky, ktorá mala ľahko zvýšenú hladinu L-laktátu (2,91 mmol/l), čo však nekorelovalo s ťažkou MAC. Pre nemožnosť priameho stanovenia D-laktátu v plazme sme diagnózu potvrdili indirektne potvrdením metabolickej acidózy so zvýšenou aniónovou medzerou (hlavný biochemický marker podporujúci diagnózu D-LA).
Prvoradým liečebným cieľom počas akútnej epizódy D-LA je korekcia acidózy, minerálového rozvratu, dostatočná hydratácia, zastavenie prívodu substrátu pre tvorbu D-laktátu a potlačenie mikrobioty produkujúcej D-laktát. V praxi to znamená obmedziť resp. pozastaviť perorálny príjem, predovšetkým jednoduchých cukrov a podávať eventuálne antibiotiká za účelom potlačenia bakteriálnej flóry. Indikácia antibiotík je však otázna a je predmetom odborných diskusií, keďže boli publikované prípady vzniku D-LA po antibiotickej liečbe (26–28). Manažment acidózy sa riadi podľa všeobecných odporúčaní pre liečbu metabolických acidóz. U našej pacientky sme postupovali podľa odporúčaní v svetovej literatúre. Acidózu sme korigovali intravenóznym 4,2 % hydrogenuhličitanom sodným. Celková dávka podaného 4,2 % hydrogenuhličitanu sodného bola 1 100 ml v priebehu troch dní. Hydrogenuhličitan sodný bol podávaný intermitentne podľa hodnoty pH krvi a klinického stavu pacientky. Takéto veľké množstvo ordinovaného hydrogenuhličitanu sodného vypovedá o závažnosti metabolickej acidózy. Okrem korekcie acidózy sme pacientku parenterálne hydratovali fyziologickými roztokmi a roztokmi glukózy, korigovali sme minerálové dysbalancie, bol jej pozastavený perorálny príjem. Po úprave vedomia sme ju postupne realimentovali. Na liečbu antibiotikami nie sú jednoznačné odporúčania, preto sme u našej pacientky boli opatrní a antibiotickú liečbu sme aj napriek recidíve závažnej metabolickej poruchy neindikovali. V závažných prípadoch do úvahy pripadá ako jedna z možností liečby hemodialýza (31). Táto eliminačná metóda v našom prípade nebola potrebná. Stav bol zvládnutý konzervatívne kombináciou farmakologickej liečby a dietetických opatrení.
Prevencia ďalších epizód D-LA spočíva v obmedzení substrátu pre bakteriálnu produkciu D-laktátu, obmedzení exogénnych zdrojov D-laktátu, v podpore a udržiavaní črevnej mikrobioty neprodukujúcej D-laktát a v podpore metabolizmu D-laktátu (32). Potlačenie abnormálnej mikrobiálnej produkcie D-laktátu je najdôležitejší faktor pre dlhodobú prevenciu recidívy D-LA. Treba sa zamerať na zníženie perorálneho príjmu hlavne jednoduchých sacharidov, pretože tie sú najrýchlejšie metabolizované na D-laktát (33). Odporúča sa príjem sacharidov v častejších a menších porciách, pretože takto dochádza k zníženiu maximálnej sérovej hladiny D-laktátu. Pacienti by sa mali vyhýbať potravinám, ktoré obsahujú D-laktát. Sú to fermentované potraviny, ako napríklad kyslé mlieko, jogurty, nakladané potraviny (32).
Dlhodobé užívanie antibiotík sa môže zvážiť u pacientov, ktorí mali opakovane epizódy D-LA za účelom potlačenia mikrobioty produkujúcej D-laktát. V tejto indikácii sa používajú minimálne vstrebateľné resp. nevstrebateľné ATB, ako napríklad klindamycín, tetracyklín, metronidazol, neomycín, vankomycín, trimetoprim-sulfametoxazol a v poslednom období preferovaný rifaximín, ktoré sú schopné modifikovať črevnú mikrobiotu (34). . Vhodné je ich cyklické podávanie. Treba si však uvedomiť, že aj po užití niektorých týchto antibiotík, boli hlásené prípady vzniku D-LA (22, 35). Preto na antibiotickú liečbu zatiaľ nie sú štandardné odporúčania a k takejto liečbe treba pristupovať prísne individuálne.
Dôležitú úlohu zohráva aj rekolonizácia čreva, hlavne baktériami, ktoré neprodukujú D-laktát, ako sú Bifidobacterium breve a Lactobacillus casei (29). Na rekolonizáciu čreva môže mať pozitívny efekt užívania vhodných probiotík a synbiotík. Treba sa vyhýbať probiotikám, ktoré obsahujú bakteriálne kmene produkujúce D-laktát, ako je Lactobacillus acidophilus (36–38). Synbiotiká, obsahujúce nielen probiotické baktérie, ale aj prebiotiká, ako napríklad galaktooligosacharidy, okrem rekolonizácie čreva podporujú syntézu SCFA (short-chain fatty acid, mastné kyseliny s krátkym reťazcom) intestinálnymi baktériami, ktoré majú pozitívny vplyv na proliferáciu intestinálneho epitelu a stimulujú intestinálnu motilitu (39). To znamená, že pri synbiotikách by bol D-laktát pravdepodobne odstránený stolicou skôr ako by sa absorboval v hrubom čreve (20). Pre túto liečebnú stratégiu je však potrebných ešte viac klinických údajov. Novinkou v liečbe SBS je teduglutid, rekombinantný GLP-2 (glukagon like peptide-2) analóg, ktorý zväčšuje absorpčnú plochu zvyšku tenkého čreva a umožňuje postupnú redukciu až ukončenie parenterálneho živenia (40, 41).
V zriedkavých prípadoch, keď zlyháva konzervatívna liečba pristupuje sa ku chirurgickej intervencii, ktorá zahŕňa všeobecné chirurgické postupy liečby SBS. V niektorých extrémnych prípadoch sa musí pristúpiť až ku kolektómii (9).
Záver
D-LA je raritná, ale závažná metabolická komplikácia SBS. Najrizikovejšiu skupinu tvoria pacienti po rozsiahlej črevnej resekcii pri zachovanom intaktnom hrubom čreve, kedy je možná fermentácia nevstrebaných sacharidov mikrobiotou hrubého čreva, pri ktorej sa tvorí ako vedľajší produkt D-laktát. V bežnej praxi sa nestanovuje plazmatická hladina D-laktátu, diagnóza je tak postavená na klinických, anamnestických a nepriamych laboratórnych vyšetreniach. Zobrazovacie modality (CT mozgu, MR mozgu) nemajú diagnostický význam, využívajú sa na vylúčenie primárneho ochorenia mozgu vzhľadom k tomu, že D-LA sa manifestuje neurologickou symptomatológiou.
Je dôležité, aby klinik myslel na existenciu tejto závažnej komplikácie u rizikových skupín pacientov, nakoľko význam včasnej terapeutickej intervencie je nepopierateľný a môže zásadne ovplyvniť klinický priebeh, ako aj podstatne znížiť riziko mortality.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Vladimír Podušel
vladimir.podusel@hospital-bojnice.sk
Interné oddelenie, NsP Prievidza so sídlom v Bojniciach Nemocničná 2, 972 01 Bojnice
Cit. zkr: Vnitř Lék 2021; 67(e5): e28–e33
Článek přijat redakcí: 23. 6. 2020
Článek přijat po recenzích k publikaci: 8. 7. 2021
Zdroje
1. Pironi L, Corcos O, Forbes A et al. Intestinal failure in adults: Recommendations from the ESPEN expert groups. Clin Nutr. 2018; 37 : 1798–1809.
2. O’Keefe SJ, Buchman AL, Fishbein TM et al. Short Bowel Syndrome and Intestinal Failure: Consensus Definitions and Overview. Clin Gastroenterol Hepatol. 2006; 4 : 6–10.
3. Oh MS, Phelps KR, Traube M, Barbosa-Saldivar JL et al. D-Lactic acidosis in a man with the short-bowel syndrome. N Engl J Med. 1979; 301 : 249–252.
4. Mason PD. Metabolic acidosis due to D-lactate. Br Med J. 1986; 292 : 1105–1106.
5. Wright MR, Jamali F. Methods for the analysis of enantiomers of racemic drugs application to pharmacological and pharmacokinetic studies. J Pharmacol Toxicol Methods. 1993; 29 : 1–9.
6. Uribarri J, Oh MS, Carroll HJ. D-lactic acidosis. A review of clinical presentation, biochemical features, and pathophysiologic mechanisms. Medicine (Baltimore). 1998; 77 : 73–82.
7. Petersen C. D-lactic acidosis. Nutr Clin Pract. 2005; 20 : 634–645.
8. Spillane K, Nagendran K, Prior PF et al. Serial electroencephalograms in a patient with D-lactic acidosis. Electroencephalogr Clin Neurophysiol. 1994; 91 : 403–405.
9. Kowlgi NG, Chhabra L. D-Lactic Acidosis: An Uderrecognized Complication of Short Bowel Syndrome. Gastroenterol Res Pract. 2015; 2015 : 476215. doi: 10.1155/2015/476215.
10. Coronado BE, Opal SM, Yoburn DC. Antibiotic-induced D-lactic acidosis. Ann Intern Med. 1995; 122 : 839–842.
11. Flourie B, Messing B, Bismuth E et al. D-lactic acidosis and encephalopathy in short - bowel syndrome occurring during antibiotic treatment. Gastroenterol Clin Biol. 1990; 14 : 596–598.
12. Yilmaz B, Schibli S, Macpherson AJ et al. D-lactic Acidosis: Successful Suppression of D-lactate-Producing Lactobacillus by Probiotics. Pediatrics. 2018; 142(3): e20180337. doi: 10.1542/peds.2018–0337.
13. Day AS, Abbott GD. D-lactic acidosis in short bowel syndrome. N Z Med J. 1999; 112 : 277–278.
14. Hudson M, Pocknee R, Mowat NAG. D-lactic acidosis in short bowel syndrome-an examination of possible mechanisms. Q J Med. 1990; 74 : 157–163.
15. Hyšpler R et al. Spektrofotometrická metóda stanovení D-laktátu v krevní plazmě a moči. Klin. Biochem. Metab. 2015; 23 : 193–197.
16. Weemaes M, Hiele M, Vermeersch P. High anion gap metabolic acidosis caused by D-lactate: mind the time of blood collection. Biochem Med (Zagreb). 2020; 30 : 1–5.
17. Mayne AJ, Handy DJ, Preece MA et al. Dietary management of D-lactic acidosis in short bowel syndrome. Arch Dis Child. 1990; 65 : 229–231.
18. Joyce E, Glasner P, Ranganathan S et al. Tubulointerstitial nephritis: diagnosis, treatment, and monitoring. Pediatr Nephrol. 2017; 32(4): 577–587.
19. Pham AQ, Xu LH, Moe OW. Drug-Induced Metabolic Acidosis. F1000Res. 2015; 4: F1000 Faculty Rev-1460. Published 2015 Dec 16. doi:10.12688/f1000research.7006.1
20. Takahashi K, Terashima H, Kohno K et al. A stand-alone synbiotic treatment for the prevention of D-lactic acidosis in short bowel syndrome. Int Surg. 2013; 98 : 110–113.
21. Fabian E, Kramer L, Siebert F et al. D-lactic acidosis – case report and review of the literature. Z Gastroenterol. 2017; 55 : 75–82.
22. Godey F, Bouasria A, Ropert M et al. Don’t forget to test for D-lactic acid in short bowel syndrome. Am J Gastroenterol. 2000; 95 : 3675–3677.
23. Bongaerts G, Tolboom J, Naber T et al. D-lactic acidemia and aciduria in pediatric and adult patients with short-bowel syndrome. Clin Chem. 1995; 41 : 107–110.
24. Narula RK, El Shafei A, Ramaiah D et al. D-lactic acidosis 23 years after jejuno-ileal bypass (case report). Am J Kidney Dis. 2000; 36 : 1–4.
25. Dahlquist NR, Perrault J, Callaway CW et al. D-lactic acidosis and encephalopathy after jejunoileostomy: response to overfeeding and to fasting in humans. Mayo Clin Proc. 1984; 59 : 141–145.
26. Coronado BE, Opal SM, Yoburn DC. Antibiotic-induced D-lactic acidosis. Ann Intern Med. 1995; 122 : 839–842.
27. Flourie B, Messing B, Bismuth E et al. D-lactic acidosis and encephalopathy in short-bowel syndrome occurring during antibiotic treatment. Gastroenterol Clin Biol. 1990; 14 : 596–598.
28. White L. D-lactic acidosis: more prevalent than we think? Practical Gastroenterology 2015; 39 : 26–45.
29. Uchida H, Yamamoto H, Kisaki Y et al. D-lactic acidosis in short-bowel syndrome managed with antibiotics and probiotics. J Pediatr Surg. 2004; 39 : 634–636.
30. Mann NS, Russman HB, Mann SK et al. Lactulose and severe lactic acidosis. Ann Intern Med 1985; 103 : 637.
31. Jorens PG, Demey HE, Schepens PJ et al. Unusual D-lactic acid acidosis from propylene glycol metabolism in overdose. J Toxicol Clin Toxicol. 2004; 42 : 163–169.
32. Bongaerts G, Bakkeren J, Severijnen R et al. Lactobacilli and acidosis in children with short small bowel. J Pediatr Gastroenterol Nutr. 2000; 30(3): 288–293.
33. Hove H, Mortensen PB. Colonic lactate metabolism and D-lactic acidosis. Dig Dis Sci. 1995; 40 : 320–330.
34. Ponziani FR, Scaldaferri F, Petito V et al. The role of antibiotics in gut microbiota modulation: the eubiotic effects of rifaximin. Dig Dis. 2016; 34(3): 269–278.
35. Scully TB, Kraft SC, Carr WC et al. D-lactate-associated encephalopathy after massive small-bowel resection. J Clin Gastroenterol. 1989; 11 : 448–451.
36. Satoh T, Narisawa K, Konno T et al. D-lactic acidosis in two patients with short bowel syndrome: bacteriological analyses of the fecal flora. Eur J Pediatr 1982; 138 : 324–326.
37. Ondriová I, Fertaľová T, Magurová D. Klinické využitie probiotík v prevencii a liečbe porúch tráviaceho traktu. Klin Farmakol Farm. 2015; 29(3): 116–118.
38. Gombošová L. Mikrobiota v etiopatogenéze a liečbe symptomatickej divertikulovej choroby hrubého čreva. Gastroent Hepatol. 2019; 73 : 418–422.
39. Cherbut C, Aubé AC, Blottière HM et al. Effects of short-chain fatty acids on gastrointestinal motility. Scand J Gastroenterol Suppl 1997; 222 : 58–61.
40. Pape UF, Iyer KR, Jeppesen PB et al. Teduglutide for the treatment of adults with intestinal failure associated with short bowel syndrome: pooled safety data from four clinical trials. Therap Adv Gastroenterol. 2020; 13 : 1–18.
41. Křížová J, Trachta P, Kotrlíková E et al. Syndrom krátkeho střeva a možnosti jeho léčby. Interná med. 2017; 17(10): 405–408.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2021 Číslo E-5- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Co dělat při intoleranci statinů?
-
Všetky články tohto čísla
- Whippleova nemoc – systémová choroba s gastrointestinálními projevy
- Preleukemické fúzne gény typické pre akútnu myeloidnú leukémiu
- Retrospektivní analýza výskytu plicní embolie v CT obraze u pacientů s pozitivní hodnotou D-dimerů
- Věnujeme medikaci seniorů dostatečnou péči? (Případ Domova Vlčí mák ÚVN Praha)
- Mortalita pacientů s covidem-19 na JIP – naše zkušenosti
- D-laktátová acidóza – zriedkavá komplikácia syndrómu krátkeho čreva
- K životnímu jubileu prof. MUDr. Lenky Špinarové, Ph.D., FESC
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- D-laktátová acidóza – zriedkavá komplikácia syndrómu krátkeho čreva
- Věnujeme medikaci seniorů dostatečnou péči? (Případ Domova Vlčí mák ÚVN Praha)
- Whippleova nemoc – systémová choroba s gastrointestinálními projevy
- Mortalita pacientů s covidem-19 na JIP – naše zkušenosti
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



