-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Whippleova nemoc – systémová choroba s gastrointestinálními projevy
Whipple disease – systemic disease with gastrointestinal manifestations
Whipple disease is rare, potentionally life-threatening disease with broad scale of possible symptoms and therefore wide differential diagnosis. Localized forms as well as systemic manifestations are possible. Etiological agent is bacteria Tropheryma whipplei. The most common manifestations include arthralgias, fever, diarrhea, abdominal pain, malabsorption syndrome and weight loss. In my article I present literature review and a case report of the pacient with relatively typical course of the disease.
Keywords:
malabsorption syndrome – Whipple disease – Tropheryma whipplei – intermitent fever – PAS positive macrophages – seronegative arthritis
Autori: Leoš Chrudimský
Pôsobisko autorov: Patologicko-anatomické oddělení, Nemocnice Jihlava, p. o.
Vyšlo v časopise: Vnitř Lék 2021; 67(E-5): 3-8
Kategória:
Súhrn
Whippleova choroba je vzácné, potenciálně život ohrožující onemocnění se širokou škálou možných příznaků a z nich vyplývající rozsáhlou diferenciálně diagnostickou rozvahou. Lze se setkat jak s lokalizovanou formou postižení, tak se systémovými projevy. Původcem onemocnění je bakterie Tropheryma whipplei. Mezi nejčastější manifestace nemoci patří bolesti kloubů, horečky, průjmy, bolesti břicha, malabsorpční syndrom a váhový úbytek. Ve svém příspěvku přináším přehled literatury a kazuistiku pacienta s poměrně typickým průběhem choroby
Klíčová slova:
malabsorpční syndrom – Whippleova choroba – Tropheryma whipplei – intermitentní febrilie – PAS pozitivní makrofágy – séronegativní artritida
Úvod
Whippleovu chorobu poprvé popsal v roce 1907 americký patolog George Hoyt Whipple na případu pacienta s váhovým úbytkem, neurčitou bolestí břicha a zvláštní artritidou (1). Onemocnění nazval intestinální lipodystrofie, protože ji, na podkladě patologického nálezu v tenkém střevě a mezenteriálních lymfatických uzlinách považoval za poruchu lipidového metabolismu. Tato teorie byla opuštěna poté, co bylo na základě histologického speciálního barvení PAS (z anglického periodic acid-Schiff) zjištěno, že zde přítomné pěnité makrofágy neobsahují lipidy, ale glykoproteiny. Teprve v roce 1961 pak byla prokázána bakteriální etiologie. Do této doby zůstávalo onemocnění neléčitelné, končící zpravidla smrtí (2). Roku 1992 byla dále identifikována specifická bakteriální ribozomální RNA (3). Původce nemoci, aktinomyceta Tropheryma whipplei, bývala kdysi považována za vzácný druh, ukazuje se však, že je naopak druhem velmi rozšířeným (1). Často je uváděno, že jde o gram pozitivní bakterii (4), ve skutečnosti ale jde o bakterii gram variabilní, která se může prezentovat i jako gram negativní. Existuje také řada jejích subtypů. Mikrobiologická kultivace je mimořádně obtížná, neboť organismus pro chybění řady metabolických drah vyžaduje k růstu eukaryotickou buňku. První úspěšná kultivace na fibroblastech proto proběhla po mnoha marných pokusech až v roce 2000, v roce 2003 pak i na umělém kultivačním médiu. Jedná se o proces nesmírně zdlouhavý, trvající asi měsíc, neboť replikační doubling time mikroba je celých 18 dní, což je ještě mnohonásobně déle než například u fylogeneticky příbuzného Mycobacterium tuberculosis (18–54 hodin). Kultura navíc velmi ochotně přerůstá dalšími kmeny přítomnými ve vzorcích (např. stolice). To vše zatím činí kultivaci pro rutinní diagnostické účely prakticky nevyužitelnou. Dlouhodobé přežití organismu v prostředí je vysvětlováno hypotézou o možnosti tvorby spor, ty ale nebyly zatím přímo pozorovány (5).
Ve své klasické formě se choroba vyskytuje s běžně udávanou incidencí asi 1/milion obyvatel, nejvyšší výskyt je zaznamenáván ve Spojených státech a severní Evropě, až 8krát častěji bývají postiženi muži (4). Některé velké studie ve Spojených státech však nenacházejí rozdíl v zastoupení obou pohlaví (6). Celkově bylo do roku 2018 v literatuře popsáno méně než 2 000 případů (7). Průměrný věk počátku onemocnění je 55 let (8). Vyšší věk nemocných je nejspíše dán také dlouhou prodlevou mezi nákazou, prvními symptomy a diagnózou (5). Je známa asociace s HLA B27 (2–3krát častější u postižených než u ostatní populace) (8) a dále alelami HLA DRB1*13 a DQB1*06 (4). Všeobecně se věří, že zvířata, na rozdíl od člověka, nepředstavují významný rezervoár infekce (5). Přítomnost bakterie ve stolici lze detekovat asi u 4 % běžné evropské populace, endemicky se může vyskytnout ale až u 40 %. Protilátky proti Tropheryma whipplei nacházíme u 70 % asymptomatických jedinců (4), předpokládá se primoinfekce již v dětství (5). Prevalence je vyšší u osob žijících v horších hygienických podmínkách, jako jsou bezdomovci, pracovníci kanalizací, pracovníci vystavení kontaktu s půdou, hnojem, fekáliemi (2) jako například zemědělci a stavební profese (9). Ještě častější je záchyt u příbuzných s chronickou Whippleovou chorobou, až 80 % příbuzných nosičů má pozitivní výsledek vyšetření stolice. Zda se jedná o interpersonální přenos, nebo následek nákazy ze stejného environmentálního zdroje, zůstává nejasné. Pravděpodobný je přenos orofekální, zřejmě je možný i přenos respirační cestou. U asymptomatických jedinců byla Tropheryma nalezena prakticky všude – ve slinách, moči, krvi, synoviální tekutině, bronchoalveolární tekutině, nitrooční tekutině, mozkomíšním moku, mozku, stolici, svalech, uzlinách, plicích, játrech, slezině, žaludku, tenkém i tlustém střevě, hrtanu, maxilárních dutinách, na kůži a chlopních (5). Zásadní rozdíl mezi promořeností populace a incidencí choroby hovoří pro mírný defekt imunitní reakce specifický pro Tropheryma whipplei, protože obranyschopnost proti jiným patogenům nebývá narušena. Udává se snížený poměr CD4/CD8 lymfocytů společně s nízkou Th1 aktivitou a zvýšený počet T-regulačních lymfocytů, inhibujících funkci makrofágů, které pak nejsou schopny patogena přirozeně eliminovat. Za vlastní poškození tkání je zodpovědná spíše chronická zánětlivá odpověď než málo virulentní bakterie (4).
Onemocnění může být jak lokalizované, tak systémové, průběh akutní i chronický. Akutní infekce končí u zdravých jedinců úzdravou, u disponovaných může přecházet do chronicity. Většinou se jedná o gastroenteritidy, pravděpodobně mohou vznikat i pneumonie.
Chronická lokalizovaná forma se vyznačuje absencí postižení tenkého střeva či více orgánových systémů, nejčastěji jde o endokarditidu, encefalitidu, uveitidu (4) a synovitidu (2). Tvoří asi 20 % všech chronických forem onemocnění (10) a vykazuje nižší tendence k relapsu (4).
Chronická systémová infekce (klasická Whippleova choroba) má charakter vleklé sepse s plíživým začátkem. Objevují se subfebrilie, artralgie až artritidy, později febrilie (9). Kloubní obtíže bývají časté – až v 75 % případů (5). Artritidy jsou nedestruktivní (8), migratorní, intermitentní, oligo - i polyartikulární (2), nejčastěji jde o kolena, kotníky a zápěstí (5). Vznik bývá náhlý, trvání omezené na hodiny až dny, běžná je sakroiliitida (8). V pozdním stadiu se objevují bolesti břicha, hubnutí (2), průjem se steatoreou. Průjem však může být i vodnatý, někdy je zjevné krvácení, okultní bývá přítomno až v 80 % (8).
Název Tropheryma je odvozen z řeckých slov trophé = výživa a eryma = překážka (5), odkazující na malabsorpční syndrom, jehož hlavní příčinou je zřejmě blokáda lymfatické drenáže střeva. Postižení tenkého střeva je dominantním projevem klasické Whippleovy choroby, změny se projevují zejména v duodenu a jejunu, ale zasaženo může být stejně tak i tlusté střevo včetně rekta (11). Makroskopicky bývají patrné četné žlutobělavé slizniční plaky (Obr. 1), které mohou splývat ve větší plochy oddělené hyperemickými oblastmi (4), sliznice je křehká (2), atrofická s hemoragiemi (1), slizniční řasy ztluštělé (12). Histologickému obrazu dominuje masivní infiltrace sliznice pěnitými makrofágy (Obr. 2), vyplněnými srpkovitými tělísky, které se intenzivně fialově barví speciálním barvením PAS (Obr. 3 a Obr. 4). Barvení PAS je běžně dostupná histologická technika. Tělíska odpovídají fagolyzosomům napěchovaným pohlcenými bakteriemi (11). Tyto pěnité makrofágy pak můžeme zastihnout i v ostatních postižených orgánech, od lymfatických uzlin až po CNS. Mesenteriální lymfadenopatie je častá a biopsie lymfatických uzlin může vést k diagnóze. Stejně tak přítomnost PAS pozitivních makrofágů v periferních uzlinách může na Whippleovu chorobu poprvé upozornit (13). Periferní lymfadenopatie je však vzácná (3). Právě infiltrace lymfatických uzlin je z velké části zodpovědná za blokádu lymfatické drenáže střeva, což se ve sliznici na mikroskopické úrovni projevuje vznikem lymfangiektázií a extravazací tukových kapének se vznikem lipogranulomů (4). Sonograficky může být patrná drobná kavitace uzlin (2) a zesílení stěny střeva (12). Je popisováno i výhradně submukózní postižení, se kterým se lze také setkat po částečné eradikaci mikroba (12). V tomto případě nemusí být patrný ani mikroskopický, ani makroskopický nález na sliznici (13).
Obr. 1. Endoskopický obraz duodena se zvýrazněnou lymfatickou kresbou 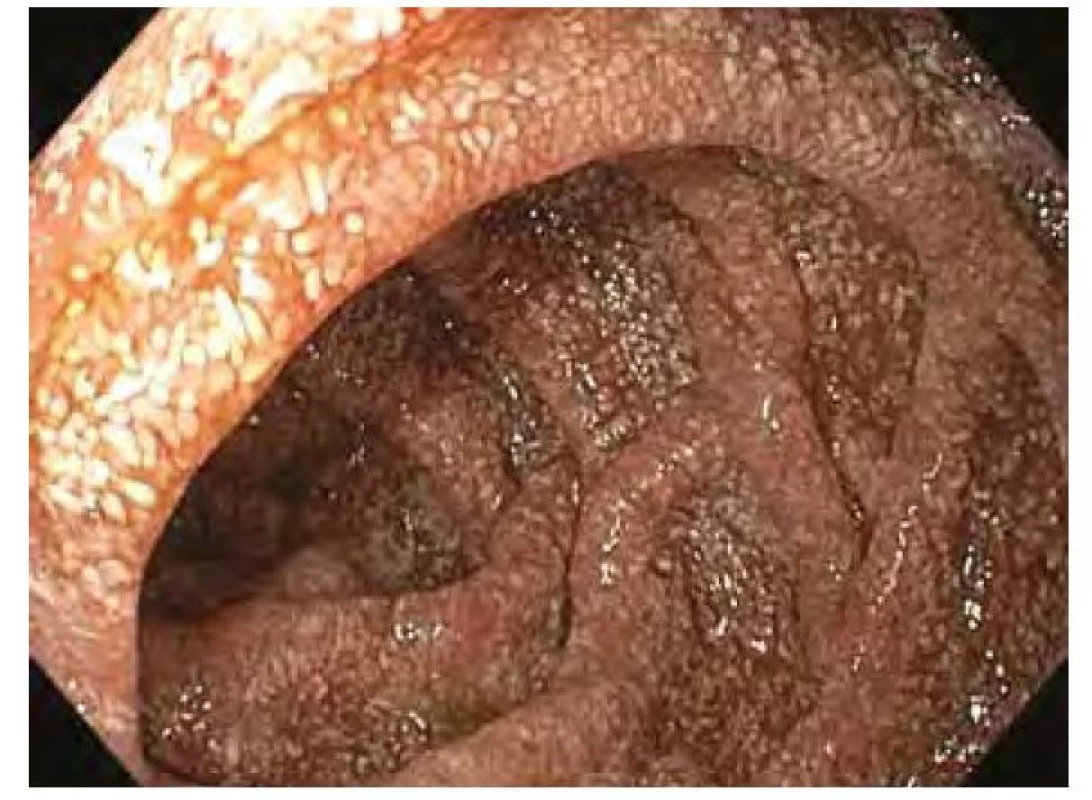
Obr. 2. Detail duodenální sliznice v barvení hematoxylinem a eosinem 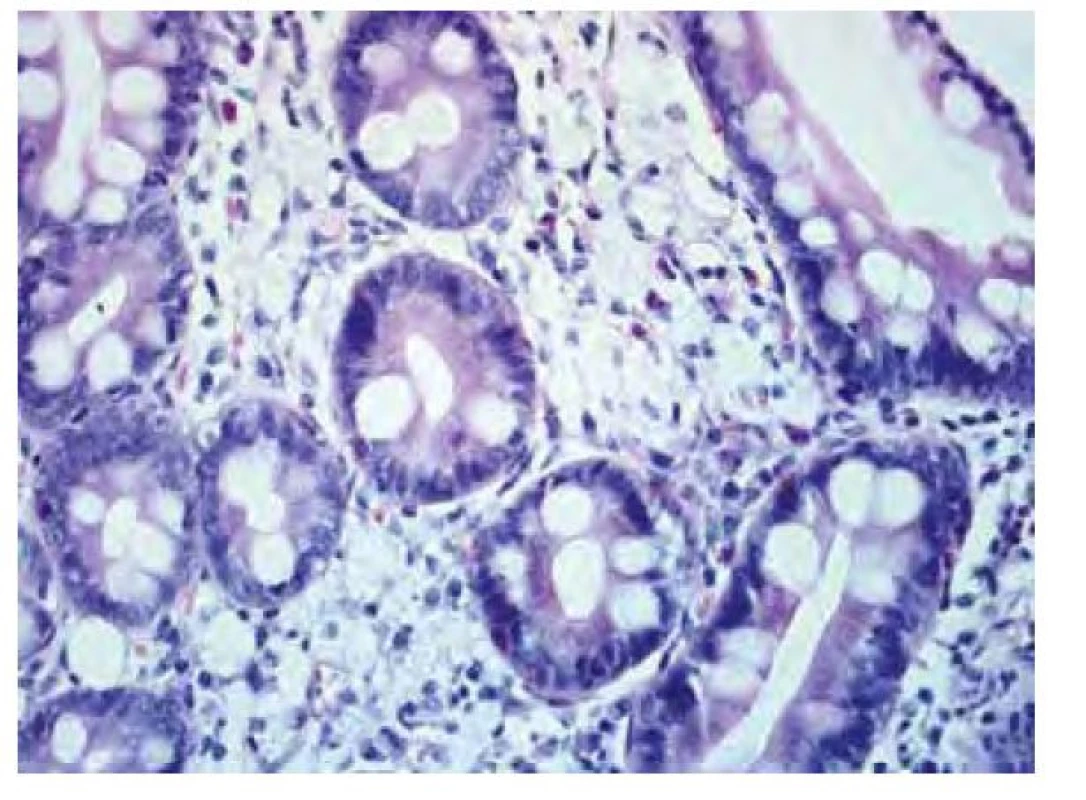
Obr. 3. Obraz duodena v barvení PAS 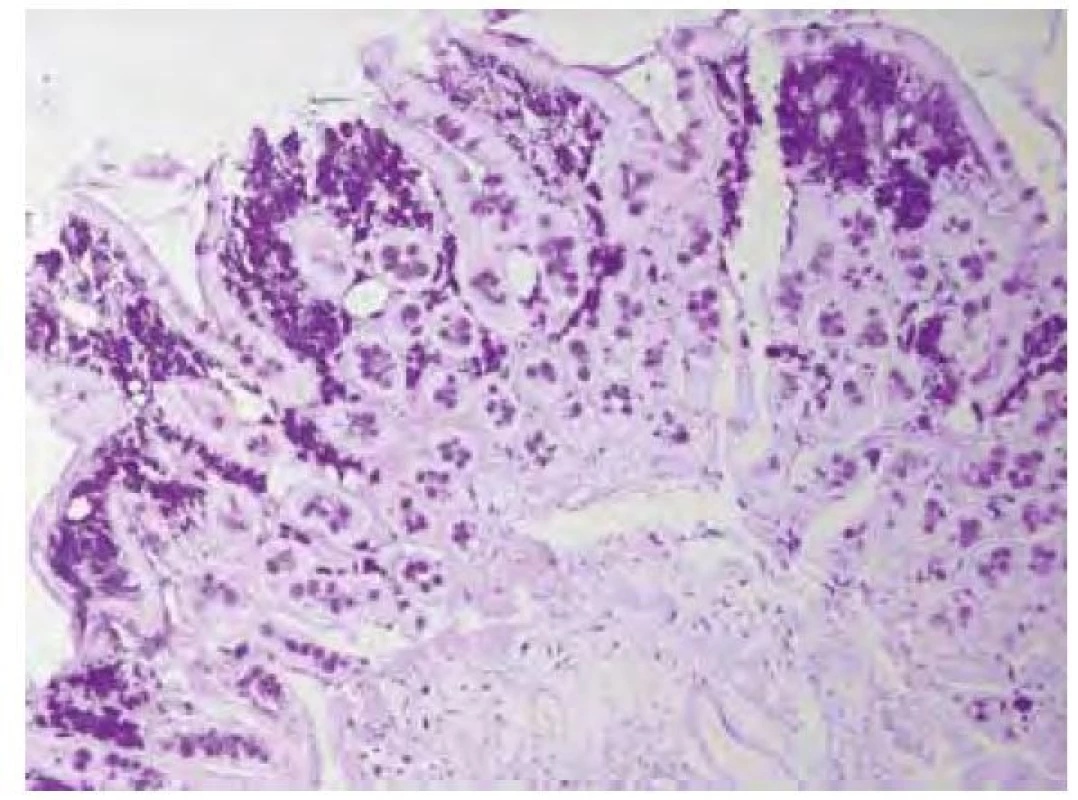
Obr. 4. Detail duodenální sliznice v barvení PAS (hvězdička označuje pohárkovou buňku, šipky makrofágy) 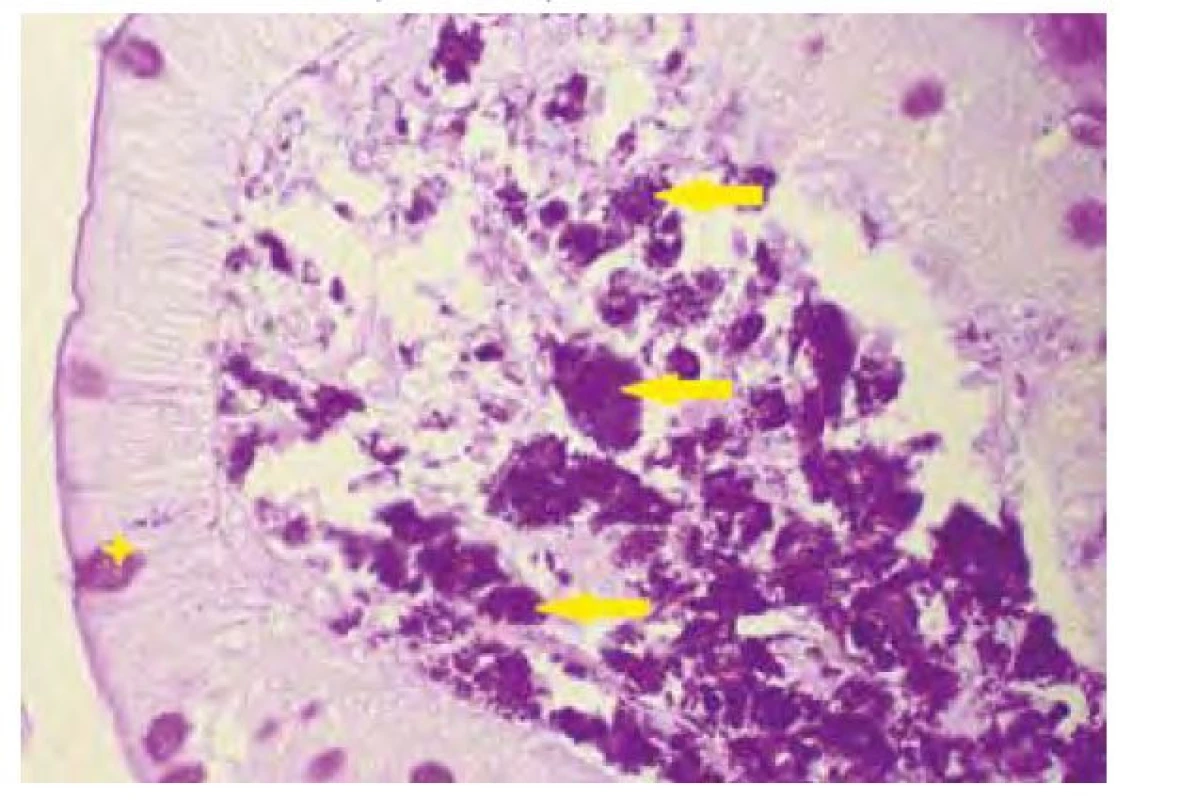
Základní laboratorní vyšetření odpovídá malabsorpčnímu sydromu jiné etiologie (9) a zánětlivé reakci. Bývá anémie (14), neutrofilie, mírná lymfopenie (8), zvýšená sedimentace erytrocytů (2), elevace zánětlivých markerů (10), pokles celkové bílkoviny v séru, nízká hladina vápníku, železa (14), transferinu (2), vitaminu K s přidruženou poruchou srážlivosti, deficit karotenoidů (15), folátu, vitaminu B12 (8). Mohou být periferní edémy s podílem protein loosing enteropatie (8).
Průjmy a hubnutí se klasicky objevují s odstupem měsíců a let od iniciálních příznaků (4) a pacienti jsou tak původně vyšetřováni napříč medicínskými obory, zejména specialisty z oblasti revmatologie, neurologie, gastroenterologie, hematologie, praktického lékařství, kardiologie, oftalmologie, infekčního lékařství a endokrinologie. Někteří nemocní udávali související obtíže i 22 let před stanovením diagnózy (10). Neléčení pacienti umírají pod obrazem těžké karenční kachexie a přidružených komplikací (14).
Jako třetí nejčastější orgánové manifestace se uvádějí poruchy CNS (5). Jsou zvláště nebezpečné kvůli hrozícímu trvalému postižení bez ohledu na proběhlou léčbu (2). Pitevní nálezy odhalují postižení v 90 % případů, jen malá část (10–40 %) je klinicky zjevná (8). Nejčastějším projevem je demence (1), příznaky jsou ale pestré. Jsou reportovány změny spánku, anorexie při postižení hypothalamu, korová slepota, bolesti hlavy, deprese, zmatenost (16), prefrontální syndrom, myoklonus, chorea (5), extrapyramidové syndromy (8), ataxie, neuropsychiatrické poruchy, epilepsie, spondylodiscitida (17). Mícha a periferní nervy bývají ušetřeny (16). Z neurologického hlediska existují dva patognomické stavy, a to okulomastikatorní myorrhytmie – mimovolní konvergenčně-divergentní oscilace očních bulbů synchronní s mimovolními kontrakcemi žvýkacích svalů a okulofaciální skeletální myorrhytmie. Alespoň jeden z těchto příznaků se (většinou společně se supranukleární oftalmoplegií) objevuje asi u 20 % nemocných (15). Poruchy CNS mohou být často prvním příznakem relapsu onemocnění (8).
Srdce je chorobou zasaženo asi v jedné třetině případů (8). Běžně se vyskytuje jak endokarditida, tak myokarditida a perikarditida (2). U endokarditid s negativní hemokulturou se jedná dokonce o 4. nejčastější příčinu (18). Většinou je postižena aortální a mitrální chlopeň (15). Setkat se lze s chronickým srdečním selháním i náhlou srdeční smrtí (16).
Kožní projevy se prezentují hyperkeratózou, změnami pigmentace, purpurami (8), vznikají uzly či puchýře podobající se dermatitis herpetiformis Duhring (16).
Oční infekce vyvolává uveitidy, vitritidy, chorioretinitidy (19).
Méně častými až vzácnými manifestacemi jsou pneumonie (15), pleuritida, polyneuritida, ascites (11), konstriktivní perikarditida (18), insuficience nadledvin (1), glositida, cheilitida, gingivitida (8), myopatie, postižení jater, žaludku, jícnu (5), infekce kloubních protéz (15). Jsou zaznamenány případy extraintestinálních maligních lymfomů (13).
Nejčastější orgánové manifestace choroby shrnuje tabulka (Tab. 1).
Tab. 1. Whippleova choroba – nejčastější orgánové manifestace 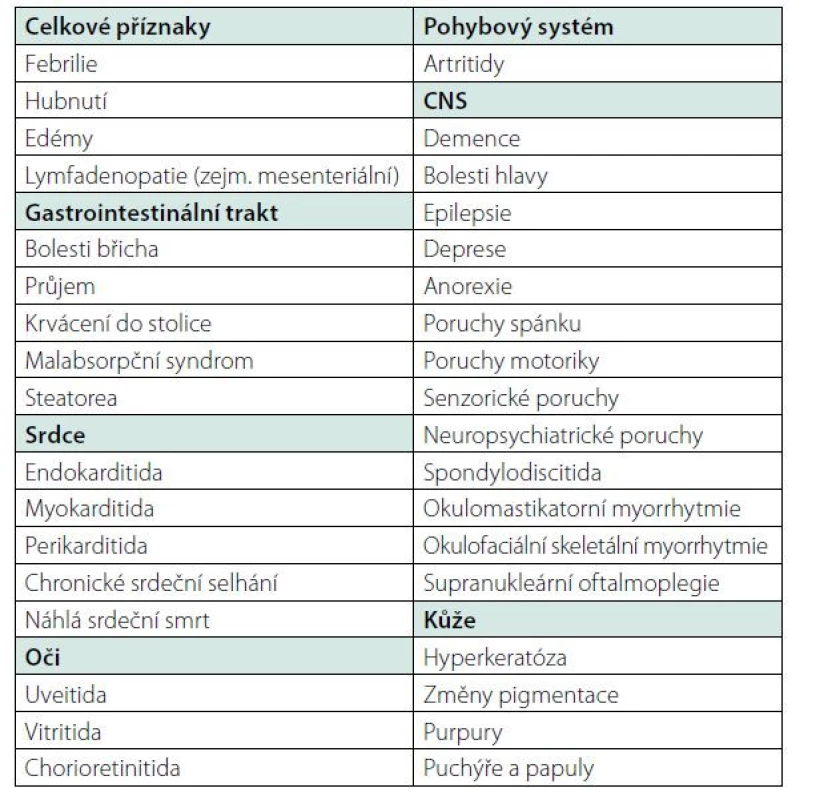
Diagnostika
Zlatým standardem je bioptické vyšetření (7) aborálního duodena v počtu alespoň 5 vzorků (9). Senzitivita barvení metodou PAS je přes 70 % (3). Následuje definitivní konfirmace pomocí PCR se senzitivitou 97 % a specificitou 100 % (1), kterou lze provádět i z klasických, ve formalínu fixovaných, do parafínu zalitých histologických vzorků (12). Může nastat situace, kdy je PCR vyšetření pozitivní při negativitě histologického nálezu. To lze mimo jiné vysvětlit například i nepravidelností léze, nízkou lokální infekční náloží či lokalizací infekce do submukózy střeva (15). Ani negativita biopsie a PCR vzorku duodena Whippleovu chorobu zcela nevylučuje. Při trvajícím klinickém podezření se doporučuje provést PCR z jiných tkání či tělesných tekutin (především synoviální tekutina, sliny, stolice). Při silné klinické suspekci u séronegativní artritidy, obzvláště s absencí systémových příznaků, může být diagnóza stanovena na základě PCR vyšetření synoviální tekutiny, pak teprve následuje klasické vyšetření gastrointestinálního traktu pro vyloučení systémového postižení. Provedení samostatného PCR z krve bez předchozí biopsie se považuje za málo senzitivní (20). Při neuroinfekcích je nutný odběr mozkomíšního moku na PCR vyšetření (7).
Průkaz přítomnosti Tropherymy je možné provést i imunohistochemicky (20), či díky charakteristické trojvrstevné stavbě buněčné stěny (8) i v elektronovém mikroskopu (3).
Po léčbě mohou typické makrofágy ve tkáních přetrvávat roky, PCR se ale stává negativní zpravidla do 12 měsíců (21).
Diferenciální diagnostika
Z hlediska diagnostiky je nejdůležitější na Whippleovu chorobu vůbec myslet. Je třeba zbystřit tam, kde dosavadní léčba (např. imunosupresivní) dlouhodobě nevede k terapeutickým úspěchům. Chybně podaná imunosupresivní terapie (především anti-TNF alfa preparáty), může urychlit a zhoršit průběh onemocnění, ale také demaskovat chorobu manifestací gastrointestinálních příznaků (22). Zpozornět je nutno také všude tam, kde léčba jiného souběžného bakteriálního onemocnění vede ke zlepšení zejména kloubních obtíží. Nově je popsán subtyp choroby přímo vyvolaný podáním imunosuprese (zejména anti-TNF alfa preparátů) asymptomatickým nosičům (2).
Klinická diferenciálně diagnostická rozvaha je velice široká a zahrnuje mimo jiné například jednotky, jako je revmatoidní artritida, adultní Stillova choroba, polymyalgia rheumatica, chronická borrelióza, chronická meningitida (7), mykobakteriózy včetně TBC (4), HIV, hyperthyreóza, hyperparathyreóza, systémová onemocnění pojiva, nespecifické střevní záněty (1), celiakie, sarkoidóza, nádorové procesy včetně lymfomů, Addisonova choroba, Castlemanova choroba (3), amyloidóza, choroby žaludku, pankreatu, jater a všechny další příčiny malabsorpčního syndromu (11). K odlišení od revmatologického onemocnění může pomoci i přítomnost anémie, která u revmatismu není tak typická (5).
PAS pozitivní makrofágy jsou pro Whippleovu chorobu charakteristické, nejsou však zcela patognomické. Obvyklé mucifágy střevní sliznice se ve standardním histologickém barvení hematoxylinem a eosinem makrofágům u Whippleovy choroby velmi podobají. I ve zcela zdravých uzlinách lze nalézt makrofágy s PAS pozitivitou (12). Z patologických stavů přichází v histologickém obraze diferenciálně diagnosticky v úvahu zejména primární lymfangiektázie (Waldmannova choroba), sekundární lymfangiektázie (například u konstriktivní perikarditidy, po chirurgickém zákroku – typicky Billroth II, při obstrukci lymfatických uzlin tumorem či po radioterapii), lymfangiomy, gastrické xantomy (vyskytují se častěji po resekcích, u gastritid, hypercholesterolemie, nejčastěji však z neznámého důvodu). Dále malakoplakie (12), makroglobulinemie, histiocytózy (18), abetalipoproteinemie, amyloidóza, autoimunitní enteritis, deficit zinku a vitaminu B12, alergie na proteiny jiné než gluten (vejce, mléko, sója) (13). Je třeba vyloučit difuzní karcinom žaludku z pečetních buněk či metastázu světlobuněčného karcinomu ledviny (12), řadu infekčních agens, především mykobakteriózy, infekci Rhodococcus equi, Histoplasma capsulatum (12), Bacillus cereus, Corynebacterium (18), parazitární onemocnění (giardiáza, capillariáza, strongyloidiáza, ankylostomóza) (13).
Terapie
Je nutná dlouhodobá terapie antibiotiky dobře prostupujícími hematoencefalickou bariérou. Doporučován je ceftriaxon 2 g i. v. jednou denně po 14 dní, následně kotrimoxazol 960 mg dvakrát denně po dobu jednoho roku. U pacientů nesnášejících ceftriaxon lze využít meropenem, v případě kotrimoxazolu doxycyklin v kombinaci s hydroxychloroquinem (5). Odpověď na antibiotickou terapii je dobrá, relapsy však časté (13), uvádí se u 17–35 % pacientů (19). Klinické zlepšení bývá patrné obvykle po 7–21 dnech, stav lze monitorovat sledováním hematokritu, tělesné hmotnosti, symptomů (15). Oční postižení může hůře reagovat na terapii (19). U patogena byla popsána rezistence na kotrimoxazol, spojená se selháním léčby (2).
Obvykle několik hodin po zahájení indukční terapie se může objevit Jarisch-Herxheimerova reakce (horečka, zimnice, bolesti hlavy, hypotenze, bolest břicha, výrazná bolest na hrudníku).
Asi 50 % pacientů s Whippleovou chorobou je před stanovením správné diagnózy nejprve léčeno DMARDS, glukokortikoidy, inhibitory TNF alfa a jinými biologickými preparáty (5). Po jejich vysazení se v horizontu týdnů (15) asi u 10 % pacientů (2) rozvíjí IRIS (immune reconstitution inflammatory syndrome = rebound fenomén při vysazení imunosupresivní terapie) s projevy, jako jsou horečka, artritida, pleuritida, erythema nodosum, perforace střeva (15). Neléčený syndrom může být fatální (5). Po vyloučení probíhající infekce je doporučeno podávání kortikoidů (2). Diagnózu IRIS je třeba přehodnotit v případě, pokud se zlepšení nedostaví ani do 24 hodin po nasazení steroidů (5). Hlavním rizikem pro vznik syndromu je dlouhodobá imunosupresivní terapie a postižení CNS (15).
Kontrola úspěšnosti léčby zahrnuje opakovanou endoskopii s biopsií (9) v intervalu 6 měsíců (5) a PCR periferní krve (9).
Do budoucna by se součástí léčebného postupu mohly stát vakcíny zaměřené proti původci onemocnění, zabraňující jednak znovuvzplanutí choroby, jednak omezující nutnost dlouhodobé antibiotické terapie. V současnosti jsou již vytipovány některé antigenní epitopy pro tuto vakcínu (23).
Kazuistika
Na doporučení praktického lékaře je pro intermitentní febrilie vzniklé po pobytu na Krétě v červenci 2011 přijat v únoru 2012 na infekční oddělení 49letý muž, kuřák, vysokoškolák žijící ve společné domácnosti s manželkou. Manželka i jeho 21letá dcera jsou zdravé, jeho rodinná anamnéza je bezvýznamná. V předchorobí pacient udává opakované angíny, jinak pouze běžná nachlazení, virózy, v dětství plané neštovice, před lety prodělal salmonelózu. Nyní se s ničím neléčí, přisátí klíštěte neguje, nevylučuje poštípání komárem. Na Krétě se stravoval jak v hotelové restauraci, tak mimo ni. Jedl místní sýry kupované v sýrárnách, tepelně upravené maso a ryby, zmrzlinu, navštívil pizzerii, vodu pil jen balenou. V okolí místa pobytu byla farma chovající ovce, kozy a slepice, do přímého kontaktu se zvířaty se však nedostal. Během deset dní trvající dovolené byl zcela bez obtíží.
Asi týden po návratu se objevila teplota v rozmezí 38–39 stupňů, zimnice, třesavka, bolesti hlavy, svalů, velkých i malých kloubů, zad. Nebyly patrné otoky kloubů ani vyrážka, chuť k jídlu byla dobrá, váhový úbytek pacient nezaznamenal. Teploty trvaly vždy maximálně 6 hodin, reagovaly na podání Paralenu, následovalo období bez příznaků v trvání asi 14 dnů, pak opět subfebrilie až febrilie kolem 38 stupňů. Pacient stav popisuje, jako by prodělával rychlou chřipku, kašel či rýmu neguje. Asi po roce těchto stále se opakujících obtíží se dostavuje vyrážka na horních a dolních končetinách (blíže nespecifikováno), kterou nikdy předtím neměl. Krevní obraz a biochemie vykazuje pouze mírnou elevaci CRP (14 mg/l). Pacient podstupuje zubní vyšetření, rtg vedlejších nosních dutin, hrudníku, sonografická vyšetření srdce, břicha, urologické vyšetření – vždy s negativním nálezem. Příčinu stavu neodhaluje ani kultivace moči a stolice včetně parazitologického vyšetření, hemokultury odebrané při horečce, sérologická vyšetření zaměřená na hepatitidy, listeriózu, tyfus, tularemii, toxoplazmózu, brucelózu, echinokokózu, leishmaniózu, CMV, EBV a další patogeny. Laboratorně je zachycena pouze mikrocytóza a pozitivní Widalova reakce, což je připisováno před lety prodělané salmonelóze. Negativní je vyšetření ASLO, RF, LD, beta-2-mikroglobulinu, výtěr z krku. Následuje spontánní zlepšení, exantém mizí, pacient je propuštěn.
Dále se opět objevují intermitentní febrilie, nemocný opakovaně navštěvuje praktického lékaře. Obtíže řeší Ibalginem. Gastroskopicky je zastižena lehká korporální hemoragická gastropatie, při kolonoskopii je vysloveno podezření z extramurální lymfadenopatie (nepravidelné vyklenutí céka při desuflaci), které CT vyšetření nepotvrzuje (zjišťuje pouze necharakteristické drobné uzliny paraaortálně). V roce 2014 se při horečce začínají objevovat otoky různých kloubů (zápěstí, kotník…), intermitentní leukocytóza. Mimo základní vyšetření je proveden revmatologický screening (ANCA, dsDNA, ENA, CIK, HLAB7/27, RF), vyšetření nádorových markerů CEA, CA19-9, PSA, sérologie HIV1 a 2, EBV, CMV, Borrelie včetně Western blotu, ELFO, imunofixační elektroforéza, vyšetření hladiny imunoglobulinů, koagulace, opětovně kultivace z moči, výtěr z krku, z nosu, CT hrudníku. Zaznamenána je pouze zvýšená sedimentace. Výsledky nevedou k žádnému specifickému závěru. Konečně CT břicha prokazuje četnou drobnou lymfadenopatii retroperitonea s infiltrací tuku v okolí radix mesenterii, a to v progresi oproti předchozímu nálezu. Vyšetření PET je bez záchytu patologicky zvýšené akumulace FDG. Trepanobiopsie kostní dřeně je v mezích normy. Je prokázána oligoklonalita lymfocytů. Po splnění tří hlavních a dvou vedlejších kritérií (horečky nad 39 stupňů, artralgie, intermitentní leukocytóza, mezenteriální lymfadenopatie, negativita ANA a RF) je pacient s diagnózou Stillovy choroby dospělých medikován kortikosteroidy a ponechán v péči revmatologa.
Do terapie je přidán metotrexát. Zpočátku dochází k ústupu potíží, CRP klesá. Postupně ovšem vyvstává nutnost navyšování dávek. Stav pacienta vede k přiznání nároku na invalidní důchod II. stupně. Další vývoj choroby vyžaduje opakované hospitalizace. Mimo jiné prodělává nemocný pásový opar. Metotrexát je dále zaměňován za azathioprin, cyklosporin, cyklofosfamid. Nakonec je v dubnu 2017 schválena biologická léčba – etanercept (inhibitor TNF alfa), na které se po dobu několika měsíců pacient zlepšuje, zejména ohledně kloubního postižení. Přetrvávají však intermitentní febrilie, exantémy a elevace zánětlivých markerů. Ke konci roku 2017 nastává selhání terapie a brzy nato nemocný přechází na kombinaci tocilizumab (inhibitor IL-6) + methotrexát, která u pacienta dobře ovlivňuje febrilie, ale ostatní obtíže neustupují. Pacient po celou dobu zůstává kortikodependentní, občas je nutná až hospitalizace s pulzy kortikoidů. Odpověď na antipyretika již začíná být proměnlivá.
Počátkem roku 2018 se u pacienta objevuje výraznější hubnutí (10 kg za 9 měsíců), gastrointestinální symptomatika v podobě průjmů a zvracení, horní i dolní dyspepsie, občasné bolesti břicha, okultní krvácení do stolice, anemizace. V červenci je opětovně vyšetřena stolice (bez průkazu Clostridium difficile, virových agens a s negativní bakteriální kultivací). Gastroskopicky jsou patrná pouze netypicky intenzivní lymfatika bulbu až pars descendens duodena, považovaná nejspíše za variantu normy. CT enterografie neprokazuje patologické změny kliček tenkého ani tlustého střeva. Dále plánováno kolonoskopické vyšetření. Je zvažována příčina gastrointestinálních obtíží v rámci základního onemocnění Stillovou chorobou, etiologie poléková či psychogenní. Histologické vyšetření sliznice bulbu a pars descendens duodena však mezitím v 1. i 2. čtení přináší diagnózu Whippleovy choroby s obrazem rozšíření střevních klků, četnými PAS pozitivními pěnitými makrofágy v lamina propria mucosae a nečetnými okrouhlými extracelulárními opticky prázdnými prostory, nejspíše odpovídajícími tukovým kapénkám. Diagnózu navíc potvrzuje i PCR vyšetření séra.
Od srpna 2018 dochází k obratu v léčbě, za hospitalizace je vysazena imunosuprese, postupně detrahovány kortikosteroidy a nasazen i.v. ceftriaxon v dávce 2 g/den. Následuje ústup febrilií, průjmů, zlepšení kloubních obtíží a nutričního stavu. Po dvou týdnech pacient opouští nemocnici s plánem celoroční kontinuální terapie kotrimoxazolem (960 mg 2krát denně).
Ihned po propuštění je řešena, nejspíše steroidy indukovaná, katarakta. Pro náhodně zjištěný srdeční šelest v rámci předoperační přípravy je indikováno echokardiografické vyšetření, které odhaluje středně těžkou aortální a těžkou mitrální insuficienci s plicní arteriální hypertenzí. Je připravována kardiochirurgická intervence, ale pátý den od propuštění je stav komplikován opětovnými febriliemi se suspekcí na akutní cholecystitidu. Následuje další antibiotická terapie s výhledem na provedení cholecystektomie a poté i kardiochirurgického výkonu. Mezitím pacient podstupuje transezofageální ultrazvuk srdce s nálezem endokarditidy aortální a mitrální chlopně. Provedená koronarografie je bez významných stenóz. Opakovaně odebrané hemokultury a lues aglutinace jsou negativní. Opět je zaveden i. v. ceftriaxon, pro alergickou reakci je však nutná záměna za doxycyklin. V říjnu 2018 je provedena úspěšná mechanická náhrada aortální a mitrální chlopně. Pooperačně však u pacienta dochází k srdečnímu selhání NYHA II s hemodynamicky významnou trikuspidální regurgitací. V tuto dobu pacienta též postihuje akutní flebitida pravé dolní končetiny. Znovu nastupuje hubnutí, průjmy, subfebrilie, CRP s oscilací kolem 100 mg/l. Pro podezření na IRIS jsou kombinována antibiotika, kortikosteroidy a plaquenil se zlepšením stavu. Zjišťujeme regresi histologického, endoskopického i PCR nálezu v duodenu.
Po vysazení kortikosteroidů v lednu 2019 se i přes normalizaci nutričního stavu opět objevují artralgie, subfebrilie, CRP v řádu desítek, nechutenství, zhoršuje se hybnost kloubů. Po vyloučení běžných zánětlivých fokusů a opětovném nasazení kortikoterapie obtíže ustupují.
Antibiotika jsou vysazena v listopadu 2019. Trvá subjektivní, endoskopická a PCR remise onemocnění, stále je však nutné trvalé podávání malé dávky kortikoidů. Je přítomna periferní neuropatie s diplopií, v dostupné dokumentaci se objevuje antidepresivní a anxiolytická medikace. V prosinci 2020 následuje ischemický iktus nejspíše kardioemboligenní etiologie s rychle se upravující levostrannou hemiparézou. Vzhledem k riziku relapsu Whippleovy choroby bude pacient celoživotně gastroenterologicky dispenzarizován.
Diskuze
Whippleova choroba představuje diagnostickou výzvu pro specialisty z mnoha různých medicínských oborů. Prezentovaný případ lze považovat za poměrně typický svým průběhem. Jedná se o onemocnění vzácné, obvykle bez specifických projevů, přesto by mělo být zahrnuto do diferenciálně diagnostické rozvahy. Po vyloučení častějších příčin obtíží má smysl na něj pomýšlet zejména u séronegativních artritid, horečky neznámého původu, malabsorpčního syndromu, endokarditid s negativní hemokultivací a u demence. Při včasném rozpoznání nemoci může cílená antibiotická léčba zabránit úmrtí a velmi efektivně a s minimálními náklady ovlivnit kvalitu života nemocných. Velkým problémem zůstává dlouhá prodleva od prvních příznaků ke stanovení správné diagnózy a dále také budoucí možný nárůst incidence Whippleovy choroby v souvislosti se stále častějším používáním moderní imunosupresivní terapie. I přes své limity, zejména v případě lokalizovaných extraintestinálních forem onemocnění, a přes dostupnost silně specifických a vysoce senzitivních molekulárně biologických diagnostických metod zůstává histologické vyšetření a role patologa zlatým standardem.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Leoš Chrudimský
Patologicko-anatomické oddělení, Nemocnice Jihlava, p. o. Vrchlického 59, 586 33 Jihlava
Cit. zkr: Vnitř Lék 2021; 67(e5): e3–e8
Článek přijat redakcí: 9. 4. 2021
Článek přijat po recenzích k publikaci: 13. 7. 2021
Zdroje
1. Kozák P. Whippleova choroba – myslíme na ni? Interní Med. 2018; 20(5): 269–273. Dostupné z DOI: http://doi 10.36290/int.2018.046.
2. Cardoso J, Gomes L, Santos S et al. Whipple‘s Disease: A Rare Cause of Malabsorption Syndrome. GE Port J Gastroenterol. 2020; 27(4): 283–289. Dostupné z DOI: http:// doi:10.1159/000504760.
3. Saito H, Shiode J, Ohya S et al. Whipple‘s Disease with Long-term Endoscopic Follow-up. Intern Med. 2018; 57(12): 1707–1713. Dostupné z DOI: http://doi:10.2169/internalmedicine.9631-17.
4. Ryška A, Dundr P, Zámečník J (ed) et al. Patologie. LD s. r. o.–Prager Publishing: Praha 2019 : 493–494. ISBN 978 80 270 6457 1.
5. Dolmans RA, Boel CH, Lacle MM, Kusters JG. Clinical Manifestations, Treatment, and Diagnosis of Tropheryma whipplei Infections. Clin Microbiol Rev. 2017; 30(2): 529–555. Dostupné z DOI: http://doi:10.1128/CMR.00033-16.
6. Elchert JA, Mansoor E, Abou-Saleh M, Cooper GS. Epidemiology of Whipple‘s Disease in the USA Between 2012 and 2017: A Population-Based National Study. Dig Dis Sci. 2019; 64(5): 1305–1311. Dostupné z DOI: http://doi:10.1007/s10620-018-5393-9.
7. Crews NR, Cawcutt KA, Pritt BS, Patel R, Virk A. Diagnostic Approach for Classic Compared With Localized Whipple Disease. Open Forum Infect Dis. 2018;5(7):ofy136. Published 2018 Jun 13. Dostupné z DOI: http://doi:10.1093/ofid/ofy136.
8. Antunes C, Singhal M. Whipple Disease. [Updated 2020 Jul 10]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2021 Jan-. Dostupné z WWW: https://www.ncbi. nlm.nih.gov/books/NBK441937/
9. Klener P, Češka R, Krejsek et al. Vnitřní lékařství. 4rd ed. Triton: Praha 2010 : 389. ISBN 978 80 7262 705 9.
10. Crews NR, Cawcutt KA, Pritt BS, Patel R, Virk A. Diagnostic Approach for Classic Compared With Localized Whipple Disease. Open Forum Infect Dis. 2018; 5(7): ofy136. Published 2018 Jun 13. Dostupné z DOI: http://doi:10.1093/ofid/ofy136.
11. Povýšil C, Šteiner I, Dušek J et al. Speciální patologie. 2nd ed. Galén: Praha 2007 : 160. ISBN 978 80 7262 494 2.
12.Lauwers G, Montgomery E, Srivastava A et al. Diagnostic pathology: Gastrointestinal. 2nd ed. In: Greenson J (ed). Diagnostic Pathology: Gastrointestinal. Elsevier: Philadelphia 2016 : 216–217, 240–2243, 264–2265, 434–2435. ISBN 978 0 323 37673 0.
13. Goldblum J, McKenney J, Lamps L et al. Rosai and Ackermans surgical pathology, 11th ed. Elsevier: Philadelphia 2018 : 576–2577, 1561. ISBN 978 0 323 26339 9.
14. Lukáš K, Žák A, Jirásek V et al. Gastroenterologie a hepatologie. Grada Publishing: Praha 2007 : 116. ISBN 978 80 247 1787 6.
15. Lopes A, Santos AF, Alvarenga MJ, Mello E, Silva A. Whipple‘s disease: a rare case of malabsorption. BMJ Case Rep. 2018; 2018: bcr2017222955. Published 2018 Mar 5. Dostupné z DOI: http://doi:10.1136/bcr-2017-222955.
16. Chandra SR, Raj P, Pai AR, Reddy N. A Case of Whipple‘s Disease: A Very Rare Cause for Rapidly Progressive Dementia. Indian J Psychol Med. 2018; 40(3): 280–283. Dostupné z DOI: http://doi:10.4103/IJPSYM.IJPSYM_149_17.
17. Kutlu O, Erhan SŞ, Gökden Y, Kandemir Ö, Tükek T. Whipple‘s Disease: A Case Report. Med Princ Pract. 2020; 29(1): 90–93. Dostupné z DOI: http://doi:10.1159/000498909.
18. Thornton CS, Wang Y, Köebel M et al. Another Whipple‘s triad? Pericardial, myocardial and valvular disease in an unusual case presentation from a Canadian perspective. BMC Cardiovasc Disord. 2019; 19(1): 312. Published 2019 Dec 23. Dostupné z DOI: http:// doi:10.1186/s12872-019-1257-2.
19. Říhová E, Brichová M, Jeníčková D et al. Uveitidy. Grada Publishing: Praha 2009 : 44. ISBN 978 80 247 2897 1.
20. Quartuccio L, Giovannini I, Pizzolitto S, Scarpa M, De Vita S. Seronegative Arthritis and Whipple Disease: Risk of Misdiagnosis in the Era of Biologic Agents. Case Rep Rheumatol. 2019; 2019 : 3410468. Published 2019 Oct 13. Dostupné z DOI: http:// doi:10.1155/2019/3410468.
21. Mills S, Greenson J, Hornick J (eds) et al. Sternbergs diagnostic surgical pathology. 6th ed. Wolters Kluwer Health: Philadephia 2015 : 1453–1454. ISBN 978 1 4511 8875 2.
22. Glaser C, Rieg S, Wiech T et al. Whipple‘s disease mimicking rheumatoid arthritis can cause misdiagnosis and treatment failure. Orphanet J Rare Dis. 2017; 12(1): 99. Published 2017 May 25. Dostupné z DOI: http://doi:10.1186/s13023-017-0630-4.
23. Joshi A, Kaushik V. In-Silico Proteomic Exploratory Quest: Crafting T-Cell Epitope Vaccine Against Whipple‘s Disease [published online ahead of print, 2020 May 18]. Int J Pept Res Ther. 2020; 1–11. Dostupné z DOI: http://doi:10.1007/s10989-020-10077-9.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2021 Číslo E-5- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Whippleova nemoc – systémová choroba s gastrointestinálními projevy
- Preleukemické fúzne gény typické pre akútnu myeloidnú leukémiu
- Retrospektivní analýza výskytu plicní embolie v CT obraze u pacientů s pozitivní hodnotou D-dimerů
- Věnujeme medikaci seniorů dostatečnou péči? (Případ Domova Vlčí mák ÚVN Praha)
- Mortalita pacientů s covidem-19 na JIP – naše zkušenosti
- D-laktátová acidóza – zriedkavá komplikácia syndrómu krátkeho čreva
- K životnímu jubileu prof. MUDr. Lenky Špinarové, Ph.D., FESC
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- D-laktátová acidóza – zriedkavá komplikácia syndrómu krátkeho čreva
- Věnujeme medikaci seniorů dostatečnou péči? (Případ Domova Vlčí mák ÚVN Praha)
- Whippleova nemoc – systémová choroba s gastrointestinálními projevy
- Mortalita pacientů s covidem-19 na JIP – naše zkušenosti
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



