-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Diferenciální diagnostika zvětšení hypofýzy
Differential diagnosis of pituitary enlargement
Enlargement of the pituitary gland is heterogenous in the etiology. Common causes of pituitary enlargement are physiological hypertrophy during pregnancy, primary and secondary tumors, autoimmune hypophysitis including side effects of anticancer therapy with check-point inhibitors. Terms like hypertrophy, hyperplasia, sellar expansion and hypophysitis are commonly used to describe enlargement of the pituitary gland on MR scan regardless its etiology.
The most common pathology causing pituitary gland enlargement is pituitary adenoma. Magnetic resonance imaging can differentiate pituitary tumors from diffuse enlargement due to hypophysitis in most but not all cases. Changes on imaging during time or response to pharmacotherapy might help determine the final diagnosis in uncertain cases.
We present a case report of a young woman with sellar expansion due to prolonged untreated peripheral hypothyroidism mimicking pituitary adenoma. Interdisciplinary cooperation of endocrinologist, radiologist and neurosurgeon is crucial in determining the diagnosis.
Keywords:
Hypothyroidism – hypophysitis – immune checkpoint inhibitors – pituitary tumor – sellar expansion
Autori: Katarína Štěchovská 1; Tomáš Tůma 2; Václav Masopust 3; Mikuláš Kosák 1
Pôsobisko autorov: Ústřední vojenská nemocnice, Interní klinika 1. LF UK a ÚVN, Praha 1; Ústřední vojenská nemocnice, Radiodiagnostické oddělení, Praha 2; Ústřední vojenská nemocnice, Neurochirurgická a neuroonkologická klinika 1. LF UK a ÚVN, Praha 3
Vyšlo v časopise: Vnitř Lék 2022; 68(1): 58-63
Kategória:
Súhrn
Diferenciální diagnostika zvětšení hypofýzy zahrnuje fyziologické a patologické procesy. Používání termínu hyperplazie hypofýzy, hypofyzitida nebo selární expanze není v české ani zahraniční literatuře konzistentní a popisuje nález zvětšení hypofýzy při zobrazovacím vyšetření bez ohledu na příčinu. Nejčastější příčinou nefyziologického zvětšení hypofýzy je adenom. Další příčiny zahrnují fyziologické zvětšení v třetím trimestru gravidity, jiné primární a sekundární nádory, autoimunitní hypofyzitidu, infiltrativní procesy při sarkoidóze, histiocytóze a další. Narůstá incidence hypofyzitidy vzniklé v důsledku onkologické imunoterapie checkpoint inhibitory.
V některých situacích, zejména u centrálně lokalizovaných lézí, může být těžké rozlišit hypofyzární adenom od difuzního zvětšení vzniklého z jiných příčin např. na podkladě hypofyzitidy. Někdy nelze z jednorázového vyšetření jednoznačně určit příčinu zvětšení hypofýzy a diagnóza je stanovena dle vývoje nálezu na kontrolních zobrazovacích vyšetřeních nebo na základě odpovědi na terapii kortikoidy.
V kazuistice uvádíme příklad zvětšení hypofýzy imitující adenom u pacientky s dlouhotrvající neléčenou těžkou periferní hypotyreózou. Postup stanovení diagnózy je založen na mezioborové spolupráci endokrinologa, neurochirurga a radiologa.
Klíčová slova:
adenóm hypofýzy – hypotyreóza – checkpoint inhibitory – hypofyzitida – selární expanze
Kazuistika
37letá pacientka byla vyšetřena pro bolesti hlavy ve frontální oblasti, únavu, poruchu soustředění. Byla provedena magnetická rezonance (MR) mozku s nálezem selární expanze o rozměru 13 x 15 x 12 mm, která byla v kontaktu s chiasma optikum (Obr. 1, 2). Oční vyšetření s perimetrem výpadky v zorném poli neprokázalo. S těmito nálezy byla pacientka odeslána na neurochirurgickou kliniku k určení dalšího postupu. Nález imponoval jako adenom hypofýzy. K endokrinologickému vyšetření byla pacientka odeslána na naši kliniku. Pacientka byla v minulosti léčena na endokrinologii pro hypothyreózu na podkladě autoimunitní thyreoiditidy. Substituční léčbu levothyroxinem v dávce 100 μg/den ale vysadila více než před rokem z obavy, že je příčinou alopecie a na další kontroly nedocházela. Klinický obraz odpovídal hypothyreóze (únava, zimomřivost) a laboratorní nálezy toto podezření potvrdily – elevované hodnoty TSH (265 mU/l) a snížená hodnota fT4 (2,1 pmol/l), elevace titrů autoprotilátek anti‑TG (113 kU/l) a anti‑TPO (232 kU/l). Dále byla přítomna mírná hyperprolaktinemie (1611 mIU/l), hraniční hodnota sérového kortizolu (192,6 nmol/l), hypercholesterolemie (9,07 mmol/l) s hypertriglyceridemií (3,53 mmol/l), hodnoty FSH, LH, IGF-1 byly v normě. Ultrazvukový nález na štítné žláze odpovídal autoimunitní thyreoiditidě. Pacientce byla nasazena substituční léčba levothyroxinem a vzhledem k hraniční hodnotě sérového kortizolu byla zahájena i substituce hydrokortisonem. Deficit kortizolu byl posléze vyloučen ACTH stimulačním testem, při kterém došlo k adekvátnímu vzestupu S‑kortizolu na 603 nmol/l a hydrokortison mohl být posléze vysazen. Při dalších kontrolách byl dokumentován postupný pokles TSH, vzestup fT4 s úpravou dyslipidemie a hyperprolaktinemie a ústupem symptomů. Již kontrolní MR v odstupu 3 měsíců od zahájení léčby prokázala částečnou regresi nálezu (Obr. 3, 4). Další vyšetření po 12 měsících potvrdilo kompletní regresi (Obr. 5, 6). Jednalo se tedy o difuzní zvětšení hypofýzy při těžké periferní hypothyreóze na podkladě hyperplazie buněk produkujících TSH imitující adenom hypofýzy s regresí po zahájení substituční léčby levothyroxinem.
Obr. 1. Magnetická rezonance mozku v sagitálním řezu v postkontrastním T1-váženém obraze, hvězdička označuje zvětšenou hypofýzu před zahájením substituční léčby hypotyreózy 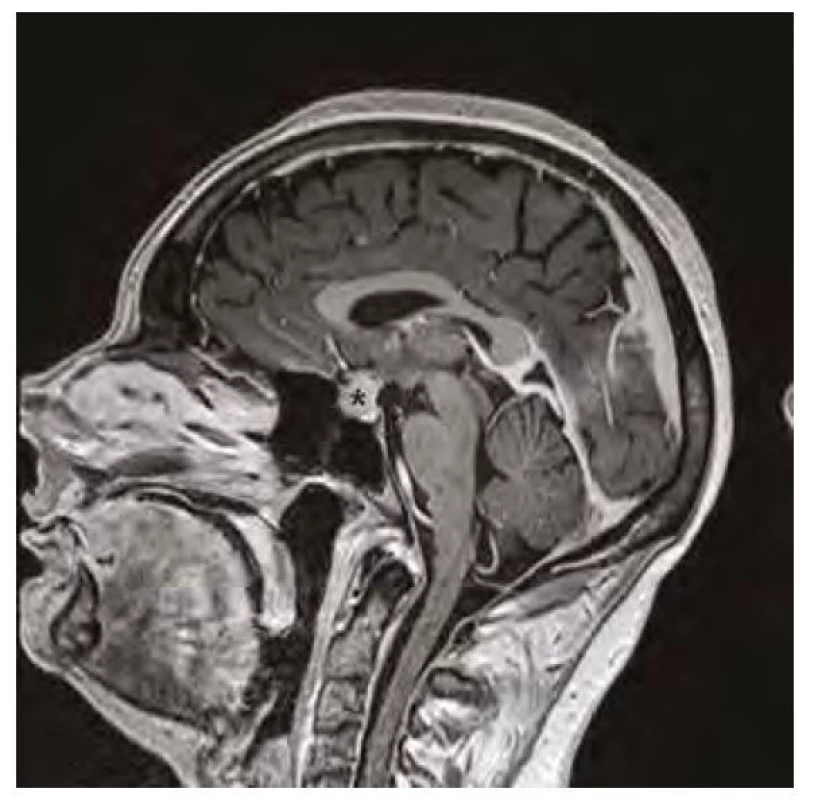
Obr. 2. Magnetická rezonance mozku ve frontálním řezu v postkontrastním T1-váženém obraze, hvězdička označuje zvětšenou hypofýzu před zahájením substituční léčby hypotyreózy 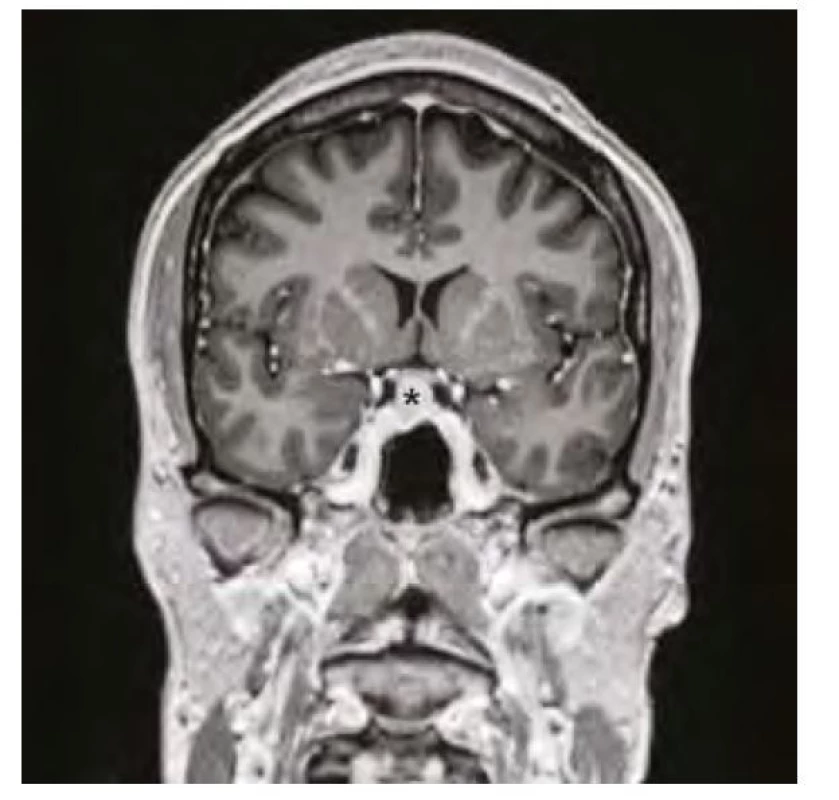
Obr. 3. Kontrolní magnetická rezonance mozku (sagitální řez v postkontrastním T1-váženém obraze) po 3 měsících substituční hormonální léčby, hvězdička zobrazuje regresi hyperplazie hypofýzy 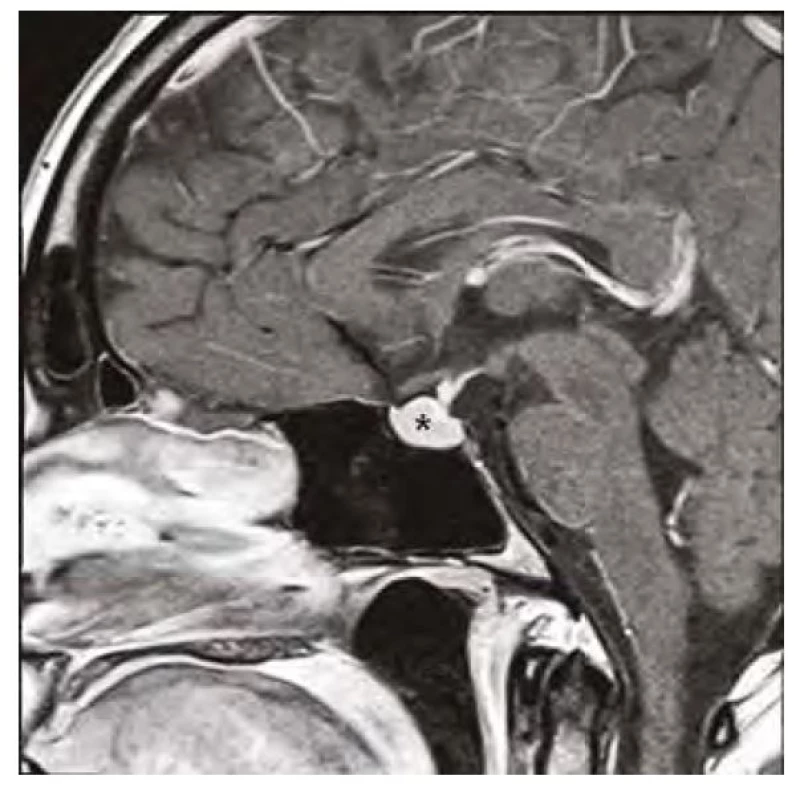
Obr. 4. Kontrolní magnetická rezonance mozku (frontální řez v postkontrastním T1-váženém obraze) po 3 měsících substituční hormonální léčby, hvězdička zobrazuje regresi hyperplazie hypofýzy 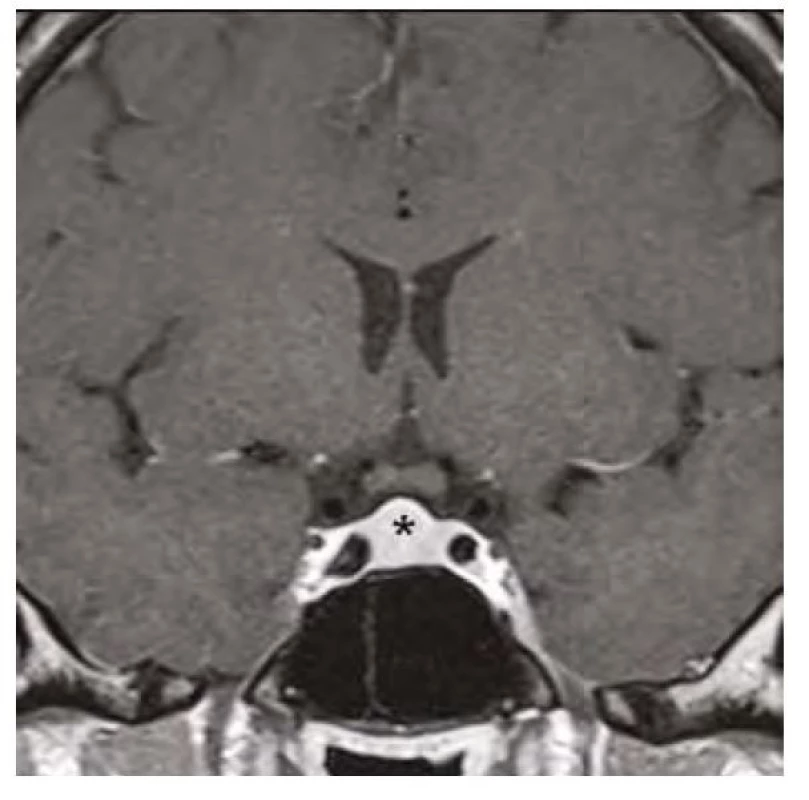
Obr. 5. Kontrolní magnetická rezonance mozku ve frontálním řezu v postkontrastním T1-váženém obraze, hvězdička označuje zmenšenou hypofýzu po 12 měsících substituční hormonální léčby 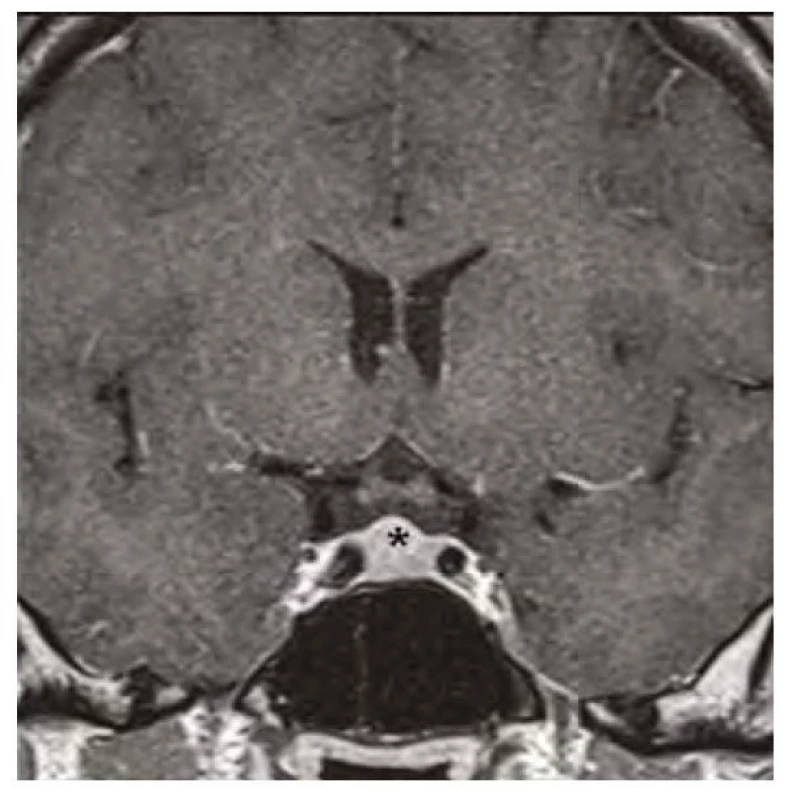
Obr. 6. Kontrolní magnetická rezonance mozku ve sagitálním řezu v postkontrastním T1-váženém obraze, hvězdička označuje zmenšenou hypofýzu po 12 měsících substituční hormonální léčby 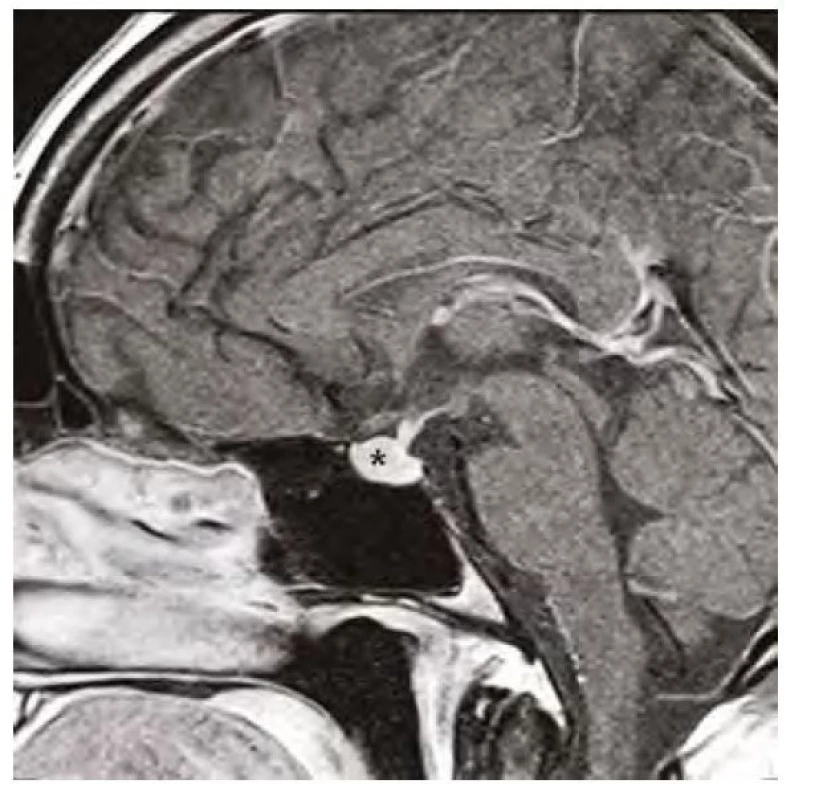
Úvod
Centrálním orgánem endokrinního systému je hypofýza skládající se ze dvou částí, přední adenohypofýzy a zadní neurohypofýzy. Je uložena v tureckém sedle a stopkou (infundibulem) spojena s hypothalamem. Anatomické rozměry hypofýzy jsou ve vertikálním rozměru do 6–9 mm, předozadním 9 mm a transverzálním do 13 mm, průměrná hmotnost je 600 mg. Normální kraniokaudální velikost hypofýzy prepubertálně dle magnetické rezonance je 2–6 mm, u dospělých žen je horní hranice normy 10 mm (1, 2). Normální šíře v infundibulu je do 3 mm (2).
Fyziologicky dochází ke zvětšení hypofýzy v období puberty, v graviditě a přetrvává u multipar. Ke změnám velikosti dochází i během menstruačního cyklu. Nejvýraznější fyziologické zvětšení se vyskytuje během 3. trimestru gravidity, kdy dochází ke zvětšení až o 70 % původního objemu. Podkladem zvětšení je hypertrofie laktotropních buněk v adenohypofýze. Kraniokaudální rozměr hypofýzy v těhotenství a v období laktace dosahuje až 12 mm. V průběhu 2–6 měsíců po porodu dojde k částečnému zmenšení, což vysvětluje větší objem hypofýzy u multipar ve srovnání s nullipary (2–5).
Epidemiologie
Náhodné nálezy expanzivních procesů hypofýzy ve velikosti do 10 mm byly zaznamenány u 6–10 % všech magnetických rezonancí prováděných z jiných důvodů než pro suspekci na nádor hypofýzy. Jedná se nejčastěji o mikroadenomy, drobné cysty, jiné nádory nebo zánětlivá ložiska (3).
Nejčastější nádorové léze hypofýzy jsou adenomy. Jejich prevalenci je obtížné přesně určit, protože část adenomů je klinicky němá. Adenom hypofýzy byl v pitevních studiích popsán ve 14 % případů, v radiologických studiích až ve 22 %. U žen je jejich výskyt ve srovnání s muži dvojnásobný (6).
Autoimunitní hypofyzitida je vzácné onemocnění vyskytující se nejčastěji u žen v období těhotenství a po porodu a jenom sporadicky u dětí a mužů (7). Často bývá asociovaná s jinými autoimunitními chorobami, typicky s Hashimotovou thyreoiditidou (8).
U pacientů léčených protinádorovou imunoterapií checkpoint inhibitory je autoimunitní hypofyzitida jednou z nejčastějších endokrinologických komplikací léčby. Dle klinických studií je její incidence 1,8–17 % (9–11).
Diagnostika
Klinický obraz
Symptomy zvětšení hypofýzy jsou do značné míry nespecifické. Typickým nálezem je porucha zraku vznikající při tlaku na chiasma optikum. Vnímání výpadku v zorném poli je ale interindividuálně značně rozdílné, proto někteří pacienti přichází až s pokročilými nálezy. Dalším možným příznakem je bolest hlavy obvykle lokalizovaná do oblasti za kořenem nosu. Při paraselární propagaci procesu s infiltrací kavernózního splavu mohou být projevem i další neurologické symptomy vyplývající z útlaku okohybných nervů. Symptomy vyplývající z hormonální nedostatečnosti jsou dané chybějícím hypofyzárním tropním hormonem. Při deficitu TSH je projevem centrální hypothyreóza, která se svými projevy neliší od periferní hypothyreózy. Centrální hypokortikalismus vznikající při deficitu ACTH se může projevit únavou, bolestmi kloubů, nauzeou a hubnutím. Hypogonadismus se u žen manifestuje výpadky v menstruačním cyklu (oligo‑amenorrhea), u mužů jsou klinickými projevy erektilní dysfunkce, pokles libida, úbytek ochlupení a svalové hmoty a nižší svalová síla.
Zobrazovací vyšetření
Standardním vyšetřením pro hodnocení morfologického nálezu na hypofýze je magnetická rezonance cílená na selární oblast – tedy s tenkými řezy a v případě absence kontraindikací s podáním kontrastní látky. Počítačová tomografie má nízkou senzitivitu, a proto ji používáme pouze výjimečně v případech, kdy je vyšetření magnetickou rezonancí kontraindikované.
Oční vyšetření
V případě nálezu selární expanze, která je v kontaktu s chiasma optikum, je třeba provést oční vyšetření se zhodnocením perimetru. Při útlaku zrakové dráhy expanzí v selární oblasti je typickým nálezem bitemporální hemianopsie. V klinické praxi jsou výpadky v zorném poli často asymetrické s akcentací postižení na jednom oku.
Laboratorní diagnostika
Nález zvětšené hypofýzy na zobrazovacím vyšetření (nejčastěji MR) by měl být vždy indikací k laboratornímu zhodnocení hypofyzárních funkcí. Cílem je vyloučit deficit hypofyzárních hormonů (hypopituitarismus). Kromě základních odběrů, jako je krevní obraz, mineralogram, glykemie, je dále zapotřebí stanovit ranní hladinu kortizolu, TSH, fT4, prolaktinu, FSH, LH, estradiolu u žen a testosteronu u mužů. Pro centrální poruchy je charakteristická nízká hladina periferních hormonů (fT4, kortizol, testosteron/estradiol). Hladiny hypofyzárních hormonů (TSH, ACTH, gonadotropiny) mohou být u pacientů s hypopituitarismem v normě. Hodnoty ranní kortizolemie jsou často nediagnostické a pokud je hladina ranního sérového kortizolu v rozmezí 200–450 nmol/l, je k vyloučení hypokortikalismu nutné doplnit stimulační test (nejčastěji ACTH stimulační test či inzulinový toleranční test). Podrobnosti stran přesných indikací, kontraindikací a provedení jednotlivých testů přesahují svým rozsahem zaměření toho článku. Pokud je v rámci diferenciální diagnostiky zvažován adenom, pak je třeba doplnit příslušná vyšetření k vyloučení hormonální aktivity expanze. Tedy zejména stanovit hladinu prolaktinu (k vyloučení prolaktinomu) a IGF-1 jako screeningový test k vyloučení akromegalie.
Deficit hypofyzárních hormonů může postihovat pouze některé osy, či všechny funkce – pak hovoříme o panhypopituitarismu. U adenomů hypofýzy, i jiných selárních nádorů, dochází typicky iniciálně k poklesu produkce růstového hormonu a poruše funkce gonadotropní osy a až posléze k postižení osy kortikotropní a thyreotropní. Naproti tomu u hypofyzitid je typickým nálezem právě porucha kortikotropní či tyreotropní osy, přičemž k postižení gonadotropní osy dochází méně často (12, 13). Pro imunoterapií indukované hypofyzitidy je typický izolovaný deficit ACTH způsobující centrální hypokortikalismus, přičemž poruchy ostatních os jsou mnohem méně časté. Z laboratorních nálezů, které mohou upozornit na možný hypokortikalismus, je třeba uvést hypoosmolární hyponatremii – jinak nevysvětlitelná hyponatremie by měla být vždy indikací k vyloučení hypokortikalismu. Častým nálezem v akutní fázi lymfocytární hypofyzitidy je hyperprolaktinemie, která může vést k diagnostickým rozpakům (14) a mylné diagnóze prolaktinomu.
Diferenciální diagnostika příčiny difuzního zvětšení hypofýzy
Nádory hypofýzy
Adenomy hypofýzy jsou nejčastějšími nádory hypofýzy. Jde o benigní nádory vycházející z předního laloku hypofýzy (adenohypofýzy). Základní dělení zohledňuje jejich hormonální aktivitu – adenomy funkční (adenomy produkující hormony a vyvolávající příslušné klinické příznaky) a adenomy afunkční (adenomy neprodukující klinicky významná množství hormonů). Hormonálně aktivní adenomy se manifestují nejčastěji typickým klinickým obrazem odpovídajícím hormonální nadprodukci. U hormonálně afunkčních adenomů převládají příznaky z útlaku hypofýzy (deficit hypofyzárních hormonů – hypopituitarismus) a okolních struktur (zrakový nerv, okohybné nervy, kavernózní splav, u gigantických adenomů tlakem na hypothalamus, frontální/temporální lalok). Vzácně se mohou adenomy hypofýzy manifestovat hydrocefalem. Terapie adenomu spočívá v kombinaci farmakoterapie, neurochirurgických a radioterapeutických postupů dle typu a velikosti nádoru se zohledněním dalších faktorů, jako je věk a preference pacienta.
Dalšími nádory v selární oblasti jsou cysty, kraniofaryngeom, pituicytom, meningeom a další. Tyto nádory mají obvykle specifické charakteristiky při zobrazovacím vyšetření a v diferenciální diagnostice zvětšení hypofýzy je obvykle není třeba zvažovat.
Tab. 1. Diferenciální diagnostika zvětšení hypofýzy 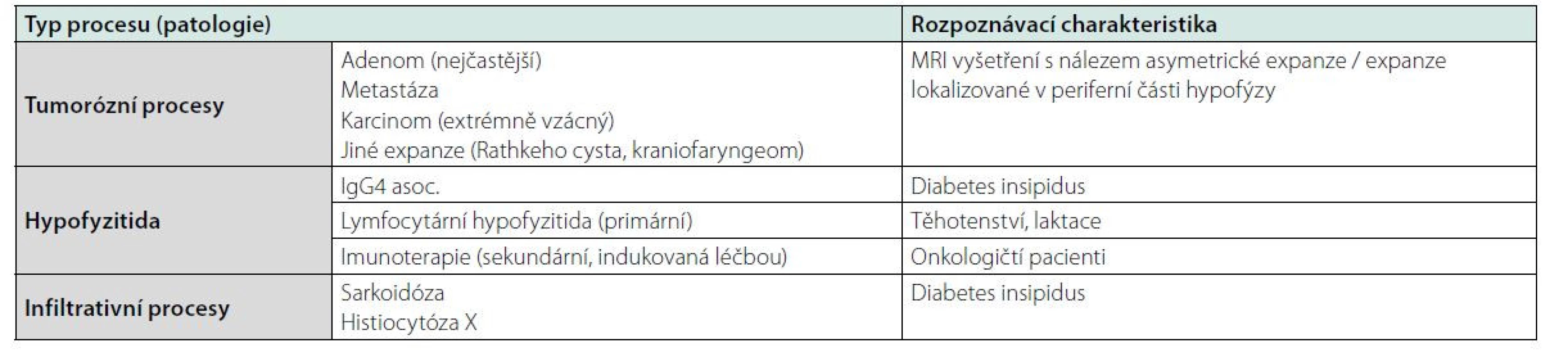
Hyperplazie hypofýzy při deficitu hormonů periferních žláz
Ke zvětšení hypofýzy může dojít při deficitu hormonů periferních žláz. Nejčastěji k tomu dochází při neléčené primární hypothyreóze. Podkladem je hyperplazie buněk produkujících TSH. Tak, jak je uvedeno v naší kazuistice, může nález na MR imitovat adenom hypofýzy (někdy je používán termín pseudotumor). Po zahájení substituční léčby dochází k regresi zvětšení. Ostatní periferní hormonální deficity obvykle ke zvěšení hypofýzy nevedou, nicméně kazuisticky bylo popsáno zvětšení hypofýzy u pacientů s periferním hypokortikalismem (Addisonovou chorobou).
Hypofyzitida
Hypofyzitidy lze klasifikovat podle etiologie nebo histologického nálezu. Konvenčně se hypofyzitidy klasifikují na základě etiologie na onemocnění, které poškozují primárně hypotalamo‑hypofyzární struktury (tzv. primární hypofyzitidy) nebo sekundární hypofyzitidy. Nejčastějším primárním onemocněním je lymfocytární hypofyzitida a idiopatická granulomatózní hypofyzitida (15).
Sekundární hypofyzitidy vznikají při některých autoimunitních onemocněních (systémový lupus erythematosus a granulomatózy s polyangiitidou) a jako vedlejší efekty léčby checkpoint inhibitory. Dále mohou hypofýzu postihnout infiltrativní procesy (sarkoidóza, histiocytóza či vzácně lymfoproliferativní onemocnění).
Stejně jako u ostatních selárních expanzí může dojít při zvětšení hypofýzy způsobené hypofyzitidou k supraselární propagaci procesu s kompresí optických drah vedoucí k výpadku v zorném poli (s typickou distribucí poruchy bitemporální hemianopsie) a také k poruše barvocitu a snížení zrakové ostrosti. Při infiltraci kavernózních splavů může dojít ke vzniku okohybných poruch (16). Častým klinickým symptomem hypofyzitid je bolest hlavy, typicky lokalizovaná frontálně ve střední části za kořenem nosu.
Diagnóza hypofyzitidy je založena na příznacích, laboratorních vyšetřeních a zobrazovacích metodách (MR). Biopsie hypofýzy se provádí vzácně. Někdy je diagnóza stanovena na základě příznivé terapeutické odpovědi (regrese objemu) na kortikoidy (viz dále).
K léčbě primární hypofyzitidy se používají kortikosteroidy, farmakoterapie může být eskalovaná na terapii azathioprinem, methotrexátem, mycofenolátem, rozšířená o radioterapii, případně biologickou léčbu rituximabem. Nedílnou součástí je v případě průkazu deficitu hypofyzárních hormonů substituce dané osy.
Hypofyzitida asociovaná s checkpoint inhibitory
Hypofyzitida se může vyskytnout jako vedlejší efekt onkologické léčby checkpoint inhibitory (17). První checkpoint inhibitor používaný v terapii melanomu byl ipilimumab (CTLA4 protilátky). Novější PD1 a PD‑L1 inhibitory jsou používané pro terapii celé řady maligních onemocnění. Postižení hypofýzy při léčbě checkpoint inhibitory se častěji vyskytuje u mužů a starších osob v porovnání s primární lymfocytární hypofyzitidou (18). K rozvoji hypofyzitidy dochází obvykle do 3. cyklu terapie a cca od 5. do 36. týdne od započetí léčby (19). Byly ale popsány případy hypofyzitid diagnostikovaných 19 měsíců po zahájení léčby (20, 21). Kombinační léčba CTLA-4 s anti PD-1 je asociovaná s dřívějším rozvojem hypofyzitidy (22).
Poměrně široký rozptyl uváděné incidence imunoterapií indukovaných hypofyzitid je ovlivněn různými faktory, zejména nekonzistentní definicí termínu hypofyzitida a délkou sledování. Riziko rozvoje hypofyzitidy ovlivňuje i konkrétní typ checkpoint inhibitoru (23). Při nízkodávkových režimech léčby anti‑CTLA - 4 (do 3 mg/kg ipilimumabu) je uváděná incidence pouze 1,8–3,3 %, u vyšších dávek se zvyšuje na 4,9–17 %. V metaanalýze 34 studií byla incidence hypofyzitid u terapie anti‑PD - 1 a anti‑PD‑L1 nižší (do 3 %) než u terapie CTLA-4 inhibitory (24). Kombinovaná terapie ipilimumabem s anti‑PD - 1 nivolumabem je asociovaná se zvýšeným rizikem hypofyzitidy v porovnání s monoterapií ipilimumabem (RR=1,94 [95% CI: 1,7–3,5]) (25). Postupná léčba anti‑CTLA - 4 a anti‑PD1 zvyšuje riziko rozvoje hypofyzitidy na úroveň kombinované terapie (26). Kromě toho byla vysoká míra zaznamenána i u pacientů léčených adjuvantní terapií bevacizumabem nebo aktivní buněčnou imunoterapií (27, 28). Zvýšená incidence hypofyzitidy nebyla pozorována u kombinační terapie ipilimumabu s chemoterapií jako carboplatina, dacarbazine, paclitaxel a fotemustine nebo v kombinaci s vemurafenibem a dabrafenibem v porovnání s monoterapií ipilimumabem (29–31). Ve srovnání s idiopatickou hypofyzitidou, která je častější u žen, je incidence checkpoint inhibitory asociovaných hypofyzitid vyšší u mužů.
Klinické projevy jsou podobné jiným formám hypofyzitid. Všichni pacienti na terapii checkpoint inhibitory s nově udávanou bolestí hlavy nebo podezřením na deficit kortizolu by měli být vyšetřeni pro podezření na hypofyzitidu (32). Výskyt zrakových symptomů je vzácný a je indikací pro léčbu vysokými dávkami kortikoidů s cílem ovlivnění velikosti hypofýzy. Endokrinní nedostatečnosti jsou zaznamenané u více než 70 % pacientů, obvykle bývá vyjádřena nedostatečná produkce ACTH s normální sekrecí TSH a gonadotropinů (33). Poměrně často vznikají při léčbě checkpoint inhibitory periferní poruchy funkce štítné žlázy – tedy primární hypothyreóza, která někdy předchází hyperfunčkní fáze. Diabetes insipidus v důsledku imunoterapií indukované hypofyzitidy je raritní (17, 32). Obvykle jde o permanentní poruchy a zejména v případě sekrece ACTH je obnovení endogenní produkce výjimečné (32, 33). Radiologicky nelze rozlišit CTLA-4 indukovanou hypofyzitidu od primárních, ale radiologické nálezy mohou předcházet klinickou manifestaci o několik týdnů (18). Pozitronová emisní tomografie s fluordeoxyglukózou (FDG PET) u onkologických pacientů má potenciál identifikovat rozvíjející se hypofyzitidy, pankreatitidy, adrenalititidy a tyreoiditidy při vyšetřeních z indikace sledování efektu onkologické terapie. Management imunoterapií indukované hypofyzitidy obvykle spočívá jen v substituční terapii bez nutnosti přerušovat či dokonce ukončit léčbu onkologického onemocnění. Pouze závažné stavy, které se vyskytují naštěstí vzácně, se symptomy vyplývající z útlaku paraselárních struktur vyžadující léčbu vysokými dávkami kortikosteroidů mohou být důvodem k přerušení onkologické léčby. Podle některých prací je rozvoj endokrinologických i jiných komplikací při léčbě checkpoint inhibitory spojen s větší pravděpodobností dosažení remise základního onkologického onemocnění.
Hypofyzitida asociovaná s IgG4
Hypofyzitida asociovaná s IgG4 byla poprvé popsána v roce 2004 (34), retrospektivně se ukázalo, že se jedná až o 41 % hypofyzitid původně klasifikovaných jako lymfocytární hypofyzitida. Exaktní role IgG4 v patogenezi tohoto onemocnění není ještě přesně definována. Často jsou přítomné pseudotumory s IgG4-dominantní plazmatickou infiltrací různých orgánů. Nejčastější IgG4-související patologie asociovaná s nemocí hypofýzy je retroperitoneální fibróza. Specifické pro diagnózu IgG4 hypofyzitidy je přítomnost víc než 10 IgG4 pozitivních buněk na zorné pole a poměr IgG4/IgG‑pozitivních buněk je víc než 40 % při provedení biopsie. Sérové hladiny IgG4 nejsou specifické pro IgG4-asociovaná onemocnění. Wallance et al. předpokládají, že zvýšené hladiny IgG4 má podskupina pacientů s multiorgánovým postižením (35). Z endokrinologického hlediska je prvním projevem IgG4 hypofyzitidy nejčastěji diabetes insipidus s možným rozvojem deficitu hormonů adenohypofýzy v dalším průběhu choroby. K zobrazení systémového postižení se používá FDG PET. Léčba spočívá v imunosupresivní terapii kortikosteroidy.
Infiltrativní procesy
Histiocytóza z Langerhansových buněk (LCH)
Histiocytóza z Langerhansových buněk je raritní onemocnění, více se vyskytující v dětské populaci. První manifestace je často centrální diabetes insipidus, poruchy funkce adenohypofýzy jsou popisovány u 20 % případů (36). Nejčastěji jde o nedostatek růstového hormonu a nedostatek gonadotropinů (15, 37). Elevace prolaktinu je považována jako možný výsledek disinhibice způsobenou tlakem stopky hypofýzy. Potvrzení diagnózy je na základě histologických a imunologických kritérií. Často je třeba provést další zobrazovací vyšetření k odhalení extrakraniálního postižení s určením lokalizace vhodné k bioptické verifikaci procesu. V této indikaci je některými autory doporučováno provedení PET‑CT. LCH se léčí imunosupresivy, chemoterapií nebo radioterapií (36). Samozřejmostí je hormonální substituční terapie.
Sarkoidóza
Sarkoidóza je systémová granulomatózní nemoc vyskytující se převážně u dospělých před 50. rokem věku. Neurologické komplikace vyvine 5–10 % pacientů. Pacienti trpící neurologickými obtížemi nemusí mít vyjádřené jiné systémové projevy. Sarkoidóza může poškozovat jak centrální, tak periferní nervový systém. Tito pacienti trpí kraniální mononeuropatií nebo se u nich rozvine granulomatózní hypofyzitida. Diagnóza neurosarkoidózy je většinou provedena na základě zobrazení pomocí MR a lumbální punkce. Při postižení selární oblasti sarkoidózou je prvním příznakem obvykle polyurie/ polydipsie. Zde je možnou příčinou centrální diabetes insipidus, v rámci diferenciální diagnostiky je ale třeba vyloučit polyurii způsobenou hyperkalcemií při zvýšené produkci kalcitriolu aktivovanými makrofágy. Léčba spočívá obvykle v kortikoterapii a substituci hormonálního deficitu. V případě pacientů nereagujících na léčbu lze použít i biologickou terapii, u akutní život ohrožující formy se může přistoupit k radioterapii (38).
Závěr
Diferenciální diagnostika zvětšení hypofýzy je rozsáhlá. Přestože prevalence adenomů hypofýzy je mnohonásobně větší než ostatních onemocnění hypofýzy, je zapotřebí vždy zvažovat i další příčiny. Jak potvrzuje uvedená kazuistika, příčinou selární expanze nemusí být vždy neoplazie – v našem případě se jednalo o „pouhou“ hyperplazii hypofýzy při těžké periferní hypothyreóze s regresí po zahájení hormonální substituce levothyroxinem. Lékaři pečující o pacienty na protinádorové terapii checkpoint inhibitory by měli pátrat po klinických i laboratorních příznacích upozorňujících na rozvíjející se hypofyzitidu. Hypofyzitida může probíhat oligosymptomaticky či zcela asymptomaticky, ale její nerozpoznání může mít až fatální následky při rozvoji hypokortikalismu s adrenokortikální krizí. Terapie se liší podle vyvolávající příčiny, avšak bez ohledu na etiologii je třeba vždy myslet na možný deficit hypofyzárních hormonů, který je nutné bezodkladně diagnostikovat a zahájit substituční léčbu.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Mikuláš Kosák, Ph.D.
Interní klinika 1. LF UK a ÚVN, Ústřední vojenská nemocnice U Vojenské nemocnice 1200, 169 02 Praha 6
Cit. zkr: Vnitř Lék 2022;68(1):58-63
Článek přijat redakcí: 9. 11. 2021
Článek přijat po recenzích: 3. 1. 2022
Zdroje
1. Osborn AG, Salzman KL, Jhaveri MD et al. Diagnostic imaging Brain, 3rd ed. Elsevier: 2010 : 1060-62. ISBN 978-0-323-37754-6.
2. Bonneville JF, Cattin F, Nagi S et al. MRI of the Pituitary Gland. Springer: 2016 : 53-55. ISBN 978-3-319-29043-0.
3. Hána V. Hypopituitarismus a diabetes insipidus centralis: průvodce ošetřujícího lékaře. In: Hugo J.Farmakoterapie pro praxi. Maxdorf: Praha:2011 : 10–21. ISBN 978-80-7345-241-4.
4. Horvath E, Kovacs K, Scheithauer BW. Pituitary hyperplasia. Pituitary 1999;1 : 169-79.
5. Marek J. Hypofýza a její onemocnění. Sanquis 2005;40 : 24.
6. Netuka D, Masopust V, Beneš V. Léčba adenomů hypofýzy. Cesk Slov Neurol N 2011;74 : 240-253.
7. Howlett TA, Levy MJ, Robertson IJ. How reliably can autoimmune hypophysitis be diagnosed without pituitary biopsy. Clin Endocrinol (Oxf) 2010;73 : 18–21.
8. Krarup T, Hagen C. Autoimmun hypophysitis [Autoimmune hypophysitis]. Ugeskr Laeger 2010;172 : 875-880.
9. Bertrand A, Kostine M, Barnetche T et al. Immune related adverse events associated with anti‑CTLA - 4 antibodies: systematic review and meta‑analysis. BMC Med 2015;13 : 211.
10. Dillard T, Yedinak CG, Alumkal J et al. Anti‑CTLA - 4 antibody therapy associated autoimmune hypophysitis: serious immune related adverse events across a spectrum of cancer subtypes. Pituitary 2010;13 : 29-38.
11. Tsoli M, Kaltsas G, Angelousi A et al. Managing Ipilimumab ‑ Induced Hypophysitis: Challenges and Current Therapeutic Strategies. Cancer Manag Res 2020; 12 : 9551-9561.
12. Caturegli P, Newschaffer C, Olivi A et al. Autoimmune hypophysitis. Endocr Rev 2005;26 : 599-614.
13. Falorni A, Minarelli V, Bartoloni E et al. Diagnosis and classification of autoimmune hypophysitis. Autoimmun Rev 2014;13 : 412-416.
14. Bellastella G, Maiorino MI, Bizzarro A et al. Revisitation of autoimmune hypophysitis: knowledge and uncertainties on pathophysiological and clinical aspects. Pituitary 2016;19 : 625-642.
15. Joshi MN, Whitelaw BC, Carroll PV. Mechanisms in Endocrinology: Hypophysitis: diagnosis and treatment. Eur J Endocrinol 2018;179 : 151-163.
16. Donadieu J, Rolon MA, Thomas C et al. Endocrine involvement in pediatric‑onset Langerhans‘ cell histiocytosis: a population‑based study. J Pediatr 2004;144 : 344-350.
17. Joshi MN, Whitelaw BC, Palomar MT et al. Immune checkpoint inhibitor ‑ related hypophysitis and endocrine dysfunction: clinical review. Clin Endocrinol (Oxf) 2016;85 : 331–339.
18. Faje AT, Sullivan R, Lawrence D et al. Ipilimumab ‑ induced hypophysitis: a detailed longitudinal analysis in a large cohort of patients with metastatic melanoma. J Clin Endocrinol Metab 2014;99 : 4078-4085.
19. Min L, Hodi FS, Giobbie‑Hurder A et al. Systemic high‑dose corticosteroid treatment does not improve the outcome of ipilimumab ‑ related hypophysitis: a retrospective cohort study. Clin Cancer Res 2015;21 : 749-755.
20. Ryder M, Callahan M, Postow MA et al. Endocrine ‑ related adverse events following ipilimumab in patients with advanced melanoma: a comprehensive retrospective review from a single institution. Endocr Relat Cancer 2014;21 : 371-381.
21. Angelousi A, Alexandraki KI, Tsoli M et al. Hypophysitis (including IgG4 and immunotherapy). Neuroendocrinology 2020;110 : 822-835.
22. Larkin J, Chiarion‑Sileni V, Gonzalez R et al. Combined nivolumab and ipilimumab or monotherapy in untreated melanoma. N Engl J Med 2015;373 : 23-34.
Další literatura u autorů a na www.casopisvnitrnilekarstvi.cz
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Levotyroxin
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2022 Číslo 1- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Ohlédnutí za XXVIII. kongresem ČIS ČLS JEP
- Jak vést interní oddělení: primář – školitel
- Jak provozovat moderní výkonově orientovanou interní ambulanci
- Pacient s jaterní cirhózou na interním oddělení
- Přímé náklady na léčbu pacientů s nevalvulární fibrilací síní nově indikovaných k léčbě apixabanem: retrospektivně prospektivní jednoramenná kohortová studie
- Doporučení Evropské společnosti pro hypertenzi pro měření krevního tlaku v ordinaci a mimo zdravotnické zařízení
- Multicentrická Castlemanova choroba. Příznaky, diagnostika a léčba
- Měření cholesterolu a současná doporučení
- Diferenciální diagnostika zvětšení hypofýzy
- Výhody současné léčby hypertenze a hypercholesterolemie fixní kombinací
- Levotyroxin
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Pacient s jaterní cirhózou na interním oddělení
- Měření cholesterolu a současná doporučení
- Diferenciální diagnostika zvětšení hypofýzy
- Levotyroxin
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



