Co musí vědět intervenční kardiolog o krevních destičkách
What is important for an interventional cardiologist to know about thrombocytes
Thrombocytes are crucial elements in the development of arterial thrombosis as an underlying condition of the acute coronary syndrome. Knowledge of the pathophysiology of adhesion, activation and aggregation of thrombocytes is essential for the interpretation of therapeutic targets for thrombosis prevention and treatment. Functional testing of the efficacy of antiplatelet drugs, though not yet routinely performed, is likely to bring further decline in thrombotic complications in the near future.
Keywords:
thrombocytes – adhesion – aggregation – functional testing – aspirin – clopidogrel – prasugrel
Authors:
M. Malý 1
; I. Marinov 2; M. Oravec 1; J. Veselka 1
Authors‘ workplace:
Kardiovaskulární centrum, Fakultní nemocnice v Motole, Praha
1; Ústav hematologie a krevní transfuze, Praha
2
Published in:
Kardiol Rev Int Med 2010, 12(3): 134-137
Overview
Krevní destičky jsou klíčovým elementem ve vzniku aterotrombózy jako podkladu akutního koronárního syndromu. Znalost patofyziologie adheze, aktivace a agregace je nutná pro interpretaci terapeutických zásahů při prevenci vzniku a léčby trombózy. Funkční testování účinnosti léčby protidestičkovými léky, byť zatím není rutinně prováděno, bude v budoucnu patrně cestou k dalšímu snížení výskytu trombotických komplikací.
Klíčová slova:
krevní destičky – adheze – agregace – funkční testy – aspirin – clopidogrel – prasugrel
Úvod
Krevní destičky hrají klíčovou úlohu ve vzniku arteriálního trombu nasedajícího na aterosklerotický plát, který je substrátem vzniku akutního koronárního syndromu. Znalost patofyziologie aktivace, adheze a agregace krevních destiček je pro kardiologa nepostradatelná pro prevenci a léčbu trombotických komplikací, včetně uplatnění doporučených postupů v praxi.
Patofyziologie aktivace, adheze a agregace krevních destiček
Trombocyty jsou nejmenší formované elementy krve. Jsou to bezjaderné okrouhlé disky o průměru 2–5 µm a tloušťce 0,5–1 µm. Tvar destiček je udržován marginálními mikrotubuly, které plní funkci skeletu. V cytoplazmě je abundantní množství kanálků a vezikul, které jsou významné pro sekreční funkci destiček. Vzhledem k tomu, že trombocyty neobsahují jádro, nemají vlastní DNA a jejich schopnost syntetizovat bílkoviny se donedávna považovala za velmi nízkou. Proto je poměrně překvapivým nálezem výsledek proteomické analýzy, která prokázala schopnost destiček exprimovat po stimulaci trombinem více než 300 proteinů, které se nevyskytovaly v klidovém stavu [1]. Hlavním energetickým zdrojem destiček je glukóza získávaná z plazmy a nevelké zásoby glykogenu, což svědčí pro intenzivní metabolizmus. Samy destičky obsahují tři typy granul: a) denzní granula mající skladovací funkci pro serotonin, kalcium, adenozindifosfát a adenozintrifosfát, b) alfa-granula obsahující směs proteinů (destičkový faktor 4, růstový faktor, fibrinogen, faktor V a beta-tromboglobulin) a c) lysozomy obsahující enzymy štěpící bílkoviny a sacharidové komplexy. Počet destiček je 200–400 × 109/litr krve. Doba života destiček je 9–12 dnů, což má význam pro reverzibilitu účinku protidestičkových léků. Destičky pocházejí z megakaryocytů kostní dřeně. Regulace jejich tvorby je řízena trombopoetinem, který je tvořen v ledvinách.
Aktivace a adheze destiček
Destičky hrají klíčovou roli v reakci cévy na její poškození. Po inzultu dojde k uvolnění destičkových denzních granul, které obsahují adenozindifosfát (ADP), a tím se aktivují okolní destičky. Zároveň se uvolňují i alfa granula, která obsahují proteiny a proteinové mediátory, jenž se účastní zánětlivých procesů. Na povrchu destiček je množství receptorů pro ostatní buňky, zahrnující aktivované buňky cévní stěny a proteiny extracelulární matrix. Destičky vykazují velkou schopnost adheze, zvláště ke strukturám poškozené cévní stěny, kde uvolňují obsah svých granul a dochází k jejich agregaci. Tímto mechanizmem hrají klíčovou úlohu v mnoha procesech cévní stěny, včetně vzniku akutního koronárního syndromu (AKS).
Za normálních okolností se destičky vyskytují v klidovém stavu a k místu poškození se dostávají pasivně krevním proudem. Iniciálně adherují k místu poškození interakcí s von Willebrandovým faktorem (vWF), který je proteinem extracelulární matrix produkovaným endoteliálními buňkami. Destičkový glykoprotein Ib/IX/V se volnou vazbou váže s vWF a umožňuje „rolování“ destiček na poškozeném povrchu cévní stěny. Destičky jsou poté ukotveny vazbou s receptory pro kolagen (glykoprotein Ia/IIa nebo integrin 21) a glykoproteinem VI, což vede k intracelulární signalizaci a aktivaci destiček. Destičková aktivace je následována pevnou adhezí mezi dalším integrinem – glykoproteinovým receptorem IIb/IIIa – mezi destičkami navzájem. Tato vazba vede k mezidestičkové agregaci.
Agregace destiček
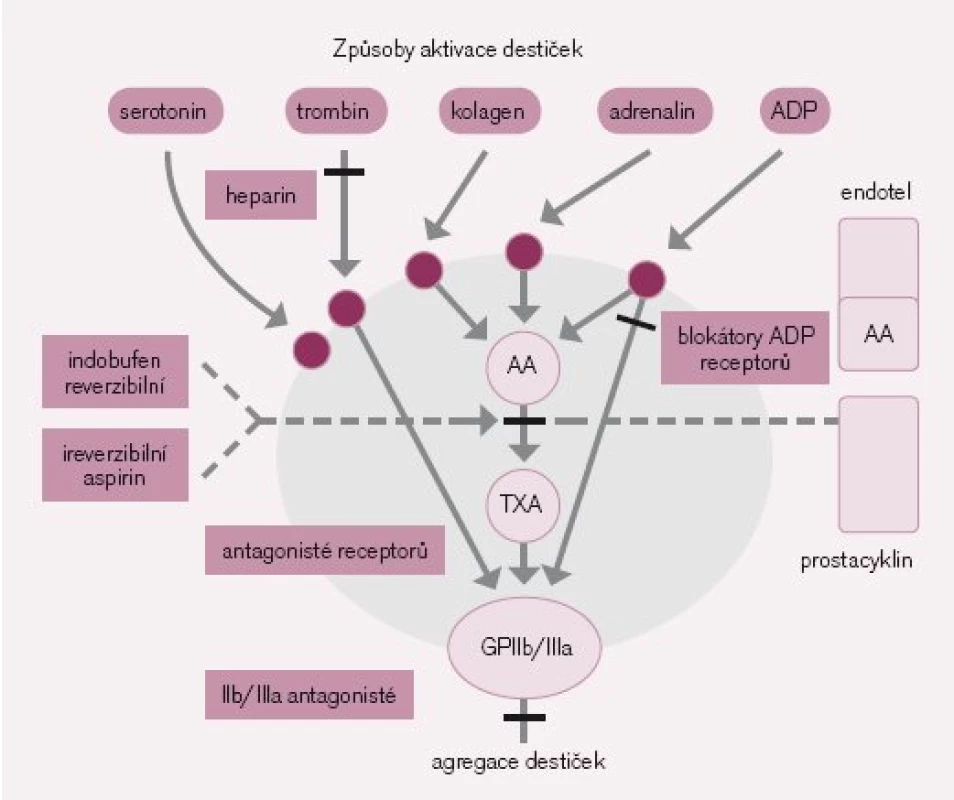
Destičkový fibrinogenový receptor (glykoprotein IIb/IIIa) je integrin, který se váže na epitop proteinů arginin-glycin-kyselina asparagová (RGD), jako je fibrinogen. Fibrinogen má dvojrozměrnou symetrii s RGD skupinou na obou koncích molekuly, čímž se stává ideální molekulou pro mezidestičkovou vazbu. V klidovém stavu jsou destičkové receptory IIb/IIIa neaktivní, exprimují se na destičkovém povrchu po aktivaci a vazbou s fibrinogenem umožňují destičkovou agregaci (obr. 1).
Aktivační receptory
Na povrchu destiček se nacházejí další receptory zodpovědné za jejich aktivaci. Jedním z nich je skupina receptorů pro ADP. Jakmile je ADP uvolněn z destičky, může dojít k aktivaci jiných destiček vazbou na jejich ADP receptor. Signalizace z ADP receptoru P2Y12 cestou G proteinu je spojena s adenylátcyklázou, enzymem, který katalyzuje konverzi adenozintrifosfátu na cyklický adenozinmonofosfát (cAMP), jehož vysoké hladiny inhibují destičkovou funkci. Při vazbě ADP na receptor P2Y12 dojde za prvé k blokádě adenylátcyklázy, tím k poklesu hladiny cAMP a v důsledku toho k aktivaci destiček [2,3] a za druhé dojde k aktivaci fosfoinozitid 3-kinázy, což má za následek mohutnou agregaci destiček [4,5].
Další cestou zprostředkování aktivace a agregace je fosfolipáza A2, která uvolňuje z povrchu destičky kyselinu arachidonovou, jež je dále metabolizována cyklooxygenázou a tromboxansyntetázou na tromboxan A2, který vede k uvolnění destičkových granul a agregaci dalších destiček [6].
Významnou měrou se na aktivaci destiček podílí trombin, který tímto vytváří spojnici mezi koagulační kaskádou a agregací. Všechna antitrombotika (tedy i heparin) mají proto i antiagregační účinek cestou inhibice trombinem zprostředkované aktivace destiček [7] (obr. 2).
Vyšetření funkce krevních destiček
V souvislosti s extenzivní protidestičkovou léčbou u aterotrombózy, individuální odpovědí na léčbu clopidogrelem a katastrofálními důsledky trombóz stentů je velká snaha o rutinní vyšetřování efektu protidestičkové léčby. Nicméně dosud má tento postup velké limitace: a) není shoda na typu používaného testu, b) není žádná shoda na definici „non-responderů“, c) není žádný velký klinický důkaz, že léčba vedená na základě výsledku testů zlepšuje klinické cílové ukazatele, d) v současnosti je monitorování léčby doporučeno pouze v rámci klinického výzkumu, i když studie provedené na malých souborech naznačují prospěch z takto vedené léčby; nicméně tato data nemají dostatečnou sílu opravňující k rutinnímu používání v denní praxi. Je nutno vyčkat na výsledky probíhajících studií s individualizovanou léčbou ADP blokátory, jako jsou studie GRAVITAS či ARCTIC [8]. Tento závěr se však autorům jeví jako příliš rigorózní a domníváme se, že je již shromážděno dostatečné množství teoretických i klinických dat k tomu, aby se alespoň u nemocných s trombotickými komplikacemi po koronárních intervencích další protidestičková léčba (zvláště léčba ADP blokátorem) řídila výsledkem vyšetření funkce destiček.
VerifyNow
Z potenciálních kandidátů na monitorování funkce krevních destiček ve specifických podmínkách kardiologie se nabízí metoda VerifyNow, jejímiž výhodami jsou možnost monitorace u lůžka nemocného a jednoduchost použití (na rozdíl od optické agregometrie se provádí vyšetření přímo z plné krve). Princip metody je stejný jako u optické agregometrie – změna průchodu světla vzorkem po přidání agonistů agregace. Neagregované destičky mají větší součet povrchů, a tudíž kladou procházejícímu světlu větší překážku než agregované destičky, kde je součet povrchů větších agregovaných částic menší, a tudíž je větší propustnost pro světlo. Čím vyšší je průchodnost pro světlo, tím větší je míra agregace (po přidání agonisty agregace, např. ADP), a tím menší je účinnost protidestičkové léčby [9].
VASP index
Metoda VASP (vasodilator stimulated fosfoprotein) je metodou založenou na fosforylaci VASP, který je intracelulárním destičkovým proteinem. Tato metoda je specifická pro ADP stimulaci, neboť jeho fosforylace je závislá na stupni aktivace P2Y12 receptoru. Pokud dojde ke stimulaci P2Y12 receptoru ADP, dojde k jeho defosforylaci. Naopak inhibice receptoru clopidogrelem vede k aktivaci kinázy, zvýšení hladin cAMP a VASP fosforylaci. Úroveň fosforylace/defosforylace VASP tedy velmi citlivě odráží aktivaci/deaktivaci receptoru P2Y12. Stupeň VASP fosforylace lze přesně stanovit metodou průtokové cytometrie. Tato metoda je vysoce specifická i senzitivní pro léčbu thienopyridiny a obecně jakýmikoliv léky interagujícími s receptorem P2Y12 [10]. Vyjádřením míry blokády receptoru je tzv. PRI – platelet reactivity index. Hodnota tohoto indexu pod 50 % má vysokou negativní prediktivní hodnotu pro trombotické komplikace po koronárních intervencích [11] (obr. 3).
![Výsledek vyšetření VASP. Trombocyty inkubujeme s PGE1 (A, B) a PGE1 + ADP (C,D). Fosforylaci VASP detekujeme po permeabilizaci trombocytů nepřímou fluorescencí za použití monoklonální protilátky <sub>-16</sub>C<sub>2</sub>. Stanovením PRI (Platelet Reactivity Index) podle vzorce PRI = [MFIc (PGE1) – MFIc (PGE1+ADP) / MFIc (PGE1)] × 100 hodnotíme kapacitu ADP blokovat VASP fosforylaci.](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/463bb58cd913e4715bd54415e77094aa.jpeg)
Shrnutí současných doporučení protidestičkové léčby [8]
Elektivní perkutánní koronární intervence
Aspirin: 250 mg bolus s následnou léčbou 75–100 mg p. o. denně [12].
Clopidogrel: 600 mg nasycovací dávka s následnou léčbou 75 mg p. o. denně [13].
GP IIb/IIIa inhibitory: podání pouze v situaci „bail-out“ (trombus, „no reflow“, vysoce komplexní léze) [12].
Akutní koronární syndrom bez ST elevací – NSTE AKS
Aspirin: 250 mg bolus s následnou léčbou 75–100 mg p. o. denně [14].
Clopidogrel: 600 mg nasycovací dávka s následnou léčbou 75 mg p. o. denně.
Prasugrel (alternativa clopidogrelu): 60 mg nasycovací dávka s následnou léčbou 10 mg p. o. denně (výjimka u nemocných s anamnézou cévní mozkové příhody, starších 75 let a s váhou méně než 60 kg) [15].
GP IIb/IIIa inhibitory: doporučeny u vysoce rizikových PCI během intervence při časném invazivním vyšetření do 24 hod od vzniku [16].
Akutní infarkt myokardu s ST elevacemi – STEMI
Aspirin: 250 mg bolus s následnou léčbou 75–100 mg p. o. denně.
Clopidogrel: 600 mg nasycovací dávka s následnou léčbou 75 mg p. o. denně.
Prasugrel (alternativa clopidogrelu): 60 mg nasycovací dávka s následnou léčbou 10 mg p. o. denně (výjimka u nemocných s anamnézou cévní mozkové příhody, starších 75 let a s váhou méně než 60 kg). Prasugrel byl inkorporován do současných doporučení ACC/AHA pro STEMI [15,17].
GP IIb/IIIa inhibitory: klinická data jsou rozporuplná, přednemocniční podání není doporučeno a během přímé PCI je podání vyhrazeno pro vysoce rizikovou intervenci s doporučeným podáním intrakoronárně [18].
Závěr
Znalost základních patofyziologických mechanizmů aktivace, adheze a agregace jako základu vzniku arteriálního trombu je nutná ke správně vedené protidestičkové léčbě na základě doporučených postupů. Funkční testy účinnosti protidestičkové léčby stále ještě hledají své místo, nicméně v budoucnu jsou cestou k dalšímu snížení trombotických komplikací. Zároveň se vyvíjejí nové protidestičkové léky s příznivějším farmakologickým profilem, jako je např. ticagrelor s reverzibilním účinkem, s nímž již byla úspěšně dokončena studie PLATO [19]. Stále ještě zůstává mnoho nezodpovězených otázek: doba trvání duální protidestičkové léčby, individualizace na základě výsledků funkčních vyšetření, postavení nových protidestičkových léků, postavení blokátorů IIb/IIIa a jejich rutinní podávání a individuální posouzení rovnováhy mezi protidestičkovou léčbou a rizikem krvácení. Na většinu z těchto otázek odpoví probíhající klinické studie.
Podpořeno grantem MZČR číslo 00064203.
MUDr. Martin Malý, Ph.D.1
MUDr. Iuri Marinov, CSc.2
MUDr. Milan Oravec1
prof.
MUDr. Josef Veselka, CSc.1
1Kardiovaskulární
centrum, Fakultní
nemocnice v Motole, Praha
2Ústav
hematologie a krevní transfuze, Praha
martin.maly@fnmotol.cz
Sources
1. Coppinger JA, Cagney G, Toomey S et al. Characterization of the proteins released from activated platelets leads to localization of novel platelet proteins in human atherosclerotic lesions. Blood 2004; 103 : 2096–2104.
2. Haslam RJ, Davidson MM, Desjardins JV. Inhibition of adenylate cyclase by adenosine analogues in preparations of broken and intact human platelets. Evidence for the unidirectional control of platelet function by cyclic AMP. Biochem J 1978; 176 : 83–95.
3. Savi P, Pflieger AM, Herbert JM. cAMP is not an important messenger for ADP-induced platelet aggregation. Blood Coagul Fibrinolysis 1996; 7 : 249–252.
4. Trumel C, Payrastre B, Plantavid M et al. A key role of adenosine diphosphate in the irreversible platelet aggregation induced by the PAR1-activating peptide through the late activation of phosphoinositide 3-kinase. Blood 1999; 94 : 4156–4165.
5. Kauffenstein G, Bergmeier W, Eckly A et al. The P2Y(12) receptor induces platelet aggregation through weak activation of the alpha(IIb)beta(3) integrin – a phosphoinositide 3-kinase-dependent mechanism. FEBS Lett 2001; 505 : 281–290.
6. Bultas J, Karetová D. Je protidestičkové léčba indikována v primární prevenci? Kardiol Rev 2007; 9: 242–246.
7. Kottke-Marchant K. Importance of platelets response in acute coronary syndromes. Cleve Clin J Med 2009; 76: S2–S7.
8. Cuisset T, Valgimigli M, Mudra H et al. Rationale and use of antiplatelet and antithrombotic drugs during cardiovascular interventions: May 2010 update. Eurointervention 2010; 6 : 39–45.
9. Magniacapra F, DeBruyne B, Muller O et al. High residual platelet reactivity after clopidogrel: extent of coronary atherosclerosis and periprocedural myocardial infarction in patients with stable angina undergoing percutaneous coronary intervention. JACC Cardiovasc Interv 2010; 3 : 35–40.
10. Schwarz UR, Geiger J, Walter U et al. Flow cytometry analysis of intracellular VASP phosphorylation for the assessment of activating and inhibitory signal transduction pathways in human platelets – definition and detection of ticlopidine/clopidogrel effects. Thromb Haemost 1999; 82 : 1145–1152.
11. Bonello L, Camoin-Jau L, Arques S et al. Adjusted Clopidogrel Loading Doses According to Vasodilator-Stimulated Phosphorylation Index Decrease Rate of Major Adverse Cardiovascular Events in Patients With Clopidogrel Resistance. J Am Coll Cardiol 2008; 51 : 1404–1411.
12. Silber S, Albertsson P, Avilés FF et al. Task Force for Percutaneous Coronary Interventions of the European Society of Cardiology. Guidelines for percutaneous coronary interventions. The Task Force for Percutaneous Coronary Interventions of the European Society of Cardiology. Eur Heart J 2005; 26: 804–847.
13. Montalescot G, Sideris G, Meuleman C et al. ALBION Trial Investigators. A randomized comparison of high clopidogrel loading doses in patients with non-ST-segment elevation acute coronary syndromes: the ALBION (Assessment of the Best Loading Dose of Clopidogrel to Blunt Platelet Activation, Inflammation and Ongoing Necrosis) trial. J Am Coll Cardiol 2006; 48: 931–938.
14. Task Force for Diagnosis and Treatment of Non-ST--Segment Elevation Acute Coronary Syndromes of European Society of Cardiology, Bassand JP, Hamm CW, Ardissino D et al. Guidelines for the diagnosis and treatment of non-ST-segment elevation acute coronary syndromes. Eur Heart J 2007; 28 : 1598–1660.
15. Wiviott SD, Braunwald E, McCabe CH et al. TRITON-TIMI 38 Investigators. Prasugrel versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2007; 357 : 2001–2015.
16. Mehta SR, Granger CB, Boden WE et al. TIMACS Investigators. Early versus delayed invasive intervention in acute coronary syndromes. N Engl J Med 2009; 360 : 2165–2175.
17. Kushner FG, Hand M, Smith SC Jr et al. American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. 2009 Focused Updates: ACC/AHA Guidelines for the Management of Patients With ST-Elevation Myocardial Infarction (updating the 2004 Guideline and 2007 Focused Update) and ACC/AHA/SCAI Guidelines on Percutaneous Coronary Intervention (updating the 2005 Guideline and 2007 Focused Update): a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation 2009; 120 : 2271–2306.
18. Thiele H, Schindler K, Friedenberger J et al. Intracoronary compared with intravenous bolus abciximab application in patients with ST-elevation myocardial infarction undergoing primary percutaneous coronary intervention: the randomized Leipzig immediate percutaneous coronary intervention abciximab IV versus IC in ST-elevation myocardial infarction trial. Circulation 2008; 118 : 49–57.
19. Cannon CP, Harrington RA, James S et al. PLATelet inhibition and patient Outcomes (PLATO) Investigators. Comparison of Ticagrelor With Clopidogrel in Patients With a Planned Invasive Strategy for Acute Coronary Syndromes (PLATO): A Randomised Double-Blind Study. Lancet 2010; 375 : 283–293.
Labels
Paediatric cardiology Internal medicine Cardiac surgery CardiologyArticle was published in
Cardiology Review

2010 Issue 3
-
All articles in this issue
- Akutní infarkt myokardu u pacientů se srdečním selháním
- Výskyt srdečního selhání po infarktu myokardu v klinických studiích
- Studie SHIFT (The Systolic Heart Failure Treatment with the If Inhibitor Ivabradine Trial) a její význam pro léčbu srdečního selhání
- Kontrola krevního tlaku u diabetiků s ischemickou chorobou srdeční
- Rizikové faktory fibrilace síní
- Co musí vědět intervenční kardiolog o krevních destičkách
- Současné postavení pravastatinu v hypolipidemické léčbě
- Farmakoekonomika pro lékaře v klinické praxi
- Současné metody stanovení glomerulární filtrace a jejich klinický význam
- Je ischemická choroba srdca u žien iná ako u mužov?
- Cardiology Review
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Současné metody stanovení glomerulární filtrace a jejich klinický význam
- Farmakoekonomika pro lékaře v klinické praxi
- Rizikové faktory fibrilace síní
- Je ischemická choroba srdca u žien iná ako u mužov?
