Katetrová ablace elektrické bouře po infarktu myokardu
Catheter ablation of an electric storm following myocardial infarction
Electric storm in the acute or chronic phase of myocardial infarction is a life threatening condition resulting, if uncontrolled, in death. Interplay of the arrhythmogenic substrate, autonomic tone, and milieu on the cell membrane of the cardiomyocytes constitutes the source of electric storm. The background arrhythmic mechanisms may differ as, in addition to the recurrent monomorphic (mostly reentry) ventricular tachycardia, the cause of arrhythmia may include incessant ectopic activity from the Purkinje fibers -induced recurrent ventricular fibrillation. Regardless of the basic ES mechanism, catheter ablation represents a life-saving procedure for ESs uncontrolled by the standard therapy.
Keywords:
myocardial infarction – electric storm – ventricular tachycardia – ventricular fibrillation – catheter ablation
Authors:
M. Fiala
Authors‘ workplace:
Oddělení kardiologie, Kardiocentrum, Nemocnice Podlesí, a. s.
Published in:
Kardiol Rev Int Med 2010, 12(Supplementum): 32-36
Overview
Elektrická bouře v akutní nebo pozdní fázi po infarktu myokardu je život ohrožující stav, který, není-li zvládnut, končí smrtí. Příčinou je souhra arytmogenního substrátu, autonomního tonu a rovnováhy na buněčné membráně myocytu. Mechanizmus arytmie v pozadí EB se do jisté míry liší, neboť vedle recidivující monomorfní (převážně reentry) komorové tachykardie se její příčinou může stát recidivující fibrilace komor spouštěná incesantní ektopickou aktivitou vycházející zvláště z Purkyňových vláken. Bez ohledu na základní mechanizmus elektrické bouře, nevede-li standardní léčba ke zklidnění EB, stává se katetrová ablace život zachraňujícím výkonem.
Klíčová slova:
infarkt myokardu – elektrická bouře – komorová tachykardie – fibrilace komor – katetrová ablace
Úvod
Katetrová ablace komorových tachykardií (KT) se stala rutinní léčbou u pacientů se strukturálně zdravým srdcem i u pacientů se strukturálním postižením srdce. Zatímco u prvně jmenované skupiny je ablace ve většině případů výkonem plně kurativním, u pacientů se strukturálním postižením srdce zůstává výkonem paliativním, prováděným s cílem redukovat intervence z automatického kardioverteru-defibrilátoru (implantable cardioverter defibrillator – ICD) a zlepšit kvalitu života jeho nositelů. Jedním z problémů pacientů s ICD je asi 20% prevalence elektrické bouře (EB) v důsledku opakující se KT nebo fibrilace komor (FK), jejíž nezvládnutí má za následek smrt [1]. Akutní i pozdější fáze infarktu myokardu je dominantním stavem, který je život ohrožujícími komorovými tachyarytmiemi provázen.
Současná definice elektrické bouře (EB) je založena na výskytu tří a více nezávislých epizod KT/FK během 24 hod. V současnosti jsou EB vedoucí k intervenci z ICD pochopitelně pozorovány mnohem častěji než před érou ICD. Nedořešenou částí definice EB zůstává, zda se do ní má zahrnout incesantní KT nebo zda by se měl její součástí stát pětiminutový interval mezi jednotlivými epizodami KT/ FK [2–5].
EB v zásadě vzniká jako výsledek souhry mnoha faktorů na úrovni arytmogenního substrátu a akutních odchylek v autonomním napětí a v rovnováze na buněčné membráně kardiomyocytů [5]. Proto by měla léčba EB zahrnovat v první řadě korekci vyvolávajících příčin, jako je především elektrolytová dysbalance, dále potlačení napětí sympatiku beta-blokátory a modifikaci arytmogenního substrátu amiodaronem, lidocainem nebo procainamidem, i když je někdy efektivní až zavedení celkové anestezie [6,7]. Pokud i nadále zůstává ES rezistentní na zavedenou léčbu, je urgentní katetrová ablace jedinou možností, jak jinak infaustní stav zvrátit. Ablace KT používá metodiky zavedené již mnoho let, v posledních letech se ale množí i případy úspěšné ablace FK. Arytmogenní substrát a ablační strategie jsou však u obou jednotek do jisté míry odlišné.
Ablace EB v důsledku recidivující monomorfní KT
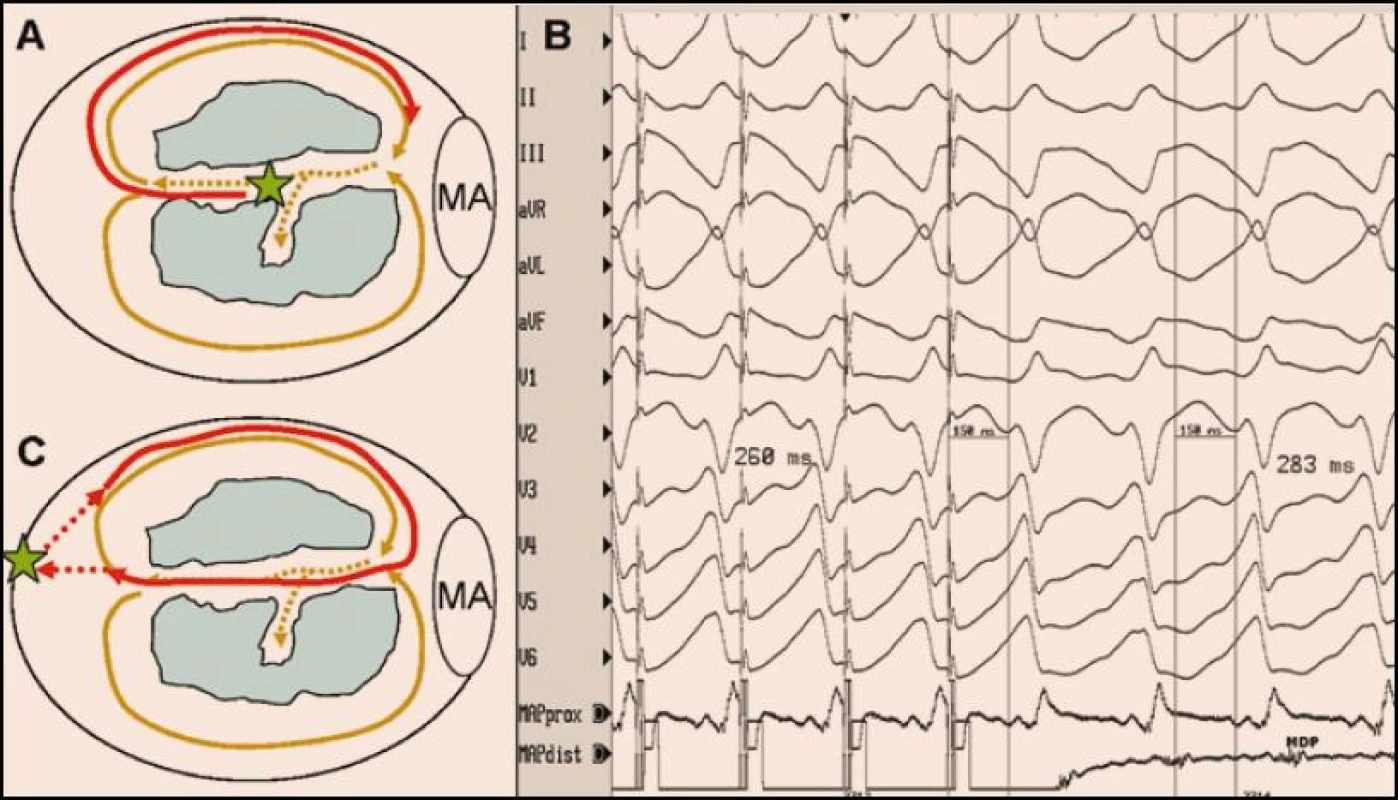
Ablační strategie EB v důsledku recidivujících KT se v zásadě neliší od strategií, které se využívají při ablaci monomorfní KT v běžné situaci mimo EB [8–11]. Běžící tolerovanou KT lze nejlépe určit trojrozměrným mapováním, které současně definuje anatomii srdečního oddílu a postup elektrické aktivace (obr. 1). Vzhledem k tomu, že většina KT po infarktu myokardu má mechanizmus reentry, je doplnění tzv. entrainmentu (najetí do tachykardie) nejpřesnějším způsobem, jak identifikovat či potvrdit, které části srdečního oddílu jsou součástí reentry okruhu a která část reentry okruhu je jeho kritickou oblastí projevující se pomalým vedením ohraničeným ze dvou stran bariérami převodní blokády (obr. 2). Ablace této části myokardu (obvykle na okraji poinfarktové jizvy) vede k trvalé eliminaci dané formy KT.
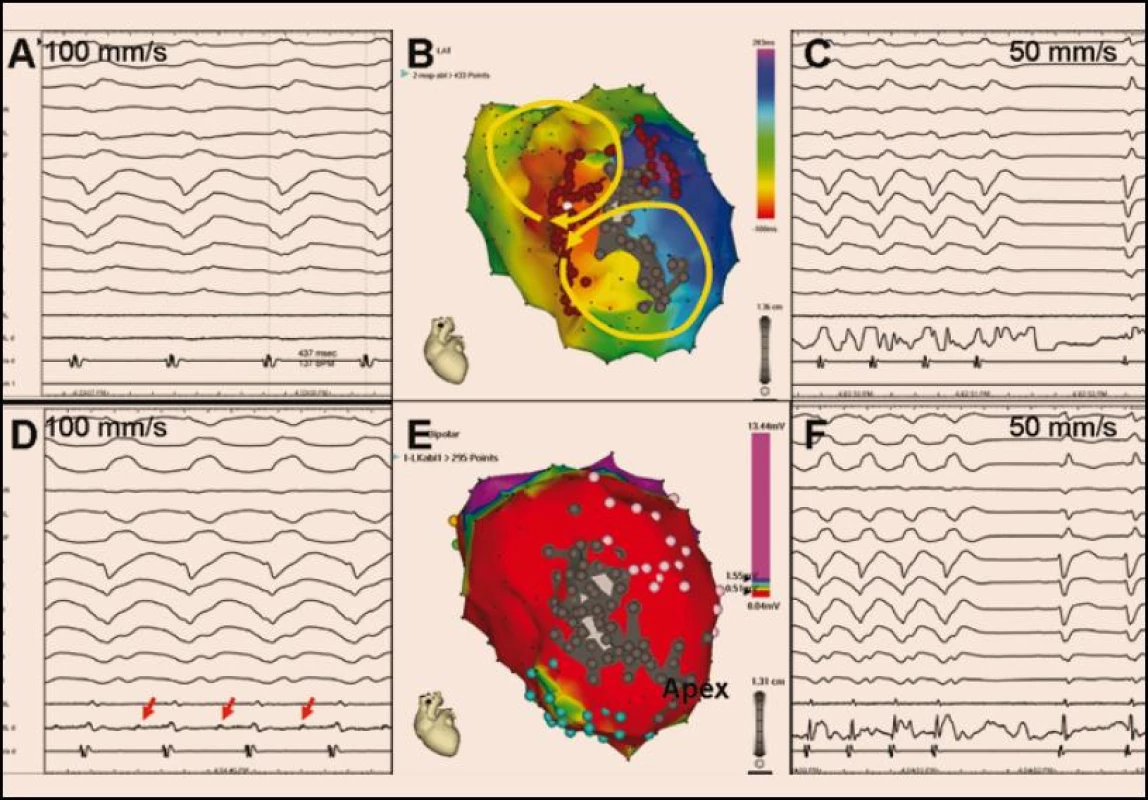
Uvedené mapovací strategie lze uplatnit u hemodynamicky dobře snášených KT. U KT, které nejsou hemodynamicky tolerovány a nemohou být tedy mapovány přímo, lze využít tzv. substrátového mapování a ablace, zjednodušeně řečeno ablace podle nepřímých ukazatelů. Tato strategie spočívá v trojrozměrném mapování komory (komor) při sinusovém rytmu nebo při pomalé stimulaci síní či komor a ve stanovení „oblasti zájmu“, která je následně cílena ablací [12]. Toho lze dosáhnout analýzou informací získaných z voltážové mapy (stanovení oblasti poinfarktové jizvy, oblasti normálního myokardu a rozhraní mezi nimi), aktivační mapy (identifikace pozdních potenciálů) a stimulace do různých míst, tzv. pacemappingu (který umožňuje určení kritických míst reentry okruhu, tj. vnitřního segmentu
oblasti pomalého vedení nebo míst, kde elektrický impulz vystupuje z oblasti pomalého vedení do zdravého myokardu) (obr. 3). Ablace je pak cílena na tato kritická místa. V praxi se často v jednom výkonu používá kombinace přímého a substrátového mapování a všechny dostupné mapovací techniky.
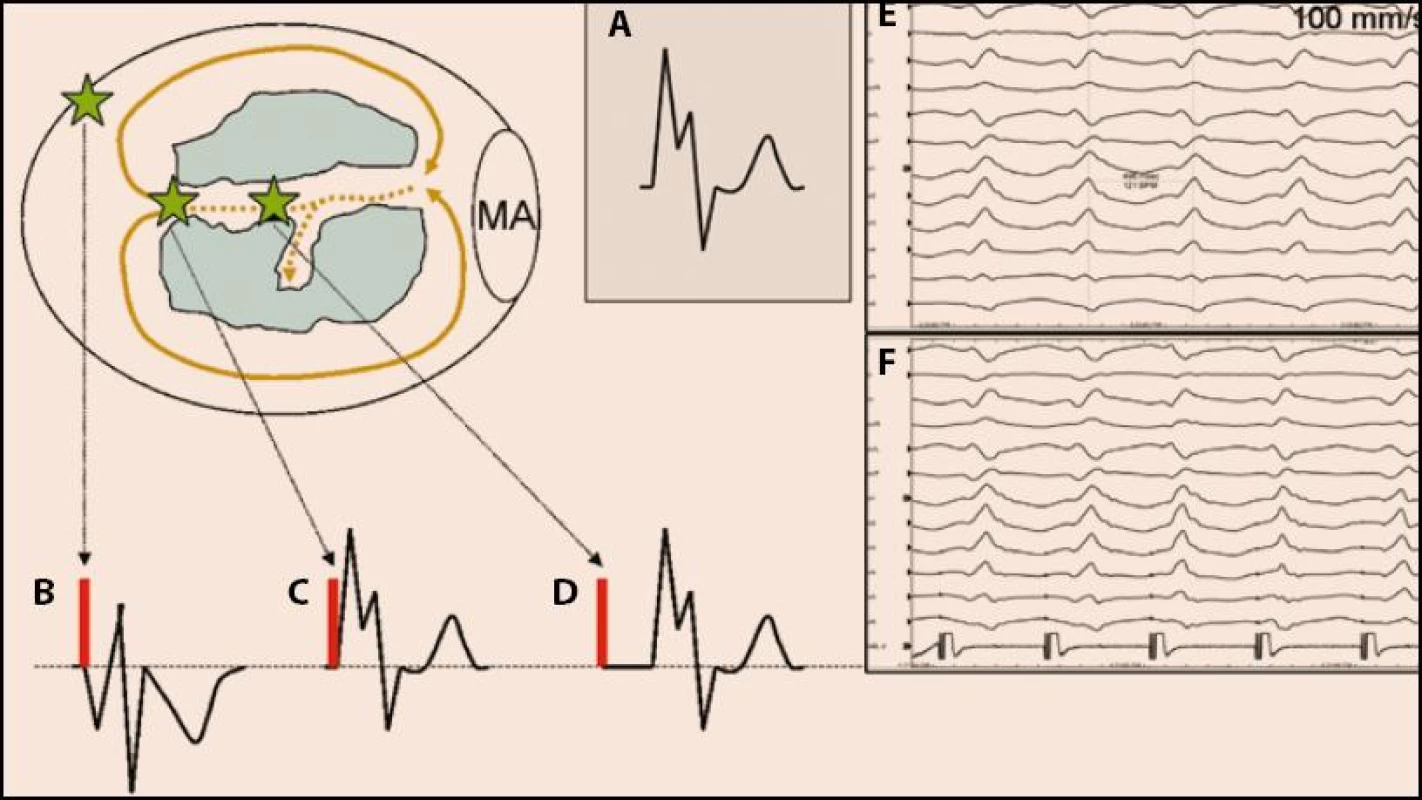
Zhodnocení voltážové mapy (voltáže jednotlivých signálů generovaných srdečním oddílem) navíc dávají možnost odlišit tzv. idiopatickou KT u zcela zdravého srdce od KT při menším strukturálním postižení srdce [13,14].
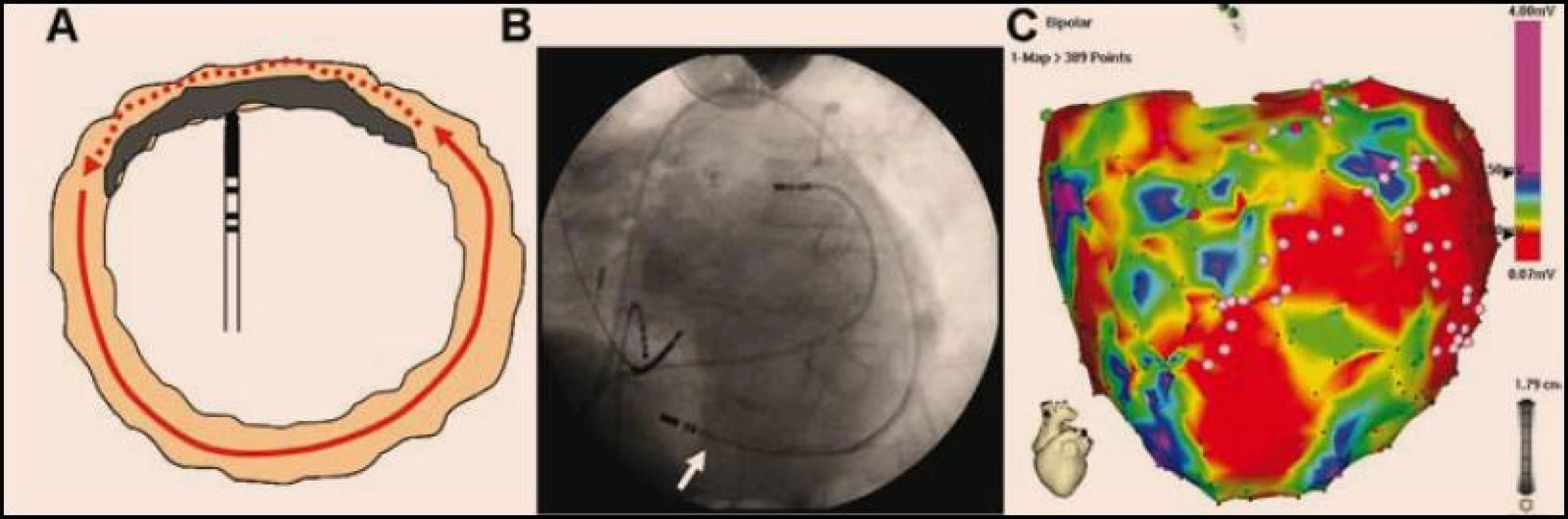
Účinnost ablace při potlačení EB dosahuje přibližně 90 %, byť u jisté části populace je potřebný i epikardiální přístup (obr. 4). Cílovým momentem ablace je ideálně odstranění všech forem KT, neboť přetrvávající inducibilita alespoň jedné formy KT je spojována s vyšším rizikem recidivy EB [15–17].
Ablace EB v důsledku recidivující polymorfní KT/FK
Katetrová ablace EB způsobené recidivující FK (či polymorfní KT) je založena na jiném principu. Při ní se cílí komorové extrasystoly (KES), které fungují jako iniciátor FK. Lokalizace místa jejich vzniku se stanovuje podobnou metodou jako při ablaci KES nespouštějících FK. Hojně se vyskytující KES se nejlépe mapují podle časnosti lokální aktivace srovnávané s počátkem QRS komplexu na povrchovém EKG. V případě KES vycházejících z oblasti fascikulů levého Tawarova raménka je obvykle nejčasnější komorová aktivace navíc předcházena izolovaným fascikulárním potenciálem. V případě izolovaných nečetných KES se lokalizace ektopického zdroje musí často opřít o tzv. pacemapping, tj. srovnání tvaru QRS komplexu při spontánní KES s tvarem QRS komplexu při stimulaci komory (viz též obr. 3).
První zkušenosti s ablací FK pocházejí od pacientů s tzv. idiopatickou FK. Studie publikovaná skupinou z Bordeaux ukázala, že 85 % spouštěcích KES pochází z oblasti Purkyňových vláken a jen relativně malá část spouštěcích KES vycházela z výtokového traktu pravé komory. KES z Purkyňových vláken měly kratší trvání QRS komplexu (126 vs 145 ms) a také kratší vazebný interval (280 vs 355 ms) [18,19]. Tato ablační strategie byla použita i u pacientů s dlouhým QT intervalem a pacientů s Brugada syndromem, u nichž zdroj KES vychází právě z výtokového traktu pravé komory [20,21].
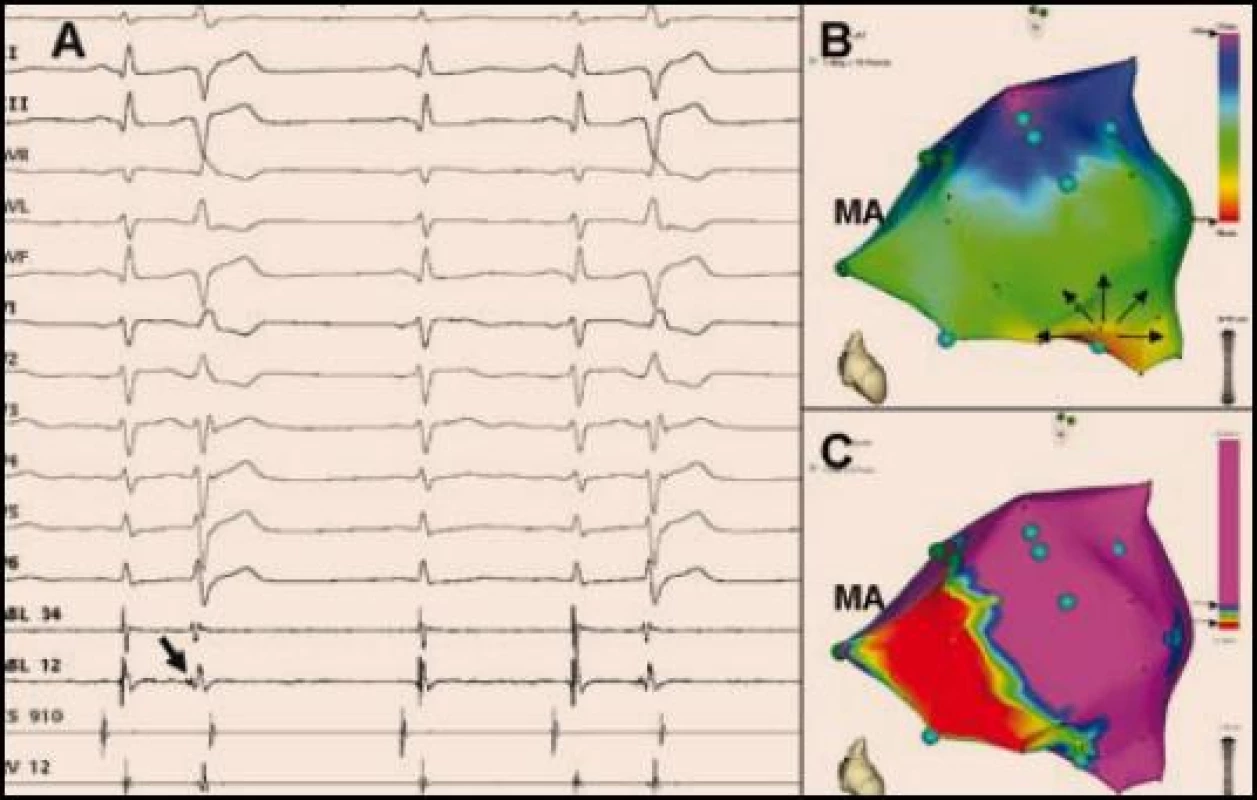
Stejná koncepce ablace je v současné době uplatňována také u pacientů v časném nebo pozdějším období po vzniku infarktu myokardu a mnohdy u nich znamená život zachraňující výkon [22–24]. Nabízí se vysvětlení, že Purkyňovy buňky mají větší šanci přežít ischemickou ataku proto, že jsou k ischemii více rezistentní, respektive mohou díky své endokardiální pozici využívat okysličenou krev přímo z dutiny levé komory [25,26]. Předpokládá se, že po infarktu myokardu vznikají v Purkyňových buňkách časné následné depolarizace, které spouštějí polymorfní KT/FK. Oblast ektopické aktivity je obvykle lokalizována v hraniční zóně na okraji infarktové jizvy, což lze zobrazit pomocí trojrozměrného mapování (obr. 5). Studie ukazují, že rozsah ablace nutný k eliminaci ektopické aktivity pacientů po infarktu myokardu je větší než u pacientů s idiopatickou KF. Úspěch výkonu může být zásadně ovlivněn (ne)přítomností ektopické aktivity, proto je výhodné jej provést neprodleně v době EB, dokud je spouštěcí ektopie aktivní.
Závěr
Ablace maligních komorových tachyarytmií v akutní i pozdější fázi infarktu myokardu má především paliativní význam, nicméně tento význam může mít přesah do oblasti mortalitní. Ačkoli je prevence náhlé smrti u pacientů s maligními komorovými tachyarytmiemi v současné době založena na implantaci ICD, byl studován i preventivní význam ablace po implantaci ICD s cílem dosáhnout redukce následných intervencí z ICD. Ze 128 randomizovaných pacientů bylo ve skupině pacientů s ICD a preventivní ablací dosaženo významné redukce následných výbojů nebo antitachykardické stimulace oproti skupině s ICD bez preventivní ablace (12 vs 33 %; P = 0,007). Bylo také zaznamenáno nižší zastoupení pacientů bez výbojů (9 vs 31 %; P = 0,003), ačkoli mortalita se významně nelišila (9 vs 17 %; P = 0,29) [27]. Tyto výsledky je pochopitelně nutné rozšířit a potvrdit v dalších multicentrických randomizovaných studiích. V kontextu s tím ablace EB rozšiřuje spektrum výkonů jak u pacientů se zdánlivě strukturálně zdravým srdcem, tak i u pacientů s ischemickou nebo neischemickou kardiomyopatií. Každopádně, byť zatím na relativně malých počtech pacientů, prokazuje ablace EB potenciál zachránit jinak nezachranitelný život, a měla by se proto v klinické praxi více zvažovat a využívat.
doc. MUDr. Martin Fiala, Ph.D.
Oddělení kardiologie, Kardiocentrum,
Nemocnice Podlesí, a. s.
martin.fiala@gmail.com
Sources
1. Verma A, Kilicaslan F, Marrouche NF et al. Prevalence, predictors, and mortality significance of the causative arrhythmia in patients with electrical storm. J Cardiovasc Electrophysiol 2004; 15 : 1265–1270.
2. Gatzoulis KA, Andrikopoulos GK, Apostolopoulos T et al. Electrical storm is an independent predictor of averse long-term outcome in the era of implantable defibrillator therapy. Europace 2005; 7 : 184–192.
3. Hohnloser SH, Al-Khalidi HR, Pratt CM et al. SHock Inhibition valuation with AzimiLiDe (SHIELD) Investigators. Electrical storm in patients with implantable defibrillator: incidence, features, and preventive therapy: insights from a randomized trial. Eur Heart J 2006; 27 : 3027–3032.
4. Istrael CW, Barold SS. Electrical storm in patients with and implanted defibrillator: a matter of definition. Ann Noninvasive Electrocardiol 2007; 12 : 375–382
5. Huang DT, Traub D. Recurrent ventricular arrhythmia storms in the age of implantable cardioverter defibrillator therapy: A comprehensive review. Progr Cardiovasc Dis 2008; 51 : 229–236.
6. Nademanee K, Taylor R, Bailey WE et al. Treating electrical storm: sympathetic blockage versus advanced cardiac life support guided therapy. Circulation 2000; 102 : 742–747.
7. European Heart Rhythm Association; Heart Rhythm Society. Zipes DP, Camm AJ, Borggrefe M et al. ACC/AHA/ESC 2006 guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: a report of the American College of Cardiology/American Heart Association Task Force and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Develop Guidelines for Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death). J Am Coll Cardiol 2006; 48: e247–e346.
8. Stevenson WG, Friedman PL, Sager PT et al. Exploring postinfarction reentrant ventricular tachycardia with entrainment mapping. J Am Coll Cardiol 1997; 29 : 1180–1189.
9. Bogun F, Kim HM, Han J et al. Comparison of mapping criteria for hemodynamically tolerated, postinfarction ventricular tachycardia. Heart Rhythm 2006; 3 : 20–26.
10. Fiala M, Chovančík J, Neuwirth R et al. M. Setrvalá monomorfní komorová tachykardie u pacientů se strukturálním postižením srdce. Různé arytmogenní substráty, různé možnosti paliativní nebo kurativní léčby katetrovou ablací v éře trojrozměrného mapování. Vnitř Lék 2006; 52 : 577–589.
11. Stevenson WG, Wilber DJ, Natale A et al. Irrigated radiofrequency ablation guided by electroanatomical mapping for recurrent ventricular tachycardia after myocardial infarction: the multicenter thermocool ventricular tachycardia ablation trial. Circulation 2008; 119 : 2773–1782.
12. Marchlinski FE, Callans DJ, Gottlieb CD et al. Linear ablation lesions for control of unmappable ventricular tachycardia in patients with ischemic and nonischemic cardiomyopathy. Circulation 2000; 101 : 1288–1296.
13. Boulos M, Lashevsky I, Gepstein L. Usefulness of electroanatomical mapping to differentiate between right ventricular outflow tract tachycardia and arrhythmogenic and right ventricular dysplasia. Am J Cardiol 2005; 95 : 935–940.
14. Corrado D, Basso C, Leoni L et al. Three-dimensional electroanatomical voltage mapping and histologic evaluation of myocardial substrate in right ventricular outflow tract ventricular tachycardia. J Am Coll Cardiol 2008; 51 : 731–739.
15. Brugada J, Berruezo A, Cesta A et al. Nonsurgical transthoracic epicardial radiofrequency ablation: an alternative in incessant ventricular tachycardia. J Am Coll Cardiol 2003; 41 : 2036–2043.
16. Earley MJ, Park MAJ, Schilling RJ. Emergency nonsurgical epicardial catheter ablation of incessant ventricular tachycardia in a man with dilated cardiomyopathy. Br J Cardiol 2004; 11: AIC70–AIC72.
17. Carbucicchio C, Santamaria M, Trevisi N et al. Catheter ablation for the treatment of electrical storm in patients with implantable cardioverter-defibrillators: shortand long-term outcomes in a prospective single center study. Circulation 2008; 117 : 462–469.
18. Haïssaguerre M, Shah DC, Jaïs P et al. Role of Purkinje conduction system in triggering of idiopathic ventricular fibrillation. Lancet 2002; 359 : 677–678.
19. Haïssaguerre M, Shoda M, Jaïs P et al. Mapping and ablation of idiopathic ventricular fibrillation. Circulation 2002; 106 : 962–967.
20. Haïssaguerre M, Extramiana F, Hocini M et al. Mapping and ablation of ventricular fibrillation associated with long-QT and Brugada syndromes. Circulation 2003; 108 : 925–928.
21. Nakagawa E, Takagi M, Tatsumi H et al. Successful radiofrequency catheter ablation for electrical storm of ventricular fibrillation in a patient with Brugada syndrome. Circ J 2008; 72 : 1025–1029.
22. Enjoji Y, Mizobuchi M, Shibata K et al. Catheter ablation for an incessant form of antiarrhythmic drug-resistant ventricular fibrillation after acute coronary syndrome. Pacing Clin Electrophysiol 2006; 29 : 3011–3016.
23. Bänsch D, Oyang F, Antz M et al. Successful catheter ablation of electrical storm after myocardial infarction. Circulation 2003; 108 : 3011–3016.
24. Szumowski L, Sanders P, Walczak F et al. Mapping and ablation of polymorphic ventricular tachycardia after myocardial infarction. J Am Coll Cardiol 2004; 44 : 1700–1706.
25. Friedman PL, Stewart JR, Wit AL. Spontaneous and induced cardiac arrhythmias in subendocardial Purkinje fibers surviving extensive myocardial infarction in dogs. Circ Res 1973; 33 : 612–626.
26. Friedman PL, Stewart JR, Fenoglio JJ jr et al. Survival of subendocardial Purkinje fibers after extensive myocardial infarction in dogs. Circ Res 1973; 33 : 597–611.
27. Reddy VY, Reynolds MR, Neuzil P et al. Prophylactic catheter ablation for the prevention of defibrillator therapy. N Engl J Med 2007; 357 : 2657–2665.
Labels
Paediatric cardiology Internal medicine Cardiac surgery CardiologyArticle was published in
Cardiology Review

2010 Issue Supplementum
-
All articles in this issue
- Kardiopulmonální resuscitace: komentované doporučení ERC 2005
- Prevence náhlé srdeční smrti u akutního infarktu myokardu
- Supraventrikulární arytmie u akutního infarktu myokardu
- Bradykardie u akutního infarktu myokardu
- Antiarytmika vs implantabilní kardiovertery-defibrilátory v prevenci náhlé srdeční smrti: definitivně vyřešená otázka?
- Katetrová ablace elektrické bouře po infarktu myokardu
- Cardiology Review
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Bradykardie u akutního infarktu myokardu
- Kardiopulmonální resuscitace: komentované doporučení ERC 2005
- Supraventrikulární arytmie u akutního infarktu myokardu
- Prevence náhlé srdeční smrti u akutního infarktu myokardu
