Léčba inhibitory protonové pumpy
Proton pump inhibitor treatment
PPIs are weak bases metabolized in an acid environment and blocking the function of active proton pumps. They provide effective treatment for oesophageal reflux disease, Helicobacter pylori infection, functional dyspepsia and non‑steroidal anti‑inflammatory drug‑induced gastropathy. The first generation includes omeprazole, pantoprazole and lansoprazole; the second one consists of esomeprazole and rabeprazole. The pharmacokinetic differences between different PPIs do not always result in relevant clinical consequences. Generally, the second generation PPIs provide a more rapid effect and a more prolonged inhibition of the gastric secretion. The effect of rabeprazole, especially, is less dependent on the method of administration and has a lower influence on the cytochrome P450 function. The effectiveness of first ‑ generation PPIs is influenced by the genetic variability of the CYP2C19 enzyme, being significantly lower in rapid metabolizers. PPIs are very safe and immediate complications are exceptional. In Helicobacter pylori infection they cause a worsening of gastritis. Although PPIs cause hypergastrinaemia, they do not exhibit any malignant potential. Their long‑term administration is associated with an increased risk of spine and hip fractures, community pneumonia and clostridium bowel infection. They can lower the effectiveness of antiplatelet therapy with clopidogrel, with a consequent increased risk of cardiovascular events.
Keywords:
proton pump inhibitors – histamine - 2 receptor antagonists – gastric secretion physiology – equipotency – oesophageal reflux disease – Helicobacter pylori eradication – non‑steroid anti‑inflammatory drug‑induced gastropathy – complications – interactions
:
J. Špičák
:
Klinika hepatogastroenterologie, Institut klinické a experimentální medicíny, Praha
:
Kardiol Rev Int Med 2014, 16(3): 214-218
:
Internal Medicine
Inhibitory protonové pumpy (IPP) jsou slabé zásady metabolizující se v kyselém prostředí a blokující funkci aktivní protonové pumpy. Poskytují účinnou léčbu u refluxní nemoci jícnu, eradikace Helicobacter pylori, funkční dyspepsie a gastropatie z nesteroidních antirevmatik. Do první generace patří omeprazol, pantoprazol a lanzoprazol, do druhé esomeprazol a rabeprazol. Rozdíly IPP v jednotlivých farmakokinetických charakteristikách nemusí mít klinicky relevantní důsledky. Obecně IPP druhé generace zajišťují rychlejší nástup účinku, protrahovanější inhibici žaludeční sekrece a zejména účinek rabeprazolu je méně závislý na způsobu podávání a méně ovlivňuje funkce cytochromu P450. Účinnost IPP zejména první generace ovlivňuje genetická variabilita enzymu CYP2C19 a je významně nižší u rychlých metabolizátorů. IPP jsou velmi bezpečné a bezprostřední komplikace jsou výjimečné. U helikobakterové infekce vedou k progresi gastrititidy. Přestože IPP způsobují hypergastrinemii, nevykazují maligní potenciál. Jejich dlouhodobé podávání je spojeno s vyšším rizikem fraktur páteře a kyčlí, komunitních pneumonií a klostridiové střevní infekce. Mohou vést ke snížení účinnosti antiagregační léčby s clopidogrelem se zvýšeným rizikem recidivujících kardiovaskulárních příhod.
Klíčová slova:
inhibitory protonové pumpy (IPP) – antagonisté H2 receptorů (AH2R) – fyziologie žaludeční sekrece – ekvipotence – refluxní nemoc jícnu – eradikace Helicobacter pylori – gastropatie u nesteroidních antirevmatik – komplikace – interakce
Úvod
Léky ovlivňující acidopeptická onemocnění jsou jedněmi z nejčastěji podávaných medikamentů vůbec. Nejúčinnější jsou inhibitory protonové pumpy (IPP), které zatlačily antagonisty H (histamin) 2 receptorů (AH2R) a všechny další léky ovlivňující žaludeční sekreci do pozadí. IPP jsou substituované benzimidazoly a slabé zásady, které se jako primárně neúčinné proléky téměř výlučně akumulují v kyselém prostředí parietálních buněk žaludku. Kovalentní inhibice enzymu H+,K+-ATP ‑ ázy vede k jejímu zablokování. IPP jsou nejaktivnější při plné sekreci HCl postprandiálně a protože je protonová pumpa nejaktivnější po dlouhodobém lačnění, měly by se IPP s výjimkou rabeprazolu podávat před prvním denním jídlem [1]. Všechny protonové pumpy nefungují simultánně a protože IPP blokují pouze ty aktivní, pokles sekrece po jednorázovém podání není maximální a stane se tak až po několika dnech. Proto nelze od podávání on ‑ demand očekávat na rozdíl od AH2R dostatečný efekt. Plné účinnosti IPP také brání současné podávání s jinými léky snižujícími sekreci [2,3]. Cílem následujícího přehledu je zohlednit a přiblížit klinické praxi nové poznatky.
Omeprazol
Podává se ve směsi dvou enantiomerů. Stejně jako ostatní IPP je acidolabilní a vyžaduje acidorezistentní úpravu, rychle se vstřebává a jeho metabolity se vylučují převážně močí. Metabolizují jej jaterní enzymy cytochromu P450, zejména CYP2C19 a CYP3A4. Polymorfizmus CYP2C19 významně ovlivňuje jeho metabolizmus (méně esomeprazolu – viz dále). Podle účinnosti enzymu lze klasifikovat jedince na homozygotní rychlé metabolizátory, heterozygotní rychlé metabolizátory a pomalé metabolizátory. Prevalence pomalých metabolizátorů činí do 3,8 % v euroatlantické populaci a až 23 % v populaci asijské. Pomalá metabolizace se projevuje větší účinností [4].
Lanzoprazol
Jeho farmakokinetika po opakovaném podávání je stejná jako po jednorázové aplikaci. Metabolizuje se enzymy CYP3A4 a CYP2C19, z čehož plyne problém interakcí, například s klaritromycinem, který zvyšuje jeho účinnost.
Pantoprazol
Jeho vysoká biologická dostupnost není ovlivněna výší dávky ani příjmem jídla. Je metabolizován méně CYP2C19 a více CYP3A4 a vykazuje jen interakce, které vyplývají z potlačení kyselé žaludeční sekrece [5].
Esomeprazol
Většina léků se podává ve formě racemických směsí. Řada biologických procesů je však prostorově selektivních, z čehož vyplývá, že prostorově opačně orientovaná „dvojčata“ mohou mít různou účinnost. Specifickými vlastnostmi tohoto S ‑ enanthiomemru jsou vyšší biologická dostupnost, menší individuální variabilita a odlišná metabolizace. Esomeprazol je relativně více metabolizován CYP3A4, a je tedy méně závislý na geneticky podmíněné variabilitě prvního z enzymů s možným důsledkem méně významné interakce, například s clopidogrelem [6].
Rabeprazol
Je spolu s esomeprazolem představitelem tzv. druhé generace IPP. Jeho disociační konstanta (pKa1) je nejvyšší, tudíž je nejvyšší také jeho aktivace v sekrečním kanálku parietální buňky, a to i v méně kyselém prostředí. Proto se rabeprazol aktivuje v relativně větším počtu parietálních buněk než ostatní IPP a jeho farmakokinetické parametry neovlivňuje renální a jaterní dysfunkce. Účast CYP2C19 a CYP3A4 v jeho metabolizaci je menší než u ostatních IPP, takže jeho účinnost i interakce vykazují minimální ovlivnění polymorfizmem těchto enzymů.
Jak se liší jednotlivé IPP – ekvipotentní dávky
Jednotlivé farmakokinetické a farmakodynamické vlastnosti se u IPP liší, otázkou je nakolik jsou tyto odlišnosti klinicky relevantní (tab. 1). Snahou je IPP srovnávat a u jednotlivých molekul stanovovat dávku se stejnou účinností (tzv. ekvipotentní dávky), ve hře je ovšem celá řada různých faktorů od genetických po nejasné definice cílů. Je otázkou, jak posuzujeme snížení žaludeční sekrece či zda se orientujeme podle symptomů nebo endoskopických nálezů. Účinnost IPP stoupá s výší dávky, u jejich komplikací je tento vztah méně jednoznačný.
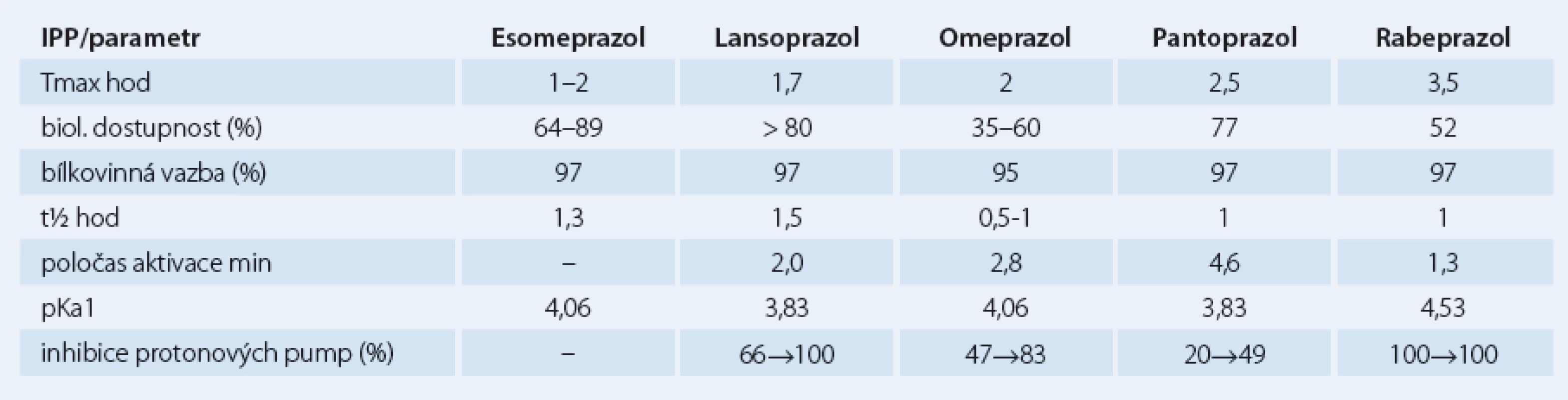
Účinnost jednotlivých IPP se liší v jednotlivých indikacích. K dosažení stejné změny pH je třeba u refluxní nemoci jícnu dávka vyšší, naopak u helikobakterové infekce nižší. Jednotlivé národní a mezinárodní doporučené postupy se od sebe poněkud liší. WHO Collaborating Centre for Drug Statistics Methodology navrhuje základní dávkování u refluxní nemoci jícnu takto: omeprazol 20 mg, esomeprazol 30 mg, lanzoprazol 30 mg, pantoprazol 40 mg a rabeprazol 20 mg [7,8].
Refluxní nemoc jícnu
Cílem léčby obecně je léčba slizničních lézí, prevence rekurence a komplikací a úleva obtíží a zlepšení kvality života. Úleva obtíží a zlepšení kvality života jsou více zvažovány v posledních letech s narůstajícím zájmem o neerozivní refluxní ezofagititidu a extraezofageální symptomatologii refluxu. Nejčastějším kritériem je žaludeční pH v důsledku nestandardizovaného hodnocení pH jícnového refluxátu. Nejčastějším zástupným kritériem účinnosti jednotlivých farmak je doba, během které je pH žaludku > 4. Refluxní nemoc jícnu je primárně multifaktoriální motorická porucha, v jejímž důsledku se zjednodušeně řečeno obsah žaludku ve zvýšené míře dostává do oblasti jícnu, přičemž abnormální expozice jícnu HCl není obvykle spojena s její hypersekrecí. Protože léky upravující dostatečně a specificky poruchu motility chybí, léčba spočívá v aplikaci antisekreční léčby, přičemž klinická účinnost IPP nad 80 % byla prokázána v mnoha srovnávacích studiích. Podle jedné z metaanalýz obsahující deset studií poskytuje esomeprazol přibližně o 5 % vyšší úspěšnost než ostatní bez přímého srovnání s rabeprazolem. Naopak v dalších studiích dosáhl rabeprazol nejvyšší 90% účinnosti. Protože jen 30 % nemocných s refluxní nemocí jícnu vykazuje slizniční erozivní změny, je úleva od obtíží hlavním cílem u zbývajících 70 % nemocných [9 – 11].
Eradikace Helicobacter pylori
IPP v násobné dávce jsou nedílnou součástí jakéhokoli eradikačního schematu. Eradikaci hypoteticky ovlivňuje genotyp CYP2C19, protože u rychlých metabolizátorů omeprazolu a lanzoprazolu lze očekávat sníženou účinnost inhibice žaludeční sekrece. U esomeprazolu a rabeprazolu není eradikace genetickými variantami ovlivněna. Rozdíl mezi generacemi v dosažení očekávaných výsledků vyznívá jednoznačně ve prospěch druhé generace, genetickou variabilitou je nejvíce zatížen omeprazol.
V úspěšnosti eradikace ovšem hrají roli další faktory, z nichž nejvýznamnější je rezistence na antibiotika [12,13].
Prevence gastropatie a jejích důsledků
Aspirin a další nesteroidní antirevmatika (NSAID) jsou vůbec nejužívanější léky v populaci, ať už z indikace antiagregace či pro antirevmatické a analgetické působení. Jejich gastrotoxicita je různá, nicméně vychází z inhibice syntézy prostaglandinů a do určité míry z přímého poškození sliznice žaludku. Snižuje se angiogeneze, průtok kapilárami, produkce bikarbonátu a hlenu, agregace trombocytů, zvyšuje se adherence leukocytů a zpětná difuze kyseliny. Výsledky jednotlivých studií se liší podle definice toxických lézí a způsobu detekce. Přibližné riziko gastrotoxicity u uživatelů nízkých dávek aspirinu ukazuje tab. 2.
Ulcerózní léze po aspirinu se nejčastěji vyskytují v těle žaludku, na angulární řase a v bulbu duodena, bývají mnohočetné a vznikají často již během prvních 24 hod. Riziko lézí do určité míry závisí na dávce, do určité míry pak protektivně působí enterosolventní úprava medikamentu.
V prevenci a léčbě gastropatie a jejích důsledků a komplikací připadá v úvahu podávání méně gastrotoxických COX‑2 inhibitorů a simultánní podávání gastroprotektivních léků. Odůvodnění podávání prostaglandinů spočívá v substituci jejich deplece způsobené NSAID. Na poškození žaludku při léčbě NSAID se podílí kyselý obsah a v prevenci a léčbě gastropatie hraje zvýšení pH zásadní roli. AH2R jsou účinné v hojení slizničních lézí, mají však malý vliv na doprovodné krvácení. IPP jsou účinnější, nejpřesvědčivější výsledky dosáhly esomeprazol a rabeprazol podobně jako v jiných indikacích. Zkouší se kombinace IPP a NSAID v jedné tabletě. Nevýhodou IPP je, že dostatečně nepůsobí na další komplikace NSAID jako kolopatie a enteropatie a v případě helikobakterové toxicity negativně ovlivňují vývoj gastritidy.
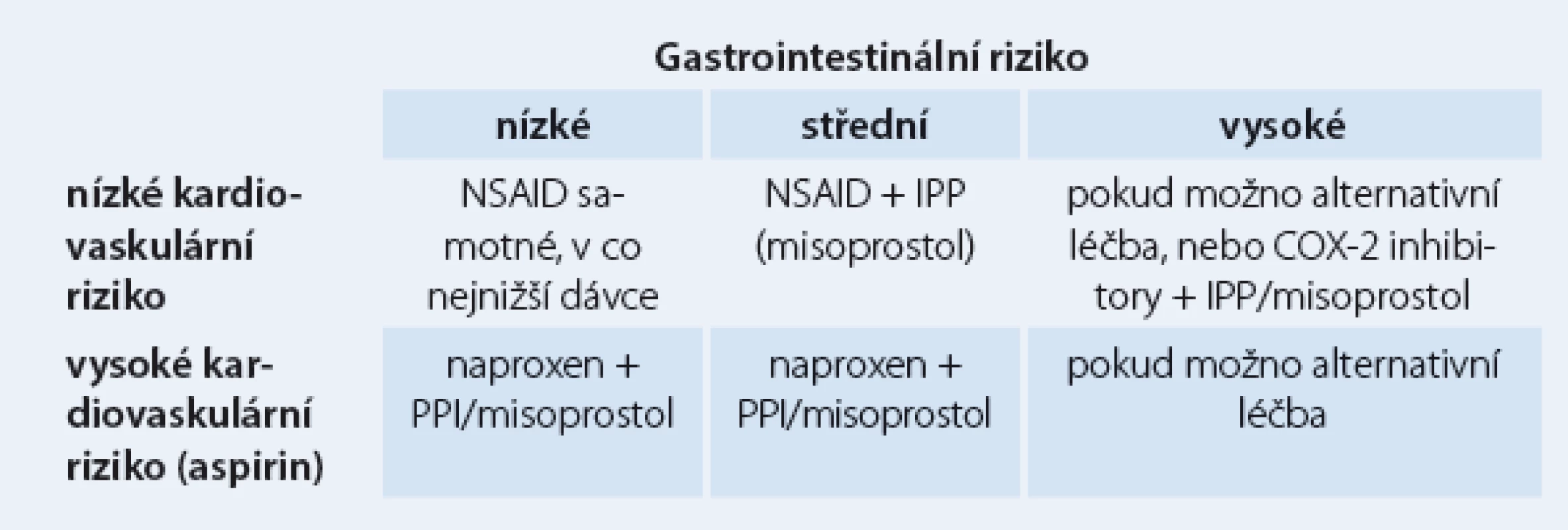
Další možností je podávání COX‑2 inhibitorů, nevýhodou je kardiotoxicita v důsledku inhibice syntézy prostacyklinu. Řada prací se zabývá mírou rizika gastrointestinálních změn u uživatelů aspirinu a dalších NSAID. Evropská metaanalýza kvalifikuje rizikové faktory na jednoznačné (vysoký věk nad 65 – 70 let, vřed v anamnéze, současné užívání antikoagulancií, kortikosteroidů, aspirinu a více druhů NSAID), kontraverzní (vysoké dávky NSAID, současné užívání clopidogrelu či SSRI – selective serotonin reuptake inhibitor, gastrointestinální symptomy v anamnéze, obtěžující revmatoidní artritida a choroby kardiovaskulární) a aditivní, kterým je helikobakterová infekce. Problematiku konečně shrnuje podrobný doporučený postup Americal College of Gastroenterology. Konstatuje se, že až u 25 % chronických uživatelů NSAID vzniká vřed, gastrotoxicita zapříčiňuje ročně v USA 100 000 hospitalizací a až 10 000 úmrtí. Podle jednotlivých srovnávacích studií byly IPP účinnější než AH2R i misoprostol. COX‑2 inhibitory snižují významně riziko gastropatie, ale tento efekt mizí při společném užívání aspirinu. Vždy se individuálně zvažují kardiovaskulární a gastrointestinální rizika.
Střední gastrointestinální riziko znamená jeden nebo dva rizikové faktory, vysoké riziko předchozí vřed, současné užívání kortikoidů či antikoagulancií nebo dva a více dalších rizikových faktorů. Naproxen vykazuje kardioprotektivní a nikoli kardiotoxické vlastnosti.
Jiným fenoménem je NSAID enteropatie. Vzniká s odstupem, podílí se na ní enterohepatální oběh NSAID, změny v metabolizmu prostaglandinů a gramnegativní bakterie. Pomoci může misoprostol [14,15].
Funkční dyspepsie
Vzhledem k nejasné patogenezi a variabilitě dyspepsie je nutné brát výsledky studií ve všech ohledech obecně s nadhledem. Několik doporučených postupů vyznívá v souhrnu přibližně takto: IPP jsou indikovány jako lék první volby v oblastech s nízkou prevalencí helikobakterové infekce a dále tam, kde příznaky přetrvávají po její eradikaci. Dávka má být standardní, ale v případě úspěchu má být držena na co nejnižší úrovni, naopak v případě snížení účinnosti může být zdvojnásobena [16].
Komplikace
Vzhledem k objemu veškeré medikace jsou IPP léky neobyčejně bezpečné. Vážné bezprostřední komplikace jsou mimořádně vzácné a zahrnují ojedinělé případy intesticiální nefritidy a hepatitidy po omeprazolu a lanzoprazolu a poruch vidění po pantoprazolu a omeprazolu. Nicméně dlouhodobé podávání je zvažováno v souvislosti se zvýšeným rizikem řady vážných onemocnění.
Obvyklé nezávažné komplikace (bolest hlavy, průjem, nauzea, urtica) se vyskytují u maximálně 5 % uživatelů IPP a v podstatě se neliší od placeba.
Předpokládaný a sám o sobě fyziologický důsledek dlouhodobého podávání IPP je zvýšená hladina gastrinu. Je relativně vyšší při podávání rabeprazolu a lanzoprazolu a relativně nižší při podávání pantoprazolu [17].
Gastritida a neoplazie žaludku
U osob bez helikobakterové infekce nevyvolávají IPP atrofickou gastrititidu a případný preexistující zánět mohou dokonce zmírnit. U osob Helicobacter pylori pozitivních může podávání IPP vést k progresi zánětu a ke změně antrum ‑ predominantní gastrititidy na gastritidu převážně lokalizovanou v oblasti těla žaludku. Eradikace Helicobacter pylori může vést k regresi zánětlivých změn. Poslední konsenzuální konference o helikobakterové infekci doporučila eradikaci u nemocných s předpokládanou dlouhodobou léčbou IPP. Zvýšení počtu enterochromafiních‑like buněk (ECL) hypoteticky v důsledku hypergastrinemie není jednoznačné. Významnou informaci poskytuje LOTUS trial srovnávající vliv dlouhodobé medikace esomeprazolem a fundoplikace. Při podávání esomeprazolu došlo u helikobakter pozitivní podskupiny během pěti let k poklesu zánětlivé aktivity v antru a snížení koncentrace bakteriálního osídlení. Ačkoli došlo ke zvýšení koncentrace ECL buněk, nebyly zaznamenány dysplastické změny.
Gastrin vykazuje trofický vliv na gastrointestinální sliznici obecně a u perniciózní anemie zvyšuje riziko rakoviny žaludku. Naopak hypergastrinemie při Zollinger ‑ Ellisonově syndromu obvykle nevede ke zvýšení počtu ECL, karcinom žaludku i karcinoid byly u tohoto onemocnění popsány zcela ojediněle. V důsledku užívání IPP se objevuje hyperplazie parietálních buněk a zvýšený výskyt polypů z fundických žlázek, které nevykazují dysplastické změny [18,19].
Deficience železa a vitaminu B12
Vzhledem ke snížené žaludeční sekreci může dojít ke snížení intestinální absorpce organického i anorganického železa, nicméně hyposideremie a sideropenická anemie nevzniká. Důsledkem snížené kyselé sekrece dochází ke snížení aktivace pepsinogenu a následně snížení uvolňování vitaminu B12 vázaného na složky potravy [17].
Osteoporóza, osteopenie, fraktury
V důsledku léčby IPP nedochází ke změnám metabolizmu vitaminu D a vliv na absorpci kalcia je velmi variabilní. Hypoteticky snížení žaludeční sekrece vede ke snížení uvolnění ionizovaného, a tedy vstřebatelného kalcia z nerozpustných kalciových solí. Dlouhodobé užívání IPP zvyšuje riziko fraktur 1,62krát. Hrozí zejména osteoporotické fraktury páteře a kyčlí. Nicméně do statistik mohou zasahovat další faktory a specifická opatření se u uživatelů IPP nedoporučují [20].
Hypomagnezemie
U více než 20 nemocných byla zaznamenána hypomagnezemie obvykle také s hypokalemií a hypokalcemií manifestující se tetanickými křečemi. Přesná příčina není jasná, pravděpodobně u disponovaných jedinců dochází ke snížení absorpce magnezia. Komplikace není závislá na výši dávky IPP [21].
Nozokomiální a komunitní pneumonie
Hypoacidita žaludku znamená snížení přirozené funkce baktericidního filtru. Dochází ke kolonizaci žaludku aerobními bakteriemi, jejich mikroaspiraci a následné kolonizaci dýchacích cest, ovšem nejasným mechanizmem i bakteriemi v žaludku se nevyskytujícími. Recentní metaanalýza si kladla za cíl posoudit vliv IPP i AH2R na veškeré pneumonie. Zahrnovala osm studií a prokázala zvýšené riziko jak IPP (OR 1,27), tak AH2R (OR 1,22). Běžné riziko komunitní pneumonie je přibližně 0,6 na 100 pacient ‑ roků a užívání IPP je zvyšuje 1,89krát. Krátkodobé užívání IPP je rizikovější než dlouhodobé. IPP obecně nezvyšuje riziko nozokomiální pneumonie. Konstatuje se, že lékaři by si měli být vědomi tohoto rizika a v případě hrozby komunitní pneumonie zvážit namísto IPP alternativní léčbu [22].
Střevní infekce
IPP nevykazují vliv na střevní mikrobiot. Banální průjmy jsou nejčastějším důvodem přerušení léčby. Zvyšuje se riziko infekce salmonelou až 11,2krát a kampylobacterem až 11,7krát. Clostridium difficile je nejčastější příčinou střevní infekce u hospitalizovaných pacientů. Recentně publikovaná metaanalýza zahrnula 30 studií a zjistila riziko klostridiové infekce zvýšené 2,15krát. Mechanizmus je nejasný [23].
Lékové interakce
Značná pozornost se v poslední době obrací k lékovým interakcím. IPP jako běžně dlouhodobě podávané léky se nevyhnutelně kombinují s jinými medikamenty, s nimiž se dostávají do interakce v důsledku styčných metabolických principů.
Vyšší pH v trávicí trubici může vést k poruše absorpce. IPP vedou ke snížení absorpce ketoconazolu a itraconazolu, nikoli však fluconazolu. Pantoprazol snížil hladinu mykofenolatu ‑ mofetilu až o 30 %. IPP zasahují do metabolizmu inhibitorů proteáz podávaných u AIDS. Naopak se zvyšuje biologická dostupnost penicilinů. Alterací renální eliminace mohou IPP zpomalit vylučování metotrexátu. Omeprazol zvyšuje AUC phenytoinu, nifedipinu a carbamazepinu. Lanzoprazol zvyšuje AUC tacrolimu. Zvýšenou afinitou k CYP2C19 jsou více zatíženy interakcemi omeprazol a lanzoprazol než pantoprazol a rabeprazol. Opatrnost je na místě při současném podávání diazepamu, imipraminu a citalopramu, jejichž hladiny mohou být zvýšené. V případě užívání kumarinových preparátů se doporučuje monitorovat koagulační parametry. Ke vzájemnému zvýšení AUC může dojít při současném podávání omeprazolu a klarithromycinu.
Velmi významná je interakce s antiagregancii clopidogrelem a aspirinem, kterých se užívá k redukci kardiovaskulárních příhod zejména při akutním koronárním syndromu a po zavedení koronárního stentu. Clopidogrel není primárně ulcerogenní, zvyšuje však riziko krvácení z preexistujících lézí. Riziko krvácení při léčbě clopidogrelem je dvojnásobné proti běžné populaci a dvojnásobně také zvyšuje riziko dané podáváním aspirinu. Proto má být léčba antiagregancii u nemocných se zvýšeným rizikem doprovázena podáváním IPP. Clopidogrel se aktivuje v játrech cytochromem P450, jehož součástí je CYP2C19, kde dochází ke kompetici s IPP, což může vést ke snížení účinku antiagregační léčby a ke zvýšení rizika kardiovaskulárních příhod. Největším inhibitorem CYP2C19 je lanzoprazol, následují omeprazol, esomeprazol, pantoprazol a rabeprazol. Pantoprazol je ovšem největším inhibitorem CYP3A4. CYP2C19 je značně variabilní a ohroženi jsou zejména nositelé afunkčních alel. Tři metaanalýzy shledaly častější výskyt infarktu myokardu i závažných kardiovaskulárních příhod obecně, jen v jedné byla u IPP častější i mortalita.
Dvě metaanalýzy prokázaly významný projektivní účinek IPP v prevenci krvácení do GIT.
V jediné dvojslepé randomizované studii byl ve skupině s omeprazolem menší výskyt krvácivých příhod, v kardiovaskulárních parametrech (smrt, infarkt myokardu, ischemická cévní mozková příhoda a koronární revaskularizace) nebyly mezi skupinami statisticky významné rozdíly.
Metabolická aktivita CYP2C19 je značně interindividuálně variabilní, což může vést k závažným klinickým důsledkům. CYP2C19 je také inhibován IPP, zejména omeprazolem a lanzoprazolem. Vlivem genetických variant na účinek clopidogrelu se zabývala řada studií a jedna recentně publikovaná metaanalýza zahrnující 23 studií a 11 959 nemocných. Nositelé alely CYP2C19*2 (28 %, n = 3 418) vykázali 30% nárůst závažných kardiovaskulárních příhod a ještě vyšší rozdíl byl v mortalitě (1,8 % vs 1 %) a trombóze stentů (2,9 vs 0,9 %). Uživatelé IPP (42 %) byli zatíženi větším rizikem závažných kardiovaskulárních příhod (21,8 vs 16,7 %; OR 1,41) a mortalitou (12,7 vs 4,4 %; OR 1,18).
Byla publikována řada prací zkoumajících předpokládané odlišné riziko interakcí mezi jednotlivými IPP a clopidogrelem. V budoucnu by kandidáti kombinované antiagregační léčby a IPP se zvýšeným rizikem krvácení měli podstoupit vyšetření genetiky CYP2C19 a u rychlých metabolizátorů by se dávka IPP měla zdvojnásobit.
Na interakci IPP s antiagregancii reagují v doporučených postupech profesionální organizace a regulační úřady. FDA varuje před užíváním omeprazolu (i esomeprazolu) společně s clopidogrelem. Výslovně se udává, že varování neplatí pro ostatní IPP. European Medicines Agency nabádá, že v případě nutnosti u rizikových pacientů by se mělo IPP podávat v nejmenší účinné dávce. Toto doporučení poněkud postrádá logiku, uvědomíme‑li si, že u rychlých metabolizátorů (genetické vyšetření se běžně neprovádí) je účinnost IPP snížena, a navíc krvácení u nemocných na antiagregační léčbě se obvykle objevuje bez varovných příznaků [24,25].
Budoucnost inhibice žaludeční sekrece
Přibližně u 20 – 30 % nemocných se očekávaný výsledek nedostavuje nebo je úspěch jen částečný za cenu zvýšení doporučené dávky. Je tomu tak zejména u refluxní nemoci jícnu a gastropatie z užívání nesteroidních antirevmatik. U řady nemocných je doba redukce žaludeční sekrece běžnou dávkou IPP nedostatečná, často v důsledku genetické predispozice (rychlí metabolizátoři).
Dalším snad i nejčastějším faktorem je nedostatečná compliance nemocných. Ideální preparát by měl dostatečně snižovat žaludeční sekreci v průběhu alespoň 20 hod, užíval by se v jedné dávce, byl by prost vedlejších účinků a interakcí a jeho účinek by nebyl závislý na konzumaci potravy.
Tenatoprazol je imidazol ‑ pyridin, nikoli benzimidazol. Aktivuje se pomaleji než schválená IPP a jeho vazba je ireverzibilní. Podobně působí ilaprazol.
Dex ‑ lanzoprazol je R ‑ enantiomer lanzoprazolu, který v důsledku galenické úpravy působí více protrahovaně než běžný lanzoprazol. Dva typy granulí se uvolňují jednak při pH 5,5, resp. při pH 6,8. Klinické studie vyznívají velmi příznivě, dosahuje se až 95% hojení erozivní refluxní ezofagititidy a obvykle postačí jedna denní dávka.
Alevium je opět proléková forma omeprazolu, nicméně tento sulfonamidový derivát omeprazolu je acidorezistentní a pomalu se vstřebává v průběhu celého tenkého střeva, takže jeho poločas v plazmě je ve srovnání s omeprazolem podstatně delší.
Potassium ‑ kompetitivní blokátory sekrece jsou imidazol pyridiny, které nevyžadují aktivaci kyselinou a jejich antisekreční působení je rychlé a dlouhodobé, nicméně výsledky klinických studií jsou dosud nepřesvědčivé.
Přes dobře zdůvodněné antagonistické působení různých principů inhibice sekrece vývoj spočívá i v jejich kombinování. IR (immediate ‑ release) omeprazol kombinuje zmíněnou molekulu s bikarbonátem, který stimuluje protonovou pumpu. Zkouší se v podobě žvýkačky.
OX17 je kombinací omeprazolu a famotidinu, Vecam omeprazolu a succiniovou kyselinou s pentagastrinovou aktivitou.
Objevují se nové kombinace AH2R například emodin‑kalcium karbonát a magnezium hydroxid. Ebrotidin vedle antisekrečního účinku chrání žaludeční epitel. Latifudin je dostupný v Japonsku a jeho účinek nastupuje velmi rychle, takže je lze užívat on ‑ demand.
Spiroglumid a itriglumid jsou antagonisté gastrinových a CCK receptorů, které lze využívat v kombinaci s prazoly [26].
Závěr
IPP poskytují účinnou léčbu u refluxní nemoci jícnu, eradikace Helicobacter pylori, funkční dyspepsie a gastropatie z nesteroidních antirevmatik u 70 – 80 % nemocných. Velmi zjednodušeně a přibližně lze soudit, že IPP nové generace, tj. rabeprazol a esomeprazol, zvyšují úspěšnost léčby o 5 %, což vzhledem k šíři problému není rozdíl zanedbatelný. IPP jsou celkově léky velmi bezpečné, jejich přímá toxicita je výjimečná. Závažné mohou být jejich interakce, a to zejména s podáváním antiagregační léčby, kdy může dojít ke zvýšení rizika závažných kardiovaskulárních příhod. Zde je riziko jednotlivých IPP různé, nejnižší patrně u rabeprazolu. Účinnost IPP je významně ovlivněna polymorfizmem cytochromu P450 a genetické vyšetření se bude v budoucnu využívat ve zvýšené míře. Od nových IPP lze očekávat menší závislost na příjmu potravy a jistě i větší účinnost v inhibici sekrece, což se ovšem nemůže neprojevit na některých vedlejších účincích. Vždy je třeba mít na paměti, že žaludeční sekrece a vysoká acidita žaludku jsou primárně fyziologické fenomény.
Doručeno do redakce: 14. 5. 2014
Přijato po recenzi: 28. 5. 2014
prof. MUDr. Julius Špičák, CSc.
www.ikem.cz
julius.spicak@ikem.cz
Sources
1. Sachs G. Proton pump inhibitors and acid‑related diseases. Pharmacotherapy 1997; 17 : 22 – 37.
2. Huang JQ, Hunt RH. Pharmacological and pharmacodynamic essentials of H2 – receptor antagonists and proton pump inhibitors for the practicing physicians. Best Pract Res Clin Gastroenterol 2001; 15 : 355 – 370.
3. Martínek J, Lukáš M. Inhibitory protonové pumpy – up to date. Gastroent Hepatol 2011; 65 : 331 – 342.
4. Andersson T, Weidolf L. Stereoselective disposition of proton pump inhibitors. Clin Drug Investig 2008; 28 : 263 – 279.
5. Sachs G. Improving on PPI‑based therapy of GORD. Eur J Gastroenterol Hepatol 2001; 13 (Suppl 1): S35 – S41.
6. Horn J. Review article: understanding the pharmacodynamic and pharmacokinetic differences between proton pump inhibitors – focus on pKa and metabolism. Alimentary Pharmacology & Therapeutics Symposium Series 2006; 2 : 340 – 350. doi: 10.1111/ j.1746 ‑ 6342.2006.00065.x.
7. Li XQ, Andersson TB, Ahlström M et al. Comparison of inhibitory effects of the proton pump‑inhibiting drugs omeprazole, esomeprazole, lansoprazole, pantoprazole and rabeprazole on human P450 activities. Drug Metab Dispos 2004; 32 : 821 – 827.
8. Kirchheiner J, Glatt S, Fuhr U et al. Relative potency on proton ‑ pump inhibitors ‑ comparison of effects on intragastric pH. Eur J Clin Pharmacol 2009; 65 : 19 – 31. doi: 10.1007/ s00228 ‑ 008 ‑ 0576 ‑ 5.
9. Friedlander EA, Pallentino J, Miller SK et al. The evolution of proton pump inhibitors for the treatment of gastroesophageal reflux disease. J Am Acad Nurse Pract 2010; 22 : 674 – 683. doi: 10.1111/ j.1745 ‑ 7599.2010.00578.x
10. Pace F, Sonnenberg A, Bianchi Porro G. The lessons learned from randomized clinical trials of GERD. Dig Liver Dis 2007; 39 : 993 – 1000.
11. Altman KW, Prufer N, Vaezi MF. A review of clinical practice guidelines for reflux disease: toward creating a clinical protocol for the otolaryngologist. Laryngoscope 2011; 121 : 717 – 723. doi: 10.1002/ lary.21429.
12. McNicholl AG, Linares PM, Nyssen OP et al. Meta‑analysis: esomeprazole or rabeprazole vs. first ‑ generation pump inhibitors in the treatment of Helicobacter pylori infection. Aliment Pharmacol Ther 2012; 36 : 414 – 425. doi: 10.1111/ j.1365 ‑ 2036.2012.05211.x.
13. Selgrad M, Bornschein J, Malfertheiner P et al. Guidelines for treatment of Helicobacter pylori in the East and West. Expert Rev Anti Infect Ther 2011; 9 : 581 – 588. doi: 10.1586/ eri.11.80.
14. Tielemans MM, Eikendal T, Jansen JB et al. Identification of NSAID users at risk for gastrointestinal complications: a systematic review of current guidelines and consensus agreements. Drug Saf 2010; 33 : 443 – 453. doi: 10.2165/ 11534590 ‑ 000000000 ‑ 00000.
15. Lanza FL, Chan FK, Quigley EM et al. Guidelines for prevention of NSAID‑related ulcer complications. Am J Gastroenterol 2009; 104 : 728 – 738. doi: 10.1038/ ajg.2009.115.
16. Vakil N. Proton pump inhibitors for dyspepsia. Dig Dis 2008; 26 : 215 – 217. doi: 10.1159/ 000121349.
17. Lodato F, Azzaroli F, Turco L et al. Adverse effects of proton pump inhibitors. Best Pract Res Clin Gastroenterol 2010; 24 : 193 – 201. doi: 10.1016/ j.bpg.2009.11.004.
18. Lamberts R, Brunner G, Solcia E. Effects of very long (up to 10 years) proton pump blockade on human gastric mucosa. Digestion 2001; 64 : 205 – 213.
19. Malfertheiner P, Megraud F, O’Morain C et al. Management of Helicobacter pylori infection: the Maastricht IV/ Florance consensus report. Gut 2012; 61 : 646 – 664. doi: 10.1136/ gutjnl ‑ 2012 ‑ 302084.
20. Yu EW, Bauer SR, Bain PA et al. Proton pump inhibitors and risk of fractures: a meta‑analysis of 11 international studies. Am J Med 2011; 124 : 519 – 526. doi: 10.1016/ j.amjmed.2011.01.007.
21. Shabajee N, Lamb EJ, Sturgess I et al. Omeprazole and refractory hypomagnesaemia. BMJ 2008; 337: a425. doi: 10.1136/ bmj.39505.738981.BE.
22. Eom CS, Jeon CY, Lim JW et al. Use of acid ‑ suppressive drugs and risk of pneumonia: a systematic review and meta‑analysis. CMAJ 2011; 183 : 310 – 319. doi: 10.1503/ cmaj.092129.
23. Deshpande A, Pant Ch, Pasupuleti V et al. Association between proton pump inhibitor therapy and clostridium difficile in a meta‑analysis. Clin Gastroenterol Hepatol 2012; 10 : 225 – 233. doi: 10.1016/ j.cgh.2011.09.030.
24. Drepper MD, Spahr L, Frossard JL. Clopidogrel and proton pump inhibitors – where do we stand in 2012? World J Gastroenterol 2012; 18 : 2161 – 2171. doi: 10.3748/ wjg.v18.i18.2161.
25. Chen J, Yuan YC, Leontiadis GI et al. Recent safety concerns with proton pump inhibitors. J Clin Gastroenterol 2012; 46 : 93 – 114. doi: 10.1097/ MCG.0b013e3182333820.
26. Sachs G, Shin JM, Hunt R. Novel approaches to inhibition of gastric acid secretion. Curr Gastroenterol Rep 2010; 12 : 437 – 447. doi: 10.1007/ s11894 ‑ 010 ‑ 0149 ‑ 5.
Labels
Paediatric cardiology Internal medicine Cardiac surgery CardiologyArticle was published in
Cardiology Review

2014 Issue 3
-
All articles in this issue
- Irritable bowel syndrome – diagnosis and treatment
- Diverticular disease of the colon – new trends in therapy
- Colorectal cancer screening
- Idiopatické střevní záněty
- Chronic pancreatitis
- Acute heart failure treatment
- Regular supraventricular tachycardias – diagnosis, treatment and the experiences of a high‑capacity cardio centre
- Modern trends in the treatment of long‑standing persistent atrial fibrillation
- Nursing care standardization for sheath removal at interventional centres in the Czech Republic
- POEM – new endoscopic method of oesophageal achalasia treatment
- Gastro‑oesophageal reflux disease
- Proton pump inhibitor treatment
- Coeliac disease
- Cardiology Review
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Diverticular disease of the colon – new trends in therapy
- Irritable bowel syndrome – diagnosis and treatment
- Chronic pancreatitis
- Proton pump inhibitor treatment
