Akutní stavy v tyreologii
Acute conditions in medicine of thyroid gland
Acute conditions in medicine of thyroid gland include thyroid storm, myxoedema coma, acute hypocalcaemia following thyroid surgery, imminent suffocation and superior vena cava syndrome in rapidly growing goitre, sight - threatening Graves’ ophthalmopathy and acute purulent thyroiditis and its complications (acute mediastinitis and sepsis). As these are rare conditions, the management is often not fully evidence based and is rather empirical and based on pathophysiological principles. Thyroid storm is treated with intravenous methimazole, hydrocortisone and beta‑blockers, myxoedema coma with hydrocortisone and high‑dose levothyroxine and in individual cases in combination with triiodothyronine. In acute postoperative hypocalcaemia, calcium must be supplemented intravenously or orally (in mild cases) and if hypoparathyroidism is confirmed, calcitriol should be added. Rapidly growing goitre often has malignant etiology and when the fine needle aspiration biopsy is not diagnostic, material for purpose of histological examination must be obtained and only after that corticosteroids may be administered. The patient with sight - threatening Graves’ ophthalmopathy must be immediately referred to a “thyroid eye centre”. Fine needle aspiration biopsy with bacteriological examination of the obtained sample is the first step in the management of a patient with acute purulent thyroiditis followed by systemic antibiotic treatment, abscess evacuation and drainage and intensive care if needed (sepsis).
Keywords:
thyroid storm – myxoedema coma – hypocalcaemia – hypoparathyroidism – anaplastic thyroid cancer – thyroid lymphoma – sight - threatening Graves’ ophthalmopathy – acute purulent thyroiditis
Authors:
J. Jiskra
Authors‘ workplace:
3. interní klinika 1. LF UK a VFN v Praze
Published in:
Kardiol Rev Int Med 2015, 17(2): 172-177
Category:
Internal Medicine
Overview
Akutní situace v tyreologii zahrnují tyreotoxickou krizi, hypotyreózní kóma, akutní hypokalcemii po operaci štítné žlázy, hrozící sufokaci a syndrom horní duté žíly u rychle rostoucí strumy, zrak ohrožující endokrinní orbitopatii a akutní hnisavou tyreoiditidu a její komplikace (akutní mediastinitida, sepse). Protože jde o stavy poměrně vzácné, nemáme pro diagnosticko‑terapeutické postupy dostatečné důkazy z randomizovaných kontrolovaných studií a léčba je většinou empirická a na patofyziologických podkladech. Tyreotoxická krize se léčí intravenózním methimazolem, hydrokortizonem a betablokátory, hypotyreózní kóma hydrokortizonem a vyšší dávkou levotyroxinu a v individuálních případech lze zkusit efekt trijodtyroninu. U pooperační hypokalcemie je nutná substituce kalcia intravenózně nebo v lehčích případech perorálně a pokud je prokázána hypoparatyreóza, podáváme současně kalcitriol. Rychle rostoucí struma je často maligní etiologie a když není diagnostický přínos aspirační biopsie tenkou jehlou, je nutné získat co nejdříve materiál k histologickému vyšetření a teprve potom podat kortikoidy. Zrak ohrožující endokrinní orbitopatie (maligní exoftalmus) je důvodem k bezodkladnému odeslání pacienta do specializovaného centra (týž den). U akutní hnisavé tyreoiditidy je první krokem aspirační biopsie tenkou jehlou s odběrem materiálu na mikrobiologické vyšetření, po které následuje systémová antibiotická léčba, chirurgická incize a evakuace abscesu, event. komplexní péče na jednotce intenzivní péče v případě sepse.
Klíčová slova:
tyreotoxická krize – myxedémové kóma – hypokalcemie – hypoparatyreóza – anaplastický karcinom štítné žlázy – lymfom štítné žlázy – zrak ohrožující endokrinní orbitopatie – akutní hnisavá tyreoiditida
Úvod
Cílem přehledného článku je praktický popis diagnosticko‑terapeutických postupů u nejčastějších akutních stavů v tyreologii: tyreotoxické krize, hypotyreózního kómatu, akutní hypokalcemie po operaci štítné žlázy, hrozící sufokace a syndrom u horní duté žíly u rychle rostoucí „strumy“, zrak ohrožující endokrinní orbitopatie a akutní hnisavé tyreoiditidy a jejich komplikací (akutní mediastinitida a sepse).
Tyreotoxická krize
Tyreotoxická krize se definuje jako excesivní nadbytek tyreoidálních hormonů, který ohrožuje pacienta na životě oběhovým a multiorgánovým selháním. Tyreotoxická krize je vzácná a postihuje méně než 1 % pacientů s hypertyreózou. I přes pokroky v léčbě zůstává však mortalita vysoká (20 – 30 %). Na rozdíl od hypotyreózního kómatu může tyreotoxická krize postihnout i osoby mladší a vzácně i děti.
Příčinami jsou nejčastěji Gravesova - Basedowova nemoc nebo hyperfunkční tyreoidální uzly. Vzniká obvykle při dlouhodobě neléčené nebo nedostatečně léčené hypertyreóze a k rozvoji krize je často nutný další vyvolávající moment. Tím bývá koincidující akutní onemocnění (infekce, sepse, akutní kardiovaskulární příhoda apod.), náhlý přísun většího množství jodu (RTG kontrastní látky, amiodaron), operace, trauma nebo náhlé přerušení léčby tyreostatiky. Určité riziko je i po léčbě tyreotoxikózy radiojodem bez předchozího farmakologického zklidnění. Tyreotoxickou krizi mohou vyvolat rovněž léky, které vytěsňují tyreoidální hormony z vazby na plazmatické bílkoviny (salicyláty, fenytoin, fenothiaziny).
Klinický obraz je charakteristický vystupňovanými příznaky hypertyreózy: hyperpyrexií, pocením, třesem rukou nebo celého těla, tachykardií, hyperkinetickou cirkulací, supraventrikulárními tachyarytmiemi (fibrilace/ flutter síní) a srdečním selháním. Stupeň kvalitativní a kvantitativní poruchy vědomí bývá různý (neklid, delirium nebo naopak apatie až kóma). Kůže je jemná, teplá a opocená, bývá nauzea a zvracení. Klinická diagnostická kritéria tyreotoxické krize publikovali v roce 1993 Burch a Wartowsky (tab. 1) [1]. Laboratorně je snížený tyreoidální stimulační hormon (TSH) a zvýšené jsou tyreoidální hormony (volný tyroxin – FT4a volný trijodtyronin – FT3) v séru, jejich hodnoty ale nemusejí korelovat se závažností stavu. Elevace aminotransferáz a alkalické fosfatázy a jejich další vzestup je varujícím příznakem pro hrozící jaterní selhání. Průvodní hypertyreózní myopatie může během tyreotoxické krize vyústit do periodické hypo‑, normo - či hyperkalemické svalové paralýzy.
Diferenciálně diagnosticky přicházejí v úvahu jiné příčiny tachykardie, tachyarytmie, hyperpyrexie a poruch vědomí. V laboratorních nálezech je důležité odlišit syndrom nízkého trijodtyroninu (T3), kdy je často rovněž snížený TSH, může být i přechodně mírně zvýšený FT4 (u tyreotoxické krize je zvýšení výrazné), FT3 je ale nízký. K potvrzení či vyloučení „tyreoidální“ příčiny laboratorních odchylek může přispět ultrazvuk štítné žlázy a vyšetření protilátek.
Terapie tyreotoxické krize musí být komplexní na jednotce intenzivní péče za monitorace základních životních funkcí. Aplikují se antipyretika a fyzikální chlazení (kontraindikovány jsou salicyláty, které uvolněním tyreoidálních hormonů z vazby na plazmatické bílkoviny mohou stav zhoršit) a co nejdříve se zahajuje specifická terapie. Prvním krokem je podání tyreostatik. Optimální je podání methimazolu (Favistan inj.) i.v. (dle závažnosti stavu 80 – 160 mg denně ve 2 – 4 dílčích dávkách, výjimečně lze podat i vyšší dávku do 240 mg denně). Není‑li i.v. preparát k dispozici, podává se methimazol nazogastrickou sondou (NGS) nebo perorálně, event. rozdrcené tablety v klyzmatu [2], dle závažnosti stavu 60 – 80 mg denně ve 2 – 4 dílčích dávkách, výjimečně více. Při použití vysokých dávek tyreostatik stoupá riziko nežádoucích účinků, zatímco vyšší účinnost nelze jednoznačně prokázat. Je proto lepší kombinovat tyreostatika s dalšími způsoby léčby než neúměrně zvyšovat dávky. Po aplikaci úvodní dávky methimazolu je indikován hydrokortizon 200 mg i.v. jako bolus a dále 50 – 100 mg i.v. po 6 – 8 hod (nebo stejné dávky v kontinuální infuzi), který blokuje uvolňování tyreoidálních hormonů do cirkulace a konverzi tyroxinu (T4) na trijodtyronin (T3) a představuje i určitou „stresovou dávku“ kortikoidů (alternativně lze podat i metylprednisolon: 100 mg hydrokortizonu odpovídá 20 mg metylprednisolonu). Nejsou‑li kontraindikace, podávají se vždy betablokátory. Dnes se upřednostňují kardioselektivní preparáty bez vnitřní aktivity, např. metoprolol v iniciální dávce 5 – 10 mg i.v., a dále po 6 hod s přechodem na podávání do NGS nebo perorálně. Dobré zkušenosti jsou i s ultrakrátkým esmololem (bolus 300 µg/ kg během 1 min, udržovací kontinuální infuze 50 – 300 µg/ kg/ min). Dávky betablokátorů jsou vždy individuální a upravují se podle hemodynamického stavu nemocného. Nejdříve 2 – 3 hod po úvodní dávce tyreostatik můžeme zahájit podávání jodových preparátů (blokují syntézu a uvolňování tyreoidálních hormonů, snižují prokrvení štítné žlázy a blokují i konverzi T4 na T3). Podává se nasycený roztok jodidu draselného (SSKI – 1 000 mg jodidu v 1 ml, cca 50 mg jodidu v jedné kapce) perorálně 3× denně 1 – 2 kapky (0,05 – 0,1 ml) nebo Lugolův roztok (8 mg jodidu v jedné kapce) perorálně 3× denně 5 – 7 kapek (0,25 – 0,35 ml) nebo alternativně stejné dávky i.v. ve formě sterilně připraveného ředěného roztoku jodidu draselného na příslušnou koncentraci (např. 3× denně 50 ml roztoku o koncentraci 1 mg jodu/ 1,308 mg jodidu v 1 ml) nebo ředěného sterilně připraveného Lugolova roztoku [2]. Lugolův roztok lze připravit smísením 5 g jodu (I2), 10 g jodidu draselného (KI) a 85 ml destilované vody. Lze podat i kyselinu iopanovou (RTG kontrastní látka) 500 mg i.v. po 6 hod, která však u nás není k dispozici. Použijeme‑li jodové preparáty, je nutné po zvládnutí akutního stavu indikovat totální tyreoidektomii (ne dříve než s odstupem dvou týdnů), protože jinak hrozí relaps hypertyreózy. Pouze pokud je známa intolerance methimazolu, lze léčbu výjimečně zahájit i propylthiouracilem, je však třeba brát v úvahu nebezpečí hepatotoxicity. Zcela výjimečně lze u rezistentní tyreotoxické krize vyzkoušet efekt chloristanu draselného (přípravek Chlorigen není u nás registrován) nebo lithium karbonátu (600 – 900 mg denně), jejichž nevýhodou je ale potenciální toxicita a je vždy třeba zvažovat poměr přínos/ riziko. Zásady specifické léčby tyreotoxické krize jsou uvedeny v tab. 2.
![Klinická diagnostická kritéria tyreotoxické krize. Upraveno podle [1].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/2be485958e0d5ade78cc7aa2f78ea938.png)

Hypotyreózní kóma
Hypotyreózní kóma se definuje jako kvantitativní porucha vědomí a selhávání základních životních funkcí způsobené nedostatkem tyreoidálních hormonů. Mortalita hypotyreózního kómatu je vysoká a dosahuje až 30 – 50 %, i když se v posledních desetiletích díky rozvoji a dostupnosti resuscitační a intenzivní péče snižuje. Onemocnění je vzácné, incidence se odhaduje na 0,22 případů na 1 milion osob za rok. Průměrný věk pacientů je okolo 75 let.
Příčinou je nepoznaná a neléčená hypotyreóza autoimunitní etiologie nebo po operaci či léčbě radiojodem a především přerušení substituční léčby. K rozvoji přispívá většinou vyvolávající moment (podchlazení, infekce, akutní koronární příhoda, cévní mozková příhoda, útlum dechového centra léky, trauma, krvácení do gastrointestinálního traktu apod.). V klinickém obraze je vždy kvantitativní porucha vědomí, hypotermie, hypoventilace a bradykardie. Častá je hypotenze, efektivní cirkulující intravaskulární objem je snížený, je snížená glomerulární filtrace, klesá vylučování vody ledvinami a tvoří se otoky. Na EKG je nápadná snížená voltáž a nespecifické změny ST úseku (ploché až negativní T vlny). Pokud je provedena echokardiografie, prokáže často perikardiální výpotek, může být i ascites. Velmi časté jsou různé nespecifické laboratorní odchylky (tab. 3). Nejčastějšími komplikacemi jsou hypoventilace a respirační insuficience, arytmie, akutní koronární příhoda a srdeční selhání. Při klinickém podezření vyšetřujeme laboratorně nejen tyreoidální parametry (TSH, FT4 a FT3), ale vždy také kortizol, ACTH (adrenokortikotropní hormon) v séru (pokud je metoda k dispozici) a při podezření na hypopituitarizmus i další hypofyzární hormony, abychom diagnostikovali event. další hormonální deficity. U hypotyreózního kómatu je především výrazně snížený až neměřitelný FT4. FT3 bývá také snížený, avšak dejodací T4 se potřebné koncentrace T3 v tkáních i séru udržují delší dobu. TSH je u kómatu periferní etiologie zvýšený a u centrálního snížený, hodnota TSH však nemusí korelovat se závažností stavu, neboť i reaktivita hypotalamu a hypofýzy může být při dlouhotrvající hypotyreóze snížená.

V diferenciální diagnostice je nejdůležitější pomýšlet na možnost kombinace hypotyreózy a hypokortikalizmu, jak periferního, tak při hypopituitarizmu. Izolované hypotyreózní kóma centrální etiologie je vzácné. Je třeba také odlišit ostatní časté příčiny poruchy vědomí (kardiovaskulární, metabolické, neurologické, psychiatrické, traumata CNS a intoxikace), u kterých mohou být nespecifické změny tyreoidálních parametrů v rámci syndromu nízkého T3. V těchto případech je snížený FT3 (reverzní T3, který se rutinně neměří, je naopak zvýšený), normální, lehce snížený nebo ve fázi rekonvalescence i mírně zvýšený FT4 a snížený TSH v krvi. V diferenciální diagnostice jsou velmi cenné anamnestické údaje o užívání tyreoidálních hormonů v minulosti (resp. přerušení jejich podávání), případně o operaci štítné žlázy či léčbě radiojodem, získané většinou od příbuzných či jiných osob v okolí pacienta.
Terapie je komplexní na jednotce intenzivní péče. Pacienta pomalu rehydratujeme, zahříváme a pomalu korigujeme vnitřní prostředí. Před zahájením substituce levotyroxinem je nutno odebrat krev nejen na stanovení TSH, FT4 a FT3, ale i kortizolu, event. ACTH, pokud je metoda k dispozici. Protože těžká hypotyreóza může způsobit relativní hypokortikalizmus a také proto, že se i primárně může kombinovat s hypokortikalizmem, doporučuje se vždy zahájit léčbu „stresovou dávkou“ hydrokortizonu: 100 mg i.v. jako bolus a pak 50 – 100 mg i.v. po 6 – 8 hod (nebo stejné dávky v kontinuální infuzi), ve které se má pokračovat do zlepšení stavu nebo vyloučení hypokortikalizmu. Teprve po podání úvodní dávky hydrokortizonu následuje podání tyreoidálních hormonů: levotyroxinu (LT4) samotného nebo v kombinaci s T3. Ideální je podání intravenózní, v praxi však většinou intravenózní preparáty nejsou k dispozici (jsou dostupné pouze na zvláštní dovoz, např. L - Thyroxin injekt 0,5 mg), takže se podává LT4 do NGS nejlépe v mírně okyseleném roztoku (k dostatečné resorpci je nutné kyselé prostředí v žaludku). Léčba se zahajuje bolusem LT4 200 – 400 µg (menší dávka u starších osob, pacientů s ICHS a osob s menší hmotností) a v následujících dnech se podává dávka 1,6 µg/ kg a při zlepšení stavu se přechází na perorální podávání. Při i.v. aplikaci se dávka snižuje na 75 %. Protože se předpokládá, že je u těžké hypotyreózy snížená aktivita dejodáz, lze přidat T3, i když důkazy pro tento postup jsou slabé [3] a velké dávky T3 mohou být spojeny i se zvýšenou mortalitou [4]. U nás je v současné době k dispozici preparát Cynomel s obsahem 25 µg T3, tudíž v praxi lze jako doplněk k léčbě LT4 podat v úvodu 1/ 2 – 1 tabletu jako bolus a pak 2× denně 1/ 4 – 1/ 2 tablety perorálně nebo do NGS (menší dávky u starších osob, pacientů s ICHS a osob s menší hmotností). Zpočátku lze monitorovat FT4 v séru (vždy před podáním dávky LT4) 1× za 1 – 2 dva dny a když není patrné zlepšení, může to být důvodem pro zvýšení dávek LT4 nebo přidání T3. Zásady specifické léčby hypotyreózního kómatu jsou uvedeny v tab. 2.
Akutní hypokalcemie po operaci štítné žlázy
Po operaci štítné žlázy se může vyskytnout přechodná hypokalcemie s normálním parathormonem (PTH) a normálním fosforem v séru, která nemá zcela objasněnou etiologii a většinou se rychle spontánně upraví. Nebývá spojena s tetanií a pacienta bezprostředně neohrožuje. Akutní pooperační hypoparatyreóza (bezprostředně po operaci nelze rozhodnout, zda je přechodná či trvalá) vzniká odstraněním nebo přechodným poškozením (tranzientní ischemií) všech čtyř příštítných tělísek. U pacienta, který má všechna čtyři příštítná tělíska, tedy nikdy nevznikne po jednostranném výkonu. Prevalence pooperační hypoparatyreózy se udává v širokém rozmezí 1 – 50 %, většina případů je ale lehkých a spontánně se upraví nebo se na mírnou trvalou hypoparatyreózu pacienti adaptují. Prevalence trvalé hypoparatyreózy se udává maximálně 1 – 3 % [5 – 7].
Akutní hypokalcemie je provázena bolestmi hlavy, paresteziemi a křečemi (tetanie), náhlý těžký pokles ionizovaného kalcia snižuje fibrilační práh. Jde‑li o hypoparatyreózu, je v krvi snížené nejen celkové a ionizované kalcium, ale i parathormon, fosfor v krvi je zvýšený a je přítomná hyperkalciurie.
Léčebně se podává 10% kalcium glukonát (calcium gluconicum) zředěný ve fyziologickém roztoku nebo v 5% glukóze v pomalé infuzi, maximální dávka může být až 2 ml/ kg za 24 hod, většinou ale stačí dávky menší (50 – 100 ml/ 24 hod, někdy i méně). Po odeznění akutního stavu se přechází na perorální podání kalciových preparátů. Pokud je potvrzena hypoparatyreóza (je snížený PTH v krvi) je třeba současně podat kalcitriol (1,25 dihydroxycholecalciferol), protože při nedostatku parathormonu vázne hydroxylace v ledvině a nehydroxylovaný vitamin D není účinný. Začíná se dávkou 0,25 mg perorálně 1× nebo 2× denně a zvyšuje se postupně za kontroly kalcemie. Při terapii kalciem a kalcitriolem často výrazně stoupá kalciurie (při chronické hyperkalciurii je riziko hyperkalciurické nefropatie a nefro ‑ a urolithiazy), kterou lze snížit přidáním hydrochlorothiazidu. Zásady diagnostiky a léčby hypokalcemie po operaci štítné žlázy jsou uvedeny v tab. 4.

Rychle rostoucí struma
Pokud rychle rostoucí struma ohrožuje pacienta útlakem okolních struktur a hrozí syndrom horní duté žíly, event. sufokace, jde téměř vždy o zhoubný nádor štítné žlázy, nejčastěji anaplastický karcinom, lymfom, nediferencovaný karcinom štítné žlázy, event. metastáza jiného špatně diferencovaného karcinomu. Tento stav je poměrně vzácný, výše zmiňované nádory představují max. 5 – 10 % všech zhoubných nádorů štítné žlázy a navíc ne u všech těchto pacientů se tento akutní stav vyvine. Během několika týdnů může v těchto případech struma narůst do obrovských rozměrů a pak se může stav prudce zhoršit během několika hodin až do akutní sufokace. Bezprostřední příčinou akutního zhoršení může být otok krku při útlaku a trombóze horní duté žíly, spontánní krvácení, krvácení po biopsii, aspirace apod. Často je přítomný chrapot, dysfagie, stridor (který může vyvrcholit sufokací), v obličeji a na krku je otok, cyanóza a jsou patrné kolaterály na přední stěně hrudníku. Závažné podezření na zhoubný rychle rostoucí nádor je evidentní již z klinického obrazu. Tento obraz je indikací k bezodkladnému provedení biopsie tenkou jehlou s cytologickým vyšetřením s odběrem do cytobloku, což ale často nevede k definitivní diagnóze a je třeba získat co nejdříve materiál k histologickému vyšetření. To je možné buď chirurgicky (takto pokročilý nádor je obvykle neresekabilní, takže zbývá pouze diagnostická excize, nebo paliativní zmenšovací/ dekompresní operace, která je také částečně léčebným výkonem) nebo lze získat materiální core‑cut biopsií (silnější jehlou). Druhý způsob se osvědčil zejména při podezření na lymfom, kdy je další léčba čistě onkologická a chirurgický výkon není vůbec indikovaný. Prognóza je v těchto případech po onkologické léčbě poměrně dobrá. V případech rychle rostoucí strumy nejasné etiologie je vždy na místě vyšetření kalcitoninu v krvi k vyloučení agresivního medulárního karcinomu.
Po odběru materiálu na histologické vyšetření (diagnostická excize, core‑cut biopsie) je indikováno podání glukokortikoidů (metylprednisolon 60 – 125 mg i.v. první den, 20 – 60 mg i.v. nebo perorálně v dalších dnech), které působí protizánětlivě a sníží otok krku. U trombózy horní duté žíly podáváme antikoagulační léčbu. V případě hrozící sufokace je třeba zajistit dýchací cesty intubací, event. tracheostomií, pokud je možné ji v terénu pokročilého nádoru vůbec založit, a přístup do gastrointestinálního traktu nazogastrickou sondou, perkutánní endoskopickou, event. výjimečně i chirurgickou gastrostomií. Zajistit dýchací cesty a přístup do gastrointestinálního traktu je také vhodné před event. paliativní radioterapií, protože následný otok může situaci zhoršit. Kromě lymfomu má v případech anaplastického karcinomu a nediferencovaných karcinomů veškerá léčba většinou pouze paliativní charakter a onemocnění téměř vždy přes veškerou snahu končí fatálně. Rizikovým faktorem anaplastického karcinomu je kromě známých rizikových faktorů kancerogeneze (zevní ozáření apod.), také letitá polynodózní struma dlouhodobě léčená tyreostatiky. Zásady diagnostiky a léčby hypokalcemie po operaci štítné žlázy jsou uvedeny v tab. 5.

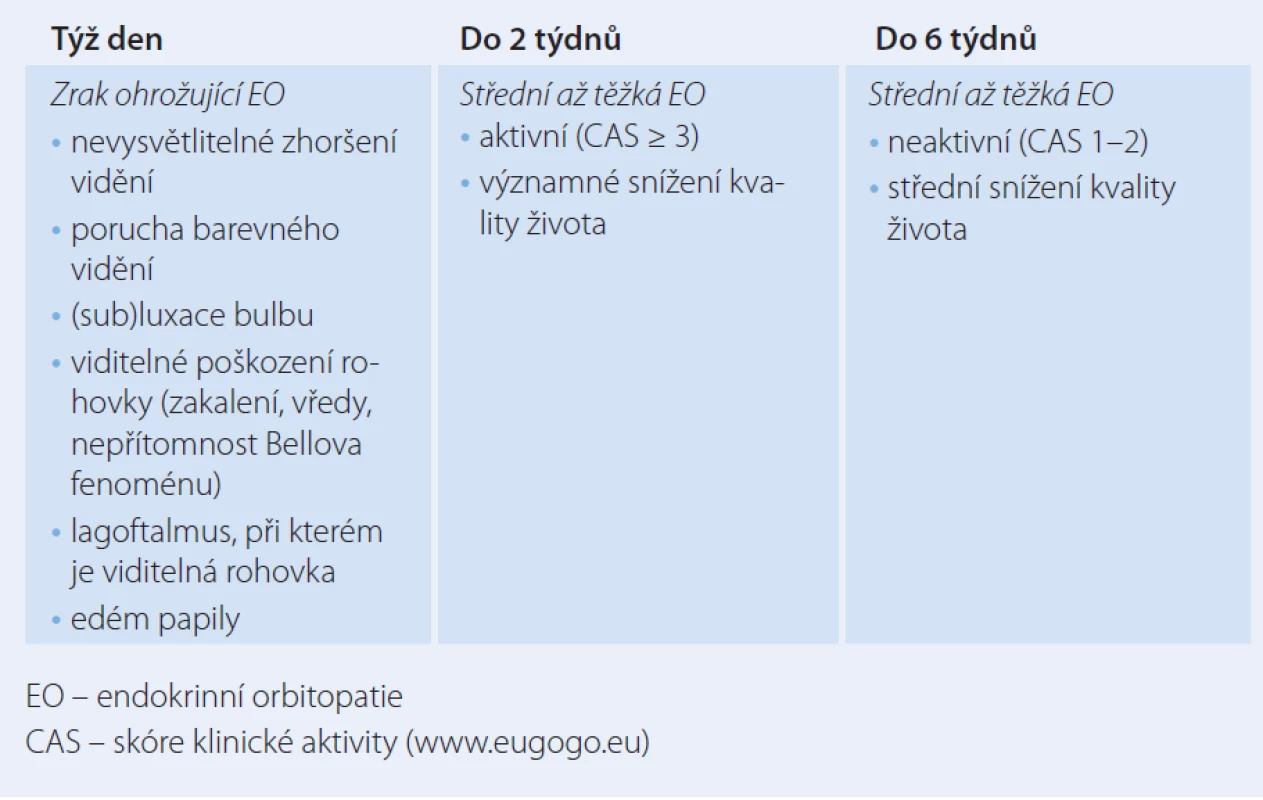
Zrak ohrožující endokrinní orbitopatie (maligní exoftalmus)
Endokrinní orbitopatie (EO) může ohrozit zrak kompresí zrakového nervu (dystyreózní neuropatie n. opticus) nebo vážným poškozením rohovky z důvodu exoftalmu. Bezprostřední ohrožení zraku přichází v úvahu u méně než 5 % pacientů s EO. Příznaky ohrožení zraku u EO a indikace k odeslání do specializovaného centra jsou uvedeny v tab. 6. U zrak ohrožující EO do oka aplikujeme indiferentní mast, při defektech antibiotickou mast. Při expozici s lagoftalmem a/ nebo chemózou spojivky je nutno provést tarzorhafii, event. aplikovat tzv. vlhkou komůrku. Bezodkladně je indikována pulzní terapie i.v. glukokortikoidy a pokud nedojde ke zlepšení během 1 – 2 týdnů, je na místě chirurgická dekomprese očnice co nejdříve. Chirurgickou dekompresi s odstraněním jedné nebo více stěn očnice indikuje oftalmolog, ale zpravidla provádí rhinolaryngolog (endoskopicky) nebo stomatochirurg (tab. 6).
Akutní hnisavá tyreoiditida její komplikace
Akutní hnisavá tyreoiditida je raritní onemocnění, jehož prevalence se udává 0,1 – 0,7 % všech tyreopatií [8], což se ale jeví jako poněkud nadhodnocené. Onemocnění se vyskytuje prakticky výhradně u imunokompromitovaných osob. Infekčními agens jsou nejčastěji bakterie (Staphylococcus aureus, Streptococcus pyogenes, Streptococcus epidermidis, Streptococcus pneumoniae, Clostridie, Peptostreptococcus), méně často houby nebo tuberkulóza, raritně i paraziti [9]. K infekci může dojít hematogenní cestou (sepse, endokarditida, hnisavá pyelonefritida aj.) nebo častěji rozšířením z blízkého okolí (zánětlivé procesy dutiny ústní a hltanu – hnisavá tonsilitida, retrotonsilární a submandibulární absces, hnisavá periodontitida aj.). Onemocnění má akutní průběh s horečkami až obrazem sepse, je přítomno bolestivé zduření na krku v místě abscesu/ flegmóny, které je na povrchu teplé, zarudlé a jsou zánětlivě zvětšené lymfatické uzliny na krku. Mortalita akutní infekční tyreoiditidy se udává až 12 % [8] a při komplikující akutní mediastinitidě a sepsi je ještě vyšší.
Laboratorně je obraz sepse, tyreoidální laboratorní testy mohou být normální nebo je obraz syndromu nízkého T3, výjimečně může být přechodná mírná hyperfunkce z rozpadu tyreoidální tkáně. Diagnózu potvrdí ultrazvuk štítné žlázy a krku s nálezem hypoechogenního hnisavého ložiska, okolní flegmóny a zánětlivě aktivovaných lymfatických uzlin. Aspirační biopsie tenkou jehlou umožní odběr materiálu na mikrobiologické vyšetření a je částečně i terapeutickým výkonem, podaří‑li se odsát alespoň část hnisavého obsahu, což je spojeno s okamžitou úlevou pro pacienta. Léčba spočívá v chirurgické incizi, evakuaci a drenáži abscesu, podávání systémových širokospektrých antibiotik a komplexní péči na jednotce intenzivní péče v případě sepse. Zásady diagnostického a léčebného postupu jsou uvedeny v tab. 7.

Závěr
Popsané akutní stavy v tyreologii jsou poměrně vzácné. Z toho důvodu nemáme pro diagnosticko‑terapeutické postupy dostatečné důkazy z randomizovaných kontrolovaných studií a léčba je většinou empirická a na patofyziologických podkladech.
Doručeno do redakce: 11. 3. 2015
Přijato po recenzi: 3. 4. 2015
doc. MU Dr. Jan Jiskra, Ph.D.
www.vfn.cz
jan.jiskra@vfn.cz
Sources
1. Burch HB, Wartofsky L. Life - threatening hyperthyroidism: thyroid storm. Endocrinol Metab Clin North Am 1993; 22 : 263 – 277.
2. Bahn RS, Burch HB, Cooper DS et al. Hyperthyroidism and other causes of thyrotoxicosis: management guidelines of the American Thyroid Association and American Association of Clinical Endocrinologists. Endocr Pract 2011; 17 : 456 – 520.
3. Jonklaas J, Bianco AC, Bauer AJ et al. Guidelines for the treatment of hypothyroidism. Thyroid 2014; 24 : 1670 – 1751. doi: 10.1089/ thy.2014.0028.
4. Yamamoto T, Fukuyama J, Fujiyoshi A. Factors associated with mortality of myxedema coma: report of eight cases and literature survey. Thyroid 1999; 9 : 1167 – 1174.
5. Vlček P, Neumann J. Karcinom štítné žlázy. Pooperační sledování nemocných. Praha: Maxdorf 2002 : 218.
6. Brunaud L, Zarnegar R, Wada N et al. Incision length for standard thyroidectomy and parathyroidectomy: he is it minimaxy invasive? Arch Surg 2003; 138 : 1140 – 1143.
7. Dvořák J, Kubín S, Schuster J. Chirurgie štítné žlázy. Postgraduální medicína 2002; 4 : 597 – 603.
8. Paes JE, Burman KD, Cohen J et al. Acute bacterial suppurative thyroiditis: a clinical review and expert opinion. Thyroid 2010; 20 : 247 – 255. doi: 10.1089/ thy.2008.0146.
9. Farwell AP. Infectious thyroiditis. In: Braverman LE, Utiger RD (eds). Werner and Ingbar’s The Thyroid. 8th ed. Philadelphia: Lippincott, Williams and Wilkins 2000 : 1044 – 1149.
Labels
Paediatric cardiology Internal medicine Cardiac surgery CardiologyArticle was published in
Cardiology Review

2015 Issue 2
-
All articles in this issue
- Náhlá srdeční smrt
- Skórovací systémy preventivní kardiologie
- Skórovací systémy u pacientů s akutním koronárním syndromem
- Skórovací systémy u fibrilace síní
- Skórovací systémy u tromboembolické nemoci
- Klinické klasifikace a skórovací systémy u srdečního selhání
- Role echokardiografie v hodnocení aortální stenózy a mitrální regurgitace
- Přímé versus nepřímé metody stanovení intenzity zatížení v kardiovaskulární rehabilitaci
- Skórovací systémy před kardiochirurgickou operací
- Primární hyperaldosteronizmus – nejčastější forma sekundární hypertenze
- Cushingův syndrom a kardiovaskulární riziko
- Saturace jodem v České republice a ve světě – nedostatky a perspektivy
- Akutní stavy v tyreologii
- Diferenciální diagnostika hyponatremie
- Endokrinologie stárnutí – krátký přehled
- Cardiology Review
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Klinické klasifikace a skórovací systémy u srdečního selhání
- Skórovací systémy u tromboembolické nemoci
- Diferenciální diagnostika hyponatremie
- Akutní stavy v tyreologii
