Skórovací systémy u fibrilace síní
Scoring systems used in atrial fibrillation
Atrial fibrillation (AF) with 25% lifetime risk of onset is one of the most common arrhythmias compromising quality of life. The cardiovascular epidemic of AF contributes to the onset of heart failure, in 20% of cases it causes stroke and increases total mortality. Due to a growing number of elderly individuals, AF contributes to the high socioeconomic burden, therefore there is a great need for identification of clinical factors affecting development and progression of AF and stratification of risks and complications of AF. This will lead to more effective prevention strategy in the management of AF.
Keywords:
atrial fibrillation – scoring systems – thromboembolic disease – anticoagulant therapy
Authors:
Z. Mihalová 1,2; J. Hlásenský 1; R. Lábrová 1; J. Špinar 1,2; O. Ludka 1,2
Authors‘ workplace:
Interní kardiologická klinika LF MU a FN Brno
1; Mezinárodní centrum klinického výzkumu, FN u sv. Anny v Brně
2
Published in:
Kardiol Rev Int Med 2015, 17(2): 121-125
Category:
Cardiology Review
Overview
Atriální fibrilace (AF) je s rizikem vzniku 25 % nejfrekventovanější arytmií snižující kvalitu života. Tato kardiovaskulární epidemie přispívá k srdečnímu selhání, z 20 % zapříčiňuje cévní mozkovou příhodu, a zvyšuje tak celkovou mortalitu. Vzhledem ke stárnutí populace přispívá AF ve výrazné míře k vysoké socioekonomické zátěži společnosti. Vyvstává tedy potřeba identifikace klinických faktorů ovlivňujících vznik, progresi AF a stratifikace rizika vzniku následných komplikací AF, která se následně promítne do efektivní preventivní strategie managementu AF.
Klíčová slova:
fibrilace síní – skórovací systémy – tromboembolická nemoc – antikoagulace
Úvod
Fibrilace síní je bez ohledu na sníženou kvalitu života postiženého pacienta a zvýšení celkové kardiovaskulární mortality nebezpečná zejména svými tromboembolickými (TE) komplikacemi v podobě cévní mozkové příhody či jiného systémového tromboembolizmu. Vzhledem k tomu, že ne všichni pacienti mají stejné riziko vzniku těchto komplikací, vyvstává nutnost identifikovat pacienty ohrožené nejvíce. Na druhou stranu, použitím antitrombotické terapie zvyšujeme u těchto pacientů riziko vzniku závažného život ohružujícího krvácení. Významnou pomoc v odhalení ohrožených pacientů nám poskytují právě skórovací systémy.
Riziko progrese paroxyzmální formy fibrilace síní v setrvalou formu
V roce 2010 De Vos et al sledovali možné klinické koreláty vedoucí k progresi paroxyzmální formy AF v setrvalé formy u pacientů zařazených do Euro Heart Survey [1]. V průběhu jednoho roku progredovala paroxyzmální forma AF v setrvalou formu u 15 % sledovaných pacientů. Multivariantní logistickou analýzou se identifikovalo pět nezávislých prediktorů této jednoroční progrese, a to konkrétně: srdeční selhání, cévní mozková příhoda/ transientní ischemická ataka (CMP/ TIA), chronická obstrukční plicní nemoc, věk nad 75 let a hypertenze. Další faktory včetně diabetes mellitus se ukázaly jako nevýznamné. Regresní analýzou se určilo relativní přispění jednotlivých faktorů na predikci progrese AF. Vzniklo tak HATCH skóre predikující pravděpodobnost progrese paroxyzmální formy AF v setrvalou formu. Se stoupajícím HATCH skóre stoupala pravděpodobnost progrese, u pacientů, kteří dosahovali skóre 6 a 7 bodů, byla tato pravděpodobnost 50 %, zatímco u pacientů se skóre 0 byla pozorována progrese jen u 6 %. To naznačovalo možné využití k identifikaci populace pacientů vyžadujících častější kontroly, eventuálně populaci, kde by kontrola frekvence mohla být první volbou v managementu AF.
Novější Barrettova studie [2] s kohortou pacientů s nově vzniklou AF a preciznějším designem hodnotila přesnost HATCH skóre a ukázala stejnou vzestupnou pravděpodobnost progrese AF do setrvalých forem s vzestupným HATCH skóre. Nicméně odhalila mnohem širší populaci pacientů s nulovým HATCH skóre, u kterých paroxyzmální AF zprogredovala do setrvalých forem (18,8 vs. 6 %), což bylo dáno odlišným designem studie.
Zatím se tedy nedá určit přesná cut off hodnota vysoce rizikového HATCH skóre a je vhodné ověřit spolehlivost tohoto skórovacího systému na robustnější kohortě vybraných pacientů.
Stratifikace rizika trombembolických komplikací
AF je asociovaná se značným rizikem vzniku cévní mozkové příhody a tromboembolizmu. Cévní mozková příhoda (CMP) je v jednom případu z pěti zapříčiněna právě AF, je také prokázáno, že CMP asociovaná s AF má vyšší 30denní mortalitu, horší průběh, rozsáhlejší rezidua a bývá 2× fatálnější než CMP jiné etiologie. Nepřehlédnutelný je fakt, že toto riziko je obdobné u paroxyzmální formy i setrvalých forem AF. Je tedy kruciální identifikovat populaci pacientů vysoce ohroženou tímto následkem AF na základě dalších klinických podmínek zvyšujících riziko tromboembolizmu. Výsledkem této snahy byly postupem času vyvinuty skórovací systémy stratifikující riziko vzniku ischemické CMP u populace pacientů s nevalvulární AF.
Jedním z prvních byl skórovací systém Atrial Fibrillation Investigators (AFI) [3], který na základě porovnání výsledků roční míry vzniku ischemické CMP (iCMP) u pacientů s AF v pěti randomizovaných studiích s warfarinem/ aspirinem u kontrol bez medikace určil komorbidity těchto pacientů, které se ukázaly, že byly spojeny s vysokým rizikem vzniku iCMP. Jsou to tyto komorbodity: předchozí CMP/ tranzitorní ischemická ataka (TIA), diabetes mellitus, hypertenze a dále faktor pokročilého věku. Pacienti, kteří neměli žádný z těchto rizikových faktorů (RF) a byli starší 65 let, byli ve středním riziku vzniku iCMP a pacienti mladší 65 let bez dalších RF měli podle výsledků této studie jen nízké riziko vzniku iCMP i bez antitrombotické léčby, pacienti, kteří trpěli hypertenzí, diabetem nebo měli v anamnéze TIA/ CMP, měli dle tohoto schématu vysoké riziko vzniku CMP. Dle výsledků National Register of Atrial Fibrillation hodnotících predikční hodnoty klinických klasifikačních schémat, dosáhl tento systém dostatečné spolehlivosti.
Obdobná analýza studií Stoke Prevention in Atrial Fibrillation (SPAF) u kohort SPAF I – III [4] hodnotila faktory asociované s iCMP u pacientů s AF léčených aspirinem. Na základě nezávislých prediktorů (ženské pohlaví, věk nad 75 let, systolický krevní tlak nad 160 mm Hg, hypertenze, diabetes mellitus, předchozí CMP/ TIA) byli identifikováni pacienti s AF, kteří měli v průběhu terapie aspirinem nízkou a vysokou míru rizika vzniku iCMP. Jen pacienti nemající žádný RF jsou tímto schématem hodnoceni jako nízce rizikoví, ve středním riziku jsou pacienti s hypertenzí nebo diabetem, ve vysokém riziku ženy nad 75 let, muži nad 75 let zároveň trpící hypertenzí, dále pacienti s anamnézou TIA/ CMP bez ohledu na věk.
Další skórovací systém, ACCP ‑ 6 (Sixth consensus of American College of Chest Physicians) [5], zahrnoval RF jako věk nad 75 let, hypertenzi, zhoršenou funkci levé komory/ srdeční selhání, diabetes mellitus, koronární aterosklerózu. Nepřítomnost žádného RF představuje jen nízké riziko vzniku iCMP u pacientů s AF, přítomnost jednoho RF znamená pro pacienta středně vysoké riziko a přítomnost dvou RF nebo předchozí CMP/ TIA značí vysoké riziko vzniku CMP/ TIA. Dle novějšího ACCP ‑ 8 jsou v nízkém riziku pacienti bez RF, ve středním riziku pacienti starší 75 let, s hypertenzí, s mírně/ těžce sníženou ejekční frakcí LK, event. se srdečním selháním nebo diabetem. Pacienti s předchozí CMP, TIA, embolizmem nebo pacienti se dvěma a více RF mají již riziko vysoké.
Posouzením prediktivní hodnoty systémů AFI a SPAF a jejich kombinací se systémem ACCP ‑ 6 vznikl bodový skórovací systém s akronymem CHADS2 [6]. Přítomnost RF jako srdeční selhání (congestive heart failure), hypertenze (hypertension), věk nad 75 let (age), diabetes mellitus (diabetes mellitus), hodnotíme jedním bodem za každý přítomný faktor, ale dvěma body za předchozí CMP/ TIA (stroke). Dle výsledného součtu bodů jsou pacienti rozřazeni dle výše uvedeného rizika. Nula bodů značí pro pacienta nízké riziko vzniku tromboembolizmu, 1 – 2 body riziko střední, 3 a více bodů pak vysoké riziko.
Nevýhodou výše uvedených systémů je zohlednění různého cut off pro věk jako RF, podle kterého jsou různě staří pacienti indikováni k antikoagulaci, a také fakt, že tyto skórovací systémy byly založeny na RF stanovených ve studiových kohortách, tedy v předem definované populaci. Rietbrock et al proto otestovali přesnost stanovení prognózy CMP/ TIA pomocí systému CHADS2 na populaci pacientů v klinické vyhledávací databázi praktických lékařů v Anglii (General practice research database) zahrnující více než 51 800 pacientů [7]. Investigátoři testovali nejen rizikové faktory sledované schématem CHADS2, ale také významnost dalších RF jako ženské pohlaví, BMI index, anamnéza kouření či ischemické choroby srdeční. Rozšířili kategorii věku a přehodnotili významnost stávajících RF. Tyto změny značně vylepšily prediktivní hodnotu předchozího CHADS2 systému. Maximální bodová hodnota tohoto revidovaného CHADS2 systému dosahovala 14 bodů, a většina pacientů se tak díky detailnějšímu hodnocení přesunula do vyšší rizikové skupiny. Tím se rozšířila populace pacientů indikovaných k antikoagulaci. Skóre spočítáme ze součtu bodové hodnoty přiřazené věku (40 – 64 let 1 bod, 65 – 69 let 2 body, 70 – 74 let 3 body, 75 – 79 let 4 body, 80 – 84 let 5 bodů, 85 – 115 let 6 bodů), ženskému pohlaví (1 bod), diabetes mellitus (1 bod), anamnéze CMP/ TIA (6 bodů). Pacienti dosahující celkového revidovaného CHADS2 skóre 0 jsou v nízkém riziku, pacienti se skóre 1 – 5 bodů ve středním a pacienti se skóre více než 5 bodů jsou vysoce rizikoví. Prediktivní hodnota tohoto systému je 0,72.
Wang et al vytvořili Framinghamský matematický skórovací model odhadující pětileté riziko vzniku CMP na podkladě 10letého sledování pacientů Framinghamské kohorty s nově vzniklou nerevmatickou AF [8]. Ve výsledku zavzali 868 pacientů, z nichž 705 nebylo primárně léčeno warfarinem. Do multivariantního modelu zahrnuli proměnné jako je věk, pohlaví, systolický krevní tlak, diabetes mellitus a předchozí TIA/ CMP. Dle dosaženého součtu bodů od 0 do 31 měli pacienti nízké (0 – 7), střední (8 – 15) a vysoké (16 – 31) pětileté riziko vzniku CMP/ TIA. Přidáním dalších proměnných, jako jsou užívání antihypertenzní medikace, předchozí IM nebo městnavé srdeční selhání, současné kouření, EKG známky hypertrofie levé komory a srdeční šelest 3/ 6 (mimo šelestu u mitrální stenózy, který byl vylučovacím kritériem), vznikl model odhadující pětileté riziko vzniku CMP nebo smrti. V současnosti se sporným bodem jeví proměnná přítomnost srdečního šelestu vzhledem k rutinně užívané echokardiografii, která ale nebyla dostupná v době vzniku Framinghamské kohorty.
Dalším užívaným skórovacím systémem odhadujícím roční riziko vzniku CMP/ TIA je britský model Birmingham/ National Institut of Health and Clinical Excellence Birmingham (NICE) [9]. Vychází z výsledků studie SPAF III s kohortou 990 pacientů léčených apirinem/ nízkými dávkami warfarinu s dosažením hodnoty INR 1,2 – 1,5. Ženské pohlaví, věk nad 75 let, systolický krevní tlak nad 160 mm Hg, hypertenze, diabetes mellitus a předchozí CMP/ TIA byly identifikovány jako nezávislé RF vzniku CMP/ TIA u pacientů s AF, dále se jako nezávislý RF spjatý s vyšším rizikem ischemických a vaskulárních příhod ukázala i přítomnost von Willebrandtova faktoru. Dle tohoto skóre mají pacienti mladší 65 let, bez významných RF nízké riziko vzniku CMP/ TI. Pacienti starší 65 let bez dalších RF nebo mladší 75 let s anamnézou diabetu, hypertenze, cévního onemocnění, středně vysoké riziko. Vysoce rizikoví jsou pacienti s anamnézou předešlé CMP/ TIA, tromboembolizmu, dále pacienti starší 75 let zároveň trpící diabetem, hypertenzí nebo cévním onemocněním, srdečním selháním nebo abnormální funkcí levé srdeční komory.
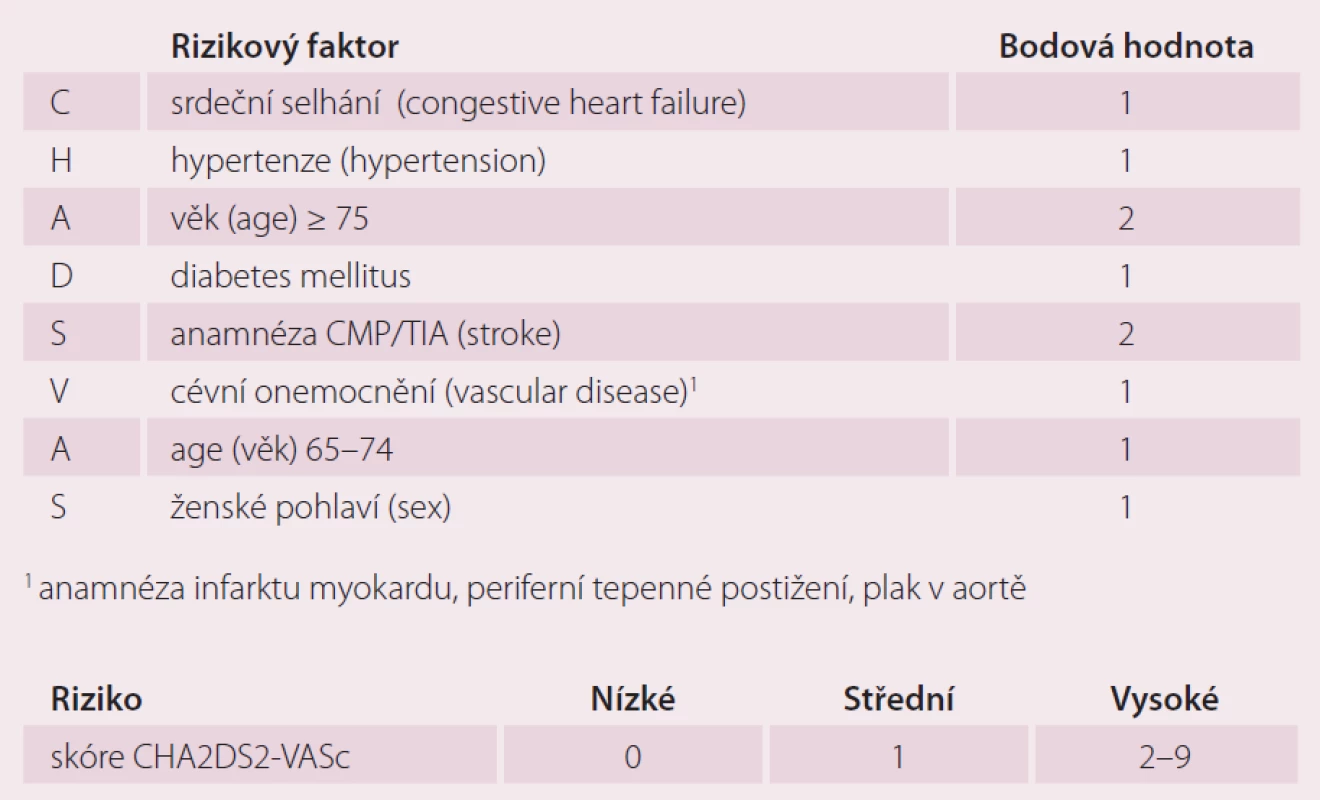
Dalším vývojem revidovaného systému CHADS2 a jeho kombinací se systémem Birmingham/ NICE vzniklo skórovací schéma CHA2DS2 – VASc (tab. 1) [10]. Vychází z výsledků multicentrické studie Euro Heart Survey zahrnující 1 084 pacientů z 35 zemí s diagnózou AF, kteří neužívali antikoagulancia. End pointem byla tromboembolická příhoda nebo CMP. Výsledky ukazují, že s narůstajícím CHA2DS2 - VASc skóre narůstá i počet trombembolických příhod u pacientů s AF neužívajících antikoagulaci. Hlavní rizikové faktory jsou věk nad 75 let a anamnéza předešlé CMP/ TIA/ trombembolizmu, hodnocené dvěma body. Vedlejší RF jsou srdeční selhání, hypertenze, diabetes mellitus, věk 65 – 74 let, ženské pohlaví a periferní cévní onemocnění zahrnující předešlý IM, periferní onemocnění tepen, aortický plát (vascular complications). Tyto RF jsou pak hodnoceny jedním bodem. Bodový součet kategorizuje pacienta jako nízce rizikového (pro skóre 0 bodů), středně rizikového (pro skóre 1 bod) a vysoce rizikového (2 body a více). Žádná TE příhoda nebyla zaznamenána u skupiny nerizikových pacientů se skóre 0, v míře 0,6 % se TE příhody vyskytovaly u středně rizikových pacientů a v míře 3 % u vysoce rizikových pacientů se skóre 2 a více. Prediktivní hodnota tohoto systému je přesnější než u předešlých skórovacích schémat.
Stratifikace krvácivých příhod
Prevence cévní mozkové příhody závisí na použití antitrombotik. Warfarin snižuje riziko CMP o 60 %, kyselina acetylsalicylová přibližně o 20 %, nicméně léčba těmito medikamenty s sebou nese riziko závažného krvácení (GIT, inktrakraniální krvácení a další). I nová antikoagulancia (dabigatran, rivaroxaban, apixaban) nejsou úplně bez rizika těchto významných nežádoucích účinků, i když výsledky recentních studií naznačují nižší míru výskytu závažného krvácení. Prevence CMP či jiného tromboembolizmu proto musí zahrnovat proces vyhodnocení jak rizika vzniku těchto komplikací, tak rizika možného život ohrožujícího krvácení při antitrombotické profylaxi. Proto byla vyvinuta pomocná schémata k vyhodnocení rizika krvácení u antikoagulovaných pacientů, ne všechny jsou však určeny jen pro fibrilaci síní.
Beyth et al na základě výsledků retrospektivní sedmileté follow-up studie u 566 pacientů propuštěných z hospitalizace na dlouhodobé terapii warfarinem pro AF, CMP a další formy tromboembolizmu určili relativní riziko závažného krvácení. Rizikové faktory zahrnují věk nad 65 let, anamézu GIT krvácení, předchozí CMP a další komorborbidity jako čerstvý IM, hodnota hematokritu pod 30 %, hodnota kreatininu nad 1,5 mg/ dl, diabetes mellitus. Každý RF je hodnocen jedním bodem. Pacienti se skóre OBRI (Outpatient Bleeding Risk Index) 0 mají nízké riziko vzniku závažného krvácení, pacienti se skóre 1 – 2 jsou ve středním riziku a pacienti se skóre 3 – 4 ve vysokém riziku [11]. Míra krvácení u pacientů s nízkým rizikem dosahovala 5 % u antikoagulační terapie v délce tří měsíců, event. 12 % v terapii trvající 12 měsíců. Míra rizika u pacientů vysoce rizikových dosahovala 23 % po třech měsících a 48 % po 12 měsícíchantikoagulace.
Kuijer et al odvodili z analýzy 15 studií RF krvácení u pacientů užívajících antikoagulaci [12]. Tyto jsou věk nad 60 let, ženské pohlaví, přítomná malignita, plocha tělesného povrchu víc než 2 m2, užívání dlouho působícího kumarinu. Pro zjednodušenou formu vynechal poslední dva jmenované RF. Na základě součtu odds ratio těchto RF byli pacienti stratifikováni jako nerizikoví, s ORBI skóre 0 bodů, středně rizikoví se skóre 0 – 3 a vysoce rizikoví se zjednodušeným skóre více než 3 body. U nízce rizikové skupiny pacientů se nevyskytla žádná krvácivá příhoda, zatímco míra výskytu krvácivých příhod u vysoce rizikových pacientů dosahovala 26 %, z toho u 13 % to bylo závažné krvácení.
Další bodový skórovací systém odhadující jednoroční riziko krvácivých příhod u antikoagulovaných pacientů je HEMORR2HAGES [13]. Tento akronym zahrnuje RF (hepatic/ renal dissease), abúzus alkoholu (ethanol abuse), přítomné malignity (malignancy), věk (older age than 75), předešlé krvácivé příhody (rebleeding risk), nízký počet nebo dysfunkce trombocytů (reduced trombocytes count or function – zahrnuje užívání aspirinu, jakoukoli trombocytopenii, krevní dyskrasii), nekontrolovanou hypertenzi, anémii (hemoglobin pod 130 g/ l u mužů, pod 120 g/ l u žen), genetické faktory (např. polymorfizmus CYP2C9), zvýšené riziko pádů (excesive fall risk) u pacientů trpících demencí, parkinsonizmem, psychiatrickým onemocněním. Všechny tyto faktory jsou hodnoceny jedním bodem kromě faktoru anamnézy krvácivé příhody hodnoceným dvěma body. Pacienti dosahující maximálně 1 bod jsou v nízkém riziku, pacienti dosahující 2 – 3 body v riziku středním a pacienti se skóre vyšším než 3 body ve vysokém riziku vzniku krvácení. Míra výskytu krvácivých příhod u nízce rizikových pacientů dosahovala 1,9 – 2,5 %, u pacientů ve středním riziku 5,3 – 8,4 %, u pacientů ve vysokém riziku 10,4 % a více. Toto skórovací schéma bylo testováno u pacientů zařazených do National Registry of Atrial Fibrillation, na kterém byl testován systém CHA2DS odhadující míru jednoročního rizika vniku CMP/ TIA. Je ale potřeba zdůraznit, že nebyla zkoumána závažnost krvácení a zařazeni byli pacienti s jakoukoli formou aktivního krvácení. Zařazením polymorfizmu CYP2C9 mezi RF zároveň toto schéma odhaluje rychlé/ pomalé metabolizátory warfarinu.
Skórovací systém navrhnutý Shiremanem et al [14] byl vyvinut na základě RF identifikovaných multivariantní analýzou hodnotící v retrospektivní studii robustní (23 000) kohortu pacientů s AF. Celkově jsou zařazeny rizikové faktory násobené odds ratio přítomného faktoru, tedy věk nad 70 let × 0,49, ženské pohlaví × 0,32, anamnéza krvácení × 0,58, recentní krvácení × 0,62, diabetes mellitus × 0,27, abúzus alkoholu/ drog × 0,71, užívání protideštičkové terapie × 0,32, anémie × 0,86. Dle dosáhnutého bodového součtu jsou pacienti klasifikováni jako nízce rizikoví se skóre menším než 1,07, středně rizikoví při skóre 1,07 – 2,19, u skóre nad 2,19 byli pacienti ve vysokém riziku. Míra krvácivých příhod byla 0,9 % v nízce rizikové skupině, 2,0 % ve středně rizikové skupině a u pacientů vysoce rizikových 5,4 %.
RIETE schéma hodnotí tříměsíční riziko vzniku závažného krvácení u pacientů antikoagulovaných pro venózní tromboembolizmus [15]. Bylo stanoveno hodnocením robustní korohty registru RIETE zahrnující 19 274 konsekutivních pacientů s VTE. Multivariantní analýzou byly jako rizikové stanoveny faktory: významné krvácení, které se objevilo 15 dnů před trombotickou příhodou – hodnocené 2 body, anémie, hodnota kreatininu nad 1,2 mg/ dl po 1,5 bodu, přítomnost malignity, klinická plicní embolie, věk nad 75 let – hodnocené 1 bodem. Skóre 0 bodů značí nízké riziko, 1 – 4 body středně vysoké riziko, skóre nad 4 body vysoké riziko výskytu závažného krvácení. Míra výskytu závažného krvácení byla 0,3 % u skupiny nízce rizikových pacientů, 2,6 % u středně rizikových a 7,3 % u vysoce rizikových pacientů, nicméně použití RIETE schématu u pacientů s AF je zatím sporné vzhledem k tomu, že zatím u těchto pacientů testováno nebylo.
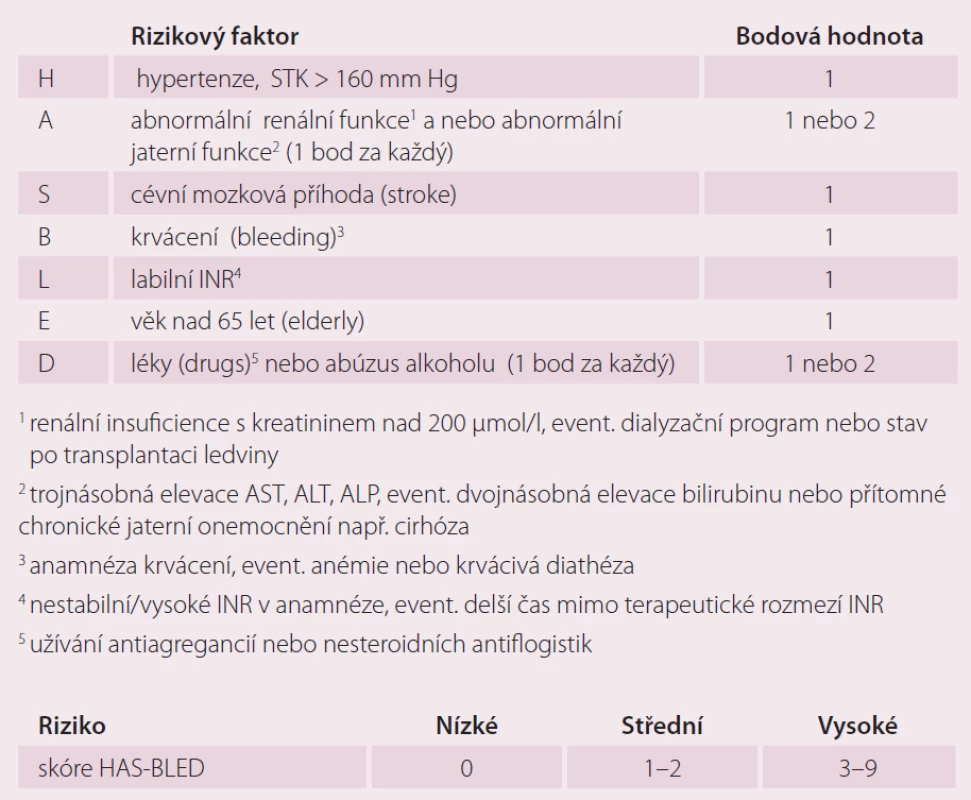
Pisters et al [16] prospektivně hodnotili riziko závažného krvácení (intrakraniální krvácení, pokles hemoglobinu o více než 2 g/ l) anebo nutnost transfuze u 3 978 pacientů z Euro Heart Survey s AF užívajících orální antikoagulancia, antiagregancia a kombinovanou terapii OAK a protidestičkovou léčbu. Analýzou byly určeny rizikové faktory jako TK nad 160 mm Hg, renální insuficience s hodnotou kreatininu nad 200 µmol/ l, event. nutností dialýzy nebo stav po transplantaci ledviny, abnormální jaterní fuknce zahrnující více než trojnásobně zvýšenou hodnotu AST, ALT, ALP, event. násobně zvýšenou hodnotu bilirubinu, nebo přítomné chronické jaterní onemocnění např. cirhózu (abnormal liver or renal tests). Další faktory jsou anamnéza CMP (stroke), předešlého masivního krvácení, event. anémie nebo diatézy (bleeding), labilní INR (labile INR), současné užívání antiagregancií/ NSAID, abúzus alkoholu a věk nad 65 let (elderly). Tento skórovací systém byl nazván HAS ‑ BLED (tab. 2). Každý přítomný rizikový faktor je hodnocen jedním bodem. Nízce rizikoví jsou pacienti se skóre 0 bodů, s 1 – 2 body jsou ve středně vysokém riziku a skóre nad 3 body pro ně značí vysoké riziko jednoroční míry vzniku závažného krvácení.
Fang et al vytvořili skórovací schéma ATRIA [17] odhadující riziko závažného krvácení u kohorty 13 559 pacientů s nevalvulární AF užívajících warfarin, zařazených do studie ATRIA. Multivariantní analýzou bylo určeno pět rizikových faktorů: anémie, závažné renální onemocnění s glomerulární filtrací pod 30 ml/ min nebo dialyzační program, hodnoceno 3 body, věk nad 75 let hodnocen 2 body, anamnéza předešlého krvácení a hypertenze hodnocené 1 bodem. Skóre do 3 bodů označuje nízké riziko, skóre 3 – 4 body středně vysoké a skóre 5 – 10 bodů vysoké riziko vzniku závažného krvácení.
Když se u pacienta s AF rozhodneme v prevenci TE/ CMP užít antikoagulaci antagonisty vitaminu K (VKA), je určujícím faktorem právě kvalita této antikoagulace vyjádřená časem stráveným v terapeutickém rozmezí (TTR ‑ time in therapeutic range) INR.
Apostolakis et al proto u kohorty 1 756 pacientů zařazených do studie AFFIRM pomocí lineární regresní analýzy určili faktory související s TTR: ženské pohlaví (sex), věk do 60 let (age), anamnéza dvou z následujících komorbidit (hypertenze, diabetes mellitus, IM, srdeční selhání, CMP, plicní, jaterní nebo renální onemocnění) (medical histrory), užívání amiodaronu (treatment). Každý z těchto rizikových faktorů se do skóre započítá jedním bodem, kouření v posledních dvou letech (tabacco use) a nekavkazská rasa dvěma body (race). Pacienti dosahující SAMe ‑ TT2R2 [18] skóre 0 – 2 body mají vyšší tendenci dosáhnout dostatečného času (víc než 65 %) stráveného v terapeutickém rozmezí INR, jsou tedy vhodnými kandidáty v užívání warfarinu. Pacienti dosahující skóre více než dva body tyto hodnoty TTR nedosahují, je proto vhodnější začít u nich antikoagulaci novými antikoagulancii (dabigatran, rivaroxaban, apixaban), event. zvolit strukturovanější kontrolu INR.
Závěr
V současné době je v klinické praxi nejužívanější skórovací systém CHA2DS2 - VASc odhadující u pacientů s AF jednoroční riziko CMP a tromboembolických příhod a systém HAS ‑ BLED odhadující jednoroční riziko vzniku krvácivých komplikací u antikoagulovaných pacientů s AF.
Podpořeno Evropským regionálním fondem pro obnovu a rozvoj – Projekt FNUSA ‑ ICRC (No. CZ.1.05/ 1.1.00/ 02.0123) a projektem MZ ČR – RVO (FNBr, 65269705).
Doručeno do redakce: 27. 4. 2015
Přijato po recenzi: 11. 5. 2015
doc. MUDr. Ondřej Ludka, Ph.D.
www.fnbrno.cz
oludka@fnbrno.cz
Sources
1. De Vos CB, Pisters R, Nieuwlaat R et al. Progression from paroxysmal to persistent atrial fibrillation clinical correlates and prognosis. J Am Coll Cardiol 2010; 55 : 725 – 731. doi: 10.1016/ j.jacc.2009.11.040.
2. Barrett TW, Self WH, Wasserman BS et al. Evaluating the HATCH score for predicting progression to sustained atrial fibrillation in ED patients with new atrial fibrillation. Am J Emerg Med 2013; 31 : 792 – 797. doi: 10.1016/ j.ajem.2013.01.020.
3. Atrial Fibrillation Investigators. Risk factors for stroke and efficacy of antithrombotic therapy in atrial fibrillation. Analysis of pooled data from five randomized controlled trials. Arch Intern Med 1994; 154 : 1449 – 1457.
4. Hart RG, Pearce LA, McBride R et al. Factors associated with ischemic stroke during aspirin therapy in atrial fibrillation: analysis of 2012 participants in the SPAF I – III clinical trials. The Stroke Prevention in Atrial Fibrillation (SPAF) Investigators. Stroke 1999; 30 : 1223 – 1229.
5. Sixth ACCP Consensus Conference on Antithrombotic Therapy. Quick Reference Guide. Chest 2001; 119 (Suppl 1): 1S – 2S.
6. Gage BF, Waterman AD, Shannon W et al. Validation of clinical classification schemes for predicting stroke: results from the National Registry of Atrial Fibrillation. JAMA 2001; 285 : 2864 – 2870.
7. Rietbrock S, Heeley E, Plumb J et al. Chronic atrial fibrillation: incidence, prevalence, and prediction of stroke using the congestive heart failure, hypertension, age greater than 75, diabetes mellitus, and prior stroke or transient ischemic attack (chads2) risk stratification scheme. Am Heart J 2008; 156 : 57 – 64. doi: 10.1016/ j.ahj.2008.03.010.
8. Wang TJ, Massaro JM, Levy D et al. A risk score for predicting stroke or death in individuals with new‑onset atrial fibrillation in the communitythe Framingham heart study FREE. JAMA 2003; 290 : 1049 – 1056.
9. Lip GY, Lane D, Van Walraven C et al. Additive role of plasma von Willebrand factor levels to clinical factors for risk stratification of patients with atrial fibrillation. Stroke 2006; 37 : 2294 – 2300.
10. Lip GY, Nieuwlaat R, Pisters R et al. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor‑based approach: the euro heart survey on atrial fibrillation. Chest 2010; 137 : 263 – 272. doi: 10.1378/ chest.09 ‑ 1584.
11. Beyth RJ, Quinn LM, Landefeld CS. Prospective evaluation of an index for predicting the risk of major bleeding in outpatients treated with warfarin. Am J Med 1998;105 : 91 – 99.
12. Kuijer P, Hutten B, Prins MH et al. Prediction of the risk of bleeding during anticoagulant treatment for venous thromboembolism. Arch Intern Med 1999; 159 : 457 – 460.
13. Gage BF, Yan Y, Milligan PE et al. Clinical classification schemes for predicting hemorrhage: results from the National Registry of Atrial Fibrillation (NRAF). Am Heart J 2006; 151 : 713 – 719.
14. Shireman TI, Mahnken JD, Howard PA et al. Development of a contemporary bleeding risk model for elderly warfarin recipients. Chest 2006; 130 : 1390 – 1396.
15. Ruíz ‑ Giménez N, Suárez C, González R et al. RIETE Investigators. Predictive variables for major bleeding events in patients presenting with documented acute venous thromboembolism. Findings from the RIETE Registry. Thromb Haemost 2008; 100 : 26 – 31. doi: 10.1160/ TH08 ‑ 03 ‑ 0193.
16. Pisters R, Lane DA, Nieuwlaat R et al. A novel user ‑ friendly score (HAS ‑ BLED) to assess 1‑year risk of major bleeding in patients with atrial fibrillation: the Euro Heart Survey. Chest 2010; 138 : 1093 – 1100. doi: 10.1378/ chest.10 ‑ 0134.
17. Fang MC, Go AS, Chang Y et al. A new risk scheme to predict warfarin‑associated hemorrhage: The ATRIA (Anticoagulation and Risk Factors in Atrial Fibrillation) Study. J Am Coll Cardiol 2011; 58 : 395 – 401. doi: 10.1016/ j.jacc.2011.03.031.
18. Apostolakis S, Sullivan RM, Olshansky B et al. Factors affecting quality of anticoagulation control among patients with atrial fibrillation on warfarin: the SAMe ‑ TT₂R₂ score. Chest 2013; 144 : 1555 – 1563. doi: 10.1378/ chest.13 ‑ 0054.
Labels
Paediatric cardiology Internal medicine Cardiac surgery CardiologyArticle was published in
Cardiology Review

2015 Issue 2
-
All articles in this issue
- Náhlá srdeční smrt
- Skórovací systémy preventivní kardiologie
- Skórovací systémy u pacientů s akutním koronárním syndromem
- Skórovací systémy u fibrilace síní
- Skórovací systémy u tromboembolické nemoci
- Klinické klasifikace a skórovací systémy u srdečního selhání
- Role echokardiografie v hodnocení aortální stenózy a mitrální regurgitace
- Přímé versus nepřímé metody stanovení intenzity zatížení v kardiovaskulární rehabilitaci
- Skórovací systémy před kardiochirurgickou operací
- Primární hyperaldosteronizmus – nejčastější forma sekundární hypertenze
- Cushingův syndrom a kardiovaskulární riziko
- Saturace jodem v České republice a ve světě – nedostatky a perspektivy
- Akutní stavy v tyreologii
- Diferenciální diagnostika hyponatremie
- Endokrinologie stárnutí – krátký přehled
- Cardiology Review
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Klinické klasifikace a skórovací systémy u srdečního selhání
- Skórovací systémy u tromboembolické nemoci
- Diferenciální diagnostika hyponatremie
- Akutní stavy v tyreologii