Hyperurikémia, kardiovaskulárne choroby a srdcové zlyhávanie
Hyperuricaemia, cardiovascular diseases and heart failure
Hyperuricaemia is a common abnormal finding in patients with cardiovascular diseases and heart failure. The most common cause of hyperuricaemia is an increased activity of xanthine oxidase, the enzyme which degrades xanthine to hypoxanthine and uric acid, giving rise to the formation of a significant amount of free oxygen radicals. Associations of hyperuricaemia with systemic inflammation, decreased vasodilatory response of the vessels, pro-aggregation, endothelial dysfunction, hypertension and obesity have been demonstrated. In patients with heart failure, hyperuricaemia, particularly in concentrations exceeding 600 µmol/ l, is considered a signal of poor prognosis. Clinical studies have shown that uricostatics may be relevant for the prevention and control of hypertension in adolescents. In patients with heart failure, treatment of hyperuricaemia with allopurinol leads to decreased levels of uric acid and to the improvement of some parameters of endothelial or myocardial function. However, the effect of xanthine oxidase inhibition on mortality has not yet been demonstrated.
Keywords:
hyperuricaemia – hypertension – heart failure – allopurinol
Authors:
A. Dukát 1; E. Goncalvesová 2
Authors‘ workplace:
II. Interná klinika LF UK a UN Bratislava, Slovensko
1; Oddelenie zlyhávania a transplantácie srdca, Národný ústav srdcových a cievnych chorôb a. s., Bratislava, Slovensko
2
Published in:
Kardiol Rev Int Med 2016, 18(1): 43-46
Category:
Cardiology Review
Overview
Hyperurikémia je častým abnormálnym nálezom u pacientov s kardiovaskulárnymi ochoreniami a srdcovým zlyhávaním. Je väčšinou odrazom zvýšenej aktivity xantín oxidázy, enzýmu, ktorý degraduje xantín na hypoxantín a kyselinu močovú za vzniku signifikantného množstva voľných kyslíkových radikálov. Boli dokázané asociácie hyperurikémie so systémovým zápalom, zníženou vazodilatačnou odpoveďou ciev, proagregačným stavom, endotelovou dysfunkciou, hypertenziou a obezitou. U chorých so srdcovým zlyhávaním je nález hyperurikémie, predovšetkým v hodnotách viac ako 600 μmol/ l, signálom zlej prognózy. Klinické štúdie ukazujú, že urikostatiká môžu mať význam pri prevencii, vzniku a kontrole hypertenzie u adolescentov. U chorých so srdcovým zlyhávaním liečba hyperurikémie allopurinolom viedla k zníženiu hladiny kyseliny močovej, zlepšeniu niekorých parametrov endotelovej či myokardiálnej funkcie, efekt na mortalitu však zatiaľ nebol preukázaný.
Kľúčové slová:
hyperurikémia – hypertenzia – srdcové zlyhávanie – allopurinol
Hyperurikémia (HU), teda zvýšenie hladiny kyseliny močovej (KM) v krvi, sa vyskytuje približne u 6 % päťdesiatročných mužov [1,2]. Na základe údajov z Framinghamskej štúdie sa zistilo, že HU je spojená so 25% zvýšením relatívneho rizika vzniku kardiovaskulárnych (KV) ochorení, predovšetkým u žien [3]. Za dvadsaťročie 1970 – 1990 ročná incidencia v USA stúpla z 20,2/ 100 000 na 45,9/ 100 000 ľudí [4]. Výskyt HU v rôznych populáciách významne kolíše od 4 % až do 40 % v závislosti od rasových a geografických vplyvov. V populácii hospitalizovaných je okolo 7 % [5].
Už Hippocrates (460 – 370 pr. n. l.) poznal a opísal, že pacienti neschopní chôdze pre artritídu zomierajú častejšie na srdce. Trvalo celé dlhé storočia, až kým sa na začiatku tohto storočia naozaj vedecky potvrdilo, že okrem artritídy majú pacienti s dnou zvýšené KV riziko [1]. Hyperurikémiu je potrebné odlišovať od dny (arthritis urica). Len malá časť pacientov s HU dostane dnu, avšak všetci pacienti s dnou majú v niektorom štádiu svojho ochorenia HU. Patofyziológia HU je komplexná a individuálna, pričom sú dokázané asociácie HU so systémovým zápalom, zníženou vazodilatačnou odpoveďou ciev, proagregačným stavom, endotelovou dysfunkciiou a oxidačným stresom, hypertenziou, obezitou a srdcovým zlyhávaním [2,6].
Patofyziologické vzťahy
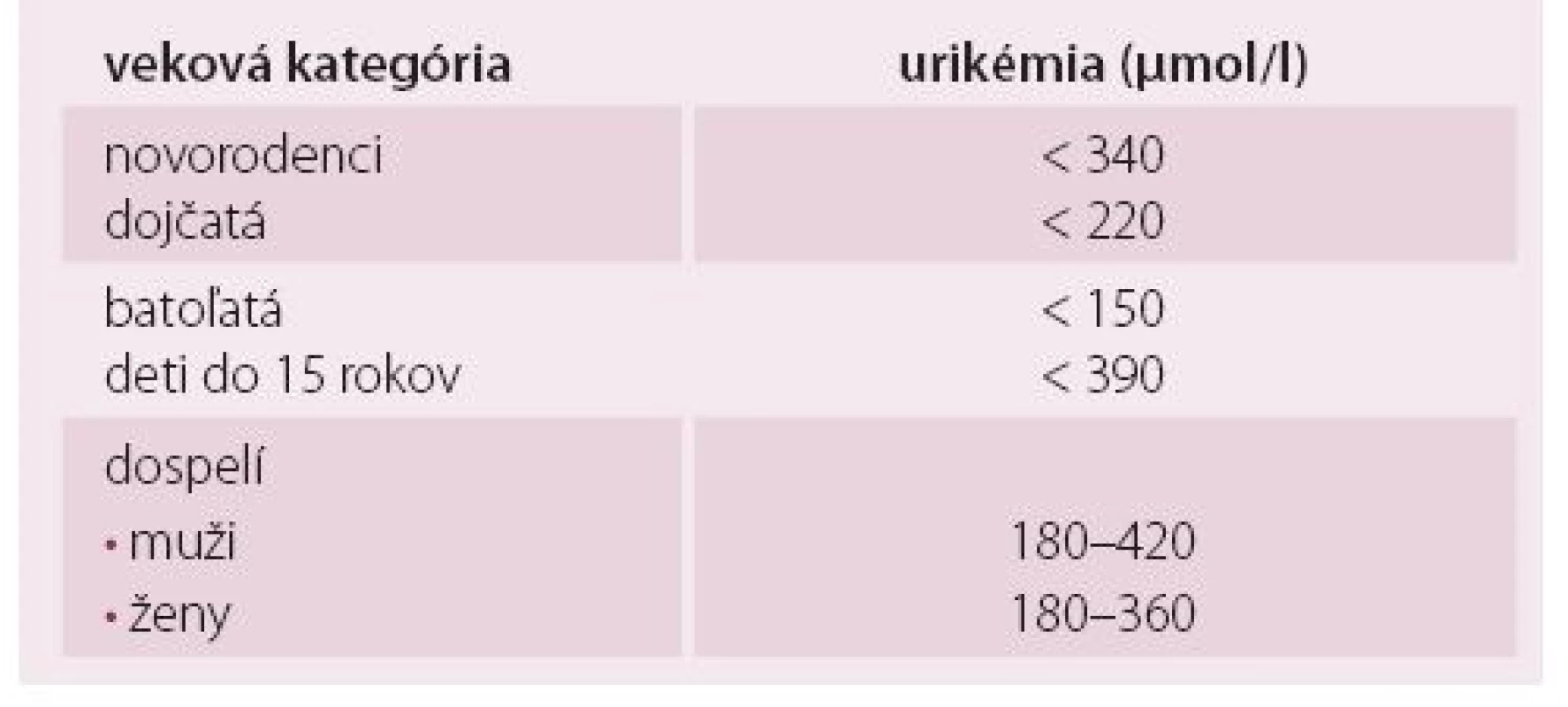
Kyselina močová je chemicky 2,6,8-trihydroxypurín. U človeka je KM konečným produktom metabolizmu purínových látok, okrem toho sa syntetizuje energeticky náročným spôsobom v pečeni. V krvi cirkuluje ako rozpustený urát bez väzby na bielkoviny vo voľnej forme. Vo všetkých extracelulárnych tekutinách, kde je hlavným katiónom sodík a je pH okolo 7,4, sa až 98 % KM vyskytuje vo forme monosódnej soli (monosodiumurát). Pri prekročení indexu rozpustnosti vznikajú u chorých s dnou kryštály v synoviálnej tekutine, alebo tofy zložené z monohydrátu monosodiumurátu. Uráty majú vysokú antioxidačnú kapacitu. In vitro pozorovania ukázali, že urát je účinný odpratávač (scavenger) reaktívnych kyslíkových radikálov. U zdravých osôb predstavujú uráty až 60 % celkovej antioxidačnej kapacity [5]. Referenčné populačné hodnoty KM v sére v priebehu života sú uvedené v tab. 1. V období pred pubertou je hladina KM nízka u oboch pohlaví. V puberte sa hladina urikémie zvyšuje. U dievčat sa zvyšuje iba mierne a to až do menopauzy. U chlapcov sa v puberte zvyšuje veľmi prudko a zostáva potom v priebehu života na individuálne rovnakej úrovni. Hladina urikémie má teda pomerne široký populačný referenčný interval, ktorý sa za bežných okolností udržiava až do staroby [7]. Najčastejšie príčiny HU sú uvedené v tab. 2. Hyperurikémia je výsledkom zvýšenej tvorby a zníženého vylučovania KM, alebo kombinácie oboch týchto príčin. Až 70 % urátu sa vylučuje obličkami. Zvyšok sa potom vylučuje gastrointestinálnym traktom, kde KM degradujú črevné baktérie na amoniak a oxid uhličitý.

KM je finálnym produktom degradácie purínov. Xantínoxidáza katalyzuje premenu hypoxantínu na xantín a xantínu na KM. Obidva tieto metabolické procesy sú spojené s tvorbou voľných kyslíkových radikálov a táto reakcia je jedným z najintenzívnejších zdrojov reaktívnych foriem kyslíka v ľudskej fyziológii. Tvorba voľných kyslíkových radikálov môže byť do určitej miery obranným mechanizmom proti invázii infekčných patogénov. Ak je však ich produkcia dlhodobo zvýšená, vyústi do celého spektra škodlivých účinkov. Kľúčovú úlohu zohráva zvýšená aktivita xantínoxidázy. V ischemickom a zápalovom tkanive ako aj pri hypoxii, katabolizme, inzulínovej rezistencii či smrti buniek sa zistila významná upregulácia tvorby endotelovej xantínoxidázy [8]. Xantínoxidáza sa viaže na luminálny povrch endotelových buniek a významne sa podieľa na zhoršení endotelovej funkcie. Výsledkom je účinok prozápalový, proagregačný, prooxidačný a proliferačný. Všetky tieto „vaskulotoxické“ vplyvy sa spolupodieľajú na endotelovej dysfunkcii [7]. Zvýšená hladina KM je asociovaná so zvýšením pomeru triglyceridov a HDL cholesterolu, s prítomnosťou steatózy pečene (nezávisle na prítomnosti metabolického syndrómu či obezite) a so zvýšením hsCRP (nezávisle na prítomnosti metabolického syndrómu) [9].
Hyperurikémia má negatívny vplyv na renálne fukcie. Pozorovaný bol vaskulárny zápal s následnou preglomerulárnou arteriolopatiou. Reakciou na HU v obličkách je aj tubulointersticiálny zápal a fibróza. Svoju úlohu zohráva aj aktivácia systému renín-angiotenzín-aldosterón, ktorá sa spolupodieľa na poklese glomerulovej filtrácie a znížení frakčnej exkrécie sodíka. Celý proces je sprevádzaný zvýšenou tvorbou renínu a poklesom NO-syntázy [7,10]. Renálne dopady HU sú s najväčšou pravdepodobnosťou v pozadí artériovej hypertenzie asociovanej s HU [2]. Problémom v štúdiu vzťahov medzi HU a renálnou dysfunkciou je však skutočnosť, že všetky formy renálnej insuficiencie sú asociované so zvýšením KM, a je preto skutočne zložité rozlíšiť medzi príčinou a následkom [11].
Hyperurikémia, hypertenzia a ischemická choroba srdca
Vzťah medzi HU a hypertenziou bol dokázaný v experimente v r. 2008. Ukázalo sa, že pri akútnom zvýšení KM v sére dochádza ku okamžitému zvýšeniu hodnôt krvného tlaku (TK) [2]. Chronické zvýšenie vedie ku pretrvávaniu abnormálnych hodnôt TK a vyvoláva aj ireverzibilné cievne zmeny aj zmeny v glomeruloch, ktoré napokon vedú ku fixovaniu hypertenzie citlivej na soľ [1]. Nález HU v mladosti je spoľahlivým prediktorom neskoršieho rozvoja hypertenzie [12]. Farmakologickým ovplyvnením HU a jej dopadom na hypertenziu u adolescentov sa zaoberalo niekoľko štúdií. Feig et al [13]v randomizovanej štúdii podávali 400 mg allopurinolu adolescentom s hypertenziou v prvom štádiu a sérovou koncentráciou KM viac ako 336 mmol/ l. Po štyroch týždňoch liečby došlo k normalizácii TK u dvoch tretín pacientov.
Súčasný stav vedomostí o liečbe HU v spojení s hypertenziou sa opiera o randomizovanú klinickú štúdiu, v ktorej bol sledovaný súbor 11 – 17-ročných detí a adolescentov s neliečenou prehypertenziou, BMI v stupni obezity a urikémiou ≥ 5 mg/ dl [14]. Zaradených bolo 107 (70 %) subjektov a všetci dostali odporúčania o vhodnej diete, znížení príjmu kuchynskej soli a znížení telesnej hmotnosti. Randomizácia prebehla na allopurinol 100 mg 2× denne, probenecid 250 mg 2× denne, alebo na placebo 2× denne po dobu týždňa. Po týždni sa dávky upravili (allopurinol 200 mg 2× denne, probenecid 500 mg 2× denne, alebo placebo 2× denne po dobu 7 týždňov). Kontroly TK boli realizované metódou 24-hodinového monitorovania TK. V obidvoch skupinách s liekmi znižujúcimi urikémiu došlo k významnému poklesu TK aj k poklesu periférnej vaskulárnej rezistencie. Prekvapujúcim nálezom bol výsledok vplyvu liečby na telesnú hmotnosť (pri liečbe allopurinolom alebo probenecidom) nedošlo ku vzostupu telesnej hmotnosti, pričom v skupine, ktorá užívala placebo, bol zaznamenaný nárast telesnej hmotnosti >1 kg za mesiac. Jedným z vysvetlení je vedľajším účinkom liekov v zmysle nausey a nechutenstva, čo však nekorelovalo s hlásením pacientov. Z epidemiologických sledovaní však vieme aj o tom, že zvýšená urikémia predikuje akútny aj chronický vzostup telesnej hmotnosti [15]. Je celkom možné, že okrem samotného vplyvu na hypertenziu HU zasahuje aj do mechanizmov obezity a s ňou spojených komorbidít. Zatiaľ nevieme presne, či zhoršenie hypertenzie je spôsobené samotným poklesom urátov v sére, alebo nezávislým biochemickým vplyvom inhibície xantínoxidázy. Inhibícia xantínoxidázy má však niekoľko dôležitých klinických účinkov. Tieto sú v prehľade uvedené v tab. 3. Štúdia trvala len niekoľko týždňov a nezodpovedanou otázkou zostáva dopad dlhodobej liečby touto skupinou liečiv. Závery rozsiahlej metaanalýzy z roku 2013 [16] venovanej liečbe HU u hypertonikov zatiaľ neodporúčajú tento prístup ako štandardnú doplnkovú liečbu hypertenzie. Aj najnovšie rozsiahle pozorovania však potvrdzujú zistenie, že prítomnosť HU u adolescentov je spoľahlivým prediktorom rozvoja hypertenzie a metabolického syndrómu [17].

Štúdia MRFIT [18] už dávnejšie preukázala, že HU je asociovaná s až 26% zvýšením relatívneho rizika infarktu myokardu. Národný prieskum NHANES v USA ukázal, že HU je nezávislým prediktorom KV mortality osôb nad 45 rokov, bez ohľadu na pohlavie, menopauzálny stav, liečbu diuretikami, prítomnosti KV ochorenia alebo na rasové rozdiely [5].
Vzťah HU a rizika KV príhod je dokumentovaný dostatočne a jednoznačne. Je najsilnejší u žien a ľudí s vysokým KV rizikom. Príčinná súvislosť, ktorá by opodstatnila systematický farmakologický zásah, však nie je jasná a je predmetom ďalších štúdií [2].
Hyperurikémia a srdcové zlyhávanie
Srdcové zlyhávanie (SZ) je systémové ochorenie a jeho vývoj a klinická manifestácia presahuje hemodynamické dopady tohto syndrómu. Neuroendokrinné a metabolické zmeny, ktoré ho sprevádzajú, majú dopad na progresiu dysfunkcie myokardu, symptómy aj prognózu. Hladina KM je u pacientov so SZ často zvýšená a je v zjavnej asociácii so závažnosťou SZ podľa NYHA triedy ako aj úrovňou záťažovej kapacity hodnotenou spiroergometricky. V súlade s týmito nálezmi bola zistená aj súvislosť HU s ukazovateľmi mechanickej a energetickej účinnosti myokardu, ejekčnou frakciou ľavej komory, srdcovým výdajom, hladinami nátriuretických peptidov aj progresiou SZ [8]. Signifikantná HU považovaná za hodnotu ≥ 536 μmol/ l (9,5mg/ dl) bola zistená asi u 25 % pacientov so SZ a redukovanou ejekčnou frakciou ľavej komory [19]. Dobre dokumentovaný je aj vzťah medzi hladinou KM a mortalitou. Pacienti s hladinou KM > 600 μmol/ l majú šesťnásobne a tí s HU > 800 μmol/ l až 18násobne vyššiu mortalitu [8]. Podľa nedávnej metaanalýzy [20] každé zvýšenie hladiny KM o 56 μmol/ l zvyšovalo riziko vzniku SZ o 19 % a u pacientov s už diagnostikovaným SZ riziko celkovej mortality o 4 % a riziko mortality alebo KV príhody o 28 %. Vzťah medzi HU a prognózou pacientov so SZ je natoľko presvedčivý, že hladina KM je súčasťou uznávaných multiparametrických predikčných modelov prežívania pacientov so SZ, ako je Seattle Heart Failure Model či SENIORS. Vzťah medzi HU, arteriálnou tuhosťou, znížením záťažovej kapacity aj zvýšenou mortalitou bol preukázaný aj u pacientov so SZ so zachovanou ejekčnou frakciou ľavej komory [21].
Napriek tomu, že je prognostická hodnota HU pri SZ dobre preskúmaná, stále sa diskutuje o tom, či v procese progresie SZ zohráva zvýšenie KM samostatnú úlohu alebo je iba pasívnym markerom. Zvýšenie hladiny KM pri SZ je predovšetkým odrazom zvýšenej aktivity xantínoxidázy, v dôsledku čoho dochádza k zvýšeniu produkcie voľných kyslíkových radikálov a endotelovej dysfunkcii. V kontexte SZ sa na HU môže podieľať aj porucha renálnych funkcií (kardiorenálny syndróm) či vylučovania KM pri diuretickej liečbe.
Experimentálne štúdie na zvieracích modeloch SZ preukázali, že podávanie inhibítorov xantínoxidázy viedlo k zlepšeniu funkcie ľavej komory, spomaleniu remodelácie, zníženiu afterloadu a zlepšeniu ventrikulo-vaskulárneho spriahnutia (coupling) [22]. Na zníženie hladiny KM u pacientov so SZ sa v experimentoch používali urikostatiká (benzpromazon, probenecid). Sérová hladina KM pri tejto liečbe významne poklesla, avšak nedošlo k žiadnym priaznvm zmenám v parametroch endotelovej dysfunkcie či klinického stavu.
Klinickými dôsledkami inhibície xantínoxidázy u chorých so srdcovým zlyhávaním sa v randomizovanom placebom kontrolovanom dizajne zaoberalo niekoľko štúdií (tab. 4).
![Randomizované placebom kontrolované štúdie použitia inhibítorov xantínoxidázy pri srdcovom zlyhávaní. Upraveno podľa [24].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/dbd70e85e748fd4dc78a59fe70ef6993.jpg)
Dve z nich boli prospektívne randomizované a kontrolované. V prvej z nich [23] realizovanej na 405 pacientoch so SZ v štádiu NYHA III – IV sa podával oxypurinol. Sledovala sa mortalita, morbidita a kvalita života. V celom súbore sa nezistili rozdiely medzi placebom a oxypurinolom, avšak u chorých so sérovou hladinou KM viac ako 532 μmol/ l došlo ku klinickému zlepšeniu, ktoré bolo v priamej korelácii s rozsahom poklesu KM. Výsledky nedávno publikovanej klinickej štúdie (EXACT-HF) [24], do ktorej boli zaraďovaní len pacienti s KM > 532 μmol/ l, však boli sklamaním. Pacientom bol podávaný allopurinol v cieľovej dávke 600 mg alebo placebo. V priebehu sledovania, ktoré trvalo 24 týždňov, došlo k signifikantnému poklesu hladiny KM, avšak v klinických ukazovateľoch (mortalita, hospitalizácie, funkčný stav, kvalita života) sa nezaznamenal rozdiel medzi pacientmi s allopurinolom alebo placebom. Jedným s diskutovaných vysvetlení je možnosť, že účinná inhibícia xantínoxidázy vedie tiež k inhibícii NO syntázy a poklesu NO [22].
Samostatným problémom v kontexte HU môže byť liečba dny a jej akútnej exacerbácie u chorých so SZ. Používa sa niekoľko skupín protizápalových liekov, ako sú nesteroidné antireumatiká (NSAI), kolchicín, lokálne a celkové steroidy a biologická liečba v podobe inhibície účinku interleukínu-1ß. Liekom prvej voľby sú obyčajne NSAI. U pacientov so SZ a retenciou tekutín, cirkulačne nestabilných ako aj tých, ktorí užívajú warfarín sa neodporúčajú NSAI a uprednostňuje sa kolchicín v nízkych dávkach. Má sa začať podávať už pi iniciálnych príznakoch ataku dnavej artritídy. V poslednom období sa na prevenciu dny čoraz častejšie používa nepurínový inhibítor xantínoxidázy febuxostat, ktorý znižuje hladinu KM účinnejšie ako allopurinol [25]. Podľa SPC tohto prípravku sa jeho podávanie u chorých s pokročilým SZ neodporúča a KV bezpečnosť je predmetom prebiehajúcich štúdií [8]. U pacientov so SZ a významnou HU je vhodné voliť KV liečivá s prídavným urikozurickým efektom (losartan). Dôležitou súčasťou liečby je diéta. Puríny sú najviac zastúpené v živočíšnych potravinách, hlavne vo vnútornostiach: pečeň, ľadviny, mozoček. Sú aj v rybích konzervách, strukovinách a niektorých druhoch zeleniny, napr. špenát, karfiol, alebo cvikla. Odporúča sa vyhýbať sa aj údeninám, mäsu a zverine. Nevhodné sú aj koreniace zmesi, sójové omáčky a bujónové kocky. Významne sa má obmedziť víno, pivo, káva a kakao.
Hyperurikémia je u pacientov so SZ častým patologickým nálezom. Prítomnosť HU je prejavom dysfunkcie endotelu, celkovej zápalovej reakcie a je signálom nepriaznivej prognózy. Farmakologická intervencia zameraná na zníženie hladiny KM urikostatikami vedie k poklesu hladiny KM, ale jej dopad na mortalitu a klinické prejavy SZ nie je stále jasný.
doc. MU Dr. Eva Goncalvesová, CSc.
www.nusch.sk
eva.goncalvesova@nusch.sk
Doručeno do redakce: 10. 1. 2016
Přijato po recenzi: 24. 1. 2016
Sources
1. Johnson RJ, Kang DH, Feig D et al. Is there a pathogenetic role for uric acid in hypertension and cardiovascular and renal disease? Hypertension 2003; 41 : 1183 – 1190.
2. Feig DI, Kang DH, Johnson RJ. Uric acid and cardiovascular risk. N Eng J Med 2008; 359 : 1811 – 1821. doi: 10.1056/ NEJMra0800885.
3. Culleton BF, Larson MG, Kannel WB et al. Serum uric acid and risk for cardiovascular disease and death: the Framingham Heart Study. Ann Intern Med 1999; 131 : 7 – 13.
4. Gavorník P, Dukát A, Gašpar L et al. Klinický význam a liečba hyperurikémie. Slov Klin Pr 2007; 1 : 18 – 20.
5. Zhu Y, Pandya BJ, Choi HK. Prevalence of gout and hyperuricemia in the US general population: the National Health and Nutrition Examination Survey 2007 – 2008. Arthritis Rheum 2011; 63 : 3136 – 3141. doi: 10.1002/ art.30520.
6. Tangri N, Weiner DE. Uric acid, CKD, and cardiovascular disease: confounders, culprits, and circles. Am J Kidney Dis 2010; 56 : 247 – 250. doi: 10.1053/ j.ajkd.2010.06.004.
7. Khosla UM, Zharikov S, Finch JL et al. Hyperuricemia induces endothelial dysfunction. Kidney Int 2005; 67 : 1739 – 1742.
8. Doehner W, Jankowska EA, Springer J et al. Uric acid and xanthine oxidase in heart failure - Emerging data and therapeutic implications. Int J Cardiol 2015; pii: S0167-5273(15)30319-3. doi: 10.1016/ j.ijcard.2015.08.089.
9. Keenan T, Blaha MJ, Nasir K et al. Relation of uric acid to serum levels of high-sensitivity C-reactive protein, triglycerides, and high-density lipoprotein cholesterol and to hepatic steatosis. Am J Cardiol 2012; 110 : 1787 – 1792. doi: 10.1016/ j.amjcard.2012.08.012.
10. Kang DH, Nakagawa T, Feng L et al. A role for uric acid in the progression of renal disease. J Am Soc Nephrol 2002; 13 : 2888 – 2897.
11. Odden MC, Amadu AR, Smit E et al. Uric acid levels, kidney function, and cardiovascular mortality in US adults: National Health and Nutrition Examination Survey (NHANES) 1988–1994 and 1999–2002. Am J Kidney Dis 2014; 64 : 550 – 557. doi: 10.1053/ j.ajkd.2014.04.024.
12. Loeffler LF, Navas-Acien A, Brady TM et al. Uric acid level and elevated blood pressure in US adolescents: National Health and Nutrition Examination Survey, 1999-2006. Hypertension 2012; 59 : 811 – 817. doi: 10.1161/ HYPERTENSIONAHA.111.183244.
13. Feig DI, Soletsky B, Johnson RJ. Effect of allopurinol on blood pressure of adolescents with newly diagnosed essential hypertension: a randomized trial. JAMA 2008; 300 : 924 – 932. doi: 10.1001/ jama.300.8.924.
14. Soletsky B, Feig DI. Uric acid reduction rectifies prehypertension in obese adolescents. Hypertension 2012; 60 : 1148 – 1156. doi: 10.1161/ HYPERTENSIONAHA.112.196980.
15. Masuo K, Kawaguchi H, Mikami H et al. Serum uric acid and plasma norepinephrine concentrations predict subsequent weight gain and blood pressure elevation. Hypertension 2003; 42 : 474 – 480.
16. Gois PH, Souza ER. Pharmacotherapy for hyperuricemia in hypertensive patients. Cochrane Database Syst Rev 2013; 1: CD008652. doi: 10.1002/ 14651858.CD008652.pub2.
17. Sun HL, Pei D, Lue KH et al. Uric acid levels can predict metabolic syndrome and hypertension in adolescents: A 10-Year Longitudinal Study. PloS One 2015; 10: e0143786. doi: 10.1371/ journal.pone.0143786.
18. Krishnan E, Baker JF, Furst DE et al. Gout and the risk of acute myocardial infarction. Arthritis Rheum 2006; 54 : 2688 – 2696.
19. Harzand A, Tamariz L, Hare JM. Uric acid, heart failure survival, and the impact of xanthine oxidase inhibition. Congest Heart Fail 2012; 18 : 179 – 182. doi: 10.1111/ j.1751-7133.2011.00262.x.
20. Huang H, Huang B, Li Y et al. Uric acid and risk of heart failure: a systematic review and meta-analysis. Eur J Heart Fail 2014; 16 : 15 – 24. doi: 10.1093/ eurjhf/ hft132.
21. Shimizu T, Yoshihisa A, Kanno Y et al. Relationship of hyperuricemia with mortality in heart failure patients with preserved ejection fraction. Am J Physiol Heart Circ Physiol 2015; 309: H1123 – H1129. doi: 10.1152/ ajpheart.00533.2015.
22. Tamariz L, Hare JM. Xanthine oxidase inhibitors in heart failure: where do we go from here? Circulation 2015; 131 : 1741 – 1744. doi: 10.1161/ CIRCULATIONAHA.115.016379.
23. Hare JM, Mangal B, Brown J et al. Impact of oxypurinol in patients with symptomatic heart failure. Results of the OPT-CHF study. J Am Coll Cardiol 2008; 51 : 2301 – 2309. doi: 10.1016/ j.jacc.2008.01.068.
24. Givertz MM, Anstrom KJ, Redfield MM et al. Effects of xanthine oxidase inhibition in hyperuricemic heart failure patients: the xanthine oxidase inhibition for hyperuricemic heart failure patients (EXACT-HF) Study. Circulation 2015; 131 : 1763 – 1771. doi: 10.1161/ CIRCULATIONAHA.114.014536.
25. Tayar JH, Lopez-Olivo MA, Suarez-Almazor ME. Febuxostat for treating chronic gout. Cochrane Database Syst Rev 2012; 11: CD008653. doi: 10.1002/ 14651858.CD008653.pub2.
Labels
Paediatric cardiology Internal medicine Cardiac surgery CardiologyArticle was published in
Cardiology Review

2016 Issue 1
-
All articles in this issue
- Infekční komplikace u pacientů s akutním srdečním selháním – přehled
- Přidružená onemocnění a jejich význam pro prognózu akutního srdečního selhání – AHEAD score
- Tělesný trénink a rehabilitace u srdečního selhání
- Kardiálna kachexia
- Kvalita života pacientů s akutní dekompenzací chronického systolického srdečního selhání hodnocená pomocí standardizovaných dotazníků
- Hyperurikémia, kardiovaskulárne choroby a srdcové zlyhávanie
- Antikoagulace, antiagregace nebo obojí u pacientů s ischemickou chorobou srdeční a fibrilací síní
- Místo sitagliptinu v léčbě pacientů s diabetem 2. typu po studii TECOS
- Na jaké hodnoty snižovat systolický krevní tlak? Studie SPRINT
- Evropský konsenzus k otázkám aterogenní dyslipidemie a kombinační léčbě statinem a fibrátem
- Inhibitory protonové pumpy – nové molekuly, nové poznatky
- Nové pohledy na patofyziologii, diagnostiku a léčbu srdečního selhání se zachovanou ejekční frakcí
- Jak nejlépe blokovat renin-angiotenzinový systém u nemocných s hypertenzí a diabetes mellitus?
- Cardiology Review
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Inhibitory protonové pumpy – nové molekuly, nové poznatky
- Antikoagulace, antiagregace nebo obojí u pacientů s ischemickou chorobou srdeční a fibrilací síní
- Kardiálna kachexia
- Hyperurikémia, kardiovaskulárne choroby a srdcové zlyhávanie
