Statinová intolerance a její praktická řešení
Statin intolerance – finding practical solutions
Statins significantly reduce cardiovascular morbidity and mortality, nevertheless, adequate use of statins to reach LDL-cholesterol target values may be limited by adverse symptoms that lead to discontinuation or termination of treatment. The most common cause of statin intolerance and non-adherence to treatment is statin-associated myopathy (SAM). SAM may be largely avoided by understanding the risk factors which increase the risk of SAM (rheumatological and neurological diseases, acute infections, hypothyroidism, old age, drug interactions and others), and, if they occur, by careful statin dose titration or by choice of statins with a lower risk of drug interactions. As there is neither a sufficiently sensitive and specific laboratory marker of SAM nor a specific examination method, a score system is recommended to assess the likelihood of SAM based on symptom characteristics (type of pain, association of the symptoms with statin therapy over time, including after withdrawal and re-challenge). In statin-intolerant patients, statins should be administered according to a modified regimen with a potential for increasing the dose up to a tolerated maximum.
Keywords:
statin intolerance – statin-associated myopathy – creatine kinase elevation – modified treatment regimen
Authors:
M. Šnejdrlová
Authors‘ workplace:
Centrum preventivní kardiologie, III. interní klinika 1. LF UK a VFN v Praze
Published in:
Kardiol Rev Int Med 2017, 19(3): 161-164
Overview
Statiny výrazně snižují kardiovaskulární morbiditu a mortalitu, nicméně adekvátní použití statinů vedoucí k dosažení cílových hodnot LDL cholesterolu může být limitováno nežádoucími symptomy, které pak vedou k přerušení nebo ukončení léčby. Nejčastější příčinou statinové intolerance a nonadherence k léčbě je myopatie asociovaná se statiny (SAM). SAM se lze významnou měrou vyhnout při znalosti rizikových faktorů, které riziko SAM zvyšují (revmatologická a neurologická onemocnění, akutní infekce, hypotyreóza, vysoký věk, lékové interakce a další), v případě jejich výskytu pak volit opatrnou titraci dávky statinu, event. volit statiny s menším rizikem lékových interakcí. Protože neexistuje dostatečně specifický a senzitivní laboratorní marker ani vyšetřovací metoda, je vhodné používání skórovacích systémů, které nám pomohou určit pravděpodobnost SAM na základě charakteru symptomů (typ bolestí, časová souvislost obtíží s nasazením a popř. vysazením statinu). U pacientů se statinovou intolerancí by měly být podávány statiny minimálně v atypickém dávkovacím schématu s možným navýšením k nejvyšší tolerované dávce.
Klíčová slova:
statinová intolerance – myopatie asociovaná se statiny – elevace kreatinkinázy – atypické dávkovací schéma
Úvod
Málokterá léková skupina vyvolává v posledních letech tak vášnivé diskuze, jako je tomu u statinů. Na jedné straně stojí neotřesitelná data z obrovských randomizovaných studií, která poukazují na významné pozitivní ovlivnění kardiovaskulární (KV) morbidity a mortality, na straně druhé pak články v tisku a na sociálních sítích pojednávající o nebezpečnosti, resp. četných nežádoucích účincích této lékové skupiny. Skeptický postoj ke statinům a indikacím k léčbě pak získává nejen laická veřejnost, ale také lékaři některých profesí, kteří se problematikou ovlivnění KV rizika podrobně nezabývají. To vše pak vede k tomu, že velké množství pacientů indikovaných k hypolipidemické léčbě, resp. k léčbě statiny, je stále neléčeno, popř. léčeno neefektivně. Cílem tohoto článku není bagatelizovat možné nežádoucí účinky statinů, ale připomenout, že neopodstatněné přerušení či ukončení správně indikované statinové léčby může mít pro pacienta následky v podobě recidivy či primomanifestace KV příhody, které bylo možné zabránit. S diagnózou „statinová intolerance“ je tedy potřeba zacházet velmi opatrně. V léčbě dyslipidemie (jako významného rizikového faktoru KV onemocnění) je nezbytné, stejně jako při léčbě jiných onemocnění, zvažovat „cost-benefit ratio“.
Důvodů k častým diskuzím na téma nežádoucích účinků statinů může být několik. Svou roli jistě hraje fakt, že počet pacientů užívajících statiny narůstá – zatímco v roce 2011 byla v ČR spotřeba nejfrekventněji předepisovaných statinů (atorvastatin, rosuvastatin, simvastatin a fluvastatin) cca 290 mionů DDD (doporučených denních dávek) [1], v roce 2016 narostla spotřeba týchž statinů (vyjma kombinovaných preparátů) na cca 419 milionů DDD/ rok [2], tzn. statiny užívá zřejmě více než milion obyvatel ČR. Svou roli jistě hraje i objevení nových hypolipidemik, resp. PCSK9 inhibitorů, které jsou obecně velmi dobře tolerovány a navíc užívány (byť parenterálně) 1 – 2× měsíčně, což u řady pacientů (i lékařů nekardiologů) opět budí naději na „lepší léčbu“. Je ovšem potřeba připomenout, že PCSK9 inhibitory stále nelze v ČR rutinně předepisovat (zatím nebyla pojišťovnami schválena úhrada z prostředků veřejného zdravotního pojištění) a navíc tyto léky nejsou a nebudou určeny k „výměně“ za statiny, ale jako aditivní léčba u vysoce rizikových pacientů, kteří na maximální dostupné hypolipidemické léčbě nedosahují cílových hodnot LDL cholesterolu (LDL-c), popř. pro jedince ve vysokém riziku se statinovou intolerancí.
Důkazy z velkých randomizovaných studií ukazují, že léčba statinem snižuje riziko závažných KV příhod (tj. smrt z KV příčin, infarkt myokardu, koronární revaskularizace a cévní mozkové příhody) na každé snížení LDL-c o 1 mmo/ l přibližně o čtvrtinu. Nicméně absolutní přínos léčby statiny závisí na absolutním riziku aterosklerotické KV příhody a absolutní dosažené redukci LDL-c. Například snížení LDL-c o 2 mmol/ l běžně užívaným statinem v běžném dávkování (např. atorvastatin 40 mg denně) po dobu 5 let u 10 000 pacientů zabrání vzniku závažné KV příčiny u 1 000 pacientů s již preexistujícím KV onemocněním (tedy v sekundární prevenci) a u 500 pacientů v primární prevenci s vysokým rizikem KV příhod. Statinová terapie redukuje KV riziko tím více, čím déle je užívána [3].
Z nežádoucích účinků je trvale skloňováno zejména svalové postižení, resp. myopatie asociovaná se statiny, na které je zaměřeno toto sdělení. V posledních letech také diabetogenní účinky statinů, méně pak např. neurologické nežádoucí účinky [4] či elevace jaterních enzymů [5].
Myopatie asociovaná se statiny
Myopatie asociovaná se statiny (statin assocciated myopathy – SAM) je nejčastější nežádoucí účinek statinové léčby a rovněž nejčastější příčina nonadherence k léčbě a přerušení či ukončení terapie statiny. Prevalence SAM je uváděna v rozmezí 1 – 29 % podle toho, zda se jedná o data z randomizovaných klinických studií (výskyt 1 – 5 %) či data z registrů a observačních studií (11 – 29 %). Samozřejmě že každý z uvedených údajů má své limitace. Z randomizovaných studií jsou často vyloučeni pacienti rizikoví pro vznik myopatie (starší pacienti, pacienti s anamnézou svalových bolestí, jedinci s revmatologickými onemocněními apod.) (tab. 1), naopak observačním studiím často chybí kontrolní skupiny [6,7]. Důležitým faktem ovšem zůstává, že závažné „svalové“ nežádoucí účinky jsou extrémně raritní. Ve srovnání např. s kyselinou acetylsalicylovou (ASA) připadá na 248 pacientů léčených ASA 1 komplikace ve smyslu krvácení do gastrointestinálního traktu (GIT), na 2 066 pacientů léčených ASA připadá 1 fatální krvácení do GIT [8]. Naproti tomu rhabdomyolýza se vyskytne u 1 ze 100 000 léčených pacientů a smrt v souvislosti s rhabdomyolýzou u 1 pacienta z 1 000 000 [9].
SAM se lze významnou měrou vyhnout při znalosti rizikových faktorů, které riziko SAM zvyšují (tab. 1), v případě jejich výskytu pak volit opatrnou titraci dávky statinu, event. volit statiny s menším rizikem lékových interakcí.
![Rizikové faktory myopatie asociované se statiny [7].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/ae93b86fb63a421a975d7b5140144de3.png)
Stejně tak znalost alespoň základních lékových interakcí nám může pomoci vyhnout se závažným nežádoucím účinkům, dle Thompsona et al mohou být lékové interakce zodpovědné až za 60 % případů rhabdomyolýzy při užívání statinů (tab. 2). [10].
![Farmakokinetické vlastnosti nejčastěji užívaných statinů, riziko interakcí [11].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/96f9de2f7cc2b9969bce7e8186adf192.png)
Léky, které mohou interagovat se statiny na úrovni metabolizmu, jsou buď inhibitory, nebo induktory enzymů cytochromu P450 (CYP450). Statiny jsou metabolizovány převážně dvěma izoformami CYP450 – CYP3A4 (simvastatin, minimálně užívaný lovastatin a z 20 % také atorvastatin) a CYP2C9 (fluvastatin a z 10 % i rosuvastatin).
V kontextu lékových interakcí (tab. 2) [11] na úrovni CYP3A4 se velmi často mluví o silných inhibitorech CYP3A4, mezi které patří např. makrolidová antibiotika (zejména klarithromycin, erytromycin, méně roxitromycin), antimykotika ze skupiny azolů (ketokonazol, itrakonazol), většina inhibitorů proteáz (antivirotika) a cyklosporin A. Vlivem inhibice CYP3A4 pak dochází ke zpomalené degradaci a eliminaci statinu, čímž narůstá riziko nežádoucích účinků. V běžné praxi se ale mnohem častěji setkáváme se současným podávaním statinů s antiarytmiky amiodaronem a propafenonem či kalciovými blokátory verapamilem, diltiazemem a amlodipinem, které jsou středně silnými inhibitory CYP3A4. Při současném podávání kteréhokoli z nich stoupá expozice (součin plazmatické koncentrace a délky působení) u simvastatinu 3×, (s klarithromycinem až 10×), u atorvastatinu je vzestup expozice nižší, u středně silných inhibitorů (propafenon, amiodaron, verapamil) je vzestup dvojnásobný, u silných inhibitorů trojnásobný [12].
Cestou CYP2C9 je metabolizováno nesrovnatelně menší množství farmak, CYP2C9 je významně inhibován flukonazolem a částečně i amiodaronem, slabým inhibitorem 2C9 je omeprazol. Hydrofilní statiny (rosuvastatin, pravastatin) nejsou transformovány cytochromovým systémem, variabilita jejich hladiny je tedy výrazně menší [12].
Diagnostika SAM
Stanovení diagnózy SAM je velmi obtížné, zejména proto, že je založeno na subjektivním hodnocení, nemáme spolehlivý diagnostický test ani laboratorní marker, který by diagnózu jednoznačně potvrdil nebo vyvrátil. Asi nejdůležitějším a vcelku logickým klíčem ke zhodnocení kauzální souvislosti statinové léčby a vzniku myalgií je jistá časová návaznost. Příznaky lze připsat statinům, pokud se objeví v průběhu prvního měsíce léčby, zlepší se po jejich vysazení (během 4 týdnů) a event. se znovu objeví po opětovném podání. Rovněž svým charakterem mohou svalové bolesti podporovat či vyvrátit souvislost léčby s obtížemi. Bolesti svalů způsobené statiny jsou spíše symetrické, postihující proximální velké svalové skupiny (stehna, paže), jedná se o difuzní bolest, popř. křeče, pocit ztuhlosti či svalové slabosti a nevýkonnosti. Naopak svalové bolesti malé izolované oblasti, bolesti charakteru parestezií, záškubů či lokalizované spíše do oblasti šlach a kloubů pro obtíže způsobené statiny spíše nesvědčí (tab. 3).
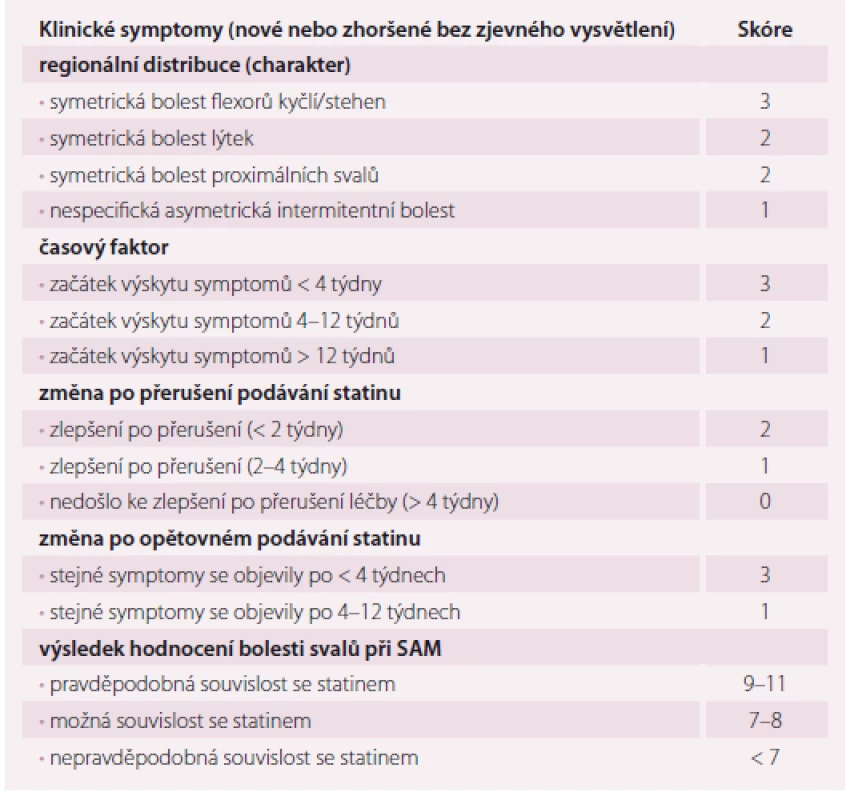
Jak už bylo řečeno, neexistuje žádný vysoce spolehlivý biochemický marker, který by diagnózu SAM potvrdil nebo vyvrátil. Elevace kreatinkinázy (CK) je pro SAM nespecifická, může být způsobena myopatií jakékoli etiologie vč. statinové (vzácně), řadou neurologických onemocnění, ale také recentní svalovou aktivitou (v posledních 48 – 72 hod), abúzem alkoholu, hypotyreózou, malignitou a celou řadou dalších stavů, u některých jedinců můžeme dokonce zaznamenat chronickou elevaci CK bez zjevné příčiny, tzv. idiopatická hyperCKemie [13].
Na základě výše uvedených skutečností lze tedy SAM (v širším slova smyslu statinovou intoleranci) definovat jako výskyt nežádoucích symptomů, které jsou pacientem vnímány jako neakceptovatelné nebo laboratorní odchylky, které značí nadměrná rizika, jsou přisuzována statinové léčbě a vedou k jejímu přerušení. Kritéria SAM se liší v různých studiích, nicméně dle konsenzu EAS (European Atherosclerosis Society) je využívána definice ze studí ODYSSEY ALETARNATIV a GAUSS 2, která charakterizuje intoleranci jako neschopnost tolerovat dva a více statinů v minimálních dávkách. V našich podmínkách pracujeme s termíny:
kompletní statinová intolerance – neschopnost tolerovat ani jeden ze tří základních statinů v jejich obvyklé nejnižší počáteční dávce (rosuvastatin 5 mg, atorvastatin 10 mg, simvastatin 20 mg),
parciální statinová intolerance – neschopnost tolerovat statiny v podobě a dávkách nezbytných k dosažení cílových hodnot [14].
Terapeutický přístup k pacientům se statinovou intolerancí
Podrobný návod, jak přistupovat k pacientům se statinovou intolerancí, je shrnut v tab. 4. Pro pacienty, kteří netolerují žádný statin v obvyklé počáteční denní dávce, vzniká doporučení pokusit se alespoň o velmi nízké dávky nebo nižší než denní dávkování. Mnohé studie u pacientů s hypercholesterolemií ukázaly, že dávky 5 – 10 mg rosuvastatinu nebo 10 – 20 mg atorvastatinu podávané každý den snížily LDL-c o 20 – 40 %. U pacientů s předchozí statinovou intolerancí se díky rosuvastatinu podávanému 1 – 2× týdně (průměrná dávka 10 mg/ týden) podařilo snížit LDL-c o 23 – 29 % a byl velmi dobře tolerován u 74 – 80 % pacientů. [15,16].
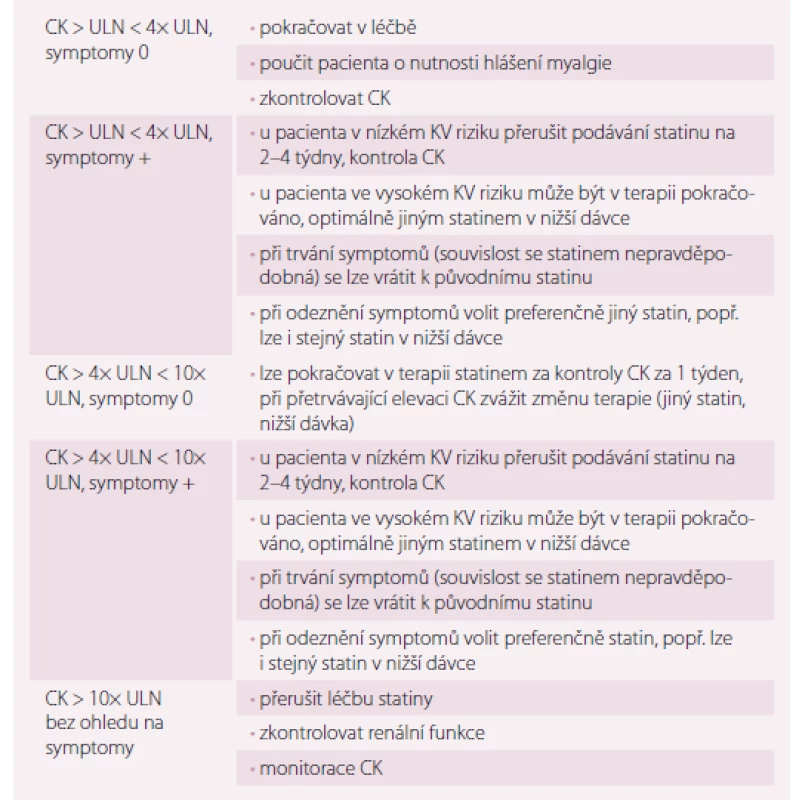
Závěr
Nežádoucí příznaky spojené s užíváním statinů a zejména pak svalové obtíže (myopatie asociované se statiny) jsou relativně častým důvodem pro přerušení či dokonce ukončení statinové terapie. Nicméně závěrem je potřeba zdůraznit několik skutečností.
- Závažné nežádoucí účinky jsou velmi raritní.
- Celé řadě nežádoucích účinků se lze vyhnout znalostí a respektováním možných rizikových faktorů rozvoje statinové intolerance, respektováním nejfrekventnějších lékových interakcí (amiodaron, propafenon, verapamil, diltiazem, amodipin, makrolidy, azolová antimykotika).
- Pacientů s kompletní statinovou intolerancí (tzn. neschopnost tolerovat ani jeden ze tří základních statinů v jejich obvyklé nejnižší počáteční dávce – rosuvastatin 5 mg, atorvastatin 10 mg, simvastatin 20 mg) je velmi málo.
- U pacientů, u nichž je indikována statinová léčba, bychom měli zvážit alespoň pozměněné dávkovací schéma (minimální dávka statinu, popř. ordinovaná několikrát týdně).
- Pro úplnost problematiky je potřeba dodat, že podrobný rozhovor s pacientem s vysvětlením nejen možných jiných příčin myalgií, ale také s vysvětlením heterogenity celé lékové skupiny a zdůrazněním důležitosti efektivní léčby, je nezbytností. Pokud i přesto je pacient přesvědčen, že by jeho obtíže mohly být způsobeny užívaným statinem, je jistě ke zvážení jeho záměna (přestože lékař si toto nemyslí), protože „bagatelizováním“ obtíží pacienta s tím, že se nejedná o statinovou intoleranci, docílíme pouze výrazného snížení adherence k léčbě.
Doručeno do redakce: 4. 9. 2017
Přijato po recenzi: 8. 9. 2017
MU Dr. Michaela Šnejdrlová, Ph.D.
www.vfn.cz
michaelasnejdrlova@vfn.cz
Sources
1. Souhrnné údaje o dodávkách léčivých přípravků do lékáren a jiných zdravotnických zařízení dle léčivé látky a cesty podání za rok 2011. Státní ústav pro kontrolu léčiv. Dostupné na: http:/ / www.sukl.cz/ rok-2011-1.
2. Souhrnné údaje o dodávkách léčivých přípravků do lékáren a jiných zdravotnických zařízení dle léčivé látky a cesty podání za rok 2016. Státní ústav pro kontrolu léčiv. Dostupné na: http:/ / www.sukl.cz/ rok-2016-1.
3. Collins R, Reith C, Emberson J et al. Interpretation of the evidence for the efficacy and safety of statin therapy. Lancet 2016; 388(10059): 2532 – 2561. doi: 10.1016/ S0140-6736(16)31357-5.
4. Rojas-Fernandez CH, Goldstein LB, Levey AI et al. The National Lipid Association’s Safety Task Force. An assessment by the Statin Cognitive Safety Task Force: 2014 update. J Clin Lipidol 2014; 8 (Suppl 3): S5 – S16. doi: 10.1016/ j.jacl.2014.02.013.
5. Bays H, Cohen DE, Chalasani N et al. The National Lipid Association’s Safety Task Force. An assessment by the Statin Liver Safety Task Force: 2014 update. J Clin Lipidol 2014; 8 (Suppl 3): S47 – S57. doi: 10.1016/ j.jacl.2014.02.011.
6. Laufs U, Filipiak KJ, Gouni-Berthold I et al. Practical aspects in the management of statin associated muscle symptoms (SAMS). Atheroscler Suppl 2017; 26 : 45 – 55. doi: 10.1016/ S1567-5688(17)30024-7.
7. Pella D, Gvozdjáková A, Lietava J et al. Myopatie asociovaná se statiny: klinické doporučení Slovenskej asociácie aterosklerózy a České společnosti pro aterosklerózu. AtheroRev 2016; 1(1): 7 – 13.
8. Derry S, Loke YK. Risk of gastrointestinal haemorrhage with long term use of aspirin: meta-analysis. BMJ 2000; 231(7270): 1183 – 1187.
9. Baigent C, Blackwell L, Emberson J et al. Cholesterol Treatment Trialist’s (CTT) Collaboration. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 parti-cipants in 26 randomised trials. Lancet 2010; 376(9753): 1670 – 1681. doi: 10.1016/ S0140-6736(10)61350-5.
10. Thompson PD, Clarkson P, Karas RH. Statin associated myopathy. JAMA 2003; 289(13): 1681 – 1690. doi: 10.1001/ jama.289.13.1681
11. Doseděl M, Malý J, Vlček J. Lékové interakce statinů, jejich klinická závažnost a management. Remedia 2011; 21 : 392 – 397.
12. Bultas J. Vzájemné srovnání statinů z pohledu farmakologa. Remedia 2013; 23 : 143 – 150.
13. Prelle A, Tancredi L, Sciacco M et al. Retrospective study of a large population of patients with asymptomatic or minimally symptomatic raised serum creatine kinase levels. J Neurol 2002; 249(3): 305 – 311.
14. Backes JM, Moriarty PM, Ruisinger JF et al. Effects of once weekly rosuvastatin among patients with a prior statin intolerance. Am J Cardiol 2007; 100(3): 554 – 555. 10.1016/ j.amjcard.2007.03.059.
15. Gadarla M, Kearns AK, Thompson PD. Efficacy od rosuvastatin (5 mg and 10 mg) twice a week in patients intolerant to daily statins. Am J Cardiol 2008; 101(12):1747 – 1748. doi: 10.1016/ j.amjcard.2008.02.061.
16. Štulc T, Beránková Š, Češka R. Praktický přístup ke statinové intoleranci. Vnitř Lék 2015; 61(11): 936 – 941.
Labels
Paediatric cardiology Internal medicine Cardiac surgery CardiologyArticle was published in
Cardiology Review

2017 Issue 3
-
All articles in this issue
- Stratifikace kardiovaskulárního rizika a nové cílové hodnoty sérových lipidů
- Management dyslipidemií v definovaných skupinách pacientů
- Statinová intolerance a její praktická řešení
- Co nedělat a proč aneb kardiovaskulární prevence ve světle posledních doporučení
- Je srdcové zlyhávanie so zachovalou ejekčnou frakciou vážne ochorenie?
- Ularitid v léčbě akutně dekompenzovaného srdečního selhání – výsledky studie TRUE-AHF
- Infekční endokarditida
- Katetrizační ablace fibrilace síní a přímá antikoagulancia
- 30 let inhibice systému renin-angiotensin-aldosteron u srdečního selhání
- SGLT2 (glifloziny) antidiabetika, antihypertenziva nebo léky na srdeční selhání?
- Zoletorv – farmakologický profil
- Edukační činnost sester u pacientů po infarktu myokardu – přehledová studie
- Cardiology Review
- Journal archive
- Current issue
- About the journal
Most read in this issue
- SGLT2 (glifloziny) antidiabetika, antihypertenziva nebo léky na srdeční selhání?
- Stratifikace kardiovaskulárního rizika a nové cílové hodnoty sérových lipidů
- Statinová intolerance a její praktická řešení
- Infekční endokarditida
