Problematika těhotenství u žen s vrozenou srdeční vadou
Congenital heart disease in pregnancy
Most women after surgery for congenital heart disease in childhood survive until an adult age. There has been an increasing number of women with congenital heart disease in the Czech Republic who want to become pregnant. The article presents and gives an overview of the issues associated with pregnant women with congenital heart defects and deals with the assessment of risk for the pregnant woman in relation to the basic diagnosis, the possibilities of preconception care and the most common complications in pregnancy and possible solutions.
Key words:
pregnancy – congenital heart disease – delivery – maternal mortality – risk stratification
Authors:
Žáková D.
Authors‘ workplace:
Centrum kardiovaskulární a transplantační chirurgie Brno Centrum komplexní péče o vrozené srdeční vady v dospělosti Brno
Published in:
Kardiol Rev Int Med 2018, 20(4): 273-278
Overview
Vzhledem k excelentním výsledkům dětské kardiochirurgie přežívá většina žen po operaci vrozené srdeční vady do dospělého věku. V posledních dvou desetiletích jsme svědky rychlého nárůstu počtu žen v reprodukčním věku, které jsou nositelkami vrozené srdeční vady nebo podstoupily operaci vrozené srdeční vady v dětství. Článek přináší přehled problematiky gravidních žen s vrozenou srdeční vadou, zabývá se stanovením rizika pro těhotnou ve vztahu k základní diagnóze, možnostmi prekoncepční péče a nejčastějšími komplikacemi v graviditě vč. možností jejich řešení.
Klíčová slova:
gravidita – vrozené srdeční vady – porod – mateřská mortalita – riziková stratifikace
Úvod
Prevalence vrozených srdečních vad (VSV) se pohybuje mezi 0,4 a 1,5 % [1]. Díky excelentním výsledkům dětské kardiochirurgie přežívá do dospělosti téměř 90 % pacientů vč. nejtěžších komplexních VSV [2]. Důsledkem je narůstající počet žen ve fertilním věku s VSV neoperovanou nebo po operaci v dětství, což v kombinaci se zvyšujícím se věkem těhotných žen v posledních letech představuje rizikový faktor kardiovaskulárních (KV) komplikací v graviditě.
Epidemiologie
Ve vyspělých zemích se KV komplikace vyskytují u 0,2– 4 % těhotných žen. V posledních dvou desetiletích jsme svědky nárůstu mateřské mortality ve vyspělých zemích [3]. Přestože v USA má chronické srdeční onemocnění jen 1,4 % rodiček, KV onemocnění gravidních žen je hlavní příčinou mateřské mortality a podílí se na celkové hospitalizační mortalitě 28 % [4,5]. Podíl úmrtí v souvislosti s graviditou u VSV ale zůstává vcelku nízký oproti ženám se získaným srdečním onemocněním. Tato skutečnost je z větší části způsobena sledováním fertilních žen s VSV ve specializovaných centrech, kde se ženám dostává poradenství prekoncepčně a v graviditě jsou pravidelně v centrech sledovány, na rozdíl od žen se získanými KV chorobami, u nichž často dochází k primomanifestaci srdečního onemocnění až v graviditě.
Fyziologické změny v těhotenství, během porodu a v poporodním období
V těhotenství narůstá srdeční výdej o 30– 50 %, zpočátku je nárůst dán růstem tepového objemu, v pozdější fázi gravidity, přibližně od 20. týdne, pak nárůstem tepové frekvence. Současně dochází k poklesu systolického a diastolického krevního tlaku (TK) vlivem snížené cévní rezistence. Diastolický TK (dTK) v průběhu 2. trimestru dosahuje minima, naopak ve 3. trimestru se postupně jeho hodnoty navrací k normě. Bolestivé kontrakce v druhé době porodní zvyšují srdeční výdej a systémovou cévní rezistenci, dochází k nárůstu systolického TK (sTK) o 15– 25 %, dTK o 10– 15 %. Po porodu díky autotransfuzi krve z dělohy a uvolněné dolní duté žíle dochází k dalšímu nárůstu srdečního výdeje. Těhotenství též provází četné změny v hemokoagulačních parametrech, jako je zvýšená koncentrace koagulačních faktorů, fibrinogenu, zvýšená adhezivita destiček a snížená fibrinolýza, čímž je navozen hyperkoagulační stav. V kombinaci s omezeným venózním návratem na podkladě útlaku dolní duté žíly těhotnou dělohou přispívá k vyššímu riziku tromboembolických komplikací. Hormonální změny u gravidní ženy vedou taktéž k rozvolnění pojivové tkáně, čímž stoupá riziko disekce aorty hlavně u geneticky podmíněných aortopatií (Marfanův syndrom, Loyes-Dietzův syndrom, Turnerův syndrom).
Management plánování gravidity u žen s VSV
Optimálním postupem je vyšetření fertilní ženy před graviditou a stanovení stupně rizika těhotenství ještě před početím (tab. 1). Bohužel ale stále početná skupina žen podceňuje prekoncepční doporučení kardiologa s ohledem na jejich základní diagnózu a často se s těhotnou ženou potkáváme až v graviditě, nezřídka i v pokročilé fázi. Základem prekoncepčního managementu je podrobné kardiologické vyšetření zahrnující klinické vyšetření, zhodnocení funkční klasifikace NYHA, EKG, echokardiografické vyšetření, zátěžový test a další zobrazovací metody (CT, MR). Nezbytné je prekoncepčně vysadit embryotoxickou medikaci (např. inhibitory angiotenzin konvertující enzymů – ACEI, sartany, spironolakton, amiodaron apod.). Dále je třeba při plánování gravidity zohlednit prognózu matky a její schopnost postarat se o dítě v budoucnu, její psychický stav (u VSV spojených s mentální retardací) a ve složitějších případech detailně informovat a zapojit partnera do procesu rozhodování.

Genetické poradenství
Součástí plánování těhotenství je též genetické poradenství. Pravděpodobnost vzniku VSV u dítěte zdravých rodičů je 0,6– 0,8 %, riziko dědičnosti izolované VSV od rodiče s VSV je přibližně 3– 5 % [6]. Riziko dědičnosti je obzvláště vysoké při obstrukci výtokového traktu levé komory, vč. syndromu hypoplastického levého srdce. Genetické poradenství je nezbytné u vrozeně podmíněných aortopatií s vysokým rizikem přenosu genetické malformace na plod (Marfanův syndrome, Loyes-Dietzův syndrom apod.) a u genetických malformací asociovaných s konotrunkálními abnormitami či bikuspidní aortální chlopní (např. 22q11 delece, Williams-Beuren či Holt-Oram syndrom).
Kardiovaskulární diagnostika v průběhu těhotenství
EKG, echokardiografie (transthorakální a transezofageální) – představují základní vyšetřovací metody a lze je použít opakovaně v průběhu těhotenství bez rizik pro plod i matku.
Zátěžovou ergometrii je doporučeno provádět u asymptomatických žen s významnou aortální stenózou k ozřejmení tlakové reakce na dynamickou zátěž, EKG změn či provokaci symptomů. V případě pozitivity testu, tzn. výskytu symptomů, poklesu TK pod výchozí hodnoty či provokaci ischemických EKG změn, doporučujeme korekci aortální stenózy ještě před graviditou. Ke zhodnocení funkční kapacity je test indikován u žen s funkčně jednou komorou, u Fontanovské cirkulace a nekorigované transpozice velkých tepen po atriálním switchi, kde též sledujeme tepovou rezervu. U pacientek s Ebsteinovou anomálií trikuspidální chlopně pomůže zátěžový test odhalit desaturaci při zátěži v přítomnosti patentního foramen ovale (PFO) či zkratu na úrovni síní a posoudit přítomost zátěží provokovaných arytmií. Test do 80 % predikovaného maxima lze provést u již gravidní ženy bez zvýšení rizika potratu.
RTG hrudníku – lze provést s nízkým rizikem do 14 dní od početí a poté až po 12. týdnu gravidity.
Magnetická rezonance – nativní vyšetření lze v graviditě provést a je preferováno před CT vyšetřením. Použití kontrastní látky gadolinia je však kontraindikováno pro jeho přechod uteroplacentární bariérou.
Scintigrafie – je nevhodná, neboť dochází ke kumulaci radiofarmaka v močovém měchýři matky, a tudíž k radiační zátěži plodu.
Elektrofyziologické a katetrizační vyšetření – provádíme pouze v nevyhnutelných indikacích, pokud jsou nezbytná, lze je provést optimálně z radiálního přístupu až po 12. týdnu gravidity.
Kardiochirurgický výkon u gravidních
Mimotělní oběh (extracorporeal circulation – ECC) vždy představuje obrovské riziko ztráty plodu a fetální mortalita dosahuje až 20 % [7]. Kardiochirurgické řešení je doporučeno pouze při selhání farmakologické či intervenční léčby. V případě nutnosti je doporučeno kardiochirurgický výkon provést mezi 13. a 28. týdnem gestace. Prognóza plodu je úzce spjata s jeho gestačním stářím. V případě nezbytnosti urgentního kardiochiurgického výkonu je u plodu ≥ 26 týdnů doporučen porod císařským řezem na kardiochirurgickém sále a následně zahájení srdeční operace u matky.
Intervenční výkony u gravidních
Při nezbytnosti provést intervenční výkon je optimální jej načasovat na 2. trimestr až po dokončení organogeneze a měl by být prováděn na pracovišti s dostatkem zkušeností. Je třeba zkrátit dobu ozáření plodu, použít radiální přístup a odstínění dělohy.
Porod – načasování a způsob vedení porodu
Porodní plán by měl být vytvořen již v průběhu gravidity a zaznamenán v dokumentaci. V případě středně a vysoce rizikové gravidity je doporučeno vyjádření heart teamu specializovaného centra. Současným trendem je vaginální porod, který je doporučován většině pacientek s VSV. Výhodou je menší krevní ztráta a nižší riziko infekce a tromboembolických komplikací oproti porodu císařským řezem. Data z registru ROPAC (Registry on Pregnancy and Cardiac Disease) neprokázala benefit plánovaného císařského řezu [8]. V průběhu vaginálního porodu je možno užít epidurální anestezii vyjma vad s obstrukcí výtokového traktu levé komory z důvodu vysokého rizika systémové hypotenze. Indukce porodu je doporučena po 40. týdnu gestace u všech žen s KV onemocněním. Profylaxe infekční endokarditidy není paušálně doporučována [9]. Karidiologické indikace k císařskému řezu shrnuje tab. 2.

Riziková stratifikace těhotných s vrozenou srdeční vadou
Riziko komplikací v těhotenství je dáno základním onemocněním, funkcí levé komory, funkční klasifikací, přítomností cyanózy, plicní hypertenzí a dalšími komorbiditami (muskuloskeletární patologie, mentální retardace atd.). V klinické praxi je doporučeno použít modifikovanou klasifikaci WHO, která je součástí aktuálních doporučení Evropské kardiologické společnosti pro léčbu KV chorob v graviditě z roku 2018 [10]. Tabulka s klasifikací je uvedena v editorialu tohoto čísla [11]. Těhotenství lze tedy rozdělit na nízkoriziková (mWHO I), středněriziková (mWHO II, III) a těhotenství s vysokým rizikem (mWHO IV). Třída rizikovosti se může v průběhu těhotenství měnit s ohledem na aktuální stav pacientky a je třeba ji přehodnocovat každou klinickou návštěvu. Při rozhodování je důležité stanovit pravděpodobnost komplikací a rozlišit mezi komplikacemi, které jsou snadno řešitelné (např. síňové arytmie), a těmi, které mohou být fatální (např. cévní mozková příhoda při špatně vedené antikoagulační léčbě u žen s mechanickými chlopenními náhradami) [7]. Součástí stratifikačního procesu je i otázka, zda může intervence či korekce VSV před početím snížit riziko v graviditě. Tuto skutečnost je třeba bedlivě zvážit, neboť někdy může být provedená operace větším rizikem než ponechaná neřešená VSV. Například žena s asymptomatickou aortální stenózou a normální hemodynamickou odpovědí na zátěž je v menším riziku příhod než žena s mechanickou chlopenní náhradou. Taktéž profylaktická náhrada pulmonální chlopně u žen s méně významnou regurgitací představuje riziko infekční endokarditidy a zvyšuje pravděpodobnost opakovaných intervencí v budoucnu [12]. V případě středně a vysoce rizikového těhotenství je doporučeno zhodnocení klinických nálezů a rizik multidisciplinárním týmem (pregnancy heart team), optimálně v rámci center pro VSV, jehož součástí jsou kardiolog, kardiochirurg, anesteziolog, neonatolog, genetik, hematolog a další specialisté [10,13].
Přehled doporučení u jednotlivých VSV dle stupně rizika
Vrozené srdeční vady dle mWHO II– III
Defekt septa síní (ASD) a defekt septa komor (VSD) (mWHO II) – málo a středně významné zkraty na úrovni síní a komor jsou v těhotenství dobře tolerovány, hemodynamicky významný zkrat je indikací k intervenci či operaci před plánovanou graviditou. Vzhledem k asi 5% riziku tromboembolických komplikací u neuzavřeného síňového defektu je nutná profylaxe tromboembolie jako časná mobilizace a profylaktické podání heparinu či nízkomolekulárního heparinu (low molecular weight heparin – LMWH). V průběhu porodu je třeba myslet i na riziko paradoxní embolizace při možném pravo-levém zkratu.
Defekt atrioventrikulárního septa (AVSD) (mWHO II– III) s významným zkratem či významnou mitrální regurgitací je doporučeno korigovat před těhotenstvím, obdobná pravidla platí i pro významnou reziduální mitrální regurgitaci po operaci v dětství.
Koarktace aorty po korekci (CoA) představuje pro těhotnou ženu střední riziko (mWHO II– III). Těhotenství i u nevýznamné rekoarktace je spojeno s rizikem ruptury či disekce v prekoarktační části aorty. Hypertenze může být příčinou ruptury aneuryzmatu mozkové tepny s následným krvácením do mozku. K ruptuře preformovaného aneuryzmatu mozkové tepny ale může dojít i bez současně přítomné hypertenze.
Pulmonální stenóza (PuS) bývá obecně dobře tolerována. Významná PuS může vést k selhání pravé komory a k arytmiím a je prediktorem mateřských komplikací, obzvláště u již přítomné pravokomorové dysfunkce. Pacientka s významnou pulmonální stenózou vyžaduje sledování po 1– 2 měsících a v případě výskytu symptomů či poklesu funkce pravé komory lze provést perkutánní balonkovou valvuloplastiku v těhotenství.
Pacientky po korekci Fallotovy tetralogie (TOF), u nichž je nejčastějším reziduálním nálezem pulmonální regurgitace, tolerují graviditu dobře (mWHO II). U většiny pacientek jsou doporučeny kontroly každý trimestr, v případě významné pulmonální regurgitace pak sledujeme pacientku 1× za 1– 2 měsíce. Kardiální komplikace byly popsány u 8 % žen, převážně u žen s již zavedenou kardiální medikací před těhotenstvím [14]. Nejčastějšími komplikacemi jsou arytmie, srdeční selhání (SS) a intrauterinní růstová retardace plodu [15]. Náhrada plicnicové chlopně bioprotézou je indikována před graviditou u žen s významnou pulmonální regurgitací a dilatací pravé komory splňující volumová kritéria získaná z vyšetření MR. Pravostranné SS řešíme v graviditě primárně konzervativně šetrnou diuretickou terapií a klidovým režimem, při refrakterním selhání pak zvažujeme ukončení gravidity. Častým nálezem po operaci Fallotovy tetralogie je dilatace kořene aorty, kde při rozměrech > 50 mm těhotenství nedoporučujeme (mWHO IV).
Ebsteinova anomálie bez symptomů, bez cyanózy v klidu a při zátěži, bez arytmií a SS bývá v graviditě dobře tolerovaná (mWHO II). Vhodné je provedení zátěžového testu před graviditou k posouzení zátěžové tolerance a vyloučení zátěží indukované cyanózy či arytmií. Těhotenství nedoporučujeme ženám symptomatickým, s významnou trikuspidální regurgitací, při současné cyanóze (v přítomnosti PFO či defektu septa síní) nebo při dysfukci pravé komory a SS, kdy doporučujeme ženám operaci vady před graviditou. V přítomnosti komunikace na úrovni síní je pacientka při trvale zvýšených pravosíňových tlacích v riziku paradoxní embolizace. Pravděpodobnost progrese arytmií při již přítomném WPW syndromu (Wolff-Parkinson-White syndrome) je taktéž zvýšená. Cyanóza matky potencuje pravděpobnost předčasného porodu či potratu.
Pravou komoru v systémové pozici nacházíme u nekorigované transpozice velkých tepen po atriálním switchi dle Mustarda či Senninga (nTGA) a u vrozeně korigované transpozice velkých tepen (ccTGA). Rizikovost gravidity je dána systolickou i diastolickou funkcí pravé komory, která bývá trvale mírně snížená. Přestože většina žen se systémovou pravou komorou toleruje těhotenství vcelku dobře, riziko selhání pravé komory a progrese regurgitace systémové AV chlopně je výrazně zvýšené. SS bývá často ireverzibilní [16]. Vysoká je pravděpodobnost hypotrofie plodu a předčasného porodu (až 38 %). Těhotenství nedoporučujeme ženám se středně těžce a těžce sníženou funkcí pravé komory (EF ≤ 40 %), ve funkční třídě NYHA III/ IV nebo v přítomnosti významné trikuspidální regurgitace. Prekoncepčně provádíme u žen vyšetření MR, která zhodnotí funkci systémové pravé komory a taktéž je schopna semikvantitavně zhodnotit významnost trikuspidální regurgitace. V průběhu těhotenství sledujeme ženy 1× měsíčně nebo 1× za 2 měsíce.
Fontanovská cirkulace (společná komora po TCPC – total cavo-pulmonary connection) představuje středně zvýšené riziko v případě, že nejsou u pacientky přítomny komplikující faktory (mWHO III). Hemodynamika Fontanovské cirkulace neumožňuje v těhotenství adekvátně zvýšit srdeční výdej a trvale je přítomna žilní hypertenze. Těhotná je v riziku vzniku arytmií, SS a tromboembolických komplikací. Plod je ohrožen intrauretinní růstovou retardací, předčasným porodem, nízkou porodní hmotností a rizikem potratu, který je udáván až v 50 % [17]. Nezanedbatelné je i riziko peripartálního krvácení [18]. Těhotenství nedoporučujeme u pacientek s klidovou saturací < 85 %, sníženou funkcí společné komory, při přítomnosti středně významné a významné regurgitace systémové AV chlopně, protein-losing enteropatii či refrakterních arytmiích. V těchto případech je gravidita zatížena vysokým rizikem (mWHO IV). Pokud je již pacientka s Fontanovskou cirkulací gravidní, je třeba pečlivé klinické sledování 1× měsíčně, případné síňové arytmie by měly být řešeny promptně elektrickou kardioverzí. Plná antikoagulační léčba je indikována při výskytu arytmií, přítomnosti fenestrace nebo jiného pravo-levého zkratu a anamnézy trombózy či embolizace. Pokud indikujeme LMWH, je nutná těsná monitorace hladin antiXa. U ženy s Fontanovskou cirkulací lze tedy o graviditě uvažovat pouze v případě asymptomatičnosti pacientky, dobré funkci společné komory, příznivé spiroergometrii, nízkých hodnotách NT-proBNP, saturaci > 90 % a nepřítomnosti protein-losing enteropatie.
Vrozené srdeční vady dle mWHO IV
Plicní hypertenze a Eisenmengerův syndrom představují velmi vysoké riziko pro matku i plod. Mateřská mortalita se pohybuje mezi 16 a 30 % u plicní hypertenze [19] a 20 a 50 % u Eisenmengerova syndromu [20]. Neexistuje jednoznačně bezpečná cut-off hodnota středního tlaku v plicnici určující zvýšené riziko gravidity, obecně je považováno riziko za nižší pouze v případě mírné plicní hypertenze [19], v riziku jsou i oligosymptomatické pacientky. Nejčastějšími příčinami úmrtí u plicní hypertenze jsou hypertenzní krize, plicní trombózy a SS. Nejrizikovějším obdobím pro možné komplikace a úmrtí matky je doba 3. trimestru, těsně po porodu a v šestinedělí. Těhotenství by ženě nemělo být doporučeno. Pokud je již žena gravidní, je třeba diskutovat o ukončení gravidity. Pokračuje-li gravidita, doporučujeme klidový režim, opatrnou diuretickou léčbu při SS a obezřetnou antikoagulační léčbu při současném riziku tromboembolie i krvácení, hlavně hemoptýzy. Kontroly provádíme ve 3. trimestru 1× týdně. Sledování v těhotenství a porod u žen s plicní hypertenzí by měly být řízeny multidisciplinárním týmem v rámci specializovaného centra pro VSV. Během porodu je třeba zamezit situacím, které vedou k vazodilataci, poklesu vaskulární rezistence a následně ke snížení srdečního výdeje. Riziková je celková anestezie, regionální anestezie je preferována. U pacientek s Eisenmengerovým syndromem vede pokles vaskulární rezistence k prohloubení pravo-levého zkratu, zhoršení cyanózy, riziku paradoxní embolizace a snížení průtoku plícemi. Těhotenství často končí potratem, při klidové saturaci matky < 85 % je šance na porod živého plodu méně než 15 % [21]. V případě, že fertilní žena užívá bosentan či jiné inhibitory receptorů pro endotelin, je třeba vzhledem k embryotoxicitě tuto medikaci ukončit ještě před graviditou s vědomím nárůstu mateřského rizika. Možnou náhradou je perorální sildenafil. Porod je podobně jako u plicní hypertenze třeba směřovat do expertního centra.
Vzácně řešíme graviditu u pacientek s cyanotickou vadou bez plicní hypertenze (nejčastěji se jedná o komplexní vadu, která je inoperabilní, s vybalancovanou hemodynamikou, nebo vadu po paliativním řešení). Při saturaci matky > 90 % je riziko potratu 10 %, naproti tomu při saturaci < 85 % je pravděpodobnost porodu živého dítěte jen 12 % a je velké riziko intrauterinní růstové retardace, předčasného porodu či potratu [21]. Zátěžový test před graviditou indikujeme při saturaci mezi 85 a 90 %, při zátěží navozeném rychlém a významném poklesu saturace těhotenství nedoporučujeme. Vzhledem k riziku tromboembolických příhod a paradoxní embolizace je třeba zvážit profylaxi LMWH za současné konzultace s hematologem.
Těžká symptomatická obstrukce výtoku levé komory (významná aortální stenóza, významná subvalvární a supravalvulární stenóza aorty) je u těhotné spojena s neschopností adekvátně zvýšit srdeční výdej, narůstá riziko SS a hypoperfuze plodu. V případě symptomatické obstrukce výtoku levé komory indikujeme operační řešení před graviditou. S ohledem na střední riziko v graviditě (mWHO III), které představuje přítomnost mechanické chlopně, je vhodnou variantou Rossova operace bez nutnosti antikoagulační či antiagregační léčby nebo náhrada aortální chlopně bioprotézou. V případě asymptomatičnosti doporučujeme ženě absolvovat zátěžový test před graviditou. Při jeho pozitivitě, tj. poklesu TK při zátěži pod výchozí hodnotu, vzniku symptomů či ischemických EKG změn, doporučujeme operační řešení vady před graviditou. Při středně významné obstrukci výtoku levé komory graviditu povolujeme a je zatížena středním rizikem s nutností kontrol 1× za 2 měsíce.
Významná nativní koarktace, rekoarktace a pseudoaneuryzma po operaci koarktace aorty představují pro těhotnou ženu vysoké riziko ruptury aorty a měly by být korigovány před těhotenstvím. Významnost (re)koarktace hodnotíme měřením tlakového spádu mezi horními a dolními končetinami, přítomností klidové a zátěží indukované hypertenze a posouzením morfologie aorty pomocí zobrazovacích metod (CT, MR, katetrizace). Léčba hypertenze musí být vedena obezřetně s vědomím rizika hypoperfuze plodu či potratu při přílišné kompenzaci hypertenze a také s vyšším rizikem preeklampsie při neadekvátní korekci TK.
Choroby aorty, geneticky podmíněné aortopatie – hemodynamické a hormonální změny v těhotenství jsou spojeny se zvýšeným rizikem disekce aorty [22]. Největší pravděpodobnost disekce aorty je ve 3. trimestru (50 %) a časně po porodu (33 %). Rizikovými faktory dilatace aorty jsou hypertenze a vyšší věk matky. Pacientky s patologií aorty by měly být sledovány po celé těhotenství a dalších 6 měsíců po porodu. U žen s vysokým rizikem disekce jsou doporučeny časté kontroly v měsíčních intervalech, u středně a nízce rizikových žen dostačují kontroly po 3 měsících. Před graviditou je vhodné zobrazení celé aorty pomocí CT nebo MR, je-li to nutné, lze v průběhu gravidity provést vyšetření MR bez použití gadolinia. Striktní kontrola hypertenze je nedílnou součástí v průběhu celého těhotenství, doporučeny jsou betablokátory, u pacientek s Ehlers-Danlosovým syndromem typu IV je vhodý celiprolol i u normotenzních žen [23]. Všechny ženy s geneticky podmíněnou aortopatií by měly být prekoncepčně informovány o riziku disekce. Poradenství, sledování a porod by měly probíhat ve specializovaných centrech VSV s dostupností kardiochirurgie. Císařský řez je doporučen při rozměrech ascendentní aorty ≥ 45 mm a u žen s anamnézou disekce. Pokud dojde v průběhu gravidity k progresivní dilataci aorty a je-li plod životaschopný, doporučujeme chirurgické řešení s plodem in utero. Pokud je plod neviabilní, následuje po kardiochirurgickém výkonu porod císařským řezem. V případě vzniku disekce typu A v těhotenství postupujeme podobně, fetální mortalita při mimotělním oběhu je 20– 30 %. Při desekci typu B postupujeme primárně konzervativně se striktní kontrolou TK. Podrobnější informace o geneticky podmíněných chorobách aorty shrnuje tab. 3.
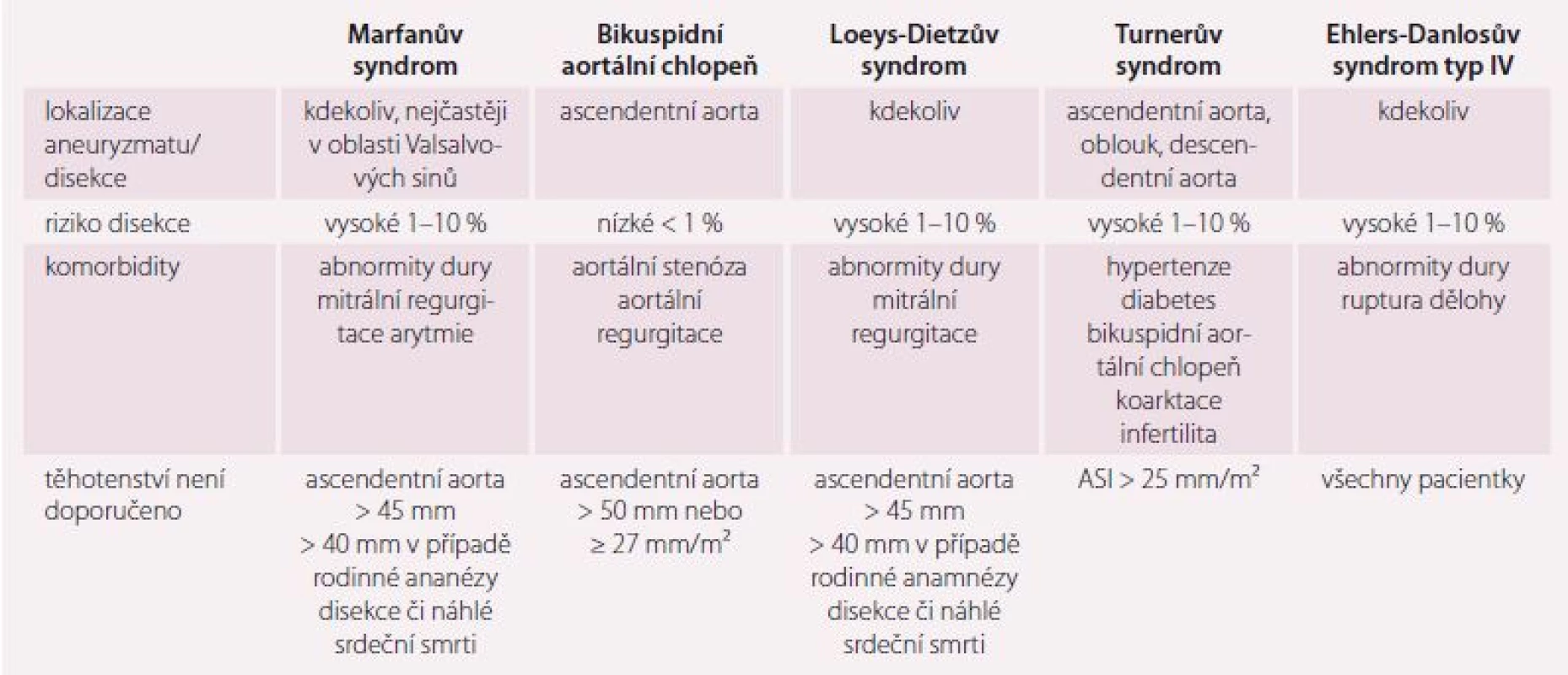
Marfanův syndrom – prevalence je udávána 1 : 5 000 a nejčastěji je dilatací postižena aorta v místě Valsalvových sinů, ale postižen může být kterýkoli úsek aorty. Často je přidružena mitrální regurgitace a durální abnormity. Riziko disekce v graviditě se pohybuje mezi 1 a 10 %, nejčastěji je kolem 3 % [24] a stoupá úměrně rostoucímu diametru aorty. V asi 1% riziku disekce jsou i ženy s šíří kořene aorty < 40 mm. V průběhu těhotenství může dojít k další dilataci kteréhokoli úseku aorty vlivem hormonálních změn, jenž může být reverzibilní. Při rozměru kořene aorty 40– 45 mm je doporučeno operační řešení před graviditou, jsou-li současně přítomny další rizikové faktory, jako je rodinná anamnéza disekce či dynamika progrese rozměru aorty. Při aortě ≥ 45 mm graviditu nedoporučujeme a je indikováno operační řešení před koncepcí, a to buď záchovná operace dle Davida, při nemožnosti záchovné operace pak operace dle Bentalla či pouze náhrada ascendentní aorty. Relativně novou metodou je možnost zpevnění kořene a ascendentní aorty implantací extraaortální síťky Exovasc, jejíž textilní materiál postupně vroste do adventicie a zabrání další progresi dilatace. V průběhu gravidity se též setkáváme s progresí mitrální regurgitace.
Turnerův syndrom – celkem 50 % žen s Turnerovým syndromem má KV abnormity jako dilataci aorty, bikuspidní aortální chlopeň (25 %) a koarktaci aorty (10 %). K spontánnímu těhotenství dojde velmi zřídka, a tak jsme v poslední době svědky narůstajícího počtu těhotných žen s Turnerovým syndromem po IVF donorskými oocyty. Vzhledem k tomu, že mateřská mortalita je 100× větší než v běžné populaci a asi 2 % gravidních žen umírá na disekci aorty [25], je třeba každé těhotenství u ženy s Turnerovým syndromem považovat za rizikové. Riziko disekce dále narůstá v přítomnosti hypertenze, bikuspidní aortální chlopně a koarktace aorty [26]. Těhotenství je kontraindikováno při rozměrech aorty ≥ 25 mm/ m² nebo > 35 mm (s ohledem na malý vzrůst je nutná indexace rozměrů na povrch těla), koarktaci aorty, nekontrolované hypertenzi, anamnéze disekce či předchozí operaci aorty či chlopní. Při rozměrech aorty mezi 20 a 25 mm/ m² a nepřítomnosti rizikových faktorů je gravidita možná se středně zvýšeným rizikem (mWHO III), ale je nutné těsné sledování rozměrů aorty ultrazvukem a v případě nárůstu diametru o ≥ 10 % je doporučeno zobrazení MR. V případě, že MR potvrdí nárůst rozměrů o ≥ 10 %, je doporučeno ukončení gravidity císařským řezem.
Bikuspidní aortální chlopeň je spojena s dilataci ascendentní aorty, ale s nižším rizikem disekce než u Marfanova či Turnerova syndromu (< 1 %). Těhotenství nedoporučujeme při rozměrech ascendentní aorty ≥ 50 mm (mWHO IV dle tab. 3). Středním rizikem je zatížena gravidita při rozměrech asendentní aorty 45– 50 mm a je nutné těsné sledování rozměrů ascendentní aorty v průběhu těhotenství. Porod sekcí doporučujeme při aortě ≥ 45 mm, vaginální porod je možný při rozměrech aorty 40– 45 mm za současného zkrácení 2. doby porodní a vyvarování se hypertenze.
Ostatní geneticky podmíněné aortopatie – těhotenství není doporučeno u vaskulární formy Ehlers-Danlosova syndromu (typ IV), kde se udává vysoká mateřská mortalita způsobená rupturou dělohy nebo disekcí velkých tepen a žil. V případě ostatních geneticky podmíněných aortopatií je těhotenství s vysokým rizikem. Posouzení gravidity je nutné multidispiplinárním týmem.
Závěr
Plánování těhotenství u žen s VSV začíná již před početím. Optimální je vyšetření žen ve specializovaných centrech, kde je provedena stratifikace rizika a stanoven plán dalšího sledování vč. formy vedení porodu. Většina těhotenství je zatížena nízkým nebo středním rizikem a je možné sledování regionálními kardiology. Vysokorizikové gravidity je nutné monitorovat ve specializovaných centrech, která jsou prostřednictvím multidisciplinárního týmu schopna řešit širokou škálu možných komplikací. Do budoucna se musíme připravit na nárůst počtu těhotných žen s VSV.
Doručeno do redakce: 26. 10. 2018
Přijato po recenzi: 9. 11. 2018
MU Dr. Daniela Žáková
Sources
1. Hoffman J, Kaplan S. The incidence of congenital heart disease. J Am Coll Cardiol 2000; 39(12): 1890– 1900.
2. Warnes CA, Williams RG, Bashore TM et al. ACC/ AHA 2008 guidelines for the management of adults with congenital heart disease. J Am Coll Cardiol 2008; 52(23): e143– e263. doi: 10.1016/ j.jacc.2008.10.001.
3. Cantwell R, Clutton-Brock T, Cooper G. Saving mother’s lives: reviewing maternal deaths to make motherhood safer: 2006-2008. The eight report of the confidential enquiries into maternal deaths in the United Kingdom. BJOG 2011; 118 (Suppl 1): 1– 203. doi: 10.1111/ j.1471-0528.2010.02847.x.
4. Kuklina E, Callaghan W. Chronic heart disease and severe obstetric morbidity among hospitalisations for pregnancy in the USA: 1995– 2006. BJOG 2011; 118(3): 345– 352. doi: 10.1111/ j.1471-0528.2010.02743.x.
5. CEMACH. CEMACH Saving Mothers’ Lives: Reviewing Maternal Deaths to Make Motherhood safer 2003– 2005: The Seventh Report on Confidential Enquiries into Maternal Deaths in the United Kingdom. London: Centre for Maternal and Child Enquiries 2008.
6. Burn J, Brennan P, Little J et al. Recurrence risks in offspring of adults with major heart defects: results from first cohort of British collaborative study. Lancet 1998; 351(9099): 311– 316.
7. Kapoor MC. Cardiopulmonary bypass in pregnancy. Ann Card Anaesth 2014; 17(1): 33– 39. doi: 10.4103/ 0971-9784.124133.
8. Ruys TP, Roos-Hesselink JW, Pijua-Domenech Aet al. Is a planned caesarean section in women with cardiac disease beneficial? Heart 2015 : 101(7): 530– 536. doi: 10.1136/ heartjnl-2014-306497.
9. Royal College of Obstetricians and Gynaecologists. Antenatal corticosteroids to reduce nenatal morbidity and mortality. Royal College of Obstretricians and Gynaecologists Green-Top Guideline No. 7.London: Royal College of Obstetricians and Gynaecologists 2015.
10. Regitz-Zagrosek V, Roos-Hesselink JW, Baursachs Jet al. ESC Guidelines for the management of cardiovascular diseases during pregnancy of the European Society of Cardiology (ESC). Eur Heart J 2018; 39(34): 3165– 3241. doi: 10.1093/ eurheartj/ ehy340.
11. Krejčí J. Editorial. Proč bychom měli věnovat pozornost problematice kardiovaskulárních onemocnění v těhotenství? Kardiol Rev Int Med 2018; 20(4): 249– 250.
12. Greutmann M, Pieper PG. Pregnancy in women with congenital heart disease. Eur Heart J 2015; 36(37): 2491– 2499. doi: 10.1093/ eurheartj/ ehv288.
13. Roos-Hesselink JW, Budts W, Walker F. Organisation of care for pregnancy in patients with congenital heart disease. Heart 2017; 103(23): 1854– 1859. doi: 10.1136/ heartjnl-2017-311758.
14. Balci A, Drenthen W, Mulder BJ et al. Pregnancy in women with corrected tetralogy of Fallot: Occurrence and predictors of adverse events. Am Heart J 2011; 161(2): 307– 313. doi: 10.1016/ j.ahj.2010.10.027.
15. Kampman MA, Siegmund AS, Bilardo CM et al. Uteroplacental doppler flow and pregnancy outcome in women with tetralogy of Fallot. Ultrasound Obstet Gynecol 2017; 49(2): 231– 239. doi: 10.1002/ uog.15938.
16. Cataldo S, Doohan M, Rice K et al. Pregnancy following Mustard or Senning correction of transposition of the great arteries: a retrospective study. BJOG 2016; 123(5): 807– 813. doi: 10.1111/ 1471-0528.13508.
17. Stephen G, Vause S, Clarke B. Outcomes of pregnancy following maternal fontan repair. The 2nd international congress on cardiac problems in pregnancy 2012. Berlin. Abstract 123.
18. Cauldwell M, Von Klemperer K, Uebing A et al. Why is post-partum haemorrhage mor common in women with congenital heart disease ? Int J Cardiol 2016; 218 : 285– 290. doi: 10.1016/ j.ijcard.2016.05.068.
19. Sliwa K, van Hagen IM Budts W et al. Pulmonary hypertension and pregnancy outcomes: Data from the Registry od Pregnancy and Cardiac Disease (ROPAC) of the European Society of Cardiolgy. Eur J Heart Fail 2016; 18(9): 1119– 1128. doi: 10.1002/ ejhf.594.
20. Duan R, Xu X, Wang X et al. Pregnancy outcome in women with Eisenmenger’s syndrome: A case series from west china. BMC Pregnancy Childbirths 2016; 16(1): 356. doi: 10.1186/ s12884-016-1153-z.
21. Presbitero P, Somerville J, Stone S et al. Pregnancy in cyanotic congenital heart disease. Outcome of mother and fetus. Circulation 1994; 89(6): 2673– 2676.
22. Manalo-Estrella P, Barker AE. Histopathologic findings in human aortic media associated with pregnancy. Arch Pathol 1967; 83(4): 336– 341.
23. Ong KT, Perdu J, De Backer et al. Effect of celiprolol on prevention of cardiovascular events in vascular Ehlers-Danlos syndrome: A prospective randomised, open, blinded-endpoints trial. Lancet 2010; 376(9751): 1476– 1484. doi: 10.1016/ S0140-6736(10)60960-9.
24. Pyeritz RE. Maternal and fetal complications of pregnancy in the Marfan syndrome. Am J Med 1981; 71(5): 784– 790.
25. Matura LA, Ho VB, Rosing DR et al. Aortic dilatation and dissection in Turner syndrome. Circulation 2007; 116(15): 1663– 1670. doi: 10.1161/ CIRCULATIONAHA.106.685487.
26. Gravholt CH, Landin-Wilhelmsen K, Stockholm K et al. Clinical and epidemiological description of aortic dissection in Turner’s syndrome. Cardiol Young 2006; 16(5): 430– 436. doi: 10.1017/ S1047951106000928.
Labels
Paediatric cardiology Internal medicine Cardiac surgery CardiologyArticle was published in
Cardiology Review

2018 Issue 4
-
All articles in this issue
- Hypertenze v těhotenství
- Srdeční selhání, kardiomyopatie a gravidita
-
Peripartální kardiomyopatie –
diagnostika a léčba - Těhotenství po transplantaci srdce
- Těhotenství a chlopenní vady
- Problematika těhotenství u žen s vrozenou srdeční vadou
- Poruchy srdečního rytmu v graviditě
- Plicní arteriální hypertenze a těhotenství
- Diagnóza a manažment angioedému
- Hypertenze není jen nemoc s nutností léků
- Index kotník-paže u diabetiků – jaká je nejvhodnější metoda měření?
- Arteriální hypertenze a syndrom spánkové apnoe
- Deprese u seniorů s chronickým selháním srdce
- Vliv terapie perindoprilem na kardiovaskulární přínosy v České republice
- Cardiology Review
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Hypertenze v těhotenství
- Poruchy srdečního rytmu v graviditě
- Diagnóza a manažment angioedému
-
Peripartální kardiomyopatie –
diagnostika a léčba
