Minimum o mechanických podporách srdca – klasifikácia, indikácie, princípy, klinické skúsenosti
Mechanical circulatory supports – basic principles and clinical evidence
Severe heart failure with signs of cardiogenic shock, whether in cases of acute myocardial lesion or in the context of chronic heart failure, is a syndrome with a very poor prognosis. The only solution today is the use of a device that takes over the heart’s function. Mechanical circulatory supports are devices designed in a variety of ways to support or replace heart function as pumps, to a greater or lesser extent, for a longer or shorter period of time. In acute conditions, short-term support is being used to create a setting for myocardial recovery and/or a decision on further treatment. In highly selected patients with terminal chronic heart failure, the implantation of a long-term left ventricular assist device for bridging to heart transplantation or as a definitive treatment solution of left ventricular failure is usually indicated. The article provides a brief overview of the basic principles and results of the use of both short- and long-term mechanical circulatory support.
Keywords:
mechanical circulatory supports – classification – indications – durable devices
:
Goncalvesová E.
:
Národný ústav srdcových a cievnych chorôb, Bratislava
; Oddelenie pre zlyhávanie a transplantáciu srdca, Kardiologická klinika LF UK a NUSCH, Bratislava
:
Kardiol Rev Int Med 2019, 21(2): 78-85
Pod pojem mechanické podporné systémy srdca spadajú zariadenia, ktoré dokážu podporiť alebo aj úplne nahradiť činnosť srdca ako pumpy. Ich technická konštrukcia je rôznorodá, ale základný funkčný princíp či cieľ je jednotný a tým je zabezpečiť prečerpávanie okysličenej krvi do arteriálneho riečiska. Zlyhávanie srdca so známkami kardiogénneho šoku či už pri akútnej lézii myokardu alebo v kontexte chronického srdcového zlyhávania je syndróm s veľmi zlou prognózou. Jediným riešením je v súčasnosti použitie zariadenia, ktoré preberie činnosť srdca. Podľa základného liečebného zámeru ich rozdeľujeme na 1. krátkodobé – aplikované s prvotným zámerom zabezpečiť cirkuláciu do zotavenia srdca (bridge to recovery) alebo do obdobia rozhodnutie o ďalšej liečbe (bridge to decision) a 2. dlohodobé, ktorých cieľom je nahradiť činnosť srdca do doby transplantácie (brigdge to transplant) alebo definitívne ako jeden zo spôsobov liečby pokročilého srdcového zlyhávania (destination therapy). Krátkodobé podpory , sú väčšinou prístroje, pri ktorých sú mechanické komponenty (čerpadlá) uložené extrakorporálne. U dlhodobých mechanických podpôr, kde sa plánuje dlhšie čakanie a nezávislý život s prístrojom v ambulantných podmienkach, sú mechanické komponenty (čerpadlo) umiestnené intratorakálne. Extrakorporálne ostávajú elektronické ovládače na zdroje energie. Článok poskytuje stručný prehľad základných princípov a výsledkom použitia krátkodobých aj dlhodobých mechanických podpôr cirkulácie.
Klíčová slova:
mechanické podpory obehu – klasifikácia – indikácie – dlhodobé podpory ľavej komory
Mechanické podporné systémy srdca (mechanical circulatory support – MCS) sú rôznym spôsobom konštruované zariadenia, čerpadlá, ktoré sú schopné vo väčšej alebo menšej miere, na dlhšiu alebo kratšiu dobu podporiť alebo aj nahradiť funkciu srdca ako pumpy. Princípom MCS je vytvorenie cirkulačného okruhu, pri ktorom sa obchádza celé srdce (veno-arteriálna exkorporálna membránová oxygenácia – ECMO) alebo sa prečerpáva krv z ľavej komory/ predsiene do aorty (left ventricular assist device – LVAD) či z pravej predsiene do pľúcnice (right ventricular assist device – RVAD). Tým sa zabezpečí efektívna cirkulácia a odbremenenia komory srdca.
V súčasnosti je k dispozícii široká škála zariadení, množstvo ďalších je vo vývoji. Pri výbere vhodného MCS pre konkrétneho pacienta v konkrétnej klinickej situácii je nutné zvážiť množstvo faktorov. Je to predovšetkým cieľ liečby (čas na zotavenie myokardu, premostenie k transplantácii či inému riešeniu); predpokladané trvanie podpory (hodiny, dni, týždne či mesiace až roky); miesto komorovej podpory (ľavá komora, pravá alebo obe) veľkosť tela; kontraindikácie k antikoagulačnej terapii a v neposlednom rade skúsenosti a možnosti pracoviska.
Krátkodobé podpory
Certifikovaný čas použitia krátkodobých podpôr závisí od typu zariadenia a pohybuje sa od niekoľkých dní do jedného mesiaca. Indikáciou sú stavy pri akútnom (a teda pravdepodobne reverzibilnom) zlyhaní srdca, postkardiotomický kardiogénny šok, primárne zlyhanie štepu alebo zlyhanie pravej komory darcovského srdca po transplantácii srdca. V kontexte chronického terminálneho srdcového zlyhania (SZ) je indikáciou na implantáciu krátkodobej podpory multiorgánové zlyhanie s cieľom jeho úpravy a následnej implantácie dlhodobého LVAD. Výhodou týchto systémov je relatívna jednoduchosť zavedenia, často možnosť perkutánnej implantácie a výrazne nižšia cena oproti dlhodobým VAD systémom. Najpriaznivejšie výsledky sú pri použití po kardiochirurgických výkonoch s omráčeným („stunning“) myokardom. Často sa používajú u pacientov s kardiogénnym šokom pri akútnom infarkte myokardu. Tieto spôsoby dočasnej mechanickej podpory cirkulácie sa využívajú aj pre zaistenie rizikových invazívnych diagnostických či liečebných intervenčných výkonov. Krátkodobé podpory sú perkutánne alebo chirurgicky implantované. Perkutánne sú schopné podporiť cirkuláciu na niekoľko hodín až dní, chirurgicky implantované, na niekoľko dní až týždňov. Spoločným znakom všetkých krátkodobých podpôr je to, že pohonná jednotka je umiestnená extrakorporálne.
Zásadnou otázkou na ktorú treba nájsť odpoveď pri indikovaní týchto relatívne zložitých personálne aj finančne náročných metód je, či pacient, u ktorého sa plánuje tento postup, má reálne vyhliadky na predĺženie života primeranej kvality. Vo všeobecnosti sa má MCS zvážiť u chorých s minimálnymi komorbiditami, ktorí sú v kardiogénnom šoku krátky čas a majú reálne korigovateľnú príčinu (napr. krátkotrvajúcu akútnu koronárnu oklúziu) a súčasne nemajú zjavné kontraindikácie k transplantácii srdca alebo dlhodobej mechanickej podpore pokiaľ nedôjde k zotaveniu myokardu.
Perkutánne krátkodobé podpory
Primárnym zámerom použitia perkutánnych mechanických podporných systémov srdca (percutaneous ventricular assist device –
Pc-VAD) je podporiť a udržať kriticky ohrozenú cirkuláciu a vytvoriť tak časový priestor na zotavenie myokardu alebo aplikáciu iného liečebného zákroku. Sú rôznej konštrukcie a spôsob, ktorým podporujú funkciu komory, zlepšujú cirkuláciu a pomáhajú zvyšovať perfúziu periférnych tkanív, je rozdielny (tab. 1).
![Hemodynamický efekt jednotlivých perkutánnych mechanických podpôr obehu.
Modifi kované podľa [3].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/fb52f02734c2642948c8c05b67ee584c.png)
Prednosťou Pc-VAD v porovnaní s chirurgicky implantovanými krátkodobými podporami je podstatne menšia invazivita zákroku a s tým súvisiaca možnosť rýchleho použitia, ktorá nie je limitovaná výhradne na pracoviská s kardiochirurgickým zázemím.
Perkutánne mechanické podpory majú tri základné okruhy indikácií:
- Kardiogénny šok spôsobený akútnou koronárnou príhodou alebo iným akútnym zhoršením kontraktility (napríklad fulminantná myokarditída). V týchto situáciách sa používajú s očakávaním zotavenia myokardu po príslušnej cielenej liečbe [1].
- Prudké zhoršenie známeho chronického SZ nereagujúce na farmakologické intervencie. Pri tomto klinickom postupe je úlohou Pc-VAD stabilizovať cirkuláciu a vytvoriť podmienky na dožitie do transplantácie („bridge to transplant“) alebo do aplikácie iného dlhodobého podporného systému („bridge to bridge“). Často ide o opatrenie u kriticky chorého pacienta s cieľom umožniť ďalšie diagnostické a liečebné rozhodnutia („bridge to decision“).
- Pc-VAD sa používajú aj elektívne alebo semielektívne na zabezpečenie obehu u chorých podstupujúcich iné rizikové perkutánne intervencie (koronárne, valvulárne alebo arytmologické) [2].
Spoločnými podmienkami na ich použitie sú vhodný cievny prístup (najčastejšie femorálna tepna) a prípustnosť antikoagulačnej liečby heparínom.
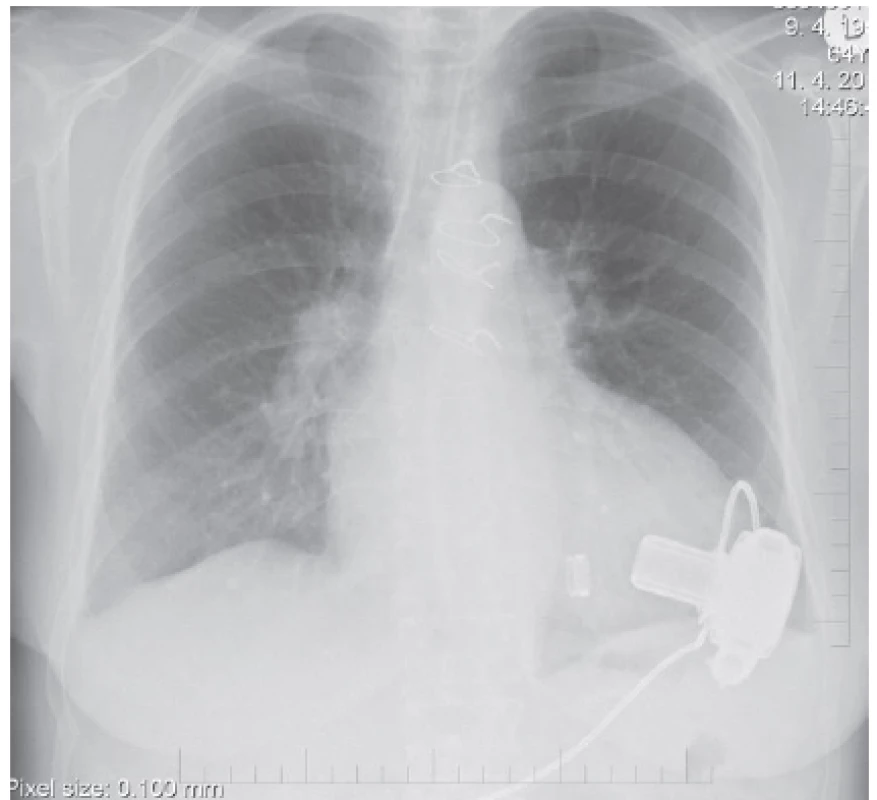
Intraaortálna balóniková kontrapulzácia
Najstaršou intravaskulárnou podpornou metódou je intraaortálna balóniková kontrapulzácia (IABP) (obr. 1). Princíp IABP spočíva v nafúknutí dlhého balónika umiestneného v descendentnej aorte na začiatku diastoly a jeho rýchlom odsatí tesne pred začiatkom systoly. Plniacim plynom je hélium. Najčastejšie sa umiestňuje perkutánnou Seldingerovou technikou, pričom začiatok balóna má byť uložený tesne pod odstupom ľavej subklaviálnej tepny. Veľkosť balóna sa vyberá podľa výšky pacienta. IABP zvyšuje stredný systémový tlak krvi, perfúziu cez otvorené koronárne tepny predovšetkým prostredníctvom zvýšenie diastolického tlaku. Pokles spotreby kyslíka v myokarde sa pri IABP dosahuje aj prostredníctvom zníženia afterloadu defláciou balóna na začiatku systoly. Zníženie afterloadu je pravdepodobne najdôležitejší účinok IABP, ktorý vedie k zvýšeniu vývrhového objemu, srdcového výdaja, stredného systémového tlaku aj systémovej perfúzie. Zlepšenie hemodynamických pomerov je zreteľnejšie pri SZ spojenom s ischémiou myokardu, ako pri iných príčinách SZ, kde je pokles afterloadu jediným mechanizmom podpory srdcovej činnosti. Hemodynamické zmeny pri IABP sú veľmi variabilné a závisia od objemu balóna, jeho pozície, systémovej rezistencie a poddajnosti aorty, ale vo všeobecnosti sa systolický tlak znižuje asi o 20 %, diastolický tlak narastá asi o 30 % a stredný arteriálny tlak o 20 %. Dochádza tiež približne k 20% redukcii tlaku v pľúcnici v zaklinení a tiež k 20% zvýšeniu srdcového výdaja [3].
Najčastejšou komplikáciou je ischémia končatiny, cez ktorú je zavedená kanyla kontrapulzátora. Ďalšími komplikáciami je krvácanie, ruptúra alebo perforácia aorty, periférna embolizácia, viscerálna ischémia, infekcie, prípadne mechanické poruchy, ako napríklad ruptúra balóna. Kontraindikáciami IABP sú významná aortálna regurgitácia, disekcia aorty, obliterujúca ateroskleróza periférnych tepien a všeobecné kontraindikácie i. v. antikoagulačnej liečby.
Napriek dobre dokumentovanému zlepšeniu hemodynamiky ostáva reálny klinický prínos IABP v zmysle redukcie mortality stále nejasný. Výsledky klinických pozorovaní, registrov aj niekoľkých metaanalýz sú konfliktné. Potvrdzujú síce zlepšenie hemodynamických ukazovateľov a aj napriek tomu, že niektoré z nich dokazujú zníženie hospitalizačnej aj 30-dňovej mortality u chorých s kardiogénnym šokom pri infarkte myokardu, zdá sa, že tieto výsledky skôr súvisia so selekčným skreslením (pacienti s IABP majú celkovo lepšiu prognózu aj sú častejšie revaskularizovaní), ako by predstavovali skutočný prínos IABP [4–6]. V súlade s týmito závermi je aj výsledok jedinej randomizovanej klinickej skúšky IABP. V tejto štúdii (SHOCK II) bolo 600 pacientov s kardiogénnym šokom pri infarkte myokardu, ktorí boli riešení včasnou revaskularizáciou; 301 z nich boli náhodne vybraní a použila sa IABP, 299 bolo liečených bez IABP. Nezistil sa rozdiel v 30-dňovej mortalite medzi týmito skupinami (39,7 vs. 41,3 %) [7]. Kvantitatívny rozsah hemodynamickej podpory, ktorý poskytuje IABP, je malý a v mnohých prípadoch nedostatočný na podporu perfúzie periférnych tkanív. Odľahčenie práce ľavej komory je tiež malé a nedostatočné na vytvorenie optimálnych podmienok na zotavenie myokardu.
Novšie intravaskulárne podporné systémy sú miniatúrne čerpadlá zavedené transkutánne, pričom krv sa z ľavej predsiene alebo komory prečerpáva do aorty. Porovnanie základných charakteristík jednotlivých Pc-VAD je v tab. 2.
![Porovnanie jednotlivých mechanických systémov. Modifi kované podľa [3].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/d62b0b921a4fde334d6e81f9bfb67812.png)
TandemHeart a Impella
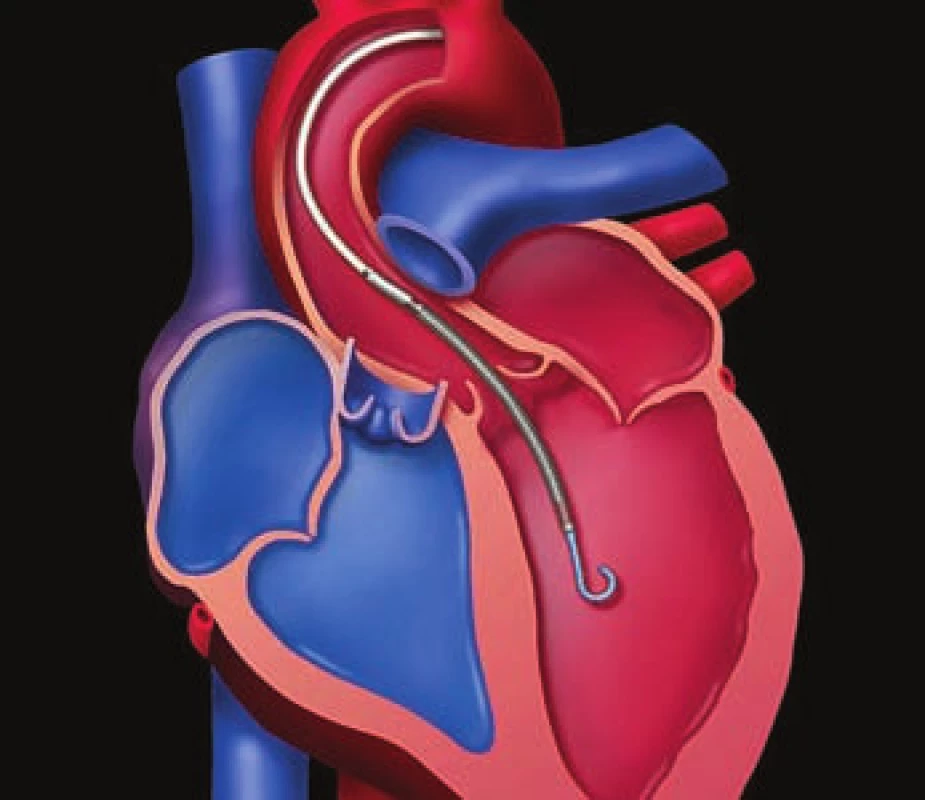
TandemHeart (obr. 2) je mechanická podpora cirkulácie, kde krv kontinuálne prečerpáva extrakorporálne uložená centrifugálna pumpa. Prívodná kanyla sa zavádza cez femorálnu vénu transseptálne do ľavej predsiene. Odtiaľ sa odvádza okysličená krv cez pumpu a ďalšie kanyly do abdominálnej aorty, alebo oboch iliackých artérií v objeme do 5 l/ min. Uznaná dĺžka použitia je do 14 dní. Systém umožňuje účinnejšiu podporu obehu ako IABP. Skúsenosti sú predovšetkým z USA. Komplikácie sú podobné ako pri IABP, častejšie je krvácanie a ischémia končatiny [3]. Na Slovensku sa úspešne niekoľkokrát použil perkutánny podporný systém Impella 2.5 (obr. 3) [1,2]. Impella je mikroaxiálna rotačná pumpa, ktorá sa zavádza bežnou technikou cez femorálnu tepnu. Rotujúca závitnica, ktorá generuje axiálny prietok, je uložená cez aortálnu chlopňu. Vstupný otvor čerpadla má byť vo výtokovom trakte ľavej komory asi 4 cm pod aortálnou chlopňou, výstupný niekoľko centimetrov nad cípmi aortálnej chlopne. Perkutánne použiteľná Impella má maximálny prietok 2,5 l/ min. Existuje aj verzia, ktorá poskytuje prietok do 5 l/ min, táto si však vyžaduje chirurgické zavedenie. Uznaná dĺžka použitia je do 7 dní. Kontraindikáciou použitia systému sú periférne artériové ochorenie, ťažko kalcifikovaná aorta a mechanická aortálna protéza. V porovnaní s IABP poskytuje Impella efektívnejšie zvýšenie srdcového výdaja [8]. Tridsaťdňová mortalita u pacientov s kardiogénnym šokom a použitou podporou Impella 2.5 alebo 5 bola 25 % [9]. Impella v porovnaní s IABP umožňuje dosiahnuť lepšie výsledky ako hemodynamická podpora pri vysokorizikových perkutánnych koronárnych intervenciách [10]. Použitie Impelly 2.5 u pacientov v kardiogénnom šoku na umelej pľúcnej ventilácii neprinieslo v porovnaní s IABP zlepšenie 30 dňovej mortality [11].
![Perkutánny podporný obehový
systém TandemHeart. Okysličenú krv odčerpáva
pumpa cez kanylu umiestnenú do
ľavej predsiene do descendentnej aorty.
Tým sa odľahčuje ľavá komora a nahrádza
sa jej činnosť [29].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/f6272e160a7f5d9af56633542c31ba6a.jpeg)
Extrakorporálna membránová oxygenácia
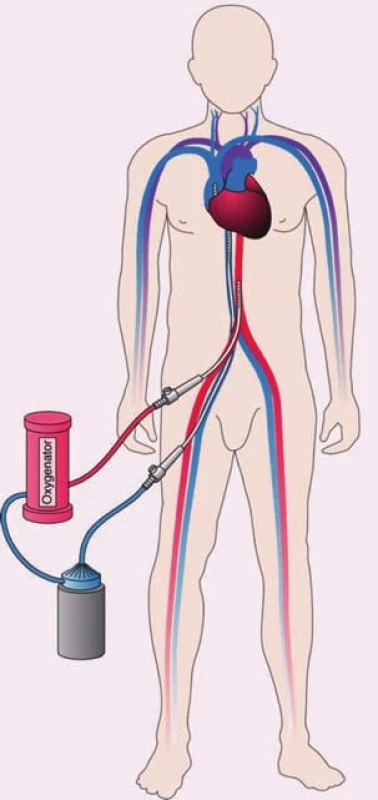
V súčasnosti sa v indikácii dočasnej perkutánnej podpory obehu čoraz častejšie používa extrakorporálna membránová oxygenácia (ECMO). Jej rozšírenie umožňuje konštrukcia kompaktného malého rýchlo zostaviteľného systému. Pri akútnom SZ s charakteristikami kardiogénneho šoku, či už v teréne známeho chronického SZ, alebo de novo SZ sa používa tzv. veno-arteriálne ECMO. Pri ňom sa krv z pravej predsiene vháňa extrakorporálnou pumpou do oxygenátora. Tu sa jej okysličí a zbaví oxidu uhličitého a vracia sa do krvného obehu cez veľké tepny (obr. 4). Ide o biventrikulárny nepulzatilný podporný systém schopný dočasne prakticky nahradiť funkciu oboch komôr. Okrem kardiológie sa často využíva aj v kardiochirurgii v prípadoch, kedy nemožno pacienta odpojiť z mimotelového obehu pre nedostatočný vlastný srdcový výdaj. V týchto prípadoch sa kanyly zavádzajú do centrálnych žíl a aorty. Pri už spomínaných „kardiologických“ indikáciách sa kanyly zavádzajú perkutánne punkciou alebo po predchádzajúcej preparácii cievnych vstupov. Nasávajúca, teda žilová kanyla sa zavádza obyčajne cez v. femoralis (prípadne v. jugularis). Koniec žilovej kanyly sa umiestňuje do pravej predsiene alebo tesne pod vyústenie do dutej žily. Výstupná kanyla sa umiestňuje do a. femoralis (prípadne a. axilaris). Komplikácie ako krvácanie, hemolýza alebo ischémia končatiny s kanylovanou tepnou sú podobné ako pri iných Pc-VAD. Špecifické komplikácie ECMO sú hypoxia mozgu až tzv. harlekýnov syndróm. Je spôsobený tým, že horná časť tela a predovšetkým jeho pravá strana sa zásobia krvou z vlastného obehu, ktorá nemusí byť dostatočne oxygenovaná, kým ľavá a dolná časť tela sa prednostne zásobia mimotelovým obehom. Riešením je intenzívnejšia ventilačná podpora a/ alebo zavedenie ďalšej kanyly, ktorá privádza oxygenovanú krv do a. subclavia alebo do žilového systému. Inou možnou komplikáciou spojenou s ECMO je distenzia výrazne oslabenej ľavej komory v dôsledku zvýšenia afterloadu pri neadekvátne vysokom extrakorporálnom prietoku. Napriek týmto problémom je použitie ECMO často preferované pre možnosť rýchlej inzercie, poskytnutia plnej cirkulačnej podpory a dosiahnutia dobrej oxygenácie tkanív najmä v situáciách súčasnej respiračnej insuficiencie, ktorá je v súvislosti s akútnym SZ častá [12,13].
Chirurgicky implantované krátko- až strednodobé podpory
U pacientov, kde sa nepredpokladá rýchle zotavenie myokardu alebo u chorých s postkardiotomickým zlyhaním srdca, ktorí majú priaznivú dlhodobú perspektívu (sú kandidáti transplantácie alebo implantácie dlhodobej mechanickej podpory), možno mechanickú podporu obehu zabezpečiť chirurgicky implantovaným exktrakorporálnym systémom. Podporované môžu byť obidve komory izolovane alebo aj súčasne. Zapojenia kanýl sú z ľavej predsiene alebo komory do aorty a z pravej predsiene do pľúcnice. Najčastejšie používaným systémom je Levitronix Centrimag (obr. 5). Tento systém poskytuje vysoký prietok, trombózy systému sú veľmi zriedkavé. Poskytuje účinnú podporu niekoľko týždňov a vytvára tak dostatočný časový priestor na zotavenie myokardu (napr. pri fulminantých myokarditídach či zlyhaní špet po transplantácii) alebo na rozhodnutie o ďalšej liečbe.
![Biventrikulárne zapojenie
extrakorporálnej mechanickej podpory
Centrimag [30].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/0056f6b20f1bf1ad819a7c4521afe768.jpeg)
Dlhodobé podpory
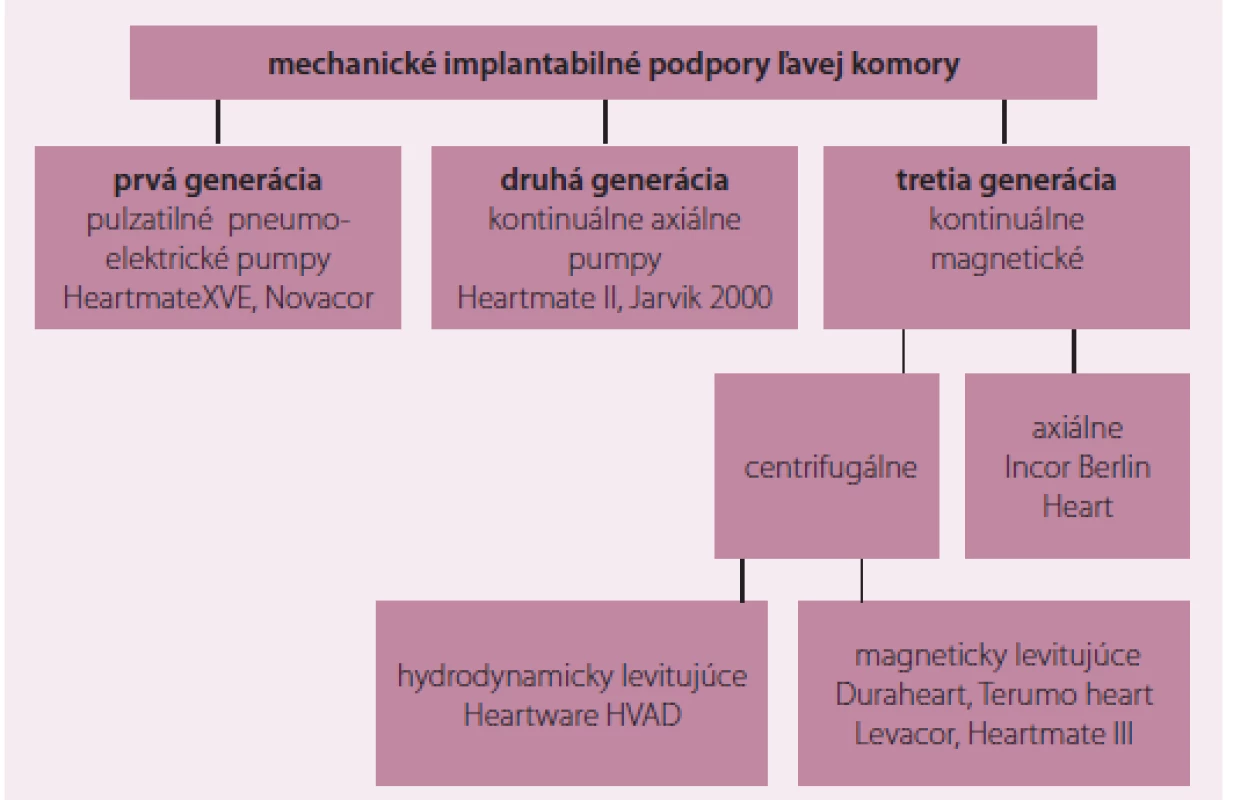
Dlhodobé implantabilné mechanické podpory ľavej komory sú preferenčne indikované u chorých s ťažkým pokročilým chronickým SZ. Sú určené na komorovú podporu v dĺžke až niekoľko rokov. Prehľad používaných LVAD je na obr. 6. Do klinickej praxe ako prvé prenikli LVAD, ktoré vytvárali pulzatilný prietok, a napodobňovali fyziologickú funkciu ľavej komory. Pulzatilný tok sa generoval zmenou polohy membrány umiestnenej v komore čerpadla, ktorá sa presúvala prečerpávaním plynu. Komora sa plnila a vyprázdňovala cez umelými chlopňami opatrené ústia, podobne ako v srdci. V posledných rokoch úplne prevládlo používanie mechanických podpôr, ktoré vytvárajú kontinuálny prietok. Hnacím princípom v prípade púmp druhej generácie je axiálne uložená závitnica. Táto svojim rotačným pohybom v osi pumpy zaisťuje nasávanie krvi v oblasti prívodnej kanyly a jej pretláčanie do odvodnej kanyly (obr. 7). Podstatou kontinuálnych púmp 3. generácie je profilovaný disk rotujúci v magnetickom poli komôrky, ktorý tvorí prietok na princípe centrifúgy (obr. 8). V absolútnej väčšine sa dnes používajú LVAD s kontinuálnym prúdením. Prietok je u púmp s kontinuálnym prúdením regulovaný rýchlosťou rotora (počtom otáčok), ale významne závisí na tlakovom gradiente cez pumpu (čím vyšší gradient tým menší prietok). Je výrazne ovplyvňovaný zmenami preloadu a afterloadu, pričom prietok klesá pri znižovaní preloadu a zvyšovaní afterloadu [14].
![Kontinuálna mechanická podpora ľavej komory Heartmate II a jej zapojenie [31].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/e6558835adebf7ab53ab407144219183.png)
Indikácie LVAD ako aj taktika následnej starostlivosti sa hodnotia s ohľadom na cieľ, ktorý sa má implantáciou VAD dosiahnuť. Takýmito dvomi základnými indikáciami implantácie dlhodobých mechanických podpôr obehu je premostenie k transplantácii („bridge to transplant“) a destinačná liečba („destination therapy“). Pod pojmom premostenie k transplantácii (bridge to transplant – BTT) sa chápe klinická situácia, kedy je LVAD implantovaný pacientom, ktorí sú na čakacom liste na transplantáciu srdca. V období čakania sa však jeho stav natoľko zhorší, že na zvýšenie pravdepodobnosti dožitia sa vhodného darcu je potrebné pre udržanie cirkulácie implantovať mechanickú podporu. U pacientov, ktorí majú pravdepodobne reverzibilné alebo dočasné kontraindikácie na transplantáciu srdca (vysoká pľúcna vaskulárna rezistencia, nejasná renálna insuficiencia, nedávne malignity) sa niekedy indikuje implantácia LVAD ako premostenie k zaradeniu na čakaciu listinu („bridge to candidacy“). Pojmom destinačná liečba (destination therapy – DT) sa chápe implantácia VAD ako konečné riešenie terminálneho zlyhávania srdca. Dnešná klinická prax ukazuje, že toto triedenie je do veľkej miery umelé, pretože u čoraz viac pacientov sa pristupuje k implantácii LVAD ako primárnemu opatreniu a až neskôr sa pristupuje k rozhodnutiu o indikácii transplantácie
srdca [15].
Pri širšom používaní mechanických podporných systémov sa zistilo, že aj niektoré poškodenia myokardu, doteraz považované za nezvrátiteľné, sú po účinnej, nezriedka dlhodobej mechanickej podpore cirkulácie, reverzibilné. Po zrušení podpory môže dôjsť aj k dlhodobej stabilizácii krvného obehu a pôvodná úvaha o transplantácii nie je aktuálna. Tieto pozorovania sa vysvetľujú priaznivým účinkom odbremenenia ľavej komory („unloading“) s jej následnou reverznou remodeláciou a obnovením jej systolickej funkcie. Zotavenie („recovery“) funkcie ľavej komory sa pozoruje asi do 5 % pacientov, ktorí majú implantované LVAD pre SZ na podklade kardiomyopatie. Prebiehajú pokusy o navodenie „recovery“, kedy sa dôsledné odľahčenie ľavej komory kombinuje s intenzívnou farmakologickou liečbou v podobe vysokých dávok ACE inhíbitorov, betablokátorov, antagonistov angiotenzínových receptorov a clembuterolu. Počiatočné výsledky sú povzbudivé, širšie skúsenosti však chýbajú [16].
O implantácii VAD sa uvažuje u čakateľov na transplantáciu srdca, ktorí sú vo funkčnom štádiu NYHA IV a u ktorých sa napriek komplexnej konzervatívnej liečbe vrátane inotropnej podpory nedarí udržať prijateľnú orgánovú perfúziu. Implantácia LVAD až vo fáze multiorgánového zlyhávania sa však považuje za nevhodnú. Pokiaľ sa uvažuje o implantácii LVAD ako o konečnom riešení (destinačná liečba), je možno výkon lepšie plánovať a pacienta pripraviť.
Klinické výsledky dlhodobých mechanických podpôr ľavej komory
Prvá a jediná randomizovaná kontrolovaná štúdia zaoberajúca sa použitím implantovateľného LVAD u pacientov so srdcovým zlyhaním štádia D (Randomized Evaluation of Mechanical Assistance for the Treatment of Congestive Heart Failure Trial) porovnávala farmakoterapiu s implantáciou prístroja HeartMate XVE s pulzatilným prietokom. Štúdia preukázala jednoročné prežitie 52 % u pacientov s implantáciou oproti 25 % u farmakologicky liečených pacientov [17]. Výsledkom tejto štúdie bolo schválenie prístroja HeartMate XVE pre DT pokročilého SZ. Širšie využitie pulzatilných prístrojov obmedzili pomerne vysoká pooperačná mortalita a vysoké percento komplikácií po implantácii, ako aj technických porúch pri dlhodobom fungovaní.
Nová éra LVAD sa otvorila po zavedení novej generácie púmp, čo boli prístroje s kontinuálnym prietokom (CF LVAD). Charakteristickým rysom týchto púmp sú významne menšie rozmery. Navyše sú CF LVAD tiché alebo len minimálne hlučné či vibrujúce, poskytujú pacientom väčšie pohodlie, zvyšujú kvalitu života a znižujú riziko infekcie. Prospektívna multicentrická štúdia s 133 kandidátmi transplantácie srdca, ktorým bola implantovaná CF LVAD (HeartMate II) [18], preukázala 75% prežitie po 6 mesiacoch a 68% prežitie po 12 mesiacoch. Po tejto štúdii boli publikované aktualizované údaje o celkovo 281 pacientoch operovaných ako BTT. Po 18 mesiacoch žilo 72 % chorých [19].
Iné štúdie boli zamerané na štúdium implantácií CF LVAD u pacientov nevhodných pre transplantáciu, teda DT. V jednej z nich bolo 134 pacientov zaradených do skupiny s implantáciou CF LVAD (HeartMate II) a 66 pacientov do skupiny s implantáciou prístrojov s pulzatilním prietokom. Primárne sledovaným parametrom bolo prežívanie bez indisponujúcej cievnej mozgovej príhody (CMP) a reoperácia z dôvodu opravy alebo výmeny prístroja do 2 rokov. Dvojročné prežitie bez príhody sa dosiahlo v 58 % (CF) vs. 24 % (pulzatilné LVAD) [20]. Na základe tejto štúdie schválil FDA prístroj LVAD HeartMate II na použitie ako DT. Ďalšie štúdie vykonané po schválení prístroja opäť preukázali prednosti LVAD HeartMate II
oproti pulzatilným prístrojom u pacientov s BTT [21] aj DT [22]. V prípade DT sa dĺžka jednoročného prežitia zlepšila zo 68 % na 73 %. Podobné výsledky uviedlo niekoľko európskych pracovísk [23]. V posledných rokoch bola do klinickej praxe zavedená 3. generácia LVAD. Pumpa HeartWare je menšia a možno ju umiestniť intraperikardiálne. Krv v nej prúdi centrifugálne a rotujúci disk levituje v hydromagnetickom poli. V klinickej štúdii, ktorú vykonali Aaronson et al [24], boli takéto pumpy implantované 140 kandidátom pre transplantáciu srdca. Postimplantačný priebeh bol porovnaný s priebehom u pacientov po implantácii komerčne dostupných prístrojov. Primárne sledovaný parameter, teda úspešnosť výkonu, bol definovaný ako prežitie pri použití pôvodne implantovaného zariadenia, transplantácia alebo explantácia pre zotavenie komôr do 180 dní. Úspech bol zaznamenaný u 90,7 % pacientov s testovanou pumpou a u 90,1 % pacientov slúžiacich ako kontroly. Uvedená veľká štúdia potvrdila pozitívne výsledky predchádzajúcich menších štúdií s implantáciou týchto prístrojov v Európe i Austrálii [25].
Poslednou inováciou, ktorá prenikla do širokej klinickej praxe je LVAD HeartMate III. Ide o centrifugálnu pumpu, kde rotujúci disk levituje v plne magnetickom poli. V porovnaní so axiálnymi formami LVAD bolo 6mesačné prežívanie bez vážnej CMP alebo nutnosti náhrady pumpy 86,2 % pri HearMate III oproti 76,8 % pri použití axiálnych prístrojov (p < 0,01) [26].
Prístroje LVAD s kontinuálnym prietokom nielen zlepšujú veľmi nepriaznivú prognózu pacientov s pokročilým SZ, ale aj kvalitu ich života. Analýza štúdií s BTT a DT, do ktorých bolo zaradených viac ako 600 pacientov s implantovanou LVAD HeartMate II, preukázala, že u 82 % (BTT) a 80 % (DT) pacientov do 6 mesiacov, u 79 % (DT) do 24 mesiacov došlo k zlepšeniu na funkčný stupeň I alebo II podľa klasifikácie NYHA [27].
Otázkou ostáva, ako sa výsledky prospektívnych registračných štúdií premietnu do reálnej klinickej praxe. Podľa aktuálnych údajov z registrov sa prežívanie po implantácii LVAD pohybuje okolo 80 % v 1. roku a 70 % po 2 rokov od implantácie [28].
Mechanické podpory ľavej komory napriek všetkým komplikáciám, nárokom na ekonomiku aj prácu, získavajú čoraz väčšie uplatnenie a počet implantácií v niektorých krajinách prekračuje počet transplantácií srdca. Technika v tejto oblasti dramaticky napreduje a miniaturizuje. Asi najväčšou prekážkou na naozaj široké uplatnenie týchto metód je závislosť na pripojení k energetickým článkom prostredníctvom cez kožu vyvedeného kábla a sústavnom nosení externe uloženého príslušenstva. Intenzívne sa pracuje na plne implantabilných systémoch s možnosťou transkutánneho nabíjania implantovanej batérie. Ak tieto systémy budú v náročnom klinickom skúšaní úspešné, môžeme predpokladať revolučnú zmenu v liečbe pokročilého SZ.
Doručeno do redakce: 13. 2. 2019
Přijato po recenzi: 21. 2. 2019
doc. MU Dr. Eva Goncalvesová, CSc., FESC
Mechanická podpora ľavej komory očami pacienta
Žil som ako veľa iných ľudí, v zamestnaniu s veľkou psychickou a fyzickou záťažou, 24 hodín služby plus štúdiom. Často som pociťoval po práci chvenie a vyčerpanosť. K nahromadeniu stresu prispela aj stavba rodinného domu. Do práce 3–5 km som chodil peši, rýchlou chôdzou. Žiaden autobus, električka, každý deň okrem zlého počasia. V strave som sa vyhýbal mastným jedlám, alkoholu. Len príležitostne pri oslavách 1–2 štamperlíky, prípadne víno. Snažil som sa žiť zdravo. Chorobu som nepoznal, len každé 2 roky som robil preventívnu prehliadku. Práce stále pribúdalo a ľudí na ňu ubúdalo. Stres sa zvyšoval geometrickým radom, rôznymi administratívnymi nariadeniami a zostavovaním rôznych a zbytočných štatistík.
Po odchode zo zamestnania všetko prestalo a cítil som sa veľmi dobre, práca v záhrade, včelárenie, turistika. Žiaden stres. Po štyroch kľudných rokoch ma nahovorili, aby som v obci zobral funkciu hlavného kontrolóra. Znovu stres, nikto nebol s ničím spokojný. Boje skupiniek poslancov medzi sebou, starostom a občanmi. Kontrolór, rieš to! Po jednom a pol roku som to chcel nechať, ale ťažký infarkt ma predbehol.
Raz v noci som sa zobudil spotený a prišla na mňa slabosť. Napil som sa vody a po chvíli ma to prešlo. Ráno som mal zvýšený tlak. Nepokladal som to za niečo vážne, ale šiel som k lekárovi, kde som dostal lieky na tlak. Mali sme predplatenú týždňovú rekreáciu s manželkou a tak sme asi o 4 dni aj na ňu odišli. Mal som zvýšenú teplotu 37,3 a cítil som únavu. Po návrate som znovu zašiel za lekárom a v jeho ordinácii ma na stoličke zalial pot, skoro som padol na zem. Dostal som ťažký infarkt. Asi za 3 minúty tam bola záchranka a o ďalších 5–6 minút som už ležal v operačnej sále, kde mi prepchali všetky upchaté cievy, okrem jednej. Ostal som žiť. Dozvedel som sa, že takýto infarkt neprežije ani 5 % ľudí. Nasledovala niekoľko týždňová liečba v nemocnici. Mal som dojem, že z najhoršieho som sa dostal a žijem. Po príchode domov asi po týždni sa mi začalo zhoršovať dýchanie. Každý deň sa mi dýchalo ťažšie. Trvalo to asi týždeň, pričom posledné 2 dni som už vleže nemohol spať ani dýchať. Syn ma zaviezol ku kardiológovi a ten ma poslal ihneď do nemocnice, kde mi zistili vodu v pľúcach. Došiel som tam v poslednú chvíľu, takmer už bez nádeje. Vytiahli mi 5 litrov vody na 3krát, už bola zafarbená do červena. Po asi 3týždňovej liečbe sa mi uľavilo a odišiel som domov. Znovu som to prežil. Ale po pár dňoch sa to zopakovalo a zase som šiel do nemocnice, kde mi vytiahli asi 2,5 litra vody. Nevládal som už takmer nič. Dýchalo sa mi ťažko a už sa mi ani nechcelo, psychicky som bol na dne a cítil som, že to je koniec. Nepomohlo ani obrovské úsilie všetkých lekárov, sestier, záchranárov a ostatného personálu. Veľmi som schudol. Bol som prijatý do Národného ústavu srdcových a cievnych chorôb. Po vyšetreniach som bol hneď operovaný. Zaplátali srdce a dostal som podporný prístroj (LVAD) Heart Mate II (čerpadlo). Toto bol najväčší zlom v mojom živote. Večer pred operáciou som volal domov, rozlúčil sa s rodinou, zariadil ešte všetky potrebné veci, ako majú naložiť so mnou až bude koniec. Otec mi zomrel na rakovinu a veľmi dlho sa trápil, morfium a pod. Ja to budem mať za sebou rýchlo a bezbolestne. I keď som chcel žiť, už som v to neveril. Celú noc som nespal a hlavou sa mi premietal celý život. Na samotnú operáciu som už išiel unavený, otupený a už som to ani nevnímal. Nepamätám si z toho nič. Zobudil som sa až o 3 dni . Do izby svietilo cez okno slnko. Stratil som orientáciu o čase. Až sestrička mi vysvetlila, aký je deň a že prichádza večer. Okolo mňa bolo veľa prístrojov, hadíc, infúzií, kyslík v nose... To bol pre mňa štart do nového života. Začali prevládať nové pozitívne myšlienky. Len to všetko vydržať. Cesta bola ešte veľmi dlhá. Starostlivosť lekárov, sestričiek a celého personálu bola obrovská. Po 8 dňoch strávených na „JIS-ke,“ kde sa môj stav stabilizoval, som začal postupne chodiť. Taktiež sa začala rehabilitácia. Po čase som sám začal chodiť po chodbe oddelenia, ale len popri stene, kde som sa stále pridržiaval rukou. Na otvorené priestranstvo som sa bál s prístrojom v kapse (4,5 kg) chodiť, lebo som bol slabý a niekedy mi prichádzalo zle. V prípade pádu by to pre mňa asi bola katastrofa, poškodenie batérií a riadiacej jednotky. Na tom záležal môj život. To ma stále psychicky zaťažovalo. Stav sa však zlepšoval. Po preškolení so zaobchádzaním s prístrojom som bol po mesiaci prepustený do domáceho liečenia. Čerpadlo fungovalo bez poruchy až do transplantácie srdca. V prípade poruchy som mal záložný prístroj, ale sám doma pod psychickým tlakom sa odpojiť od batérií a zapojiť nový, neviem či by som to zvládol. Pri odpojení je to cítiť v srdci. Prepojenie musí byť veľmi rýchle.
Prvýkrát som sa z čerpadlom vybral na prechádzku po ulici asi po týždni. Prešiel som od domu 200 metrov a 200 naspäť. Cítil som sa dobre, a preto som zašiel opačným smerom ešte ďalších 100 metrov. Precenil som svoje sily, došlo mi zle a naspäť ma doviezol sused autom. V druhom prípade, pri kontrole u kardiológa, som sa zdržal dlhšie, bolo mi treba vymeniť batérie, ale tie ostali v aute. Syn odišiel autom do práce a mal pre mňa na požiadanie prísť. Boli to pre mňa veľmi dlhé chvíle v živote, začali sa mi triasť ruky a zovrel ma obrovský psychický tlak. Čakal som na ceste. V treťom prípade, asi o 2. hodine v noci, som sa prepojil od pevného kábla na batérie a šiel na WC. Po návrate som už ostal na batériách. Boli nabité a vydržať mali minimálne do 6. hodiny. Nechcelo sa mi znova prepájať, ale zaspal som, aj manželka. Batérie som mal pod paplónom. Asi o 7. hodine ma zobudila manželka, že v dome niečo slabo pípa. Až vtedy som zistil, že batérie sú takmer vybité. Na lenivosť som takmer doplatil životom. Asi 3krát v noci vypli elektrický prúd a spustil sa „ alarm“, zobudil asi aj susedov. Vďaka vedcom, ktorí skonštruovali takéto čerpadlo, a lekárom som ostal žiť. Pravidelne som chodil na kontroly.
Pri poslednej kontrole, asi po 4,5 mesiacoch, mi pri vývode kábla začalo hnisať a zostal som v nemocnici na oddelení chirurgie. Po menšom chirurgickom zákroku som sa liečil 2 týždne v nemocnici. Už som mal ísť domov, keď mi v nedeľu večer lekár oznámil, že ráno dostanem srdce. Veľmi som sa tomu potešil, pretože s čerpadlom je človek stále v strese, aby na niečo nezabudol. Po chvíli som si ale uvedomil, že teraz žijem a nič nie je na 100 %. Je to veľmi ťažká operácia a môžu nastať komplikácie. Zalial ma pot. Po nejakých 15 minútach došla sestrička odobrať mi krv do 8–10 ampuliek na rozbor. Ani po štvrtom pokuse zo mňa nedostala ani kvapku. Musel som sa uvoľniť zo stresu. Pochodil som po chodbách nemocnice a pozeral na nočnú Bratislavu. Až potom sestrička bez problémov odobrala krv. Dostal som tabletku na spanie a všetko už išlo bez problémov. Operácia trvala cca 9 hodín. Zobudil som sa niekedy v noci. Čerpadlo bolo preč. V hrudi mi bilo cudzie srdce. Už som nepočul za tichej noci bzukot čerpadla. Bol som ale zase napojený na 11 hadíc. Stav sa ale rýchlo zlepšoval a po 7 dňoch som už normálne chodil . Môj stav od tejto doby sa neustále zlepšuje. Denne prejdem 3–5 km, niekedy aj viac. Robím bežné práce okolo domu. Žijem životom bežného človeka. Užívam pravidelne lieky, riadim sa pokynmi lekárov. Chodím na pravidelné kontroly.
Zo začiatku som si myslel, že som mal veľké šťastie, a preto som ostal žiť. Ale po takmer 5 mesiacoch strávených v nemocniciach som zistil, že to bola len malá kvapka šťastia. Boli to vysoko kvalifikovaní lekári, zdravotné sestry, ostatný personál, záchranári, darcovia krvi, darca srdca a transplantačný program. Náhoda tam neprichádza do úvahy. Je tam vysoká zodpovednosť všetkých týchto ľudí ako celku. Stačí zabudnúť na maličkosť, a výsledok je smrť pacienta.
Ďakujem všetkým, ktorí sa podieľajú na záchrane všetkých pacientov. Spoznal som ich veľmi veľa. Keď k ním chodím na pravidelné kontroly, idem ako do druhého domova k dobrým známym. Vďaka darcovstvu ľudských orgánov som ostal žiť. Ďakujem jemu aj jeho rodine. Jeho srdce nahradilo moje. Teda žije aj časť z neho. Nech tento môj životný príbeh slúži na výstrahu ostatným. Na to, kde všade som urobil chybu, príde asi každý sám.
Zapsala
doc. MU Dr. Eva Goncalvesová, CSc., FES
Sources
1. Studenčan M, Jesenský T, Notovný R et al. Perkutánna mechanická podpora obehu u 21-ročnej ženy s kardiogénnym šokom. Cardiol 2008; 17(2): 86–89.
2. Pacák J, Fridrich V, Zelenay J et al. Perkutánny dočasný mechanický ľavokomorový podporný obeh Impella Recover LP 2. 5. pri rizikovej perkutánnej koronárnej intervencii. Opis prvej skúsenosti na Slovensku. Cardiol 2007; 16(4): 172–176.
3. Werdan K, Gielen S, Ebelt H et al. Mechanical circulatory support in cardiogenic shock. Eur Heart J 2014; 35(3): 156–167. doi: 10.1093/ eurheartj/ eht248.
4. Unverzagt S, Machemer MT, Solms A et al. Intra-aortic balloon pump counterpulsation (IABP) for myocardial infarction complicated by cardiogenic shock. Cochrane Database Syst Rev 2011; (7): CD007398. doi: 10.1002/ 14651858.CD007398.pub2.
5. de Waha S, Desch S, Eitel I et al. What is the evidence for IABP in STEMI with and without cardiogenic shock? Ther Adv Cardiovasc Dis 2012; 6(3): 123–132. doi: 10.1177/ 1753944712446669.
6. Sjauw KD, Engstrom AE, Vis MM et al. A systematic review and meta-analysis of intra-aortic balloon pump therapy in ST-elevation myocardial infarction: should we change the guidelines? Eur Heart J 2009; 30(4): 459–468. doi: 10.1093/ eurheartj/ ehn602.
7. Thiele H, Zeymer U, Neumann FJ et al. Intra-aortic balloon counterpulsation in acute myocardial infarction complicated by cardiogenic shock (IABP-SHOCK II): final 12 month results of a randomised, open-label trial. Lancet 2013; 382(9905): 1638–1645. doi: 10.1016/ S0140-6736(13)61783-3.
8. Lemaire A, Anderson MB, Lee LY et al. The Impella device for acute mechanical circulatory support in patients in cardiogenic shock. Ann Thorac Surg 2014; 97(1): 133–138. doi: 10.1016/ j.athoracsur.2013.07.053.
9. Dangas GD, Kini AS, Sharma SK et al. Impact of hemodynamic support with Impella 2. 5 versus intra-aortic balloon pump on prognostically important clinical outcomes in patients undergoing high-risk percutaneous coronary intervention (from the PROTECT II randomized trial). Am J cardiol 2014; 113(2): 222–228. doi: 10.1016/ j.amjcard.2013.09.008.
10. Flaherty MP, Pant S, Patel SV et al. Hemodynamic support with a microaxial percutaneous left ventricular assist device (Impella) protects against acute kidney injury in patients undergoing high-risk percutaneous coronary intervention. Circ Res 2017; 120(4): 692–700. doi: 10.1161/ CIRCRESAHA.116.309738.
11. Ouweneel DM, Eriksen E, Sjauw KD et al. Percutaneous mechanical circulatory support versus intra-aortic balloon pump in cardiogenic shock after acute myocardial infarction. J Am Coll Cardiol 2017; 69(3): 278–287. doi: 10.1016/ j.jacc.2016.10.022.
12. Ošťádal P, Bělohlávek J. ECMO – Extrakorporální membránová oxidace. 1. vyd. Praha: Maxdorf 2013.
13. Nagpal AD, Singal RK, Arora RC et al. Temporary mechanical circulatory support in cardiac critical care: a state of the art review and algorithm for device selection. Can J Cardiol 2017; 33(1): 110–118. doi: 10.1016/ j.cjca.2016.10.023.
14. Lee S, Fukamachi K, Golding L et al. Left ventricular assist devices: from the bench to the clinic. Cardiology 2013; 125(1): 1–12. doi: 10.1159/ 000346
865.
15. Goncalvesová E, Hulman M, Olejárová I et al. Iniciálne skúsenosti s implantabilnými mechanickými podporami ľavej komory v programe transplantácie srdca v Národnom ústave srdcových a cievnych chorôb. Cardiol 2008; 17(3): 101–108.
16. Birks EJ, George RS, Hedger M et al. Reversal of severe heart failure with a continuous-flow left ventricular assist device and pharmacological therapy: a prospective study. Circulation 2011; 123(4): 381–390. doi: 10.1161/ CIRCULATIONAHA.109.933960.
17. Rose EA, Gelijns AC, Moskowitz AJ et al. Long-term use of a left ventricular assist device for end-stage heart failure. N Engl J Med 2001; 345(20): 1435–1443. doi: 10.1056/ NEJMoa012175.
18. Miller LW, Pagani FD, Russell SD et al. Use of a continuous-flow device in patients awaiting heart transplantation. N Engl J Med 2007; 357(9): 885–896. doi: 10.1056/ NEJMoa067758.
19. Pagani FD, Miller LW, Russell SD et al. Extended mechanical circulatory support with a continuous-flow rotary left ventricular assist device. J Am Coll Cardiol 2009; 54(4): 312–321. doi: 10.1016/ j.jacc.2009.03.055.
20. Slaughter MS, Rogers JG, Milano CA et al. Advanced heart failure treated with continuous-flow left ventricular assist device. N Engl J Med 2009; 361(23): 2241–2251. doi: 10.1056/ NEJMoa0909938.
21. John R, Naka Y, Smedira NG et al. Continuous flow left ventricular assist device outcomes in commercial use compared with the prior clinical trial. Ann Thorac Surg 2011; 92(4): 1406–1413. doi: 10.1016/ j.athoracsur.2011.05.080.
22. Park SJ, Milano CA, Tatooles AJ et al. Outcomes in advanced heart failure patients with left ventricular assist devices for destination therapy. Circ Heart Fail 2012; 5(2): 241–248. doi: 10.1161/ CIRCHEARTFAILURE.111.963991.
23. Strüber M, Sander K, Lahpor J et al. HeartMate II left ventricular assist device; early European experience. Eur J Cardiothorac Surg 2008; 34(2): 289–294. doi: 10.1016/ j.ejcts.2008.05.011.
24. Aaronson KD, Slaughter MS, Miller LW et al. Use of an intrapericardial, continuous-flow, centrifugal pump in patients awaiting heart transplantation. Circulation 2012; 125(25): 3191–3200. doi: 10.1161/ CIRCULATIONAHA.111.058412.
25. Strueber M, O'Driscoll G, Jansz P et al. Multicenter evaluation of an intrapericardial left ventricular assist system. J Am Coll Cardiol 2011; 57(12): 1375–1382. doi: 10.1016/ j.jacc.2010.10.040.
26. Rogers JG, Aaronson KD, Boyle AJ et al. Continuous flow left ventricular assist device improves functional capacity and quality of life of advanced heart failure patients. J Am Coll Cardiol 2010; 55(17): 1826–1834. doi: 10.1016/ j.jacc.2009.12.052.
27. Mehra MR, Naka Y, Uriel N et al. A fully magnetically levitated circulatory pump for advanced heart failure. N Engl J Med 2017; 376(5): 440–450. doi: 10.1056/ NEJMoa1610426.
28. Kirklin JK, Naftel DC, Pagani DF et al. Seventh INTERMACS annual report: 15,000 patients and counting. J Heart Lung Transplant 2015; 34(12): 1495–1504. doi: 10.1016/ j.healun.2015.10.003.
29. Yourex-West H. TandemHeart’ helps make high-risk heart patients strong enough for surgery. Global News 2017. Available at: https:/ / globalnews.ca/ news/ 3369545/ tandemheart-helps-make-high-risk-heart-patients-strong-enough-for-surgery.
30. Takeda K, Garan AR, Ando M et al. Minimally invasive CentriMag ventricular assist device support integrated with extracorporeal membrane oxygenation in cardiogenic shock patients: a comparison with conventional CentriMag biventricular support configuration. Eur J Cardiothorac Surg 2017; 52(6): 1055–1061. doi:10.1093/ ejcts/ ezx189.
31. Casida J, Pagani FD, Aikens J. An evaluation of mobile care app as self-management tool in patients with left-ventricular assist devices. SSCD Center 2019. Available at: http:/ / www.socr.umich.edu/ CSCD/ html/ Projects/ PP1.html.
Labels
Paediatric cardiology Internal medicine Cardiac surgery CardiologyArticle was published in
Cardiology Review

2019 Issue 2
Most read in this issue
- Beta-blockers in cardiovascular diseases – Pros and Cons
- Update of the role of Lp(a) in determination of the CV risk and methods of influencing it
- Mechanical circulatory supports – basic principles and clinical evidence
- News about familial hypercholesterolaemia for cardiologists
