Hyponatrémie – frekvence, příčiny, patobiochemie, klinika a terapie
Hyponatremia – Frequency, Causes, Pathobiochemistry, Clinics and Therapy.
Objective:
Presentation of the current knowledge of hyponatremias in terms of their causes, frequency and pathobiochemical connections in development and treatment of these disbalances
Study type:
Synoptic
Settings:
Institute of Medical Biochemistry and Laboratory Diagnostics, First Faculty of Medicine and General University Hospital, Prague
Material and Methods: Based on the study of global literature is in the survey the frequency and prognostic importance of hyponatremia evaluated. Its hypotonic and non-hypotonic forms are described as well as pathophysiological consequences for the brain and clinical signs. The therapeutic proceedings are mentioned together with accompanying risks. It is referred about the problems of hyponatremia in neurointensive care, in older age and in the relation to the health of bones.
Results:
The frequency of hyponatremia in three large sets of patients admitted to ICU of various specialisations was between 10.0 % till 17.1 %. Its value is given by decreased relation of sodium supply in extracellular fluid (ECF) and size of ECF. Hyponatremia causes the decrease of osmolality – hypotonic form. If there are contemporary present another osmotically effective solutes in ECF (glucose, mannitol) they cause the shift of water from the cells to the ECF and natremia is diluted – non-hypotonic form. Decreased osmolality of ECF accompanying hyponatremia leads to the shift of water to the cells. The brain is therefore swelling and hyponatraemic encephalopathy develops. The clinical signs and prognostic significance of this evolution are described in relation to the categorization of natrium decrease. Brain compensates this disturbance by decreasing the content of ions and small organic molecules in its cells. Therapeutic proceedings are described. The rate of correction has to respect the time, necessary for the restoration if eliminated osmotically active particles back in brain cells. Maximal elevation of hyponatremia is 10 mmol/l/day and in risk patients yet less. More rapid correction is risk for brain demyelinisation. Differential diagnosis and treatment of hyponatremia is described in neurointensive care. It is referred about increased frequency of hyponatremia and its consequences in elder age and about its relation to bone fracture and osteoporosis.
Conclusion:
Hyponatremia is connected with more severe pathobiochemical changes and accompanied by elevated morbidity and mortality.
Keywords:
hyponatremia, encephalopathy, body fluids, cerebral salt-wasting syndrome, syndrome of inappropriate antidiuretic hormone secretion.
:
A. Kazda
:
Ústav lékařské biochemie a laboratorní diagnostiky 1. LF UK a VFN, Praha
:
Klin. Biochem. Metab., 26, 2018, No. 4, p. 157-165
Cíl studie:
Zpracovat aktuální znalosti o hyponatrémii z hlediska jejích příčin, frekvence a patobiochemických souvislostí při vývoji a léčení této iontové dysbalance.
Typ studie:
Přehledná práce.
Název a sídlo pracoviště: Ústav lékařské biochemie a laboratorní diagnostiky 1. LF UK a VFN, Praha.
Materiál a metody:
Na základě studia literatury je v přehledné práci hodnocena frekvence a prognostická závažnost hyponatrémie. Jsou uvedeny její formy hypotonická i nehypotonická, patofyziologické následky hyponatrémie pro mozek a její klinické příznaky. Jsou popsány terapeutické postupy a jejich rizika. Je referováno o problematice hyponatrémie v neurointenzivní péči, ve vyšším věku a ve vztahu ke zdraví kostí.
Výsledky:
Frekvence hyponatrémie se ve třech rozsáhlých souborech nemocných, akutně přijímaných na jednotky intenzivní péče různých klinických oborů, pohybovala mezi 10,0 % až 17,1 %. Její hodnota je dána poklesem vztahu mezi množstvím Na+ v extracelulární tekutině (ECT) a velikosti ECT. Hyponatrémie vede k poklesu osmolality v ECT – forma hypotonická. Jsou-li ale v ECT současně přítomny jiné osmoticky efektivní soluty (glukóza, manitol), vedou k přesunu vody z buněk do ECT a natrémie klesá – hyponatrémie nehypotonická. Pokles osmolality ECT provázející vývoj hyponatrémie vede k přesunu vody do buněk. Vzniká edém mozku a hyponatrémická encefalopatie. Jsou popsány klinické příznaky poruchy a její prognostická závažnost vzhledem ke kategorizaci tíže hyponatrémie. Mozek vzniklou situaci kompenzuje snížením vodu vázajících částic, iontů a malých organických molekul. Jsou popsány terapeutické postupy při korekci poruchy, jejíž úprava musí respektovat čas, nutný pro zpětné doplnění deficitu iontů a organických částic do mozkových buněk. Nevhodně rychlá korekce je rizikem vývoje demyelinisace mozku. Aktuálně doporučované rychlosti úpravy jsou z tohoto důvodu proti minulosti omezeny. Maximum zvýšení natrémie je o 10 mmol/l/den a u rizikových nemocných 6 mmol/l/den. Je popsána problematika hyponatrémií v neurointenzivní péči a význam klinicko-biochemického vyšetření pro jejich diferenciální diagnostiku. Je referováno o vyšších frekvencích a možných následcích hyponatrémie u starších osob. V návaznosti na to jsou popsány vztahy mezi hyponatrémií a rizikem kostních fraktur a osteoporózy.
Závěr:
Hyponatrémie je spojena s řadou závažných patobiochemických změn a s následnou vyšší morbiditou i mortalitou.
Klíčová slova:
hyponatrémie, encefalopatie, tělesné tekutiny, syndrom cerebrální ztráty soli, syndrom nevhodné sekrece antidiuretického hormonu.
Úvod
Frekvence dysnatrémií je sledována v rozsáhlých multicentrických studiích. Rakouská studie hodnotila natrémie při příjmu na 77 jednotek intenzivní péče (JIP) u celkem 151 486 nemocných [1]. Z výsledků v Tabulce 1 vyplývá vyšší frekvence nálezů hyponatrémie než hypernatrémie. Mortalita se s tíží dysnatrémie jednoznačně zvyšuje a u hypernatrémických nemocných je vždy vyšší než u hyponatrémických.
![Dysnatremia at admission on ICU.151 486 patients, 77 ICU internal, surgical and mixed. Mortality of the patients with
normonatremia 9,7 % [1]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/1904370c7a80d4603a328afabb317ba3.jpeg)
Další studie, německá, hodnotila dysnatrémie při příjmu u 10 923 nemocných chirurgických JIP. Hodnoty S-Na+ < 135 mmol/l byly zjištěny v 11,2 % a > 145 mmol/l v 2,5 %. Během hospitalizace se u zbývajících 9 431 nemocných vyvinula dysnatrémie ve 31,3 %. Jak dysnatrémie při příjmu, tak i vzniklé během hospitalizace, byly v nezávisle významném vztahu k riziku úmrtí. U dysnatrémií při příjmu bylo ale riziko úmrtí ještě významnější než při vzniku během hospitalizace. Také fluktuace S-Na+ > 6 mmol/l v rámci referenčního rozmezí byla spojena s horší prognózou [2].
Další studie je z pracovišť urgentního příjmu ve Švýcarsku a Rakousku. U 43 911 nemocných byla při příjmu zjištěna S-Na+ < 135 mmol/l v 10,0 %, < 121 mmol/l v 0,4 %, hodnoty > 145 mmol/l ve 2,0 % a > 149 mmol/l v 0,2 % [3].
Natrium je základní elektrolyt v organismu. Natrémie (S-Na+) je udržována díky bilanci příjmu a výdeje Na+ a vody mezi 135 až 145 mmol/l. Koncentrace v extracelulární tekutině (ECT) je 10x vyšší než v intracelulární tekutině (ICT).
Na+ se podílí na regulaci dvou základních oblastí vnitřního prostředí.
- Spolu s odpovídajícími anionty tvoří 85 % osmotické aktivity ECT.
- Spolu s odpovídajícími anionty se podílí na acidobazické rovnováze.
Následky: snížení S-Na+ acidifikuje (ve sloupci aniontů klesá prostor pro HCO3-), zvýšení S-Na+ naopak alkalizuje.
Schéma tří prostorů tělesných tekutin a pohybů komponent, které určují osmolalitu séra je uvedeno na obr. 1. Vyplývá z něj, že voda stejně jako močovina, procházejí volně kapilární stěnou i buněčnou membránou. Na+ i glukóza procházejí volně pouze kapilární stěnou. Jejich zvýšení stejně jako snížení S-Na+ mají za následek vznik osmotického gradientu mezi ECT a ICT. Proto jsou označovány jako osmoticky efektivní. Aby se osmolality mezi prostory tělesných tekutin znovu vyrovnaly, musí při hyponatrémii dojít k přesunu vody z ECT do ICT (obr. 2) a při hypernatrémii nebo hyperglykémii naopak k přesunu vody z ICT do ECT.
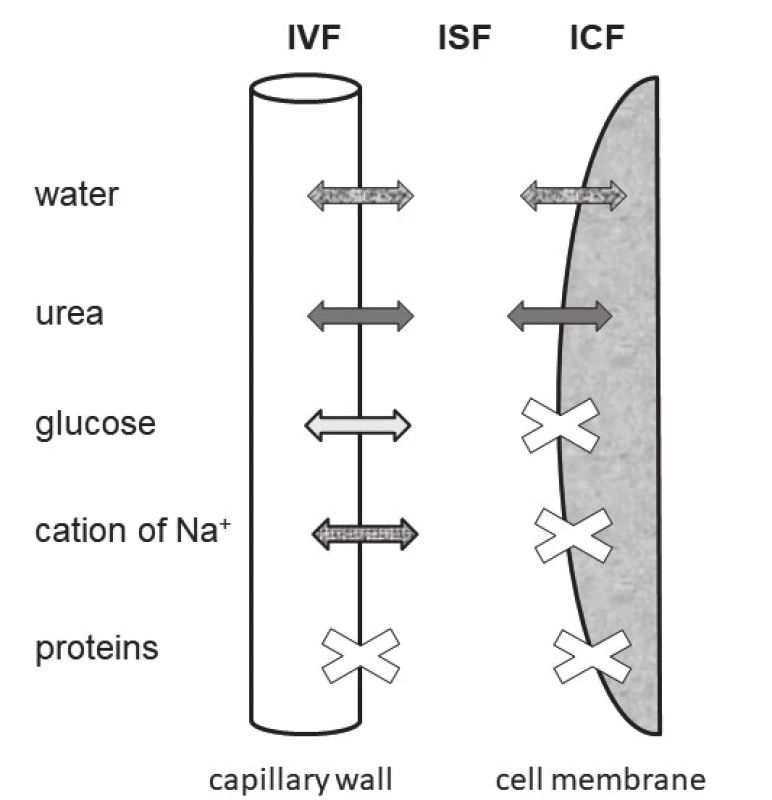
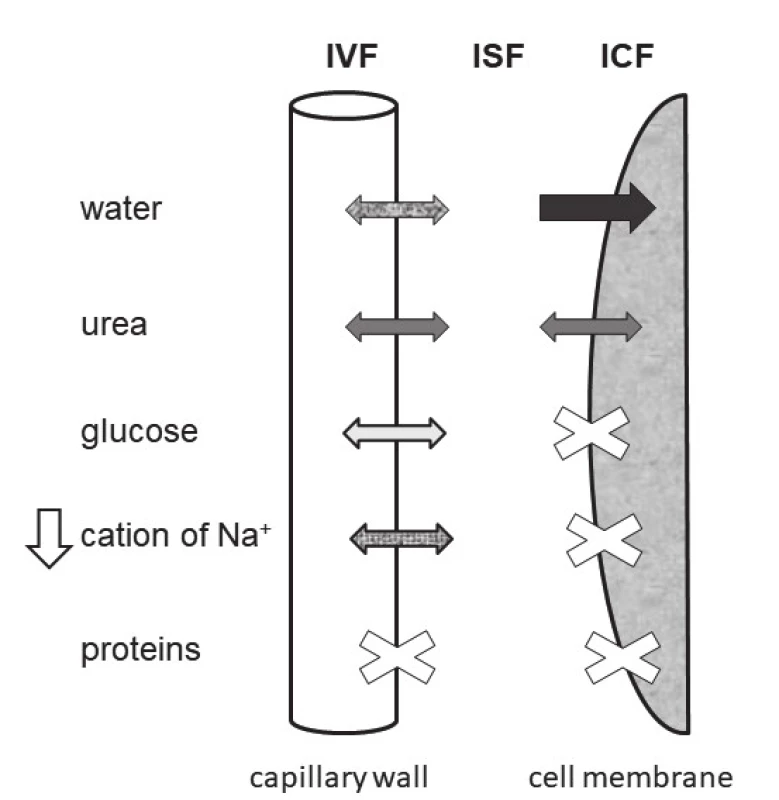
Hyponatrémie
K hyponatrémii vedou stavy, kdy se mění poměr mezi množstvím Na+ v ECT a velikostí ECT v neprospěch Na+. Zásoba Na+ může přitom být snížená, fyziologická, ale i zvýšená, pokud se objem vody zvýšil ještě více. Pro správnou diagnózu musí být tedy kromě laboratorního nálezu vždy hodnocena také anamnéza a klinický stav.
Hyponatrémie je buď provázena hypoosmolalitou = hypotonická nebo normoosmolalitou či hyperosmolalitou = nehypotonická.
Příčiny hyponatrémie jsou prezentovány ve vztahu k osmolalitě a oběhové náplni následovně.
Hypotonická hyponatrémie
- Hypovolemická: deficit vody i Na+, deficit Na+ je větší. Příčiny renální: diuretika (thiazidy), osmotická diuréza (glykosurie), insuficience nadledvin, syndrom cerebrální ztráty soli (cerebral salt wasting syndrome - CSWS), sůl ztrácející nefropatie. Příčiny mimorenální: ztráty potu hrazené vodou, zvracení, průjem, únik tekutin do 3. prostoru.
- Euvolemická: deficit Na+ bez deficitu vody. Příčiny: hypothyreoidismus, syndrom nevhodné sekrece antidiuretického hormonu (syndrome of inappropriate secrection of antidiuretic hormone – SIADH), akutní psychózy, pooperační stres a léky zvyšující produkci ADH nebo zesilující jeho renální efekt – viz dále.
- Hypervolemická: obsah Na+ může být i zvýšen, ale objem ECT je zvýšen více. Příčiny: selhání srdeční, jaterní, nefrotický syndrom [4-7].
Hodnocení příčin hypotonické hyponatrémie
Příspěvek hodnocení osmolality moče a Na+ v moči (U-Na+) k diagnóze příčin hypotonické hyponatrémie [5]:
- Močová osmolalita <100 mmol/l.
- a. Primární polydipsie.
- b. Zvýšená konzumace piva.
- Močová osmolalita >100 mmol/l.
- a. 1. Hypovolemie, U-Na+ <30 mmol/l = extrarenální ztráty: průjem, zvracení, popáleninové trauma, pankreatitis, trauma.
2. Hypovolemie, U-Na+ >30 mmol/l = renální ztráty: diuretika, deficit mineralokortikoidů, sůl ztrácející nefropatie, CSWS. bikarbonáturie. - b. Euvolemie, U-Na+ >30 mmol/l: SIADH, léky, stres, bolest, nevolnost, deficit glukokortikoidů, hypotyreóza.
- c. 1. Hypervolemie, U-Na+ <30 mmol/l: nefrotický syndrom, chronické srdeční selhání, cirhóza.
2. Hypervolemie, U-Na+ >30 mmol/l: renální insuficience.
Poznámka: alternativa euvolemie, U-Na+<30 mmol/l není uvažována.
Léky ovlivňující homeostázu vody a Na+ k vývoji hyponatrémie
Přehled těchto léků je uveden v Tabulce 2 [5, 8]. K tomuto výčtu zde poznámka: někteří autoři uvádějí i ACE inhibitory, blokátory receptoru angiotensinu a inhibitory protonové pumpy [4, 10].
![Causes of the syndrome of inappropriate antidiuretic hormone secretion (SIADH) [5, 8, 30]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/adfefb3fd3a7375020e3e3265165827d.jpeg)
Hyponatrémie nehypotonická
Může být provázena nejen normo - i hyperosmolalitou. Vzniká z přítomnosti osmoticky efektivních částic, které přetahují vodu z ICT do ECT, a tím ředí S-Na+.
Příčiny: hyperglykémie, infuze manitolu, i.v. podání hyperosmolálních látek radiokontrastních. Přesun vody z ICT do ECT při zvýšení glykémie o 5,5 mmol/l vede k přesunu vody z ICT do ECT a naředění S-Na+ o 1,5 mmol/l [7]. Přítomnost endogenních solutů (hyperlipidemie, monoklonální gamapatie) vede k falešnému snížení S-Na+, k tzv. pseudohyponatrémii při měření Na+ plamenovou fotometrií. Při měření ion selektivní elektrodou toto zkreslení nevzniká [11, 12].
Na obr. 3 je prezentována názorná ukázka vztahu mezi hyperglykémií a S-Na+. Diabetik 23 let byl přijat na metabolickou jednotku 3. interní kliniky VFN po několikadenním abúzu alkoholu v hlubokém bezvědomí, anurický, v dehydrataci a v šokovém stavu. Při snižování hyperglykémie se voda vrací z ECT do ICT a S-Na+ se prudce zvyšuje. Např. mezi prvním a pátým vyšetřením klesla glykémie z hodnoty 107,6 mmol/l na 39 mmol/l a S-Na+ se zvýšilo ze 127 mmol/l na 162 mmol/l. Tato prudká změna nemění ale dramaticky osmolalitu, která se z hodnoty 395 mmol/kg H2O snížila pouze na 387 mmol/kg H2O. Kdyby nebyl nemocný těžce dehydrován, byla by výchozí natrémie ještě nižší a po úpravě glykémie by se vracela do referenčního rozmezí. Rozdíl mezi měřenou a vypočítanou osmolalitou (při 3. vyšetření) je zřejmě zaviněn přetrvávající hladinou alkoholu v krvi, kterou neznáme. Tak rychlá změna natrémie by sama o sobě vedla k demyelinizačním projevům (viz dále), ale protože současně klesala glykémie, osmolalita se mění jen zvolna. Nemocný byl po týdenní hospitalizaci propuštěn v dobrém stavu [13].
Definice hyponatrémie
V roce 2014 publikovaly tři evropské společnosti (European Society of Intensive Care Medicine, European Society of Endocrinology a European Renal Best Practice) pokyny pro diagnózu a léčení hyponatrémie, které jsou aktuálním užitečným zdrojem informací v této problematice [14].
Podle těchto pokynů je hyponatrémie definována následovně.
Podle poklesu: mírná 130-135 mmol/l, střední 125-129 mmol/l, těžká <125 mmol/l.
Podle trvání: akutní - trvá < 48 h. a chronická - trvá > 48 h.
Podle příznaků: středně těžká - nevolnost (ne zvracení), zmatenost, bolest hlavy a těžká - zvracení, kardiorespirační potíže, somnolence, křeče, kóma (Glasgow Coma Scale ≤ 8). Protože je tento výčet příznaků poměrně stručný, jsou příznaky dále uvedeny ještě v širším rozsahu obvyklém v pracích o hyponatrémii [4, 5, 15].
Příznaky poklesu efektivní osmolality
Typické příznaky jsou neurologické při zvýšení nitrolebního tlaku a edému mozku.
Subjektivní: poruchy chování jako dezorientace, letargie, apatie, ale i agitovanost, bolesti hlavy, anorexie až nauzea.
Objektivní: senzorické poruchy, snížené reflexy, křeče, pseudobulbální parézy a hlubší poruchy vědomí vedoucí s progresí stavu do kómatu. Je nebezpečí herniace mozkového kmene. Je uváděno i Cheyne-Stokesovo dýchání a hypotermie.
Příznaky jsou dříve u starých lidí a dětí. Riziková skupina – alkoholici, nemocní s hepatopatií, v malnutrici a premenopauzální ženy (estrogeny zvyšují sekreci ADH).
Hyponatremická encefalopatie (HNE)
Laboratorní hodnoty, při nichž je porucha symptomatická, se liší v závislosti na rychlosti poklesu S-Na+. Při akutním vzniku hyponatrémie je to již při hodnotách S-Na+ < 130 mmol/l a S-Osm < 271 mmol/kg. Při vícedenním vývoji až při S-Na+ < 120 mmol/l a S-Osm < 250 mmol/kg. Rozdíl je dán mozkovou kompenzací, jejíž vývoj je závislý na čase. I minimální změny buněčného objemu centrálního nervového systému mohou mít dramatické příznaky. Mnohé buněčné funkce, např. enzymatické aktivity, závisejí na objemu buněk a na iontovém složení cytoplazmy.
Adaptace mozkových buněk na hypoosmolalitu
Mozkové buňky vyvinuly několik mechanismů, kterými čelí ničivému efektu hypotonicity ECT na buněčný objem. Cílem je návrat k původnímu objemu. Při hyponatrémii dochází k vypuzování nitrobuněčných osmoticky efektivních solutů, které jsou provázeny ztrátou vody, a tím je omezován vzniklý buněčný otok.
Časné mechanismy adaptace mozku na hyponatrémii
Již během prvních minut hyponatrémie se zvyšuje hydrostatický tlak vytlačující vodu do likvoru a později do systémové cirkulace. Dalším stupněm adaptace je únik iontů z ICT do ECT. Během prvních hodin významně klesají Na+, Cl- a K+, přičemž Na+ a Cl- opouštějí mozkové buňky rychleji než K+. Deplece iontů z buněk mozku dosahuje asi 18 % v širokém rozsahu hyponatrémie. Významnou roli hrají i organické osmolity. Jsou to myoinositol, betain, glutamin, taurin a kyselina gama-aminomáselná. Jejich význam se uplatňuje pomaleji a maxima poklesu je dosaženo do 48 hod. od vzniku hyponatrémie. Podíl elektrolytů v regulaci objemu mozku při chronické hyponatrémii je asi 70 %, zbývajících 30 % je zajištěno ztrátou organických osmolitů. Po její korekci se ztracené osmolity opět v mozkových buňkách doplňují. Tato reakumulace je rychlejší pro elektrolyty než pro organické osmolity, pro které trvá i nad pět dní. To může mít úlohu v patofyziologii osmotického demyelinizačního syndromu (ODS) - viz dále [5, 15].
Klinické manifestace neurologických dysfunkcí jsou ve vztahu ke kapacitě mozkové adaptace, rychlosti vývoje a k tíži hyponatrémie. Akutní hyponatrémie těžká stejně jako chronická indukuje drastičtější příznaky, až křeče a kóma. Hypoxie zhoršuje HNE. Otok mozku v něm utlačuje cévní řečiště, již to přispívá k hypoxii mozku. Ta může vést k neurogennímu otoku plic a ten dále zhoršuje dodávku kyslíku do mozku. Pokud je vývoj hyponatrémie pomalý (třeba až k extremním hodnotám <100 mmol/l), nemusí dojít k edému mozku ani bezprostřednímu zvýšení mortality. Existují zřejmě další mechanismy, neaktivované během akutní hyponatrémie, které se v prevenci edému mozku uplatní při jejím chronickém zhoršování [15].
Příznaky HNE
Vznikají z komprese parenchymu mozku v tvrdé lebce – základní popis viz výše. Při akutní těžké hyponatrémii, kdy mozek nemá čas se přizpůsobit, hrozí jeho herniace a smrt, které předcházejí křeče a kóma. Ale i mírná akutní hyponatrémie, např. u maratonských běžců, může vést k nevolnosti, zvracení a zmatenosti, které ustoupí po korekci S-Na+. Akutní těžká hyponatrémie může být fatální, až u 60 % postižených hrozí náhlá zástava dýchání. Úprava S-Na+ tuto prognózu zlepšuje.
Chronická hyponatrémie se obvykle projevuje nevolností, slabostí, zmateností a bolestmi hlavy. Do nedávna byla mírná chronická hyponatrémie považována za asymptomatickou, ale detailnější studie prokázaly, že je spojena s jemnými neurologickými abnormalitami, jako jsou deficit pozornosti, nejistota při chůzi a pády. Některé z těchto příznaků se po korekci S-Na+ upraví. Fyzio-logický základ chronické HNE začíná být osvětlován. Např. absorpce glutamátu astrocyty je v experimentu u hyponatremických krys zhoršena. Přitom glutamát působí jako neurotransmiter zapojený do ovládání chůze. Mozkové buňky při kompenzaci opouští také taurin působící proti křečím v experimentu u hyponatremických krys. To, že tyto organické osmolity opouštějí mozek, může mít úlohu v HNE [4, 16, 15].
Terapie hyponatrémie
Jde-li o akutní poruchu, tj. do 1 až 2 dnů po začátku, lze zvyšovat S-Na+ maximálně o 1 až 2 mmol/l/h. Trvá-li stav déle, je rychlost úpravy S-Na+ jen o 0,5 mmol/l/h. Rychlost korekce S-Na+ mmol/dny: maximálně o 10 mmol/l za prvních 24 h., a o dalších 8 mmol/l za každých dalších 24 h. Kromě dávky korekční vždy uvážit i dávku substituční, tj. krytí průběžných denních ztrát Na+ sondami, drény apod.
Mimořádná situace nastává při nutnosti korigovat hyponatrémii s příznaky středně těžkými a těžkými.
Postup je následovný:
- i.v. infuze 150 ml 3% NaCl během 20 min., kontrola S-Na+,
- hned podat stejnou infuzi 3% NaCl 20 min., kontrola S-Na+,
- totéž opakovat do zvýšení S-Na+ o 5 mmol/l.
Pozn.: přesnější dávkování je 2 ml 3% NaCl na kg tělesné hmotnosti, tato dávka zvýší S-Na+ o cca 1,5 mmol/l, i zde platí limity zvýšení/24 h. uvedené výše.
- následují kontroly S-Na+ po 6-12 h. do dosažení stabilizace,
- hradit ztráty Na+ tělesnými sekrety,
- přerušit medikaci a další faktory vedoucí k hyponatrémii [14, 11]. Zvýšení natrémie o 5-6 mmol/l sníží nitrolební tlak o 5-10 mm Hg. Předpokládá se, že toto zvýšení snižuje riziko mortality [4, 14, 17].
Další terapeutická upřesnění s ohledem na objem cirkulujících tekutin
- Hypovolemická hyponatrémie: cirkulující objem upravit infuzí 0,9% NaCl, nebo bilancovanými krystaloidními roztoky rychlostí 0,5-1,0 ml/kg/h. Úprava objemu odstraní důvod k vyšší sekreci ADH. Podání K+ přispěje k přesunu Na+ z ICT do ECT, a tím k zvýšení S-Na+.
- Hypervolemická hyponatrémie: omezení příjmu tekutin pod 1000 ml/d. a kličková diuretika.
- Euvolemická hyponatrémie: omezit příjem tekutin, malé dávky kličkových diuretik, NaCl p.o., ureu 0,25-0,50 g/kg/den. Podrobnější popis terapie viz dále u SIADH (nejčastější příčiny hypovolemické hyponatrémie).
Vaptany
Jsou to perorální antagonisté vasopresinu, které blokují v ledvinách jeho V2 receptory. Výsledkem je zvýšení diurézy a úprava hyponatrémie. Nejdříve byly užívány v USA, od r. 2009 i v některých evropských státech. Protože u nás užívány nejsou, je následující zmínka o nich uvedena pouze pro komplexnost informovanosti čtenáře. V zahraničních publikacích s tématikou léčení hyponatrémie se s jejich problematikou setkáváme velmi často.
Americké a evropské názory odborníků na použití vaptanů u hyponatrémie se liší. V USA (kde je užíván i přípravek pro i. v. podání) je doporučováno užití vaptanů u netěžké hyponatrémie při SIADH, cirhóze a srdečním selhání, pokud byla neúspěšná předchozí léčba s restrikcí vody [5, 6, 17, 18]. Evropští experti nesouhlasí s užitím u SIADH a varují před užitím u cirhózy a srdečního selhání. Upozorňují na nedostatek důkazů prognostického zisku podání vaptanů, na možné vztahy k dysfunkci jater a na riziko nadměrné korekce S-Na+. Někteří tuto léčbu přímo odmítají [14, 19]. Přesto se i v pracích evropských autorů s jejich vymezenými indikacemi setkáváme [10, 11, 15].
Výpočet množství Na+ potřebného k dosažení cílové natrémie:
mmol Na+ = kg x f x (S-Na+ cílové – S-Na+ zjištěné)
f = 0,60 u mužů a 0,55 u žen
Příklad: muž, 70 kg, S-Na+ 115 mmol/l, chceme zvýšit S-Na+ o 8 mmol/l/den, tj. na 123 mmol/l
mmol Na+ = 70 x 0,6 x (123 – 115) = 336
Podle následujícího vzorce lze také vypočítat, o kolik se zvýší S-Na+ (∆ [Na+]) po infuzi 1000 ml hypertonické tekutiny [14]:
CTV = celková tělesná voda v litrech
[Na+]infuzát = Na+ mmol/l infúze
Použití těchto vzorců může být zavádějící, pokud není uvážena komplexní situace nemocného. Sem patří především náplň ECT, příčiny hyponatrémie (např. při hypokortikalismu se S-Na+ dobře upravuje již po hydrokortizonu) a zohlednění měřitelných i neměřitelných ztrát Na+ a vody.
Cílová hodnota zvýšení S-Na+ není v praxi často dodržena. Např. ve studii, kde bylo sledováno 412 hyponatremických, bylo dosaženo optimální korekce do 24 hod. jen u 211 (51,2 %) z nich. Nedostatečnou korekci mělo 87 (21,1 %) a hyperkorekci 114 (27,8 %). Na této nepřesnosti se podílely vlivy ze strany nemocných, i ze strany léčebné péče [17]. Obdobné problémy s korekcí uvádějí i jiní [3]. Překorigováním cílové hodnoty S-Na+ jsou při léčení hyponatrémie ohroženi především nemocní, kteří jsou v riziku ODS (viz dále). U nich, stejně jako u chronické hyponatrémie, je bezpečnější plánovat rychlost úpravy již pro celý první den <10 mmol/l. Za bezpečný rozsah je považováno zvýšení <6-8 mmol/l/den. Kontroly natrémie jsou nutné po 4-6 hodinách [11].
Chronická hyponatrémie a její léčení
Při chronickém vývoji hyponatrémie nemusí být ani při těžce snížených hodnotách přítomné klinické příznaky nebo jsou jen nespecifické. Mezi ně patří bolesti hlavy, mentální zhoršení, slabost, nevolnost až zvracení. Chronická hyponatrémie byla považována za asymptomatickou, ale studie z nedávné doby prokazují, že je provázena nepříznivými příznaky, jako jsou deficit chůze a pozornosti, deficity kognitivní, pády, poškození kostí (osteoporóza a fraktury). Úprava hyponatrémie tyto stavy koriguje. Doporučená rychlost korekce viz v předchozím odstavci. Při léčení chronické, asymptomatické hyponatrémie stačí většinou odstranit vyvolávající příčinu. Významná je i normalizace objemu cirkulujících tekutin. U hypovolemických nemocných bez příznaků nebo jen s mírnými příznaky se podává 0,9% NaCl nebo bilancované krystaloidní roztoky v množství 0,5-1,0 ml/kg/hod. U nemocných s euvolemií nebo hypervolemii je základem omezení příjmu vody. Úprava trvá několik dnů, nemocní ji neradi podstupují. Může dojít k hypovolemii a zhoršení renálních funkcí [20].
CSWSa SIADH, diagnóza a diferenciální diagnóza
Mezi příčinami hypotonické hyponatrémie hypovolemické byl uveden CSWS a euvolémické SIADH. Oba tyto syndromy se vyskytují u řady stejných postižení mozku, i když mohou mít, zejména SIADH, řadu dalších příčin. Oba mají shodné i změny některých základních biochemických parametrů. Ale stejně jako jejich etiologie je i léčení zcela odlišné. Jejich diferenciální diagnostika je výzvou v neurotraumatologii.
Název CSWS je odvozen od časté vazby na patologii mozku. Příčiny: subarachnoidální krvácení (nejčastěji), jiné cerebrovaskulární příhody a malformace mozku, mozkové nádory, karcinomatozní a tuberkulozní meningitida, traumata hlavy, neurochirurgie, AIDS a Alzheimerova choroba (popsáno při podávání trimethoprimu) u dětí hydrocefalus a těžká dehydratace [4]. Pokud je ale CSWS zjištěn bez této patologie, je jeho vhodnější název „sůl ztrácející nefropatie“. Za mechanismus vzniku je považováno uvolnění natriuretických peptidů. Je zvýšené vylučování Na+ močí, provázené ztrátou vody. Deplece objemu i. v. tekutiny vede k sekreci ADH a aktivaci systému renin-angiotensin-aldosteron. Nemocní jsou klinicky v dehydrataci. K terapii slouží hypertonické roztoky NaCl, při polyurii fludrokortizon. U většiny nemocných se stav upravuje do dvou týdnů, u starších i za dobu delší [11, 19, 21].
SIADH vzniká z nadměrné neregulované sekrece antidiuretického hormonu (ADH). Zvýšená resorpce vody vede k poklesu osmolality séra i natrémie. Před stanovením diagnózy SIADH je třeba vyloučit insuficienci nadledvin, štítné žlázy, hypofýzy, ledvin a v nedávné anamnéze terapii diuretiky [10]. Příčiny SIADH viz Tabulka 2. Zde k jejich výčtu jen poznámky. SIADH vzniká u onkologických nemocných jako paraneoplastický syndrom, kdy dochází k ektopické produkci ADH. Uplatňují se i následky chemoterapie, zvláště po lécích s platinou, opiátech a nesteroidních protizánětlivých lécích. Ve vztahu k onkologické léčbě se předpokládá nepříznivý vliv hyponatrémie na její efekty a je naopak prokazován pozitivní vliv normalizace S-Na+ [20, 22]. U subarachnoidálního krvácení je hyponatrémie z iontových komplikací nejčastější [23]. Diferenciálně-diagnostická kriteria mezi CSWS a SIADH vycházejí především z vyšetření renálních funkcí – viz Tabulka 3. Doplňuje je nízká hladina urey v séru a její vysoká exkreční frakce (>55 %) u SIADH. Již první studie v této oblasti neurointenzivní péče hodnotící tato kritéria, prokázala výrazně vyšší frekvenci CSWS než SIADH [24]. V daleko recentnější práci našich autorů byl díky hodnocení renálních parametrů u 31 hyponatrémických nemocných v neurointenzivní péči diagnostikován CSWS 25x, jiné příčiny hyponatrémie 6x, SIADH ani jednou [25]. Hyponatrémie zde vznikají především po terapii hypotonickými roztoky, thiazidy nebo pro iatrogenní SIADH, hypernatrémie po furosemidu, osmoterapii manitolem nebo po profuzním pocení. Prevencí vývoje dysnatrémií v neurointenzivní péči je jejich časná diagnóza a léčení dle kvalitního protokolu [19].
![Regulatory dysturbance of effective osmolality in brain disease [24, 30]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/8a8275a3726fa2e7577075334e04fd1d.jpeg)
Protože při SIADH bývá euvolemie, je potlačena sekrece aldosteronu a Na+ je močí vylučováno. Vylučování vody je naopak pro zvýšenou sekreci ADH omezeno. Příjem tekutin má být omezen. Jeho vhodné množství lze vypočítat na základě poměru koncentrací iontů v moči (U) a v plazmě (P):
U/P = [Na]u + [K]u / [Na]p
kde [Na]u + [K]u = koncentrace Na+ a K+ v moči, [Na]p = S-Na+
Hodnocení: U/P >1: vylučování bezelektrolytové vody je negativní, příjem tekutin, přesahující neměřitelné ztráty (500–700 ml/den) bude zadržen a hyponatrémie se zhorší. Doporučen příjem tekutin <500 ml/den. U/P <1: je přece jen vylučována část vody bez elektrolytů, příjem <1000 ml/den. U/P cca 1: příjem 500 až 700 ml/den. Někteří autoři publikují dobré zkušenosti s ureou. Podává se v množství 0,25 – 0,50 g/kg/den [26]. Její nepříjemnou chuť lze korigovat ochucením např. kys. citronovou + cukrem. Vysadit léky zvyšující sekreci ADH nebo zesilující jeho efekt. Dříve indikované lithium a demeclocyklin nejsou pro toxické působení na ledviny doporučovány [14, 18].
![The schema of glycemia, natremia and serum osmolality in dehydrated patient with extreme value of glycemia at admission
to metabolic ICU. There was nonhypotonic hyponatremia caused by extreme values of glucose. Succesful decrease of
glucose is accompanied by elevation of natremia to high values in severely dehydrated patient [13].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/55e4973bfe19c76d80a0c9f66c2c7503.jpeg)
Osmotický demyelinizační syndrom
Riziko rychlé úpravy hyponatrémie představuje osmotický demyelinizační syndrom (ODS). Toto riziko je větší u hyponatrémie chronické, při níž se v mozkových buňkách snížil počet osmoticky efektivních částic, vázajících vodu, ale vývoj ODS je popsán i po rychlé korekci hyponatrémie akutní. Při nevhodně rychlé úpravě S-Na+ vede zvyšování osmolality ECT k přesunu vody z ICT. Mozkové buňky se zmenšují tak prudce, že dochází ke střižnímu efektu na rozhraní axonů a jejich myelinových obalů. Vzniká poškození myelinu a za 1–6 dnů se mohou objevit poruchy citlivosti, chabé kvadruparézy, pseudobulbární parézy a v krajních případech poruchy vědomí rázu stuporu až kómatu [4, 5]. Někdy jsou uváděny i dysartrie, mutismus, afektivní změny nebo letargie. Ohroženi jsou zejména alkoholici, nemocní s hypokalémií, v malnutrici a s pokročilou hepatopatií [5, 11, 20], nebo s těžkou hyponatrémií <105 mmol/l [10]. U těchto rizikových nemocných jsou cíle zvýšení hyponatrémie maximálně o 8 mmol/l 1. den léčby a o 6 mmol/l v dalších dnech [10, 15, 20]. Při každé úpravě chronické hyponatrémie je nutno vzhledem k tomu, že mozkové buňky musí zpětně doplňovat při kompenzaci snížené ionty, současně s úpravou a monitorováním hodnot Na+ sledovat a včas dodávat i ionty K+, fosfáty a Mg++. Dostupnost fosfátů je nutná pro funkci Na-K-ATPázové pumpy, která zajistí zpětný vstup K+ do ICT, ionty Mg++ jsou kofaktorem této pumpy [27]. Pokud bude korekce hyponatrémie proti vhodnému limitu nadměrně rychlá (riziko ODS!), přerušit aktivní léčbu, podat tekutiny p.o. a dle potřeby i.v. 5% glukózu 4 – 6 ml/hod po dobu 2 hodin s následnou kontrolou natrémie. Někteří autoři navrhují podat desmopresin [20]. ODS se může vyvinout i bez hyponatrémie resp. její úpravy také již při prudším kolísání S-Na+. Mezi takto ohrožené rizikové stavy patří i těhotenství, stavy po porodu, těžké sepse, insuficience nadledvin a složité metabolické poruchy [21].
Hyponatrémie a stáří
Frekvence hyponatrémie se s věkem zvyšuje. Zatímco hodnoty S-Na+ byly v holandské populaci pro věkovou kategorii 55-75 roků sníženy u 7,7 % probandů, bylo to pro věk ≥75 roků již v 11,6 %. V další studii měli residenti domů s pečovatelskou službou ve věku >60 roků hyponatrémii v 18 %. Hyponatrémie je zjišťována asi u 10 % starých osob žijících doma a až u 20 % žijících v ústavech s pečovatelskou péčí. Až 50 % těchto rezidentů prodělá jednu i více hyponatremických period v průběhu jednoho roku [11, 16].
Ve stáří jsou přítomny faktory, které přispívají ke zvýšení ADH a jsou předepisovány léky natrémii snižující. Jsou důvody ke vzniku SIADH, jedné z nejfrekventovanějších příčin hyponatrémie v tomto věkovém období. Patří sem řada nádorových a plicních onemocnění i postižení mozku (uvedeno výše). Patogenetické mechanismy vývoje hyponatrémie u starších osob dále představuje zhoršená schopnost vylučovat vodu pro pokles glomerulární filtrace (GF), pokles tvorby prostaglandinů v ledvinách (působí proti ADH, takže jejich vliv klesá), klesá obsah vody v těle, proto se i menší změny v obsahu Na+ v těle více projeví a je vyšší frekvence jinak vzácného idiopatického SIADH [11].
Schopnost zřeďovat moč je ale u většiny starších osob zachována i při poklesu GF, a proto se hyponatrémie vyvíjí až při kombinaci zvýšeného příjmu vody a některé z dále uvedených příčin. Mezi ty patří řada onemocnění, jejichž frekvence s věkem stoupá: např. infekce, srdeční selhání, jaterní nemoci, malignity, endokrinopatie (insuficience nadledvin při hypopituitarismu a špatně kontrolovaný diabetes). Hyponatrémie má sezónní variace (vyšší výskyt v létě) pro častější zhoršení renálních funkcí, zvýšené ztráty solí, omezený příjem soli a zvýšený příjem vody [11]. Riziko vývoje hyponatrémie s věkem roste a je vyšší u žen. Po přerušení léčby některými léky (SSRI) se hyponatrémie spontánně upravuje.
Hyponatrémie a kosti
Epidemiologické vztahy mezi hyponatrémií a frakturami.
Byly hodnoceny v devíti klinických studiích. U akutně přijímaných starších nemocných s frakturami byly hyponatrémie zjištěny ve 13 %, u kontrolních věkově odpovídajících ambulantních nemocných v 3,9 %. V jiné studii bylo vyšetřeno 364 nemocných na oddělení akutního příjmu. Ve skupině postižených frakturami byly hyponatrémie zjištěny v 9,1 %, u kontrol bez fraktur v 4,1 %. A konečně v další studii bylo zjištěno, že nemocní s hyponatrémií trvající >90 dní měli proti kontrolám významně častěji fraktury kyčle.
Epidemiologický vztah mezi hyponatrémií a osteo-porózou.
V americké rozsáhlé populační studii NHANES byly osoby se zjištěnou hyponatrémií porovnány s normonatremickými kontrolami. Byl zjištěn významný vztah mezi hyponatrémií a frekvencí osteoporózy kyčle i krčku femuru. Kostní minerální hustota (BMD) klesala o 0,037 g/cm3 s každým poklesem natrémie o 1 mmol/l. Významnost tohoto vztahu prokazuje i řada dalších studií. Také ve skupině 404 mladých žen s mentální anorexií měly probandky s hyponatrémií významně nižší BMD ve všech oblastech skeletu. A konečně u 703 hyponatremických osob byl výskyt osteoporózy významně častější než u kontrol (17,6 % proti 6,6 %, p<0,001) [16].
Možné mechanismy vztahu mezi hyponatrémií a frakturami.
Chronická hyponatrémie může ke vzniku fraktur přispívat zhoršením kognitivních funkcí, poruchami chůze, vznikem nestability a pády. Možnou příčinou je úbytek glutamátu v mozkových buňkách – ovládání chůze viz výše. Dále je v kostní dřeni ovlivněna diferenciace mesenchymálních stromálních buněk, prekurzorů osteoblastů i adipocytů. Je přitlumena jejich přeměněna v osteoblasty a zvýšená transformace v adipocyty. Navíc osteoblasty, které vznikají, zvyšují expresi faktorů, stimulujících aktivitu osteoklastů. Tato změna kostní struktury může mobilizovat Na+ z kostních zásob ve snaze udržovat jeho homeostázu. Výsledkem je snížení BMD a zvýšení rizika fraktur [28].
Tím, že hyponatrémie může vést k poruchám chůze a pozornosti, vzrůstá při ní nezávisle na BMD riziko fraktur. Vyšší výskyt je mezi staršími lidmi. Až v 80 % jde přitom o chronickou střední hyponatrémii. V obrovské populační studii zahrnující 2,9 miliónu obyvatel byly v USA z databází zdravotnického systému hodnoceny vztahy mezi hyponatrémiií, osteoporózou a frakturami z křehkosti. Jedinci s osteoporózou (n=30 517) a s frakturami z křehkosti (n=46 256) byli porovnáni s kontrolami bez osteoporózy a fraktur. Statistické zpracování prokázalo, že hyponatrémie je ve významném vztahu k oběma nálezům. Pravděpodobnost osteoporózy a fraktur rostla postupně s tíží hyponatrémie [16, 29].
Autor není ve střetu zájmů.
Do redakce došlo 20. 7. 2018
Adresa pro korespondenci
prof. MUDr. Antonín Kazda, DrSc.
Ústav lékařské biochemie a laboratorní diagnostiky 1. LF UK a VFN
Kateřinská 32
120 00 Praha 2
E-mail: kazda@vfn.cz
Sources
1. Funk, G. Ch., Lindner, G., Druml, W. et al. Incidence of dysnatremias in critical care. Int. Care Med., 2010, 36, p. 304-311.
2. Sakr, Y., Rother, S., Ferreira, A. M. P. et al. Fluctuations in serum sodium level are associated with an increased risk of death in surgical ICU patients. Crit Care Med, 2013, 41, p. 133-142.
3. Arampatzis, S., Frauchiger, B., Fiedler, G. M. et al. Characteristics, symptoms, and outcome of severe dysnatremias present on hospital admission. Amer. J. Med., 2012, 125, 11, 1125e1-1125e7.
4. Wiliams, D. M., Gallagher, M., Handley, J. et al. The clinical management of hyponatraemia. Postgrad. Med. J., 2016, 92, p. 407-411.
5. Buffington, M. A., Abreo, K. Hyponatremia: a review. J. Intens. Care Med., 2016, 31(4), p. 223-236.
6. Sterns, R. H., Silver, S. M. Complications and management of hyponatremia. Curr. Opin. Nephrol. Hypertens, 2016, 25, p. 114-119.
7. Jabor, A., Franeková, J. Hyponatrémie. Labor Aktuell, 2014, 3, p. 13-15.
8. Liamis, G., Milionis, H., Elisaf, M. A review of drug-induced hyponatremia. Am. J. Kidney Diseas., 2008, 52, 1, p. 144-153.
9. Jabor, A. et al. Vnitřní prostředí. Praha, Grada, Publishing 2008, 312 s. ISBN 978-80-247-1221-5.
10. Weismann, D., Schneider, A., Höybye, Ch. Clinical aspects of symptomatic hyponatremia. Endocr. Connections, 2016, 5, R35-R43.
11. Filippatos, T. D., Elisaf, M. S., Liamis, G. Hyponatremia in the elderly: challenges and solutions. Devepress, 2017, 12, p. 1957-1965.
12. Heinrich, S., Wagner, S., Gross, P. Hyponaträmie. Med. Clin. Intensive Med. Notfmed., 2012, 108, p. 53-58.
13. Brodská, H., Kazda, A., Křemen, J. Komplexní kazuistika – diabetické koma. In Průša, R. Kazuistiky a stručné kapitoly z klinické biochemie. Praha: ÚKBP, 2. LF UK Praha a FN Motol 2009, s. 124-127.
14. Spasovski, G., Vanholder, R., Allolio, B. et al. Clinical practice guideline on diagnosis and treatment of hyponatraemia. Int. Care Med., 2014, 40, p. 320-331.
15. Kengne, F., G., Decaux, G. Hyponatremia and the brain. Kidney Internat. Reports., 2018, 3, p. 24-35.
16. Negri, A. L., Ayus, J. C. Hyponatremia and bone disease. Rev. Endocr. Metab. Disord., 2004, 18, p. 67-78.
17. Rondon-Berrios, H., Berl, T. Vasopresin receptor antagonists in hyponatremia: uses and misuses. Front. Med., 2017, 4, art. 141.
18. Dasta, J., Waikar, S. S., Xie, L. et al. Patterns of treatment and correction of hyponatremia in intensive care unit patients. J. Crit. Care, 2015, 30, p. 1072-1079.
19. Špatenková, V., Škrabálek, P. Protokol diagnostiky a léčby hyponatremie a hypernatremie v neurointenzivní péči. Cesk. Slov. Neurol., 2015, 78/111(1), s. 34-37.
20. Berardi, R., Rinaldi, S., Caramanti, M. et al. Hyponatremia in cancer patients: time for a new approach. Crit. Rev. Oncology/Hematology, 2016, 102, p. 15-25.
21. Shah, M. K., Mandayam, S., Adrogue, H. J. Osmotic demyelination unrelated to hyponatremia. Am. J. Kidney Dis., 2017, 71(3), p. 436-440.
22. Khan, M. I., Dellinger, R. P., Vaguespack, S. G. Electrolyte disturbances in critically ill cancer patients: an endocrine perspective. J. Intens. Care Med., 2018, 33, p. 147-158.
23. Hall, A., O´Kane, R. The extracranial consequences of subarachnoid hemorrhage. World Neurosurg., 2018, 109, p. 381-392.
24. Lolin, Y., Jackowski, A. Hyponatremia in neurosurgical patients. Br. J. Neurosurg., 1992, 6, p. 457-466.
25. Špaténková, V., Kazda, A., Barsa, P. et al. Diagnostika hyponatremií v neurointenzivní péči: úloha renálních funkčních parametrů. Cesk. Slov. Neurol. N., 2008, 71/104(2), p. 156-162.
26. Coussement, J., Danguy, Ch., Zouaoui-Boudjeltia, K. et al. Treatment of the syndrome of inappropriate secretion of antidiuretik hormone with urea in critically ill patients. Am. J. Nephrol., 2012, 35, p. 265-270.
27. Kraft, M. D., Btaiche, I. F., Sacks, G. S. Treatment of electrolyte disorders in adult patients in the intensive care unit. Amer. J. Health Syst. Pharm., 2005, 62, p. 1663-1682.
28. Fibbi, B., Benvenuti, S., Giuliani, C. et al. Low extracellular sodium promotes adipogenic commitment of human mesenchymal stromal cells: a novel mechanism for chronic hyponatremia-induced bone loss. Endocrine, 2016, 52, p. 73-85.
29. Holm, J. P., Amar, A. O. S., Hyldstrup, L., Jensen, J. E. B. , a risk factor for osteoporosis and fractures in women. Osteopor. Int., 2016, 27, p. 989-1001.
30. Kazda, A. et al. Kritické stavy. Praha, Galén, 2012, 346 s. ISBN 978-80-7262-763-9.
Labels
Clinical biochemistry Nuclear medicine Nutritive therapistArticle was published in
Clinical Biochemistry and Metabolism

2018 Issue 4
-
All articles in this issue
- Biological effects of carbon monoxide
- Hyponatremia – Frequency, Causes, Pathobiochemistry, Clinics and Therapy.
- ree light chains and pairs of heavy and light chains of immunoglobulins in relation to morbidity of patients before liver transplantation and post-transplantation.
- Hemolysis index as a tool for determination of free hemoglobin in plasma.
- Verification of the reference range of free triiodothyronine in serum on the analyzer Architect ci 16200
- Kidney stones - effect of indapamide treatment – a case study
- Zeman M.: Refeeding syndrome after paleodiet
- Clinical Biochemistry and Metabolism
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Hyponatremia – Frequency, Causes, Pathobiochemistry, Clinics and Therapy.
- Hemolysis index as a tool for determination of free hemoglobin in plasma.
- Zeman M.: Refeeding syndrome after paleodiet
- Kidney stones - effect of indapamide treatment – a case study

