Aktuálne problémy štruktúry a orientácie komplexných národných programov boja proti zhubným nádorom
Actual Problems in Structure and Orientation of Concise National Cancer Control Programs
Important and increasing contribution of malignant tumours on the total number of deaths in developed and later also in developing countries led in the middle of previous century to the formulation of preventive cancer control programs. Eroneus interpretation of epidemiological as well as results obtained on laboratory animals, the general acceptance that the etiology of nearly all human malignant tumours is known, declarative character of these programs, orientation on large scale of cancer sites, ignorance of local priorities, avaiting the positive results in short time together with limited material and personal resources led to the failure of majority of cancer control programs. Moreover.the formation and implementation of these programs remained all the time behind dramatic increase of cancer. Actually cancer control programs are based on generally accepted fact that the causes of about 40% of cancers are known and therefore preventable. Possibilities of treatement roughly 33% of cancer cases provide the aims of secondary prevention .The essential basis of the performance of cancer control programs is their surveillance which was succesfully used in prevention of infectious diseases. In oncology surveillance encompasses the systematic collection of detailed data on actual and future burden and development of cancer incicence and mortality in given population, as well as on diagnostic, treatment and overall care of cancer patients. Information of this kind could be derived only from population based cancer registries which are also valuable for the evaluation and monitoring of the results of national cancer control programs.
Key words:
cancer – health planning – prevention – Comprehensive Health Care
Authors:
I. Pleško
Authors‘ workplace:
Ústav experimentálnej onkológie SAV, Bratislava, Slovenská republika
Published in:
Klin Onkol 2010; 23(6): 408-415
Category:
Reviews
Overview
Významný a rastúci podiel zhubných nádorov na celkovom počte úmrtí obyvateľov vyspelých a postupne i rozvojových krajín viedol už od polovice minulého storočia k formulovaniu preventívnych programov proti týmto ochoreniam. Deklaratívny charakter programov, ich zameranie na rozsiahle spektrum lokalizácií, nerešpektovanie lokálnych priorít, rýchle očakávanie pozitívnych výsledkov pri súčasnom nedostatku materiálnych a personálnych zdrojov viedlo k ich zlyhaniu. Naviac tvorba a implementácia onkologických programov nutne zaostávala za dramatickým a pritom dlhodobo podceňovaným vzostupom onkologických ochorení. Pri formulovaní onkologických programov v súčasnosti sa zdôrazňuje predovšetkým ich komplexný a reálny charakter. Vychádzajú zo všeobecne akceptovaného faktu poznania príčin zhruba 40 % všetkých nádorov, čím sú určené a ohraničené možnosti ich primárnej prevencie. Akceptované možnosti liečby asi 33 % sú východiskom pre aplikáciu metód sekundárnej prevencie, zlepšenia diagnostiky a následnej úspešnejšej liečby ranných štádií ochorenia. Všetky uvedené zásady splňuje metóda surveillance osvedčená pri prevencii infekčných chorôb. Ide o sústavný zber detailných údajov o aktuálnom a budúcom rozsahu a vývoji zhubných nádorov, ako aj diagnostike, liečbe a celkovej starostlivosti o onkologických pacientov. Takéto poznatky môžu poskytnúť iba populačné onkologické registre, a to nielen pri formulovaní a smerovaní komplexných programov, ale i hodnotení ich výsledkov.
Kľúčové slová:
zhubné nádory – plány – prevencia – komplexná starostlivosť
Úvod
V porovnaní s úspechmi, ktoré zaznamenalo použitie epidemiologických prístupov a metód pri prevencii infekčných ochorení, predstavovalo samotné získanie základných poznatkov o rozsahu výskytu ochorení spôsobených zhubnými nádormi ako nutných východísk pre štúdium ich epidemiológie a následne i prevencie, pomerne dlhý a zložitý proces. Rastúci počet správ o ich výskyte v minulosti vychádzal výhradne z absolútnych počtov prípadov zistených pri pitve a z poznatkov o prevalencii – počtov všetkých žijúcich onkologických pacientov k určenému dátumu. V správach však chýbali údaje o veľkosti a vekovej štruktúre sledovanej populácie [1 – 3]. Významný prelom pri určovaní rozsahu a vývoja onkologických ochorení sa zaznamenal pri hodnotení údajov o mortalite v definovanej populácii koncom 19. a v prvej polovici 20. storočia. V období medzi prvou a druhou svetovou vojnou nebol sekulárny a stabilizovaný vývoj mortality na zhubné nádory s trvale vyšším postihnutím žien považovaný za významný zdravotný problém. Rôzne lokálne iniciatívy upozorňujúce na rastúci výskyt zhubných nádorov ako významnej až prioritnej položky zdravotníctva vyspelých krajín nemali medzinárodný ohlas [1]. Podobne ani dramatický rast úmrtnosti na zhubné nádory pľúc u mužov signalizovaný z viacerých krajín neakceptovali ani mnohí významní odborníci a ešte okolo roku 1940 sa pripisoval zlepšenej diagnostike [4].
V plnej miere sa však vzostup mortality na zhubné nádory a jej podiel a vplyv na štruktúru celkovej mortality prejavil a medzinárodne akceptoval až po druhej svetovej vojne. Už v septembri 1946 prebehla v Kodani konferencia, ktorá v záveroch poukázala na potrebu rozsiahleho monitorovania mortality na zhubné nádory, potrebu postupného získavania údajov o ich incidencii, spolu s používaním jednotnej klasifikácie ako aj koordinácie týchto aktivít v medzinárodnom stredisku [5].
Druhá polovica minulého storočia sa vyznačovala viac alebo menej výrazným, ale všeobecným vzostupom úmrtnosti na jednotlivé orgánové lokalizácie zhubných nádorov vo vyspelých a postupne i v rozvojových krajinách. V celkovej úmrtnosti zaujali popri dominantnom postavení kardiovaskulárnych ochorení druhé miesto úmrtia spôsobené zhubnými nádormi. Ich podiel na celkových počtoch úmrtí vo vyspelých štátoch stúpol zo 14–17 % v roku 1960 postupne na 21–24 % v roku 1980 [3]. V súčasnosti dosahuje v rôznych regiónoch Európy 24 až 27 % u mužov a 21 až 28 % u žien [6].
Postupne sa však akceptoval fakt, že jediným indikátorom rozsahu a dynamiky trendov výskytu zhubných nádorov sú počty nových prípadov ochorení za jeden rok v ohraničenej populácii so známym vekovým zložením, teda hodnoty incidencie [1,7]. Údaje o hodnotách a trendoch incidencie jednotlivých lokalizácií a typov zhubných nádorov poskytli prvé alebo práve vznikajúce populačné onkologické registre v USA, Dánsku, Anglicku, Nemecku, Nórsku a postupne i v ďalších krajinách a regiónoch sveta [1,7]. Keďže zhubné nádory prichádzajú predovšetkým vo vyššom veku, významnú úlohu pri exaktnejšom hodnotení trendov a geografickej distribúcie incidencie a mortality nádorových ochorení zohralo i zavedenie vekovo štandardizovaných hodnôt oboch ukazovateľov, pri ktorých bol do značnej miery vylúčený vplyv rozdielnej vekovej štruktúry populácie pri porovnávaní hodnôt incidencie a mortality v priestore i čase [8].
Veľký záujem o hodnoty mortality a incidencie zhubných nádorov nebol daný iba ich prudkým nárastom, hrozivým priebehom a zlou prognózou, ale zrejme skutočnosťou, že v rámci chronických neinfekčných ochorení ide o jedinú dobre ohraničenú skupinu, klasifikovanú z hľadiska orgánovej lokalizácie, morfológie i klinického štádia, čo pripomínalo presnú identifikáciu a klasifikáciu infekčných chorôb [1,2,9]. Zhubné nádory sa tak stali základom pre programy boja proti rozsiahlej skupine neinfekčných chronických ochorení, na ktoré sa musela v povojnových rokoch pohotovo zamerať Svetová zdravotnícka organizácia (ďalej SZO).
Vývoj komplexných programov boja proti zhubným nádorom
Práve vyššie spomínaný vzostup podielu úmrtí na zhubné nádory na celkovom počte zomretých považovala SZO za hlavnú výzvu na vytvorenie komplexných programov boja proti zhubným nádorom. Aktivity v jednotlivých krajinách, celoeurópske alebo globálne v rámci SZO nutne zaostávali za dramaticky sa zvyšujúcim výskytom a tým i významom zhubných nádorov ako vysoko prioritného zdravotného problému. Už v roku 1963 definovali experti SZO program boja proti zhubným nádorom („cancer control“) ako „sériu opatrení vychádzajúcich zo súčasných medicínskych poznatkov v oblasti prevencie, detekcie, diagnostiky, liečby, rehabilitácie a celkovej starostlivosti o onkologických pacientov, zameraných na významnú redukciu počtu nových prípadov ochorenia, rozšírenie diagnostických a liečebných postupov a zníženie invalidity a mortality spôsobenej zhubnými nádormi“ [10]. Medzinárodná konferencia venovaná komplexnému boju proti zhubným nádorom v európskom merítku v júli 1977 v sídle Regionálneho úradu SZO pre Európu reagovala predovšetkým na dramatický rast incidencie a prevalencie jednotlivých lokalizácií zhubných nádorov, signalizovaný z niekoľkých populačných onkologických registrov, a na veľký podiel nádorových ochorení na celkovej mortalite. Ďalším dôvodom podporujúcim vznik a etablovanie preventívnych programov bola rastúca cena diagnostiky a liečby onkologických ochorení, pričom ani veľké a odborné úsilia, podporované enormnými finančnými nákladmi, sa neprejavili ani na zlepšení prežívania onkologických pacientov. Závery z uvedenej konferencie zdôraznili nižšiu účinnosť preventívnych opatrení v porovnaní s dobrými výsledkami prevencie iných chorôb. Táto skutočnosť sa pripísala nielen samotnej inherentnej, špecifickej biologickej komplexnosti vzniku a vývoja onkologických ochorení, ale i nedostatočným preventívnym aktivitám a malej pozornosti venovanej problematike onkologických ochorení v mnohých štátoch, a to i napriek početným priamym aj nepriamym poznatkom o možnostiach prevencie aspoň niektorých zhubných nádorov [11].
Približne v tom istom období, najmä koncom sedemdesiatych rokov minulého storočia, boli publikované i prvé odhady o percentuálnych podieloch niektorých rizikových faktorov prostredia a životného štýlu na vznik zhubných nádorov u mužov a žien [12]. Najznámejšie odhady vychádzali z údajov o incidencii zhubných nádorov získaných v regionálnych onkologických registroch v Anglicku [12 ] a v USA [13]. V oboch prácach súčet podielov jednotlivých rizikových faktorov dosahoval skoro 100 %. Na druhej strane sa už v tom čase kritizoval prehnaný optimizmus v očakávaní zásadných zmien vo výskyte zhubných nádorov od v tom čase uskutočňovaných alebo plánovaných preventívnych zásahov [14].
Vznik a formulovanie uvedených programov bolo však markantne ovplyvnené po roku 1981 veľkým, celosvetovým ohlasom práce anglických autorov Dolla a Peta zameranej na vplyv širokej škály rizikových faktorov na mortalitu zhubných nádorov v USA [15]. Vplyv jednotlivých faktorov vonkajšieho prostredia a životného štýlu s možným karcinogénnym účinkom bol prezentovaný v tabuľke, kde sa uvádzali jednak najnižšie i najvyššie akceptovateľné hodnoty podielov a zároveň ich priemer považovaný za najlepší odhad. Súčet stredných, resp. priemerných hodnôt jednotlivých podielov karcinogénnych faktorov, ktorý dosahoval opäť skoro 100 %, bol zdrojom mnohých omylov a nepochopení, ktoré sa prejavili najmä v náhľadoch na primárnu prevenciu zhubných nádorov. Nielen bulvárna tlač, ale i mnohí významní odborníci považovali niektoré závery vychádzajúce z epidemiologických poznatkov a podporené výsledkami odvodenými z pokusov na laboratórnych zvieratách za dôkaz expozície ľudí karcinogénom. Mechanická aplikácia uvedených poznatkov viedla k optimistickým názorom, že pre skoro všetky zhubné nádory u ľudí poznáme príčiny. Ich odstránenie môže viesť k ich markantnému zníženiu behom krátkeho času. Prevládal názor, že už na začiatku 21. storočia nebudú zhubné nádory predstavovať závažnú hrozbu a do popredia sa vo vyspelých štátoch dostanú hlavne psychiatrické a prípadne i kardiovaskulárne ochorenia. Je však treba uviesť, že uvedení anglickí autori i ďalší odborníci sa proti takémuto zjednodušovaniu ohradzovali [14 – 16]. Na tab. 1 uvádzame v percentách podiely úmrtí na zhubné nádory pripisované jednotlivým rizikovým faktorom prostredia a životného štýlu v USA [15], vo vyspelých krajinách [17] a podstatne nižšie v Holandsku [18]. V tab. 2 uvádzame prehľad podielov rizikových faktorov, ktorých vylúčenie zo životného a pracovného prostredia by sa prejavilo celkovým poklesom vzniku zhubných nádorov vo Švédsku [19], v USA a UK [20] a v celej Škandinávii [21]. Z údajov v uvedených tabuľkách vyplýva aj postupný pokles hodnotenia vplyvu rizikových faktorov prostredia a životného štýlu na mortalitu a incidenciu zhubných nádorov.
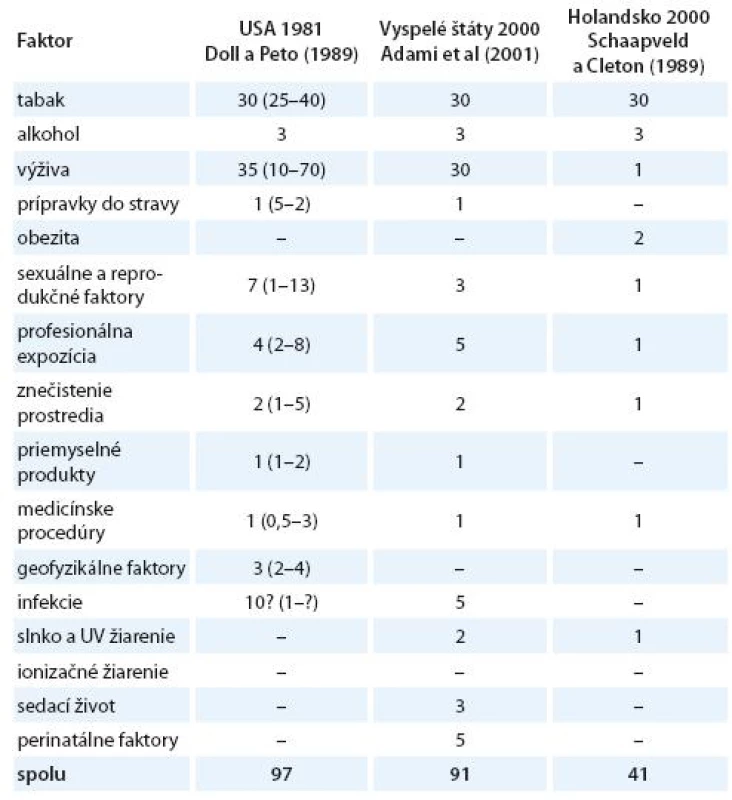
Pod vplyvom týchto informácií vzniká v Európe množstvo národných alebo regionálnych programov boja proti zhubným nádorom. Uvedené programy mali rozdielny efekt, ale i osud. Väčšina mala skôr charakter nereálnej deklarácie alebo manifestu, nikdy sa nezaviedli do praxe a postupne sa na ne zabudlo. Hlavným problémom, prípadne nedostatkom uvedených programov bolo ich široké zameranie skoro na celé spektrum zhubných nádorov bez ohľadu na postavenie a rozsah jednotlivých lokalizácií a typov z hľadiska výskytu, závažnosti a prognózy. Nerešpektovali lokálne priority, materiálne a odborné možnosti a sledovanie dopadov programov nebolo zaistené a ani možné. V mnohých prípadoch sa očakával, podobne ako pri prevencii infekčných ochorení, pomerne rýchly efekt. Na druhej strane ani obmedzené zdroje určené na prevenciu nádorov neboli vždy použité na daný účel a pod rúškom boja proti nádorom a výskumu v oblasti onkológie sa riešili všeobecne biologické a onkológii dosť vzdialené projekty [22]. Tak napr. v USA Národný onkologický ústav (NCI) poskytol na prevenciu z celkového rozpočtu iba 1 % (19 miliónov dolárov z celkovej sumy 2 miliárd) [23].
Optimistické závery z interpretácie výsledkov práce Dolla a Peta korigovali nielen samotní autori, ale viacerí experti. Na pravú mieru celú problematiku však uviedli až nemeckí autori v roku 1989. Dôkaz vychádzal z analýzy úmrtnosti na 12 hlavných lokalizácií zhubných nádorov, ktoré predstavovali až 70 % z celkovej úmrtnosti na zhubné nádory v Nemeckej spolkovej republike v roku 1985. Konfrontáciou počtov osôb, ktoré podľahli zhubným nádorom s dokázanými a akceptovanými etiologickými faktormi, došli k záveru, že zatiaľ poznáme príčiny asi tretiny všetkých zhubných nádorov u ľudí a iba pre takýto podiel vieme uplatniť preventívne zásahy [24].
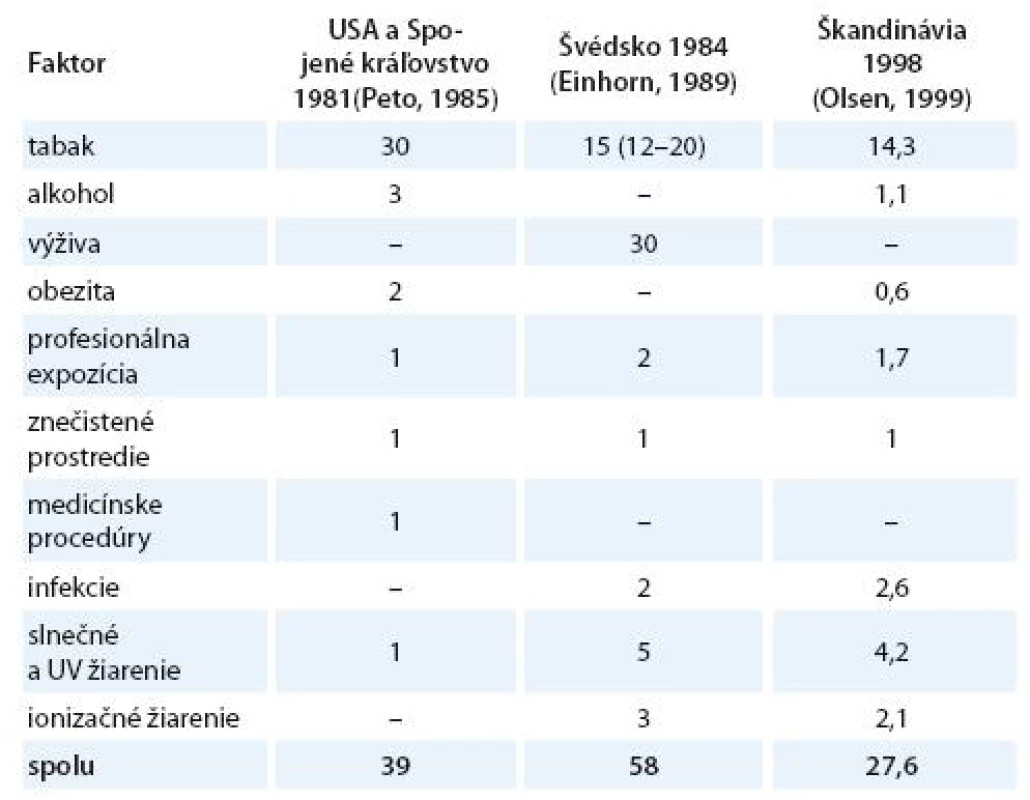
Výrazne sa na mortalite spôsobenej zhubnými nádormi odrazili výsledky programov zameraných na prevenciu kardiovaskulárnych ochorení (KVO). Viedli nečakane rýchlo, behom niekoľkých rokov, k markantnému zníženiu ich mortality v USA, Japonsku, Anglicku a Walese i v Nemeckej spolkovej republike a v Austrálii. V niektorých krajinách viedlo markantné zlepšenie prevencie a liečby KVO k ich presunu na druhé miesto v celkovom počte zomretých a na prvé miesto sa dostali zhubné nádory [25]. Paralelný rast mortality na zhubné nádory s poklesom mortality na kardiovaskulárne choroby nemožno pripísať náhode, i keď v tom istom čase došlo k poklesu mortality na nepresne určené príčiny, ktoré sa dodatočne pripisujú neinfekčným chronickým ochoreniam. Z faktu, že každý človek musí zomrieť, je jasné, že časť z osôb, ktoré predtým podľahli kardiovaskulárnym ochoreniam, zomiera v súčasnosti aj na zhubné nádory. Táto skutočnosť nie je na prvý pohľad veľmi vítaná. Na druhej strane bolo exaktne dokázané, že napríklad u mužov v USA v rokoch 1955 – 1965 sa kardiovaskulárne ochorenia podieľali celou tretinou na celkovej úmrtnosti mužov, kým v roku 1986 podiel mortality na ischemickú chorobu srdca klesol na štvrtinu a na mozgové krvácanie z 10 na 5 %. V tom istom čase podiel zomretých na zhubné nádory stúpol zo 14,5 na 22,7 %. Na druhej strane priemerný vek mužov zomierajúcich na zhubné nádory sa z očakávaného veku dožitia – 64,4 v roku 1955 – zvýšil na 68,7 v roku 1986. Pritom značný podiel predstavovali zhubné nádory pľúc, pre ktoré poznáme etiológiu a tým aj účinnú prevenciu [26].
Súčasné možnosti prevencie zhubných nádorov
Pripomeňme si ešte, že pre prevenciu zhubných nádorov možno použiť širokú škálu metód primárnej a sekundárnej prevencie, prípadne kombináciu oboch metód.
Primárna prevencia
Cieľ primárnej prevencie možno definovať ako „zamedzenie efektívneho kontaktu karcinogénu s vnímavým terčom v ľudskom tele, tak aby následnosť udalostí, ktoré kulminujú vznikom zhubného nádoru, bola prerušená alebo zastavená“ [17]. Zásadným východiskom pre stanovenie aktivít v oblasti primárnej prevencie je rešpektovanie všeobecne akceptovaného poznatku, že poznáme etiológiu asi 40 % zhubných nádorov, teda že pre 40 % môžeme očakávať pozitívne výsledky od aplikovania metód primárnej prevencie [24,27,28].
- Hlavným, detailne dokumentovaným a plne zdôvodneným zásahom v oblasti primárnej prevencie je boj proti fajčeniu. Je exaktne dokázané, že fajčenie je plne zodpovedné za 90 % zhubných nádorov pľúc, pričom máme presné poznatky i o vplyve tohto faktoru na úrovni sublokalizácií a histologických typov [29,30]. Takisto je dokázaná úloha fajčenia pri vzniku zhubných nádorov močového mechúra, i keď v menšom rozsahu a pri dlhodobejšej expozícii. Dávnejšie je známa tiež úloha fajčenia pri vzniku zhubných nádorov ďalších lokalizácií, hlavne postihnutie orgánov priamo exponovaných tabakovému dymu – ústna dutina, priľahlá časť hltanu a hrtan, a to často v spojitosti s iným faktorom, hlavne koncentrovaným alkoholom [31]. V posledných desaťročiach narastajú poznatky o vplyve tabaku na vznik nádorov v orgánoch, ktoré nie sú priamo exponované tabakovému dymu, napr. kolorekta, pečene, pažeráku, pankreasu, obličiek (hlavne panvičky a močovodov), ale i krčku maternice a možno i prsníka u žien [32]. Plne možno súhlasiť s názorom, že prinajmenšom jeden zo siedmych prípadov zhubných nádorov je spôsobený fajčením [33]. Je viac ako zrejmé, že intenzívny boj proti fajčeniu predstavuje základný a plne zdôvodnený článok primárnej prevencie a patrí mu i najvýznamnejšie miesto v národných programoch proti zhubným nádorom [33].
- Významným faktorom primárnej prevencie sú i opatrenia zamerané na zníženie konzumu alkoholu. Je dokázané, že nadmerný konzum alkoholických nápojov zvyšuje riziko vzniku nádorov ústnej dutiny, hltana, hrtana, pažeráka, prsníkov a veľmi pravdepodobne i hrubého čreva s konečníkom [34]. Upozorňuje sa aj na úlohu alkoholu pri vzniku zhubných nádorov ženských pohlavných orgánov, konkrétne krčka maternice, vulvy a vagíny [35] a nádorov pľúc u belochov [36]. Je pozoruhodné, že i nízky trvalý príjem alkoholu sa prejavil miernym, asi 10% vzostupom rizika vzniku nádorov prsníkov u žien [34]. Všeobecne je akceptovaný poznatok, že skoro všetky primárne karcinómy pečene vo vyspelých štátoch sú dôsledkom alkoholickej cirhózy. Riziko spojené s pitím alkoholu je dané samotným alkoholom a je bez vzťahu k forme, v akej sa konzumuje [37]. Karcinogénny efekt alkoholu je v prípade nádorov ústnej dutiny, hltana, pažeráka a hrtana potencovaný tabakovým dymom, pričom alkohol zvyšuje permeabilitu tkanív pre toxické, resp. karcinogénne zložky tabakového dymu [31,32,38].
- V priebehu
posledných desaťročí vzrástol význam infekcie pri vzniku
zhubných nádorov. Chronické infekcie vírusmi hepatitídy typu B
(HBV) a C (HCV) sa spájajú so vznikom 80 %
všetkých hepatocelulárnych karcinómov v globálnom merítku.
Vakcína proti HBV prináša pozitívne výsledky. Známa je i úloha ľudských papiloma vírusov (HPV) pri vzniku zhubných nádorov
krčka maternice, vulvy, vagíny, konečníka, penisu, kože
ano genitálnej
oblasti a orofaryngu. Určenie vysoko rizikových typov HPV
a ich inkorporácia do vakcín predstavuje už v súčasnosti
veľmi významný krok a možnosť úplne nového zamerania
primárnej prevencie zhubných nádorov krčka maternice, prípadne
i ďalších lokalizáciií. V prípade zhubných nádorov
krčka maternice však je i u vakcinovaných žien plne
zdôvodnený pravidelný screening tohto ochorenia pomocou
cytologického vyšetrenia sterov z tohto orgánu. Známy je
i vzťah vírusu ľudskej imunitnej nedostatočnosti (HIV) pri
vzniku non Hodgkinových lymfómov, Kaposiho sarkómu a ďalších
malígnych nádorov, Epstein Barrovej vírusu (EBV)
k non Hodgkinovým lymfómom, Hodgkinovej chorobe a ku
karcinómu nosohltanu [37 – 39].
Využitie poznatkov o úlohe Helicobacter
pylori (HP) pri vzniku
zhubných nádorov žalúdka, prípadne gastro ezofageálneho
spojenia pomocou vakcíny zatiaľ neprekročili rámec
experimentálnych a epidemiologických dôkazov [40]. Na význam
vzťahu chronických ochorení pri vzniku zhubných nádorov
upozornili v posledných rokoch americkí autori. Ide o úlohu
chronickej bronchitídy, obštrukčnej choroby pľúc a pneumokoniózy
pri vzniku nádorov pľúc, vzťah Crohnovej choroby a ulceróznej
kolitídy ku vzniku zhubných nádorov kolorekta, chronickej
cholecystitídy ku karcinómom žlčníka, zápalovej atrofie
a fokálnej hyperplázie ku karcinómom prostaty, ako aj
gastro ezofágeálneho refluxu ku vzniku karcinómov
lokalizovaných v dolnej časti pažeráka a v kardii
žalúdka [40].
Význam parazitov v etiológii zhubných nádorov je obmedzený na niektoré endemické oblasti sveta a môže sa uplatniť v niektorých regionálnych programoch rozvojových krajín [32,38]. Pôvodný odhad britských autorov prisudzoval infekcii úlohu pri vzniku 1 až 10 % nádorov [15]. V súčasnosti sa infekciám pripisuje 20 až 25% podiel pri vzniku zhubných nádorov v rozvojových krajinách a 7 až 10% i vyšší a stúpajúci vo vyspelých štátoch [38 – 40]. Možnosti zvyšovania odolnosti pomocou vakcinácie otvárajú nový prístup k primárnej prevencii niektorých nádorov. - Opakovane doporučovanú a diskutovanú primárnu prevenciu pomocou zmeny stravovacích návykov, najmä zloženia stravy, nemožno zatiaľ považovať za zdôvodnenú. I samotní britskí autori považujú vysoký podiel úmrtí na zhubné nádory pripisovaný strave – až 35% a jeho veľký rozsah uvádzaný jednotlivými autormi – s rozdielmi od 10 do 70 % za vysoko špekulatívny a týkajúci sa zatiaľ nie úplne dokázaných zložiek stravy [15]. Možno plne súhlasiť so závermi viacerých autorov, podľa ktorých súčasné poznatky nedovoľujú navrhnúť taký stravovací režim, ktorý by vylúčil potraviny obsahujúce karcinogény alebo identifikoval zložky stravy poskytujúce ochranu pred vznikom zhubných nádorov [32,41,42].
- V posledných
rokoch sa úloha výživy pri vzniku, ale i prevencii zhubných
nádorov dostáva do oblasti vyváženia príjmu a výdaja
energie a tým boja proti obezite. Z tohto hľadiska sa
doporučuje adekvátne množstvo a rozumné zloženie stravy
(s dostatkom ovocia a zeleniny) a primeraná fyzická
aktivita [43]. Obezita spolu so sedavým spôsobom života je
zodpovedná za vznik zhubných nádorov endometria,
post menopauzálného karcinómu prsníka, obličiek, žlčníka,
pankreasu, dolnej tretiny pažeráka a kardie žalúdka, ako aj
kolorekta a pravdepodobne i prostaty, pečene, štítnej
žľazy a mnohopočetného myelómu [44,45]. Prevalencia obezity
vo vyspelých krajinách trvale narastá. Podľa údajov z USA
15–20 %
úmrtí žien a 10–14 %
úmrtí mužov na zhubné nádory možno pripísať nadváhe až
obezite [32,44]. Zdá sa zdôvodnený predpoklad, že eliminácia
fajčenia (spolu s vylúčením expozície k tabakovému
dymu v prostredí), mierny konzum alkoholu a zastavenie
rastu obezity môže viesť až k 50% poklesu mortality na
zhubné nádory [38].
Podľa doporučení WHO sa majú (nielen) rozvojové krajiny sústrediť na prevenciu najčastejších nádorov, ale i na orgánové lokalizácie s vysokým potenciálom pre úspešnú liečbu. Významný je predovšetkým boj proti fajčeniu a ochrana pred parazitárnymi a vírusovými infekciami, ako ukázala úspešná vakcinácia proti hepatitíde spôsobenej HBV v endemických oblastiach a následný pokles hepatocelulárneho karcinómu. Pre krajiny so strednými finančnými a odbornými zdrojmi sa doporučuje etablovať ambulancie na pomoc fajčiarom, ktorí chcú prestať s týmto zlozvykom, realizovať intenzívnu zdravotnú výchovu v školách a na pracoviskách, prípadne vypracovať i integrovaný preventívny program proti ostatným chronickým neinfekčným ochoreniam. Pre bohaté krajiny sú otvorené všetky oblasti prevencie bez obmedzenia [37].
Sekundárna prevencia
Sekundárna prevencia je zameraná na zisťovanie ranných, bezpríznakových štádií onkologických ochorení, pri ktorých možno očakávať nielen lepšie terapeutické výsledky, ale i úplné vyliečenie. Môže ísť o zisťovanie premalignych lézií, napr. polypov hrubého čreva, dysplázií, nádorov v štádiu in situ krčka maternice a iných orgánov. Sekundárna prevencia sa realizuje individuálnym vyšetrovaním jedincov alebo screeningom pokrývajúcim vybrané vekové skupiny populácie [17,37,46,47]. Je ešte potrebné dodať, že aplikácia metód sekundárnej prevencie je pomerne nákladná, a preto sa vždy hodnotí pomer nákladov k jej skutočným prínosom. Z tohto dôvodu SZO odporúča pri zavádzaní sekundárnej prevencie brať do úvahy ekonomické, technické a odborné možnosti danej krajiny.
- Do úvahy prichádza predovšetkým a zatiaľ skoro výhradne vyhľadávanie prekanceróz a ranných foriem nádorov krčka maternice s predpokladaným znížením úmrtnosti až o 50 % a oveľa vyššou efektivitou pri kombinácii cytologického testovania s dôkazom HPV [17,37,47,48]. Pre krajiny s obmedzenými zdrojmi sa v prípade existencie cytologickej infraštruktúry doporučuje prevádzať screening u 35 až 40 – ročných žien raz počas života, prípadne každých 10 rokov u 30 až 60 – ročných žien. V krajinách so strednými zdrojmi sa doporučuje aplikovať cytologický scrrening nádorov krčku maternice každých 5 rokov u 30–60 - ročných žien.
- Krajiny s vysokými zdrojmi môžu markantne vylepšiť screening karcinómov krčku maternice a zaviesť i screening nádorov prsníkov. Pri screeningu nádorov prsníka očakávame pokles mortality asi o 30 %. Nedoporučuje sa zavádzať mamografiu do screeningu, ak odborné a ekonomické zdroje neumožňujú prevádzať efektívny screening aspoň u 70 % 50 - ročných a starších žien [38].
- V prípade screeningu nádorov kolorekta zisťovaním okultného krvácania v stolici (a následným doriešením, resp. liečbou zistených prípadov) môžeme po desiatich rokoch očakávať pokles vzniku nádorov v tomto orgáne o 20 % [17,38,47]. Významná je i skutočnosť, že pri prevádzaní kolonoskopie sa odstraňujú polypy, v ktorých vznikajú karcinómy a tým sa nepriamo znižuje i incidencia kolorektálnych tumorov.
- Screening ďalších lokalizácií zhubných nádorov nie je zatiaľ doriešený a závisí od lokálnych priorít – napr. screening zameraný na včasné štádia karcinómov žalúdka v Japonsku, prostaty v niektorých vyspelých krajinách a pod.
- Problém predstavujú i nežiadúce vedľajšie dopady sekundárnej prevencie. V prípade screeningu nádorov prsníka môžu výsledky mamografie indikovať potrebu biopsie až u polovice vyšetrených žien. Na druhej strane nálezy malígnych buniek v prostate môžu viesť k prostatektómii u značného počtu mužov, u ktorých by počas ich života nedošlo k vzniku invazívneho karcinómu [17].
Všeobecne sa najvyššie hodnotí primárna prevencia, pretože zabraňuje vzniku ochorenia a znižuje incidenciu a následne mortalitu. Zároveň pri jej zlyhaní zostáva voľný a nezmenený priestor pre aplikáciu sekundárnej prevencie a liečby. Nevýhodou je, že jej pozitívne dopady sa prejavia až o niekoľko desaťročí, pričom určenie akcie alebo faktora, ktorý viedol k poklesu výskytu a tým i mortality určitých zhubných nádorov s vylúčením iných faktorov, ktoré sa mohli na poklese výskytu podieľať, je zložité [17]. Na druhej strane však dobré výsledky liečby ranných foriem zhubných nádorov sa prejavia v krátkom čase a majú podstatne širšiu odozvu v populácii [17]. Primárna prevencia je z dlhodobého hľadiska najvyššie hodnotená a SZO a Medzinárodná agentúra pre výskum rakoviny (IARC) doporučujú v poslednej správe zamerať výskum predovšetkým na rozšírenie primárnej prevencie zistením ďalších príčinných alebo sprievodných faktorov vzniku nádorov [49]. Význam primárnej prevencie podstatne vzrástol po zistení vplyvu úspešných preventívnych programov zameraných proti KVO na zvýšený výskyt zhubných nádorov, ako sme uviedli vyššie.
V posledných desaťročiach sa používa i termín terciárna prevencia, ktorá zahrňuje diagnostiku, liečenie, rehabilitáciu a celkovú starostlivosť o onkologického pacienta. Nejde teda o prevenciu v pravom slova zmysle. Adekvátna diagnostika, liečba a dlhodobé, celoživotné sledovanie onkologického pacienta patrí nevyhnutne k hlavným častiam moderných komplexných onkologických programov. V prípade diagnostiky a liečby ide o bezodkladný nástup liečby po diagnostike ochorenia. Pripomeňme si, že podľa posledných zistení WHO je liečiteľných až 33 % nádorov [43]. Z tohto hľadiska si dovoľujeme poukázať na zistenie, že v prípade zhubných nádorov prsníkov u žien sa dosiahol napriek prudko stúpajúcej incidencii pokles mortality u žien v krajinách, kde nebol prevádzaný plošný screening pomocou mamografie. Tento výsledok sa pripisuje kvalitnej liečbe spolu so zachytením ochorení v relatívne priaznivých klinických štádiách [50]. V súčasnosti sa hodne používa i termín intervencia, čo je preventívna aktivita zameraná na vybranú skupinu osôb a prípadne i časovo ohraničená.
Súčasné zameranie a štruktúra komplexných programov boja proti zhubným nádorom
Moderné programy boja proti zhubným nádorom, ich štruktúra a orientácia vychádzajú zo súčasných poznatkov a skúseností v onkológii i iných oblastiach medicíny. Veľmi vhodné je inkorporovanie národných onkologických programov do celkového programu boja proti neinfekčným chronickým ochoreniam. Ide o kardiovaskulárny program, prípadne i o program zameraný proti chronickým ochoreniam pľúc. Mnohé rizikové faktory podmieňujúce vznik zhubných nádorov majú významnú úlohu i pri vzniku iných chronických neinfekčných ochorení [48,49,51,52]. Zásadným východiskom je všeobecne akceptovaná skutočnosť, že pre 40 % zhubných nádorov poznáme etiológiu, čo umožňuje uplatnenie metód primárnej prevencie. Ďalších 33 % prípadov možno s úspechom vyliečiť a u zbývajúceho podielu je potrebné zamerať sa na efektívne potláčanie bolesti a zlepšenie kvality života [27,48,49].
Všeobecné požiadavky na formulovanie onkologických programov možno zhrnúť do nasledujúcich bodov:
- Musia v plnej miere rešpektovať lokálne priority vo výskyte onkologických ochorení, ich súčasné postavenie a predpokladaný vývoj v budúcnosti. Východiskom pre štruktúru a orientovanie komplexných programov boja proti zhubným nádorom sú údaje o incidencii ochorení spôsobených zhubnými nádormi, získané z populačných registrov, ktoré zároveň spolu s údajmi o mortalite umožňujú i komplexné sledovanie a monitorovanie ich dopadu [8,37,49,53].
- Nároky kladené na primárnu a sekundárnu prevenciu musia byť realistické, vychádzajúce z bežných a všeobecne akceptovaných poznatkov o vzniku zhubných nádorov. Nemôžu byť futuristické, napr. vychádzajúce z poznatkov o manipulácii telemerázy, apoptózy buniek, signálnej transdukcii a iných procesov na úrovni molekulárnej biológie [17].
- Zásadným rysom ich štruktúry musí byť ich komplexnosť, to znamená, že majú byť zamerané nielen na sekundárnu a primárnu prevenciu, ale i na sústavné zlepšovanie diagnostiky, kuratívnej liečby, ako aj na komplexnú starostlivosť a dlhodobé sledovanie onkologických pacientov [49].
- Vysoko sa hodnotí predovšetkým stručnosť a reálnosť plnenia jednotlivých úloh onkologických programov. Nemajú mať charakter politického manifestu, ani uvádzať, čo chceme dokázať v širokej spolupráci mnohých vládnych rezortov, pripadne podmieňovať plnenie jednotlivých bodov získaním ďalších finančných prostriedkov. To znamená, že sa musia vytyčovať úlohy, ktoré sú dosiahnuteľné z hľadiska súčasných ekonomických a odborných možností danej krajiny vo vymedzenom čase. Z tohto hľadiska je potrebné rešpektovať pokyny WHO určujúce rozsah a smery primárnej i sekundárnej prevencie z hľadiska materiálnych i odborných zdrojov danej krajiny [37].
- Splnenie jednotlivých úloh programu musí byť termínované a na druhej strane program musí byť flexibilný a prispôsobovať sa dosiahnutým výsledkom, novým prioritám v danom štáte alebo regióne, ako aj novým poznatkom, ktoré možno uplatniť pri prevencii.
- Zvláštna pozornosť sa za posledných 10 rokov venuje paliatívnej a hospicovej liečbe a starostlivosti o nevyliečiteľne chorých pacientov. Tento, v mnohých krajinách zanedbávaný a podceňovaný problém, bol nedávno podrobne analyzovaný v časopise Klinická onkologie [54]. Jeho zaradenie do moderných komplexných programov boja proti zhubným nádorom je samozrejmé a nevyžaduje si zvláštne zdôvodnenie.
- Podľa skupiny významných odborníkov sa účinnosť dopadov primárnej a sekundárnej prevencie hodnotí na troch úrovniach [17]. Teoretická účinnosť indikuje, čo by sa mohlo dosiahnuť pri optimálnych teoretických podmienkach. Na druhej strane klinická efektivita opisuje, čo možno dosiahnuť v skupine kultivovaných, vzdelaných ľudí, s neobmedzenými zdrojmi. Pre onkologické programy sa doporučuje vyžadovať od preventívnej zložky programov populačnú efektivitu, to znamená brať do úvahy skutočnosť, že určitá časť populácie je na nižšej intelektuálnej úrovni, nedostatočne informovaná, bezstarostná, nemá záujem alebo možnosť obrátiť sa na adekvátne zdravotné služby alebo je iným spôsobom odolná voči princípom kvalitnej prevencie [17].
- Žiadny komplexný program zameraný proti zhubným nádorom sa neobíde bez sústavnej zdravotnej výchovy populácie o význame karcinogénov v prostredí a životnom štýle a o ranných príznakoch vzniku zhubných nádorov. Bez výchovy populácie a jej vedenia k osvojeniu si zdravého spôsobu života nie je možná ani realizácia Európskeho kódexu prevencie zhubných nádorov [55].
V súčasnosti sa všeobecne akceptuje potreba použiť pre základnú orientáciu, trvalé určovanie aktuálnych lokálnych priorít i pre predikciu vývoja a štruktúry zhubných nádorov metódy surveillance [38,43]. Surveillance, ktorá sa plne osvedčila pri prevencii až eradikácii mnohých infekčných chorôb, je definovaná ako kontinuálny zber komplexných údajov o jednotlivých ochoreniach v danej populácii a ich používanie pre usmerňovanie zvládnutia ich prevencie. V prípade zhubných nádorov pôjde o monitorovanie incidencie, prevalencie, mortality, distribúcie klinických štádií a prežívanie, sledovanie vývoja metód diagnostiky a liečby onkologických pacientov. Surveillance môže naviac poskytnúť informácie o závažných rizikových faktoroch a o rozsahu expozície k týmto faktorom v danej populácii. Okrem základnej a flexibilnej orientácie onkologických programov poskytuje dobre riadená surveillance sústavné monitorovanie dopadu onkologických programov na prevenciu, detekciu včasných prípadov ochorenia, informácie o screeningu, pokrokov v diagnostike a liečbe, ako aj o paliácii a starostlivosti o onkologických pacientov [37,47,51]. V priebehu posledných 50 rokov bol rozpracovaný detailný systém surveillance onkologických ochorení, ktorého východisko a základ tvoria populačné onkologické registre [37,53]. Preto je i etablovanie populačných onkologických registrov nutným a základným krokom v krajinách, ktoré chcú zaviesť a rozvíjať lokálne, národné alebo regionálne onkologické programy [8,47,52,53]. Záverom ešte raz zdôrazňujeme, že údaje poskytované onkologickými registrami netvoria v žiadnom prípade „ozdobnú“ zložku, akýsi ornament preventívnych onkologických programov, ale predstavujú východisko pre ich štruktúru a flexibilnú orientáciu.
Autor
deklaruje, že v souvislosti s předmětem studie nemá žádné
komerční zájmy.
The
author declares he has no potential conflicts of interest concerning
drugs, pruducts, or services
used in the study.
Redakční
rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro
publikace zasílané do bi omedicínských
časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform
requirements” for biomedical papers.
doc.
MUDr. Ivan Pleško, DrSc.
Ústav
experimentálnej onkológie SAV
Vlárska
ul. 7
83391 Bratislava
Slovenská
republika
e-mail:
plesko@adamsoft.sk
Sources
1. Clemmesen J. Statistics in cancer. In: Zuppinger A, van der Plaats GJ (eds). Handbuch der medizinischen radiologie. Berlin, Heidelberg, New York: Springer Verlag 1967 : 142 – 242.
2. Lilienfeld AM, Pedersen E, Dowd JE. Cancer epidemiology: Methods of study. Baltimore: Johns Hopkins Press 1967.
3. Tomatis L. Cancer: Causes, occurrence and control (IARC Scientific publications No. 100). Lyon: IARC 1990.
4. Davis DL, Hoel D, Preface. Ann N Y Acad Sci 1990; 609: IX – XI.
5. Schinz HR. Kleine internazionale Krebskonferenz vom 2 – 4 September 1946 in Kopenhagen. Schweiz Med Wschr 1946; 76 : 1194 – 1196.
6. Sancho ‑ Garnier H. Introduction. In: Sancho ‑ Garnier H, Anderson A, Biedermann A et al (eds). Prevention des cancers: Strategies d’action a ľ usage des ONG europeennes. Geneva: UICC 2005 : 11 – 13.
7. Knowelden J, Mork T, Phillips AJ. The registry in cancer control. Geneva: UICC 1970.
8. Doll R, Smith PG. Comparison between registries: age ‑ standardized rates. In: Waterhouse J, Muir C, Shanmugaratnam K et al (eds). Cancer incidence in five. Continents Vol. IV (IARC Scientific publications No. 42). Lyon: IARC 1982 : 671 – 674.
9. Hansluwka H. International aspects of cancer statistics. In: Comprehensive cancer control report on a conference. Copenhagen: WHO Regional Office for Europe 1978 : 26 – 40.
10. WHO Expert Committee on Cancer Control. In: WHO Technical Report Series (No.251). Copenhagen: WHO Regional Office for Europe 1963 : 4 – 8.
11. WHO Regional Office for Europe. Comprehensive cancer control: report on a conference, Copenhagen 11 – 15 July 1977. Copenhagen: WHO Regional Office for Europe 1978.
12. Higginson J, Muir CS. Determination de ľimportance des facteurs environmentaux dans le cancer humain: role de ľepidemiologie. Bull Cancer 1974; 64 : 365 – 384.
13. Wynder EL, Gori GB. Contribution of the environment to cancer incidence: an epidemiological exercise. J Natl Cancer Inst 1977; 58(4): 825 – 832.
14. Higginson J, Muir CS. Environmental carcinogenesis: Misconception and limitations to cancer control. J Natl Cancer Inst 1979; 63 : 1291 – 1298.
15. Doll R, Peto R. The causes of cancer: quantitative estimates of avoidable risks of cancer in the United States today. J Natl Cancer Inst 1981; 66(6): 1191 – 1308.
16. Higginson J. Changing concepts in cancer prevention: limitations and implications for future research on environmental carcinogens. Cancer Res 1988; 48(6): 1381 – 1389.
17. Adami HO, Day NE, Trichopoulos D et al. Primary and secondary prevention in reduction of cancer morbidity and mortality. Eur J Cancer 2001; 37 (Suppl 8): S118 – S127.
18. Schaapveld K, Cleton FJ. Cancer in The Netherlands. From scenarios to health policy. Eur J Cancer Clin Oncol 1989; 25(4): 767 – 741.
19. Einhorn J. Cancer by the year 2000. Educational requirements for future oncologists. Acta Oncol 1989; 28(5): 723 – 728.
20. Peto R. The preventability of cancer. In: Vessey MP, Gray M (eds). Cancer risk and prevention. Oxford: Oxford University Press 1987 : 1 – 14.
21. Olsen JH, Andersen A, Droyers L et al. Avoidable cancer in the Nordic countries. APMIS Suppl 1997; 76 : 1 – 146.
22. Pujol H. La prévention des cancers doit ‑ elle devenir un traitement? Bull Cancer 1995; 82 (Suppl 3): S149 – S150.
23. Epstein SS. Evaluation of the National cancer program and proposed reforms. Am J Int Med 1993; 24 : 109 – 133.
24. Schmähl D, Preussmann R, Berger MR. Causes of cancer – an alternative view to Doll and Peto (1981). Klin Wochenschr 1989; 67(23): 1169 – 1173.
25. Ma X, Yu H. Global burden of cancer. Yale J Biol Med 2006; 79(3 – 4): 85 – 94.
26. Lopez AD. Competing causes of death. A review of recent trends in mortality in industrialized countries with special reference to cancer. Ann NY Acad Sci 1990; 609 : 58 – 76.
27. WHO global action plan against cancer. The WHO multistrategy approach to fight cancer. Draft proposal. 2007 (series of slides).
28. WHO. Cancer control: knowledge’s into action. WHO quide for effective programs. Geneva: WHO 2007.
29. Parkin DM, Sankaranarayanan R. Overview on small cell lung cancer in the world: industrialized countries, Third world and eastern Europe. Anticancer Res 1994; 14(1B): 277 – 282.
30. Plesko I, Severi G, Obsitníková A et al. Lung cancer incidence rates by histologic types: an example of trends in Eastern Europe – Slovakia 1978 – 1995. Neoplasma 2001; 48(4): 247 – 253.
31. Seitz HK, Cho CH. Contribution of alcohol and tobacco use in gastrointestinal cancer development. In: Verma M (ed.). Cancer Epidemiology. Vol. 2. Modifiable factors. New York: Humana Press 2009 : 387 – 396.
32. Schottenfeld D, Beebe ‑ Dimmer J. Alleviating the burden of cancer: a perspective on advances, challenges and future directions. Cancer Epidemiol Biomarkers Prev 2006; 15(11): 2049 – 2055.
33. Parkin DM, Pisani P, Lopez AD et al. At least one in seven cases of cancer is caused by smoking. Global estimates for 1985. Int J Cancer 1994; 59(4): 494 – 504.
34. Muller R, L’alcohol. In: Sancho ‑ Garnier H, Anderson A, Biedermann A et al (eds). Prevention des cancers: Strategies d’actions a ľusage des ONG européennes. Geneva: UICC 2005 : 123 – 134.
35. Weiderpass E, Ye W, Tamimi R et al. Alcoholism and risk of cancer of the cervix uteri, vagina and vulva. Cancer Epidemiol Biomarkers Prev 2001; 10(8): 899 – 901.
36. Bandera EV, Freudenheim JL, Graham S et al. Alcohol consumption and lung cancer in white males. Cancer Causes Control 1992; 3(4): 361 – 369.
37. WHO. National Cancer Control Programmes. Policies and managerial guidelines. 2nd ed. Geneva: WHO 2003.
38. Schottenfeld D, Beebe ‑ Dimmer JL. Advances in cancer epidemiology: understanding causal mechanisms and the evidence for implementing interventions. Ann Rev Public Health 2005; 26 : 37 – 60.
39. Bosch X, Franceschi S, Lambert E et al. Les infections. In: Sancho ‑ Garnier H, Anderson A, Biederman A (eds). Préventiion des cancers : Strategies d’actions a ľusage des ONG européennes. Geneva: UICC 2005 : 169 – 182.
40. Schottenfeld DE, Beebe ‑ Dimmer J. Chronic inflammation: a common and important factor in the pathogenesis of neoplasia. CA Cancer J Clin 2006; 56(2): 69 – 83.
41. Faivre J, Couillault C, Belghiti C. Prévention primaire du cancer colorectal. Bull Cancer 1995; 82 (Suppl 3): 172s – 177s.
42. Boyle P, Burns HJ, Gray N et al. Epidemiology of colorectal cancer control. In: McArdle CS, Kerr DJ, Boyle P (eds). Colorectal cancer. Oxford: Isis Medical Media 2000 : 1 – 31.
43. Fogelholm M. L’activité physique. In: Sancho ‑ Garnier H, Anderson A, Biederman A (eds). Prevention des cancers: Strategies d’action a ľusage des ONG europeenes. Geneva: UICC 2005 : 115 – 122.
44. Ceschi M, Gutzwiller F, Moch H et al. Epidemiology and pathophysiology of obesity as a cause of cancer. Swiss Med Wkly 2007; 137(3 – 4): 50 – 56.
45. Yi Pan S, des Meules M. Energy intake, physical activity, energy balance and cancer: Epidemiologic evidence. In: Verma M (ed.). Cancer epidemiology. Vol. 2 – Modifiable factors. New York: Humana Press 2009 : 191 – 216.
46. Segnan N, Armaroli P, Sancho ‑ Garnier H. Le depistage. In: Sancho ‑ Granier H, Anderson A, Biederman A (eds). Prevention des cancers: Strategies d’action a ľusage des ONG europeennes. Geneva: UICC 2005 : 183 – 198.
47. Stracci F. Cancer screening, diagnostic technology evolution, and cancer control. In: Verma M (ed.). Cancer epidemiology. Vol. 1. Host susceptibility factors. New York: Humana Press 2009 : 107 – 136.
48. WHO. Cancer control. Knowledge into action. Guide for effective progress. WHO: Copenhagen 2007.
49. WHO. Fight against cancer. Strategies that prevent, cure and care. WHO: Copenhagen 2007.
50. Botha JL, Bray F, Sankila R et al. Breast cancer incidence and mortality in 16 European countries. Eur J Cancer 2003; 39(12): 1718 – 1729.
51. WHO. 2008 – 2013 Action plan for the global strategy for the prevention of noncomunicable diseases. Geneva 2008.
52. Parkin DM, Wagner G, Muir CS. The role of the registry in cancer control. IARC Scientific Publications No. 66. Lyon: IARC 1985.
53. Sankila R, Démaret E, Hakama M et al. Evaluation and monitoring of screening programmes. Brussels ‑ Luxembourg: Eropean Network of Cancer Registries 2000.
54. Sláma O. Paliativní a hospicová péče v České republice a v Evropě. Klin Onkol 2009; 22(4): 183 – 185.
55. Boyle P, Autier P, Bartelink H et al. European code against cancer and scientific justification: third version (2003). Ann Oncol 2003; 14(7): 973 – 1005.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2010 Issue 6
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Safety and Tolerance of Metamizole in Postoperative Analgesia in Children
-
All articles in this issue
- Nové možnosti léčby glioblastoma multiforme
- Akútna myeloblastová leukémia s alteráciami MLL protoonkogénu (11q23/ MLL+ AML)
- Aktuálne problémy štruktúry a orientácie komplexných národných programov boja proti zhubným nádorom
- Problematika originálních léčiv, generických přípravků a biosimilars – záměny léků dnes a zítra s hlavním zacílením na rizika spojená s biotechnologiemi
- Hodnocení neoadjuvantní chemoradioterapie u lokálně pokročilého karcinomu rekta srovnáním objemu tumoru před léčbou a po léčbě
- Hormonálna antikoncepcia a jej vzťah k rakovine prsníka
- Pooperačná akcelerovaná parciálna rádioterapia karcinómu prsníka
- Analýza nákladů na cílenou biologickou léčbu pacientů s metastatickým karcinomem ledviny
- Maligní forma cystosarcoma phyllodes s metastázami do mozku
- Variabilita dávek melfalanu vztažených na kilogram tělesné hmotnosti a následky
- Genetické testování a prevence hereditárních nádorů v MOÚ – více než desetiletá zkušenost
- Inflamatórne kožné metastázy ako prvý prejav progresie karcinómu pľúc – kazuistika
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Nové možnosti léčby glioblastoma multiforme
- Hormonálna antikoncepcia a jej vzťah k rakovine prsníka
- Akútna myeloblastová leukémia s alteráciami MLL protoonkogénu (11q23/ MLL+ AML)
- Pooperačná akcelerovaná parciálna rádioterapia karcinómu prsníka
