Genetické pozadí ototoxicity cisplatiny
Genetic Background of Cisplatin Induced Ototoxicity
Background:
Cisplatin induced ototoxicity is a serious adverse effect of cisplatin therapy. Cisplatin induced ototoxicity shows significant interindividual variability. This variability is probably based on genetic background. Recent papers describe association of cisplatin ototoxicity with allelic variants of glutathion-S-transferase coding genes.
Patients and Methods:
We have analyzed 55 patients treated with cisplatin therapy without any previous hearing impairment. Audiometric examination was performed before the start of cisplatin therapy and then before and after each cycle of cisplatin. DNA isolated from peripheral blood samples was used to analyze genetic polymorphisms of selected genes coding for glutathion-S-transferases.
Results:
We have demonstrated association of early onset of cisplatin induced hearing impairment with absence of null allele of GSTT1 (p = 0.009). Both GSTM1 gene deletion and single nucleotide polymorphism in GSTP1 gene (rs1695) did not show any association with cisplatin induced ototoxicity.
Conclusion:
Early onset of cisplatin induced hearing impairment is more probable in persons with two functional alleles of GSTT1 gene.
Key words:
cisplatin – ototoxicity – DNA copy number variations – single nucleotide polymorphism
This study supported by grant IGA NS10101-4/2008.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Submitted:
7. 5. 2012
Accepted:
20. 5. 2012
Authors:
Michal Jurajda 1
; T. Talach 2; R. Kostřica 2; R. Lakomý 3; I. Kocák 3; M. Cvanová 4
Authors‘ workplace:
Ústav patologické fyziologie, LF MU Brno
1; Klinika otorinolaryngologie a chirurgie hlavy a krku, FN u sv. Anny v Brně
2; Klinika komplexní onkologické péče, MOÚ Brno
3; Institut biostatistiky a analýz, LF a PřF MU Brno
4
Published in:
Klin Onkol 2012; 25(3): 184-187
Category:
Original Articles
Overview
Východiska:
Cisplatinou indukovaná ototoxicita je závažným nežádoucím účinkem tohoto široce používaného cytostatika. Ototoxicita vyvolaná cisplatinou vykazuje značnou interindividuální variabilitu, která by mohla mít genetický podklad. Několik prací z nedávné doby popisuje asociaci ototoxicity s alelickými variantami genů kódujících glutathion-S-transferázy.
Soubor pacientů a metody:
V naší studii jsme analyzovali 55 pacientů léčených cisplatinou, u kterých se nevyskytovalo poškození sluchu v předchorobí. Pacienti byli audiometricky vyšetřeni před terapií a následně před a po každém cyklu podání cisplatiny. Genové polymorfizmy vybraných genů kódujících glutathion-S-transferázy byly stanoveny analýzou DNA izolované z periferní krve.
Výsledky:
V souboru námi vyšetřených pacientů jsme prokázali asociaci časného nástupu ototoxicity indukované cisplatinou s nepřítomností delece genu pro GSTT1 (p = 0,009). U delece genu pro GSTM1 ani u jednonukleotidového polymorfizmu v genu pro GSTP1 (rs1695) jsme asociaci s ototoxicitou indukovanou cisplatinou neprokázali.
Závěr:
Ototoxicita indukovaná cisplatinou vykazuje časný nástup u pacientů, kteří nenesou deleci genu pro GSTT1.
Klíčová slova:
cisplatina – ototoxicita – rozdíly v počtu kopií úseků DNA – polymorfizmus jednoho nukleotidu
Východiska
Cisplatina (cisplatinum, cis-diamminedichloroplatinum – CDDP) je chemoterapeutikum se širokým využitím při léčbě maligních tumorů. Cisplatina se váže na DNA na purinové báze a vytváří tak příčné vazby mezi DNA řetězci. Detoxifikace cisplatiny v buňkách probíhá konjugací s methioninem, cisteinem a glutathionem. Konjugace s glutathionem je katalyzována enzymy tvořícími rodinu glutathion-S-transferáz (GST).
Ototoxicita indukovaná cisplatinou je jedním ze závažných vedlejších účinků léčby tímto cytostatikem. Příznaky ototoxicity jsou zhoršení sluchu, bolesti ucha a tinnitus. Zhoršení sluchu se projevuje na audiogramu obzvláště ve vyšších frekvencích. Za příčinu ototoxicity cisplatiny na biochemické úrovni je považován oxidativní stres způsobený nerovnováhou mezi produkcí a odstraňováním reaktivních metabolitů kyslíku (ROS) a následná indukce buněčné apoptózy podmíněna aktivací kaskády enzymů BCL-2, kaspasy 9 a 3 [1]. Za fyziologických podmínek jsou nežádoucí účinky ROS blokovány systémem antioxidativních enzymů. Stochastický účinek ROS spočívá v poškozování buněčných struktur a makromolekul, jako jsou lipidy, proteiny a DNA, radikálovými reakcemi, což při určité koncentraci, kdy antioxidativní systém již nestačí neutralizovat jejich škodlivý vliv, vede k buněčné smrti. Mezi antioxidativní enzymy patří zejména glutathionperoxidáza (GPx), glutathionreduktáza (GR), superoxiddizmutáza (SOD), glutathion-S-transferáza (GST), γ-glutamylcystein-syntetáza (γ-GCS) a kataláza (CAT).
Ototoxicita indukovaná cisplatinou vykazuje značnou interindividuální variabilitu. Tato variabilita má pravděpodobně genetický podklad. Variabilita v genech kódujících enzymy podílející se na metabolizaci cisplatiny a odstraňování ROS by mohla mít vliv na výskyt jejích nežádoucích účinků [2,3]. V nedávné době bylo provedeno několik genetických asociačních studií, které analyzovaly tzv. kandidátní geny nebo postupovaly strategií „whole genom screening“ [4]. Oldenburg et al asociovali se zhoršením sluchu po terapii cisplatinou jednonukleotidový polymorfizmus v genu pro GSTP1 a přítomnost genu pro GSTM1 [5]. Stejná skupina autorů asociovala také příznaky neurotoxicity cisplatiny s jednonukleotidovým polymorfizmem v genu pro GSTP1 [6]. Peters et al na relativně malém souboru pacientů identifikovali GSTM3*B alelu jako otoprotektivní ve vztahu k cisplatině [7]. Ross et al asociovali s ototoxicitou cisplatiny u skupiny 162 dětských pacientů jednonukleotidové polymorfizmy v genech pro COMT a TPMT [8]. Cílem naší práce bylo zjistit, jestli jsou některé z těchto genetických polymorfizmů asociovány s ototoxicitou indukovanou cisplatinou také v populaci českých pacientů. Glutathion-S-transferázy totiž patří mezi kandidátní geny hned ze dvou důvodů: jednak se podílejí na detoxifikaci cisplatiny, jednak na odstraňování ROS [9].
Soubor pacientů a metody
Do studie byli zařazováni pacienti léčení v Masarykově onkologickém ústavu v Brně. Pro zařazení do studie byla rozhodující terapie cisplatinou a absence klinicky významného poškození sluchu v klasické tónové audiometrii (250 Hz–8 kHz). Pacienti byli před a po každém cyklu cisplatiny audiometricky vyšetřeni. Všichni pacienti podepsali informovaný souhlas.
Zhoršení sluchu dle tónového audiogramu bylo vyhodnoceno srovnáním tónového audiogramu získaného před léčbou se všemi dalšími audiogramy během terapie. Jestliže se kdykoliv vyskytlo zhoršení buď ve dvou frekvencích současně o 10 decibelů, anebo v jediné frekvenci o 15 decibelů anebo více, pak byl daný výsledek měření pacienta hodnocen jako zhoršení sluchu. Pro zvýšení kontrastu mezi pacienty s poškozením sluchu a bez poškození sluchu jsme se zaměřili na raná stadia terapie, kde jsme očekávali brzký nástup ototoxicity u nejcitlivějších jedinců.
DNA byla izolována ze vzorku leukocytů periferní krve pomocí izolačních kolonek NucleoSpinBlood XL (Mancherey-Nagel). Delece genů pro GSTT1 a GSTM1 byly detekovány pomocí TaqMan Copy NumberAssaysHs00010004_cn a Hs02575461_cn (Life Technologies). Jednonukleotidový polymorfizmus v genu pro GSTP1 (rs1695) byl detekován pomocí TaqManGenotypingAssayC_3237198_20 (Life Technologies). Veškeré genotypizace byly provedeny pomocí realtimecycleru ABI 7000 (AppliedBiosystems).
Asociace postižení sluchu s alelickými variantami studovaných genů byla vyhodnocena v software IBM SPSS Statistics 19 for Windows (Release 19.0.1, ©IBM Corporation 2010) pomocí Fisherova exaktního testu. Pro hodnocení genotypových variant byl výpočet exaktní významnosti založen na odhadech metody Monte Carlo (100 000 vzorků). Hodnota p menší než 0,05 byla považována za statisticky významnou.
Výsledky
V rámci studie byla vyhodnocena data 55 pacientů léčených cisplatinou pro nádorové onemocnění. Soubor tvořilo 52 mužů a 3 ženy; věk 35 (22–59), medián (0,05.–0,95. percentil). Převažovala diagnóza C621 (87 % pacientů), z ostatních diagnóz byli vybráni pacienti s podobným dávkovým schématem cisplatiny, což zajistilo vysoký stupeň homogenity souboru z hlediska dávky a farmakokinetiky cisplatiny. Doporučená dávka byla 100 mg/m2. Totální dávka na cyklus byla získána vynásobením doporučené dávky tělesným povrchem (BSA). Medián sledování pacientů byl 273 dní. Po prvním cyklu bylo audiometricky vyšetřeno všech 55 pacientů, po druhém cyklu 53 pacientů.
Výsledky asociace poškození sluchu po jednotlivých cyklech cisplatiny s vybranými polymorfizmy v genech glutathion-S-transferáz jsou uvedeny v tab. 1.
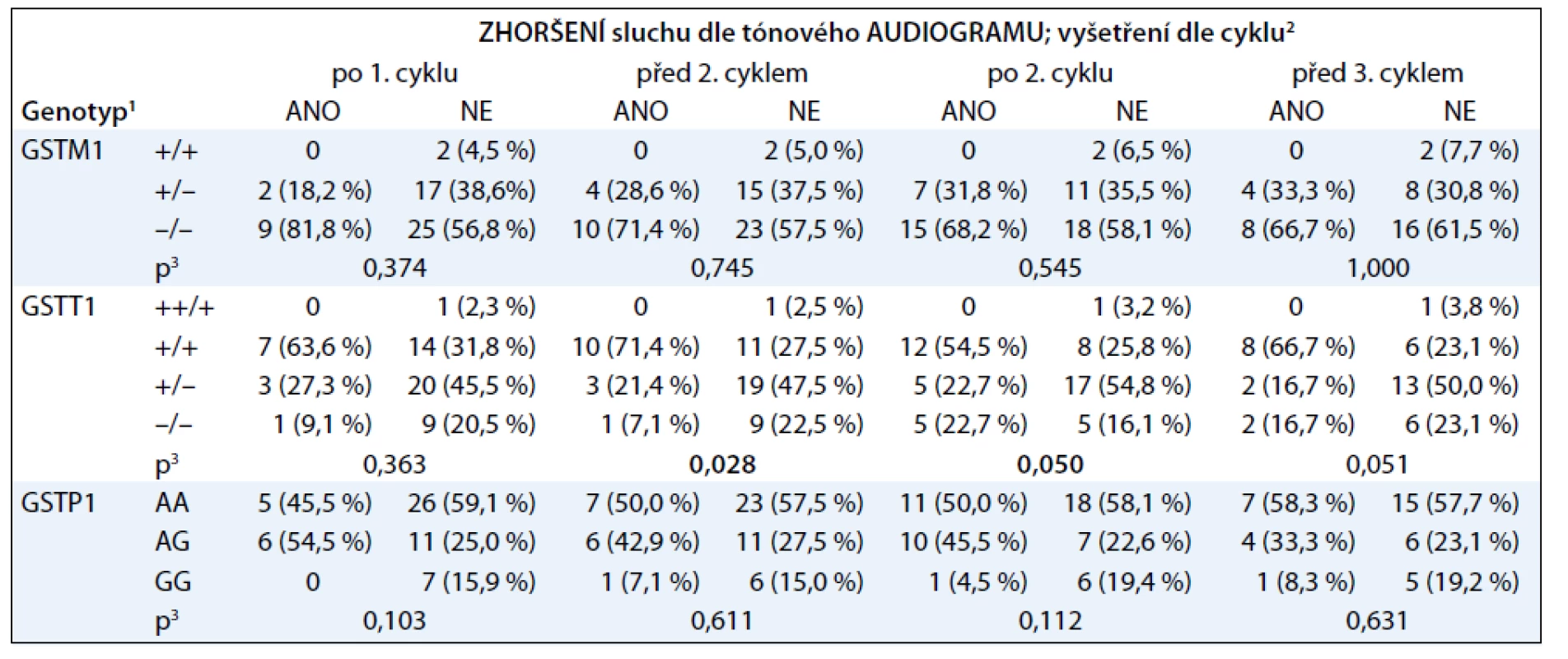
V tab. 2 je znázorněna asociace ototoxicity cisplatiny s delecí genu pro GSTT1, pokud pacienty rozdělíme podle přítomnosti této delece.
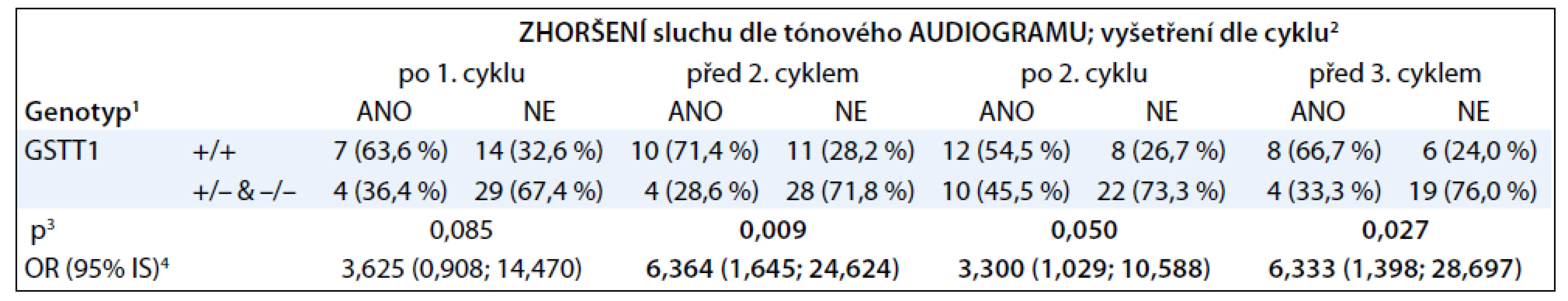
Z tabulek vyplývá, že nástup ototoxicity cisplatiny po prvních cyklech léčby významně asociuje s nositelstvím dvou kopií genu pro GSTT1. Přítomnost genu pro GSTM1 ani SNP v genu pro GSTP1 (rs1695) neasociovaly s poškozením sluchu. Obzvláště výrazný je rozdíl mezi nositeli dvou kopií genu pro GSTT1 a nositeli žádné či jedné kopie. V jednom případě jsme detekovali amplifikaci genu pro GSTT1, pacient byl nositelem tří alel.
Diskuze
Ototoxicita cisplatiny se obvykle projevuje již po prvních cyklech léčby, a proto jsme zaměřili svou pozornost právě na počáteční fáze terapie [10]. Při studiu delece genů pro GSTT1 a GSTM1 jsme nalezli statisticky významnou asociaci poškození sluchu při terapii cisplatinou s přítomností dvou kopií genu pro GSTT1. Tato asociace byla nejvýraznější v období před a po podání druhého cyklu cisplatiny. S přibývajícími cykly terapie se tato asociace oslabovala z důvodu, že ve studii klesal počet pacientů léčených větším počtem cyklů. Výsledek naší studie je v souladu s výsledky již publikovaných studií, které jako protektivní faktor proti ototoxicitě vyvolané cisplatinou uvádějí přítomnost alel kódujících méně aktivní formy GSTP1 a také delece genu pro GSTM1. Tento efekt není jednoduché vysvětlit, protože enzymy z rodiny glutathion-S-transferáz se podílejí jak na detoxifikaci cisplatiny, tak na obraně buněk před oxidativním stresem, který cisplatina vyvolává. Jelikož se jednotlivé enzymy z rodiny GST liší svou substrátovou specifitou, je možné, že nižší aktivita některých GST ponechává v buňkách dostupné vyšší hladiny společného substrátu – glutathionu. Ten pak může být využit jinými enzymy z rodiny GST k účinnější detoxifikaci cisplatiny nebo odstraňování ROS [11].
Závěr
V naší studii jsme prokázali statisticky významnou asociaci časného poškození sluchu během terapie cisplatinou s přítomností dvou alel genu pro GSTT1 u pacientů léčených cisplatinou v dávce 100 mg/m2 na cyklus. Nejvýrazněji se vazba poškození sluchu na genotyp projevovala v období před a po druhém cyklu terapie cisplatinou.
Tato práce byla podpořena grantem IGA NS10101-4/2008.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
MUDr. Michal Jurajda, Ph.D.
Ústav patologické fyziologie
Lékařská fakulta MU Brno
Kamenice 5
625 00 Brno
e-mail: mjuraj@med.muni.cz
Obdrženo: 7. 5. 2012
Přijato: 20. 5. 2012
Sources
1. García-Berrocal JR, Nevado J, Ramírez-Camacho R et al. The anticancer drug cisplatin induces an intrinsic apoptotic pathway inside the inner ear. Br J Pharmacol 2007; 152(7): 1012–1020.
2. Rybak LP. Mechanisms of cisplatin ototoxicity and progress in otoprotection. Curr Opin Otolaryngol Head Neck Surg 2007; 15(5): 364–369.
3. Rybak LP, Mukherjea D, Jajoo S et al. Cisplatin ototoxicity and protection: clinical and experimental studies. Tohoku J Exp Med 2009; 219(3): 177–186.
4. Huang RS, Duan S, Shukla SJ et al. Identification of genetic variants contributing to cisplatin-induced cytotoxicity by use of a genomewide approach. Am J Hum Genet 2007; 81(3): 427–437.
5. Oldenburg J, Kraggerud SM, Cvancarova M et al. Cisplatin-induced long-term hearing impairment is associated with specific glutathione s-transferase genotypes in testicular cancer survivors. J Clin Oncol 2007; 25(6): 708–714.
6. Oldenburg J, Kraggerud SM, Brydøy M et al. Association between long-term neuro-toxicities in testicular cancer survivors and polymorphisms in glutathione-s-transferase-P1 and -M1, a retrospective cross sectional study. J Transl Med 2007; 5 : 70.
7. Peters U, Preisler-Adams S, Hebeisen A et al. Glutathione S-transferase genetic polymorphisms and individual sensitivity to the ototoxic effect of cisplatin. Anticancer Drugs 2000; 11(8): 639–643.
8. Ross CJ, Katzov-Eckert H, Dubé MP et al. Genetic variants in TPMT and COMT are associated with hearing loss in children receiving cisplatin chemotherapy. Nat Genet 2009; 41(12): 1345–1349.
9. Douglas KT. Mechanism of action of glutathione-dependent enzymes. Adv Enzymol Relat Areas Mol Biol 1987; 59 : 103–167.
10. Knight KR, Kraemer DF, Winter C et al. Early changes in auditory function as a result of platinum chemotherapy: use of extended high-frequency audiometry and evoked distortion product otoacoustic emissions. J Clin Oncol 2007; 25(10): 1190–1195.
11. Oldenburg J, Fosså SD, Ikdahl T. Genetic variants associated with cisplatin-induced ototoxicity. Pharmacogenomics 2008; 9(10): 1521–1530.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2012 Issue 3
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Safety and Tolerance of Metamizole in Postoperative Analgesia in Children
-
All articles in this issue
- Nové a klinicky využívané onkomarkery karcinómu močového mechúra
- Reprodukční funkce u onkologických pacientek
- Genetické pozadí ototoxicity cisplatiny
- Triple-negativní karcinom prsu: analýza souboru pacientek diagnostikovaných a/nebo léčených v Masarykově onkologickém ústavu v letech 2004 až 2009
- Angioimunoblastický T-lymfom (AITL) jako velmi nepříznivá malignita – zkušenost centra
- Pacient s B-CLL s anamnézou darování krvetvorných buněk nepříbuznému pacientovi – retrospektivní sledování vývoje nemoci a důsledky pro příjemc
- Výhody jednotlivých zobrazovacích metod pro diagnostiku a sledování aktivity mnohočetného myelomu
- Pozitronová emisní tomografie a klinické prediktory přežití u primárních extragonadálních germinálních nádorů
- Faktor stimulující kolonie granulocytů (G-CSF) zrychluje hojení vlhké deskvamace kůže vyvolané radiací
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Angioimunoblastický T-lymfom (AITL) jako velmi nepříznivá malignita – zkušenost centra
- Triple-negativní karcinom prsu: analýza souboru pacientek diagnostikovaných a/nebo léčených v Masarykově onkologickém ústavu v letech 2004 až 2009
- Nové a klinicky využívané onkomarkery karcinómu močového mechúra
- Faktor stimulující kolonie granulocytů (G-CSF) zrychluje hojení vlhké deskvamace kůže vyvolané radiací
